"Клинические рекомендации "Пароксизмальная ночная гемоглобинурия"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПАРОКСИЗМАЛЬНАЯ НОЧНАЯ ГЕМОГЛОБИНУРИЯ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: D59.5
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 695
Разработчик клинической рекомендации
- Национальное гематологическое общество
- Национальное общество детских гематологов, онкологов
- Ассоциация специалистов и организаций лабораторной службы "Федерация лабораторной медицины"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ПНГ - пароксизмальная ночная гемоглобинурия
АА - апластическая анемия
ЛДГ - лактатдегидрогеназа
МДС - миелодиспластический синдром
СКК - стволовая кроветворная клетка
МАК - мембраноатакующий комплекс
GPI - гликозилинозитолфосфат
СДЛА - систолическое давление в легочной артерии
ХБП - хроническая болезнь почек
ВГН - верхняя граница нормы
ГКС - глюкокортикоиды
ТГСК - трансплантация гемопоэтических стволовых клеток.
Термины и определения
Пароксизмальная ночная гемоглобинурия (ПНГ) - это редкое приобретенное клональное заболевание системы крови, характеризующееся внутрисосудистым гемолизом, дисфункцией костного мозга и повышенным риском тромботических и органных осложнений.
Внутрисосудистый гемолиз - это процесс разрушения собственных эритроцитов в сосудистом русле, обусловленный, преимущественно, комплемент-опосредованными механизмами и ассоциированный с высвобождением большого количества свободного гемоглобина в плазму крови.
Гемолитический криз - резкое нарастание клинических проявлений ПНГ, снижение показателей гемоглобина и эритроцитов, сопровождающееся повышением лабораторных маркеров активности гемолиза - непрямого билирубина, активности ЛДГ, количества ретикулоцитов, в большинстве случаев связанное с предшествующим воздействием провоцирующих факторов - инфекции, применение некоторых лекарственных препаратов и др.
Прорывной гемолиз - утрата контроля внутрисосудистого гемолиза, в т.ч. с развитием гемолитического криза, на фоне регулярной патогенетической терапии ПНГ. Фармакокинетический прорывной гемолиз развивается у пациентов с индивидуальными параметрами снижения концентрации экулизумаба** за 1 - 4 дня до очередного введения препарата в поддерживающей фазе. Фармакодинамический прорывной гемолиз связан с комплемент-активирующими состояниями (инфекции, операции, беременность и др.) и может развиваться у любого пациента.
ПНГ-клон - клетки-потомки стволовой кроветворной клетки с мутацией гена PIGA, в результате которой нарушается экспрессия мембранных белков, в том числе защищающих клетки от разрушения системой комплемента.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Пароксизмальная ночная гемоглобинурия (ПНГ) - это редкое приобретенное клональное заболевание системы крови, характеризующееся внутрисосудистым гемолизом, дисфункцией костного мозга и повышенным риском тромботических и органных осложнений.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В основе патогенеза ПНГ лежит комплемент-опосредованный лизис эритроцитов, обусловленный приобретенным генетическим дефектом, приводящим к нарушению экспрессии на поверхности клеток важнейших регуляторных гликопротеинов.
Генетические мутации
Согласно современной концепции патогенеза ПНГ, в стволовой кроветворной клетке (СКК) происходит соматическая мутация гена PIGA, локализованного на X-хромосоме [1, 2]. В результате этой приобретенной мутации нарушается биосинтез гликозилинозитолфосфата (GPI) - гликолипидной структуры, служащей "якорем" для фиксации на поверхности клеток множества гликопротеинов, в том числе регулирующих активность комплемента. Следствием этого является полная или частичная утрата клетками-потомками мутантной СКК поверхностных GPI-связанных белков - CD55 и CD59, защищающих клетки от комплемент-обусловленного лизиса [1 - 5].
Соматическая мутация в гене PIGA может происходить в одной или нескольких СКК. В дальнейшем, мутантные СКК получают клональное преимущество, по сравнению с нормальными клетками, что ведет к развитию и манифестации ПНГ. Предполагаемыми механизмами экспансии патологических СКК служат клональная селекция и клональная эволюция.
Система комплемента и роль поверхностных гликопротеинов CD55 и CD59
Система комплемента представляет собой важный компонент врожденного иммунитета, играющий ключевую роль в защите от инфекций и элиминации собственных поврежденных клеток. В нормальных условиях активность системы комплемента строго регулируется рядом растворимых белков, а также гликопротеинами на поверхности клеток, в том числе DAF (CD55) и MIRL (CD59). Активация системы комплемента обеспечивается тремя разными путями: классическим, лектиновым и альтернативным. Несмотря на различия в триггерах, необходимых для активации каждого из путей комплемента, после каскада реакций все пути приводят к образованию C3-конвертазы, которая расщепляет C3-компонент на два фрагмента: C3a, являющийся провоспалительным анафилотоксином, и C3b. Функции компонента C3b включают опсонизацию патогенов и собственных дефектных клеток, а также активацию следующего этапа каскада комплемента терминального пути. Наличие C3b необходимо для образования C5-конвертазы, которая расщепляет C5-компонент комплемента на C5a - провоспалительный медиатор, и C5b - инициирующий сборку мембраноатакующего комплекса (МАК) на поверхности клетки [6]. После завершения сборки МАК создает трансмембранный канал в клетке, что приводит к ее гибели [7, 8]. В норме активность C3-конвертазы регулируется GPI-связанным гликопротеином CD55, а сборку МАК на поверхности клеток блокирует другой GPI-связанный ингибитор - CD59 [9 - 11]. В отсутствие CD55 и CD59 на поверхности клеток происходит неконтролируемая активация компонентов комплемента и сборка МАК с последующим лизисом клетки [12].
Система свертывания крови при ПНГ
Механизмы выраженного повышения тромбогенности при ПНГ изучены недостаточно [13]. В процессе гемолиза происходит выброс в сосудистое русло большого количества продуктов распада эритроцитов, в том числе свободного гемоглобина, который обладает способностью вызывать активацию тромбоцитов, приводить к истощению запасов оксида азота и к развитию локального тромбофлебита [14 - 18]. Все перечисленные факторы ассоциируются с повышенным риском тромбообразования. Помимо протромбогенных эффектов продуктов распада эритроцитов существуют также прямые взаимодействия между системой комплемента и системой свертывания крови: компонент C5a способен индуцировать экспрессию лейкоцитами тканевого фактора и ингибитора активатора плазминогена 1 типа [19, 20].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ПНГ является крайне редким заболеванием. По данным международного Регистра ПНГ, инициированного в 2003 г., заболеваемость ПНГ составляет 1 - 1,5 на 1 000 000 населения в год [21, 22]. Распространенность составляет 1,59 на 100 000 человек [23].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Пароксизмальная ночная гемоглобинурия согласно МКБ-10 соответствует коду D59.5 "Пароксизмальная ночная гемоглобинурия".
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Пароксизмальная ночная гемоглобинурия согласно МКБ-10 соответствует коду D59.5 "Пароксизмальная ночная гемоглобинурия".
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
ПНГ в большинстве случаев развивается постепенно в виде медленно нарастающей слабости, утомляемости, эпизодов желтухи и темной мочи, иногда с субфебрильной температурой. Выраженное ухудшение состояния может наступать в момент гемолитического криза [24].
Клинические проявления ПНГ целесообразно разделить на несколько категорий:
1) Симптомы, обусловленные гемолитической анемией.
Пациенты жалуются на повышенную утомляемость, одышку, тахикардию, желтушность кожи и слизистых, потемнение мочи (вплоть до черной). Состояние может значительно ухудшаться во время гемолитических кризов, развитие которых зачастую провоцируется инфекциями.
2) Симптомы, обусловленные тромботическими осложнениями.
Тромбозы являются наиболее частой причиной смерти пациентов с ПНГ. Венозные тромбозы встречаются несколько чаще артериальных и характеризуются необычной локализацией: тромбозы собственных вен печени (синдром Бадда-Киари), сосудов портальной системы, венозных синусов головного мозга. Симптоматика в данных случаях определяется локализацией тромбоза.
3) Симптомы, обусловленные гладкомышечной дистонией.
Предположительно, данная категория симптомов обусловлена истощением пула оксида азота (NO), ассоциированным с повышенной концентрацией свободного гемоглобина в плазме крови. Наиболее характерными клиническими проявлениями гладкомышечной дистонии у пациентов с ПНГ являются: дисфагия и спазм пищевода, абдоминальные боли, эректильная дисфункция.
4) Другие симптомы.
Пациенты с ПНГ имеют в 6 раз более высокий риск развития хронической болезни почек (ХБП), что может быть обусловлено как тромбозами микрососудов почек, так и повреждающим действием депозитов железа, накапливающегося в паренхиме почек в результате распада эритроцитов [25].
Примерно у 1/3 пациентов с ПНГ, не получающих патогенетическую терапию, развиваются симптомы легочной гипертензии. Основной жалобой пациентов с легочной гипертензией является одышка. Вероятными причинами развития легочной гипертензии могут служить как спазм легочных артериол вследствие истощения пула оксида азота в результате активного гемолиза, так и хронические тромбозы мелких ветвей легочной артерии [26].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния: диагноз ПНГ устанавливается на основании:
- характерной клинической и лабораторной картины внутрисосудистого гемолиза
- выявления в периферической крови ПНГ-клона методом проточной цитометрии (Иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин)
2.1 Жалобы и анамнез
См. раздел "Клиническая картина"
2.2 Физикальное обследование
См. раздел "Клиническая картина"
2.3 Лабораторные диагностические исследования
Стандартом диагностики ПНГ у пациентов с клинической и лабораторной картиной внутрисосудистого гемолиза является определение GPI-связанных гликопротеинов на поверхности эритроцитов (CD59), нейтрофилов (CD24/FLAER), моноцитов (CD14/FLAER) методом проточной цитометрии (Иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин). Ранее использовавшиеся пробы Хема (кислотная проба) и Хартмана (сахарозная проба) в настоящее время имеют лишь историческое значение и не рекомендуются к применению.
2.3.1 Диагностика анемии и внутрисосудистого гемолиза
- Рекомендуется всем пациентам с подозрением на ПНГ или впервые установленным диагнозом ПНГ исследование рутинных лабораторных показателей с целью диагностики гемолитической анемии, оценки функционального состояния внутренних органов (печени и почек), электролитного состава крови, углеводного обмена, сывороточных показателей метаболизма железа, системы гемостаза, маркеров хронических инфекций [22, 27 - 29]:
- общий (клинический) анализ крови развернутый;
- исследование уровня ретикулоцитов в крови;
- анализ крови биохимический общетерапевтический (определение активности аланинаминотрансферазы, аспартатаминотрансферазы, ЛДГ, креатинина, мочевины, билирубина связанного (конъюгированного), билирубина свободного (неконъюгированного), ферритина, исследование железосвязывающей способности сыворотки, железа, исследование уровня свободного гемоглобина в плазме крови, при доступности - исследование уровня гаптоглобина крови);
- прямой антиглобулиновый тест (прямая проба Кумбса);
- непрямой антиглобулиновый тест (тест Кумбса) - только пациентам, получающим заместительные гемотрансфузии;
- общий (клинический) анализ мочи с определением гемосидерина в моче
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: для активного внутрисосудистого гемолиза характерно повышение активности ЛДГ, общего билирубина за счет непрямой фракции, свободного гемоглобина плазмы, а также истощение гаптоглобина и появление гемосидерина в моче.
2.3.2 Определение ПНГ-клона
- Рекомендуется: иммунофенотипирование клеток периферической крови для диагностики ПНГ расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин) (исследование биологического материала методом проточной цитофлуориметрии) пациентам с подозрением на ПНГ [30 - 33].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарии: диагноз ПНГ следует заподозрить у пациентов со следующими клиническими и лабораторными проявлениями заболевания:
- Наличие признаков внутрисосудистого гемолиза
- Наличие признаков гемолиза в комбинации с:
- Гипохромной и/или микроцитарной анемией
- Абдоминальными болями
- Дисфагией
- Тромбозами
- Нейтро- или тромбоцитопенией
- Тромбозы редких локализаций или с необычными проявлениями:
- Тромбозы собственных вен печени (синдром Бадда-Киари), тромбозы сосудов портальной системы, венозных синусов головного мозга, вен кожи)
- Сопутствующая гемолитическая анемия
- Сопутствующая неясная цитопения
- Признаки костномозговой недостаточности
- Предполагаемая или доказанная АА
- Предполагаемый или доказанный МДС
- Цитопенические синдромы, этиология которых осталась не ясной после полноценного гематологического обследования.
Проточная цитометрия позволяет выявить процент клеток с дефицитом или полным отсутствием GPI-связанных гликопротенинов (GPI-AP). Выделяют 3 типа эритроцитов: эритроциты с нормальной экспрессией GPI-AP (I типа), эритроциты с частичным дефицитом GPI-AP (II типа), эритроциты с полным отсутствием GPI-AP (III типа). Ответ дается лабораторией в виде процентного содержания того или иного типа клеток в периферической крови. При проведении исследования ПНГ-клона методом проточной цитометрии необходимо руководствоваться рекомендациями международного общества клинической цитометрии (ICCS) от 2018 г. [34, 35], согласно которым ПНГ-клон оценивается по нескольким клеточным линиям (эритроциты, нейтрофилы, моноциты). При исследовании только лишь эритроцитов возможно искажение истинного размера ПНГ-клона в результате предшествующих гемотрансфузий и/или комплемент-опосредованного лизиса дефектных эритроцитов. Определение GPI-дефицитных нейтрофилов и моноцитов является более точным тестом для оценки истинного размера ПНГ-клона [30, 36]. Высокочувствительная проточная цитометрия позволяет выявлять ПНГ-клон размером 0,01% и более.
2.4 Инструментальные диагностические исследования
Инструментальные исследования при ПНГ применяются для диагностики вероятных осложнений заболевания, а также выявления сопутствующей патологии, которая может оказывать влияние на течение и прогноз основного заболевания.
- Рекомендуется: всем пациентам с впервые установленным диагнозом ПНГ проводить рутинное обследование с целью выявления осложнений (тромботических, легочной гипертензии) и выявления сопутствующей патологии, включающее [13, 27, 37]:
- УЗИ-исследование органов брюшной полости (комплексное);
- ультразвуковую допплерографию вен нижних конечностей
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- эхокардиографию [26];
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: при выявлении у пациентов с ПНГ характерных осложнений - тромбозов различных локализаций, проводится дообследование, включающее (по показаниям) ультразвуковое исследование органов брюшной полости (комплексное), магнитно-резонансную ангиографию с контрастированием, ультразвуковую допплерографию сосудов брыжейки, дуплексное сканирование нижней полой вены и вен портальной системы для подтверждения тромбоза и определения его точной локализации [13, 38]. Использование внутривенного контрастирования должно быть строго обосновано в связи с дополнительным риском развития нефропатии и острого почечного повреждения на фоне активного внутрисосудистого гемолиза.
2.5 Иные диагностические исследования
- Рекомендуется проведение исследований костного мозга: получение цитологического препарата костного мозга путем пункции и цитологическое исследование мазка костного мозга (миелограмма), а также получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов, цитогенетическое исследование (кариотип) костного мозга у пациентов с подозрением на ПНГ или с впервые выявленным ПНГ-клоном с целью дифференциальной диагностики классической ПНГ и АА/ПНГ, МДС/ПНГ и первичный миелофиброз/ПНГ [39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: исследование костного мозга должно включать морфологическое, цитохимическое (окраска на сидеробласты), кариологическое и, по возможности, молекулярное исследование миелокариоцитов для дифференциальной диагностики классической ПНГ и формы, ассоциированной с другим гематологическим заболеванием (АА, МДС, первичный миелофиброз).
При подозрении на апластическую анемию или МДС взрослым пациентам показано гистологическое исследование костного мозга и выполнение FISH-исследований согласно рекомендациям при соответствующих заболеваниях.
Спонтанное уменьшение размера клона ПНГ может быть признаком клональной трансформации в МДС и ОМЛ и требует повторного исследования костного мозга.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
В настоящее время для патогенетической терапии ПНГ применяются препараты, подавляющие активность системы комплемента и, соответственно, предотвращающие комплемент-зависимый лизис эритроцитов в кровеносном русле. В Российской Федерации зарегистрированы три препарата для патогенетической терапии у пациентов с ПНГ: экулизумаб**, равулизумаб и пэгцетакоплан.
Экулизумаб** представляет собой гуманизированное моноклональное антитело против C5-компонента комплемента для внутривенного введения.
Равулизумаб - гуманизированное моноклональное антитело против C5-компонента комплемента с длительным периодом полувыведения, предназначенное для внутривенного введения (с интервалом между введениями 56 +/- 7 дней).
Пэгцетакоплан предназначен для подкожного введения и представляет собой малую молекулу массой 40 кДа, состоящую из двух идентичных пентадекапептидов, ковалентно связанных с молекулой полиэтиленгликоля (ПЭГ). Пептидные фрагменты связываются с комплементом C3 и подавляют активацию всего каскада комплемента, что ведет к подавлению не только характерного для ПНГ внутрисосудистого гемолиза, но и внесосудистого гемолиза, обусловленного опсонизацией эритроцитов C3d компонентами комплемента.
Равулизумаб и пэгцетакоплан зарегистрированы Минздравом России в 2023 г. Достаточный опыт применения данных лекарственных препаратов у пациентов с ПНГ в нашей стране пока отсутствует.
3.1 Патогенетическая терапия
Лечение экулизумабом** приводит к прекращению внутрисосудистого гемолиза, исчезновению или уменьшению трансфузионной зависимости, снижению частоты тромботических осложнений, улучшению или стабилизации функции почек, снижению выраженности легочной гипертензии и к достоверному увеличению продолжительности жизни пациентов с ПНГ [25, 26, 29, 40 - 43].
- Рекомендуется: патогенетическая терапия экулизумабом** у пациентов с ПНГ с активным внутрисосудистым гемолизом (уровень общей ЛДГ более 1,5 верхней границы нормы) в следующих клинических ситуациях [25, 26, 40 - 46]:
Наличие в анамнезе тромботических осложнений, в развитии которых ведущую роль играет внутрисосудистый гемолиз
Трансфузионная зависимость вследствие хронического гемолиза
Наличие высокой активности заболевания, включая симптомы гладкомышечной дистонии, обусловленные гемолизом (дисфагия, абдоминальные боли, боли в груди, эректильная дисфункция и др.)
Нарушения функциональной способности почек, обусловленные внутрисосудистым гемолизом, включая эпизоды острого повреждения почек и критерии хронической болезни почек.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: терапия экулизумабом** сопряжена с повышенным риском развития инфекционных осложнений, прежде всего, менингококковой инфекции (Neisseria meningitidis). В соответствии с этим, пациентам, не менее чем за 2 недели до начала терапии экулизумабом** показана вакцинация противоменингококковой вакциной (группа J07AH Вакцины для профилактики менингита по АТХ-классификации), с последующей ревакцинацией в соответствии с существующими в РФ стандартами. В экстренных случаях, когда терапию экулизумабом** необходимо начать раньше, чем через 2 недели после вакцинации, пациенту следует назначить профилактическую антибактериальную терапию [47].
В случае наступления беременности у пациентки с ПНГ, не имеющей вышеуказанных показаний, решение о начале и длительности патогенетической терапии экулизумабом** принимается врачебной комиссией с участием гематологов-экспертов в лечении ПНГ.
При развитии прорывного внутрисосудистого гемолиза на фоне регулярной терапии экулизумабом** следует оценить его связь с потенциальными комплемент-активирующими факторами и интервалом после предшествующего введения препарата. В случае типичного рецидивирующего прорывного гемолиза за 1 - 4 дня до следующего введения экулизумаба** может потребоваться коррекция дозового режима экулизумаба**: #повышение дозы до 1200 мг каждые 14 дней или сокращение интервала - между введениями стандартной дозы 900 мг до 12 дней. Альтернативной тактикой является переключение пациента на терапию равулизумабом [37, 46, 48]. Дополнительным показанием к переключению на терапию равулизумабом, учитывая пролонгированный период его действия, служат детский возраст и отсутствие или крайне затрудненный венозный доступ у пациентов. Терапия равулизумабом, аналогично экулизумабу, требует наличия актуальной вакцинации противоменингококковой вакциной (группа J07AH по АТХ-классификации).
У ряда больных ПНГ, несмотря на регулярное лечение экулизумабом** и отсутствие лабораторных признаков внутрисосудистого гемолиза, сохраняется анемия с потребностью в заместительных трансфузиях эритроцитной взвеси, что следует расценивать как субоптимальный ответ на патогенетическую терапию. Критерии оптимального и субоптимального ответа на лечение приведены в табл. 1.
Причиной персистирующей трансфузионнозависимой анемии на фоне терапии экулизумабом** является активация внесосудистого (синоним - внутриклеточного) гемолиза, патогенез которого связан с активацией проксимального комплемента и опсонизацией ПНГ-эритроцитов C3d компонентами комплемента с последующим фагоцитозом и разрушением эритроцитов макрофагальной системой. Лабораторными критериями внесосудистого гемолиза служат положительная прямая проба Кумбса, ретикулоцитоз > 120 тыс/мкл, гипербилирубинемия за счет непрямой фракции > 1,5 x ВГН при отсутствии достоверных лабораторных маркеров внутрисосудистого гемолиза (ЛДГ > 1,5 x ВГН, наличие гемосидерина в моче, повышенный свободный гемоглобин плазмы крови). Наличие выраженного внесосудистого гемолиза у пациентов длительно (более 6 месяцев) получающих экулизумаб может служить показанием для переключения на терапию пэгцетакопланом. Назначение пэгцетакоплана, выключающего весь каскад комплемента, требует наличия вакцинации против трех возбудителей: Neisseria Meningitidis, Streptococcus pneumoniae и Haemophilus Influenzae. Режим последующей ревакцинации определяется инструкциями по применению использованных вакцин. В случае отсутствия вакцинации против одного или нескольких возбудителей требуется назначение профилактической антибактериальной терапии [49].
Другой причиной субоптимального гематологического ответа на экулизумаб** является костномозговая недостаточность. В соответствии с этим у пациентов с 2 - 3 ростковой цитопенией необходимо исследование костного мозга для исключения развития аплазии костного мозга [50].
Решение о переключении пациента с лечения экулизумабом** на равулизумаб или пэгцетакоплан принимается врачебной комиссией с привлечением врачей-гематологов-экспертов в области лечения ПНГ.
Терапия патогенетическими препаратами может проводиться в условиях круглосуточного стационара, а также, на этапе поддерживающей терапии - в дневном стационаре или в амбулаторных условиях.
Таблица 1. Критерии эффективности патогенетической терапии ПНГ ингибиторами комплемента [50]:
Гематологический ответ
Гемоглобин, г/л
Частота трансфузий эритроцитов
Комментарий
Оптимальный ответ
Полный ответ
> 120
Не проводятся
Хороший ответ
100 - 120
Субоптимальный ответ
Частичный ответ
80 - 100
и < 2 доз за полгода
Необходимо исключить костномозговую недостаточность
Малый ответ (отсутствие ответа)
< 80
и/или > 2 доз за полгода
При сохраняющемся субоптимальном гематологическом ответе в течение 3-х месяцев и более (при условии соблюдения режима патогенетической терапии) необходимо провести поиск причин недостаточной эффективности терапии и, по возможности, принять соответствующие меры коррекции.
3.2 Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических стволовых клеток (ТГСК - A16.05.001 Трансплантация костного мозга) в настоящее время является единственным радикальным способом лечения ПНГ, однако проведение ТГСК взрослым пациентам ассоциируется с высокой частотой тяжелых осложнений и, соответственно, высокой летальностью. В данной связи "классическая" форма ПНГ более не является показанием для проведения ТГСК при условии доступности патогенетического лечения.
- Не рекомендуется проведение ТГСК взрослым пациентам с классической формой ПНГ [51, 52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: при ПНГ, ассоциированной с другими гематологическими заболеваниями (АА, МДС), проведение ТГСК может рассматриваться в качестве лечебной опции, согласно показаниям, принятым при данных заболеваниях [51 - 53].
- Рекомендуется проведение ТГСК детям до 18 лет с любой формой ПНГ при наличии HLA-геноидентичного сиблинга (см. приложение А3.1) [51, 52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: терапия экулизумабом** проводится до трансплантации и в течение 4 недель после трансплантации.
- Рекомендуется проведение алло-ТГСК от HLA-идентичного родственного или неродственного донора пациентам моложе 40 лет при наличии костномозговой недостаточности, соответствующей критериям тяжелой АА, ассоциированной с ПНГ [51, 52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: риск аллогенной ТГСК повышен у больных с наличием тромбозов в анамнезе. Решение о трансплантации у таких больных должно приниматься коллегиально с привлечением специалистов-экспертов федеральных центров.
3.3 Сопроводительная терапия
Пациенты с нетяжелым течением ПНГ при отсутствии показаний к началу патогенетической терапии наблюдаются гематологом по месту жительства с регулярным мониторингом клинического статуса и основных лабораторных показателей, отражающих активность гемолиза, степень анемии, функциональную способность печени и почек, состояние свертывающей системы и метаболизма железа.
- Рекомендуется проведение заместительных гемотрансфузий пациентам с ПНГ при наличии выраженных симптомов гипоксии по индивидуальным показаниям [54].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: при гемотрансфузиях пациентам с ПНГ необходимо руководствоваться существующими в РФ стандартами и рекомендациями по трансфузиологии. Ранее существовавшая теория о необходимости применения в качестве трансфузионной среды только отмытых эритроцитов не нашла своего подтверждения в клинических исследованиях [55]. Для переливания могут использоваться различные эритроцит-содержащие компоненты крови, однако необходимо помнить, что у пациентов с выраженной трансфузионной зависимостью со временем может развиваться аллосенсибилизация, в связи с чем предпочтение необходимо отдавать лейкоредуцированным компонентам крови. Необходимо также помнить о возможном развитии посттрансфузионной перегрузки железом у пациентов, регулярно получающих переливания эритроцит-содержащих компонентов крови.
При оценке показаний к заместительным гемотрансфузиям необходимо учитывать совокупность факторов: возраст пациента, наличие сопутствующих и интеркуррентных заболеваний, переносимость гипоксии, социальные факторы (работоспособность, профессия и др.)
- Рекомендуется как можно быстрее начинать антикоагулянтную терапию пациентам с ПНГ, осложнившейся развитием острых тромбозов любой локализации [13].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: рецидивирующие тромбозы являются частым осложнением ПНГ. В случае развития острого тромбоза любой локализации необходима госпитализация в стационар и немедленное начало антикоагулянтной терапии. Предпочтительно использование низкомолекулярных гепаринов (АТХ Группа гепарина - B01AB: далтепарин натрия, эноксапарин натрия**, надропарин кальция, парнапарин натрия**, бемипарин натрия) в лечебной дозе. Решение о длительности антикоагулянтной терапии, в том числе профилактической после разрешения тромбоза, должно приниматься индивидуально, с учетом сопутствующих заболеваний, степени тромбоцитопении и доступности патогенетической терапии, так как стандартные режимы профилактической антикоагуляции на данный момент не разработаны. Как правило, на фоне лечения экулизумабом** тромботические осложнения являются редким событием. Данные по использованию прямых ингибиторов фактора Xa (B01AF по АТХ классификации) у пациентов с ПНГ на данный момент ограничены отдельными сообщениями.
- Не рекомендуется назначение глюкокортикоидов пациентам с доказанной ПНГ с целью купирования внутрисосудистого гемолиза [54, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Не рекомендуется назначение препаратов железа пациентам с ПНГ с целью лечения гипохромной анемии без надежных доказательств наличия абсолютного дефицита железа (низкий ферритин сыворотки, повышенные показатели ОЖСС и трансферрина, низкие средний объем эритроцитов и среднее содержание гемоглобина в эритроцитах) [54, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: назначение глюкокортикоидов и препаратов железа пациентам с ПНГ ассоциируется с повышенной частотой развития тяжелых осложнений: инфекций, тромбозов, почечной недостаточности, увеличением трансфузионной зависимости.
- Рекомендуется: проводить терапию фолиевой кислотой** (противопоказано детям до 3-х лет) и цианокобаламином** в стандартных дозировках (при дефиците) у пациентов с гемолитической формой ПНГ при развитии дефицита фолиевой кислоты и витамина B12, соответственно [27].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: у пациентов с ПНГ часто развивается дефицит фолиевой кислоты и витамина B12, что требует проведения дополнительной метаболической терапии для компенсации дефицита.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специальных методов реабилитации для пациентов с ПНГ не существует. Потребность в реабилитации может возникнуть при развитии жизнеугрожающих осложнений, таких как тромбозы мозговых сосудов или асептические некрозы головок бедренных костей с развитием вторичных коксартрозов. В данных случаях показания к нейрореабилитации или показания к эндопротезированию с последующей ортопедической реабилитацией определяются в порядке, установленном для перечисленных состояний.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактики развития ПНГ не существует.
Пациенты с ПНГ нуждаются в постоянном динамическом наблюдении врачом-гематологом и, при необходимости - профильных специалистов в соответствии с характером и тяжестью развившихся осложнений (например, при развитии внепеченочной портальной гипертензии вследствие тромбоза портальной системы необходима консультация и наблюдение портального хирурга).
Периодичность осмотров определяется индивидуально (от 3 до 12 месяцев) и зависит от тяжести течения ПНГ, частоты гемолитических кризов, характера лечения (патогенетическая терапия или заместительные гемотрансфузии), наличия и характера осложнений и сопутствующих заболеваний.
Наблюдение пациентов с ПНГ, помимо контроля рутинных показателей, включает мониторинг размера ПНГ-клона.
- Рекомендуется всем пациентам с установленным диагнозом ПНГ проведение диспансерных осмотров для контроля за динамикой процесса, оценки эффективности лечения и коррекции терапевтических назначений не реже 1 раза в год [29].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с "классической" ПНГ, АА/ПНГ и МДС/ПНГ определение размера ПНГ клона методом проточной цитометрии (Иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин) с частотой 1 раз в 6 месяцев [30, 32, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3)
- Рекомендуется всем пациентам без клинических проявлений ПНГ, но с ранее выявленным ПНГ-клоном, контроль размера патологического клона методом проточной цитометрии (Иммунофенотипирование клеток периферической крови для диагностики пароксизмальной ночной гемоглобинурии расширенной панелью маркеров, включая FLAER (флюоресцентно-меченый аэролизин):
- при исходном ПНГ-клоне > 1% - с частотой 1 раз в 6 месяцев, а также незамедлительно при клиническом ухудшении или развитии тромботических осложнений [30, 32, 56];
- при исходном ПНГ-клоне < 1% - с частотой 1 раз в 12 месяцев [30, 32, 56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3)
- Рекомендуется всем пациентам с ПНГ, получающим патогенетическую терапию, проводить исследование следующих показателей крови с частотой не реже 1 раза в 3 месяца [30, 32, 56, 57]:
- общий (клинический) анализ крови развернутый;
- исследование уровня ретикулоцитов в крови;
- анализ крови биохимический общетерапевтический (определение активности аланинаминотрансферазы, аспартатаминотрансферазы, ЛДГ, креатинина, мочевины, билирубина связанного (конъюгированного), билирубина свободного (неконъюгированного);
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с ПНГ, получающим патогенетическую терапию, проводить следующие исследования с частотой не реже 1 раза в 12 месяцев [27, 30, 32, 56 - 58]:
- Прямой антиглобулиновый тест (прямая проба Кумбса);
- Анализ крови биохимический общетерапевтический (определение ферритина, исследование железосвязывающей способности сыворотки, железа);
- Определение уровня витамина B12 (цианокобаламин) в крови;
- Исследование уровня фолиевой кислоты в сыворотке крови;
- Эхокардиографию (при наличии указаний на легочную гипертензию в анамнезе или сопутствующей кардиальной патологии).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
6. Организация оказания медицинской помощи
Показания для экстренной госпитализации пациентов с ПНГ в медицинскую организацию:
1. Развитие гемолитического криза и/или тромботических осложнений и/или тяжелого инфекционно-воспалительного процесса (пневмония, сепсис, особенно у пациентов, получающих патогенетическую терапию).
Показания для плановой госпитализации в медицинскую организацию:
1. Диспансерное обследование, в т.ч. при первичной постановке диагноза;
2. Диспансерное обследование для контроля эффективности патогенетической терапии;
3. Сохранение или нарастание трансфузионной зависимости, рецидивы прорывного гемолиза у пациентов, регулярно получающих патогенетическую терапию.
Показания к выписке пациента из медицинской организации
1. Стабилизация клинических и гематологических показателей на фоне патогенетической или симптоматической терапии;
2. Купирование инфекционных осложнений.
Условия проведения патогенетической терапии (стационарные/амбулаторные):
Учитывая хорошую переносимость, патогенетическая терапия внутривенными ингибиторами системы комплемента может проводиться как в условиях круглосуточного стационара, так и в условиях дневного стационара или амбулаторно. Препарат для подкожного введения может вводиться пациентом самостоятельно после соответствующего обучения и при удовлетворительной переносимости.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительные факторы в данных рекомендациях не представлены
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения (да/нет)
1.
Проведено исследование ПНГ-клона методом проточной цитометрии при первичной диагностике
Да/нет
2.
Проведена лабораторная оценка гемолитической активности (ретикулоциты, лактатдегидрогеназа, билирубин)
Да/нет
3.
Проведены стандартные лабораторные исследования (общий (клинический) анализ крови развернутый, общий (клинический) анализ мочи
Да/нет
4.
Проведен анализ крови биохимический общетерапевтический (определение активности аланинаминотрансферазы, аспартатаминотрансферазы, ЛДГ, креатинина, мочевины, билирубина связанного (конъюгированного), билирубина свободного (неконъюгированного), ферритина, трансферрина, исследование железосвязывающей способности сыворотки, железа) - при первичной диагностике
Да/нет
5.
Проведены стандартные инструментальные исследования (УЗИ-исследование органов брюшной полости (комплексное); эхокардиография) при первичной диагностике
Да/нет
6.
Проведены исследования костного мозга (при первичной диагностике ПНГ) (получение цитологического препарата костного мозга путем пункции и цитологическое исследование мазка костного мозга (миелограмма), а также получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов, цитогенетическое исследование (кариотип) костного мозга)
Да/нет
7.
Не назначались глюкокортикоиды (за исключением наличия других показаний к ГКС)
Да/нет
Список литературы
1. Bessler M. et al. Paroxysmal nocturnal haemoglobinuria (PNH) is caused by somatic mutations in the PIG-A gene.//EMBO J. 1994. Vol. 13, N 1. P. 110 - 117.
2. Takeda J. et al. Deficiency of the GPI anchor caused by a somatic mutation of the PIG-A gene in paroxysmal nocturnal hemoglobinuria//Cell. 1993. Vol. 73, N 4. P. 703 - 711.
3. Medof B.Y.M.E., Kinoshita T., Nussenzweig V. INHIBITION OF COMPLEMENT OF CELLS AFTER ACTIVATION ON THE OF INCORPORATION (DAF) INTO THEIR MEMBRANES A key step in complement activation on targets is the deposition of C4b and/or C3b fragments. These major cleavage products of C3 and C4 can associa//Journal of Experimental Medicine. 1984. Vol. 160, N November. P. 1558 - 1578.
4. Lublin D.M., Atkinson J.P. Decay-Accelerating Factor: Biochemistry, Molecular Biology, and Function//Annu Rev Immunol. 1989. Vol. 7, N 1. P. 35 - 58.
5. Rollins S.A., Sims P.J. The complement-inhibitory activity of CD59 resides in its capacity to block incorporation of C9 into membrane C5b-9.//The Journal of Immunology. 1990. Vol. 144, N 9. P. 3478 LP - 3483.
6. Noris M., Remuzzi G. Overview of complement activation and regulation//Semin Nephrol. Elsevier, 2013. Vol. 33, N 6. P. 479 - 492.
7. Tegla C.A. et al. Membrane attack by complement: the assembly and biology of terminal complement complexes//Immunol Res. 2011. Vol. 51, N 1. P. 45 - 60.
8. Serna M. et al. Structural basis of complement membrane attack complex formation//Nat Commun. Nature Publishing Group, 2016. Vol. 7. P. 1 - 7.
9. Sun X. et al. Role of decay-accelerating factor in regulating complement activation on the erythrocyte surface as revealed by gene targeting//Proc Natl Acad Sci U S A. 1999. Vol. 96, N 2. P. 628 - 633.
10. Brodbeck W.G. et al. Structure/function studies of human decay-accelerating factor//Immunology. 2000. Vol. 101, N 1. P. 104 - 111.
11. Farkas I. et al. CD59 blocks not only the insertion of C9 into MAC but inhibits ion channel formation by homologous C5b-8 as well as C5b-9//J Physiol. 2002. Vol. 539, N 2. P. 537 - 545.
12. Bessler M., Hiken J. The pathophysiology of disease in patients with paroxysmal nocturnal hemoglobinuria.//Hematology/the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2008. P. 104 - 110.
13. Hill A., Kelly R.J., Hillmen P. Thrombosis in paroxysmal nocturnal hemoglobinuria//Blood. 2013. Vol. 121, N 25. P. 4985 - 4996.
14. Rother R.P. et al. The Clinical Sequelae of Intravascular Hemolysis and Extracellular Plasma Hemoglobin//JAMA. 2005. Vol. 293, N 13. P. 1653.
15. Olsen S.B. et al. Enhancement of Platelet Deposition by Cross-Linked Hemoglobin in a Rat Carotid Endarterectomy Model//Circulation. 1996. Vol. 93, N 2. P. 327 - 332.
16. Simionatto C.S. et al. Thrombophlebitis and disturbed hemostasis following administration of intravenous hematin in normal volunteers//Am J Med. 1988. Vol. 85, N 4. P. 538 - 540.
17. Studt J.-D. et al. Fatal congenital thrombotic thrombocytopenic purpura with apparent ADAMTS13 inhibitor: in vitro inhibition of ADAMTS13 activity by hemoglobin//Blood. 2005. Vol. 105, N 2. P. 542 - 544.
18. Seregina E.A. et al. Eculizumab effect on the hemostatic state in patients with paroxysmal nocturnal hemoglobinuria//Blood Cells Mol Dis. 2015. Vol. 54, N 2. P. 144 - 150.
19. Ritis K. et al. A Novel C5a Receptor-Tissue Factor Cross-Talk in Neutrophils Links Innate Immunity to Coagulation Pathways//The Journal of Immunology. 2006. Vol. 177, N 7. P. 4794 - 4802.
20. Wojta J. et al. C5a stimulates production of plasminogen activator inhibitor-1 in human mast cells and basophils//Blood. 2002. Vol. 100, N 2. P. 517 - 523.
21. Yu F., Du Y., Han B. A comparative analysis of clinical characteristics of patients with paroxysmal nocturnal hemoglobinuria between Asia and Europe/America//Int J Hematol. Springer Japan, 2016. Vol. 103, N 6. P. 649 - 654.
22. Hill A. et al. Paroxysmal nocturnal haemoglobinuria//Nat Rev Dis Primers. 2017. Vol. 3, N 1. P. 17028.
23. Hill A. et al. The incidence and prevalence of paroxysmal nocturnal hemoglobinuria (PNH) and survival of patients in Yorkshire.//Blood. 2006. Vol. 108, N September 2018. P. Abstract 985.
24. Кулагин А.Д. et al. Клиническая манифестация и ошибки диагностики классической пароксизмальной ночной гемоглобинурии: анализ 150 наблюдений//Клиническая онкогематология. 2017. Vol. 10, N 3. P. 333 - 341.
25. Hillmen P. et al. Long-term effect of the complement inhibitor eculizumab on kidney function in patients with paroxysmal nocturnal hemoglobinuria//Am J Hematol. 2010. Vol. 85, N 8. P. 553 - 559.
26. Hill A. et al. Under-recognized complications in patients with paroxysmal nocturnal haemoglobinuria: Raised pulmonary pressure and reduced right ventricular function//Br J Haematol. 2012. Vol. 158, N 3. P. 409 - 414.
27. Sahin F. et al. Pesg PNH diagnosis, follow-up and treatment guidelines. 2016. Vol. 6, N 2. P. 19 - 27.
28. Brodsky R.A. Paroxysmal nocturnal hemoglobinuria//Blood. 2014. Vol. 124, N 18. P. 2804 - 2811.
29. Кулагин А.Д. et al. Национальные клинические рекомендации по диагностике и лечению пароксизмальной ночной гемоглобинурии//Онкогематология. 2014. Vol. 2. P. 20 - 28.
30. Borowitz M.J. et al. Guidelines for the diagnosis and monitoring of paroxysmal nocturnal hemoglobinuria and related disorders by flow cytometry//Cytometry B Clin Cytom. Wiley-Liss Inc., 2010. Vol. 78, N 4. P. 211 - 230.
31. Manivannan P., Ahuja A., Pati H.P. Diagnosis of Paroxysmal Nocturnal Hemoglobinuria: Recent Advances//Indian Journal of Hematology and Blood Transfusion. Springer India, 2017. Vol. 33, N 4. P. 453 - 462.
32. Movalia M.K. et al. Incidence of PNH Clones by Diagnostic Code Utilizing High Sensitivity Flow Cytometry//Blood. 2011. Vol. 118, N 21. P. 1033 - 1033.
33. Sipol A.A. et al. An inter-laboratory comparison of PNH clone detection by high-sensitivity flow cytometry in a Russian cohort//Hematology. 2015. Vol. 20, N 1. P. 31 - 38.
34. Dezern A.E., Borowitz M.J. ICCS/ESCCA consensus guidelines to detect GPI-deficient cells in paroxysmal nocturnal hemoglobinuria (PNH) and related disorders part 1 - clinical utility//Cytometry B Clin Cytom. 2018. Vol. 94, N 1. P. 16 - 22.
35. Sutherland D.R. et al. ICCS/ESCCA consensus guidelines to detect GPI-deficient cells in paroxysmal nocturnal hemoglobinuria (PNH) and related disorders part 2 - reagent selection and assay optimization for high-sensitivity testing//Cytometry B Clin Cytom. 2018. Vol. 94, N 1. P. 23 - 48.
36. Brubaker L.H., Essig L.R.J., Mengel C.E. Neutrophil life span in paroxysmal nocturnal hemoglobinuria//Blood. 1977. Vol. 50, N 4. P. 657 - 662.
37. Patriquin C.J. et al. How we treat paroxysmal nocturnal hemoglobinuria: A consensus statement of the Canadian PNH Network and review of the national registry//European Journal of Haematology. Blackwell Publishing Ltd, 2019. Vol. 102, N 1. P. 36 - 52.
38. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО).//Флебология. 2015. Vol. 4, N 2. P. 3 - 52.
39. Villegas A. et al. Spanish consensus statement for diagnosis and treatment of paroxysmal nocturnal haemoglobinuria//Med Clin (Barc). Ediciones Doyma, S.L., 2016. Vol. 146, N 6. P. 278e1 - 278e7.
40. Hill A. et al. Sustained response and long-term safety of eculizumab in paroxysmal nocturnal hemoglobinuria//Blood. 2005. Vol. 106, N 7. P. 2559 - 2565.
41. Hillmen P. et al. The Complement Inhibitor Eculizumab in Paroxysmal Nocturnal Hemoglobinuria//New England Journal of Medicine. 2006. Vol. 355, N 12. P. 1233 - 1243.
42. Savva S. The Potential of a Museum-School Partnership to Support Diversity and Multiliteracies-Based Pedagogy for the 21st Century. 2016. Vol. 111, N 4. P. 1840 - 1848.
43. Hillmen P. et al. Effect of Eculizumab on Hemolysis and Transfusion Requirements in Patients with Paroxysmal Nocturnal Hemoglobinuria//New England Journal of Medicine. 2004. Vol. 350, N 6. P. 552 - 559.
44. Reiss U.M. et al. Efficacy and safety of eculizumab in children and adolescents with paroxysmal nocturnal hemoglobinuria//Pediatr Blood Cancer. Pediatr Blood Cancer, 2014. Vol. 61, N 9. P. 1544 - 1550.
45. Lee J.W. et al. Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study//Blood. 2019. Vol. 133, N 6. P. 530 - 539.
46. Kulasekararaj A.G. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor-experienced adult patients with PNH: the 302 study//Blood. 2019. Vol. 133, N 6. P. 540 - 549.
47. McNamara L.A. et al. High Risk for Invasive Meningococcal Disease Among Patients Receiving Eculizumab (Soliris) Despite Receipt of Meningococcal Vaccine//MMWR Morb Mortal Wkly Rep. 2017. Vol. 66, N 27. P. 734 - 737.
48. Brodsky R.A. et al. Characterization of breakthrough hemolysis events observed in the phase 3 randomized studies of ravulizumab versus eculizumab in adults with paroxysmal nocturnal hemoglobinuria//Haematologica. 2020. Vol. 106, N 1. P. 230 - 237.
49. Инструкция по медицинскому применению препарата пэгцетакоплан ЛП-N(002459)-(РГ-RU) от 02.06.2023. Государственный реестр лекарственных средств.
50. Debureaux P.-E. et al. Categorizing hematological response to eculizumab in paroxysmal nocturnal hemoglobinuria: a multicenter real-life study//Bone Marrow Transplant. 2021. Vol. 56, N 10. P. 2600 - 2602.
51. Brodsky R.A. Stem cell transplantation for paroxysmal nocturnal hemoglobinuria. 2010. Vol. 95, N 6. P. 855 - 856.
52. de Latour R.P. et al. Allogeneic stem cell transplantation in paroxysmal nocturnal hemoglobinuria//Haematologica. 2012. Vol. 97, N 11. P. 1666 - 1673.
53. SHASHELEVA D.A. et al. Hematopoietic stem cell transplantation with alpha/beta T-lymphocyte depletion and short course of eculizumab in adolescents and young adults with paroxysmal nocturnal hemoglobinuria//Ter Arkh. 2018. Vol. 90, N 7. P. 57 - 64.
54. Young N.S. et al. The Management of Paroxysmal Nocturnal Hemoglobinuria: Recent Advances in Diagnosis and Treatment and New Hope for Patients//Semin Hematol. W.B. Saunders, 2009. Vol. 46, N SUPPL. 1.
55. Brecher M., Taswell H. Paroxysmal nocturnal hemoglobinuria and the transfusion of washed red cells. A myth revisited//Transfusion (Paris). 1989. Vol. 29, N 8. P. 681 - 685.
56. Parker C. Diagnosis and management of paroxysmal nocturnal hemoglobinuria//Blood. 2005. Vol. 106, N 12. P. 3699 - 3709.
57.  R.D. et al. Consensus statement for diagnosis and treatment of paroxysmal nocturnal haemoglobinuria//Hematol Transfus Cell Ther. 2021. Vol. 43, N 3. P. 341 - 348.
R.D. et al. Consensus statement for diagnosis and treatment of paroxysmal nocturnal haemoglobinuria//Hematol Transfus Cell Ther. 2021. Vol. 43, N 3. P. 341 - 348.
58. Kulasekararaj A.G., Brodsky R.A., Hill A. Monitoring of patients with paroxysmal nocturnal hemoglobinuria on a complement inhibitor//Am J Hematol. 2021. Vol. 96, N 7.
59. Ayuk F., Balduzzi A. Donor Selection for Adults and Pediatrics//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies/ed. Carreras E. et al. Springer, 2019. P. 87 - 99.
60. Carreras E., Rambaldi A. Evaluation and Counseling of Candidates//EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 77 - 87.
61. Confer D.L., Miller J.P., Chell J.W. Bone Marrow and Peripheral Blood Cell Donors and Donor Registries//Thomas' Hematopoietic Cell Transplantation. Chichester, UK: John Wiley & Sons, Ltd, 2016. Vol. 1 - 2. P. 423 - 432.
62. Witt V., Peters C. Collection of HSC in Children//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 123 - 127.
63. Gorin N.C. Bone Marrow Harvesting for HSCT//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 109 - 117.
64. Gorin N.C. Bone Marrow Harvesting for HSCT//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 109 - 117.
65. ![]() K. Mobilization and Collection of HSC//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 117 - 123.
K. Mobilization and Collection of HSC//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 117 - 123.
66. Querol S., Rocha V. Procurement and Management of Cord Blood//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 131 - 137.
67. Wuchter P. Processing, Cryopreserving and Controlling the Quality of HSCs//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 127 - 131.
68. Schumm M., Lang P., Handgretinger R. Graft Manipulation//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 137 - 143.
69. Nagler A., Shimoni A. Conditioning//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 99 - 109.
70. Danylesko I., Shimoni A., Nagler A. Treosulfan-based conditioning before hematopoietic SCT: more than a BU look-alike//Bone Marrow Transplantation 2012 47:1. Nature Publishing Group, 2011. Vol. 47, N 1. P. 5 - 14.
71. Ruutu T. How to use busulfan in conditioning for allogeneic transplantation//Cell Ther Transplant. Universitatsklinikum Hamburg - Eppendorf, 2018. Vol. 7, N 1. P. 18 - 20.
72. Langenhorst J.B. et al. Population Pharmacokinetics of Fludarabine in Children and Adults during Conditioning Prior to Allogeneic Hematopoietic Cell Transplantation//Clin Pharmacokinet. Springer, 2019. Vol. 58, N 5. P. 627.
73. Yoshida N. et al. Conditioning regimen for allogeneic bone marrow transplantation in children with acquired bone marrow failure: fludarabine/melphalan vs. fludarabine/cyclophosphamide//Bone Marrow Transplantation 2020 55:7. Nature Publishing Group, 2020. Vol. 55, N 7. P. 1272 - 1281.
74. Penack O. et al. Prophylaxis and management of graft versus host disease after stem-cell transplantation for haematological malignancies: updated consensus recommendations of the European Society for Blood and Marrow Transplantation//The Lancet Haematology. Elsevier Ltd, 2020. Vol. 7, N 2. P. e157 - e167.
75. Michonneau D., ![]() G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
76. Michonneau D., ![]() G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
G. GVHD Prophylaxis (Immunosuppression)//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 177 - 183.
77. Watanabe N. et al. Relationship between tacrolimus blood concentrations and clinical outcome during the first 4 weeks after SCT in children//Bone Marrow Transplantation 2010 45:7. Nature Publishing Group, 2009. Vol. 45, N 7. P. 1161 - 1166.
78. Jacoby E. et al. Single agent post-transplantation cyclophosphamide as GVHD prophylaxis after HLA-matched related BMT for pediatric and young adult patients with hematologic malignancies//Biol Blood Marrow Transplant. NIH Public Access, 2016. Vol. 22, N 1. P. 112.
79. Baron F. et al. Anti-thymocyte globulin as graft-versus-host disease prevention in the setting of allogeneic peripheral blood stem cell transplantation: a review from the Acute Leukemia Working Party of the European Society for Blood and Marrow Transplantation//Haematologica. 2017. Vol. 102, N 2.
80. Koreth J. et al. Bortezomib-based immunosuppression after reduced-intensity conditioning hematopoietic stem cell transplantation: randomized phase II results//Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 3. P. 522 - 530.
81. Wertheimer T. et al. Abatacept as salvage therapy in chronic graft-versus-host disease - a retrospective analysis//Ann Hematol. 2021. Vol. 100, N 3. P. 779 - 787.
82. Drobyski W.R. et al. Tocilizumab for the Treatment of Steroid Refractory Graft-versus-Host Disease//Biology of Blood and Marrow Transplantation. Elsevier, 2011. Vol. 17, N 12. P. 1862 - 1868.
83. Abouelnasr A. et al. Defining the Role of Sirolimus in the Management of Graft-versus-Host Disease: From Prophylaxis to Treatment//Biology of Blood and Marrow Transplantation. 2013. Vol. 19. P. 12 - 21.
84.  H. et al. A prospective single-center study on CNI-free GVHD prophylaxis with everolimus plus mycophenolate mofetil in allogeneic HCT//Annals of Hematology 2021 100:8. Springer, 2021. Vol. 100, N 8. P. 2095 - 2103.
H. et al. A prospective single-center study on CNI-free GVHD prophylaxis with everolimus plus mycophenolate mofetil in allogeneic HCT//Annals of Hematology 2021 100:8. Springer, 2021. Vol. 100, N 8. P. 2095 - 2103.
85. Malard F. et al. Rituximab-based first-line treatment of cGVHD after allogeneic SCT: results of a phase 2 study//Blood. Content Repository Only!, 2017. Vol. 130, N 20. P. 2186 - 2195.
86. Cutler C., Antin J.H. Manifestations and Treatment of Acute Graft-versus-Host Disease//Thomas' Hematopoietic Cell Transplantation. Chichester, UK: John Wiley & Sons, Ltd, 2016. Vol. 2 - 2. P. 1012 - 1025.
87. Holler E., Greinix H., Zeiser R. Acute Graft-Versus-Host Disease//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 323 - 330.
88. Toubai T., Magenau J. Immunopathology and biology-based treatment of steroid-refractory graft-versus-host disease//Blood. American Society of Hematology, 2020. Vol. 136, N 4. P. 429 - 440.
89. Martin P.J. How I treat steroid-refractory acute graft-versus-host disease//Blood. American Society of Hematology, 2020. Vol. 135, N 19. P. 1630 - 1638.
90. Nassar A. et al. Methotrexate for the Treatment of Graft-versus-Host Disease after Allogeneic Hematopoietic Stem Cell Transplantation//J Transplant. Hindawi Limited, 2014. Vol. 2014. P. 1 - 10.
91. Kawashima N. et al. Prophylaxis and treatment with mycophenolate mofetil in children with graft-versus-host disease undergoing allogeneic hematopoietic stem cell transplantation: a nationwide survey in Japan//International Journal of Hematology 2019 109:4. Springer, 2019. Vol. 109, N 4. P. 491 - 498.
92. Khandelwal P. et al. The successful use of alemtuzumab for treatment of steroid-refractory acute graft-versus-host disease in pediatric patients//Pediatr Transplant. Pediatr Transplant, 2014. Vol. 18, N 1. P. 94 - 102.
93. Vicent M.G. et al. Ruxolitinib treatment for steroid refractory acute and chronic graft vs host disease in children: Clinical and immunological results//Am J Hematol. John Wiley & Sons, Ltd, 2019. Vol. 94, N 3. P. 319 - 326.
94. Faraci M. et al. Etanercept as Treatment of Steroid-Refractory Acute Graft-versus-Host Disease in Pediatric Patients//Biology of Blood and Marrow Transplantation. Elsevier, 2019. Vol. 25, N 4. P. 743 - 748.
95. Sleight B.S. et al. Infliximab for GVHD therapy in children//Bone Marrow Transplantation 2007 40:5. Nature Publishing Group, 2007. Vol. 40, N 5. P. 473 - 480.
96. Albert M.H. et al. Oral graft vs. host disease in children - Treatment with topical tacrolimus ointment//Pediatr Transplant. Pediatr Transplant, 2007. Vol. 11, N 3. P. 306 - 309.
97. Zangrilli A. et al. Treatment of disfiguring chronic graft versus host disease in a child with topical pimecrolimus//Pediatrics International. Pediatr Int, 2010. Vol. 52, N 3. P. e161 - 3.
98. Baird K. et al. Imatinib Mesylate for the Treatment of Steroid-Refractory Sclerotic-Type Cutaneous Chronic Graft-versus-Host Disease//Biology of Blood and Marrow Transplantation. Biol Blood Marrow Transplant, 2015. Vol. 21, N 6. P. 1083 - 1090.
99. Wolff D., Lawitschka A. Chronic Graft-Versus-Host Disease//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 331 - 347.
100. Filipovich A.H. et al. National Institutes of Health Consensus Development Project on criteria for clinical trials in chronic graft-versus-host disease: I. diagnosis and staging working group report//Biology of Blood and Marrow Transplantation. Biol Blood Marrow Transplant, 2005. Vol. 11, N 12. P. 945 - 956.
101. Jagasia M.H. et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. The 2014 Diagnosis and Staging Working Group Report//Biology of Blood and Marrow Transplantation. Elsevier Inc., 2015. Vol. 21, N 3. P. 389 - 401. e1.
102. Mikulska M. Infection Control and Isolation Procedures//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 189 - 197.
103. Mikulska M. Neutropenic Fever//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 259 - 265.
104. Ljungman P., Styczynski J., Einsele H. Viral Infections//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 281 - 291.
105. Maertens J.A. Invasive Fungal Infections//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 273 - 281.
106. Groll A.H. et al. Fourth European Conference on Infections in Leukaemia (ECIL-4): Guidelines for diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or allogeneic haemopoietic stem-cell transplantation//The Lancet Oncology. Lancet Publishing Group, 2014. Vol. 15, N 8.
107. Cesaro S. Haemorrhagic Cystitis and Renal Dysfunction//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 387 - 393.
108. Carreras E., Diaz-Ricart M. Early Complications of Endothelial Origin//EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 315 - 323.
109. Mahadeo K.M. et al. Diagnosis, grading, and treatment recommendations for children, adolescents, and young adults with sinusoidal obstructive syndrome: an international expert position statement//The Lancet Haematology. Elsevier Ltd, 2020. Vol. 7, N 1. P. e61 - e72.
110. Sung L. et al. Guideline for the prevention of oral and oropharyngeal mucositis in children receiving treatment for cancer or undergoing haematopoietic stem cell transplantation//BMJ Supportive and Palliative Care. BMJ Publishing Group, 2017. Vol. 7, N 1. P. 7 - 16.
111. Ghali M.G.Z. et al. Posterior reversible encephalopathy syndrome in pediatric patients: pathophysiology, diagnosis, and management//Leukemia and Lymphoma. Taylor and Francis Ltd, 2019. Vol. 60, N 10. P. 2365 - 2372.
112. Cooke K.R. Acute lung injury after allogeneic stem cell transplantation: From the clinic, to the bench and back again//Pediatr Transplant. John Wiley & Sons, Ltd, 2005. Vol. 9, N SUPPL. 7. P. 25 - 36.
113. Jodele S. et al. New approaches in the diagnosis, pathophysiology, and treatment of pediatric hematopoietic stem cell transplantation-associated thrombotic microangiopathy//Transfusion and Apheresis Science. Elsevier Ltd, 2016. Vol. 54, N 2. P. 181 - 190.
114. Baumgartner A., Schuetz P. Nutritional Support//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 171 - 177.
115. Schrezenmeier H. et al. Transfusion Support//The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies. 7th ed./ed. Carreras E. et al. Springer, 2019. P. 163 - 171.
116. Bahar B., Tormey C.A. Prevention of transfusion-associated graft-versus-host disease with blood product irradiation the past, present, and future//Archives of Pathology and Laboratory Medicine. College of American Pathologists, 2018. Vol. 142, N 5. P. 662 - 667.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Члены Национального гематологического общества:
- Паровичникова Е.Н. <1>, д.м.н., генеральный директор НМИЦ гематологии, главный внештатный специалист-гематолог Минздрава России
- Лукина Е.А. <1>, д.м.н., профессор, зав. отделом орфанных заболеваний НМИЦ гематологии
- Михайлова Е.А. <1>, д.м.н., профессор, ведущий научный сотрудник сектора научных исследований химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга
- Латышев В.Д. <1>, заведующий дневным стационаром гематологии для больных с наследственными метаболическими заболеваниями НМИЦ гематологии
- Цветаева Н.В. <1>, к.м.н., старший научный сотрудник сектора изучения неопухолевых заболеваний системы крови
- Пономарев Р.В. <1>, к.м.н., руководитель сектора изучения неопухолевых заболеваний системы крови НМИЦ гематологии.
- Фидарова З.Т. <1>, к.м.н., заведующая отделением химиотерапии гемобластозов и депрессий кроветворения с блоком трансплантации костного мозга и гемопоэтических стволовых клеток НМИЦ гематологии
- Гальцева И.В. <1>, д.м.н., руководитель сектора иммунофенотипирования клеток крови и костного мозга НМИЦ гематологии
- Двирнык В.Н. <1>, к.м.н., зав.централизованной клинико-диагностической лабораторией НМИЦ гематологии
- Птушкин В.В. <2>, д.м.н., главный внештатный специалист-гематолог ДЗ г. Москвы, зам.главного врача по гематологии ГБУЗ "ГКБ им. С.П. Боткина ДЗМ", профессор кафедры онкологии, гематологии и лучевой терапии ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
- Кулагин А.Д. <3>, д.м.н., директор Научно-исследовательского института детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Минздрава России, главный внештатный специалист-гематолог СЗФО
- Шилова Е.Р. <4>, к.м.н. врач-гематолог ФГБУ "Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства"
- Митина Т.А. <7>, д.м.н., проф., руководитель отделения клинической гематологии и иммунотерапии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, главный внештатный гематолог Министерства здравоохранения Московской области
Члены Российского общества детских онкологов и гематологов:
- Масчан А.А. <5>, д.м.н., профессор, член-корреспондент РАН, заместитель генерального директора, директор Института гематологии, иммунологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
- Сметанина Н.С. <5>, д.м.н., профессор, заместитель директора Института гематологии, иммунологии и клеточных технологий ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России
Члены Федерации лабораторной медицины:
- Луговская С.А. <6>, д.м.н., профессор кафедры клинической лабораторной диагностики ФГБОУ ДПО РМАНПО Минздрава России
--------------------------------
1. Федеральное государственное бюджетное учреждение "Национальный медицинский исследовательский центр гематологии" Министерства здравоохранения Российской Федерации
2. Государственное бюджетное учреждение здравоохранения города Москвы Городская клиническая больница имени С.П. Боткина Департамента здравоохранения города Москвы
3. Научно-исследовательский институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Минздрава России
4. ФГБУ "Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико-биологического агентства"
5. ФГБУ "Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева (НМИЦ ДГОИ им. Дмитрия Рогачева)" Министерства здравоохранения Российской Федерации
6. ФГБОУ ДПО Российская медицинская академия непрерывного профессионального образования (РМАНПО) Министерства здравоохранения Российской Федерации
7. ГБУЗ МО МОНИКИ им. М.Ф. Владимирского
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Специалисты врачи-гематологи
2. Специалисты врачи-терапевты
3. Специалисты врачи-неврологи
4. Специалисты врачи-нефрологи
5. Специалисты врачи-пульмонологи
Методология сбора доказательств
- Поиск публикаций в специализированных периодических печатных изданиях
- Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств проводилась в соответствии со шкалой оценки уровней достоверности доказательств (УДД) для методов диагностики (табл. 1) и для методов профилактики, лечения и реабилитации (табл. 2). Оценка значимости рекомендаций проводилась в соответствии с Шкалой оценки уровней убедительности рекомендаций (табл. 3)
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ТРАНСПЛАНТАЦИЯ
ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У ПАЦИЕНТОВ
С ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИЕЙ
В ВОЗРАСТЕ ОТ 0 ДО 18 ЛЕТ
1. Общие положения
Трансплантация гемопоэтических стволовых клеток (ТГСК) - медицинская технология, применяемая при лечении злокачественных болезней крови, неизлечимых иными (консервативными) методами. Принцип метода состоит в комбинированном воздействии на гемопоэтическую и лимфоидную систему, пораженные болезнью, которое складывается из 1) иммуно- и миелосупрессивного эффекта высокодозной химио- и лучевой терапии; 2) замещения кроветворной функции костного мозга донорскими гемопоэтическими стволовыми клетками; и 3) иммунологическом (аллоиммунном) воздействии со стороны донорских иммунокомпетентных клеток на резидуальный лимфогемопоэз реципиента.
2. Этапы ТГСК и клиническая периодизация
Процедура ТГСК состоит из следующих этапов (периодов):
1. Предтрансплантационное обследование донора и реципиента
2. Предтрансплантационная подготовка донора и реципиента
3. Кондиционирование реципиента
4. Заготовка и обработка трансплантата
5. Миелоинфузия (собственно трансплантация)
6. Иммуносупрессивная и сопроводительня терапия до миелореконституции (приживления трансплантата)
7. Иммуносупрессивная и сопроводительня терапия на раннем этапе после приживления (день 30 - 100)
8. Иммуносупрессивная и сопроводительня терапия на позднем этапе после приживления (день 100 - 365)
1. Выбор донора и источника ГСК [59]
С целью своевременного выбора донора всем пациентам с ПНГ при установлении показаний к ТГСК выполняется тканевое (HLA) типирование пациента и потенциальных родственных доноров. Тактика типирования членов семьи определяется стратегией клиники в отношение использования доноров ГСК. Донором для пациента с ПНГ может быть (в порядке снижения приоритета):
a. Родственный полностью совместимый донор
b. Родственный частично совместимый (гаплоидентичный) донор или Неродственный совместимый донор или неродственный частично совместимый донор с допустимой степенью несовместимости
c. Неродственная пуповинная кровь
Источник ГСК выбирается исходя из технологической платформы ТГСК, реализуемой в клинике. Источником ТГСК может являться:
- Костный мозг (КМ)
- Стволовые клетки периферической крови (СКПК)
- Пуповинная кровь (ПК)
2. Обследование пациента перед ТГСК [60]
Обследование пациента перед ТГСК направлено на установление статуса основного заболевания, оценку коморбидности, функционального статуса, нутритивного статуса, инфекционного статуса, психологического статуса.
Методы клинической лабораторной диагностики, применяемые при обследовании пациента перед ТГСК [60]:
- Общий (клинический) анализ крови развернутый
- Анализ крови биохимический общетерапевтический с исследованием следующих показателей: альбумин, общий белок, общий билирубин, прямой билирубин, креатинин, мочевина, глюкоза, электролиты (K, Na, Mg, Ca), аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтрансфераза, щелочная фосфатаза, лактатдегидрогеназа, альфа-амилаза, панкреатическая амилаза, холестерин общий, триглицериды, липаза, липопротеины низкой плотности, липопротеины высокой плотности
- Исследование уровня ферритина в крови, исследование уровня фолиевой кислоты в сыворотке крови, определение уровня витамина B12 (цианокобаламин) в крови
- Исследование кислотно-основного состояния и газов крови
- Иммунофенотипирование периферической крови для выявления субпопуляционного состава лимфоцитов (основные)
- Исследование уровня иммуноглобулинов в крови
- Определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК вируса герпеса 6 типа (HHV6) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК аденовируса (Human Adenovirus) в мазках со слизистой оболочки носоглотки/ротоглотки методом ПЦР
- Микробиологическое (культуральное) исследование крови на стерильность
- Определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактор)
- Непрямой антиглобулиновый тест (тест Кумбса), определение содержания антител к антигенам эритроцитов в крови, определение содержания антител к антигенам групп крови, определение холодовых антиэритроцитарных антител в крови
- Прямой антиглобулиновый тест (прямая проба Кумбса)
- Определение протромбинового (тромбопластинового) времени в крови или в плазме, определение международного нормализованного отношения (МНО)
- Определение активированного частичного тромбопластинового времени
- Определение тромбинового времени в крови
- Определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови
- Госпитальный скрининг: определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к ядерному антигену вируса гепатита B (Hepatitis B virus) в крови, молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus), молекулярно-биологическое исследование крови на Treponema pallidum, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови
- Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование
- Определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, количественное исследование
- Иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile)
- Микробиологические исследования основных возбудителей инфекционных заболеваний со слизистых оболочек/поверхности кожи
- Общеклиническое исследование спинномозговой жидкости (ликвора): исследование физических свойств спинномозговой жидкости, микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза), цитологическое исследование клеток спинномозговой жидкости
- Общий (клинический) анализ мочи, микроскопическое исследование осадка мочи,
- Определение белка в моче
- Исследование уровня глюкозы в моче
- Исследование уровня креатинина в моче
- Исследование уровня мочевины в моче
- Микробиологическое (культуральное) исследование на стерильность крови, спинномозговой жидкости, мочи, фрагментов медицинских устройств (ЦВК, имплант)
- Микробиологические исследования основных возбудителей инфекционных заболеваний в биологических жидкостях (экссудатах, транссудатах)
- Микробиологические исследования основных возбудителей инфекционных заболеваний в биоптатах
- Микробиологические исследования основных возбудителей инфекционных заболеваний в бронхоальвеолярном лаваже/мокроте
- Микробиологические исследования основных возбудителей инфекционных заболеваний в раневом отделяемом
- Микробиологические исследования основных возбудителей инфекционных заболеваний фекалий/ректального мазка
- Исследование уровня кальция в моче
- Исследование уровня фосфора в моче
- Исследование уровня калия, натрия, кальция, хлора в моче
- Определение активности панкреатической амилазы в крови
- Исследование уровня тропонинов I, T в крови
- Исследование функции нефронов по клиренсу креатинина (проба Реберга),
- Сортировка клеточных линий методом проточной цитофлуориметрии (исследование биологического материала методом проточной цитофлуориметрии)
- Флуоресцентная in situ гибридизация (FISH) (после гипотонической обработки клеток, на готовой суспензии клеток, на отпечатках и мазках) (1 ДНК-зонд)* (молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом)
- Дифференцированный подсчет лейкоцитов (лейкоцитарная формула)
- Исследование уровня свободного трийодтиронина (СТ3) в крови
- Исследование уровня свободного тироксина (СТ4) сыворотки крови
- Исследование уровня тиреотропного гормона (ТТГ) в крови
- Исследование уровня общего кортизола в крови
- Исследование уровня инсулиноподобного ростового фактора I в крови
- Исследование уровня фолликулостимулирующего гормона в сыворотке крови, исследование уровня лютеинизирующего гормона в сыворотке крови
- Исследование уровня общего эстрадиола в крови, исследование уровня общего тестостерона в крови
- Определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови
- Определение антител класса G (IgG) к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
- Определение антител класса M (IgM) к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
- Определение антител класса G (IgG) к вирусу ветряной оспы и опоясывающего лишая (Varicella-Zoster virus) в крови
- Определение антител класса M (IgM) к вирусу ветряной оспы и опоясывающего лишая (Varicella-Zoster virus) в крови
- Определение антител класса G (IgG) к вирусу простого герпеса 1 и 2 типа (Herpes simplex virus 1, 2) в крови
- Определение антител класса M (IgM) к вирусу простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в крови
- Определение антител класса G (IgG) к токсоплазме (Toxoplasma gondii) в крови
- Определение антител класса M (IgM) к токсоплазме (Toxoplasma gondii) в крови
Инструментальные методы, применяемые при обследовании пациента перед ТГСК:
- Прицельная рентгенография грудной клетки (2 проекции)
- Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием
- Спиральная компьютерная томография придаточных пазух носа
- Компьютерная томография органов грудной полости
- Магнитно-резонансная томография головного мозга с контрастированием под наркозом - 3Т (Тесла)
- Ультразвуковое исследование почек, надпочечников мочевого пузыря, органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезенка), забрюшинного пространства, малого таза
- Регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных (дети 1 - 18 лет)
- Суточное мониторирование артериального давления
- Эргоспирометрия
- Дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока
- Дуплексное сканирование нижней полой вены и вен портальной системы
- Получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма)
- Спинномозговая пункция
- Анестезиологическое пособие (включая раннее послеоперационное ведение)
- Эзофагогастродуоденоскопия
- Колоноскопия
- Биопсия пищевода, желудка, двенадцатиперстной кишки с помощью эндоскопии
- Биопсия ободочной кишки эндоскопическая
- Биопсия прямой кишки с помощью видеоэндоскопических технологий
- Биопсия кожи
- Бронхоскопия диагностическая
- Электроэнцефалография с видеомониторингом
- Ортопантомография
Консультации врачей-специалистов в предтрансплантационном периоде:
- Врач-офтальмолог
- Врач-отоларинголог
- Врач-невролог
- Врач-стоматолог
- Медицинский психолог
- Врач-кардиолог
- Врач-пульмонолог
- Врач-эндокринолог
- Врач-акушер-гинеколог
3. Обследование донора перед ТГСК [61]
Обследование донора перед ТГСК выполняется в два этапа. Этап 1: обследование потенциального донора. Направлен на установление степени совместимости по антигенам HLA, выявление абсолютных противопоказаний к донации. Этап 2: обследование актуального донора. Направлен на объективную оценку состояния здоровья донора, инфекционного статуса, выявление относительных противопоказаний к донации, установление приоритетного метода заготовки ГСК.
Методы клинической лабораторной диагностики, применяемые при обследовании донора перед ТГСК [61]:
- Общий (клинический) анализ крови развернутый
- Анализ крови биохимический общетерапевтический с исследованием следующих показателей: альбумин, общий белок, общий билирубин, прямой билирубин, креатинин, мочевина, глюкоза, электролиты (K, Na)), аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтрансфераза, щелочная фосфатаза, альфа-амилаза, панкреатическая амилаза, холестерин общий, триглицериды, липаза, липопротеины низкой плотности, липопротеины высокой плотности
- Определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактор)
- Определение протромбинового (тромбопластинового) времени в крови или в плазме, определение международного нормализованного отношения (МНО)
- Определение активированного частичного тромбопластинового времени
- Определение тромбинового времени в крови
- Определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови
- Госпитальный скрининг: определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к ядерному антигену вируса гепатита B (Hepatitis B virus) в крови, молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus), молекулярно-биологическое исследование крови на Treponema pallidum, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови
- Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование
- Определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, количественное исследование
- Общий (клинический) анализ мочи, микроскопическое исследование осадка мочи
- Определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови
- Определение антител класса G (IgG) к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
- Определение антител класса M (IgM) к капсидному антигену (VCA) вируса Эпштейна-Барр (Epstein-Barr virus) в крови
- Определение антител класса G (IgG) к вирусу ветряной оспы и опоясывающего лишая (Varicella-Zoster virus) в крови
- Определение антител класса M (IgM) к вирусу ветряной оспы и опоясывающего лишая (Varicella-Zoster virus) в крови
- Определение антител класса G (IgG) к вирусу простого герпеса 1 и 2 типа (Herpes simplex virus 1, 2) в крови
- Определение антител класса M (IgM) к вирусу простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в крови
- Определение антител класса G (IgG) к токсоплазме (Toxoplasma gondii) в крови
- Определение антител класса M (IgM) к токсоплазме (Toxoplasma gondii) в крови
Инструментальные методы, применяемые при обследовании донора перед ТГСК [61]:
- Прицельная рентгенография грудной клетки (2 проекции)
- Ультразвуковое исследование почек, надпочечников мочевого пузыря, органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезенка), забрюшинного пространства, малого таза
- Регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных
- Суточное мониторирование артериального давления
- Дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока
- Дуплексное сканирование нижней полой вены и вен портальной системы
- Эхокардиография
- Анестезиологическое пособие (включая раннее послеоперационное ведение)
4. Заготовка трансплантата [62]
Заготовка и обработка трансплантата ГСК включают мероприятия по извлечению ГСК донора и их последующую обработку, направленную на формирование оптимальных функциональных характеристик трансплантата. Этапами заготовки трансплантата являются:
- Подготовка донора
- Заготовка трансплантата
- Обработка трансплантата
- Контроль качества трансплантата
- Транспортировка и хранение трансплантата (при разобщении места и времени заготовки трансплантата и инфузии трансплантата)
Подготовка донора
Подготовка донора зависит от метода заготовки трансплантата и, соответственно, от избранного источника ГСК (КМ или СКПК).
При использовании в качестве источника ГСК костного мозга подготовка донора включает:
- Предоперационное обследование
- Обеспечение сосудистого доступа
При использовании в качестве источника ГСК подготовка донора включает:
- Фармакологическую мобилизацию ГСК в сосудистое русло. Целью фармакологической мобилизации ГСК является временное перемещение ГСК костного мозга в сосудистое русло с целью обеспечения возможности заготовки необходимого количества ГСК.
- Обеспечение сосудистого доступа
Заготовка трансплантата
Заготовка донорского КМ [63]
Заготовка донорского КМ выполняется в условиях операционного блока под общей или эпидуральной анестезией. Технически заготовка КМ представляет собой последовательные пункции в области верхней задней подвздошной ости и подвздошного гребня и аспирацию КМ. Целевой объем донорского КМ составляет 20 мл/кг массы тела реципиента и не должен превышать 20 мл/кг массы тела донора. Аспирированный КМ переносится в гепаринизированную емкость (пакет).
Медикаменты и средства медицинского применения, необходимые для заготовки КМ донора [64]:
- Желатин** - раствор 4%
- Пропофол**
- Рокурония бромид**
- Сугаммадекс**
- Севофлуран**
- Фентанил**
- Ропивакаин**
- Интубационная трубка
- Периферический венозный катетер
- Игла для аспирации костного мозга
- Шприц медицинский объем 10 мл, 5 мл, 2 мл
- Система для заготовки костного мозга (или система для забора компонентов крови)
- Система инфузионная
- Гепарин натрия**
- Декстроза + натрия цитрат
- Шовный материал
- Скальпель
- Пластырная повязка
- Перчатки стерильные
- Антисептики и дезинфицирующие средства для обработки операционного поля
Заготовка донорских СКПК [65]
Заготовка донорских СКПК выполняется в условиях отделения переливания крови или врачом-трансфузиологом отделения ТГСК. Технически заготовка донорских СКПК осуществляется методом аппаратного лейкоцитафереза на сепараторе клеток крови. Объем лейкоцитафереза определяется исходя из концентрации ГСК в крови в результате фармакологической мобилизации и составляет от 0,5 до 2 объемов циркулирующей крови (ОЦК).
Медикаменты и средства медицинского применения, необходимые для заготовки СКПК донора [65]:
- Колониестимулирующие факторы (группа L03AA по классификации АТХ)
- #Плериксафор 0,24 мг/кг/сут п/к
- Фистульные иглы 17G
- Периферический катетер 16G
- Центральный венозный катетер 7 - 12F
- Система Spectra Optia Collection Set (ref 10110, Terumo BCT) или Spectra Optia IDL Set (ref 10310, Terumo BCT)
- Декстроза + натрия цитрат
- Эритроцитарная масса
- Системы для трансфузий крови
- Дискофикс (трехходовой коннектор)
- Пустой стерильный мешок для компонентов крови
Заготовка ПК [66]
Заготовка ПК выполняется в условиях родильного блока. Технически заготовка ПК осуществляется путем пункции пупочной вены пупочного канатика и сбора ПК в систему для заготовки (четырехкамерный мешок с антикоагулянтом).
Обработка трансплантата ГСК [67]
Обработка трансплантата - набор технических манипуляций, направленных на изменение качественных и количественных параметров трансплантата ГСК с целью обеспечения оптимальных функциональных характеристик трансплантата с точки зрения эффективности и безопасности процедуры ТГСК. Обработка трансплантата выполняется на базе специализированной лаборатории в составе отделения переливания крови или отделения ТГСК. Основными типами обработки трансплантата являются [68]:
- Разделение трансплантата
- Редукция объема трансплантата
- Редукция (удаление) плазмы
- Редукция (удаление) эритроцитов
- Селекция ГСК (CD34 селекция)
- Избирательная деплеция лимфоцитов (ab T деплеция, CD19 деплеция, CD45RA деплеция)
- Криоконсервация и разморозка
Выбор метода (комбинации методов) обработки трансплантата определяется исходными характеристиками пары донор-реципиент, источником ГСК и технологической платформой ТГСК, реализуемой в трансплантационном центре.
Контроль качества трансплантата
Трансплантат ГСК представляет собой взвесь ядросодержащих клеток донора, обогащенных ГСК. Перед введением трансплантата ГСК реципиенту обязательно выполняется контроль качества трансплантата.
Обязательными параметрами трансплантата ГСК, подлежащими контролю и регистрации, являются:
- Объем трансплантата
- Концентрация и абсолютное содержание ядросодержащих клеток
- Концентрация и абсолютное содержание CD34+ клеток (фракция, обогащенная ГСК)
Дополнительными параметрами трансплантата ГСК, подлежащими контролю и регистрации, являются
- Концентрация и абсолютное содержание субпопуляций лейкоцитов (в зависимости от избранного метода обработки трансплантата)
- Жизнеспособность CD34+ клеток (фракция, обогащенная ГСК)
Транспортировка и хранение трансплантата ГСК
Транспортировка и хранение трансплантата ГСК (или его части) необходимы в ситуации разобщения процедур заготовки, обработки и введения трансплантата во времени и пространстве. Транспортировка трансплантата ГСК может осуществляться в нативном виде и после криоконсервации. Транспортировка нативного трансплантата осуществляется в температурном режиме от +3 до +8 °C с соблюдением холодовой цепи. Максимальный срок транспортировки и хранения (включая обработку) без криоконсервации составляет 72 часа от момента заготовки трансплантата ГСК. Транспортировка криоконсервированного трансплантата осуществляется в температурном режиме от -150 до -196 °C с соблюдением холодовой цепи.
5. Режим кондиционирования [69]
Режим кондиционирования представляет собой программу высокодозной химиотерапии +/- лучевой терапии, целью которой является эрадикация опухоли (лейкемии), гемопоэтической и иммунной системы реципиента, и создание, таким образом, условий, необходимых для приживления и функционирования донорского гемопоэза, формирования донорской иммунной системы и реакции трансплантат-против-лейкемии (РТПЛ). В состав режима кондиционирования включают химиопрепараты, обладающие выраженным иммуносупрессивным и/или миелосупрессивным эффектом. Набор препаратов, дозы и последовательность введения химиопрепаратов в составе режима кондиционирования могут варьировать. Как правило, в режиме кондиционирования используют высокие дозы химиопрепаратов, ассоциированные с высоким риском развития дозо-зависимых побочных эффектов. Выбор режима кондиционирования определяется технологической платформой ТГСК, реализуемой в трансплантационном центре, исходными характеристиками пары донор-реципиент.
Медикаменты, используемые в составе различных режимов кондиционирования при ПНГ (суммарная курсовая доза) [69]:
- #Треосульфан, 30 - 42 г/м2 [70]
- #Бусульфан**, 8 мг/кг, пероральная форма [71]
- #Флударабин**, 100 - 180 мг/м2 [72, 73]
- Тиотепа, 3,38 - 8,10 мг/кг
- #Циклофосфамид**, 40 - 200 мг/кг [73]
- Тотальное облучение тела 2 - 6 Гр
6. Введение в РТПХ [74]
Реакция трансплантат-против-хозяина (РТПХ) - ключевое иммунологическое осложнение ТГСК. РТПХ - иммунопатологический процесс, в основе которого лежит распознавание донорскими иммунокомпетентными клетками антигенных различий между донором и реципиентом, формирование иммунного ответа и воспалительное повреждение органов и тканей реципиента. Выделяют 4 категории РТПХ 1) классическая острая РТПХ (оРТПХ); 2) поздняя острая РТПХ; 3) "синдром перекреста" острой и хронической РТПХ; 4) хроническая РТПХ (хРТПХ). Согласно Консенсусу ВОЗ две последние категории формируют широкую категорию хронической РТПХ.
1) Классическая оРТПХ: клинический синдром, развивающийся в интервале до 100 дня после ТГСК или инфузии донорских лимфоцитов (ИДЛ). В основе - острое воспалительное повреждение органов и их дисфункция. Классические органы-мишени: кожа, желудочно-кишечный тракт (ЖКТ), печень. Поражение кожи проявляется пятнисто-папулезной сыпью, эпидермолизом. Поражение ЖКТ - диарея, тошнота, рвота, гемоколит, илеус. Поражение печени - гепатит с преобладанием холестаза.
2) Поздняя оРТПХ: типичные клинические проявления оРТПХ, развившиеся после дня 100 после ТГСК или инфузии донорских лимфоцитов (ИДЛ). Часто наблюдается при отмене иммуносупрессивной терапии.
3) "Синдром перекреста" оРТПХ и хРТПХ: сочетание типичных клинических проявлений оРТПХ и хРТПХ, независимо от срока развития.
4) хРТПХ: хроническое иммуно-опосредованное повреждение органов и тканей, в основе которого лежит нарушение формирования иммунологической толерантности. Гистопатологически характерен исход в фиброз.
К основным факторам риска развития РТПХ относятся: различия в HLA-совместимости донора и реципиента (при классическом подходе к профилактике РТПХ), донор женского пола у реципиента мужского пола, использование СКПК в качестве источника трансплантата, аллоиммунизация донора (беременности, гемотрансфузии в анамнезе), предлеченность пациента, миелоаблативное кондиционирование, наличие цитомегаловирусной инфекции.
7. Профилактика РТПХ [75]
Целью профилактики РТПХ является предотвращение развития РТПХ в целом и в особенности тяжелых, угрожающих жизни и инвалидизирующих форм РТПХ. Профилактика РТПХ может быть основана на целенаправленном удалении эффекторов РТПХ из трансплантата ГСК ex vivo (см. раздел Заготовка трансплантата) и на фармакологическом воздействии на реципиента. Список препаратов, применяющихся в профилактике РТПХ представлен ниже [76]. Препараты группируют в схемы профилактики РТПХ, выбор схемы определяется риском развития РТПХ в паре донор-реципиент и технологической платформой ТГСК, реализуемой в трансплантационном центре.
- #Циклоспорин**, 3 мг/кг/сут
- #Метотрексат**, 10 - 15 мг/м2/сут
- #Такролимус**, 0,02 - 0,03 мг/кг/сут [77]
- #Микофенолата мофетил**, 30 мг/кг/сут
- #Циклофосфамид**, 50 мг/кг/сут [78]
- #Иммуноглобулин антитимоцитарный**, кроличий 1,5 - 2,5 мг/кг/сут, суммарная доза 2,5 - 10 мг/кг [79]
- #Бортезомиб**, 1,3 мг/м2/сут [80]
- #Абатацепт**, 10 мг/кг (не более 800 мг) каждые 2 недели первые 3 дозы, далее - каждые 4 недели [81]
- #Тоцилизумаб**, 4 - 8 мг/кг 1 раз в неделю [82]
- #Сиролимус 4 - 12 мг/сут [83]
- #Эверолимус** 1,5 мг/м2 2 раза в день [84]
- #Ритуксимаб**, 375 мг/м2/нед. [85]
3. Приживление трансплантата (миелореконституция) [4]
Первый этап оценки эффективности ТГСК - достижение приживления трансплантата. К критериям приживления трансплантата относятся: достижение концентрации лейкоцитов более 1 тыс. в мкл, нейтрофилов более 0.5 тыс. в мкл и тромбоцитов выше 20 тыс. в мкл в течение 3 последовательных дней. Дополнительным критерием приживления является наличие донорского химеризма в костном мозге. Первичное неприживления можно констатировать при отсутствии критериев приживления в течение 30 дней, однако, использование ряда трансплантационных технологий (например, посттрансплантационный циклофосфамид** или трансплантация 2 доз пуповинной крови) приживление может наступать и в более поздние сроки. Оппортунистические вирусные инфекции также могут задерживать приживление трансплантата.
8. Диагностика и терапия острой РТПХ [86, 87]
Диагностика оРТПХ основана на наблюдении и фиксации характерных клинических проявлений и симптомов у реципиента после инфузии трансплантата ГСК. Для верификации клинического диагноза оРТПХ необходимо выполнение биопсии вовлеченного органа и гистологического исследования. Тяжесть оРТПХ оценивается в соответствии международной шкалой, приведенной в таблицах 1, 2 [86, 87].
Таблица 1. Клиническое стадирование острой РТПХ (тяжесть органного поражения) [86]
Степень
Кожа
Печень
Кишечник
+ (I)
Макуло-папулезная сыпь < 25% поверхности тела
Билирубин, 2 - 3 мг/дл (34 - 50 мкмоль/л)
Диарея, 500 - 1000 мл/сутки (300 - 580 мл/м2 в сутки).
*Диарея > 10 - 15 мл/кг/24 ч либо постоянная тошнота и "+" биопсия
+ + (II)
Макуло-папулезная сыпь 25 - 50% поверхности тела
Билирубин, 3 - 6 мг/дл (51 - 102 мкмоль/л)
Диарея, 1000 - 1500 мл/сутки (580 - 880 мл/м2 в сутки).
*Диарея > 16 - 20 мл/кг/24 ч
+ + + (III)
Генерализованная эритродерма
Билирубин, 6 - 15 мг/дл (102 - 255 мкмоль/л)
Диарея, > 1500 мл/сутки (> 880 мл/м2 в сутки)/
*Диарея > 21 - 25 мл/кг/24 ч
+ + + + (IV)
Десквамация и образование булл
Билирубин, > 15 мг/дл (> 255 мкмоль/л)
Сильная боль или илеус
*Диарея > 26 мл/кг/24 ч
* St Jude
Таблица 2. Клиническое стадирование острой РТПХ (общая стадия (grade) [86]
Стадия
Степень
Нарушение функции
Кожа
Печень
Кишечник
0 (отсутствует)
0
0
0
0
I (легкая)
+ до
+ +
0
0
0
II (умеренная)
+ до
+ + +
+
+
+
III (выраженная)
++ до
+ + +
+ + до
+ + +
+ + до
+ + +
+ +
IV (жизнеугрожающая)
++ до
+ + + +
+ + до
+ + + +
+ + до
+ + + +
+ + +
При установлении клинического диагноза оРТПХ инициируется терапия, состав которой определяется тяжестью оРТПХ. Тяжесть оРТПХ и ответ на терапию первой линии определяют прогноз течения оРТПХ и выживаемости. При отсутствии ответа на терапию первой линии принимают решение о назначении терапии второй и последующих линий.
Методы клинической лабораторной диагностики, применяемые при диагностике и терапии РТПХ [86, 87]:
- Общий (клинический) анализ крови развернутый
- Анализ крови биохимический общетерапевтический с исследованием следующих показателей: альбумин, общий белок, общий билирубин, прямой билирубин, креатинин, мочевина, глюкоза, электролиты (K, Na, Mg, Ca), аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтрансфераза, щелочная фосфатаза, альфа-амилаза, панкреатическая амилаза, холестерин общий, триглицериды, липаза, липопротеины низкой плотности, липопротеины высокой плотности
- Исследование кислотно-основного состояния и газов крови
- Иммунофенотипирование периферической крови для выявления субпопуляционного состава лимфоцитов (основные)
- Исследование уровня иммуноглобулинов в крови
- Молекулярно-генетическое исследование химеризма кроветворения после неродственной трансплантации костного мозга
- Определение ДНК вируса Эпштейна-Барр (Epstein-Barr virus) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК вируса герпеса 6 типа (HHV6) методом ПЦР в периферической и пуповинной крови, качественное исследование
- Определение ДНК аденовируса (Human Adenovirus) в мазках со слизистой оболочки носоглотки/ротоглотки методом ПЦР
- Микробиологическое (культуральное) исследование крови на стерильность
- Определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактор)
- Непрямой антиглобулиновый тест (тест Кумбса), определение содержания антител к антигенам эритроцитов в крови, определение содержания антител к антигенам групп крови, определение холодовых антиэритроцитарных антител в крови
- Прямой антиглобулиновый тест (прямая проба Кумбса)
- Совместимость эритромассы индивидуальная (Проба на совместимость по иммунным антителам реципиента и антигенам главного комплекса гистосовместимости донора)
- Определение протромбинового (тромбопластинового) времени в крови или в плазме, определение международного нормализованного отношения (МНО)
- Определение активированного частичного тромбопластинового времени
- Определение тромбинового времени в крови
- Определение антител к грибам рода аспергиллы (Aspergillus spp.) в крови
- Госпитальный скрининг: определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к ядерному антигену вируса гепатита B (Hepatitis B virus) в крови, молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus), молекулярно-биологическое исследование крови на Treponema pallidum, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови
- Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, количественное исследование
- Определение РНК вируса гепатита C (Hepatitis C virus) в крови методом ПЦР, количественное исследование
- Иммунохроматографическое экспресс-исследование кала на токсины A и B клостридии (Clostridium difficile)
- Микробиологические исследования основных возбудителей инфекционных заболеваний со слизистых оболочек/поверхности кожи
- Общеклиническое исследование спинномозговой жидкости (ликвора): исследование физических свойств спинномозговой жидкости, микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза), цитологическое исследование клеток спинномозговой жидкости
- Общий (клинический) анализ мочи, микроскопическое исследование осадка мочи,
- Определение белка в моче
- Исследование уровня глюкозы в моче
- Исследование уровня креатинина в моче
- Исследование уровня мочевины в моче
- Микробиологическое (культуральное) исследование на стерильность крови, спинномозговой жидкости, мочи, фрагментов медицинских устройств (ЦВК, имплант)
- Микробиологические исследования основных возбудителей инфекционных заболеваний в биологических жидкостях (экссудатах, транссудатах)
- Микробиологические исследования основных возбудителей инфекционных заболеваний в биоптатах
- Микробиологические исследования основных возбудителей инфекционных заболеваний в бронхоальвеолярном лаваже/мокроте
- Микробиологические исследования основных возбудителей инфекционных заболеваний в раневом отделяемом
- Микробиологические исследования основных возбудителей инфекционных заболеваний фекалий/ректального мазка
- Исследование уровня кальция в моче
- Исследование уровня фосфора в моче
- Исследование уровня калия, натрия, кальция, хлора в моче
- Определение активности панкреатической амилазы в крови
- Исследование уровня тропонинов I, T в крови
- Исследование функции нефронов по клиренсу креатинина (проба Реберга),
- Сортировка клеточных линий методом проточной цитофлуориметрии (исследование биологического материала методом проточной цитофлуориметрии)
- Флуоресцентная in situ гибридизация (FISH) (после гипотонической обработки клеток, на готовой суспензии клеток, на отпечатках и мазках) (1 ДНК-зонд)* (молекулярно-цитогенетическое исследование (FISH-метод) на одну пару хромосом)
Инструментальные методы и пособия, применяемые при диагностике и терапии РТПХ [86, 87]:
- Прицельная рентгенография грудной клетки (2 проекции)
- Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием
- Спиральная компьютерная томография придаточных пазух носа
- Компьютерная томография органов грудной полости
- Магнитно-резонансная томография головного мозга с контрастированием под наркозом - 3Т (Тесла)
- Ультразвуковое исследование почек, надпочечников мочевого пузыря, органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезенка), забрюшинного пространства, малого таза
- Регистрация электрокардиограммы; расшифровка, описание и интерпретация электрокардиографических данных (дети 1 - 18 лет)
- Суточное мониторирование артериального давления
- Эргоспирометрия
- Исследование диффузионной способности легких (дети > 10 лет)
- Дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока
- Эхокардиография в динамике (предоставляется пациентам, находящимся в стационаре)
- Дуплексное сканирование нижней полой вены и вен портальной системы
- Получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма)
- Спинномозговая пункция
- Анестезиологическое пособие (включая раннее послеоперационное ведение)
- Эзофагогастродуоденоскопия
- Колоноскопия
- Биопсия пищевода, желудка, двенадцатиперстной кишки с помощью эндоскопии
- Биопсия ободочной кишки эндоскопическая
- Биопсия прямой кишки с помощью видеоэндоскопических технологий
- Биопсия кожи
- Бронхоскопия диагностическая
- Электроэнцефалография с видеомониторингом
Медикаменты, используемые в терапии РТПХ (суточная доза) [87 - 89]:
- #Метилпреднизолон**, 2 мг/кг/сут
- Иммуноглобулин антитимоцитарный** кроличий - кроличий 1,5 - 2,5 мг/кг/сут, суммарная доза 2,5 - 10 мг/кг [79]
- Циклоспорин**, 1 - 3 мг/кг/сут
- #Метотрексат**, 5 - 15 мг/м2/сут [90]
- #Такролимус**, 0,03 мг/кг/сут [77]
- #Микофенолата мофетил**, 190 - 1600 мг/м2/сут [91]
- #Циклофосфамид**, 50 мг/кг/сут [78]
- #Алемтузумаб**, 0,3 - 2 мг/кг (суммарная доза, вводимая в течение 2 - 6 дней) [92]
- Ибрутиниб**, 140 - 420 мг/сут
- #Руксолитиниб**, 2,5 - 10 мг/м2 2 раза в сутки [93]
- #Этанерцепт**, 0,4 мг/кг 2 раза в неделю [94]
- #Бортезомиб**, 1,3 мг/кг/сут [80]
- #Абатацепт**, 10 мг/кг (не более 800 мг) каждые 2 недели первые 3 дозы, далее - каждые 4 недели [81]
- #Тоцилизумаб**, 4 - 8 мг/кг 1 раз в неделю [82]
- #Сиролимус 2 - 4 мг/сут [83]
- #Эверолимус** 1,5 мг/м2 2 раза в день [84]
- #Инфликсимаб**, 10 мг/кг 1 раз в неделю [95]
- #Ритуксимаб**, 375 мг/м2/нед. [85]
- Глюкокортикоиды для местного применения
- Топические ингибиторы кальциневрина (из группы "Препараты для лечения дерматита, кроме глюкокортикостероидов", D11AH по АТХ классификации) - #такролимус**, #пимекролимус** в форме для наружного применения [96, 97]
- Мезенхимальные стромальные клетки
- #Иматиниб**, 65 - 260 мг/м2/день [98]
9. Диагностика и терапия хронической РТПХ [99]
Диагноз хронической РТПХ устанавливается при выявлении одной диагностической манифестации либо одного отличительного проявления с подтверждением биопсией, лабораторными тестами или рентгенологическим исследованием (табл. 3).
Таблица 3. Характерные признаки и диагностические критерии хронической РТПХ [100]
Орган или локализация
Диагностические
(достаточные для постановки диагноза хронической РТПХ)
Отличительные (наблюдаемые при хронической РТПХ, но недостаточные для постановки диагноза)
Другие проявления
Общие
(для острой и хронической РТПХ)
Кожа
- пойкилодерма
- лихеноиды
- склеротические изменения
- кольцевидная склеродермия
- склерозированные лихеноиды
- депигментация
- папулосквамозные поражения
- нарушение потоотделения
- ихтиоз
- кератоз
- гипопигментация
- гиперпигментация
- эритема
- макуло-папулезная сыпь
- зуд
Ногти
- дистрофия
- вертикальная исчерченность
- лизис ногтевых пластинок
- птеригиум ногтя (гипертрофия эпонихия)
- симметричная потеря ногтевых пластинок
Волосяной покров
- возобновление алопеции с/без рубцеванием (после восстановления роста волос после химиотерапии)
- потеря волос на теле
- шелушение, папуло-сквамозные участки
- истончение волос, обычно очаговое, жесткие и тусклые волосы (не связано с эндокринными и иными нарушениями),
- преждевременное поседение волос
Ротовая полость
- лихеноидные проявления
- ксеростомия
- мукоцеле
- атрофия слизистой
- псевдомембраны
- язвенное поражение
- гингивит
- мукозит
- эритема
- боль
Глаза
- сухость, зуд, боли в глазах
- рубцующий конъюнктивит
- сухой кератоконъюнктивит
- точечная кератопатия
- фотофобия
- периорбитальная гиперпигментация
- блефарит (эритема и отек век)
Гениталии
- лихеноиды
- рубцевание и стеноз влагалища, фимоз или стеноз уретры
- эрозии
- трещины
- язвы
ЖКТ
- пищеводные спайки
- стриктуры или стеноз верхней и средней третей пищевода
- экзокринная панкреотическая недостаточность
- анорексия
- тошнота
- рвота
- диарея
- потеря веса
- нарушение развития у детей
Печень
- общий билирубин, ЩФ <1> в 2 р > нормы
- АЛТ <2> или АСТ <3> в 2 раза > нормы
Легкие
- облитерирующий бронхиолит, подтвержденный биопсией
- синдром облитерирующего бронхиолита
- облитерирующий бронхиолит, подтвержденный радиологически и тестами - воздушные ловушки или бронхоэктазы
- облитерирующий бронхиолит с организующейся пневмонией
- рестриктивная болезнь легких
Мышцы, фасции, суставы
- фасциит
- тугоподвижность суставов или контрактуры вследствие склероза
- миозит или полимиозит (проксимальная мышечная слабость; миалгии нехарактерны)
- отек
- судороги в мышцах
- артралгия или артрит
Гемопоэз и иммунные нарушения
- тромбоцитопения
- эозинофилия
- лимфопения
- гипо- или гипергаммаглобулинемия
- аутоантитела (АИГА <4>, ИТП <5>)
- феномен Рейно
Другие
- выпоты в перикард или плевральную полость
- асцит
- периферическая нейропатия
- нефротический синдром
- миастения gravis
- нарушения сердечной сократимости или кардиомиопатии
Тяжесть хРТПХ определяется на основании числа пораженных органов и степени выраженности нарушения функции пораженного органа (см. табл. 4) [101].
- Незначительная (mild) хРТПХ - вовлечение 1 - 2 органов или локализаций (кроме легких), без клинически значимого функционального нарушения (максимально 1 балл во всех пораженных органах)
- Умеренная (moderate) хРТПХ - вовлечение по меньшей мере одного органа или участка с клинически значимой, но не обширной дисфункцией (максимально 2 балла), либо 3-х и более органов без нарушения клинической функции (максимально 1 балл в каждом органе), либо поражение легких не более 1 балла.
- Тяжелая (severe) хРТПХ - значительная дисфункция (3 балла в каждом органе), либо поражение легких (2 балла и более).
Таблица 4. Балльная оценка проявлений хронической РТПХ [101]
Шкалы:
Индекс Карновского (ИК) (см. Приложение Г1)
отсутствие симптомов или полная активность (ECOG <*> 0; ИК 100%)
симптоматика, амбулаторное наблюдение, ограничение физической активности (ECOG 1, ИК 80 - 90%)
симптоматика, амбулаторное наблюдение, способность к самообслуживанию, > 50% бодрствования вне постели (ECOG 2, ИК 60 - 70%)
симптоматика, ограничение самообслуживания, > 50% бодрствования в постельном режиме (ECOG 3 - 4, ИК < 60%)
Кожа
Клинические проявления:
- пятнисто-папулезная сыпь
- лихеноиды
- папуло-сквамозные участки, ихтиоз
- гиперпигментация
- гипопигментация
- кератоз
- эритема
- эритродермия
- пойкилодерма
- склеротические изменения
- зуд
- повреждение волос
- нарушение структуры ногтей
ППТ - % вовлеченной площади
нет симптомов
< 18% ППТ с признаками заболевания, но без склеротических изменений
19 - 50% ППТ или поверхностные склеротические изменения (не глубокие, возможность щипка)
> 50% ППТ или глубокие склеротические изменения или нарушение мобильности, язвенные поражения, или выраженный зуд
Полость рта
- Лейкоплакии
нет симптомов
незначительные симптомы с признаками заболевания, но без значительного ограничения перорального приема пищи
умеренные проявления с признаками заболевания и с частичным ограничением перорального приема
выраженные симптомы с признаками заболевания и выраженным ограничением перорального приема
Глаза
- Сухой кератоконъюнктивит (подтвержден офтальмологом
- Тест Ширмера (мм)
нет симптомов
легкая сухость, без нарушения ежедневной активности (ЕДА) (капли <= 3-х раз в день) или асимптоматическое течение сухого кератоконъюнктивита
умеренная сухость с частичным нарушением ЕДА (капли > 3-х раз в день), без нарушения зрения
выраженная сухость со значительным нарушением ЕДА (специальные гели для обезболивания) или неспособность работать вследствие поражения глаз либо потеря зрения вследствие сухого кератоконъюнктивита
ЖКТ
- стриктуры пищевода
- дисфагия
- анорексия
- тошнота
- рвота
- диарея
- потеря веса >= 5% за 3 мес.
- нарушение глотания
нет симптомов
дисфагия, анорексия, тошнота, рвота, боли в животе или диарея без значительной потери веса (< 5%)
симптомы ассоциированы с незначительной либо умеренной потерей веса (5 - 15%)
симптомы ассоциированы со значительной потерей веса > 15%, требуют нутритивной поддержки для обеспечения основных энергетических затрат либо дилатации пищевода
Печень
общий билирубин в норме, АЛТ или ЩФ < 3-х норм
общий билирубин в норме, АЛТ >= 3 - 5 х норм, или ЩФ <**> >= 3-х норм
общий билирубин повышен, но <= 3 мг/дл, или АЛТ >= 5 норм
общий билирубин > 3 мг/дл
Легкие <***>
нет симптомов
ОВФ1 > 80% или LFS = 2
незначительные симптомы (одышка при подъеме по лестнице)
ОФВ1 60 - 79% или LFS 3 - 5
умеренные симптомы (одышка при ходьбе по плоскости)
ОВФ1 40 - 59% или LFS 6 - 9
выраженные симптомы (одышка в покое; требующая O2)
ОФВ1
![]() или LFS 9 - 12
или LFS 9 - 12
Суставы и фасции
Для оценки активности движений (АД) используется фотографическая шкала объема движений в суставах (P-ROM)
нет симптомов
легкая тугоподвижность рук или ног, нормальная или несколько сниженная АД, не влияющая на ЕДА
тугоподвижность рук или ног либо контрактуры суставов, эритема вследствие фасциита, умеренное снижение АД и от незначительного до умеренного ограничения ЕДА
контрактуры со значительным снижением АД и выраженным ограничением ЕДА (невозможность обуться, завязать шнурки, застегнуть рубашку, одеться самостоятельно и т.д.)
Гениталии
Активная половая жизнь
нет симптомов
незначительные проявления при осмотре, без влияния на коитус и минимальный дискомфорт при гинекологическом обследовании
умеренные проявления при осмотре, с незначительной диспареунией или дискомфортом при гинекологическом обследовании
выраженные симптомы (стриктуры, лабиаагглютинация с язвенным поражением) и сильная боль при коитусе либо невозможность влагалищной пенетрации
--------------------------------
Примечания.
<*> ECOG (Eastern Cooperative Oncology Group), шкала Европейской Кооперативной Группы Онкологов (см. Приложение Г1)
<**> ЩФ может быть повышена у растущих детей, без отражения печеночной дисфункции
<***> Оценка легочной функции по шкале должна осуществляться с учетом клиники и функции вешнего дыхания. Lung Function Score (LFS) - наиболее распространенная шкала, отражающая глобальную оценку функции легких после установления диагноза облитерирующего бронхиолита. Процент FEVI и DLCO необходимо перевести в численную шкалу: > 80% = 1; 70 - 79% = 2; 60 - 69% = 3; 50 - 59% = 4; 40 - 49% = 5; < 40% = 6. LFS = FEV1 + DLCO, в норме 2 - 12.
Сокращения: ИК - индекс Карновского, ИЛ - индекс Ланского, ППТ - площадь поверхности тела, ЕДА - ежедневная активность, ЖКТ - желудочно-кишечный тракт, ЩФ - щелочная фосфатаза, АЛТ - аланинаминотрансфераза, АСТ - аспартатаминотраснфераза, LFS - lung function score: оценка функции легких, ОВФ1 - объем формированного выдоха за 1 сек, DLCO - диффузионная способность легких по монооксиду углерода, АД - активность движений, P-ROM - photographic range of motions, фотографическая шкала движения в суставах
С целью своевременной постановки диагноза и раннего начала терапии, предупреждения развития жизнеугрожающих состояний и инвалидизации, необходимо проведение систематической и тщательной оценки органов и систем пациентов. Это также помогает оценивать ответ на терапию и определять дальнейшую стратегию лечения. Частота систематической оценки вовлеченности органов и тяжести хРТПХ составляет 1 раз в 4 недели.
Терапия хРТПХ основана на фармакологической иммуносупрессии. Целью терапии является восстановление функции пораженных органов, предотвращение или минимизация инвалидизации, восстановление качества жизни. Базовым препаратом является преднизолон в дозе 1 мг/кг/сутки (или метилпреднизолон в эквипотентной дозе). Подход к дополнительной лекарственной терапии и терапии второй линии определяется тяжестью процесса, набором вовлеченных органов, базовой иммуносупрессивной терапией на момент манифестации хРТПХ.
10. Профилактика и терапия инфекционных осложнений [102]
Вторичный иммунодефицит у реципиентов ТГСК формируется вследствие основного заболевания, базовой терапии, режима кондиционирования, режима профилактики и терапии РТПХ и собственно РТПХ. Иммунодефицит носит комбинированный характер и включает нарушения всех основных компонентов иммунной защиты: 1) нарушение барьерной функции кожи и слизистых; 2) нарушение нормальной микробиоты с потерей колонизационной резистентности; 3) гранулоцитопения; 4) моноцитопения; 5) гуморальный иммунодефицит; 6) клеточный иммунодефицит; Характер иммунодефицита и его тяжесть варьирует на разных этапах ТГСК. В первые 30 дней (до приживления и ранние сроки после приживления) доминирует гранулоцитопения и нарушение барьерной функции кожи и слизистых. Между 30 и 100 днем доминирует клеточный иммунодефицит. После 100 дней сохраняется гуморальный иммунодефицит, а выраженность клеточного варьирует в зависимости от объема иммуносупрессивной терапии. Характер иммунодефицита определяет предрасположенность к развитию определенного типа инфекций и диктует набор мер по профилактике и терапии инфекционных осложнений в соответствии с периодом после ТГСК.
a. Бактериальные инфекции [103]
Основными факторами риска развития бактериальных инфекций у реципиентов ТГСК на ранних сроках являются гранулоцитопения, использование центральных венозных катетеров, мукозит, дерматит, предсуществующая колонизация мультирезистентными патогенами, рефрактерное течение основного заболевания. Бактериальные инфекции на ранних сроках вызываются Грам-положительными кокки и Грам-отрицательными палочками. На поздних сроках основным фактором риска становится дефицит гуморального звена иммунитета и гипоспления, предрасполагающие к инфекциям инкапсулированными микроорганизмами (пневмококк, гемофильная палочка, менингококк). Основными типами бактериальных инфекций после ТГСК являются пневмония, синуситы, проктиты, инфекции мягких тканей и бактериемия/сепсис.
Профилактика бактериальных инфекций включает санитарно-эпидемические меры: контроль доступа, обработка рук персонала и ухаживающего члена семьи, микробиологическая безопасность продуктов питания и воды. Фармакологическая профилактика бактериальных инфекций возможна в соответствии с политикой инфекционного контроля в стационаре.
Диагностика бактериальных инфекций включает клиническую, инструментальную и лабораторную диагностику.
Терапия бактериальных инфекций у реципиентов ТГСК проводится по принципу эмпирической терапии с последующей коррекцией в соответствии с результатами микробиологического исследования и этапной эскалацией или дезэскалацией в зависимости от динамики течения инфекционного процесса.
b. Вирусные инфекции [104]
Основными факторами риска развития вирусных инфекций у реципиентов ТГСК являются лимфопения, клеточный иммунодефицит, течение РТПХ, терапия кортикостероидами системного действия, терапия лимфодеплетирующими моноклональными антителами, использование неродственных и частично совместимых доноров, наличие персистирующей вирусной инфекции у пациента и/или донора до ТГСК, ex vivo T деплеция, рефрактерное течение основного заболевания. Основными вирусными патогенами у реципиентов ТГСК являются цитомегаловирус (ЦМВ), Эпшетйн-Барр вирус, Герпес вирус человека 6 типа, Вирус простого герпеса, вирус варицелла-зостер, парвовирус B19, аденовирус, респираторно-синтициальный вирус. Вирусные инфекции у реципиентов ТГСК могут протекать в типичной форме, однако характерно тяжелое течение и генерализация инфекции.
Профилактика вирусных инфекций включает санитарно-эпидемические меры: контроль доступа, обработка рук персонала и ухаживающего члена семьи, микробиологическая безопасность продуктов питания и воды, микробиологическая безопасность компонентов крови. Специфической мерой профилактики является выбор донора, соответствующего пациенту в части экспозиции к ключевым вирусным патогенам, и выбор технологии ТГСК с минимизацией объема и длительности фармакологической иммуносупрессии после ТГСК. Фармакологическая профилактика вирусных инфекций проводится в отношении вирусов семейства герпес в соответствии с индивидуальным риском развития инфекции соответствующим представителем группы.
Диагностика вирусных инфекций включает клиническую, инструментальную и лабораторную диагностику.
Терапия вирусных инфекций у реципиентов ТГСК проводится по принципу упреждающей терапии и эмпирической терапии с последующей коррекцией в соответствии с результатами микробиологического исследования и этапной эскалацией или дезэскалацией в зависимости от динамики течения инфекционного процесса. Упреждающая терапия является стандартом для контроля ЦМВ инфекции и включает еженедельный количественный мониторинг вирусной нагрузки в крови пациента и назначение противовирусной терапии при превышении пороговых значений. Аналогичная тактика применяется для ЭБВ, аденовируса и ГВЧ 6 типа в группе высокого риска.
c. Грибковые инфекции [105, 106]
Основными факторами риска развития вирусных инфекций у реципиентов ТГСК являются гранулоцитопения, лимфопения, клеточный иммунодефицит, течение РТПХ, терапия кортикостероидами системного действия, терапия лимфодеплетирующими моноклональными антителами, использование неродственных и частично совместимых доноров, наличие колонизации слизистых дрожжевыми грибами, инвазивная грибковая инфекции у пациента до ТГСК, ex vivo T деплеция, рефрактерное течение основного заболевания. Основными грибковыми патогенами у реципиентов ТГСК являются грибы род Candida, рода Aspergillus и Зигомицеты. Грибковые инфекции у реципиентов ТГСК могут протекать в виде поверхностного микоза, однако характерно тяжелое течение, инвазивный рост и генерализация инфекции.
Профилактика грибковых инфекций включает санитарно-эпидемические меры: контроль качества воздуха, контроль доступа, обработка рук персонала и ухаживающего члена семьи, микробиологическая безопасность продуктов питания и воды. Специфической мерой профилактики является выбор технологии ТГСК с минимизацией объема и длительности фармакологической иммуносупрессии после ТГСК. Фармакологическая профилактика грибковых инфекций проводится в соответствии с индивидуальным риском развития инфекции в конкретный период после ТГСК.
Диагностика грибковых инфекций включает клиническую, инструментальную и лабораторную диагностику. В зависимости от локальной эпидемиологии грибковых инфекций может использоваться мониторинг биомаркеров грибковых инфекций и упреждающая тактика терапии.
Терапия грибковых инфекций у реципиентов ТГСК проводится по принципу упреждающей терапии и эмпирической терапии с последующей коррекцией в соответствии с результатами микробиологического исследования и этапной эскалацией или дезэскалацией в зависимости от динамики течения инфекционного процесса.
4. Профилактика и терапия специфических (органных) осложнений
d. Геморрагический цистит [107]
Геморрагический цистит - специфическое осложнение ТГСК, развивающееся вследствие повреждения слизистой мочевого пузыря препаратами, применяемыми в составе кондиционирования и/или инфекционного процесса. Наибольший риск развития раннего гемооррагического цистита характерен для режимов кондиционирования, включающих высокие дозы циклофосфамида**, бусульфана** и тотального облучения тела. Поздний геморрагический цистит ассоциирован с инфекцией полиомавирусом BK, некоторыми серотипами аденовируса и, реже, цитомегаловирусом. Определенную роль в развитии геморрагического цистита играет РТПХ. Клинически геморрагический цистит проявляется дизурией, гематурией (от микрогематурии до массивного кровотечения обтурации уретры сгустками). Профилактика геморрагического цистита включает выбор режима кондиционирования с минимизацией экспозиции к высоким дозам циклофосфамида**, режим гиперинфузии во время терапии циклофосфамидом**, системное введение месны**. Терапия раннего геморрагического цистита включает инфузию, форсированный диурез, системную гемостатическую терапию, локальный гемостаз. Терапия позднего геморрагического цистита включает инфузию, форсированный диурез, системную гемостатическую терапию, локальный гемостаз, прооивовирусную терапию.
e. Вено-окклюзионная болезнь печени (синдром обструкции синусоидов) [108, 109]
Вено-окклюзионная болезнь печени - специфическое осложнений ТГСК, обусловленное повреждением эндотелия синусоидов портальной системы, развитием микротромбоза и окклюзии сосудов портальной системы, с исходом в портальную гипертензию и печеночную недостаточность. Факторами риска веноокклюзивной болезни (ВОБ) печени являются миелоаблативные режимы кондиционирования с использованием таких препаратов, как бусульфан**, циклофосфамид** или этопозид**, а также применение тотального облучения тела. Вероятность развитие данной патологии также увеличивают флударабин**, сиролимус и ингибиторы кальциневрина. Кроме того, риском развития ВОБ являются предсуществующие нарушения функции печени (цирроз, фиброз), гепатит C, перегрузка печени железом (ферритин сыворотки > 1000 нг/дл).
Диагноз ВОБ устанавливается на основании следующих критериев (наличие двух и более симптомов):
- Тромбоцитопения, рефрактерная к трансфузиям тромбоконцентрата
- Необъяснимая прибавка массы тела в течение 3 дней, несмотря на диуретическую терапию или увеличение массы тела > 5% от исходного значения
- Гепатомегалия
- Асцит
Повышение уровня билирубина выше исходного значение в течение 3 дней или >= 2 мг/дл в течение 72 часов
Профилактика ВОБ включает выбор режима кондиционирования в соответствии с анализом факторов риска ВОБ, в частности отказ от применения высоких доз бусульфана** и комбинации алкилирующих средств у пациентов с предсуществующим поражением печени. Медикаменты, используемые в профилактике и терапии ВОБ суммированы ниже.
f. Мукозит [110]
Поражение слизистой оболочки желудочно-кишечного тракта, обусловленное цитотоксичностью химиопрепаратов и лучевой терапии, входящих в состав кондиционирования. Основными факторами риска развития является состав кондиционирования и дозы противоопухолевых препаратов. Локализация поражения варьирует от ограниченных форм (стоматит, эзофагит, гастрит, энтероколит) до генерализованного поражения. Определенный вклад в развитие мукозита вносят инфекции, в частности вирус простого герпеса и грибы рода Candida. Клинические проявления мукозита включают болевой синдром, отек, гиперемию и изъязвление слизистой, нарушение глотания, диарейный синдром. Профилактика мукозита включает гигиену полости рта, стоматологическое пособие на этапе подготовки пациента к ТГСК, медикаментозное подавление желудочной секреции и антацидов. Терапия мукозита носит симптоматический характер, центральной задачей является адекватное обезболивание и обработка антисептическими и дезинфицирующими средствами.
g. Синдром задней обратимой энцефалопатии (PRES) [111]
Синдром задней обратимой энцефалопатии (posterior reversible encephalopathy syndrome). Специфическое неврологическое осложнение ТГСК, в основе которого лежит локальный субкортикальный обратимый вазогенный отек вещества головного мозга. Характерна ассоциация с терапией ингибиторами кальциневрина, артериальной гипертензией. Клиническая картина включает головную боль, судороги, нарушение зрения, энцефалопатию, фокальный неврологический дефицит. Диагноз верифицируется характерными изменениями на МРТ головного мозга. Терапия включает отмену препаратов, ассоциированных с развитием PRES, контроль артериальной гипертензии.
h. Респираторный дистресс-синдром [112]
Острый респираторный дистресс-синдром (РДС) является частым осложнением после ТГСК и может развиваться в рамках септического процесса, синдром приживления трансплантата, синдрома выброса цитокинов, поражения легких, ассоциированного с трансфузиями (TRALI). РДС у реципиентов ТГСК обусловлен повышенной проницаемостью капиллярного русла легких и развитием некардиогенного отека легких. Клинически проявляется дыхательной недостаточностью, гипоксемией, крепитирующими хрипами при аускультации. При визуализации характерно диффузное снижение прозрачности легочной ткани. Специфической профилактики РДС не разработано. Терапия включает респираторную поддержку, от дотации кислорода до искусственной вентиляции легких, высокие дозы кортикостероидов, строгое соблюдение баланса жидкости.
i. Тромботическая микроангиопатия [113]
Тромботическая микроангиопатия, ассоциированная с ТГСК (ТА-ТМА) - это гетерогенная группа заболеваний, характеризующаяся микроангиопатической гемолитической анемией и тромбоцитопенией потребления вследствие образования сгустков в микроциркуляторном русле, что является причиной ишемического поражения органов.
При развитии ТА-ТМА повреждение эндотелия приводит к активации воспалительного и прокоагулянтного каскадов, что в результате приводит к окклюзии капилляров. Однако, в отличие от других эндотелиальных синдромов, в развитии ТА-ТМА может играть роль дисрегуляция системы комплемента. Это в свою очередь способствует продукции C4d фракции комплемента и мембран-атакующего комплекса C5b-9. Клинические и лабораторные проявления представлены в таблице 7. К факторам риска развития ТА-ТМА относят применение ингибиторов кальциневрина, вирусные инфекции (ЦМВ, аденовирус, BK-вирус и некоторые другие), грибковые инфекции и РТПХ. Терапия ТА-ТМА включает снижение дозы или отмену ингибиторов кальциневрина, посиндромную сопроводительную терапию и специфическую лекарственную терапию (см. ниже).
11. Нутритивная поддержка [114]
Реципиенты ТГСК сталкиваются с существенным дефицитом питания, обусловленным комплексом факторов: стоматит, эзофагит, гастроэнтероколит, разрушение микробиома кишечника, потеря аппетита, тошнота/рвота, термическая обработка пищи. Коррекция нутритивной недостаточности основана на технологиях клинического питания, включая энтеральное и парентеральное питание. Препараты энтерального и парентерального, применяемые в клиническом питании реципиентов ТГСК приведены ниже
12. Гемотрансфузионная терапия [115]
В процессе ТГСК происходит замена гемопоэза реципиента на гемопоэз донора. В процессе ТГСК формируется транзиторная аплазия кроветворения, длительность которой составляет от нескольких дней до нескольких недель. Аплазия кроветворения по определению развивается в первые 2 - 3 недели после кондиционирования, однако может развиваться и на более поздних сроках после ТГСК в результате дисфункции трансплантата различной этиологии. В заместительной трансфузионной терапии используются следующие гемокомпоненты:
1. Эритроцитная взвесь
2. Тромбоконцентрат
3. Концентрат гранулоцитов
4. Свежезамороженная плазма
Донор и реципиент могут быть несовместимы по различным системам антигенов группы крови. В зависимости от характера несовместимости по системе AB0 выделяют большая (major), малая (minor) и смешанная (major+minor). Под большой (major) несовместимостью по AB0 системе подразумевают наличие в плазме у реципиента агглютининов, активных в отношении донорских эритроцитов, например при проведении ТГСК от донора с A(II) группой крови пациенту с 0(I) группой. Малая (minor) несовместимость по AB0 системе обусловлена обратной ситуацией, то есть наличием в плазме донора ГСК агглютининов, активных в отношении эритроцитов реципиента, например при ТГСК от донора с 0(I) группой крови реципиенту с A(II) группой. О смешанной (major + minor) несовместимости говорят в том случае, когда и у донора, и у реципиента присутствуют агглютинины, активные в отношении эритроцитов реципиента и донора соответственно. В связи с вероятностью развития тяжелых осложнений, связанных с групповой AB0-несовместимостью донора и реципиента ГСК, сформулированы правила проведения трансфузионной терапии после трансплантации (начиная с дня миелоинфузии), таблица 5.
Таблица 5. Правила проведения трансфузионной терапии у пациентов после ТГСК
AB0 - несовместимость
Реципиент
Донор
Эритромасса
Тромбоконцентрат и СЗП
Большая
0
A
0
A, AB
0
B
0
B, AB
0
AB
0
AB
A
AB
A, 0
AB
B
AB
B, 0
AB
Малая
A
0
0
A, AB
B
0
0
B, AB
AB
0
0
AB
AB
A
A, 0
AB
AB
B
B, 0
AB
Смешанная
A
B
0
AB
B
A
0
AB
Профилактика посттрансфузионной реакции трансплантат-против-хозяина.
Посттрансфузионная (ассоциированная с трансфузией компонентов крови) реакция трансплантат-против-хозяина (ПТ-РТПХ) - одно из наиболее тяжелых и в большинстве случаев фатальных осложнений у иммунокомпрометированных пациентов. В основе патогенеза развития ПТ-РТПХ лежит приживление трансфузированных вместе с компонентами крови Т-лимфоцитов, их дальнейшая активация, пролиферация и цитотоксическое поражение различных органов-мишеней реципиента, таких как кожа, печень, кишечник и костный мозг. В редких случаях ПТ-РТПХ иногда может развиваться и у иммунокомпетентных пациентов, например, когда донор и реципиент имеют схожие HLA-гаплотипы.
Стандартная процедура профилактики ПТ-РТПХ - гамма-облучение компонентов крови в дозе 25 Гр [116].
Приложение А3.2
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ЭКУЛИЗУМАБА**
Международное непатентованное наименование: экулизумаб**.
Лекарственная форма: Концентрат для приготовления раствора для инфузий.
Состав: 1,0 мл концентрата содержит действующее вещество: экулизумаб** (rEclz) - 10,0 мг; вспомогательные вещества: натрия дигидрофосфата моногидрат, натрия гидрофосфата гептагидрат, натрия хлорид, полисорбат 80, вода для инъекций - до 1,0 мл.
Показания к применению:
Пароксизмальная ночная гемоглобинурия (ПНГ). Эффективность экулизумаба** подтверждена у пациентов с гемолизом и сопутствующими клиническими симптомами, свидетельствующими о высокой активности заболевания, вне зависимости от потребности в гемотрансфузиях в анамнезе;
Атипичный гемолитико-уремический синдром (аГУС)
Противопоказания:
Повышенная чувствительность к экулизумабу**, белкам хомячков или другим компонентам препарата.
Период грудного вскармливания.
Активная инфекция Neisseria meningitidis.
Отсутствие вакцинации против Neisseria meningitidis (если нет соответствующей профилактической антибиотикотерапии в течение 2 недель после вакцинации).
Способ применения и дозы:
Внутривенно капельно в течение 25 - 45 минут для взрослых и в течение 1 - 4 часов для пациентов детского возраста. Курс лечения для взрослых пациентов (>= 18 лет) включает 4-недельный начальный цикл с последующим циклом поддерживающей терапии.
Начальный цикл: 600 мг экулизумаба** 1 раз в неделю в течение 4 недель.
Поддерживающая терапия: 900 мг экулизумаба** на 5-й неделе, с последующим введением 900 мг экулизумаба** каждые 14 +/- 2 дней.
Для пациентов с ПНГ моложе 18 лет доза препарата экулизумаб** определяется в зависимости от веса ребенка:
Вес пациента
Начальный цикл
Поддерживающая терапия
>= 40 кг
600 мг 1 раз в неделю x 4
900 мг на 5-й неделе; затем 900 мг каждые 2 недели
30 - < 40 кг
600 мг 1 раз в неделю x 2
900 мг на 3-й неделе; затем 900 мг каждые 2 недели
20 - < 30 кг
600 мг 1 раз в неделю x 2
600 мг на 3-й неделе; затем 600 мг каждые 2 недели
10 - < 20 кг
600 мг 1 раз в неделю x 1
300 мг на 2-й неделе; затем 300 мг каждые 2 недели
5 - < 10 кг
300 мг 1 раз в неделю x 1
300 мг на 2-й неделе; затем 300 мг каждые 3 недели
Рекомендации по приготовлению раствора и проведению инфузии
Не смешивать экулизумаб** при внутривенном введении с другим препаратом в одном шприце или флаконе!
Используя стерильный шприц с иглой (не прилагаются), отберите все содержимое флакона/флаконов с экулизумабом** и перенесите рекомендуемую дозу во флакон с одним из следующих растворов для инъекций: 0,9% раствор натрия хлорида, 0,15% раствор натрия хлорида или 5% раствор декстрозы (глюкозы) для получения инфузионного раствора, содержащего 5,0 мг/мл. Объем приготовленного инфузионного раствора с содержанием 5,0 мг/мл экулизумаба** должен составлять: 60 мл (для дозы 300 мг), 120 мл (для дозы 600 мг), 180 мл (для дозы 900 мг) и 240 мл (для дозы 1200 мг).
Приготовленный инфузионный раствор должен быть прозрачным и бесцветным. Если раствор окрашен или в нем наблюдаются включения, его использование не допускается.
Непосредственно перед введением необходимо осторожно покачать флакон с раствором для инфузий для гомогенизации содержимого флакона. Температура раствора для инфузионного введения должна быть 20 - 25 °C. Если инфузия по каким-либо причинам откладывается, допускается хранение приготовленного инфузионного раствора при температуре от 2 до 8 °C не более 24 часов без замораживания. По окончании этого срока (24 часа) неиспользованный раствор подлежит утилизации.
Побочное действие
Наиболее частым нежелательным явлением при лечении экулизумабом** являлась головная боль (отмечалась, главным образом, в начальном цикле терапии). Наиболее тяжелым нежелательным явлением являлся менингококковый сепсис.
Приложение А3.3
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ РАВУЛИЗУМАБА
Международное непатентованное наименование: равулизумаб.
Лекарственная форма: Концентрат для приготовления раствора для инфузий (300 мг/3 мл; 1100 мг/11 мл; 300 мг/30 мл)
Состав:
300 мг/3 мл: каждый мл концентрата содержит 100 мг равулизумаба. Каждый флакон содержит 300 мг равулизумаба. Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий 4,6 мг.
1100 мг/11 мл: каждый мл концентрата содержит 100 мг равулизумаба. Каждый флакон содержит 1100 мг равулизумаба. Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий 16,8 мг.
Показания к применению при ПНГ:
Равулизумаб показан для лечения взрослых и пациентов детского возраста с массой тела не менее 10 кг с ПНГ:
- пациентов с гемолизом с клиническими симптомами, свидетельствующими о высокой активности заболевания;
- пациентов, у которых наблюдается клинически стабильное состояние после лечения экулизумабом в течение не менее 6 предшествующих месяцев.
Противопоказания:
- Гиперчувствительность к равулизумабу или к любому из вспомогательных веществ;
- Пациенты с инфекцией, вызванной Neisseria meningitidis, не разрешившейся к моменту начала лечения;
- Пациенты, которые в настоящее время не вакцинированы против инфекции Neisseria meningitidis, если только они не получают профилактическое лечение соответствующими антибиотиками в течение 2 недель после вакцинации.
Способ применения и дозы:
Режим дозирования
Взрослые пациенты с ПНГ:
рекомендованный режим дозирования состоит из нагрузочной дозы с последующим применением препарата в поддерживающих дозах, вводимых посредством внутривенной инфузии. Выбор дозы препарата зависит от массы тела пациента, как показано в таблице 1.
Взрослым пациентам (>= 18 лет) поддерживающие дозы препарата следует вводить каждые 8 недель, при этом первая поддерживающая доза вводится через 2 недели после введения нагрузочной дозы. График введения препарата позволяет в редких случаях отклоняться на +/- 7 дней от запланированной даты инфузии (за исключением первой поддерживающей дозы равулизумаба), но последующую дозу следует вводить согласно исходному графику. Пациентам, переведенным с терапии экулизумабом на терапию равулизумабом, нагрузочную дозу равулизумаба следует вводить через 2 недели после последней инфузии экулизумаба, а затем вводить поддерживающие дозы каждые 8 недель. Первая поддерживающая доза вводится через 2 недели после введения нагрузочной дозы, как показано в таблице 1.
Таблица 1. Режим дозирования равулизумаба в зависимости от массы тела у взрослых пациентов с массой тела не менее 40 кг.
Диапазон массы тела (кг)
Нагрузочная доза (мг)
Поддерживающая доза (мг) <1>
Периодичность введения
>= 40 до < 60
2400
3000
Каждые 8 недель
>= 60 до < 100
2700
3300
Каждые 8 недель
>= 100
3000
3600
Каждые 8 недель
--------------------------------
<1> Первая поддерживающая доза препарата вводится через 2 недели после введения нагрузочной дозы.
Дети
Режим дозирования для детей с ПНГ с массой тела >= 40 кг не отличается от режима дозирования для взрослых (Таблица 1). Дозы препарата в зависимости от массы тела, а также периодичность введения препарата пациентам детского возраста с массой тела от >= 10 кг до < 40 кг приведены в таблице 3. Пациентам, переведенным с терапии экулизумабом на терапию равулизумабом, нагрузочную дозу равулизумаба следует вводить через 2 недели после последней инфузии экулизумаба. Затем следует вводить поддерживающие дозы в соответствии с режимом дозирования в зависимости от массы тела, как показано в таблице 3. Первая поддерживающая доза вводится через 2 недели после введения нагрузочной дозы.
Таблица 2. Режим дозирования равулизумаба в зависимости от массы тела для пациентов детского возраста с ПНГ или аГУС с массой тела менее 40 кг.
Диапазон массы тела (кг)
Нагрузочная доза (мг)
Поддерживающая доза (мг) <1>
Периодичность введения
>= 10 до < 20
600
600
Каждые 4 недель
>= 20 до < 30
900
2100
Каждые 8 недель
>= 30 до < 40
1200
2700
Каждые 8 недель
--------------------------------
<1> Первая поддерживающая доза препарата вводится через 2 недели после введения нагрузочной дозы.
Применение равулизумаба у пациентов детского возраста с ПНГ с массой тела менее 30 кг не изучалось. Режим дозирования равулизумаба у пациентов детского возраста с массой тела менее 30 кг основан на режиме дозирования у пациентов детского возраста с аГУС, с учетом данных фармакокинетики/фармакодинамики у пациентов с ПНГ, получавших равулизумаб.
Способ применения:
Только для внутривенного инфузионного введения.
Данный лекарственный препарат необходимо вводить через фильтр 0,2 мкм и не следует вводить путем струйного или болюсного внутривенного введения.
Равулизумаб представлен во флаконах по 3 мл и 11 мл (100 мг/мл) и подлежит разведению до конечной концентрации 50 мг/мл. После разведения препарат Равулизумаб вводят посредством внутривенной инфузии с использованием шприцевого насоса или инфузионного насоса в течение минимального периода времени от 0,17 до 1,3 часа (от 10 до 75 минут) в зависимости от массы тела.
Приготовленный раствор следует использовать немедленно после разведения. Химическая и физическая стабильность разведенного препарата подтверждена при температуре 2 - 8 в течение до 24 часов, при комнатной температуре в течение до 4 часов.
Нежелательные реакции
Наиболее частыми нежелательными лекарственными реакциями являются диарея, инфекции верхних дыхательных путей, назофарингит и головная боль. Наиболее серьезными нежелательными реакциями у пациентов в клинических исследованиях являются менингококковая инфекция и менингококковый сепсис.
Приложение А3.4
КРАТКАЯ ИНСТРУКЦИЯ ПО ПРИМЕНЕНИЮ ПЭГЦЕТАКОПЛАНА
МНН: Пэгцетакоплан.
Лекарственная форма: Раствор для подкожного введения.
Показания к применению:
Препарат пэгцетакоплан показан для лечения взрослых пациентов с пароксизмальной ночной гемоглобинурией (ПНГ), у которых анемия сохраняется после лечения C5 ингибитором в течение, как минимум, 3 месяцев.
Механизм действия:
Пэгцетакоплан представляет собой симметричную молекулу, состоящую из двух идентичных пентадекапептидов, ковалентно связанных с концами линейной молекулы ПЭГ массой 40 кДа. Пептидные фрагменты связываются с комплементом C3 и оказывают широкое ингибирование каскада комплемента.
Способ применения:
Подкожно. Препарат пэгцетакоплан следует вводить только в виде подкожной инфузии с помощью инфузионного шприцевого насоса. Этот препарат можно вводить самостоятельно.
Режим дозирования:
Пэгцетакоплан может быть введен самостоятельно пациентом или лицом, осуществляющим за ним уход, после получения надлежащих инструкций, или медицинским работником. Пэгцетакоплан вводят 2 раза в неделю в виде подкожной инфузии дозы 1080 мг с помощью шприцевой инфузионной системы с насосом, которая рассчитана на введение объема до 20 мл. Рекомендуемую дозу препарата следует вводить 2 раза в неделю в первый день и четвертый день каждой недели лечения.
Нежелательные реакции:
Наиболее частыми нежелательными лекарственными реакциями (НЛР) у пациентов, получавших лечение препаратом Пэгцетакопланом, были реакции в месте инъекции: эритема в месте инъекции, зуд в месте инъекции, отек в месте инъекции, боль в месте инъекции, кровоподтеки в месте инъекции.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
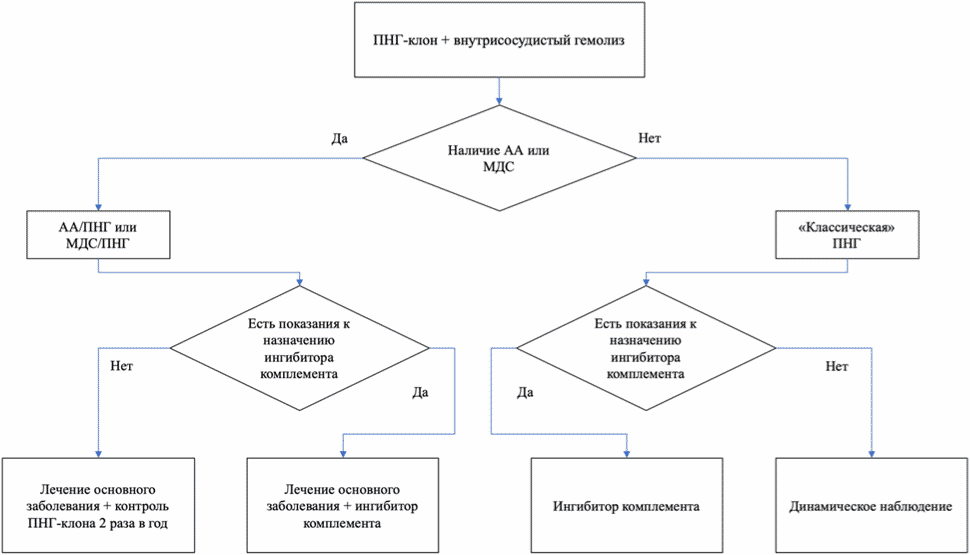
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое пароксизмальная ночная гемоглобинурия (ПНГ)?
ПНГ - это редкое приобретенное заболевание системы крови. ПНГ затрагивает в первую очередь костный мозг, где производятся все клетки крови. В результате спонтанной приобретенной мутации в одной или нескольких стволовых кроветворных клетках, начинается производство дефектных эритроцитов, которые становятся уязвимыми для собственной иммунной системы (ПНГ-клон). Такие дефектные эритроциты в сосудах подвергаются разрушению под действием ряда белков системы иммунного надзора. Процесс разрушения эритроцитов носит название "гемолиз". В результате гемолиза, из разрушенных эритроцитов высвобождается большое количество гемоглобина, который, попадая в мочу, обусловливает изменение цвета мочи на темный или даже черный с красноватым оттенком (гемоглобинурия).
Кто болеет пароксизмальной ночной гемоглобинурией?
Заболевание может поражать людей вне зависимости от пола, этнической принадлежности или возраста, однако пик заболеваемости приходится на интервал от 30 до 40 лет. Заболевание является чрезвычайно редким, так, из миллиона человек заболевает лишь 1 - 2 в год. В ряде случаев ПНГ развивается до, после, или на фоне других гематологических заболеваний, таких как апластическая анемия (АА) и миелодиспластический синдром (МДС), в таких случаях говорят о ПНГ, ассоциированной с АА или с МДС. Если другие гематологические заболевания отсутствуют, то говорят о "классической" форме ПНГ. Мер по профилактике возникновения ПНГ на данный момент не существует.
Каковы наиболее частые симптомы пароксизмальной ночной гемоглобинурии?
Симптомы, обусловленные анемией (низким содержанием гемоглобина в крови) - вы можете испытывать слабость, сонливость, повышенную утомляемость, одышку при небольших физических нагрузках, учащенное сердцебиение.
Гемоглобинурия - выделение темной, вплоть до черного цвета мочи, что обусловлено наличием в моче большого количества гемоглобина.
Желтуха - окрашивание кожи и склер в желтоватый цвет.
Дисфагия (нарушение глотания) - вы можете испытывать трудности при проглатывании пищи или жидкостей, что наиболее часто возникает во время усиления гемолиза.
Эректильная дисфункция - у некоторых пациентов может наблюдаться нарушение эрекции.
Боли в животе - могут возникать в любое время, однако, обычно усиливаются во время гемолитического криза. Необходимо помнить, что боли в животе могут быть следствием тромбоза сосудов брюшной полости, что требует немедленного обращения к врачу.
Необходимо понимать, что заболевание протекает по-разному у разных пациентов, таким образом, вы можете иметь все вышеперечисленные симптомы, или не иметь ни одного.
Какие факторы провоцируют усиление гемолиза?
У пациентов, страдающих ПНГ, существует хронический гемолиз - определенное количество эритроцитов постоянно разрушается в сосудистом русле. Однако существуют ситуации, когда гемолиз значительно усиливается, приводя к резкому снижению гемоглобина, потемнению мочи и другим вышеперечисленным симптомам (гемолитический криз). Причиной гемолитических кризов могут являться инфекции, воздействие экстремальных температур, авиаперелеты и другие стрессовые факторы.
Каковы возможные осложнения ПНГ?
Одним из осложнений ПНГ являются тромбозы сосудов. Тромбозы могут происходить как в артериях, так и в венах. Если у вас уже были тромботические осложнения в анамнезе, врач может назначить вам антитромботические средства (препараты, снижающие свертываемость крови).
Хроническая почечная недостаточность может развиваться в связи с отложением в почках большого количества железа на фоне хронического гемолиза.
Дисфункция костного мозга. ПНГ всегда сопровождается недостаточностью костного мозга той или иной степени. Костномозговая недостаточность проявляется снижением в периферической крови показателей гемоглобина, лейкоцитов и тромбоцитов (цитопения). Снижение числа лейкоцитов может приводить к повышенному риску возникновения инфекционных осложнений. Снижение числа тромбоцитов может приводить к повышенному риску кровотечений.
Как устанавливается диагноз ПНГ?
Для подтверждения диагноза достаточно провести исследование венозной крови с использованием специальной технологии (проточной цитометрии). Анализ покажет процент дефектных клеток (размер ПНГ-клона) в вашей крови. Необходимо понимать, что размер ПНГ-клона не всегда коррелирует с клинической картиной, так, ПНГ с клоном 50% может протекать с наличием большого количества осложнений, в то время как заболевание с клоном 99% может иметь относительно доброкачественное течение.
Какое существует лечение для ПНГ?
В настоящее время в России зарегистрированы три препарата для лечения ПНГ - экулизумаб**, равулизумаб и пэгцетакоплан. Экулизумаб представляет собой антитело, блокирующее комплемент (фактор иммунной системы, разрушающий эритроциты). Экулизумаб** блокирует гемолиз дефектных эритроцитов, однако, никак не влияет на производство дефектных клеток. Таким образом, экулизумаб лишь блокирует последнее звено в цепи патологических событий при ПНГ, но не приводит к излечению от заболевания. Показания к началу терапии определяются консилиумом врачей-гематологов. При наличии показаний к лечению терапия экулизумабом** должна проводиться неопределенно долго, так как при отмене препарата высока вероятность рецидива гемолиза. Препарат вводится внутривенно каждые 14 +/- 2 дней.
Равулизумаб - гуманизированное моноклональное антитело против C5-компонента комплемента с длительным периодом полувыведения, предназначенное для внутривенного введения (с интервалом между введениями 56 +/- 7 дней).
Пэгцетакоплан предназначен для подкожного введения и представляет собой малую молекулу - подавляющую активность C3.
Сопроводительная терапия может включать назначение фолиевой кислоты, цианокобаламина**, профилактической антикоагулянтной терапии, а также переливания крови по показаниям, определяемым вашим лечащим врачом.
Могу ли я передать заболевание своим детям?
Так как ПНГ является приобретенным, а не врожденным заболеванием - вы не можете передать болезнь своим детям.
Каков прогноз заболевания при ПНГ?
При "классической" форме и эффективном лечении продолжительность жизни сопоставима с таковой в общей популяции. При ПНГ, ассоциированной с АА или с МДС прогноз несколько хуже, и определяется, прежде всего, возможностями терапии основного гематологического заболевания.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название: Karnofsky Performance Status.
Оригинальная публикация:
Karnofsky DA B.J.H. The clinical evaluation of chemotherapeutic agents in cancer. Evaluation of Chemotherapeutic Agents.//Columbia Univ. Press. 1949. P. 191 - 205.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
40 - Инвалид, нуждается в специальной помощи, в том числе медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый пациент. Необходимы госпитализация и активное лечение
10 - Умирающий
0 - Смерть
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г2
ШКАЛА P-ROM
Название на русском языке: фотографическая шкала движения в суставах
Оригинальное название: The Photographic Range of Motion (P-ROM) scale
Источник (официальный сайт разработчиков, публикация с валидацией): Carpenter PA. How I conduct a comprehensive chronic graft-versus-host disease assessment. Blood. 2011; 118: 2679 - 87
Тип: шкала оценки.
Назначение: Оценить степень подвижности суставов
Содержание:
Ключ (интерпретация): оценивается сумма баллов по всем четырем суставам. Чем меньше сумма баллов - тем более выражено ограничение подвижности.
Приложение Г3
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией):
1. https://ecog-acrin.org/resources/ecog-performance-status.
2. Oken M.M., Creech R.H., Davis T.E. Toxicology and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. Cancer Clin. Trials. 1982. Vol. 5, N 6. P. 649 - 655.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все действия так же, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г4
ШКАЛА ОЦЕНКИ ФУНКЦИИ ЛЕГКИХ (LUNG FUNCTION SCORE)
Название на русском языке: Шкала оценки функции легких
Оригинальное название: The Lung function score (LFS)
Источник (официальный сайт разработчиков, публикация с валидацией): Pavletic SZ, Martin P, Lee SJ, Mitchell S, Jacobsohn D, Cowen EW, et al. Measuring therapeutic response in chronic graft-versus-host disease: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: IV. Response Criteria Working Group report. Biol Blood Marrow Transplant. 2006; 12: 252 - 66. doi: 10.1016/j.bbmt.2006.01.008
Тип: шкала оценки.
Назначение: оценить функциональную способность легких
Содержание:
FEV1 в % от ожидаемого
cDLCO в % от ожидаемого
Баллы
> 80
> 80
1
70 - 79
70 - 79
2
60 - 69
60 - 69
3
50 - 59
50 - 59
4
40 - 49
40 - 49
5
< 40
< 40
6
Ключ (интерпретация):
Сумма баллов (FEV1 + cDLCO)
Класс по шкале LFS
Норма
2
I
Незначительное снижение функции
3 - 5
II
Умеренное снижение функции
6 - 9
III
Выраженное снижение функции
10 - 12
IV
Приложение Г2
ИНДЕКС ЛАНСКОГО
Название на русском языке: Шкала Ланского.
Оригинальное название: Lansky Performance Status.
Оригинальная публикация:
Lansky S.B., List M.A., Lansky L.L., Ritter-Sterr C., Miller D.R. The measurement of performance in childhood cancer patients.//Cancer. 1987. Vol. 60, N 7. P. 1651 - 1656.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения повседневной активности и физических способностей на основе игровой деятельности - для пациентов младше 16 лет.
Содержание:
Шкала Ланского
100 - Полная активность, состояние нормальное
90 - Минимальные ограничения в активных играх
80 - Ограничен в активных играх, устает быстрее, в остальном полностью активен
70 - Более выраженные ограничения активности и меньше времени, проводимого в играх
60 - Нуждается в амбулаторном наблюдении до 50% времени, минимальная активность в подвижных играх
50 - Требуется значительная помощь в играх, не играет активно, способен участвовать в спокойных играх
40 - Часть времени лежит в кровати, но может заниматься спокойными играми
30 - Часть времени спит, нуждается в помощи даже в самых тихих играх
20 - Часть времени спит, способен только на пассивные занятия (например, просмотр телевизора)
10 - Не играет, не встает с кровати
0 - Смерть
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г3
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией):
3. https://ecog-acrin.org/resources/ecog-performance-status.
4. Oken M.M., Creech R.H., Davis T.E. Toxicology and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. Cancer Clin. Trials. 1982. Vol. 5, N 6. P. 649 - 655.
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все действия так же, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Примечание. Ключ (интерпретация) приведен в самой шкале
