"Клинические рекомендации "Неалкогольная жировая болезнь печени"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НЕАЛКОГОЛЬНАЯ ЖИРОВАЯ БОЛЕЗНЬ ПЕЧЕНИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K75.8, K76.0
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 748
Разработчик клинической рекомендации
- Российское общество по изучению печени
- Российская Гастроэнтерологическая Ассоциация
- Российское общество профилактики неинфекционных заболеваний
- Российская ассоциация эндокринологов
- Общероссийская общественная организация "Российское научное медицинское общество терапевтов"
- Национальное общество профилактической кардиологии
- Общероссийская общественная организация "Российская ассоциация геронтологов и гериатров"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АГ - артериальная гипертензия
АЛТ - аланинаминотрансфераза
АМПК - аденозинмонофосфат-активируемая протеинкиназа (AMP-activated protein kinase)
АТФ - аденозинтрифосфат
АМФ - аденозинмонофосфат
АССЗ - атеросклеротические сердечно-сосудистые заболевания
АСТ - аспартатаминотрансфераза
АРАII - антагонисты рецепторов ангиотензина II
ВГН - верхняя граница нормы
ВОЗ - Всемирная организация здравоохранения
ГГТ - гамма-глутамилтрансфераза
ГМГ-КоA-редуктаза - 3-гидрокси-3-метилглютарил-кофермент A редуктаза
ГПП-1 - глюкагоноподобный пептид-1
ГЦР - гепатоцеллюлярный рак
ДИ - доверительный интервал
ДПП-4 - дипептидилпептидаза 4-го типа
ЖКБ - желчнокаменная болезнь
ЗК - звездчатые клетки
иАПФ - ингибитор ангиотензинпревращающего фермента
ИБС - ишемическая болезнь сердца
ИЛ - интерлейкин
ИНПГ-2 - ингибиторы натрийзависимого переносчика глюкозы 2-го типа
ИМТ - индекс массы тела
ИР - инсулинорезистентность
ИФН - интерферон
КР - клинические рекомендации
ЛПВП - липопротеиды высокой плотности
ЛПНП - липопротеиды низкой плотности
ЛПУ - лечебно-профилактическое учреждение
МАЖБП - метаболически ассоциированная жировая болезнь печени
МАСГ - метаболически ассоциированный стеатогепатит
МетАБП - метаболически ассоциированная жировая болезнь печени в сочетании с избыточным употреблением алкоголя
МетС - метаболический синдром
МКБ - международная классификация болезней
МРТ - магниторезонансная томография
MRI-PDFF (Magnetic Resonance Imaging-Derived Proton Density Fat Fraction) - магнитно-резонансная томография с измерением доли жира, взвешенной по протонной плотности
НАЖБП - неалкогольная жировая болезнь печени
НАСГ - неалкогольный стеатогепатит
ПГТТ - пероральный глюкозотолерантный тест
ПОЛ - перекисное окисление липидов
ПНЖК - полиненасыщенные жирные кислоты
РААС - ренин-ангиотензин-альдостероновая система
РКИ - рандомизированное контролируемое исследование
рСКФ - расчетная скорость клубочковой фильтрации
СД - сахарный диабет
СЖК - свободные жирные кислоты
ССЗ - сердечно-сосудистые заболевания
ТГ - триглицериды
УДХК** - урсодезоксихолевая кислота**
УЗИ - ультразвуковое исследование
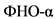 - фактор некроза опухоли-альфа
- фактор некроза опухоли-альфа
ХБП - хроническая болезнь почек
ХС - холестерин
ХСН - хроническая сердечная недостаточность
ЦП - цирроз печени
ЩФ - щелочная фосфатаза
ЭГДС - эзофагогастродуоденоскопия
ЭФЛ - эссенциальные фосфолипиды (фосфолипиды)
APRI (Aspartate Aminotransferase to Platelet Ratio Index) - отношение аспартатаминотрансаминазы к количеству тромбоцитов
AUROC (Area Under Receiver Operating Characteristic Curve) - показатель для оценки характеристик классификатора (площадь под кривой вероятности, эквивалентная вероятности)
Bax (BCL2 Associated X Protein) - bcl-2-подобный белок 4
Bcl-2 (B-Cell Leukemia/Lymphoma 2) - внутриклеточный белковый фактор, регулятор апоптоза
BSEP (Bile Salt Export Pump) - насос экспорта желчных кислот
cAMP/PKA (cAMP-Dependent Protein Kinase) - циклическая аденозинмонофосфат-зависимая протеинкиназа A
CAP (Controlled Attenuation Parameter) - параметр контролируемого затухания
CCL2 (C-C Motif Ligand) - цитокин, относящийся к группе C-C хемокинов
ChREBP (Carbohydrate-Responsive Element-Binding Protein) - углевод-реагирующий элемент-связывающий белок
DGUOK (Deoxyguanosine Kinase) - митохондриальная дезоксигуанозин киназа
FIB-4 (Fibrosis-4 Index) - индекс фиброза-4
FLI (Fatty Liver Index) - индекс стеатоза печени
FXR (Farnesoid X Receptor) - фарнезоидный X-рецептор
GPBAR1 (The G Protein-Coupled Bile Acid Receptor 1) - G-протеин-связанный рецептор желчных кислот 1
HbA1c - гликированный гемоглобин (A1c)
HOMA-IR (Homeostasis Model Assesment for Insulin Resistance) - индекс инсулинорезистентности
JNK - Jun N-концевая киназа, стресс-активируемые протеинкиназы
LOLA - L-орнитин-L-аспартат (орнитин)
М2 - второй тип макрофагов (альтернативно активированные макрофаги)
MPV17 (Mitochondrial Inner Membrane Protein MPV17) - белок внутренней мембраны митохондрий MPV17
mTOR (Mechanistic Target of Rapamycin) - мишень рапамицина млекопитающих
NAFLD (Non-Alcoholic Fatty Liver Disease) - неалкогольная жировая болезнь печени
NAS (NAFLD Activity Score) - шкала активности НАЖБП
NFS (NAFLD Fibrosis Score) - оценка фиброза при НАЖБП
![]() (Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells) - ядерный фактор каппа-би
(Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells) - ядерный фактор каппа-би
NHE3 (Sodium-Hydrogen Exchanger 3) - натрий-водородный обменник 3
NLR (NOD-Like Receptor) - NOD-подобные рецепторы
NPC1L1 (Niemann-Pick C1-Like 1) - белок (переносчик стеролов) Ниманна - Пика типа C1
PCSK (Proprotein Convertase Subtilisin/Kexin Type 9) - пропротеиновая конвертаза субтилизин-кексина типа 9
PDFF (Proton Density Fat Fraction) - протонная плотность фракции жира
PNPLA3 (Patatin-Like Phospholipase Domain-Containing Protein 3) - пататин-подобный домен, содержащий 3 фосфолипазу, ген адипонутрина
POLG (DNA Polymerase Subunit Gamma) - ДНК-полимеразная субъединица гамма
PPAR (Peroxisome Proliferator-Activated Receptor) - рецепторы, активируемые пероксисомным пролифератором
PRRs (Pattern Recognition Receptors) - рецепторы опознавания паттерна
SREBP-1c (Sterol Regulatory Element-Binding Transcription Factor 1с) - стерол-регуляторный элемент-связывающий фактор транскрипции 1
SREBP-2 (Sterol Regulatory Element-Binding Transcription Factor 2) - стерол-регуляторный элемент-связывающий фактор транскрипции 2
![]() (Transforming Growth Factor Beta) - трансформирующий фактор роста бета
(Transforming Growth Factor Beta) - трансформирующий фактор роста бета
TGR5 (Takeda G Protein-Coupled Receptor 5) - мембранный рецептор желчных кислот
Th (T-Helper) - T-хелпер
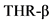 (Thyroid Hormone Receptor
(Thyroid Hormone Receptor ![]() ) - бета-рецептор гормона щитовидной железы
) - бета-рецептор гормона щитовидной железы
TLR (Toll-Like Receptors) - толл-подобные рецепторы
TM6SF2 (Transmembrane 6 Superfamily Member 2) - трансмембранный белок 6 суперсемейства-2
VDR (Vitamin D-Receptor) - рецептор витамина D
Термины и определения
Артериальная гипертензия (АГ) - синдром повышения клинического артериального давления (АД) при гипертонической болезни и симптоматических АГ выше пороговых значений, определенных в результате эпидемиологических и рандомизированных контролируемых исследований (систолическое АД >= 140 мм рт.ст. и/или диастолическое АД >= 90 мм рт.ст.), продемонстрировавших связь с повышением сердечно-сосудистого риска и целесообразность и пользу лечения, направленного на снижение АД ниже этих уровней АД.
Дислипидемии - состояния, когда концентрации липидов и липопротеидов крови выходят за пределы референтных значений.
Жировая болезнь печени - наднозологическое понятие, объединяющее заболевания печени, протекающие со стеатозом и стеатогепатитом.
Доказательная медицина - надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и с учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента.
Заболевание - состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма.
Исход - любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства.
Жировая болезнь печени специфической этиологии - наднозологическое понятие, включающее моногенные болезни, отдельные фенотипы лекарственного поражения печени, другие заболевания, при которых развитие стеатоза\стеатогепатита имеет доказанную причину, не связанную с метаболической дисфункцией и употреблением алкоголя.
Кардиометаболические факторы риска - факторы риска развития сердечно-сосудистых заболеваний, сахарного диабета 2 типа и неалкогольной жировой болезни печени.
Конфликт интересов - ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента.
Лекарственные препараты - лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
Медицинское вмешательство - выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности.
Метаболически-ассоциированная жировая болезнь печени в сочетании с употреблением избыточного употребления алкоголя (МетАБП) - хроническое заболевание печени при котором неалкогольная (метаболически-ассоциированная) жировая болезнь печени сочетается с употреблением алкоголя в среднем от 20 до 50 г/сут для женщин и от 30 до 60 г/сут для мужчин.
Неалкогольная (метаболически-ассоциированная) жировая болезнь печени (НАЖБП) - хроническое заболевание печени, связанное с метаболической дисфункцией, при котором более чем в 5% гепатоцитов определяется макровезикулярный стеатоз.
Неалкогольный стеатогепатит (НАСГ) - прогрессирующая форма (фенотип) НАЖБП, которая характеризуется стеатозом, внутридольковым воспалением, баллонной дегенерацией гепатоцитов и может протекать с развитием перицентрального и перисинусоидального (реже портального) фиброза.
Изменение образа жизни - мероприятия, направленные на нормализацию массы тела, характера питания и двигательной активности, целью которых является профилактика и лечение заболеваний.
Индекс массы тела - показатель, который используется для диагностики избыточной массы тела и ожирения, а также для оценки его степени (масса тела в килограммах, деленная на квадрат роста в метрах, кг/м2).
Клиническое исследование - любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность.
Ожирение - хроническое заболевание, характеризующееся избыточным накоплением жировой ткани в организме, представляющим угрозу здоровью, и являющееся основным фактором риска ряда других хронических заболеваний.
Окружность талии - показатель, используемый для диагностики висцерального накопления жира, абдоминального (висцерального) ожирения.
Пациент - физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния.
Предиабет - нарушение углеводного обмена, при котором не достигаются критерии сахарного диабета, но превышены нормальные значения глюкозы крови (включает любое из нарушений: нарушенную гликемию натощак и нарушенную толерантность к глюкозе).
Рабочая группа по разработке/актуализации клинических рекомендаций - коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Синдром - устойчивая совокупность ряда симптомов с единым патогенезом.
Состояние - изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи.
Сахарный диабет 2 типа - нарушение углеводного обмена, вызванное преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью или преимущественным нарушением секреции инсулина с инсулинорезистентностью или без нее.
Стеатоз печени - аккумуляция жира в печени, при которой накопление липидов происходит более чем в 5% гепатоцитов.
Стеатогепатит - аккумуляция жира в печени, сопровождающаяся внутридольковым воспалением, баллонной дегенерацией гепатоцитов и возможным развитием фиброза.
Уровень достоверности доказательств - степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций - степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Хроническая болезнь почек - наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек и/или снижением функции, оцениваемой по величине скорости клубочковой фильтрации, которые сохраняются в течение 3 и более месяцев.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Неалкогольная жировая болезнь печени (НАЖБП) - хроническое заболевание печени, связанное с метаболической дисфункцией, при котором более чем в 5% гепатоцитов определяется макровезикулярный стеатоз [1, 2]. НАЖБП охватывает патологический спектр от простого стеатоза до стеатогепатита и цирроза печени (ЦП). Согласно представлениям последних лет, стеатоз (простой стеатоз) и неалкогольный стеатогепатит (НАСГ) представляют собой два отдельных патологических состояния (фенотипа или формы) с различным прогнозом [3]:
а) простой стеатоз - состояние, при котором отсутствует воспаление и фиброз; при этом стеатоз - самостоятельный фактор риска развития сердечно-сосудистых заболеваний (ССЗ) и их осложнений [3]. Простой стеатоз может иметь прогрессирующее течение с развитием фиброза, но скорость его прогрессирования значительно меньше, чем при исходном НАСГ [4].
б) НАСГ, который характеризуется стеатозом, внутридольковым воспалением, баллонной дегенерацией гепатоцитов и может протекать с развитием перицентрального и перисинусоидального (реже портального) фиброза. НАСГ является клинически прогрессирующей формой НАЖБП с риском развития ЦП, гепатоцеллюлярного рака (ГЦР), а также ССЗ и их осложнений [3].
В 2023 г. была опубликована новая номенклатура жировой болезни печени [2], над которой работала большая группа международных экспертов. Само понятие "жировая болезнь печени" стало объединяющим, или зонтичным, термином, в ее составе выделены различные нозологические формы, в том числе НАЖБП. Международные эксперты предложили новое название для НАЖБП - Metabolic Dysfunction Associated Steatotic Liver Disease (метаболически ассоциированная жировая болезнь печени метаболически ассоцированная жировая болезнь печени, МАЖБП) и оптимизировали диагностические критерии этого заболевания. Российские эксперты обсудили все аспекты новой номенклатуры и возможности ее использования в РФ и пришли к следующим выводам и рекомендациям: использовать оптимизированные диагностические критерии НАЖБП в клинической практике российских врачей и включить их в данные рекомендации; для работы с официальной медицинской документацией использовать уже привычные термины "НАЖБП" и "НАСГ" ввиду необходимости применения МКБ-10; в научных целях можно применять новые термины с согласованным и утвержденным переводом на русский язык [5]. Например, МАЖБП - для НАЖБП, метаболически ассоциированный стеатогепатит (МАСГ) - для НАСГ.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Первоначальное представление о патогенезе НАЖБП как теории "двух ударов" [6] сменилось на понятие мультифакторного патогенеза, включающее параллельные процессы, такие как инсулинорезистентность (ИР), нарушение аутофагии, липотоксичность, воспаление, дисбаланс цитокинов и адипокинов, активация иннантного иммунитета и микробиоты, воздействие экологических и генетических факторов [7, 8]. Одним из ключевых моментов в развитии НАЖБП является нарушение системного энергетического баланса, характеризующееся избытком субстратов, преимущественно углеводов и жирных кислот. К основным источникам свободных (неэтерифицированных) жирных кислот (СЖК), поступающих в печень, относят их повышенное высвобождение из адипоцитов (около 60%), конверсию углеводов в печени (липогенез de novo, 26%) и избыточное потребление жиров в пищу (14%) [9, 10].
Инсулинорезистентность. Инсулинорезистентность (ИР) Характеризуется снижением чувствительности периферических тканей (мышц, жировой ткани, печени) к инсулину. Эпидемиологические исследования показывают корреляцию между высокоуглеводной диетой и НАЖБП. Чрезмерное потребление углеводов и повышенный уровень глюкозы в крови оказывают пагубное воздействие на клетки (глюкотоксичность). Формирование ИР в печени сопровождается повышением глюконеогенеза и снижением гликогенеза с развитием гипергликемии [11 - 13]. ИР приводит к снижению поглощения глюкозы адипоцитами и мышцами, а гепатоциты могут секретировать дипептидилпептидазу 4-го типа (ДПП-4), которая способствует воспалению жировой ткани и формированию ИР [12, 13]. Метаболическая дисрегуляция адипоцитов создает условия для избыточного липолиза триглицеридов (ТГ), высвобождения СЖК в кровоток и их попадания в печень [14]. В гепатоцитах при НАЖБП избыток глюкозы и фруктозы усиливает липогенез de novo [15]. При этом, в отличие от глюкозы, вовлечение фруктозы в этот процесс не регулируется гликолизом [16].
Жировая ткань является не только основным источником СЖК, но и эндокринным органом, секретирующим адипокины с системными регуляторными эффектами. Лептин и адипонектин, продуцируемые висцеральными адипоцитами, влияют на НАЖБП, регулируя аппетит, влияя на состав жира, чувствительность к инсулину и воспаление. При НАЖБП происходит снижение продукции адипонектина и увеличение синтеза лептина, а при НАСГ уровни сывороточного лептина повышены в сравнении со здоровыми [17, 18]. Гиперлептинемия и низкие уровни растворимого рецептора лептина (лептин-связывающего белка) свидетельствуют о лептинорезистентности периферических тканей и выявляются у пациентов с НАЖБП в большей степени, чем у лиц с ожирением без стеатоза печени [19].
Избыточная продукция провоспалительных цитокинов макрофагами висцеральной жировой ткани имеет решающее значение в развитии системного воспаления при ожирении. Активированные макрофаги секретируют цитокины и хемокины (фактор некроза опухоли-альфа 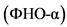 , интерлейкин (ИЛ)
, интерлейкин (ИЛ) ![]() , ИЛ-6 и CCL2 (C-C Motif Ligand - цитокин, относящийся к группе C-C хемокинов)), способствуют развитию локальной ИР, ведущей к нарушению регуляции липидного обмена, и могут формировать системную ИР [20, 21]. Провоспалительные медиаторы активируют ключевые транскрипционные факторы, такие как JNK (Jun N-концевая киназа) и
, ИЛ-6 и CCL2 (C-C Motif Ligand - цитокин, относящийся к группе C-C хемокинов)), способствуют развитию локальной ИР, ведущей к нарушению регуляции липидного обмена, и могут формировать системную ИР [20, 21]. Провоспалительные медиаторы активируют ключевые транскрипционные факторы, такие как JNK (Jun N-концевая киназа) и ![]() (ядерный фактор каппа-би), приводя к повреждению гепатоцитов, воспалению и стимуляции фиброгенеза [22].
(ядерный фактор каппа-би), приводя к повреждению гепатоцитов, воспалению и стимуляции фиброгенеза [22].
Нарушения аутофагии и липотоксичность. Аутофагия - универсальный внутриклеточный катаболический процесс (включая липофагию, митофагию, ретикулофагию и пексофагию), при котором дисфункциональные или избыточные органеллы (например, митохондрии, пероксисомы и эндоплазматический ретикулум, липидные капли) идентифицируются, метятся, доставляются к лизосомам и поглощаются для деградации в строительные блоки с последующим использованием на нужды клетки. Специфичность селективной аутофагии делает ее важнейшим процессом в уменьшении повреждения гепатоцитов, вызванным аномальным накоплением дисфункциональных органелл в патогенезе НАЖБП, при этом никакая другая система не может ее заменить [23].
Непосредственная связь аутофагии с апоптозом делает ее важным игроком в регуляции клеточной жизни и смерти. Одна из ключевых ролей в этих процессах отводится белку беклин-1 (англ. beclin-1), запускающему формирование и созревание фагофоры. В комплексе с белком Bcl-2 (B-Cell Leukemia/Lymphoma 2 - внутриклеточный белковый фактор, регулятор апоптоза) он ингибирует аутофагию, а нарушение этого взаимодействия вследствие конкурентного образования связи Bcl-2/Bax (BCL2 Associated X Protein - bcl-2-подобный белок 4) ведет к ее активации. Таким образом, беклин-1 в комплексе с Bcl-2 функционирует как молекулярный переключатель между аутофагией и апоптозом [24]. Клеточный стресс, в частности избыточное поступление в гепатоцит СЖК и накопление ТГ, первоначально стимулирует адаптационные способности гепатоцита, а затем приводит к их истощению [25]. В результате в клетке развивается дефицит аденозинтрифосфата (АТФ), накапливается аденозинмонофосфат (АМФ), что активирует работу аденозинмонофосфат-активируемой протеинкиназы (АМПК). Этот фермент запускает сложный процесс аутофагии, который при НАЖБП направлен на элиминацию липидных капель (липофагия), поврежденных митохондрий (митофагия), промежуточных продуктов синтеза ТГ (диацилглицерола и др).
Кроме того, АМПК модулирует печеночный липогенез посредством нескольких механизмов: фосфорилирование (и инактивация) факторов транскрипции SREBP-1c (фактор транскрипции 1, связывающий регуляторный элемент стерола, индуцирует экспрессию семейства генов, участвующих в утилизации глюкозы и синтезе жирных кислот; играет роль в развитии стеатоза печени), SREBP-2 (фактор транскрипции 2 - ключевой регулятор обмена холестерина (ХС), активация его гена приводит к увеличению захвата и синтеза ХС), а также ChREBP (Carbohydrate-Responsive Element-Binding Protein - углевод-реагирующий элемент-связывающий белок, в жировой ткани он индуцирует липогенез de novo из глюкозы, а в печени его индукция глюкозой способствует гликолизу и липогенезу; играет роль в развитии сахарного диабета (СД) 2-го типа, дислипидемии, стеатоза печени). Активность АМПК снижена у пациентов с НАЖБП, а ее агонисты могут быть эффективны в лечении этого заболевания [26 - 30].
Большое влияние на АМПК-зависимую аутофагию оказывает гиперактивация серин-трениновой киназы mTOR (механической мишени рапамицина), которая ингибирует лизосомальный биогенез и процессы аутофагии. Это происходит под влиянием цитозольной перегрузки Ca2+, оксидативного стресса, индуцируемого липотоксичностью СЖК, диацилглицеринов, церамидов, лизофосфатидилхолин и ХС. В результате развивается стресс эндоплазматического ретикулума и лизосомальная дисфункция, усугубляются процессы перекисного окисления липидов (ПОЛ) и происходит повреждение или гибель гепатоцитов [31, 32].
Оксидативный стресс и митохондриальная дисфункция. Повышенное поступление СЖК в печень приводит к усилению их пероксисомного ![]() и
и ![]() -окисления, а также
-окисления, а также ![]() -микросомального окисления с участием цитохрома P-450, что ведет к инициации ПОЛ. Кроме того, повышенная утилизация СЖК в митохондриях сопровождается продукцией высокоактивных форм и соединений кислорода, повреждающих эти органеллы, формируя митохондриальную дисфункцию и прогрессирующий энергодефицит [33]. В результате подавляются основные энергозависимые процессы в гепатоцитах, нарушается работа ферментативных и неферментативных компонентов антиоксидантной защиты, происходит дальнейшее образование новых свободных радикалов и гидроперекисей липидов, которые под влиянием каталитической активности ионов железа образуют вторичные свободнорадикальные продукты. Такой оксидативный каскад характеризуется повреждением гепатоцитов и приводит к развитию воспаления, стимуляции звездчатых клеток (ЗК) и фиброгенезу [34].
-микросомального окисления с участием цитохрома P-450, что ведет к инициации ПОЛ. Кроме того, повышенная утилизация СЖК в митохондриях сопровождается продукцией высокоактивных форм и соединений кислорода, повреждающих эти органеллы, формируя митохондриальную дисфункцию и прогрессирующий энергодефицит [33]. В результате подавляются основные энергозависимые процессы в гепатоцитах, нарушается работа ферментативных и неферментативных компонентов антиоксидантной защиты, происходит дальнейшее образование новых свободных радикалов и гидроперекисей липидов, которые под влиянием каталитической активности ионов железа образуют вторичные свободнорадикальные продукты. Такой оксидативный каскад характеризуется повреждением гепатоцитов и приводит к развитию воспаления, стимуляции звездчатых клеток (ЗК) и фиброгенезу [34].
Иммунные механизмы воспаления и фиброгенеза. При избыточном потоке СЖК или других патогенов (таких как эндотоксины) из кишечника в печень купферовские клетки фагоцитируют патогенные факторы и представляют их через рецепторы опознавания паттерна (PRRs) [35]. Эти рецепторы включают толл-подобные рецепторы (TLR) и нуклеотидные олигомеризационные доменоподобные рецепторы (NLRs) [36]. Инфламмасомы через белок NLR активируют каскад событий, в итоге которых активируется фактор транскрипции ![]() [37, 38]. Купфферовские клетки, в зависимости от внешнего индуктора, дифференцируются в фенотипы М1 или М2. Фенотип M1 вырабатывает провоспалительные цитокины
[37, 38]. Купфферовские клетки, в зависимости от внешнего индуктора, дифференцируются в фенотипы М1 или М2. Фенотип M1 вырабатывает провоспалительные цитокины 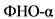 , ИЛ-1 и ИЛ-12, а М2 (второй тип макрофагов) способен стимулировать секрецию ИЛ-4, ИЛ-10 и трансформирующий фактор роста бета
, ИЛ-1 и ИЛ-12, а М2 (второй тип макрофагов) способен стимулировать секрецию ИЛ-4, ИЛ-10 и трансформирующий фактор роста бета 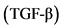 , обладающих противовоспалительным действием [39]. Продуцируемые активированными макрофагами ИЛ-6 и
, обладающих противовоспалительным действием [39]. Продуцируемые активированными макрофагами ИЛ-6 и 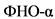 ответственны за прогрессирование НАСГ [40, 41].
ответственны за прогрессирование НАСГ [40, 41].
В реализации воспаления в печени вовлечены также T-хелперные лимфоциты. После иммунной активации T-клетки дифференцируются в Th1-, Th2- и Th17-эффекторные клетки. НАСГ характеризуется избытком Th1-производных цитокинов, таких как интерферон (ИФН) ![]() , и дефицитом Th2-производимых цитокинов - ИЛ-4, ИЛ-5 и ИЛ-13 [42]. Th17-клетки, продуцирующие ИЛ-17, инфильтрируют печень при НАСГ и усиливают воспаление и фиброз, влияя на макрофаги и ЗК [9]. Цитотоксические CD8+ T-клетки в печени при НАЖБП продуцируют
, и дефицитом Th2-производимых цитокинов - ИЛ-4, ИЛ-5 и ИЛ-13 [42]. Th17-клетки, продуцирующие ИЛ-17, инфильтрируют печень при НАСГ и усиливают воспаление и фиброз, влияя на макрофаги и ЗК [9]. Цитотоксические CD8+ T-клетки в печени при НАЖБП продуцируют 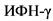 и
и 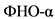 , что приводит к увеличению стеатоза, ИР, воспаления и активации ЗК [43]. В свою очередь, ЗК превращаются в активированный фенотип (миофибробласты), интенсивно пролиферируют и продуцируют коллаген, фибронектин, ламинин, гиалуроновую кислоту, матричные металлопротеиназы и их тканевые ингибиторы [44]. Накопление фибриллообразующих коллагенов (I и III типов) в пространстве Диссе обусловливает капилляризацию синусоидов, нарушение архитектоники печени, локальную гипоксию и прогрессирование фиброгенеза.
, что приводит к увеличению стеатоза, ИР, воспаления и активации ЗК [43]. В свою очередь, ЗК превращаются в активированный фенотип (миофибробласты), интенсивно пролиферируют и продуцируют коллаген, фибронектин, ламинин, гиалуроновую кислоту, матричные металлопротеиназы и их тканевые ингибиторы [44]. Накопление фибриллообразующих коллагенов (I и III типов) в пространстве Диссе обусловливает капилляризацию синусоидов, нарушение архитектоники печени, локальную гипоксию и прогрессирование фиброгенеза.
Ось "кишечник - печень". Среди комменсальных организмов, населяющих кишечник человека, доминируют 4 основных типа: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria. Микробиота играет жизненно важную роль в поддержании целостности кишечного барьера и проницаемости кишечника. Также кишечная микробиота активно участвует в биокинетике желчных кислот с образованием их метаболитов, таким образом опосредованно влияя на развитие НАЖБП через рецепторы желчных кислот, такие как фарнезоидный X-рецептор (FXR), мембранный рецептор желчных кислот (TGR5, GPBAR1) и рецептор витамина D (VDR), которые модулируют метаболизм питательных веществ и чувствительность к инсулину [45]. Нарушение состава микробиоты может повреждать кишечный эпителий и разрушать белки плотных соединений, что приводит к попаданию из кишечника бактерий, продуцируемого бактериями этанола и эндотоксинов в портальный кровоток [46, 47]. Это индуцирует воспаление и фиброгенез в печени, способствуя ее повреждению [48, 49].
Генетические аспекты. В ходе масштабных генетических исследований (полногеномный поиск ассоциаций), выполненных в различных странах преимущественно среди европеоидов, были выявлены десятки генов, полиморфизмы в которых могут быть взаимосвязаны с развитием НАЖБП и НАСГ [50, 51].
Наиболее убедительные данные в большинстве популяций получены об ассоциации с неблагоприятным течением НАЖБП (развитием НАСГ, фиброза и ГЦР) полиморфизмов rs738409 в гене PNPLA3 (пататин-подобный домен, содержащий 3 фосфолипазу, ген адипонутрина) и rs58542926 в гене TM6SF2 (трансмембранный белок 6 суперсемейства-2). Предполагается, что эти мутации имеют значение для российской популяции, но исследования были проведены лишь в отдельных регионах РФ [52 - 55].
Тиреоидные гормоны и НАЖБП. Гормоны щитовидной железы модулируют печеночный метаболизм глюкозы и липидов. Обсуждается роль гипотиреоза в развитии и прогрессировании НАЖБП [56, 57], так как снижение активации рецепторов гормонов щитовидной железы 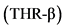 способствует увеличению стеатоза через ряд механизмов, в том числе через митохондриальную дисфункцию [58].
способствует увеличению стеатоза через ряд механизмов, в том числе через митохондриальную дисфункцию [58].
Таким образом, патогенез НАЖБП включает в себя целый комплекс патологических процессов, протекающих параллельно. Это многообразие патологических механизмов характеризует НАЖБП как заболевание, требующее мультидисциплинарного подхода, а стратегия лечения должна быть направлена на коррекцию разных сторон патологических изменений у пациента.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
НАЖБП в настоящее время представляет собой самое распространенное хроническое неинфекционное заболевание печени и поражает от 25 до 30% взрослых жителей в большинстве стран [59, 60]. В России эпидемиология НАЖБП изучалась в нескольких исследованиях. Согласно мультицентровым исследованиям DIREG (2007) и DIREG-2 (2015) среди пациентов амбулаторного звена, распространенность НАЖБП в РФ растет: 27 и 37,3% соответственно [61, 62].
По данным эпидемиологического исследования ЭССЕ-РФ-2 (2022) распространенность НАЖБП в России составила 38,5% для мужчин и 26,6% для женщин [63]. Схожие данные о распространенности НАЖБП в РФ и тенденции к ее росту были продемонстрированы и в недавнем метаанализе 5 исследований с общей выборкой 96 680 пациентов [64].
Распространенность НАСГ корректно оценить сложно, поскольку для правильного диагноза требуется биопсия печени - дорогая и инвазивная, не всегда доступная процедура. Согласно данным литературы, НАСГ встречается у 3 - 5% населения мира, большинство из которых страдает несколькими сопутствующими заболеваниями [65]. В то же время, согласно результатам проспективного исследования большой когорты людей среднего возраста, НАСГ встречается в 14% случаев, а также значимо ассоциирован с наличием у пациентов СД 2-го типа и ожирения [66]. Развитие фиброза при НАСГ определяет его клинические исходы: примерно у 20% пациентов развивается ЦП и (или) ГЦР, что служит основной причиной их смерти. Использование математической модели Маркова с учетом распространенности СД 2-го типа и ожирения показало, что распространенность НАСГ в мире к 2030 г. увеличится до 15 - 56% [67]. Соответственно, повлиять на этот негативный сценарий могут и должны усилия работников здравоохранения, в том числе в РФ.
НАЖБП тесно ассоциирована с различными коморбидностями: ожирение встречается у 51,34% (95% доверительный интервал (ДИ) 41,38 - 61,20) и 81,83% (95% ДИ 55,16 - 94,28) пациентов с НАЖБП и НАСГ соответственно, СД 2-го типа - у 22,51% (95% ДИ 17,92 - 27,89) и 43,63% (95% ДИ 30,28 - 57,98) пациентов с НАЖБП и НАСГ соответственно, распространенность гиперлипидемии/дислипидемии составляла 69,16% (95% ДИ 49,91 - 83,46) и 72,13% (95% ДИ 54,59 - 84,78) среди пациентов с НАЖБП и НАСГ соответственно, а артериальной гипертензии (АГ) - 39,34% (95% ДИ 33,15 - 45,88) и 67,97% (95% ДИ 56,31 - 77,74) среди пациентов с НАЖБП и НАСГ соответственно. Метаболический синдром (МетС) выявляется у 42,54% (95% ДИ 30,06 - 56,05) и 70,65% (95% ДИ 54,64 - 82,79) пациентов с НАЖБП и НАСГ соответственно [67].
Во всем мире в последние десятилетия отмечается тенденция к увеличению доли НАЖБП в структуре этиологических факторов ЦП [68], а также ГЦР, в том числе развивающегося без стадии цирроза [69].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
K75.8 - другие уточненные воспалительные болезни печени.
K76.0 - жировая печень (дегенерация печени), не классифицированная в других рубриках.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Выделяют два основных фенотипа (формы) НАЖБП:
- стеатоз;
- НАСГ.
Поскольку диагноз НАСГ требует гистологической верификации, в дальнейшем тексте рекомендаций при формулировке показаний к проведению диагностических и лечебных мероприятий используется преимущественно термин НАЖБП.
Вопросы ведения пациентов с ЦП при НАСГ рассматриваются в клинических рекомендациях (КР), посвященных ЦП [70], не имеют значительных особенностей при НАСГ, поэтому не обсуждаются в настоящих КР.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Для НАЖБП характерно мало- и бессимптомное течение. К наиболее частым жалобам относят гепатогенную слабость/утомляемость, которая встречается более чем у 70% пациентов, ощущение тяжести или дискомфорт в правом подреберье [71, 72]. Нередко жалобы пациентов с НАЖБП определяются коморбидными состояниями (ожирением и др.). Манифестная клиническая картина наблюдается при развитии НАСГ и ЦП с его осложнениями (см. КР "Цирроз и фиброз печени", ID 715).
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз НАЖБП устанавливается:
1) при подтверждении стеатоза печени (по данным визуализирующих исследований или гистологического исследования ткани печени);
2) наличии 1 и более факторов кардиометаболического риска:
- индекс массы тела (ИМТ) > 25 кг/м2 или окружность талии > 94 см у мужчин, > 80 см у женщин (либо выше ВГН, если пациент относится к этнической группе, для которой приняты другие нормы ИМТ и/или окружности талии);
- глюкоза натощак > 5,6 ммоль/л или постпрандиальная глюкоза > 7,8 ммоль/л или гликированный гемоглобин (HbA1c) > 5,7% или уже диагностированный СД 2-го типа или проводится лечение СД 2-го типа;
- артериальное давление >= 130/85 мм рт. ст. или фармакотерапия уже диагностированной АГ;
- ТГ в плазме >= 1,70 ммоль/л или липидоснижающее лечение;
- ХС липопротеидов высокой плотности (ЛПВП) в плазме < 1,0 ммоль/л у мужчин и < 1,3 ммоль/л у женщин или липидоснижающее лечение;
3) исключении других ведущих причин развития жировой болезни печени (табл. 1) [2, 73].
Таблица 1. Причины жировой болезни печени
Вариант жировой болезни печени
Группа причин
Причины
НАЖБП (МАЖБП)
Метаболическая дисфункция
Алкогольная болезнь печени
Избыточное употребление алкоголя
Жировая болезнь печени специфической этиологии
Моногенные заболевания
Болезнь Вильсона, абеталипопротеинемия, гипобеталипопротеинемия, врожденная липодистрофия, семейная гиперлипидемия, дефицит лизосомной кислой липазы, цитруллинемия 2-го типа и др.
Лекарственные поражения печени
Метотрексат**, тамоксифен**, амиодарон**, иринотекан** и др.
Токсины окружающей среды
Металлы (свинец, мышьяк, ртуть, кадмий); гербициды, пестициды; полихлорированные дифенилы, хлороалкены (перхлорэтилен, трихлорэтилен, винилхлорид)
Инфекция
Вирус гепатита C (генотип 3), ВИЧ-инфекция
Причины, связанные с питанием/проблемами со стороны кишечника
Резкая потеря массы тела (бариатрическая хирургия, голодание), недоедание, полное парентеральное питание, синдром короткой кишки, избыточный бактериальный рост в тонкой кишке и изменения микробиома, целиакия, воспалительные заболевания кишечника, панкреатэктомия
Заболевания, связанные с беременностью
Острая жировая дистрофия печени при беременности
Эндокринные нарушения
Гипотиреоз, синдром поликистозных яичников, дисфункция гипоталамуса/гипофиза, дефицит гормона роста
2.1 Жалобы и анамнез
Сбор жалоб и анамнеза должен быть направлен на выявление кардиометаболических факторов риска, необходимых для диагноза НАЖБП, ассоциированных с ней заболеваний и их осложнений (избыточная масса тела/ожирение, АГ, СД 2-го типа, дислипидемия, атеросклеротические ССЗ (АССЗ), хроническая болезнь почек (ХБП); изучение особенностей образа жизни, питания, употребления алкоголя.
2.2 Физикальное обследование
- Рекомендуется при сборе анамнеза и физикальном осмотре пациента с НАЖБП выполнять определение окружности талии, массы тела, расчет ИМТ, а также оценку кардиометаболических факторов риска с целью выбора тактики лечения [74].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: При объективном осмотре, как правило, выявляют признаки избыточной массы тела или ожирения, распределение жира по мужскому (абдоминальному) типу. Необходимо оценить такие показатели, как ИМТ, окружности талии и бедер. При пальпации и перкуссии живота у пациентов с НАЖБП без признаков выраженного фиброза могут обнаружить умеренное увеличение печени, край ее закруглен, консистенция тестоватая. При выраженном фиброзе печень становится плотной, на стадии цирроза могут отмечаться печеночные знаки, спленомегалия, асцит [74].
2.3 Лабораторные диагностические исследования
- Рекомендовано проведение общего (клинического) анализа крови пациентам с НАЖБП для оценки уровня гемоглобина, тромбоцитов, лейкоцитов [74, 75].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Чаще всего отклонения в общем анализе крови у пациентов с НАЖБП наблюдаются на стадии тяжелого фиброза/ЦП и проявляются цитопенией (в большеи степени - тромбоцитопенией различнои степени выраженности). Возможно наличие двух- и трехростковои цитопении, что отражает синдром гиперспленизма [74, 75]. Также показатели общего анализа крови используются для расчета неинвазивных индексов фиброза.
- Рекомендовано проведение анализа крови биохимического общетерапевтического, включающего такие показатели, как аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), ![]() -глутамилтрансфераза (ГГТ), общии билирубин, прямои билирубин, общии белок, альбумин пациентам с НАЖБП для оценки состояния печени (выявления признаков воспаления, холестаза, снижения функции) [74 - 76].
-глутамилтрансфераза (ГГТ), общии билирубин, прямои билирубин, общии белок, альбумин пациентам с НАЖБП для оценки состояния печени (выявления признаков воспаления, холестаза, снижения функции) [74 - 76].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В биохимическом анализе крови может отмечаться повышение активности сывороточных трансаминаз (АЛТ и АСТ), ГГТ (повышение активности этого фермента может быть изолированным), ЩФ и уровня билирубина. В ряде крупных клинических исследовании показано, что связь между повышением активности АЛТ и выраженностью воспалительнои реакции и фиброза печени не всегда прослеживается [77]. При НАЖБП активность трансаминаз в сыворотке крови обычно не превышает верхнюю границу нормальных значении (ВГН) более чем в 4 - 5 раз. Может преобладать как АЛТ, так и АСТ, но соотношение АСТ/АЛТ не превышает 1,3 [78]. Учет этого соотношения может быть полезным при проведении дифференциального диагноза с алкогольнои болезнью печени (соотношение АСТ/АЛТ при последней обычно выше 2). Активность ГГТ у пациентов может быть повышена, но, как правило, не более чем в 2 - 3 раза, а у некоторых из них это может быть единственным отклонением в биохимическом анализе. Активность ЩФ повышается реже и обычно не превышает нормальные значения более чем в 2 раза [75].
- Рекомендовано определение уровня глюкозы крови и (или) гликозилированного гемоглобина крови (HbA1c) и (или) проведение глюкозотолерантного теста (ГТТ) пациентам с НАЖБП для оценки кардиометаболических факторов риска [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Рекомендовано исследование уровня инсулина плазмы крови натощак для расчета индекса ИР (HOMA-IR), который служит уточняющим методом исследования у пациентов с подозрением на НАЖБП в отсутствие основных кардиометаболических факторов риска [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Согласно правилам постановки диагноза НАЖБП, к факторам кардиометаболического риска относят глюкозу крови (плазмы) натощак >= 5,6 ммоль/л (100 мг/дл) или гликемию >= 7,8 ммоль/л (>= 140 мг/дл) при проведении теста толерантности к глюкозе или HbA1c >= 5,7% (39 ммоль/л) [2]. Целесообразно скринировать пациентов с НАЖБП на наличие СД 2-го типа и других нарушении углеводного обмена путем определения глюкозы крови (плазмы) натощак или гликированного гемоглобина либо путем проведения ПГТТ с 75 г глюкозы согласно тем значениям и правилам, которые приводятся в КР "Сахарный диабет 2-го типа у взрослых" [79]. Для оценки ИР используется индекс HOMA-IR, рассчитываемый по формуле: HOMA-IR = инсулин плазмы натощак (мкед/мл) x глюкоза плазмы натощак (ммоль/л) / 22,5. Значение HOMA-IR >= 2,5 указывает на наличие ИР. Следует помнить, что диагностическая ценность индекса у пациентов с явным СД снижена [2, 80].
- Рекомендован анализ крови по оценке нарушений липидного обмена: биохимический общий ХС, ХС липопротеидов низкой плотности (ЛПНП), ХС ЛПВП, ТГ) пациентам с НАЖБП для оценки кардиометаболических факторов риска и стратификации риска сердечно-сосудистых осложнений [2, 81, 82].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: Согласно правилам постановки диагноза НАЖБП, к факторам кардиометаболического риска относят: увеличение содержания ТГ >= 1,70 ммоль/л или >= 150 мг/дл, снижение уровня ХС ЛПВП <= 1,0 ммоль/л (<= 40 мг/дл) у мужчин и <= 1,3 ммоль/л (50 мг/дл) у женщин [2]. Пациентам с НАЖБП необходимо исследовать общий ХС, ХС ЛПНП, ХС ЛПВП для стратификации риска сердечно-сосудистых осложнений согласно КР "Нарушения липидного обмена" [83].
- Рекомендовано исследование коагулограммы (ориентировочное исследование системы гемостаза) (международное нормализованное отношение, протромбиновый индекс, протромбиновое время, активированное частичное тромбопластиновое время, фибриноген) для оценки коагуляционного статуса, функции печени пациентам с НАЖБП на стадии ЦП [84 - 89].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Рекомендовано исследование общего (клинического) анализа мочи пациентам с НАЖБП на любой стадии заболевания с полуколичественным определением альбумина/белка в моче в целях скрининга ХБП, для оценки наличия мочевого осадка в целях исключения мочевои инфекции [90, 91].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано исследование уровня креатинина в крови пациентам с НАЖБП на любой стадии заболевания в целях скрининга ХБП [90, 91].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Распространенность ХБП оценивается в 20 - 55% у пациентов с НАЖБП по сравнению с 5 - 30% у пациентов без НАЖБП. Накапливается все больше данных, указывающих на ассоциацию НАЖБП и ХБП, ввиду общности факторов риска их развития, при этом имеются данные о независимой ассоциации между этими состояниями. При выявлении признаков ХБП, согласно скрининговым тестам, дальнейшее обследование пациентов проводится согласно КР "Хроническая болезнь почек у взрослых" [92]. Пациенты с НАЖБП и СД 2-го типа склонны к развитию мочевой инфекции [92, 93].
- Рекомендовано исследование уровня мочевой кислоты в сыворотке крови пациентам с НАЖБП на любой стадии заболевания для исключения/оценки степени выраженности гиперурикемии [94, 95].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В качестве предикторов развития НАЖБП определенную роль играет мочевая кислота. Ее уровень имеет самостоятельную связь с НАЖБП. Также повышение уровня мочевой кислоты ассоциировано с ожирением, ИР, тяжестью поражения печени и риском более тяжелого течения НАЖБП. В качестве маркера гиперурикемии целесообразно рассматривать уровень мочевой кислоты выше 360 мкмоль/л [93].
- Рекомендовано исследование маркеров вирусов гепатита B и C: определение антигена (HBsAg) вируса гепатита B (Hepatitis B virus) в крови, качественное исследование;, определение антител к вирусу гепатита C (Hepatitis C virus) в крови (anti-HCV IgG и anti-HCV IgM) исследование уровня иммуноглобулина G в крови (IgG), исследование уровня трансферрина сыворотки крови, исследование уровня церулоплазмина в крови, в качестве скрининговых показателей пациентам с подозрением на НАЖБП для исключения других этиологических факторов заболевания печени [1, 75].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В рамках клинической практики у пациентов всегда исключаются другие заболевания печени, которые встречаются наиболее часто в популяции взрослых. К ним относят хронический гепатит B и C, скрининговыми тестами служат HBsAg и суммарные антитела к вирусу гепатита С (anti-HCV IgG и anti-HCV IgM) соответственно; аутоиммунный гепатит (скрининговые тесты - исследование иммуноглобулинов класса G или гамма-глобулинов в сыворотке крови, имеет значение повышение их значений); наследственный гемохроматоз (скрининговый тест - повышение процента насыщения трансферрина железом > 45%); болезнь Вильсона (скрининговый тест - снижение сывороточного церулоплазмина < 20 мг/дл) [96 - 98].
2.4 Инструментальные диагностические исследования
- Рекомендовано проведение ультразвукового исследования (УЗИ) органов брюшной полости (комплексное) пациентам с НАЖБП с целью определения размеров и ультразвуковых характеристик печени, в частности определения ее эхогенности для диагностики стеатоза, выявления признаков портальной гипертензии (обнаружение асцита, измерение диаметра воротной и селезеночной вен, размеров селезенки), исключения очаговых образований печени, оценки проходимости сосудов печени [99, 100].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Диагностика стеатоза
- Рекомендовано проведение УЗИ органов брюшной полости (комплексное) пациентам с подозрением на НАЖБП как инструмента первой линии для выявления стеатоза в клинической практике [99 - 101].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Ультразвуковыми признаками НАЖБП можно считать:
диффузную гиперэхогенность паренхимы печени и неоднородность ее структуры;
нечеткость и (или) подчеркнутость сосудистого рисунка;
дистальное затухание эхосигнала [99, 100].
Чаще всего в диагностике стеатоза печени используется обычное трансабдоминальное УЗИ, поскольку оно широко доступно, безвредно, дешево и хорошо себя зарекомендовало. В метаанализе 34 исследований (2815 пациентов с подозрением на заболевание печени) совокупная чувствительность и специфичность УЗИ в выявлении стеатоза составили 85% (95% ДИ 80 - 89%) и 94% (95% ДИ 87 - 97%) соответственно (сравнение проводилось с результатами биопсии печени). Основные ограничения УЗИ заключаются в том, что оно может обнаруживать стеатоз только при накоплении жира выше 12,5 - 20%, его точность снижена у пациентов с ожирением и в определенной мере зависит от опыта оператора [101]. Тем не менее УЗИ остается наиболее широко используемым и приемлемым методом выявления стеатоза [102].
- Рекомендована оценка параметра контролируемого затухания (Controlled Attenuation Parameter - CAP) ультразвука в качестве инструмента второй линии для подтверждения стеатоза печени, а также его количественной оценки пациентам с подозрением на НАЖБП в специализированных лечебно-профилактических учреждениях (ЛПУ) при доступности данного метода [103, 104].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Возможность количественнои оценки стеатоза путем измерения затухания ультразвуковой эховолны была реализована на устройстве FibroScan ("Фиброскан") и называется "параметр контролируемого затухания" (CAP). Метод обладает высокой чувствительностью и специфичностью, особенно при выявлении стеатоза минимальной и средней степени выраженности. При выраженном стеатозе результаты были более гетерогенными ввиду влияния возраста, повышенного ИМТ, различиях в определении значения отсечки [104]. В метаанализе 16 исследований с индивидуальными данными 2346 пациентов сравнили результаты количественнои оценки стеатоза методом САР с гистологическими данными. Для пациентов с ожирением, избыточной подкожно-жировой клетчаткой при проведении исследования важно использование соответствующего зонда. Зонд M или XL выбирался согласно разработанным правилам. Зонд XL был рекомендован 1050 пациентам, 930 (89%) из которых страдали НАЖБП; результат оказался хорошим для определения стеатоза любой степени в сравнении с отсутствием стеатоза (AUROC 0,819; 95% ДИ 0,769 - 0,869), но неоптимальным для разграничения стеатоза легкой и более высокой степени выраженности (S0 - S1 к S2 - S3; AUROC 0,754; 95% ДИ 0,720 - 0,787). Согласно этому метаанализу, оптимальное пороговое значение (по индексу Юдена) для выявления стеатоза как такового у пациентов с НАЖБП составляет 294 дБ/м (чувствительность 0,790, специфичность 0,740) [103]. CAP - многообещающий метод для быстрого и стандартизированного выявления стеатоза при использовании зонда XL. Однако для его количественнои оценки уступает магнитно-резонансной томографии (МРТ-PDFF).
- Рекомендовано проведение магнитно-резонансной томографии органов брюшной полости (с определением фракции жира в печени - МРТ-PDFF) в качестве инструмента второй линии для подтверждения стеатоза печени, а также его количественной оценки пациентам с подозрением на НАЖБП в специализированных ЛПУ при доступности указанного метода [105].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Метод количественной МРТ-PDFF позволяет оценить количество жира в печени. Наиболее точный результат получают по значению протонной плотности фракции жира (англ. Proton Density Fat Fraction - PDFF). Именно значение PDFF с высокой точностью соответствует количественному и объемному содержанию жира в печени. В недавнем метаанализе (6 исследований с участием 635 пациентов с гистологически подтвержденной НАЖБП) для МРТ-PDFF сводные значения AUROC для стеатоза в количестве > 5%, > 33%, > 66% составили 0,98; 0,91 и 0,90 соответственно. Суммарная чувствительность и специфичность составили 93 и 94%, 74 и 90%, 74 и 87% соответственно [105]. Несмотря на высокую точность МРТ-PDFF в количественном определении стеатоза, высокая стоимость и ограниченная доступность метода лимитируют его использование в широкой клиническои практике.
Диагностика стеатогепатита
- Рекомендовано проведение биопсии печени (чрескожной пункционной или лапароскопической) пациентам с НАЖБП и подозрением на НАСГ с последующим патолого-анатомическим исследованием биопсийного (операционного) материала биопсии печени с целью определения признаков воспаления (стеатоз, баллонная дистрофия, лобулярное воспаление), а также в диагностически неясных случаях. При морфологическом исследовании ткани печени также оценивается степень выраженности стеатоза и фиброза [75, 106].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В настоящее время не разработано неинвазивных методов диагностики стеатогепатита (воспаления), биопсия печени служит золотым стандартом. Для установления диагноза НАСГ необходимо гистологическое исследование ткани печени и выявление стеатоза, баллонной дистрофии и лобулярного воспаления одновременно [107 - 110]. Возможны и другие гистологические изменения, но они не считаются необходимыми для постановки диагноза (портальное воспаление, полиморфно-ядерные инфильтраты, тельца Мэллори - Денка, апоптотические тельца, прозрачные вакуолизированные ядра, микровезикулярный стеатоз и мегамитохондрии). Перисинусоидальный и перицентральный фиброз также часто встречаются, но не являются частью диагностических критериев; что же касается термина "пограничный НАСГ", то он не вполне ясен и его лучше не применять. Понятие "затухающий (burned-out) НАСГ" описывает регрессию тяжелой формы заболевания (стеатоз, воспаление или баллонная дистрофия) у пациентов с факторами риска МетС. Все другие методы, такие как CK-18 (цитокератин 18), комбинации клинических переменных, комбинация клинических переменных с вариантом PNPLA3 I148M и т.д., а также предложенные для неинвазивной диагностики НАСГ методы визуализации не отражают воспаление и не рекомендуются к применению в клинической практике с этой целью, так как имеют либо противоречивые результаты, либо недостаточное число подтверждающих исследований, либо сложность получения некоторых переменных для широкого и простого воспроизведения [106].
Таким образом, биопсия печени в настоящее время остается эталонным стандартом для диагностика НАСГ у больных НАЖБП. Помимо определения таких характеристик НАЖБП, как наличие стеатоза, стадия фиброза, выраженность лобулярного воспаления, биопсия печени в ряде случаев позволяет выявить/исключить другие причины поражения печени. В 2005 г. на основе консенсуса экспертов-морфологов (CRN) для оценки НАЖБП предложена Шкала оценки активности НАЖБП (NAS - NAFLD activity score), которая является модификацией используемых ранее шкал Brunt и Matteoni 1999 г. и позволяет оценить степень морфологических изменений в баллах (от 0 до 8): выраженность стеатоза печени, внутридолькового (лобулярного) воспаления, баллонной дистрофии гепатоцитов и стадию фиброза [110] (приложение Г1). Эта шкала может использоваться и для оценки эффективности лечения НАЖБП, поскольку позволяет определить достоверность динамики морфологических изменений на фоне терапии за относительно короткий период времени [77, 111].
В 2012 г. для гистологической оценки состояния печени при морбидном ожирении была предложена, а в дальнейшем (2014) валидизирована система SAF (Steatosis, Activity, and Fibrosis), которая включает такие характеристики как выраженность стеатоза (S - steatosis), баллонную дистрофию и лобулярное воспаление (A - activity) и стадию фиброза печени (F - fibrosis) - см. приложение Г2 (результат оценки записывается в виде индекса S1A2F3, S2A1F1 и т.п.) [109]. Система оценки SAF получила дальнейшее развитие и позволяет использовать алгоритм FLIP (Fatty liver inhibition of progression), направленный на стандартизацию и улучшение качества морфологической диагностики [109].
В отсутствие гистологического исследования ткани печени, но убедительных неинвазивных данных о прогрессирующем течении заболевания (например, повышение суррогатных маркеров воспаления - трансаминаз, данные неинвазивных методов, свидетельствующие о фиброзе и т.п.) допустимо, по мнению экспертов, устанавливать диагноз "вероятный НАСГ".
Диагностика фиброза
- Рекомендовано применение неинвазивных незапатентованных тестов NFS (NAFLD Fibrosis Score - оценка фиброза при НАЖБП) и FIB-4 (Fibrosis-4 index - индекс фиброза-4) пациентам с НАЖБП с целью исключения выраженного фиброза и цирроза в широкой клинической практике [112].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Наиболее проверенными и надежными среди незапатентованных тестов (находятся в свободном доступе) являются NFS и FIB-4. В клинической практике используют следующие пороговые значения (точки отсечения) для решения вопроса о том, есть у пациента с НАЖБП тяжелый фиброз или его нет: 1,3 для FIB-4 и -1,455 для NFS (высокая чувствительность) и 3,25 для FIB-4 и 0,676 для NFS (высокая специфичность).
NFS и FIB-4 имеют следующие преимущества: 1) оба теста основаны на простых переменных, широко доступных в клинической практике; 2) их результаты можно легко получить у постели больного с помощью бесплатных онлайн-калькуляторов; 3) у них хорошая общая диагностическая точность для тяжелого фиброза, о чем свидетельствует метаанализ (36 исследований с участием 9074 пациентов) - AUROC 0,80 для FIB-4 и 0,78 для NFS соответственно, NPV составляет >= 90% [112]. К недостаткам NFS и FIB-4 относят: 1) риск получения ложноположительных критериев тяжелого фиброза - PPV < 70%; 2) в трети случаев - неопределенный результат (между верхним и нижним пороговыми значениями); 3) предположительно, влияние пожилого возраста на диагностическую точность. Эта проблема была решена принятием более высокого порогового значения для лиц старше 65 лет: 2,0 для FIB-4 и 0,12 для NFS [113]. Информативность расчетных индексов у лиц старшего возраста и с СД, вероятно, ниже [114].
- Рекомендовано применение таких неинвазивных запатентованных тестов, как 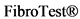 , пациентам с НАЖБП с целью исключения тяжелого фиброза при доступности данного метода [112, 366, 367].
, пациентам с НАЖБП с целью исключения тяжелого фиброза при доступности данного метода [112, 366, 367].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Среди запатентованных сывороточных маркеров фиброза наиболее распространены FibroMeterTM, 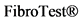 и ELFTM. Среди всех перечисленных в настоящее время в РФ доступен только
и ELFTM. Среди всех перечисленных в настоящее время в РФ доступен только 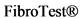 . В целом диагностическая точность запатентованных неинвазивных сывороточных тестов (FibroMeterTM,
. В целом диагностическая точность запатентованных неинвазивных сывороточных тестов (FibroMeterTM,  и ELFTM) для диагностики фиброза удовлетворительна, но их широкое применение в клинической практике ограничено высокой стоимостью и ограниченной доступностью [102, 112, 366, 367].
и ELFTM) для диагностики фиброза удовлетворительна, но их широкое применение в клинической практике ограничено высокой стоимостью и ограниченной доступностью [102, 112, 366, 367].
- Рекомендовано проведение транзиентной эластографии печени пациентам с НАЖБП с целью оценки стадии фиброза и исключения выраженного фиброза/ЦП в специализированых ЛПУ при доступности указанного метода [112].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Транзиентная эластография - наиболее широко применяемое исследование для определения жесткости печеночнои ткани с самым большим объемом данных у пациентов с НАЖБП. В крупном метаанализе (17 исследований с применением M-датчика и включением 2642 пациентов; 3 исследования с применением XL-датчика и включением 318 пациентов) сообщается о хорошей диагностической точности этого метода для выявления тяжелого фиброза, т.е. фиброза 3-й стадии (AUC 0,87 для M-датчика и 0,86 - для XL-датчика) и цирроза (AUC 0,92 для M-датчика и 0,94 - для XL-датчика) [112]. В клинической практике нет полного согласия относительно пороговых значении жесткости ткани печени для диагностики тяжелого фиброза при НАЖБП, согласно последним данным, предлагается значение >= 8 кПа, чувствительность - 93% [115]. На результат транзиентной эластографии может влиять ряд факторов, таких как активность воспаления (результат недостоверен при высоком уровне АЛТ).
- Рекомендовано пациентам с НАЖБП с целью оценки жесткости ткани печени применять эластометрию печени в рамках ультразвукового исследования (ультразвуковая эластометрия сдвиговой волной) при недоступности транзиентной эластографии [102, 112].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Измерение жесткости ткани печени посредством методик сдвиговой волны, которыми оснащены современные ультразвуковые аппараты, сопоставимо по своей точности с транзиентной эластографией, однако данные по пациентам с НАЖБП ограничены. Самые точные результаты определения жесткости ткани получают методом магнитно-резонансной эластографии, но этот метод имеет высокую стоимость, ограниченную доступность и используется преимущественно в клинических исследованиях.
- Рекомендовано проведение эзофагогастродуоденоскопии (ЭГДС) пациентам с НАЖБП при выраженном фиброзе/ЦП с целью определения признаков портальнои гипертензии (варикозное расширение вен пищевода и желудка, признаки портальной гастропатии) [116].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
2.5 Иные диагностические исследования
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечение НАЖБП должно включать две цели:
1) профилактика прогрессирования заболевания печени, регресс стеатоза, стеатогепатита и фиброза;
2) снижение кардиометаболических факторов риска.
Принципиально лечение НАЖБП делится на немедикаментозные меры (диета и физическая активность) и фармакотерапию.
3.1 Немедикаментозная терапия НАЖБП
3.1.1 Физическая активность
- Пациентам с НАЖБП для уменьшения содержания жира в печени рекомендуется регулярная физическая активность [117, 118].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Всемирной организацией здравоохранения (ВОЗ) разработаны рекомендации по физической активности для взрослых лиц с целью профилактики ряда заболеваний, в том числе ассоциированных с НАЖБП [117]. Пациентам с НАЖБП для уменьшения содержания жира в печени рекомендовано уделять аэробной физической активности умеренной интенсивности не менее 150 - 300 мин в неделю или аэробной физической активности высокой интенсивности не менее 75 - 150 мин в неделю либо сочетать в течение недели физическую нагрузку средней и высокой интенсивности. Не менее двух раз в неделю аэробную нагрузку рекомендовано дополнять физической активностью средней или высокой интенсивности (силовые упражнения), направленной на все группы мышц [117, 118]. Интенсивность - это темп осуществления физической активности или величина усилии, которые необходимы для выполнения какого-либо вида деятельности или упражнения в единицу времени (например, скорость ходьбы 5 км/ч). Ее можно охарактеризовать следующим образом: насколько напряженно работает человек для выполнения определенного вида деятельности.
Физическая активность умеренной интенсивности увеличивает частоту сердечных сокращений, но во время ее выполнения можно комфортно вести беседу. Примеры: быстрая ходьба, танцы, работа в саду, работа по дому и хозяйству, активные игры и спортивные занятия с детьми, прогулки с домашними животными и т.п.
Физическая активность высокой интенсивности (например, бег, занятия аэробикой, плавание на дистанцию, быстрая езда на велосипеде, подъем в гору и т.п.) значительно повышает частоту сердечных сокращений, частоту дыхательных движений и вызывает потоотделение [117].
Рекомендации по физической активности должны учитывать индивидуальные особенности пациента по его физической подготовке и коморбидности. Поскольку 95% пациентов с НАЖБП имеют избыточную массу тела или ожирение, то полезно учитывать положения КР "Ожирение" [119].
В систематических обзорах и метаанализах установлено, что физические упражнения уменьшают содержание жира в печени даже в отсутствие значительного снижения массы тела [118, 120 - 123]. В исследовании, включавшем 115 пациентов с НАЖБП и предиабетом, показано, что интенсивные аэробные нагрузки 2 - 3 раза в неделю по 30 - 60 мин на протяжении 6 месяцев и более приводят к уменьшению содержания жира в печени на 24,4% [124]. В систематическом обзоре показана эффективность аэробных и силовых упражнений 3 раза в неделю в течение 12 недель в уменьшении жира в печени у пациентов с НАЖБП [120]. В исследовании пациентов с НАЖБП и оценкой содержания жира в печени методом МРТ и спектроскопии было показано, что аэробные нагрузки высокой интенсивности (велоэргометр 30 - 40 мин 3 раза в неделю) достоверно уменьшают содержание жира в печени в сравнении с контролем (лица с пассивным образом жизни) [125, 126].
Пациентам, которые испытывают сложности в выполнении аэробных нагрузок (например, плохая кардиореспираторная подготовка) можно рекомендовать силовые упражнения (упражнения с отягощениями), которые также способствуют улучшению метаболизма липидов и более благоприятному течению НАЖБП [120]. В целом пациентов необходимо поощрять как можно больше внимания уделять физической активности. Оптимальную физическую активность по продолжительности и интенсивности необходимо подбирать на индивидуальной основе [127].
3.1.2 Диета
Диетические изменения остаются наиболее эффективным немедикаментозным средством как для лечения НАЖБП, так и для похудания.
- Пациентам с НАЖБП с целью снижения содержания жира в печени рекомендована сбалансированная диета с соблюдением принципов средиземноморского типа питания [128 - 130].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Средиземноморский тип питания - научная концепция, которая предполагает в первую очередь состав макронутриентов (углеводы 50 - 60%, жиры 30%, белки 20%) и сбалансированный подход. Данный тип питания содержит большое количество природных антиоксидантов, биологических компонентов с противовоспалительной активностью и имеет низкий гликемический индекс. Средиземноморский тип питания в качестве основного источника жира предполагает использование оливкового масла, характеризуется употреблением в пищу большого количества овощей, фруктов и орехов, бобовых культур, цельного зерна, рыбы и морепродуктов; напротив, низким потреблением молочных продуктов, мяса и мясных продуктов. Молекулярные механизмы благоприятного воздействия на здоровье человека доказаны для таких компонентов средиземноморского типа питания, как полифенолы, каротиноиды, олеиновая кислота, полиненасыщенные жирные кислоты (ПНЖК), пищевые волокна, кверцетин [128, 131]. В двух поперечных исследованиях показано, что приверженность средиземноморскому типу питания обратно коррелирует с риском развития НАЖБП и НАСГ [132, 133].
В рандомизированном перекрестном исследовании было показано, что на фоне 6 недель питания средиземноморского типа в сравнении со стандартной низкожировой высокоуглеводной диетой содержание жира в печени уменьшилось на 39% против 7%, соответственно, также уменьшился HOMA-IR вне зависимости от изменения массы тела [134]. Приверженность средиземноморскому типу питания - один из независимых прогностических факторов, позитивно влияющих на тяжесть течения НАЖБП [135]. Преимуществом такого типа питания служит возможность следовать ему без ущерба здоровью на протяжении неограниченно длительного периода времени и адаптировать к любому географическому региону и личным пищевым предпочтениям пациента [127].
- Пациентам с НАЖБП рекомендовано избегать употребления продуктов, содержащих добавленную фруктозу, для уменьшения накопления жира в печени [136, 137].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Употребление в пищу добавленной фруктозы (представлена преимущественно в подслащенных напитках) способствует развитию НАЖБП. Метаанализы контролируемых исследований показывают, что потребление добавленной фруктозы приводит к значительному увеличению количества жира в печени и повышению АЛТ. Негативный эффект добавленной фруктозы может быть частично связан с увеличением калорийности питания. Отрицательного влияния на НАЖБП естественных источников фруктозы (мед, фрукты, сухофрукты) при условии соблюдения адекватной энергоценности рациона не установлено [136, 137].
- Пациентам с НАЖБП без избыточной массы тела/ожирения для уменьшения ИР, профилактики ССЗ и саркопении, уменьшения висцерального жира рекомендуется регулярная физическая активность согласно правилам ВОЗ [117] и сбалансированная диета с соблюдением принципов средиземноморского типа питания [128, 363].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Ведение пациентов с НАЖБП и нормальной массой тела представляет собой клиническую проблему. В этих случаях должен проводиться тщательный дифференциальный диагноз для исключения редких причин жировой болезни печени (моногенные болезни, лекарственное воздействие и т.п.). Общая рекомендация по снижению массы тела для них в большинстве случаев неприемлема, хотя в рандомизированном контролируемом исследовании (РКИ) показано, что изменение образа жизни обеспечило ремиссию НАЖБП у пациентов с нормальной массой тела на фоне снижения массы тела на 3 - 5% [1, 138, 139]. Изменения в диете и физические упражнения в этой группе пациентов могут оказаться полезными в плане уменьшения ИР, увеличения мышечной массы и профилактики ССЗ и их осложнений. Этим пациентам рекомендуется уменьшить потребление алкоголя, добавленной фруктозы, насыщенных жиров, простых углеводов, ультраобработанных продуктов [140].
- Пациентам с НАЖБП рекомендуется воздерживаться от приема любого количества алкоголя для профилактики накопления жира и прогрессирования фиброза печени [141].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: В настоящее время общеизвестным фактом является то, что, помимо кардиометаболических факторов риска, к стеатозу, стеатогепатиту и фиброзу печени приводит и употребление алкоголя в дозах, превышающих 20 и 30 г этанола в сутки для женщин и мужчин соответственно. Причем прием алкоголя может как выступать в роли основного фактора, вызывая развитие алкогольной жировой болезни печени, так и быть дополнительным звеном, потенцирующим прогрессирование заболевания [142, 143]. Это было убедительно продемонстрировано в систематическом обзоре, авторы которого также пришли к выводу, что на прогрессирование заболевания влияют любые дозы алкоголя, даже условно безопасные [141].
Рекомендации по снижению массы тела у пациентов с ожирением представлены в разделе 3.3.2 "Лечение НАЖБП в сочетании с ожирением".
3.2 Медикаментозная терапия НАЖБП
В настоящее время, несмотря на прогресс, который достигнут в понимании патогенеза, клинического течения и прогноза НАЖБП, вопросы фармакотерапии этого заболевания все еще обсуждаются, и проводятся исследования лекарственных средств, ориентированных на разные метаболические пути: регуляцию углеводного и липидного обмена, тиреоидный путь, аутофагию и апоптоз и т.д. Основные мишени в лечении НАЖБП: стеатоз (служит независимым фактором кардиометаболического риска), воспаление и фиброз [144, 145]. Все фенотипы НАЖБП ассоциированы с повышенным риском развития ССЗ, эндокринной патологии и других метаболических нарушений [146]. Особенность НАЖБП - мультисистемность и коморбидность, что влияет на терапевтические подходы. Исходя из этого, можно сформулировать две основные цели терапии НАЖБП:
1) уменьшение содержания липидов в гепатоцитах, снижение активности воспаления, профилактика развития/замедление прогрессирования фиброза;
2) снижение кардиометаболических рисков пациента, связанных с избытком липидов в гепатоцитах и (или) воспалением и (или) фиброзом.
Соответственно, оптимальный лекарственный препарат должен способствовать одновременному достижению этих целей, обеспечивать оптимизацию экономических затрат и обладать высоким профилем безопасности.
Для лечения НАЖБП применяются различные лекарственные средства, которые можно условно разделить на 2 группы:
1) препараты с гепатотропным эффектом, в том числе с зарегистрированным показанием НАЖБП; некоторые из них обладают полипотентным действием и одновременно влияют на сердечно-сосудистую систему, липидный и углеводный обмен;
2) препараты, зарегистрированные для лечения типичных для НАЖБП коморбидных состояний с дополнительным гепатотропным эффектом. Например, статины - ингибиторы ГМГ-КоА-редуктазы - для лечения гиперхолестеринемии и дислипидемии; аналоги глюкагоноподобного пептида-1 (GLP-1) (лираглутид, семаглутид**) и ингибиторы натрийзависимого переносчика глюкозы - 2-го типа (дапаглифлозин**, эмпаглифлозин**, ипраглифлозин**) - для лечения СД 2-го типа.
В этом разделе рассматриваются гепатотропные препараты (препараты 1-й группы). Применение препаратов 2-й группы описывается в разделе лечения коморбидных состояний. Эффективность применения гепатотропных препаратов оценивается прежде всего по динамике уровня АЛТ (суррогатный маркер воспаления), а также с помощью неинвазивных методов, полуколичественно или количественно оценивающих содержание жира в печени - CAP или МРТ-PDFF (если они доступны), с применением неинвазивных методов оценки фиброза (расчетные индексы, эластография) (см. раздел 2 "Диагностика заболевания или состояния").
Сывороточные трансаминазы (АЛТ и АСТ) служат простым и надежным лабораторным признаком гепатоцеллюлярного повреждения (воспаления), на их снижение ориентируются при оценке эффективности лечения пациентов с любой этиологией повреждения печени. АЛТ более специфична для повреждения гепатоцитов в сравнении с АСТ [147]. Доказана положительная корреляция между уровнем сывороточных трансаминаз и смертностью от болезней пищеварительной системы (из них 89% - болезни печени), онкологических и ССЗ [148, 149]. Повышение АЛТ > 30 ед/л у мужчин и > 19 ед/л у женщин коррелируют с увеличением смертности от заболеваний печени и СД [147, 150]. Лица с НАЖБП и увеличенной активностью АЛТ в сыворотке крови имеют повышенный расчетный риск развития ишемической болезни сердца (ИБС) согласно Фрамингемской шкале, особенно женщины [151].
В настоящее время в лечении НАЖБП имеются лишь единичные исследования, включающие анализ гистологических данных до и после лечения (парные биопсии) и почти нет работ, оценивающих долгосрочное течение заболевания на основании "твердых" конечных точек (продолжительность жизни, смертность и т.п.). В то же время проведено большое количество рандомизированных и наблюдательных исследований, а также их метаанализов, в которых эффективность фармакотерапии НАЖБП оценивалась по суррогатным маркерам воспаления (уровень сывороточных трансаминаз, ГГТ) и фиброза. Это объяснимо, поскольку биопсия печени - инвазивная, дорогая и не везде доступная процедура. В клинической практике эффективность терапии заболеваний печени оценивается по динамике уровня АЛТ (суррогатный маркер воспаления), а современные неинвазивные методики позволяют оценить динамику стеатоза и фиброза [1]. Выбор препарата для лечения НАЖБП зависит от клинических проявлений заболевания, его фенотипа и особенностей течения, определяется лечащим врачом для каждого пациента индивидуально.
- Медикаментозная терапия НАЖБП рекомендуется в сочетании с мероприятиями по изменению образа жизни (физическая активность и правильное питание), в особенности в случае их недостаточной эффективности, препятствий к выполнению и (или) прогрессирующего течения заболевания [152, 153].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: Изменение образа жизни (физическая активность и правильное питание) лежит в основе лечения НАЖБП. По данным исследований, < 10% пациентов достигают снижения массы тела в течение года при структурированном подходе к физической активности, из них менее половины удерживают достигнутый результат в течение 5 лет [154]. Кроме того, метаанализы последних лет свидетельствуют о неопределенности влияния вмешательств в образ жизни пациентов с НАЖБП на долгосрочный прогноз и исходы заболевания в связи с относительно короткими (не более 2 лет) сроками проведенных исследований и их неоднородностью [152, 153, 155].
- Рекомендовано назначение урсодезоксихолевой кислоты (УДХК)** в дозе 13 - 15 мг/кг/сут пациентам с НАЖБП с целью уменьшения содержания липидов в гепатоцитах, уменьшения воспаления и профилактики прогрессирования фиброза [156, 157].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: В клиническом исследовании у пациентов с гистологически доказанным НАСГ и парными биопсиями печени применение УДХК** в суточной дозе 13 - 15 мг/кг массы тела в течение 12 месяцев привело к статистически значимому по сравнению с группой сравнения уменьшению выраженности стеатоза печени и снижению уровня АЛТ, АСТ, ГГТ и ЩФ [158]. Аналогичные данные продемонстрированы в другом исследовании при 6-месячном применении УДХК** [159].
В одном из исследований применение высоких доз УДХК** (#28 - 35 мг/кг/сут, доза, превышающая рекомендованную в инструкции) в течение 12 месяцев пациентами с подтвержденным биопсией НАСГ приводило к достоверному снижению уровня АЛТ: к концу исследования нормализация этого показателя отмечалась у каждого пятого пациента и только примерно у каждого двадцатого - в группе плацебо. При этом результаты не зависели от динамики массы тела пациентов. Также в группе УДХК** отмечено достоверное снижение показателей  в сравнении с плацебо (потенциальный антифибротический эффект). Серьезных нежелательных явлений не наблюдалось [160].
в сравнении с плацебо (потенциальный антифибротический эффект). Серьезных нежелательных явлений не наблюдалось [160].
По данным отечественного метаанализа, выполненного в 2018 г. на основании 4 исследований с общим размером выборки 510 человек, УДХК** при НАЖБП обладала высоким профилем безопасности, при этом влияния на гистологические и биохимические параметры заболевания не было доказано [161]. Однако в систематическом обзоре и двух более поздних метаанализах было показано, что применение УДХК** приводит к снижению сывороточных трансаминаз (АЛТ, АСТ) и ГГТ и уменьшает стеатоз печени [156, 162, 163]. В проспективном наблюдательном мультицентровом несравнительном исследовании "УСПЕХ", выполненном в условиях реальной клинической практики, показано, что лечение УДХК** в дозе 15 мг/кг массы тела в течение 6 месяцев пациентов с НАЖБП приводит к статистически значимому (p < 0,001) снижению активности АЛТ, АСТ, ГГТ, концентрации общего ХС, ТГ, ЛПНП в крови, индекса стеатоза печени FLI (Fatty Liver Index). Прогрессирования фиброза, оцененного по индексу NFS, не было отмечено [164].
Молекулярные исследования показали, что свой эффект по уменьшению стеатоза печени и воспаления УДХК** оказывает через модуляцию эффекта аутофагии, будучи стимулятором одного из основных внутриклеточных сенсоров гомеостаза - АМПК [165], активность которого снижена при стеатозе печени [25]. У пациентов с НАЖБП стимуляция липофагии и митофагии посредством УДХК** приводит к уменьшению количества жира в печени, снижению липотоксичности и, соответственно, воспаления. Аутофагия тесно связана с апоптозом через белки Bcl-2/беклин-1, а антиапоптотический эффект УДХК** хорошо известен [166]. Уменьшение стеатоза и воспаления препятствует развитию и прогрессированию фиброза. В доклинических исследованиях было показано, что УДХК** уменьшает выраженность стеатоза печени еще и как лиганд TGR5 [167]. В экспериментальном исследовании на модели НАЖБП доказано, что УДХК** способна предупреждать развитие как стеатоза, так и фиброза, не оказывая существенного влияния на баллонную дегенерацию гепатоцитов. УДХК** способствует уменьшению липогенеза в печени, повышает чувствительность тканей к инсулину, восстанавливает синтез желчных кислот и участвует в положительной модуляции активности рецептора желчных кислот GPBAR1 [168].
Рекомендуемая длительность назначения УДХК** - не менее 6 месяцев; оптимальная доза, использовавшаяся в большинстве клинических исследований, - 13 - 15 мг/кг/сут.
- Рекомендовано назначение #Альфа-токоферола ацетат (витамина E) в дозе 800 международных единиц (МЕ) в сутки пациентам с НАЖБП при доказанном прогрессирующем течении заболевания (фиброз F2 и более) для уменьшения выраженности стеатоза и воспаления, замедления прогрессирования заболевания [169 - 173].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: #Витамин E используется для лечения НАЖБП у пациентов с гистологически подтвержденным прогрессирующим НАСГ и входит в ряд КР ведения пациентов с НАЖБП, которые основаны на результатах рандомизированного исследования PIVENS [1, 174 - 177]. #Витамин E в дозе 800 МЕ/сут применялся на протяжении 22 месяцев и превышал по эффективности плацебо у пациентов с НАСГ по влиянию на стеатоз, воспаление и баллонную дистрофию, но не оказывал значимого воздействия на фиброз [169]. В тех случаях когда НАСГ сочетался с СД 2-го типа, на гистологическую активность оказывала влияние только комбинация #витамина E (800 МЕ/сут) с #пиоглитазоном (45 мг/сут) на протяжении 18 месяцев, влияние на фиброз также не было отмечено [170]. В крупном контролируемом исследовании было показано снижение риска смерти или трансплантации печени, декомпенсации заболевания при применении #витамина E в дозе 800 МЕ/сут в течение более 2 лет у пациентов с гистологически доказанным НАСГ и продвинутыми стадиями заболевания (мостовидный фиброз, цирроз). Средняя продолжительность наблюдения за пациентами составила 5,6 года [173]. По данным метаанализов, #витамин E улучшает лабораторные показатели, снижает гистологические проявления стеатоза и воспаления [171, 172].
Потенциальная проблема безопасности применения высоких доз #витамина E - повышение смертности от всех причин и геморрагического инсульта - была обозначена в метаанализах, опубликованных в 2005 и 2013 гг. [178, 179], но в более позднем метаанализе 2014 г. эти данные не были подтверждены [180]. Также обсуждается взаимосвязь приема #витамина E с повышением риска развития рака простаты у мужчин [181]. Однако во всех этих исследованиях не оценивали безопасность #витамина E именно у пациентов с НАЖБП.
Помимо этого, следует учитывать возможное взаимодействие высоких доз #витамина E (> 300 мг/сут) с одновременно назначаемыми ацетилсалициловой кислотой**, варфарином**, тамоксифеном** и циклоспорином** с изменением их активности [182]. Соответственно, назначение высоких доз #витамина E должно проводиться с осторожностью и с учетом лекарственного анамнеза пациента. Потенциальная польза назначения #витамина E у пациентов с НАЖБП и СД обсуждается [56, 170]. Рекомендуемая продолжительность лечения - не менее 12 месяцев.
- Рекомендовано пероральное назначение адеметионина** в дозе 10 - 25 мг/кг/сут (но не более 1600 мг/сут) пациентам с НАЖБП и жалобами на слабость/утомляемость для ее коррекции [183, 184].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Гепатогенная слабость/утомляемость служит симптомом, влияющим на качество жизни пациентов и ограничивающим выполнение ими рекомендаций по увеличению физической активности. Влияние адеметионина** на гепатогенную слабость/утомляемость при различных заболеваниях печени, в том числе НАЖБП, было показано в систематических обзорах и метаанализе [183, 184]. Уменьшение доли пациентов с гепатогенной слабостью/утомляемостью при применении препарата наблюдалось в одноцентровом сравнительном исследовании у пациентов с НАСГ и в многоцентровом проспективном несравнительном наблюдательном исследовании у пациентов с НАЖБП в рутинной практике [185, 186]. Уменьшение слабости/утомляемости наблюдается при краткосрочном (2 - 4-недельном) приеме адеметионина**, а увеличение продолжительности курса повышает долю пациентов со снижением этого симптома [183, 184]. Рекомендуемая продолжительность лечения - не менее 4 недель.
- Рекомендовано назначение бициклола в дозе 75 - 150 мг/сут на протяжении 24 недель пациентам с НАЖБП (НАСГ) с умеренным и выраженным повышением уровня АЛТ (> 3 и > 5 ВГН соответственно) для уменьшения активности заболевания [187, 188].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: В доклинических исследованиях бициклол препятствовал повышению уровня трансаминаз, накоплению липидов в ткани печени и фиброгенезу, ингибируя сигнальные пути воспаления и оксидативного стресса при диете, содержащей большое количество жиров [189 - 191].
По данным метаанализа, который включал 12 исследований с НАЖБП и общий размер выборки 1008 человек, бициклол в качестве монотерапии и в комбинации с другими препаратами оказывал положительное влияние на лабораторные показатели воспалительной активности и липидного обмена, стимулируя снижение уровня АЛТ, АСТ, ТГ и ХС [187].
Схожие результаты были получены в когортном исследовании с участием 93 человек, когда при 24-недельном приеме бициклола, помимо улучшения лабораторной картины, отмечалось и уменьшение признаков фиброза и стеатоза по данным фиброэластометрии [192]. В открытом несравнительном наблюдательном исследовании у 51 пациента с хроническими диффузными заболеваниями печени любой этиологии и повышенным уровнем сывороточных трансаминаз (из них 29 пациентов с НАЖБП), применение бициклола приводило к уменьшению/нормализации уровня АЛТ, который статистически значимо снижался от исходного уже через 2 недели лечения [188]. По мнению экспертов, под умеренным повышением АЛТ понимается диапазон от 3- до 5-кратного увеличения выше ВГН, под выраженным - более чем 5-кратное увеличение ВГН. Рекомендуемая продолжительность лечения - не более 24 недель.
- Рекомендовано назначение фиксированной комбинации инозин + меглюмин + метионин + никотинамид + янтарная кислота** в дозе 400 мл/сут пациентам с НАЖБП на стационарном этапе лечения, в том числе в режиме дневного стационара, для улучшения клинических симптомов и лабораторных показателей [193, 194].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3).
Комментарии: Фиксированная комбинация инозин + меглюмин + метионин + никотинамид + янтарная кислота** в виде инфузионного раствора обладает гепатотропным действием, реализуемым за счет способности янтарной кислоты корригировать явления митохондриальной дисфункции, развивающейся при НАЖБП, поддерживая активность сукцинатдегидрогеназы и увеличивая продукцию макроэргов. Метионин - незаменимая аминокислота, которая играет ключевую роль в качестве регулятора ряда клеточных функций. Инозин способен взаимодействовать с аденозиновыми A2a- и A3-рецепторами с их последующей активацией, что приводит к уменьшению повреждения гепатоцитов гипоксией и СЖК, а также оказывает системное противовоспалительное действие путем модуляции активности ![]() . Никотинамид играет роль кофермента NAD-зависимых ферментных систем, акцептора и переносчика протонов в электронтранспортной цепи, тем самым косвенно стимулируя процессы клеточного дыхания, энергопродукции, клеточной регенерации, биосинтеза и обмена белков, углеводов и липидов. Кроме того, никотинамид участвует в обеспечении сиртуин-опосредуемых процессов (репарация ДНК, биогенез митохондрий, апоптоз, воспаление). Входящий в состав препарата меглюмин обеспечивает лучшее проникновение янтарной кислоты через биомембраны [193].
. Никотинамид играет роль кофермента NAD-зависимых ферментных систем, акцептора и переносчика протонов в электронтранспортной цепи, тем самым косвенно стимулируя процессы клеточного дыхания, энергопродукции, клеточной регенерации, биосинтеза и обмена белков, углеводов и липидов. Кроме того, никотинамид участвует в обеспечении сиртуин-опосредуемых процессов (репарация ДНК, биогенез митохондрий, апоптоз, воспаление). Входящий в состав препарата меглюмин обеспечивает лучшее проникновение янтарной кислоты через биомембраны [193].
В небольших РКИ этот комбинированный препарат (400 мл 1 раз в сутки в течение 10 - 11 дней) у пациентов с НАСГ приводил к улучшению лабораторных показателей цитолиза и холестаза [195, 196]. В сравнительном исследовании включение такой фиксированной комбинации в схему лечения пациентов с НАЖБП в форме стеатогепатита приводило к более быстрому купированию астеновегетативного и диспепсического синдромов и уменьшению выраженности биохимических проявлений цитолитического и холестатического синдромов [194].
Фиксированная комбинация "инозин + меглюмин + метионин + никотинамид + янтарная кислота**" назначается по 400 мл внутривенно капельно 1 раз в сутки ежедневно в течение 10 дней на стационарном этапе лечения. Показания к стационарному лечению изложены в разделе 6 "Организация оказания медицинской помощи".
- Рекомендовано пероральное назначение адеметионина** в дозе 10 - 25 мг/кг/сут (но не более 1600 мг/сут) пациентам с НАЖБП в сочетании с вторичным холестазом для его коррекции [185].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: По данным работ, оценивающих морфологические особенности НАЖБП, гистологические признаки холестаза при этом заболевании встречаются в 27,0 - 30,1% случаев, хотя гораздо реже находят отражение в лабораторном холестатическом профиле [197, 198]. Вторичный холестаз при НАЖБП указывает на более активное течение болезни, развитие его поздних стадий и ухудшение прогноза [198, 199].
Снижение синтеза эндогенного адеметионина при хронических заболеваниях печени и НАЖБП вносит вклад в развитие внутрипеченочного холестаза посредством уменьшения активности транспортера желчных кислот (Bile Salt Export Pump (BSEP)) и нарушения целостности мембран гепатоцитов [200]. Длительность приема адеметионина** при прогрессирующей НАЖБП должна составлять от 4 месяцев, максимальная продолжительность курса не ограничена [185]. Возможна двухступенчатая схема терапии: парентеральное введение в дозе 5 - 12 мг/кг/сут с переходом на пероральный прием в дозе 10 - 25 мг/кг/сут, но не более 1600 мг/сут.
- Рекомендовано назначение орнитина в дозе 9 г/сут перорально пациентам с НАЖБП для коррекции гипераммониемии [201 - 204].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В исследовании биоптатов печени пациентов с НАЖБП показано значительное снижение активности синтеза мочевины и глутамина по сравнению с контролем [205], а на экспериментальных моделях НАСГ установлена дисрегуляции генов и экспрессии белков орнитинового цикла [206]. У значительной части пациентов на доцирротических стадиях НАЖБП показано развитие гипераммониемии [203, 204, 207].
Из препаратов орнитина наибольшая доказательная база у орнитина (L-орнитин-L-аспартат, LOLA) в пероральной форме, который диссоциирует на составляющие его аминокислоты и стимулирует синтез мочевины в перипортальных гепатоцитах и образование глутамина в перивенозных гепатоцитах, скелетных мышцах и мозге. Предполагается, что LOLA, помимо гипоаммониемического действия при НАЖБП, может оказывать благоприятное действие через механизмы метаболической трансформации в L-глутамин, L-аргинин и глутатион, уменьшая ПОЛ, оказывая противовоспалительный эффект и улучшая портальную гемодинамику [201, 202].
В параллельном контролируемом клиническом исследовании 12-недельный курс лечения LOLA в пероральной форме приводил к дозозависимому улучшению лабораторных показателей состояния печени и ее томографических характеристик у пациентов с НАСГ [208]. Результаты экспериментальных исследований также предполагают прямое благотворное влияние LOLA на скелетные мышцы при моделировании НАСГ: препарат предотвращает развитие миостеатоза и качественного изменения мышц [209], а также позволяет повысить адаптацию к физическим нагрузкам при этой патологии [210]. Рекомендуемая продолжительность лечения - не менее 12 недель.
Комбинированное применение гепатотропных препаратов
Существуют патогенетические обоснования для совместного использования ряда гепатотропных препаратов в виде как нефиксированных, так и фиксированных комбинаций, позволяющих либо расширить спектр их гепатотропного действия, либо достичь однонаправленного увеличения (аддитивность, суммация, потенцирование) того или иного фармакологического эффекта. Несмотря на то что доказательность большинства проводившихся клинических исследований не очень высокая, тем не менее она может служить обоснованием для выбора сочетанного применения ряда препаратов в рутинной клинической практике [211]. При этом следует использовать только те комбинации, которые изучались при НАЖБП или НАСГ с учетом дополнительных показаний и противопоказаний.
- Рекомендовано добавление #Альфа-токоферола ацетата (витамина E) к терапии УДХК** пациентам с НАЖБП в случае недостаточной эффективности УДХК** с целью уменьшения воспалительной активности заболевания, выраженности стеатоза [212, 213].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: В сравнительном исследовании у пациентов с НАСГ добавление к лечению УДХК** (12 - 15 мг/кг/сут) #витамина E (800 МЕ/сут) в течение 2 лет позволило статистически значимо увеличить уровень адипонектина в крови, что коррелировало с уменьшением выраженности стеатоза печени [214]. В другом исследовании анализ повторных биопсий показал, что только на фоне комбинированной терапии УДХК** и #витамином E произошло уменьшение индекса гистологической активности с регрессией стеатоза печени [212]. Длительное (4 года, диапазон - 1 - 12 лет) использование комбинации УДХК** (в среднем 16,6 мг/кг/сут) и #витамина E (в среднем 555 МЕ/сут) у пациентов с НАСГ позволило снизить АЛТ, АСТ и ГГТ у 65 - 80% пациентов и добиться у большинства улучшения гистологической картины печени при низком (5%) числе побочных эффектов, потребовавших отмены препаратов [213]. Рекомендуемая доза комбинации препаратов #витамина E и УДХК** не должна превышать предельные дозы препаратов, назначаемых по отдельности: для #витамина E - не более 800 МЕ/сут, УДХК** - 10 - 15 мг/кг/сут.
3.3 Лечение НАЖБП и ассоциированных состояний
3.3.1 Лечение НАЖБП в сочетании с сахарным диабетом 2-го типа
- Рекомендована нормализация массы тела за счет изменения образа жизни (изменения питания и расширения физической активности) пациентам с НАЖБП и сахарным диабетом 2-го типа с целью улучшения чувствительности тканей к инсулину и уменьшения содержания жира в печени [79, 215].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Изменение образа жизни при сочетании СД 2-го типа и НАЖБП должно соответствовать КР "Сахарный диабет 2-го типа у взрослых" [79]. Принципы питания при НАЖБП и СД 2-го типа близки и не противоречат друг другу. Степень снижения массы тела ассоциирована с выраженностью улучшения гистологических параметров НАЖБП и НАСГ. В 12-месячном проспективном исследовании показано, что все пациенты, снизившие массу тела более чем на 10%, имели улучшение гистологических показателей: шкалы NAS, у 90% пациентов отмечалось разрешение НАСГ, у 45% была регрессия фиброза [216].
Помимо простого снижения массы тела, соблюдение диеты (с ограниченным содержанием углеводов и повышенным содержанием белка) на протяжении 6 недель позволяет добиться лучшего контроля гликемии, приводит к снижению уровня ТГ сыворотки крови, уменьшает выраженность стеатоза печени (оцениваемого по данным МР-спектроскопии) у пациентов с СД 2-го типа [215].
Учитывая тот факт, что СД 2-го типа и НАЖБП имеют общие патогенетические черты, не удивительно, что некоторые методы, используемые для лечения СД 2-го типа, активно применяются и для лечения НАЖБП. В настоящее время проведены многочисленные исследования, нацеленные на поиск гипогликемического препарата, который мог бы повлиять на патологические изменения при НАЖБП и НАСГ. Такой препарат должен снижать массу тела, сокращать кардиоваскулярные события, предотвращать развитие поздних стадий НАЖБП, а также иметь низкую стоимость, долгосрочную безопасность и улучшать качество жизни.
- Рекомендовано применение аналогов глюкагоноподобного пептида-1 (GLP-1) (#лираглутида (1,8 - 3,0 мг/сут), #семаглутида** (2,4 мг/нед) пациентам с НАЖБП и СД 2-го типа с целью снижения массы тела, уменьшения ИР, снижения лабораторных показателей воспаления [217 - 220].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Инкретиномиметики, включая аналоги глюкагоноподобного пептида-1, используются для лечения СД 2-го типа и ожирения. Они стимулируют глюкозозависимую секрецию инсулина, уменьшают липогенез de novo, приводят к снижению массы тела, ИР и уровня сывороточных трансаминаз. Использование аналогов глюкагоноподобного пептида-1 - очень привлекательный и многообещающий метод лечения НАЖБП, однако пока неизвестно, оказывает ли данная группа препаратов прямой эффект на гепатоциты, напрямую уменьшая печеночный стеатоз и воспаление, или же эффект достигается за счет снижения массы тела.
Одним из наиболее изученных препаратов указанной группы для лечения пациентов с СД 2-го типа и НАЖБП выступает #лираглутид. По данным метаанализа 8 исследований, этот препарат приводил к уменьшению как ИМТ и объема талии, так и содержания жира в печени, что оценивалось неинвазивными методами, причем превосходил по выраженности эффектов другие гипогликемические препараты (#метформин**, инсулины и их аналоги, ингибиторы дипептидилпептидазы-4 (DPP-4)) [217]. Схожие результаты были получены в систематическом обзоре с метаанализом [218]. Кроме этого, прием #лираглутида способствовал уменьшению уровня сывороточных трансаминаз и билирубина, а также улучшению показателей неинвазивного индекса фиброза APRI (Aspartate Aminotransferase to Platelet Ratio Index - отношение аспартатаминотрансаминазы к количеству тромбоцитов) [217].
Также инициированы исследования другого препарата из группы аналогов глюкагоноподобного пептида-1 - #семаглутида**. В настоящее время завершена II фаза клинического исследования препарата #семаглутид** у пациентов с НАСГ и фиброзом. #Семаглутид** обеспечил статистически значимую регрессию НАСГ, однако статистически значимой разницы между препаратом и плацебо относительно уменьшения фиброза не было выявлено [219]. Несмотря на отсутствие убедительных данных об уменьшении фиброза печени по данным гистологического исследования, в отдельных метаанализах сообщается об уменьшении жесткости ткани печени на фоне применения #семаглутида** [220 - 222].
В исследованиях эффективности #лираглутида и #семаглутида** у пациентов с СД 2-го типа отмечено снижение сердечно-сосудистых и цереброваскулярных событий [223, 224], что было ассоциировано в том числе со снижением массы тела [225]. Рекомендуемая продолжительность применения #лираглутида (1,8 - 3,0 мг/сут) - не менее 48 недель, #семаглутида** (2,4 мг/нед) - от 48 до 72 недель по данным исследований.
- Рекомендовано рассмотреть назначение #пиоглитазона в дозе 30 - 45 мг/сут у пациентов с НАЖБП и СД 2-го типа с целью уменьшения стеатоза и воспаления в печени при уровне АЛТ < 2,5 ВГН [176, 226 - 227, 364].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Тиазолидиндионы - класс антидиабетических препаратов, повышающих чувствительность тканей к инсулину, участвующих в регуляции метаболизма липидов. Один из представителей этого класса - #пиоглитазон в дозе 30 - 45 мг/сут по сравнению с плацебо в нескольких исследованиях и метаанализах продемонстрировал эффективность при лечении НАСГ в отношении улучшения лабораторных тестов печеночной панели и гистологической картины (выраженности стеатоза и активности воспаления) у пациентов с НАСГ с СД 2-го типа и без него [176, 227, 228]. В систематическом обзоре исследований, посвященных эффектам терапии #пиоглитазоном, сообщалось об уменьшении признаков стеатоза печени у пациентов с НАЖБП и СД 2-го типа, что подтверждалось и гистологически [228]. Несмотря на отсутствие явного влияния на фиброз, в ряде исследований жесткость печени, оцениваемая по данным транзиентной и МР-эластометрий, снижалась, однако при этом не происходило уменьшения содержания коллагена IV типа 7S в сыворотке крови, что говорит о том, что снижение жесткости происходит преимущественно за счет фракции жира. Также в этой работе было отмечено значимое положительное влияние на лабораторные показатели воспаления (снижение активности АЛТ, АСТ, ГГТ) и дислипидемии (уменьшение уровня ЛПНП и повышение уровня ЛПВП) у пациентов с НАЖБП и СД 2-го типа при приеме #пиоглитазона [172].
Негативными сторонами лечения #пиоглитазоном служат прибавка массы тела, повышение риска развития рака мочевого пузыря в долгосрочном периоде и остеопороза. Препарат также не рекомендуется пациентам с хронической сердечной недостаточностью (ХСН) и получающим высокие дозы инсулинов и их аналогов или амлодипина** [229]. Как европейская, так и американская ассоциация по изучению печени рассматривают возможность использования #пиоглитазона для лечения НАСГ только у отдельных групп пациентов, учитывая риски развития вышеуказанных состояний. Рекомендуемая доза препарата - 30 - 45 мг в сутки, продолжительность приема - не менее 24 недель. Противопоказанием к назначению #пиоглитазона служит уровень АЛТ, превышающий ВГН в 2,5 раза [230].
- Рекомендовано применение ингибиторов натрийзависимого переносчика глюкозы 2-го типа пациентам с НАЖБП и СД 2-го типа с целью контроля гликемии, а также уменьшения содержания жира в печени [231, 233].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Ингибиторы натрийзависимого переносчика глюкозы 2-го типа (ИНПГ-2) представляют собой относительно новый класс антидиабетических препаратов, подавляющих реабсорбцию глюкозы в проксимальных почечных канальцах по инсулинонезависимому механизму. Помимо своей основной функции, для этих препаратов установлено наличие целого ряда плейотропных эффектов, включающих кардио- и нефропротекцию. В последнее время привлекает внимание способность ИНПГ-2 типа оказывать положительное влияние на течение НАЖБП [232]. По данным метаанализа 10 РКИ, включавших 573 пациента с НАЖБП и СД 2-го типа, прием ИНПГ-2 (преимущественно #дапаглифлозина**, #ипраглифлозина**) на протяжении от 12 недель приводил к более существенному снижению уровня АЛТ, АСТ, уменьшению показателя FIB-4 в сравнении с другими пероральными гипогликемическими препаратами. Также отмечалось положительное влияние на снижение массы тела, уменьшение висцерального жира и содержания жира в печени, которое оценивалось по данным МРТ-PDFF [233]. В крупном метаанализе были получены схожие результаты, однако при оценке фиброза по показателю коллагена IV типа 7S, а не индексу FIB-4 не было получено статистически значимой разницы между группой ИНПГ-2 и контрольной группой, которая включала другие гипогликемические препараты. В исследовании также отмечалось значимое положительное влияние на уровень ХС ЛПНП при приеме ИНПГ-2 более 24 недель в сравнении с группой контроля. Еще один важный вывод работы - подтверждение высокой безопасности ИНПГ-2. Несмотря на известные нежелательные лекарственные реакции в виде повышенного риска урогенитальных инфекций, авторы сообщают о наличии несущественной статистической разницы между исследуемыми группами [234].
По данным 2 метаанализов с включением 16 РКИ (699 пациентов) и 18 РКИ (1330 пациентов), применение ИНПГ-2 (#дапаглифлозин**, #эмпаглифлозин**, #ипраглифлозин**) в течение 12 - 24 недель приводило к статистически значимому уменьшению неинвазивных показателей стеатоза (по данным МРТ) и фиброза (индекс FIB-4, жесткость печени, CAP-параметр, сывороточное содержание коллагена IV типа 7S) [235, 236]. Рекомендуемая доза #дапаглифлозина** - 5 - 10 мг в сутки, #эмпаглифлозина** - 1 - 25 мг/сут. Прием препаратов рассчитан на длительное время как в качестве монотерапии, так и в составе комбинированного лечения.
- Рекомендовано добавление УДХК** в дозе 13 - 15 мг/кг/сут в схемы гипогликемической терапии пациентам с НАЖБП и СД 2-го типа для улучшения контроля гликемии [237, 238].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В крупном систематическом обзоре с метаанализом клинических исследований был показан эффект УДХК**, применяемой в различных дозах продолжительностью от 6 недель до 2 лет, на гликемические параметры [237]. Так, метаанализ 7 исследований с применением 8 групп лечения УДХК** продемонстрировал статистически значимое снижение уровня глюкозы натощак после такой терапии (взвешенная разность средних -3,30 ммоль/л). Метаанализ 2 групп лечения показал статистически значимое снижение концентрации гликированного гемоглобина (взвешенная разность средних - -0,41%). В дополнение к этому, метаанализ 4 групп лечения также выявил статистически значимое снижение уровня инсулина в плазме без существенного влияния на HOMA-IR. Результаты этого метаанализа показали, что УДХК** значительно снижает концентрацию глюкозы в плазме натощак, гликированного гемоглобина и инсулина, что свидетельствует о ее положительном влиянии на гомеостаз глюкозы.
В 2021 г. было опубликовано РКИ с 240 участниками, в ходе которого оценивались эффекты применения #эмпаглифлозина** в дозе 25 мг и УДХК** в дозе 250 мг/сут на протяжении 6 месяцев. Так, в группе #эмпаглифлозина** отмечалось более значительное уменьшение стеатоза по данным МРТ-PDFF, более выраженное снижение уровня ТГ, глюкозы в сравнении с группой приема УДХК**. При этом УДХК** превосходила #эмпаглифлозин** в аспекте уменьшения индексов фиброза печени и ИР. Влияние на ИМТ и уровень сывороточных трансаминаз в обеих группах было сопоставимо. Полученные результаты позволили авторам прийти к выводу, что оба препарата обладают достаточной безопасностью и эффективностью и могут быть использованы для лечения НАЖБП у пациентов с СД 2-го типа [238]. Рекомендуемая доза УДХК** - 13 - 15 мг/кг/сут. Длительность приема - не менее 6 недель.
3.3.2 Лечение НАЖБП в сочетании с ожирением
Немедикаментозная терапия
- Пациентам с НАЖБП и ожирением рекомендуется изменение образа жизни (коррекция питания, увеличение физической активности) как обязательные меры для снижения массы тела, уменьшения стеатоза, воспаления и фиброза печени [239].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: Изменение образа жизни (питания и физической активности) служит основой лечения как НАЖБП, так и ожирения и наиболее эффективно, когда проводится под врачебным контролем. В ведении пациентов с НАЖБП и ожирением следует руководствоваться также КР "Ожирение" [119]. Снижение массы тела при ожирении благоприятно влияет на выраженность стеатоза и активность стеатогепатита как в краткосрочных исследованиях, так и по данным метаанализов [239, 240], хотя результаты качественных пролонгированных наблюдений пока отсутствуют [155, 239, 240].
Аэробные упражнения и силовые тренировки эффективно снижают содержание жира в печени. Упражнения подбирают индивидуально с учетом предпочтений пациента, чтобы повысить его приверженность [174]. Упражнения с отягощениями могут быть более целесообразными, чем аэробные упражнения для пациентов с НАЖБП с плохой кардиореспираторной подготовкой или для тех, кто не может переносить аэробные упражнения или участвовать в них. Как аэробные, так и силовые упражнения снижают стеатоз печени при НАЖБП при одинаковой частоте и продолжительности упражнений (40 - 45 мин/занятие 3 раза в неделю в течение 12 недель) [120].
Важным условием эффективного лечения пациентов с НАЖБП и ожирением является одновременное соблюдение диетических рекомендаций и увеличение физической нагрузки. Так, по результатам РКИ с участием 80 человек комбинация диеты с ограничением калорий и умеренной физической нагрузки приводила к более значимому уменьшению стеатоза печени по данным МРТ-PDFF, снижению массы тела, уменьшению содержания жира, объема талии и показателей липидного обмена, чем физическая нагрузка и диета по отдельности [241]. Вместе с этим резкое ограничение калорийности и быстрое снижение массы тела может привести к прогрессированию фиброза и повышению уровня сывороточных трансаминаз. Рекомендовано медленное снижение массы тела - на 0,5 - 1 кг в неделю [175, 242, 243].
Для достижения целевой потери массы тела, сохранения приверженности к ее снижению и контроля над достигнутой массой желательно применение ряда мер по усмотрению врача, таких как более быстрая потеря массы в начале лечения, персонализированная обратная связь, положительное отношение медицинского персонала, обеспечение поддержки окружающими (друзей и членов семьи), участие в структурированных программах по снижению массы тела [244, 245].
Медикаментозная терапия
- Рекомендовано пациентам с НАЖБП и ожирением, не ответившим на изменение образа жизни, назначение препаратов, зарегистрированных в качестве лекарственных средств для лечения ожирения, с целью уменьшения массы тела и улучшения течения НАЖБП [174, 175, 246, 247].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: В отсутствие клинически значимого снижения массы тела на фоне немедикаментозных методов, а также для повышения эффективности лечения ожирения может применяться медикаментозная терапия: лираглутид (аналог глюкагоноподобного пептида-1 (GLP-1)) 0,6 - 1,8 мг/сут, или орлистат (препарат периферического действия для лечения ожирения) 120 мг/сут, или сибутрамин (препарат центрального действия для лечения ожирения) 10 - 15 мг/сут. Это позволяет добиться более эффективного снижения массы тела, облегчает выполнение рекомендаций по питанию, помогает в выработке новых привычек в питании, а также способствует длительному удержанию сниженной массы тела [174, 175, 246, 247]. Данные лекарственные средства рекомендуются для лечения ожирения согласно КР "Ожирение" [119].
- Рекомендовано назначение УДХК** в дозе 10 - 15 мг/кг/сут пациентам с НАЖБП в период снижения массы тела на фоне диетотерапии или бариатрических операций для профилактики образования конкрементов в желчном пузыре до достижения стабилизации массы тела [248 - 250, 365].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: У пациентов с ожирением частота желчнокаменной болезни (ЖКБ) выше, чем в популяции, при этом быстрая потеря массы тела, в особенности при соблюдении диеты с резким ограничением жиров, увеличивает риск образования камней, развития симптомной ЖКБ и выполнения холецистэктомии [251, 252]. По данным метаанализов показано, что применение УДХК** во время диеты для похудания предотвращает риск образования камней в желчном пузыре [248], а лечение УДХК** после бариатрической хирургии уменьшает риск симптомной ЖКБ [249, 250, 253]. При этом в исследовании по профилактике ЖКБ на фоне снижения массы тела путем применения УДХК 84% пациентов имели НАЖБП [365].
Хирургическое лечение
У пациентов с ожирением (ИМТ > 35 кг/м2) и НАЖБП, не достигших положительного результата на фоне изменения образа жизни и (или) фармакотерапии, возможно проведение хирургического бариатрического лечения (см. раздел 3.4 "Хирургическое лечение").
3.3.3 Лечение НАЖБП в сочетании с дислипидемией и АССЗ
НАЖБП уже на стадии стеатоза является самостоятельным фактором риска развития ССЗ, независимым от СД 2-го типа, дислипидемии или ожирения. У пациентов с НАЖБП и дислипидемией целевые уровни показателей липидного обмена определяются сердечно-сосудистым риском. При назначении гиполипидемической терапии пациентам с НАЖБП целевые уровни липидов выбираются в соответствии с КР "Нарушения липидного обмена" [83].
- Рекомендовано назначение ингибиторов ГМГ-КоА-редуктазы (статинов) в дозах, необходимых для достижения целевого уровня ХС ЛПНП, пациентам с НАЖБП и дислипидемией/АССЗ для предотвращения риска развития их осложнений и улучшения течения НАЖБП [83, 254, 255].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Ингибиторы ГМГ-КоА-редуктазы (статины) подавляют синтез ХС в печени и широко используются в лечении дислипидемии, АССЗ для первичной и вторичной профилактики ССЗ и их осложнений. НАЖБП часто сочетается с дислипидемией и другими кардиометаболическими нарушениями, такими как АГ, ИБС, ХСН, нарушения ритма и проводимости [93, 256]. В связи с этим таким пациентам часто назначаются статины. Дозы статинов рассчитываются согласно КР "Нарушения липидного обмена" [83, 257].
Согласно проведенным систематическим обзорам и метаанализам, ингибиторы ГМГ-КоА-редуктазы имеют хороший профиль безопасности при НАЖБП и сами по себе способствуют снижению уровня АЛТ, АСТ и ГГТ [255, 258, 259]. Это особо актуально для тех пациентов, которые имеют повышенный уровень печеночных ферментов перед началом приема ингибиторы ГМГ-КоА-редуктазы. В ряде исследований показано, что ингибиторы ГМГ-КоА-редуктазы у пациентов с НАСГ и дислипидемией приводят к уменьшению стеатоза, воспаления и фиброза [255, 258 - 261].
При назначении гиполипидемической терапии производится контроль трансаминаз через 8 - 12 недель от ее начала. В случае если АЛТ превышает 3 ВГН, производится отмена препарата. У пациентов с НАСГ и исходно повышенными показателями АЛТ вместо ВГН следует использовать исходный уровень АЛТ [262].
- Рекомендовано пациентам с НАЖБП и дислипидемией/АССЗ терапию ингибиторами ГМГ-КоА-редуктазы комбинировать с УДХК** в дозе 10 - 15 мг/кг для усиления их гиполипидемического эффекта при недостаточной эффективности стандартной тактики или непереносимости высоких доз ингибиторов ГМГ-КоА-редуктазы [263 - 264].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В рандомизированном проспективном клиническом исследовании пациентов с гиперхолестеринемией было показано, что при неэффективности терапии симвастатином** (20 мг/сут) или аторвастатином** (20 мг/сут) их комбинация с УДХК** была статистически значимо более эффективна в сравнении с увеличением дозы ингибиторы ГМГ-КоА-редуктазы в два раза по влиянию на уровни общего ХС и ХС ЛПНП [265].
В мультицентровом наблюдательном исследовании РАКУРС оценивалась эффективность и безопасность сочетанного назначения статинов и УДХК** у пациентов с хроническими заболеваниями печени и ССЗ, которые нуждались в назначении статинов. По результатам исследования добавление УДХК** к терапии статинами приводило к статистически значимо лучшему эффекту в сравнении с монотерапией ингибиторами ГМГ-КоА-редуктазы: целевые уровни ХС ЛПНП среди пациентов, принимавших ингибиторы ГМГ-КоА-редуктазы и УДХК**, к концу 6-месячного периода терапии были достигнуты у 37% пациентов, а среди принимавших только ингибиторы ГМГ-КоА-редуктазы - у 20%. Также было отмечено, что комбинация УДХК** со ингибиторами ГМГ-КоА-редуктазы препятствует статин-индуцированному росту сывороточных трансаминаз [263].
При вторичном анализе исследования РАКУРС из общей группы участников были выделены пациенты с НАЖБП (89%). У них монотерапия статинами в течение первого месяца лечения характеризовалась положительной динамикой показателей липидного обмена в отсутствие неблагоприятного влияния на печеночные функциональные тесты. В свою очередь, комбинированная терапия ингибиторами ГМГ-КоА-редуктазы и УДХК** в течение 6 месяцев привела к достоверному снижению уровней общего ХС и ХС ЛПНП в сравнении с монотерапией ингибиторами ГМГ-КоА-редуктазы [264].
На экспериментальной модели НАЖБП было показано, что комбинация УДХК**, #розувастатина и #эзетимиба приводит к статистически значимому снижению уровня АЛТ, оказывает антиапоптотический и антифибротический эффект в сравнении с действием комбинации #розувастатин + #эзетимиб [266].
Результаты исследований показали, что УДХК** способна потенцировать действие ингибиторов ГМГ-КоА-редуктазы, что особенно актуально для пациентов с неэффективностью низких доз ингибиторов ГМГ-КоА-редуктазы и непереносимостью их высоких доз. Рекомендуемая доза УДХК** - 10 - 15 мг/кг/сут.
- Рекомендовано назначение пациентам с НАЖБП и дислипидемией/АССЗ #эзетимиба в дозе 10 мг/сут в режиме моно- или комбинированной терапии при непереносимости или недостаточной эффективности ингибиторов ГМГ-КоА-редуктазы в целях уменьшения риска сердечно-сосудистых осложнений и улучшения течения НАЖБП [83, 267].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: #Эзетимиб блокирует переносчик стеролов NPC1L1 (Niemann-Pick C1-Like 1) на апикальной мембране энтероцитов, что снижает всасывание пищевого ХС и может приводить к определенной положительной динамике гистологических признаков НАЖБП. У пациентов с НАЖБП сохраняются благоприятные сердечно-сосудистые эффекты ингибиторов ГМГ-КоА-редуктазы при монотерапии и в комбинации с #эзетимибом [267]. По данным метаанализа 6 клинических исследований #эзетимиб снижал уровень трансаминаз и ГГТ, уменьшал стеатоз печени и баллонную дистрофию гепатоцитов, но не влиял на воспаление и фиброз [267]. В другом метаанализе #эзетимиб, напротив, снижал активность стеатогепатита, но не влиял на выраженность стеатоза [268]. Такие различия в выводах двух метаанализов могут быть продиктованы малым количеством исследований, в которых оценивалась гистологическая картина печени. В открытом РКИ ESSENTIAL комбинация #эзетимиба со ингибитором ГМГ-КоА-редуктазы уменьшала содержание жира в печени, оцененного методом МРТ-PDFF [269].
При применении комбинации #эзетимиба с #ингибиторами ГМГ-КоА-редуктазы также требуется контроль лабораторных показателей (АЛТ, АСТ). В случае повышения трансаминаз дальнейшее решение об отмене терапии (всей комбинации или только ингибиторы ГМГ-КоА-редуктазы) и (или) коррекции доз препаратов осуществляется в соответствии с инструкцией, актуальной для статинов. При развитии ЦП следует воздержаться от применения #эзетимиба при появлении признаков декомпенсации функции печени (класс B - C по Чайльд-Пью).
- Рекомендовано пациентам с НАЖБП и гипертриглицеридемией/АССЗ назначение #омега-3 кислот этиловые эфиры в дозе 4 г/сут с целью уменьшения уровня ТГ и стеатоза печени [276].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: #Омега-3 триглицериды, включая другие эфиры и кислоты (омега-3 ПНЖК) - препараты, применяемые для снижения уровня ТГ. В доклинических исследованиях была продемонстрирована способность #омега-3 триглицеридов, включая другие эфиры и кислоты уменьшать липогенез в печени и повышать чувствительность к инсулину [273]. В исследовании REDUCE-IT с участием 8179 пациентов было доказано положительное влияние эйкозапентаеновой кислоты (#омега-3 триглицериды, включая другие эфиры и кислоты) в сочетании со статином на "твердые" конечные точки - сердечно-сосудистые события [274]. В двойном слепом плацебо-контролируемом РКИ назначение эйкозапентаеновой кислоты (#омега-3 триглицериды, включая другие эфиры и кислоты) в дозе 2,4 г/сут у пациентов с НАЖБП хотя и не влияло на гистологические параметры НАСГ, но снижало уровень ТГ у пациентов по сравнению с плацебо без увеличения серьезных побочных эффектов [275]. В то же время в другом исследовании, в котором содержание жира в печени определялось с помощью магнитно-резонансной спектроскопии, позволяющей точнее оценить содержание жира в печени в целом, показано, что курс комбинацией #омега-3 кислот этиловые эфиры - комбинацией докозагексаеновой кислотой и эйкозапентаеновой кислоты в дозе 4 г/сут - уменьшал содержание жира в печени [276]. По данным метаанализов, #омега-3 триглицериды, включая другие эфиры и кислоты могут снизить содержание жира в печени, показатели печеночных ферментов и липидов крови [270 - 272].
Рекомендоваться может только лекарственный препарат #омега-3 кислот этиловые эфиры, так как биологически активные добавки, содержащие #омега-3 ПНЖК, не имеют утвержденных клинических показаний, доказанной терапевтической эффективности, фармацевтической и биологической эквивалентности и не могут быть использованы для замены рецептурных препаратов [277]. Доза и длительность применения препарата регулируется КР "Нарушения липидного обмена" [83].
- Рекомендуется назначение #фенофибрата** в дозе 145 - 200 мг/сут пациентам с НАЖБП и гипертриглицеридемией/АССЗ с целью снижения сердечно-сосудистого риска и уровня трансаминаз [83, 278].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Фибраты используются в лечении дислипидемии, при этом только #фенофибрат** может использоваться в комбинации со статинами. Существуют теоретические предпосылки и данные экспериментальных работ, согласно которым #фенофибрат** может оказывать позитивное влияние на НАЖБП [279]. Крупных исследований по изучению влияния фибратов на НАЖБП не проводилось. В небольшом РКИ с парными биопсиями 48-недельная терапия #фенофибратом** приводила к снижению доли пациентов с повышенным уровнем аминотрансфераз, глюкозы, ЩФ и ГГТ и уменьшению баллонной дегенерации без влияния на степень стеатоза, лобулярного воспаления, фиброза [278]. Исследования, изучавшие эффективность фибратов при дислипидемии в сочетании с НАЖБП, не показали увеличения побочных эффектов, а в отдельных, напротив, наблюдалось снижение трансаминаз [278 - 280].
При назначении #фенофибрата** в первый год терапии требуется контроль уровня трансаминаз и креатинина каждые 3 месяца, при совместном применении со статинами повышается риск рабдомиолиза.
- Рекомендуется рассмотреть дополнительное назначение фосфолипидов (эссенциальных фосфолипидов (ЭФЛ)) в дозе 1800 мг/сут пациентам с НАЖБП и наличием коморбидностей (дислипидемией, ожирением, СД 2-го типа) в составе комплексной терапии для повышения эффективности фармакотерапии [281, 282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В настоящее время накоплено большое количество исследований, посвященных применению ЭФЛ в лечении НАЖБП. Большинство из них - небольшого размера, тем не менее составляют научную базу применения указанного класса препаратов. ЭФЛ в исследованиях главным образом применяются в составе комплексной терапии: в сочетании с гипогликемической, гиполипидемической терапией, совместно с УДХК** или пробиотиками. Это объясняется тем, что ЭФЛ не только обладают собственной фармакологической активностью, но и являются биоэнхансерами (биопотенциаторами). При использовании в виде комплекса или совместном введении с другими лекарственными веществами они могут потенциально обеспечивать их более высокую биодоступность (фармакокинетический энхансинг), а следовательно, увеличение биологического эффекта (фармакодинамический энхансинг) [283, 284]. Адъювантное действие ЭФЛ продемонстрировано в наблюдательном исследовании, включающем 2843 пациента со стеатозом печени и кардиометаболической коморбидностью (СД 2-го типа, гиперхолестеринемия, АГ, ожирение или повышенная масса тела). У 69,6% пациентов после трехмесячного приема ЭФЛ и у 81,4% пациентов через 6 месяцев терапии произошло улучшение ультразвуковых характеристик состояния печени на фоне базисной фармакотерапии с добавлением препарата (1800 мг/сут) [281]. По результатам систематического обзора с метаанализом применение ЭФЛ в сочетании с гипогликемической терапией приводило к более значительному снижению уровня АЛТ, ХС и ТГ, а также улучшению ультразвуковой картины печени у пациентов с НАЖБП в сочетании с ожирением и СД 2-го типа, однако данный метаанализ отличается методологическими погрешностями [282].
Другие гиполипидемические средства (#ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK)) представляются перспективным препаратом при НАЖБП. Они могут оказывать благоприятное воздействие на течение НАЖБП, но качественных исследований пока не выполнялось. В небольшом РКИ у 40 пациентов с гетерозиготной семейной гиперлипидемией показано разрешение ранее диагностированных НАЖБП и НАСГ после 1 года лечения другими гиполипидемическими средствами (#ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK)) - #эволокумабом** или #алирокумабом**. Признаков стеатоза, воспаления и фиброза не было выявлено [285]. Другие гиполипидемические средства (#ингибиторы пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK)) считаются безопасными препаратами при НАЖБП [286], но требуется дальнейшее проведение исследований, посвященных эффективности и безопасности препаратов указанного класса у пациентов с НАЖБП.
3.3.4 Лечение НАЖБП в сочетании с хронической болезнью почек
Накапливается все больше данных, указывающих на ассоциацию НАЖБП и ХБП, ввиду общности факторов риска их развития, при этом имеются данные о независимой ассоциации между этими состояниями. Наличие НАЖБП ассоциировано с увеличением частоты развития протеинурии, более значительным снижением расчетной скорости клубочковой фильтрации (рСКФ), а также развитием и прогрессированием ХБП [287, 288]. У пациентов с СД 2-го типа наличие НАЖБП связано с повышенной частотой формирования ХБП вне зависимости от возраста, пола и АГ [289].
Факторы риска ХБП у лиц с НАЖБП, не связанные с функцией печени, включают пожилой возраст, СД, АГ, исходно сниженную расчетную скорость клубочковой фильтрации, курение, нарушение функции щитовидной железы (гипотиреоз в связи с накоплением жира, гипертиреоз в связи с образованием активных форм кислорода), употребление алкоголя. В развитие ХБП у пациентов с НАЖБП вовлечен ряд факторов, ключевым из которых является системное низкоинтенсивное воспаление, которое запускается по нескольким воспалительным каскадам [290 - 294].
- Рекомендовано применение блокаторов ренин-ангиотензин-альдостероновой системы (РААС) (ингибиторов ангиотензинпревращающего фермента (иАПФ)) и антагонистов рецепторов ангиотензина II (АРА II)) пациентам с НАЖБП и ХБП с целью замедления прогрессирования нарушений функции почек и предотвращения прогрессирования НАСГ [295, 296].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: В предварительных исследованиях было показано позитивное влияние #лозартана**, #телмисартана и #валсартана на гистологические показатели некровоспаления и лабораторные маркеры при НАСГ, при этом #телмисартан был эффективнее, чем #валсартан [297 - 299]. Влияние блокады РААС с использованием иАПФ и АРА II на течение НАЖБП оценивалось также в небольших РКИ. В частности, в небольшом открытом сравнительном исследовании с участием пациентов с НАЖБП, СД и АГ терапия АРА II #телмисартаном, обладающим также агонизмом в отношении рецепторов PPAR (Peroxisome Proliferator-Activated Receptor), приводила к снижению содержания жира в печени, оцененного по данным КТ, и снижению уровня СЖК в сыворотке крови по сравнению с #лозартаном** [296]. В другом исследовании длительное (более 1 года) применение иАПФ или АРА II у пациентов с ХБП C3 стадии, терминальной ХБП и после трансплантации почки было ассоциировано с меньшей частотой НАЖБП и меньшей жесткостью печени по сравнению с пациентами, не принимавшими эти препараты [293]. На экспериментальных моделях была показана способность иАПФ и АРА II ингибировать фиброгенез печени [300]. В когортном исследовании, включавшем 12 327 пациентов с НАЖБП, получавших иАПФ или АРА II, с наблюдением в течение как минимум 5 лет, при приеме иАПФ, но не АРА II, наблюдалось снижение событий, связанных с печенью (рак печени и осложнения цирроза), причем с  снижением их количества у пациентов с ХБП, чем без него [295].
снижением их количества у пациентов с ХБП, чем без него [295].
- Рекомендовано применение ингибиторов натрийзависимого переносчика глюкозы 2-го типа (ИНПГ-2) (#дапаглифлозина**, #эмпаглифлозина**) пациентам с НАЖБП и ХБП независимо от наличия СД 2-го типа с целью замедления прогрессирования нарушений функции почек, снижения риска сердечно-сосудистых осложнений и уменьшения содержания жира в печени [301].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Ингибиторы натрийзависимого переносчика глюкозы 2-го типа уменьшают афферентную артериолярную вазоконстрикцию и могут обеспечивать нефропротекцию за счет уменьшения клубочковой гиперфильтрации, предотвращения окислительного стресса и воспаления в клетках проксимальных канальцев, а также других механизмов [303, 304]. Оценка нефропротективного потенциала продемонстрировала, что у больных ХБП #дапаглифлозин** в сравнении с плацебо способен уменьшать комбинированный риск стойкого снижения расчетной скорости клубочковой фильтрации не менее чем на 50%, развития терминальной стадии заболевания почек или смерти от почечных или сердечно-сосудистых причин независимо от состояния углеводного обмена и функции почек. Кроме того, лечение #дапаглифлозином** было ассоциировано со снижением кардиоваскулярной смертности и госпитализаций по поводу ХСН, а также смертности от всех причин [305].
Назначение #эмпаглифлозина** больным ХБП, в свою очередь, приводило к улучшению комбинированного исхода - риска прогрессирования заболевания почек или смерти от сердечно-сосудистых причин как у пациентов с СД, так и без него [306].
Рекомендации по лечению ХБП рекомендуют включение ингибиторов натрийзависимого переносчика глюкозы 2-го типа у пациентов с ХБП и СД 2-го типа для снижения риска прогрессирования ХБП и кардиоваскулярных событий [92]. Влияние ингибиторов натрийзависимого переносчика глюкозы 2-го типа на течение НАЖБП подробно описано в разделе 3.3.1 "НАЖБП в сочетании с СД 2-го типа".
- Рекомендовано применение аналогов глюкагоноподобного пептида-1 (GLP-1) (#лираглутид, #дулаглутид, #семаглутид**) пациентам с НАЖБП и ХБП на фоне СД 2-го типа с целью замедления прогрессирования нарушений функции почек, снижения риска кардиоваскулярных событий и лабораторных показателей воспаления печени [92, 307].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1).
Комментарии: Нефропротекторное действие аналогов глюкагоноподобного пептида-1 (GLP-1) (#лираглутид, #дулаглутид, #семаглутид**) реализуется за счет многочисленных прямых и непрямых механизмов, включающих стимуляцию натрийуреза в проксимальных канальцах, активацию циклической аденозинмонофосфат-зависимой протеинкиназы A (cAMP/PKA), восстановление эндотелий-зависимого расслабления почечных сосудов, нормализацию тубулогломерулярной обратной связи (через снижение активности натрий-водородного переносчика (NHE3)), уменьшение выраженности ренальной гипоксии и др. [308]. Эти препараты способны в первую очередь предотвращать возникновение макроальбуминурии и в меньшей степени уменьшать снижение расчетной скорости клубочковой фильтрации у пациентов, страдающих СД 2-го типа.
В плацебо-контролируемых исследованиях лираглутида (LEADER) через 3,8 года лечения и #семаглутида** (SUSTAIN-6) через 2,1 года лечения удалось достигнуть значимого снижения конечной комбинированной почечной точки (развитие макроальбуминурии, удвоение креатинина, инициация заместительной почечной терапии или почечная смерть) у пациентов с СД 2-го типа, преимущественно страдающих АССЗ [309, 310]. Схожий эффект по снижению риска развития комбинированной конечной почечной точки (ренальные исходы как часть микроваскулярных исходов) продемонстрировал #дулаглутид (исследование REWIND с медианой наблюдения 5,4 года) в первую очередь за счет уменьшения развития макроальбуминурии [311]. Однако по способности предотвращать развитие почечных осложнений и снижать риск госпитализаций при ХСН эти препараты, по-видимому, уступают ингибиторам натрийзависимого переносчика глюкозы 2-го типа [312].
В КР по лечению ХБП предлагается включение аналогов глюкагоноподобного пептида-1 (GLP-1) у пациентов с ХБП и СД 2-го типа в схему лечения для снижения риска прогрессирования ХБП и кардиоваскулярных событий [92]. Влияние аналогов глюкагоноподобного пептида-1 (GLP-1) на течение НАЖБП подробно описано в разделе 3.3.1 "НАЖБП в сочетании с СД 2-го типа".
3.3.5 НАЖБП в сочетании с избыточным употреблением алкоголя
Предложенные в 80-х гг. XX в. термины НАЖБП, НАСГ и их критерии подразумевали строгое исключение алкогольного фактора [313, 314]. В дальнейшем стало ясно, что возможен сочетанный генез жировой болезни печени, а избыточный прием алкоголя пациентом с кардиометаболическими факторами риска (метаболической дисфункцией) потенцирует прогрессирование стеатогепатита. В связи с этим в 2023 г. предложено выделить новую форму - МАЖБП в сочетании с употреблением избыточного употребления алкоголя (МетАБП) [2, 5].
- Рекомендовано пациентам с НАЖБП, употреблявшим избыточное количество алкоголя, полностью прекратить его прием с целью предотвращения прогрессирования фиброза и развития ГЦР [141, 315, 316].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарии: Употребление алкоголя негативно влияет на течение и прогноз стеатогепатита у лиц с метаболическим фоном, а злоупотребление им однозначно неблагоприятно влияет на течение НАЖБП. В крупном когортном исследовании с длительным периодом наблюдения общая смертность была значительно выше среди лиц с НАЖБП и чрезмерным потреблением алкоголя в сравнении с умеренно потреблявшими алкоголь [317]. В проспективном клиническом исследовании эпизодическое злоупотребление алкоголем хотя бы 1 раз в месяц было взаимосвязано со значительным прогрессированием фиброза при НАСГ [318].
Несмотря на то, что ранее в отдельных метаанализах предполагалось протективное влияние умеренных и малых доз алкоголя на НАЖБП [319, 320], многие включенные в них работы были методологически несовершенны. Установлено, что как умеренное, так и малое употребление алкоголя неблагоприятно сказывается на развитии фиброза при НАСГ [321, 322]. Кроме того, у лиц, употреблявших алкоголь в умеренных дозах, отмечалась меньшая редукция степени стеатоза и более низкие шансы разрешения НАСГ по сравнению с вовсе не употребляющими [315]. Даже умеренное употребление алкоголя повышает риск развития ГЦР у пациентов с НАСГ [316]. Систематический обзор 6 продольных наблюдательных когортных исследований показал, что любой уровень употребления алкоголя связан с ухудшением состояния печени при НАЖБП [141].
- Рекомендовано рассмотреть назначение адеметионина** пациентам с НАЖБП в сочетании с алкогольным фактором повреждения печени для улучшения прогноза заболевания [323].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Адеметионин** широко используется в лечении алкогольной болезни печени и в РКИ показал повышение выживаемости у пациентов с алкогольным ЦП классов A и B по Чайльд-Пью [324, 325]. По мнению экспертов, адеметионин** может применяться и для лечения пациентов с НАЖБП с таким сопутствующим фактором риска, как избыточное употребления алкоголя [323].
3.4 Хирургическое лечение
Хирургическое лечение ожирения рассматривается у пациентов с НАЖБП и ИМТ > 35 кг/м2 при неэффективности консервативных методов лечения ожирения в сочетании с НАЖБП.
Кроме того, у пациентов с ЦП вследствие НАСГ может выполняться трансплантация печени, а также могут осуществляться хирургические вмешательства по поводу портальной гипертензии, но эти аспекты рассматриваются в КР "Фиброз и цирроз печени", и их проведение не имеет особенностей при данной этиологии ЦП.
- Рекомендовано рассмотреть хирургическое бариатрическое лечение для снижения массы тела, уменьшения стеатоза, воспаления и фиброза в печени, уменьшения метаболических осложнений у пациентов с ИМТ > 35 кг/м2 и НАЖБП, которые не достигли положительного результата на фоне изменения образа жизни и (или) фармакотерапии [174, 175, 326, 327].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Бариатрическая хирургия может уменьшить стеатоз, воспаление и фиброз печени, обеспечить устойчивое снижение массы тела до 30%, лечение СД 2-го типа и снижение заболеваемости и смертности от всех причин. Бариатрическое лечение не противопоказано больным ожирением и НАЖБП или НАСГ (без верифицированного цирроза), однако данные о возможности проведения пациентам с ЦП ограничены [1, 174]. По данным метаанализа, включавшего 32 когортных исследования и оценку 3093 биоптатов, бариатрическое хирургическое вмешательство привело к снижению активности воспаления в печени, а также разрешению стеатоза и фиброза (у 66 и 40% пациентов соответственно). При этом у значительно меньшей части пациентов (12%) после бариатрической операции наблюдалось ухудшение гистологических характеристик НАЖБП [328]. В другом метаанализе наблюдалось уменьшение стеатоза у 88%, а фиброза - у 30% пациентов [329]. Наиболее поздний метаанализ, включавший 37 клинических исследований, показывает подтвержденное биопсией печени уменьшение стеатоза у 56% пациентов, воспаления - у 45% и фиброза - у 25% пациентов после бариатрической операции. При этом шунтирование желудка по Py оказывает наибольшую эффективность в плане снижения стеатоза, а рукавная гастрэктомия - с точки зрения регрессии фиброза [330].
Показания и метод бариатрического вмешательства должны определятся в индивидуальном порядке мультидисциплинарной командой, включающей врача-хирурга.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфические меры реабилитации пациентов с НАЖБП отсутствуют. Может быть рекомендовано санаторно-курортное лечение по профилю гастроэнтерологии с применением физиотерапевтических процедур, регулярная физическая активность, прогулки на свежем воздухе, отказ от употребления алкоголя.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
В профилактических мероприятиях следует рассмотреть следующие направления:
- профилактика формирования НАЖБП;
- своевременное выявление НАЖБП и НАСГ;
- профилактика прогрессирования НАЖБП/НАСГ до ЦП;
- профилактика ГЦР.
Пациенты с НАЖБП должны находиться под наблюдением смежных специалистов в зависимости от профиля коморбидности (гастроэнтерологи, эндокринологи, кардиологи, диетологи). Врачебные усилия должны быть направлены на профилактику как самой НАЖБП, так и ассоциированных с НАЖБП кардиометаболических заболеваний.
- Рекомендуется при подозрении на НАЖБП осмотр врача-терапевта, или врача общей практики, или врача-гастроэнтеролога с целью установления диагноза, назначения обследования и лечения [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Для профилактики развития НАЖБП рекомендованы мероприятия, направленные на формирование здорового образа жизни, коррекцию пищевых привычек, физическую активность, отказ от приема алкоголя [331].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с факторами кардиометаболического риска без диагноза НАЖБП рекомендуется скрининговое обследование (определение тромбоцитов, АЛТ, АСТ в сыворотке крови, УЗИ органов брюшной полости, расчет FIB-4) для своевременного выявления НАЖБП 1 раз в 3 - 5 лет [332].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: Диагноз НАЖБП предполагает наличие факторов кардиометаболического риска, в основе которых лежит метаболическая дисфункция. Соответственно, пациенты с ее любыми проявлениями (ожирение, дислипидемия, СД 2-го типа и т.п.) рассматриваются как группа риска развития НАЖБП. У большинства пациентов НАЖБП протекает бессимптомно или сопровождается неспецифическими симптомами, это часто приводит к тому, что заболевание остается нераспознанным. Оптимальная частота диспансерного наблюдения не установлена, но, согласно мнению европейских экспертов, пациенты с метаболическими факторами риска без признаков НАЖБП должны наблюдаться 1 раз в 3 - 5 лет [332].
- Рекомендуется диспансерное наблюдение 1 раз в 2 года пациентам с НАЖБП без лабораторных или инструментальных признаков прогрессирующего течения/фиброза, без СД 2-го типа и с одним фактором кардиометаболического риска с оценкой неинвазивных индексов фиброза (FIB-4) для своевременного выявления прогрессии заболевания [332].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: По данным метаанализа клинических исследований, сопровождавшихся парными биопсиями, у 1/3 пациентов с НАЖБП наблюдается прогрессирование фиброза, при этом его прогрессирование от стадии F0 до F1 происходит в среднем за 14,3 года при исходном простом стеатозе и за 7,1 года - при НАСГ [4]. Оптимальная частота диспансерного наблюдения не установлена, но согласно мнению европейских экспертов, пациенты с НАЖБП без лабораторных или инструментальных признаков прогрессирующего течения должны наблюдаться 1 раз в 2 года [332].
- Рекомендуется диспансерное наблюдение 1 раз в 1 год пациентам с НАЖБП с предиабетом, СД 2-го типа и более чем двумя факторами кардиометаболического риска, а также при лабораторных или инструментальных признаках прогрессирующего течения (фиброза) с оценкой неинвазивных индексов фиброза (FIB-4) для своевременного выявления и оценки прогрессии заболевания [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: СД 2-го типа и другие факторы кардиометаболического риска способствуют прогрессирующему течению НАЖБП и развитию НАСГ. Примерно у 1/4 пациентов со сформировавшимся НАСГ заболевание прогрессирует до цирроза с риском развития ГЦР [65]. По мнению экспертов, у пациентов с СД 2-го типа или несколькими факторами кардиометаболического риска оценка возможного развития/прогрессирования фиброза должна выполняться 1 раз в 1 - 2 года [1].
- Пациентам с НАЖБП рекомендуется изменение образа жизни (коррекция питания, увеличение физической активности) для профилактики прогрессирования НАЖБП, развития и прогрессирования коморбидных состояний [130, 216, 333].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1).
Комментарии: Меры по изменению образа жизни, подробно рассмотренные в разделе 3.1 "Немедикаментозная терапия НАЖБП", не только служат для лечения НАЖБП, но и относятся к наиболее эффективной мере ее предотвращения и прогрессирования, а также позитивно влияют на большинство коморбидных состояний [129, 216].
Необходимо отметить, что отсутствие однозначного мнения по возможности немедикаментозной профилактики прогрессии НАЖБП связаны с относительной краткосрочностью проводившихся рандомизированных исследований - 1 - 2 года, в то время как убедительные данные для выявления различий в смертности между людьми с НАЖБП и населением могут быть получены при наблюдении от 8 до 28 лет [152]. Тем не менее изменение образа жизни в настоящее время следует считать основным методом предотвращения неблагоприятного течения заболевания.
- Пациентам с НАЖБП рекомендуется медикаментозная и немедикаментозная коррекция коморбидных состояний для профилактики неблагоприятного течения НАЖБП [334].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: НАЖБП и многие коморбидные заболевания взаимно друг друга отягощают. Это позволяет считать, что коррекция коморбидных заболеваний может оказать положительное воздействие на предотвращение неблагоприятного течения НАЖБП [334]. Имеются данные, что отдельные лекарственные средства, используемые в лечении НАЖБП в сочетании с СД и дислипидемией, снижают риск развития ГЦР. Так, согласно данным нескольких метаанализов, #метформин** способен снижать риск развития ГЦР примерно на 50% независимо от этиологии заболеваний печени [335 - 337]. В метаанализе 10 исследований, включавших 4298 пациентов с ГЦР в общей популяции из 1 459 417 пациентов, применение статинов было связано со значительным снижением риска развития данной опухоли, особенно в азиатских популяциях [338]. При интерпретации полученных данных следует учитывать, что  часть этих исследований не была ориентирована на пациентов с НАЖБП/НАСГ.
часть этих исследований не была ориентирована на пациентов с НАЖБП/НАСГ.
- Пациентам с НАЖБП на стадии выраженного фиброза (F3) или цирроза рекомендовано проведение УЗИ органов брюшной полости 1 раз в 6 месяцев с целью скрининга ГЦР [339, 340].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Доля ГЦР, обусловленного НАЖБП, растет в последние десятилетия и составляет уже 15% всех случаев ГЦР с частотой выявления 0,44 на 1000 человеко-лет (0,29 - 0,66) в когорте больных НАЖБП [341 - 343]. Наиболее часто ГЦР развивается на стадии выраженного фиброза и ЦП вследствие НАСГ, но может возникать и при простом стеатозе [344 - 346].
Считается, что риск развития ГЦР при НАЖБП наиболее высок у пациентов с СД, в пожилом возрасте и при одновременном употреблении алкоголя, а также имеющих полиморфизм гена PNPLA3 I148M (rs738409) [340]. Пациенты с высоким риском развития ГЦР должны быть включены в группы постоянного наблюдения [340]. Показано, что пациенты с НАСГ - ЦП, не участвовавшие в программе скрининга ГЦР, с большей вероятностью имели более продвинутую стадию рака, чем участвовавшие в скрининговой программе [347].
Пациенты с НАЖБП - ГЦР, как правило, имеют более низкие уровни альфа-фетопротеина, чем пациенты с вирусным ГЦР [348].
Наблюдение за пациентами должно включать регулярное проведение УЗИ брюшной полости 1 раз в 6 месяцев [339, 340]. Эффективность УЗИ в выявлении ГЦР составляет 94%, а в выявлении ранней ГЦР - 63% [339].
Необходимость наблюдения за пациентами с НАЖБП без цирроза пока не определена [340].
- Пациентам с НАЖБП рекомендуется отказ от употребления алкоголя и табакокурения для снижения риска развития ГЦР [316, 349].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: В 2/3 случаев ГЦР выявляется несколько факторов риска его развития, при этом алкоголь и табакокурение служат доказанными факторами риска. Показано повышение риска развития ГЦР у пациентов с НАЖБП употребляющих алкоголь [316], а также курящих [349]. Наиболее актуальна эта рекомендация для пациентов с выраженным фиброзом и циррозом, поскольку риск развития у них ГЦР наиболее высок [344 - 346].
- Рекомендуется скрининговое обследование родственников 1-й степени родства пациентов с выраженным фиброзом и ЦП вследствие НАСГ для своевременного выявления НАЖБП и прогрессирующего фиброза печени [1].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: У родственников 1-й степени родства пациентов с ЦП вследствие НАСГ в 12 раз повышен риск развития выраженного фиброза печени [350].
- Пациентам с НАЖБП в отсутствие противопоказаний рекомендуется регулярное употребление кофе для снижения риска развития фиброза и ГЦР [351 - 353].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: По данным ряда метаанализов регулярное потребление кофе ассоциировано со снижением выраженности фиброза при НАЖБП [354 - 357]. По данным других метаанализов и крупных эпидемиологических исследований кофе снижал риск не только развития фиброза при НАЖБП, но и возникновения собственно НАЖБП [351, 352, 358]. Кроме того, показано, что употребление кофе ассоциировано со снижением риска развития ГЦК [353].
Протективные свойства кофе по отношению к НАЖБП и ГЦР сохраняются независимо от наличия в нем кофеина. В ряде эпидемиологических исследований, проведенных в разных популяциях, и метаанализе "доза - реакция" был продемонстрирован дозозависимый эффект кофе для предотвращения ГЦК [359 - 362]. Однако неясно, какая ежедневная доза кофе является оптимальной.
6. Организация оказания медицинской помощи
Большинство пациентов с НАЖБП подлежат наблюдению и лечению в амбулаторных условиях.
Показания к экстренной госпитализации при НАЖБП отсутствуют.
Показаниями к плановой госпитализации пациентов с НАЖБП служат:
- отсутствие эффекта от лечения на амбулаторном этапе или нетипичное течение заболевания;
- необходимость проведения диагностических процедур, которые не могут быть выполнены в амбулаторном порядке (например, биопсия печени);
- необходимость проведения дифференциально-диагностических мероприятий для исключения других причин поражения печени, которые не могут быть выполнены в амбулаторном порядке (например, биопсии печени);
- сочетание НАЖБП с кардиометаболическими состояниями, осложняющими течение заболевания, требующее мультидисциплинарного ведения пациента и (или) круглосуточного наблюдения.
Критерии выписки из стационара: выполнение запланированных диагностических\дифференциально-диагностических мероприятий.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
N
Критерий качества
Оценка выполнения
1
Выполнен прием (осмотр, консультация) врача-гастроэнтеролога или врача-терапевта первичный
Да/нет
2
Проведена оценка кардиометаболических факторов риска
Да/нет
3
Проведен общий (клинический) анализ крови
Да/нет
4
Проведен биохимический общетерапевтический анализ крови (АЛТ, АСТ, ЩФ, ГГТ, глюкоза, общий билирубин, креатинин, общий ХС, ХС ЛПНП, ХС ЛПВП, ТГ)
Да/нет
5
Выполнено УЗИ органов брюшной полости (комплексное)
Да/нет
6
Выполнены расчет ИМТ, измерение окружности талии.
Да/нет
7
Выполнен расчет FIB-4 или NF S
Да/нет
8
Выполнено назначение рекомендаций по изменению образа жизни (питанию, физической активности)
Да/нет
9
Назначен повторный осмотр врача-терапевта или врача общей практики или врача-гастроэнтеролога (диспансерное наблюдение) через 2 года пациентам с НАЖБП без лабораторных или инструментальных признаков прогрессирующего течения/фиброза, без СД 2-го типа и с 1 фактором кардиометаболического риска или через 1 год при наличии этих признаков, СД 2 типа, предиабета, 2-мя и более кардиометаболическими факторами риска.
Да/нет
Список литературы
1. Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, Abdelmalek MF, Caldwell S, Barb D et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023; 77(5): 1797 - 1835. https://doi.org/10.1097/HEP.0000000000000323
2. Rinella ME, Lazarus JV, Ratziu V, Francque SM, Sanyal AJ, Kanwal F et al. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023; 78(6): 1966 - 1986. https://doi.org/10.1097/HEP.0000000000000520.
3. ICD-11. International Classification of Diseases 11th Revision. Available at: https://icd.who.int.
4. Singh S, Allen AM, Wang Z, Prokop LJ, Murad MH, Loomba R. Fibrosis progression in nonalcoholic fatty liver vs nonalcoholic steatohepatitis: a systematic review and meta-analysis of paired-biopsy studies. Clin Gastroenterol Hepatol. 2015; 13(4): 643 - 654. e1 - 9. https://doi.org/10.1016/j.cgh.2014.04.014.
5. Райхельсон К.Л., Маевская М.В., Жаркова М.С., Гречишникова В.Р., Оковитый С.В., Деева Т.А., Марченко Н.В., Прашнова М.К., Ивашкин В.Т. Жировая болезнь печени: новая номенклатура и ее адаптация в Российской Федерации. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2024; 34(2): 35 - 44. https://doi.org/10.22416/1382-4376-2024-34-2-35-44
6. Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998; 114(4): 842 - 845. https://doi.org/10.1016/s0016-5085(98)70599-2.
7. Byrne CD, Targher G. NAFLD: a multisystem disease. J Hepatol. 2015; 62 (Suppl. 1): S47 - 64. https://doi.org/10.1016/j.jhep.2014.12.012.
8. Xian YX, Weng JP, Xu F. MAFLD vs. NAFLD: shared features and potential changes in epidemiology, pathophysiology, diagnosis, and pharmacotherapy. Chin Med J (Engl). 2020; 134(1): 8 - 19. https://doi.org/10.1097/CM9.0000000000001263.
9. Parthasarathy G, Revelo X, Malhi H. Pathogenesis of Nonalcoholic Steatohepatitis: An Overview. Hepatol Commun. 2020; 4(4): 478 - 492. https://doi.org/10.1002/hep4.1479.
10. Haas JT, Francque S, Staels B. Pathophysiology and Mechanisms of Nonalcoholic Fatty Liver Disease. Annu Rev Physiol. 2016; 78: 181 - 205. https://doi.org/10.1146/annurev-physiol-021115-105331.
11. Basaranoglu M, Basaranoglu G, Bugianesi E. Carbohydrate intake and nonalcoholic fatty liver disease: fructose as a weapon of mass destruction. Hepatobiliary Surg Nutr. 2015; 4(2): 109 - 116. https://doi.org/10.3978/j.issn.2304-3881.2014.11.05.
12. Jensen T, Abdelmalek MF, Sullivan S, Nadeau KJ, Green M, Roncal C et al. Fructose and sugar: A major mediator of non-alcoholic fatty liver disease. J Hepatol. 2018; 68(5): 1063 - 1075. https://doi.org/10.1016/j.jhep.2018.01.019.
13. Birkenfeld AL, Shulman GI. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes. Hepatology. 2014; 59(2): 713 - 723. https://doi.org/10.1002/hep.26672.
14. Ipsen DH, Lykkesfeldt J, Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell Mol Life Sci. 2018; 75(18): 3313 - 3327. https://doi.org/10.1007/s00018-018-2860-6.
15. Lambert JE, Ramos-Roman MA, Browning JD, Parks EJ. Increased de novo lipogenesis is a distinct characteristic of inpiduals with nonalcoholic fatty liver disease. Gastroenterology. 2014; 146(3): 726 - 735. https://doi.org/10.1053/j.gastro.2013.11.049.
16. Ter Horst KW, Serlie MJ. Fructose Consumption, Lipogenesis, and Non-Alcoholic Fatty Liver Disease. Nutrients. 2017; 9(9): 981. https://doi.org/10.3390/nu9090981.
17. Shen J, Sakaida I, Uchida K, Terai S, Okita K. Leptin enhances TNF-alpha production via p38 and JNK MAPK in LPS-stimulated Kupffer cells. Life Sci. 2005; 77(13): 1502 - 1515. https://doi.org/10.1016/j.lfs.2005.04.004.
18. Subichin M, Clanton J, Makuszewski M, Bohon A, Zografakis JG, Dan A. Liver disease in the morbidly obese: a review of 1000 consecutive patients undergoing weight loss surgery. Surg Obes Relat Dis. 2015; 11(1): 137 - 141. https://doi.org/10.1016/j.soard.2014.06.015.
19. Sasaki A, Nitta H, Otsuka K, Umemura A, Baba S, Obuchi T, Wakabayashi G. Bariatric surgery and non-alcoholic Fatty liver disease: current and potential future treatments. Front Endocrinol (Lausanne). 2014; 5: 164. https://doi.org/10.3389/fendo.2014.00164.
20.  S,
S,  M,
M,  L,
L,  Duvnjak L, Duvnjak M. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2014; 20(48): 18070 - 18091. https://doi.org/10.3748/wjg.v20.i48.18070.
Duvnjak L, Duvnjak M. Adipokines and proinflammatory cytokines, the key mediators in the pathogenesis of nonalcoholic fatty liver disease. World J Gastroenterol. 2014; 20(48): 18070 - 18091. https://doi.org/10.3748/wjg.v20.i48.18070.
21. Osborn O, Olefsky JM. The cellular and signaling networks linking the immune system and metabolism in disease. Nat Med. 2012; 18(3): 363 - 374. https://doi.org/10.1038/nm.2627.
22. Yan FJ, Wang X, Wang SE, Hong HT, Lu J, Ye Q et al.  axis mediates hepatic inflammation and lipid accumulation in NAFLD. Biochem J. 2020; 477(3): 691 - 708. https://doi.org/10.1042/BCJ20190799.
axis mediates hepatic inflammation and lipid accumulation in NAFLD. Biochem J. 2020; 477(3): 691 - 708. https://doi.org/10.1042/BCJ20190799.
23. Jin S, Li Y, Xia T, Liu Y, Zhang S, Hu H et al. Mechanisms and therapeutic implications of selective autophagy in nonalcoholic fatty liver disease. J Adv Res. 2024:S2090-1232(24)00041-9. https://doi.org/10.1016/j.jare.2024.01.027.
24. Prerna K, Dubey VK. Beclin1-mediated interplay between autophagy and apoptosis: New understanding. Int J Biol Macromol. 2022; 204: 258 - 273. https://doi.org/10.1016/j.ijbiomac.2022.02.005.
25. Fromenty B, Roden M. Mitochondrial alterations in fatty liver diseases. J Hepatol. 2023; 78(2): 415 - 429. https://doi.org/10.1016/j.jhep.2022.09.020.
26. ![]() P, Foufelle F. SREBP-1c transcription factor and lipid homeostasis: clinical perspective. Horm Res. 2007; 68(2): 72 - 82. https://doi.org/10.1159/000100426.
P, Foufelle F. SREBP-1c transcription factor and lipid homeostasis: clinical perspective. Horm Res. 2007; 68(2): 72 - 82. https://doi.org/10.1159/000100426.
27. Miserez AR, Muller PY, Barella L, Barella S, Staehelin HB, Leitersdorf E et al. Sterol-regulatory element-binding protein (SREBP)-2 contributes to polygenic hypercholesterolaemia. Atherosclerosis. 2002; 164(1): 15 - 26. https://doi.org/10.1016/s0021-9150(01)00762-6.
28. Iizuka K, Takao K, Yabe D. ChREBP-Mediated Regulation of Lipid Metabolism: Involvement of the Gut Microbiota, Liver, and Adipose Tissue. Front Endocrinol (Lausanne). 2020; 11: 587189. https://doi.org/10.3389/fendo.2020.587189.
29. Ma M, Xie W, Li X. Identification of Autophagy-Related Genes in the Progression from Non-Alcoholic Fatty Liver to Non-Alcoholic Steatohepatitis. Int J Gen Med. 2021; 14: 3163 - 3176. https://doi.org/10.2147/IJGM.S317785.
30. Barrientos-Riosalido A, Real M, Bertran L, Aguilar C,  S, Parada D et al. Increased Hepatic ATG7 mRNA and ATG7 Protein Expression in Nonalcoholic Steatohepatitis Associated with Obesity. Int J Mol Sci. 2023; 24(2): 1324. https://doi.org/10.3390/ijms24021324.
S, Parada D et al. Increased Hepatic ATG7 mRNA and ATG7 Protein Expression in Nonalcoholic Steatohepatitis Associated with Obesity. Int J Mol Sci. 2023; 24(2): 1324. https://doi.org/10.3390/ijms24021324.
31. Syed-Abdul MM. Lipid Metabolism in Metabolic-Associated Steatotic Liver Disease (MASLD). Metabolites. 2023; 14(1): 12. https://doi.org/10.3390/metabo14010012.
32.  M,
M, ![]() M,
M,  T,
T,  V,
V,  N,
N,  A et al. New Therapeutic Approaches for the Treatment of Patients with Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) and Increased Cardiovascular Risk. Diagnostics (Basel). 2024; 14(2): 229. https://doi.org/10.3390/diagnostics14020229.
A et al. New Therapeutic Approaches for the Treatment of Patients with Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD) and Increased Cardiovascular Risk. Diagnostics (Basel). 2024; 14(2): 229. https://doi.org/10.3390/diagnostics14020229.
33. Zhao Y, Zhou Y, Wang D, Huang Z, Xiao X, Zheng Q et al. Mitochondrial Dysfunction in Metabolic Dysfunction Fatty Liver Disease (MAFLD). Int J Mol Sci. 2023; 24(24): 17514. https://doi.org/10.3390/ijms242417514.
34. Chen Z, Tian R, She Z, Cai J, Li H. Role of oxidative stress in the pathogenesis of nonalcoholic fatty liver disease. Free Radic Biol Med. 2020; 152: 116 - 141. https://doi.org/10.1016/j.freeradbiomed.2020.02.025.
35. Thomson AW, Knolle PA. Antigen-presenting cell function in the tolerogenic liver environment. Nat Rev Immunol. 2010; 10(11): 753 - 766. https://doi.org/10.1038/nri2858.
36. Lotze MT, Zeh HJ, Rubartelli A, Sparvero LJ, Amoscato AA, Washburn NR et al. The grateful dead: damage-associated molecular pattern molecules and reduction/oxidation regulate immunity. Immunol Rev. 2007; 220: 60 - 81. https://doi.org/10.1111/j.1600-065X.2007.00579.x.
37. Szabo G, Csak T. Inflammasomes in liver diseases. J Hepatol. 2012; 57(3): 642 - 654. https://doi.org/10.1016/j.jhep.2012.03.035.
38. Luedde T, Schwabe RF. ![]() in the liver - linking injury, fibrosis and hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol. 2011; 8(2): 108 - 118. https://doi.org/10.1038/nrgastro.2010.213.
in the liver - linking injury, fibrosis and hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol. 2011; 8(2): 108 - 118. https://doi.org/10.1038/nrgastro.2010.213.
39. Klein I, Cornejo JC, Polakos NK, John B, Wuensch SA, Topham DJ et al. Kupffer cell heterogeneity: functional properties of bone marrow derived and sessile hepatic macrophages. Blood. 2007; 110(12): 4077 - 4085. https://doi.org/10.1182/blood-2007-02-073841.
40. Fang YL, Chen H, Wang CL, Liang L. Pathogenesis of non-alcoholic fatty liver disease in children and adolescence: From "two hit theory" to "multiple hit model". World J Gastroenterol. 2018; 24(27): 2974 - 2983. https://doi.org/10.3748/wjg.v24.i27.2974.
41. Tomita K, Tamiya G, Ando S, Ohsumi K, Chiyo T, Mizutani A et al. Tumour necrosis factor alpha signalling through activation of Kupffer cells plays an essential role in liver fibrosis of non-alcoholic steatohepatitis in mice. Gut. 2006; 55(3): 415 - 424. https://doi.org/10.1136/gut.2005.071118.
42. Kremer M, Hines IN, Milton RJ, Wheeler MD. Favored T helper 1 response in a mouse model of hepatosteatosis is associated with enhanced T cell-mediated hepatitis. Hepatology. 2006; 44(1): 216 - 227. https://doi.org/10.1002/hep.21221.
43. Ghazarian M, Revelo XS, ![]() MK, Luck H, Zeng K, Lei H et al. Type I Interferon Responses Drive Intrahepatic T cells to Promote Metabolic Syndrome. Sci Immunol. 2017; 2(10): eaai7616. https://doi.org/10.1126/sciimmunol.aai7616.
MK, Luck H, Zeng K, Lei H et al. Type I Interferon Responses Drive Intrahepatic T cells to Promote Metabolic Syndrome. Sci Immunol. 2017; 2(10): eaai7616. https://doi.org/10.1126/sciimmunol.aai7616.
44. Wang M, Li L, Xu Y, Du J, Ling C. Roles of hepatic stellate cells in NAFLD: From the perspective of inflammation and fibrosis. Front Pharmacol. 2022; 13: 958428. https://doi.org/10.3389/fphar.2022.958428.
45. Li Z, Yuan H, Chu H, Yang L. The Crosstalk between Gut Microbiota and Bile Acids Promotes the Development of Non-Alcoholic Fatty Liver Disease. Microorganisms. 2023; 11(8): 2059. https://doi.org/10.3390/microorganisms11082059.
46. Clemente MG, Mandato C, Poeta M, Vajro P. Pediatric non-alcoholic fatty liver disease: Recent solutions, unresolved issues, and future research directions. World J Gastroenterol. 2016; 22(36): 8078 - 8093. https://doi.org/10.3748/wjg.v22.i36.8078.
47. Ulluwishewa D, Anderson RC, McNabb WC, Moughan PJ, Wells JM, Roy NC. Regulation of tight junction permeability by intestinal bacteria and dietary components. J Nutr. 2011; 141(5): 769 - 776. https://doi.org/10.3945/jn.110.135657.
48. Paolella G, Mandato C, Pierri L, Poeta M, Di Stasi M, Vajro P. Gut-liver axis and probiotics: their role in non-alcoholic fatty liver disease. World J Gastroenterol. 2014; 20(42): 15518 - 15531. https://doi.org/10.3748/wjg.v20.i42.15518.
49. Zorn AM, Wells JM. Vertebrate endoderm development and organ formation. Annu Rev Cell Dev Biol. 2009; 25: 221 - 251. https://doi.org/10.1146/annurev.cellbio.042308.113344.
50. Fairfield CJ, Drake TM, Pius R, Bretherick AD, Campbell A, Clark DW et al. Genome-Wide Association Study of NAFLD Using Electronic Health Records. Hepatol Commun. 2022; 6(2): 297 - 308. https://doi.org/10.1002/hep4.1805.
51. Anstee QM, Darlay R, Cockell S, Meroni M, Govaere O, Tiniakos D et al. Genome-wide association study of non-alcoholic fatty liver and steatohepatitis in a histologically characterised cohort. J Hepatol. 2020; 73(3): 505 - 515. https://doi.org/10.1016/j.jhep.2020.04.003.
52. Куртанов ХА, Сыдыкова ЛА, Павлова НИ, Филиппова НП, Додохов ВВ, Апсолихова ГА и др. Полиморфизм гена адипонутрина (PNPLA3) у коренных жителей Республики Саха (Якутия), страдающих сахарным диабетом 2-го типа. Альманах клинической медицины. 2018; 46(3): 258 - 263. https://doi.org/10.18786/2072-0505-2018-46-3-258-263.
53. Кролевец ТС, Ливзан МА, Ахмедов ВА, Новиков ДГ. Исследование полиморфизма гена PNPLA3 у пациентов с неалкогольной жировой болезнью печени и различной стадией фиброза. Экспериментальная и клиническая гастроэнтерология. 2018; (11): 24 - 32. Режим доступа: https://www.nogr.org/jour/article/view/1088.
54. Райхельсон КЛ, Ковязина ВП, Сидоренко ДВ, Назаров ВД, Лапин СВ, Эмануэль ВЛ и др. Влияние полиморфизма гена PNPLA3 на течение неалкогольной жировой болезни печени. РМЖ. 2019; (12): 85 - 88. Режим доступа: https://www.rmj.ru/articles/gastroenterologiya/Vliyanie_polimorfizma_gena_PNPLA3_na_techenie_nealkogolynoy_ghirovoy_bolezni_pecheni/.
55. Дьяконова АТ, Куртанов ХА, Павлова НИ, Соловьева НА, Соловьева ЮА, Филиппова НП, Александрова ТН. Полиморфизм rs58542926 гена TM6SF2 при хронических неинфекционных болезнях печени в якутской популяции. Современные проблемы науки и образования. 2019; (6). https://doi.org/10.17513/spno.29334.
56. Cusi K, Isaacs S, Barb D, Basu R, Caprio S, Garvey WT et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocr Pract. 2022; 28(5): 528 - 562. https://doi.org/10.1016/j.eprac.2022.03.010.
57. Lonardo A, Ballestri S, Mantovani A, Nascimbeni F, Lugari S, Targher G. Pathogenesis of hypothyroidism-induced NAFLD: Evidence for a distinct disease entity? Dig Liver Dis. 2019; 51(4): 462 - 470. https://doi.org/10.1016/j.dld.2018.12.014.
58. Ramanathan R, Patwa SA, Ali AH, Ibdah JA. Thyroid Hormone and Mitochondrial Dysfunction: Therapeutic Implications for Metabolic Dysfunction-Associated Steatotic Liver Disease (MASLD). Cells. 2023; 12(24): 2806. https://doi.org/10.3390/cells12242806.
59. Younossi ZM, Henry L. Understanding the Burden of Nonalcoholic Fatty Liver Disease: Time for Action. Diabetes Spectr. 2024; 37(1): 9 - 19. https://doi.org/10.2337/dsi23-0010.
60. Jichitu A, Bungau S, Stanescu AMA, Vesa CM, Toma MM, Bustea C et al. Non-Alcoholic Fatty Liver Disease and Cardiovascular Comorbidities: Pathophysiological Links, Diagnosis, and Therapeutic Management. Diagnostics (Basel). 2021; 11(4): 689. https://doi.org/10.3390/diagnostics11040689.
61. Драпкина ОМ, Ивашкин ВТ. Эпидемиологические особенности неалкогольной жировой болезни печени в России (результаты открытого многоцентрового проспективного исследования-наблюдения DIREG L 01903). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2014; 24(4): 32 - 38. Режим доступа: https://www.elibrary.ru/tezcyf.
62. Ивашкин ВТ, Драпкина ОМ, Маев ИВ, Трухманов АС, Блинов ДВ, Пальгова ЛК и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2015; 25(6): 31 - 41. Режим доступа: https://www.gastro-j.ru/jour/article/view/1036.
63. Евстифеева СЕ, Шальнова СА, Куценко ВА, Яровая ЕБ, Баланова ЮА, Имаева АЭ и др. Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2). Кардиоваскулярная терапия и профилактика. 2022; 21(9): 3356. https://doi.org/10.15829/1728-8800-2022-3356.
64. Маев ИВ, Андреев ДН, Кучерявый ЮА. Распространенность неалкогольной жировой болезни печени в России: метаанализ. Consilium Medicum. 2023; 25(5): 313 - 319. https://doi.org/10.26442/20751753.2023.5.202155.
65. Povsic M, Wong OY, Perry R, Bottomley J. A Structured Literature Review of the Epidemiology and Disease Burden of Non-Alcoholic Steatohepatitis (NASH). Adv Ther. 2019; 36(7): 1574 - 1594. https://doi.org/10.1007/s12325-019-00960-3.
66. Harrison SA, Gawrieh S, Roberts K, Lisanti CJ, Schwope RB, Cebe KM et al. Prospective evaluation of the prevalence of non-alcoholic fatty liver disease and steatohepatitis in a large middle-aged US cohort. J Hepatol. 2021; 75(2): 284 - 291. https://doi.org/10.1016/j.jhep.2021.02.034.
67. Estes C, Anstee QM, Arias-Loste MT, Bantel H, Bellentani S, Caballeria J et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016 - 2030. J Hepatol. 2018; 69(4): 896 - 904. https://doi.org/10.1016/j.jhep.2018.05.036.
68. Huang DQ, Terrault NA, Tacke F, Gluud LL, Arrese M, Bugianesi E, Loomba R. Global epidemiology of cirrhosis - aetiology, trends and predictions. Nat Rev Gastroenterol Hepatol. 2023; 20(6): 388 - 398. https://doi.org/10.1038/s41575-023-00759-2.
69. Huang DQ, El-Serag HB, Loomba R. Global epidemiology of NAFLD-related HCC: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2021; 18(4): 223 - 238. https://doi.org/10.1038/s41575-020-00381-6.
70. Ивашкин ВТ, Маевская МВ, Жаркова МС, Жигалова СБ, Киценко ЕА, Манукьян ГВ, Тихонов ИН. Цирроз и фиброз печени: клинические рекомендации. М.; 2021. 99 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/715_1.
71. Muthiah MD, Cheng Han N, Sanyal AJ. A clinical overview of non-alcoholic fatty liver disease: A guide to diagnosis, the clinical features, and complications - What the non-specialist needs to know. Diabetes Obes Metab. 2022; 24(Suppl. 2): 3 - 14. https://doi.org/10.1111/dom.14521.
72. Cook N, Geier A, Schmid A, Hirschfield G, Kautz A, Schattenberg JM, Balp MM. The Patient Perspectives on Future Therapeutic Options in NASH and Patient Needs. Front Med (Lausanne). 2019; 6: 61. https://doi.org/10.3389/fmed.2019.00061.
73. Liebe R, Esposito I, Bock HH, Vom Dahl S, Stindt J, Baumann U et al. Diagnosis and management of secondary causes of steatohepatitis. J Hepatol. 2021; 74(6): 1455 - 1471. https://doi.org/10.1016/j.jhep.2021.01.045.
74. Ивашкин ВТ. Пропедевтика внутренних болезней: учебник. 2-е изд. М.: ГЭОТАР-Медиа; 2023. 936 с.
75. Ивашкин ВТ, Маевская МВ, Жаркова МС, Котовская ЮВ, Ткачева ОН, Трошина ЕА и др. Клинические рекомендации Российского общества по изучению печени, Российской гастроэнтерологической ассоциации, Российской ассоциации эндокринологов, Российской ассоциации геронтологов и гериатров и Национального общества профилактической кардиологии по диагностике и лечению неалкогольной жировой болезни печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022; 32(4): 104 - 140. https://doi.org/10.22416/1382-4376-2022-32-4-104-140.
76. Obika M, Noguchi H. Diagnosis and evaluation of nonalcoholic fatty liver disease. Exp Diabetes Res. 2012: 145754. https://doi.org/10.1155/2012/145754.
77. Павлов ЧС, Глушенков ДВ, Коновалова ОН, Ивашкин ВТ. Сфера клинического применения неинвазивных методов оценки фиброза печени: результаты собственных исследований в многопрофильном стационаре. Клиническая медицина. 2009; 87(11): 40 - 45. Режим доступа: https://www.elibrary.ru/lajkvx.
78. Sorbi D, Boynton J, Lindor KD. The ratio of aspartate aminotransferase to alanine aminotransferase: potential value in differentiating nonalcoholic steatohepatitis from alcoholic liver disease. Am J Gastroenterol. 1999; 94(4): 1018 - 1022. https://doi.org/10.1111/j.1572-0241.1999.01006.x.
79. Дедов ИИ, Шестакова МВ, Майоров АЮ, Шамхалова МШ, Сухарева ОЮ, Галстян ГР и др. Сахарный диабет 2-го типа у взрослых: клинические рекомендации. М.; 2022. 251 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/290_2.
80. Fujii H, Kawada N. The Role of Insulin Resistance and Diabetes in Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 2020; 21(11): 3863. https://doi.org/10.3390/ijms21113863.
81. Targher G, Day CP, Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010; 363(14): 1341 - 1350. https://doi.org/10.1056/NEJMra0912063.
82. Кутишенко НП, Марцевич СЮ, Лерман ОВ, Балашов ИС, Невзорова ВА, Резник ИИ и др. Повышение эффективности гиполипидемической терапии у пациентов высокого сердечно-сосудистого риска с сочетанной патологией печени (результаты дополнительного анализа исследования РАКУРС). Рациональная фармакотерапия в кардиологии. 2015; 11(3): 297 - 303. https://doi.org/10.20996/1819-6446-2015-11-3-297-303.
83. Ежов МВ, Кухарчук ВВ, Сергиенко ИВ, Алиева АС, Анциферов МБ, Аншелес АА и др. Нарушения липидного обмена: клинические рекомендации. М.; 2023. 103 с. https://cr.minzdrav.gov.ru/recomend/752_1.
84. Spinosa M, Stine JG. Nonalcoholic Fatty Liver Disease-Evidence for a Thrombophilic State? Curr Pharm Des. 2020; 26(10): 1036 - 1044. https://doi.org/10.2174/1381612826666200131101553.
85. Verrijken A, Francque S, Mertens I, Prawitt J, Caron S, Hubens G et al. Prothrombotic factors in histologically proven nonalcoholic fatty liver disease and nonalcoholic steatohepatitis. Hepatology. 2014; 59(1): 121 - 129. https://doi.org/10.1002/hep.26510.
86. Balta G, Altay C, Gurgey A. PAI-1 gene 4G/5G genotype: A risk factor for thrombosis in vessels of internal organs. Am J Hematol. 2002; 71(2): 89 - 93. https://doi.org/10.1002/ajh.10192.
87. Northup PG, Argo CK, Shah N, Caldwell SH. Hypercoagulation and thrombophilia in nonalcoholic fatty liver disease: mechanisms, human evidence, therapeutic implications, and preventive implications. Semin Liver Dis. 2012; 32(1): 39 - 48. https://doi.org/10.1055/s-0032-1306425.
88. Skurk T, Hauner H. Obesity and impaired fibrinolysis: role of adipose production of plasminogen activator inhibitor-1. Int J Obes Relat Metab Disord. 2004; 28(11): 1357 - 1364. https://doi.org/10.1038/sj.ijo.0802778.
89. Kotronen A, Joutsi-Korhonen L, Sevastianova K, Bergholm R, Hakkarainen A,  KH et al. Increased coagulation factor VIII, IX, XI and XII activities in non-alcoholic fatty liver disease. Liver Int. 2011; 31(2): 176 - 183. https://doi.org/10.1111/j.1478-3231.2010.02375.x.
KH et al. Increased coagulation factor VIII, IX, XI and XII activities in non-alcoholic fatty liver disease. Liver Int. 2011; 31(2): 176 - 183. https://doi.org/10.1111/j.1478-3231.2010.02375.x.
90. Ciardullo S, Ballabeni C, Trevisan R, Perseghin G. Liver Stiffness, Albuminuria and Chronic Kidney Disease in Patients with NAFLD: A Systematic Review and Meta-Analysis. Biomolecules. 2022; 12(1): 105. https://doi.org/10.3390/biom12010105.
91. Sun DQ, Jin Y, Wang TY, Zheng KI, Rios RS, Zhang HY et al. MAFLD and risk of CKD. Metabolism. 2021; 115: 154433. https://doi.org/10.1016/j.metabol.2020.154433.
92. Бобкова ИН, Ватазин АВ, Ветчинникова ОН, Волгина ГВ, Голубев РВ, Горелова ЕА и др. Хроническая болезнь почек (ХБП): клинические рекомендации. М.; 2021. 233 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/469_2.
93. Маевская МВ, Котовская ЮВ, Ивашкин ВТ, Ткачева ОН, Трошина ЕА, Шестакова МВ и др. Национальный Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. Терапевтический архив. 2022; 94(2): 216 - 253. https://doi.org/10.26442/00403660.2022.02.201363.
94. Darmawan G, Hamijoyo L, Hasan I. Association between Serum Uric Acid and Non-Alcoholic Fatty Liver Disease: A Meta-Analysis. Acta Med Indones. 2017; 49(2): 136 - 147. Available at: https://www.actamedindones.org/index.php/ijim/article/view/381/pdf.
95. Lombardi R, Pisano G, Fargion S. Role of Serum Uric Acid and Ferritin in the Development and Progression of NAFLD. Int J Mol Sci. 2016; 17(4): 548. https://doi.org/10.3390/ijms17040548.
96. Аверкина НА, Багаева МЭ, Батышева ТТ, Быкова ОВ, Вашакмадзе НД, Волынец ГВ и др. Нарушения обмена меди (болезнь Вильсона): клинические рекомендации. М.; 2021. 66 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/376_2.
97. Ивашкин ВТ, Ющук НД, Богомолов ПО, Волчкова ЕВ, Дмитриев АС, Жаркова МС и др. Хронический вирусный гепатит C: клинические рекомендации. М.; 2021. 71 с. Режим доступа: https://cr.minzdrav.gov.ru/recomend/516_2.
98. Ивашкин ВТ, Маевская МВ, Жаркова МС, Тихонов ИН, Федосьина ЕА, Павлов ЧС. Алгоритмы диагностики и лечения в гепатологии: справочные материалы. М.: МЕДпресс-информ; 2016. 176 с.
99. Petzold G. Role of Ultrasound Methods for the Assessment of NAFLD. J Clin Med. 2022; 11(15): 4581. https://doi.org/10.3390/jcm11154581.
100. Ferraioli G, Soares Monteiro LB. Ultrasound-based techniques for the diagnosis of liver steatosis. World J Gastroenterol. 2019; 25(40): 6053 - 6062. https://doi.org/10.3748/wjg.v25.i40.6053.
101. Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, Clark JM. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: a meta-analysis. Hepatology. 2011 Sep 2; 54(3): 1082 - 1090. doi: 10.1002/hep.24452.
102. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J Hepatol. 2021; 75(3): 659 - 689. https://doi.org/10.1016/j.jhep.2021.05.025.
103. Petroff D, Blank V, Newsome PN, Shalimar, Voican CS, Thiele M et al. Assessment of hepatic steatosis by controlled attenuation parameter using the M and XL probes: an inpidual patient data meta-analysis. Lancet Gastroenterol Hepatol. 2021; 6(3): 185 - 198. https://doi.org/10.1016/S2468-1253(20)30357-5.
104. Pu K, Wang Y, Bai S, Wei H, Zhou Y, Fan J, Qiao L. Diagnostic accuracy of controlled attenuation parameter (CAP) as a non-invasive test for steatosis in suspected non-alcoholic fatty liver disease: a systematic review and meta-analysis. BMC Gastroenterol. 2019; 19(1): 51. https://doi.org/10.1186/s12876-019-0961-9.
105. Gu J, Liu S, Du S, Zhang Q, Xiao J, Dong Q, Xin Y. Diagnostic value of MRI-PDFF for hepatic steatosis in patients with non-alcoholic fatty liver disease: a meta-analysis. Eur Radiol. 2019; 29(7): 3564 - 3573. https://doi.org/10.1007/s00330-019-06072-4.
106. Verhaegh P, Bavalia R, Winkens B, Masclee A, Jonkers D, Koek G. Noninvasive Tests Do Not Accurately Differentiate Nonalcoholic Steatohepatitis From Simple Steatosis: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2018; 16(6): 837 - 861. https://doi.org/10.1016/j.cgh.2017.08.024.
107. Kleiner DE, Brunt EM. Nonalcoholic fatty liver disease: pathologic patterns and biopsy evaluation in clinical research. Semin Liver Dis. 2012; 32(1): 3 - 13. https://doi.org/10.1055/s-0032-1306421.
108. Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005; 41(6): 1313 - 1321. https://doi.org/10.1002/hep.20701.
109. Bedossa P. Utility and appropriateness of the fatty liver inhibition of progression (FLIP) algorithm and steatosis, activity, and fibrosis (SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease. Hepatology. 2014; 60(2): 565 - 575. https://doi.org/10.1002/hep.27173.
110. Bedossa P. Current histological classification of NAFLD: strength and limitations. Hepatol Int. 2013; 7(Suppl. 2): 765 - 770. https://doi.org/10.1007/s12072-013-9446-z
111. Harrison SA, Torgerson S, Hayashi P, Ward J, Schenker S. Vitamin E and vitamin C treatment improves fibrosis in patients with nonalcoholic steatohepatitis. Am J Gastroenterol. 2003; 98(11): 2485 - 2490. https://doi.org/10.1111/j.1572-0241.2003.08699.x.
112. Xiao G, Zhu S, Xiao X, Yan L, Yang J, Wu G. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fibrosis in patients with nonalcoholic fatty liver disease: A meta-analysis. Hepatology. 2017; 66(5): 1486 - 1501. https://doi.org/10.1002/hep.29302.
113. McPherson S, Hardy T, Dufour JF, Petta S, Romero-Gomez M, Allison M et al. Age as a Confounding Factor for the Accurate Non-Invasive Diagnosis of Advanced NAFLD Fibrosis. Am J Gastroenterol. 2017; 112(5): 740 - 751. https://doi.org/10.1038/ajg.2016.453.
114. Bril F, McPhaul MJ, Caulfield MP, Clark VC, Soldevilla-Pico C, Firpi-Morell RJ et al. Performance of Plasma Biomarkers and Diagnostic Panels for Nonalcoholic Steatohepatitis and Advanced Fibrosis in Patients With Type 2 Diabetes. Diabetes Care. 2020; 43(2): 290 - 297. https://doi.org/10.2337/dc19-1071.
115. Papatheodoridi M, Hiriart JB, Lupsor-Platon M, Bronte F, Boursier J, Elshaarawy O et al. Refining the Baveno VI elastography criteria for the definition of compensated advanced chronic liver disease. J Hepatol. 2021; 74(5): 1109 - 1116. https://doi.org/10.1016/j.jhep.2020.11.050.
116. De Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C. Baveno VII - Renewing consensus in portal hypertension. J Hepatol. 2022; 76(4): 959 - 974. https://doi.org/10.1016/j.jhep.2021.12.022.
117. WHO guidelines on physical activity and sedentary behaviour. Available at: https://iris.who.int/bitstream/handle/10665/336656/9789240015128-eng.pdf.
118. Keating SE, Hackett DA, George J, Johnson NA. Exercise and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J Hepatol. 2012; 57(1): 157 - 166. https://doi.org/10.1016/j.jhep.2012.02.023.
119. Дедов ИИ, Мокрышева НГ, Мельниченко ГА, Трошина ЕА, Мазурина НВ, Ершова ЕВ и др. Ожирение: клинические рекомендации. М.; 2020. Режим доступа: https://cr.minzdrav.gov.ru/recomend/28_2.
120. Hashida R, Kawaguchi T, Bekki M, Omoto M, Matsuse H, Nago T et al. Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: A systematic review. J Hepatol. 2017; 66(1): 142 - 152. https://doi.org/10.1016/j.jhep.2016.08.023.
121. Katsagoni CN, Georgoulis M, Papatheodoridis GV, Panagiotakos DB, Kontogianni MD. Effects of lifestyle interventions on clinical characteristics of patients with non-alcoholic fatty liver disease: A meta-analysis. Metabolism. 2017; 68: 119 - 132. https://doi.org/10.1016/j.metabol.2016.12.006.
122. Golabi P, Locklear CT, Austin P, Afdhal S, Byrns M, Gerber L, Younossi ZM. Effectiveness of exercise in hepatic fat mobilization in non-alcoholic fatty liver disease: Systematic review. World J Gastroenterol. 2016; 22(27): 6318 - 6327. https://doi.org/10.3748/wjg.v22.i27.6318.
123. Smart NA, King N, McFarlane JR, Graham PL, Dieberg G. Effect of exercise training on liver function in adults who are overweight or exhibit fatty liver disease: a systematic review and meta-analysis. Br J Sports Med. 2018; 52(13): 834 - 843. https://doi.org/10.1136/bjsports-2016-096197.
124. Cheng S, Ge J, Zhao C, Le S, Yang Y, Ke D et al. Effect of aerobic exercise and diet on liver fat in pre-diabetic patients with non-alcoholic-fatty-liver-disease: A randomized controlled trial. Sci Rep. 2017; 7(1): 15952. https://doi.org/10.1038/s41598-017-16159-x.
125. Hallsworth K, Thoma C, Hollingsworth KG, Cassidy S, Anstee QM, Day CP, Trenell MI. Modified high-intensity interval training reduces liver fat and improves cardiac function in non-alcoholic fatty liver disease: a randomized controlled trial. Clin Sci (Lond). 2015; 129(12): 1097 - 1105. https://doi.org/10.1042/CS20150308.
126. Rector RS, Thyfault JP, Morris RT, Laye MJ, Borengasser SJ, Booth FW, Ibdah JA. Daily exercise increases hepatic fatty acid oxidation and prevents steatosis in Otsuka Long-Evans Tokushima Fatty rats. Am J Physiol Gastrointest Liver Physiol. 2008; 294(3): G619 - 626. https://doi.org/10.1152/ajpgi.00428.2007.
127. Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, Abdelmalek MF, Caldwell S, Barb D et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023; 77(5): 1797 - 1835. https://doi.org/10.1097/HEP.0000000000000323.
128. Zelber-Sagi S, Salomone F, Mlynarsky L. The Mediterranean dietary pattern as the diet of choice for non-alcoholic fatty liver disease: Evidence and plausible mechanisms. Liver Int. 2017; 37(7): 936 - 949. https://doi.org/10.1111/liv.13435.
129. Haigh L, Kirk C, El Gendy K, Gallacher J, Errington L, Mathers JC, Anstee QM. The effectiveness and acceptability of Mediterranean diet and calorie restriction in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis. Clin Nutr. 2022; 41(9): 1913 - 1931. https://doi.org/10.1016/j.clnu.2022.06.037.
130. Younossi ZM, Corey KE, Lim JK. AGA Clinical Practice Update on Lifestyle Modification Using Diet and Exercise to Achieve Weight Loss in the Management of Nonalcoholic Fatty Liver Disease: Expert Review. Gastroenterology. 2021; 160(3): 912 - 918. https://doi.org/10.1053/j.gastro.2020.11.051.
131. Panchal SK, Poudyal H, Brown L. Quercetin ameliorates cardiovascular, hepatic, and metabolic changes in diet-induced metabolic syndrome in rats. J Nutr. 2012; 142(6): 1026 - 1032. https://doi.org/10.3945/jn.111.157263.
132. Aller R, Izaola O, de la Fuente B, De Luis  DA. Mediterranean diet is associated with liver histology in patients with non alcoholic fatty liver disease. Nutr Hosp. 2015; 32(6): 2518 - 2524. https://doi.org/10.3305/nh.2015.32.6.10074.
DA. Mediterranean diet is associated with liver histology in patients with non alcoholic fatty liver disease. Nutr Hosp. 2015; 32(6): 2518 - 2524. https://doi.org/10.3305/nh.2015.32.6.10074.
133. Abenavoli L, Greco M, Nazionale I, Peta V, Milic N, Accattato F et al. Effects of Mediterranean diet supplemented with silybin-vitamin E-phospholipid complex in overweight patients with non-alcoholic fatty liver disease. Expert Rev Gastroenterol Hepatol. 2015; 9(4): 519 - 527. https://doi.org/10.1586/17474124.2015.1004312.
134. Ryan MC, Itsiopoulos C, Thodis T, Ward G, Trost N, Hofferberth S et al. The Mediterranean diet improves hepatic steatosis and insulin sensitivity in inpiduals with non-alcoholic fatty liver disease. J Hepatol. 2013; 59(1): 138 - 143. https://doi.org/10.1016/j.jhep.2013.02.012.
135. Trovato FM, Martines GF, Brischetto D, Trovato G, Catalano D. Neglected features of lifestyle: Their relevance in non-alcoholic fatty liver disease. World J Hepatol. 2016; 8(33): 1459 - 1465. https://doi.org/10.4254/wjh.v8.i33.1459.
136. Lee D, Chiavaroli L, Ayoub-Charette S, Khan TA, Zurbau A, Au-Yeung F et al. Important Food Sources of Fructose-Containing Sugars and Non-Alcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis of Controlled Trials. Nutrients. 2022; 14(14): 2846. https://doi.org/10.3390/nu14142846.
137. Liu W, Zhai D, Zhang T, Mudoti NG, Chang Q, Liu Y et al. Meta-analysis of the association between major foods with added fructose and non-alcoholic fatty liver disease. Food Funct. 2023; 14(12): 5551 - 5561. https://doi.org/10.1039/d3fo00882g.
138. Wong VW, Wong GL, Chan RS, Shu SS, Cheung BH, Li LS et al. Beneficial effects of lifestyle intervention in non-obese patients with non-alcoholic fatty liver disease. J Hepatol. 2018; 69(6): 1349 - 1356. https://doi.org/10.1016/j.jhep.2018.08.011.
139. Long MT, Noureddin M, Lim JK. AGA Clinical Practice Update: Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Lean Inpiduals: Expert Review. Gastroenterology. 2022; 163(3): 764 - 774.e1. https://doi.org/10.1053/j.gastro.2022.06.023.
140. Francque SM, Marchesini G, Kautz A, Walmsley M, Dorner R, Lazarus JV et al. Non-alcoholic fatty liver disease: A patient guideline. JHEP Rep. 2021; 3(5): 100322. https://doi.org/10.1016/j.jhepr.2021.100322.
141. Jarvis H, O'Keefe H, Craig D, Stow D, Hanratty B, Anstee QM. Does moderate alcohol consumption accelerate the progression of liver disease in NAFLD? A systematic review and narrative synthesis. BMJ Open. 2022; 12(1): e049767. https://doi.org/10.1136/bmjopen-2021-049767.
142. Di Ciaula A, Bonfrate L, Krawczyk M,  G, Portincasa P. Synergistic and Detrimental Effects of Alcohol Intake on Progression of Liver Steatosis. Int J Mol Sci. 2022; 23(5): 2636. https://doi.org/10.3390/ijms23052636.
G, Portincasa P. Synergistic and Detrimental Effects of Alcohol Intake on Progression of Liver Steatosis. Int J Mol Sci. 2022; 23(5): 2636. https://doi.org/10.3390/ijms23052636.
143. Long MT, Massaro JM, Hoffmann U, Benjamin EJ, Naimi TS. Alcohol Use Is Associated With Hepatic Steatosis Among Persons With Presumed Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2020; 18(8): 1831 - 1841.e5. https://doi.org/10.1016/j.cgh.2019.11.022.
144. El Hadi H, Di Vincenzo A, Vettor R, Rossato M. Cardio-Metabolic Disorders in Non-Alcoholic Fatty Liver Disease. Int J Mol Sci. 2019; 20(9): 2215. https://doi.org/10.3390/ijms20092215.
145. Lizardi-Cervera J, Aguilar-Zapata D. Nonalcoholic fatty liver disease and its association with cardiovascular disease. Ann Hepatol. 2009; 8(Suppl. 1): S40 - 43. https://doi.org/10.1016/S1665 - 2681(19)31825 - 3.
146. Angulo P, Kleiner DE, Dam-Larsen S, Adams LA, Bjornsson ES, Charatcharoenwitthaya P et al. Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2015; 149(2): 389 - 397.e10. https://doi.org/10.1053/j.gastro.2015.04.043.
147. Kwo PY, Cohen SM, Lim JK. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017; 112(1): 18 - 35. https://doi.org/10.1038/ajg.2016.517.
148. Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh I. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ. 2004; 328(7446): 983. https://doi.org/10.1136/bmj.38050.593634.63.
149. Lee TH, Kim WR, Benson JT, Therneau TM, Melton LJ 3rd. Serum aminotransferase activity and mortality risk in a United States community. Hepatology. 2008; 47(3): 880 - 887. https://doi.org/10.1002/hep.22090.
150. Ruhl CE, Everhart JE. Elevated serum alanine aminotransferase and gamma-glutamyltransferase and mortality in the United States population. Gastroenterology. 2009; 136(2): 477 - 485.e11. https://doi.org/10.1053/j.gastro.2008.10.052.
151. Ioannou GN, Weiss NS, Boyko EJ, Mozaffarian D, Lee SP. Elevated serum alanine aminotransferase activity and calculated risk of coronary heart disease in the United States. Hepatology. 2006; 43(5): 1145 - 1151. https://doi.org/10.1002/hep.21171.
152. Buzzetti E, Linden A, Best LM, Madden AM, Roberts D, Chase TJG et al. Lifestyle modifications for nonalcohol-related fatty liver disease: a network meta-analysis. Cochrane Database Syst Rev. 2021; 6(6): CD013156. https://doi.org/10.1002/14651858.CD013156.pub2.
153. Komolafe O, Buzzetti E, Linden A, Best LM, Madden AM, Roberts D et al. Nutritional supplementation for nonalcohol-related fatty liver disease: a network meta-analysis. Cochrane Database Syst Rev. 2021; 7(7): CD013157. https://doi.org/10.1002/14651858.CD013157.pub2.
154.  M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol. 2017; 67(4): 829 - 846. https://doi.org/10.1016/j.jhep.2017.05.016.
M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol. 2017; 67(4): 829 - 846. https://doi.org/10.1016/j.jhep.2017.05.016.
155. Peng L, Wang J, Li F. Weight reduction for non-alcoholic fatty liver disease. Cochrane Database Syst Rev. 2011; (6): CD003619. https://doi.org/10.1002/14651858.CD003619.pub3.
156. Xiang Z, Chen YP, Ma KF, Ye YF, Zheng L, Yang YD et al. The role of ursodeoxycholic acid in non-alcoholic steatohepatitis: a systematic review. BMC Gastroenterol. 2013; 13: 140. https://doi.org/10.1186/1471-230X-13-140.
157.  M,
M,  A,
A,  LE. Effect of ursodeoxycholic acid on liver markers: A systematic review and meta-analysis of randomized placebo-controlled clinical trials. Br J Clin Pharmacol. 2020; 86(8): 1476 - 1488. https://doi.org/10.1111/bcp.14311.
LE. Effect of ursodeoxycholic acid on liver markers: A systematic review and meta-analysis of randomized placebo-controlled clinical trials. Br J Clin Pharmacol. 2020; 86(8): 1476 - 1488. https://doi.org/10.1111/bcp.14311.
158. Laurin J, Lindor KD, Crippin JS, Gossard A, Gores GJ, Ludwig J et al. Ursodeoxycholic acid or clofibrate in the treatment of non-alcohol-induced steatohepatitis: a pilot study. Hepatology. 1996; 23(6): 1464 - 1467. https://doi.org/10.1002/hep.510230624.
159. Ozel Coskun BD, Yucesoy M, Gursoy S, Baskol M, Yurci A, Yagbasan A et al. Effects of ursodeoxycholic acid therapy on carotid intima media thickness, apolipoprotein A1, apolipoprotein B, and apolipoprotein B/A1 ratio in nonalcoholic steatohepatitis. Eur J Gastroenterol Hepatol. 2015; 27(2): 142 - 149. https://doi.org/10.1097/MEG.0000000000000264.
160. Ratziu V, de Ledinghen V, Oberti F, M,athurin P, Wartelle-Bladou C, Renou C et al. A randomized controlled trial of high-dose ursodesoxycholic acid for nonalcoholic steatohepatitis. J Hepatol. 2011; 54(5): 1011 - 1019. https://doi.org/10.1016/j.jhep.2010.08.030.
161. Павлов ЧС, Варганова ДЛ, Семенистая МЧ, Кузнецова ЕА, Усанова АА, Свистунов АА. Урсодезоксихолевая кислота: эффективность и безопасность в лечении неалкогольной жировой болезни печени (мета-анализ). Вестник Российской академии медицинских наук. 2018; 73(5): 294 - 305. https://doi.org/10.15690/vramn975
162. Zhang W, Tang Y, Huang J, Hu H. Efficacy of ursodeoxycholic acid in nonalcoholic fatty liver disease: An updated meta-analysis of randomized controlled trials. Asia Pac J Clin Nutr. 2020; 29(4): 696 - 705. https://doi.org/10.6133/apjcn.202012_29(4).0004.
163. Lin X, Mai M, He T, Huang H, Zhang P, Xia E, Guo H. Efficiency of ursodeoxycholic acid for the treatment of nonalcoholic steatohepatitis: A systematic review and meta-analysis. Expert Rev Gastroenterol Hepatol. 2022; 16(6): 537 - 545. https://doi.org/10.1080/17474124.2022.2083605.
164. Nadinskaia M, Maevskaya M, Ivashkin V, Kodzoeva K, Pirogova I, Chesnokov E et al. Ursodeoxycholic acid as a means of preventing atherosclerosis, steatosis and liver fibrosis in patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2021; 27(10): 959 - 975. https://doi.org/10.3748/wjg.v27.i10.959.
165. Byrnes K, Blessinger S, Bailey NT, Scaife R, Liu G, Khambu B. Therapeutic regulation of autophagy in hepatic metabolism. Acta Pharm Sin B. 2022; 12(1): 33 - 49. https://doi.org/10.1016/j.apsb.2021.07.021.
166. Decuypere JP, Parys JB, Bultynck G. Regulation of the autophagic bcl-2/beclin 1 interaction. Cells. 2012; 1(3): 284 - 312. https://doi.org/10.3390/cells1030284.
167. Carino A, Biagioli M,  S, Fiorucci C, Zampella A, Monti MC et al. Ursodeoxycholic acid is a GPBAR1 agonist and resets liver/intestinal FXR signaling in a model of diet-induced dysbiosis and NASH. Biochim Biophys Acta Mol Cell Biol Lipids. 2019; 1864(10): 1422 - 1437. https://doi.org/10.1016/j.bbalip.2019.07.006.
S, Fiorucci C, Zampella A, Monti MC et al. Ursodeoxycholic acid is a GPBAR1 agonist and resets liver/intestinal FXR signaling in a model of diet-induced dysbiosis and NASH. Biochim Biophys Acta Mol Cell Biol Lipids. 2019; 1864(10): 1422 - 1437. https://doi.org/10.1016/j.bbalip.2019.07.006.
168.  S, Biagioli M, Roselli R, Zampella A, Di Giorgio C, Bordoni M et al. Beneficial effects of UDCA and norUDCA in a rodent model of steatosis are linked to modulation of GPBAR1/FXR signaling. Biochim Biophys Acta Mol Cell Biol Lipids. 2022; 1867(11): 159218. https://doi.org/10.1016/j.bbalip.2022.159218.
S, Biagioli M, Roselli R, Zampella A, Di Giorgio C, Bordoni M et al. Beneficial effects of UDCA and norUDCA in a rodent model of steatosis are linked to modulation of GPBAR1/FXR signaling. Biochim Biophys Acta Mol Cell Biol Lipids. 2022; 1867(11): 159218. https://doi.org/10.1016/j.bbalip.2022.159218.
169. Karedath J, Javed H, Ahsan Talpur F, Lal B, Kumari A, Kivan H et al. Effect of Vitamin E on Clinical Outcomes in Patients With Non-alcoholic Fatty Liver Disease: A Meta-Analysis. Cureus. 2022; 14(12): e32764. https://doi.org/10.7759/cureus.32764.
170. Bril F, Biernacki DM, Kalavalapalli S, Lomonaco R, Subbarayan SK, Lai J et al. Role of Vitamin E for Nonalcoholic Steatohepatitis in Patients With Type 2 Diabetes: A Randomized Controlled Trial. Diabetes Care. 2019; 42(8): 1481 - 1488. https://doi.org/10.2337/dc19 - 0167.
171. Xu R, Tao A, Zhang S, Deng Y, Chen G. Association between vitamin E and non-alcoholic steatohepatitis: a meta-analysis. Int J Clin Exp Med. 2015; 8(3): 3924 - 3934. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4443128/.
172. Mazhar IJ, Yasir M, Sarfraz S, Shlaghya G, Narayana SH, Mushtaq U et al. Vitamin E and Pioglitazone: A Comprehensive Systematic Review of Their Efficacy in Non-alcoholic Fatty Liver Disease. Cureus. 2023; 15(8): e43635. https://doi.org/10.7759/cureus.43635.
173. Vilar-Gomez E, Vuppalanchi R, Gawrieh S, Ghabril M, Saxena R, Cummings OW, Chalasani N. Vitamin E Improves Transplant-Free Survival and Hepatic Decompensation Among Patients With Nonalcoholic Steatohepatitis and Advanced Fibrosis. Hepatology. 2020; 71(2): 495 - 509. https://doi.org/10.1002/hep.30368.
174. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016; 64(6): 1388 - 1402. https://doi.org/10.1016/j.jhep.2015.11.004.
175. Chalasani N, Younossi Z, Lavine JE, Charlton M, Cusi K, Rinella M et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology. 2018; 67(1): 328 - 357. https://doi.org/10.1002/hep.29367.
176. Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010; 362(18): 1675 - 1685. https://doi.org/10.1056/NEJMoa0907929.
177. Ando Y, Jou JH. Nonalcoholic Fatty Liver Disease and Recent Guideline Updates. Clin Liver Dis (Hoboken). 2021; 17(1): 23 - 28. https://doi.org/10.1002/cld.1045.
178. Bjelakovic G, Nikolova D, Gluud C. Meta-regression analyses, meta-analyses, and trial sequential analyses of the effects of supplementation with beta-carotene, vitamin A, and vitamin E singly or in different combinations on all-cause mortality: do we have evidence for lack of harm? PLoS ONE. 2013; 8(9): e74558. https://doi.org/10.1371/journal.pone.0074558.
179. Miller ER 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med. 2005; 142(1): 37 - 46. https://doi.org/10.7326/0003-4819-142-1-200501040-00110.
180. Curtis AJ, Bullen M, Piccenna L, McNeil JJ. Vitamin E supplementation and mortality in healthy people: a meta-analysis of randomised controlled trials. Cardiovasc Drugs Ther. 2014; 28(6): 563 - 573. https://doi.org/10.1007/s10557-014-6560-7.
181. Vivarelli F, Canistro D, Cirillo S, Papi A, Spisni E, Vornoli A et al. Co-carcinogenic effects of vitamin E in prostate. Sci Rep. 2019; 9(1): 11636. https://doi.org/10.1038/s41598-019-48213-1.
182. Podszun M, Frank J. Vitamin E-drug interactions: molecular basis and clinical relevance. Nutr Res Rev. 2014; 27(2): 215 - 231. https://doi.org/10.1017/S0954422414000146.
183. Noureddin M, Sander-Struckmeier S, Mato JM. Early treatment efficacy of S-adenosylmethionine in patients with intrahepatic cholestasis: A systematic review. World J Hepatol. 2020; 12(2): 46 - 63. https://doi.org/10.4254/wjh.v12.i2.46.
184. Райхельсон КЛ, Кондрашина ЭА. Адеметионин в лечении повышенной утомляемости/слабости при заболеваниях печени: систематический обзор. Терапевтический архив. 2019; 91(2): 134 - 142. https://doi.org/10.26442/00403660.2019.02.000130.
185. Барановский А.Ю., Райхельсон К.Л., Марченко Н.В. Применение S-аденозилметионина (Гептрала(R)) в терапии больных неалкогольным стеатогепатитом. Клинические перспективы гастроэнтерологии, гепатологии, 2010; 9(1): 3 - 10. Режим доступа: https://www.elibrary.ru/kzgaan.
186. Shankar R, Virukalpattigopalratnam MP,  (Ademetionine) in Intrahepatic Cholestasis due to Chronic Non-Alcoholic Liver Disease: Subgroup Analysis of Results of a Multicentre Observational Study in India. J Clin Exp Hepatol. 2014; 4(Suppl. 2): S33. https://doi.org/10.1016/j.jceh.2014.02.071.
(Ademetionine) in Intrahepatic Cholestasis due to Chronic Non-Alcoholic Liver Disease: Subgroup Analysis of Results of a Multicentre Observational Study in India. J Clin Exp Hepatol. 2014; 4(Suppl. 2): S33. https://doi.org/10.1016/j.jceh.2014.02.071.
187. Li H, Liu NN, Peng ZG. Effect of bicyclol on blood biomarkers of NAFLD: a systematic review and meta-analysis. BMJ Open. 2020; 10(12): e039700. https://doi.org/10.1136/bmjopen-2020-039700.
188. Маевская МВ, Луньков ВД, Гейвандова НИ, Пальгова ЛК, Пирогова ИЮ, Прашнова МК и др. Бициклол в лечении пациентов с хроническими диффузными заболеваниями печени. Медицинский совет. 2020; (15): 78 - 89. https://doi.org/10.21518/2079-701X-2020-15-78-89.
189. Pan SY, Dong H, Yu ZL, Zhao XY, Xiang CJ, Wang H et al. Bicyclol, a synthetic dibenzocyclooctadiene derivative, decreases hepatic lipids but increases serum triglyceride level in normal and hypercholesterolaemic mice. J Pharm Pharmacol. 2007; 59(12): 1657 - 1662. https://doi.org/10.1211/jpp.59.12.0007.
190. Pan SY, Yu ZL, Dong H, Xiang CJ, Fong WF, Ko KM. Ethanol extract of fructus schisandrae decreases hepatic triglyceride level in mice fed with a high fat/cholesterol diet, with attention to acute toxicity. Evid Based Complement Alternat Med. 2011: 729412. https://doi.org/10.1093/ecam/nep070.
191. Zhao W, Yan Y, Xiao Z, Wang M, Xu M, Wang Z et al. Bicyclol ameliorates nonalcoholic fatty liver disease in mice via inhibiting MAPKs and NF-кB signaling pathways. Biomed Pharmacother. 2021; 141: 111874. https://doi.org/10.1016/j.biopha.2021.111874.
192. Пирогова ИЮ, Яковлева СВ, Неуймина ТВ, Синицын СП, Чулков ВС, Шамаева ТН. Эффективность и безопасность Бициклола при неалкогольной жировой болезни печени: результаты когортного исследования. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018; 28(4): 66 - 75. https://doi.org/10.22416/1382-4376-2018-28-4-66-75.
193. Оковитый СВ, Приходько ВА, Безбородкина НН, Кудрявцев БН. Гепатопротекторы: руководство для врачей. 2-е изд. М.: ГЭОТАР-Медиа; 2022. 240 с. https://doi.org/10.33029/9704-6689-6-LIV-1-240.
194. Семисtрин ВА, Каракозов АГ, Малькута МА, Золотарtва ЛА, Левченко ОБ, Калягин ИЕ, Еремин М.Н. Оценка эффективности гепатопротективной монотерапии неалкогольной жировой болезни печени в стадии стеатогепатита препаратом на основе янтарной кислоты и метионина. Терапевтический архив. 2016; 88(2): 58 - 63. https://doi.org/10.17116/terarkh201688258-63.
195. Стельмах ВВ, Козлов ВК, Баранов ВЛ, Латария ЭЛ, Некрасова АС. Энерготропная патогенетически ориентированная терапия сукцинатсодержащими препаратами при неалкогольной жировой болезни печени: перспективы клинического применения. Медицинский алфавит. 2013; 1(2): 38 - 44. Режим доступа: https://www.elibrary.ru/rmxlrt.
196. Дударенко СВ, Коваленко АЛ, Прокопенко СМ, Белогурова ЕВ. Применение ремаксола в терапии метаболического синдрома у пациентов с неалкогольным стеатогепатитом и сахарным диабетом 2 типа. Экспериментальная и клиническая гастроэнтерология. 2016; (6): 89 - 94. Режим доступа: https://www.nogr.org/jour/article/view/221.
197. Шиповская АА, Дуданова ОП. Внутрипеченочный холестаз при неалкогольной жировой болезни печени. Терапевтический архив. 2018; 90(2): 69 - 74. https://doi.org/10.26442/terarkh201890269-74.
198. Pennisi G, Pipitone RM, Grimaudo S, Spatola F, Di Martino V,  C et al. A cholestatic pattern predicts liver outcomes in patients with nonalcoholic fatty liver disease. Dig Liver Dis. 2021; 53(Suppl. 1): S27. https://doi.org/10.1016/j.dld.2020.12.069.
C et al. A cholestatic pattern predicts liver outcomes in patients with nonalcoholic fatty liver disease. Dig Liver Dis. 2021; 53(Suppl. 1): S27. https://doi.org/10.1016/j.dld.2020.12.069.
199. Широкова Е.Н. Внутрипеченочный холестаз при неалкогольной жировой болезни печени: патогенез и роль адеметионина в терапии. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2023; 33 (2): 79 - 86. https://doi.org/10.22416/1382-4376-2023-33-2-79-86.
200. Anstee QM, Day CP. S-adenosylmethionine (SAMe) therapy in liver disease: a review of current evidence and clinical utility. J Hepatol. 2012; 57 (5): 1097 - 1109. https://doi.org/10.1016/j.jhep.2012.04.041.
201. Butterworth RF, Kircheis G, Hilger N, McPhail MJW. Efficacy of l-Ornithine l-Aspartate for the Treatment of Hepatic Encephalopathy and Hyperammonemia in Cirrhosis: Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Exp Hepatol. 2018; 8 (3): 301 - 313. https://doi.org/10.1016/j.jceh.2018.05.004.
202. Ермолова Т.В., Ермолов С.Ю., Сологуб Т.В., Карев В.Е., Добкес А.Л., Апресян А.Г. Нарушения портопеченочной гемодинамики при хронических заболеваниях печени на начальных стадиях фиброза и их коррекция. Фарматека. 2016; (15): 58 - 66. Режим доступа: https://pharmateca.ru/ru/archive/article/33748.
203. Зыкина Е.Ю., Симонова Ж.Г. Гипераммониемия у пациентов со стабильной стенокардией и неалкогольной жировой болезнью печени на стадии стеатоза. Экспериментальная и клиническая гастроэнтерология. 2023; (8): 57 - 65. https://doi.org/10.31146/1682-8658-ecg-216-8-57-65.
204. Гаранина Е.В. Влияние курсового приема L-орнитин - L-аспартата на фиброз и стеатоз печени у больных ассоциированной с нарушениями метаболизма жировой болезнью печени (неалкогольной жировой болезнью печени), имеющих гипераммониемию. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2021; 31 (4): 31 - 36. https://doi.org/10.22416/1382-4376-2021-31-4-31-36.
205. Kaiser S, Gerok W,  D. Ammonia and glutamine metabolism in human liver slices: new aspects on the pathogenesis of hyperammonaemia in chronic liver disease. Eur J Clin Invest. 1988; 18 (5): 535 - 542. https://doi.org/10.1111/j.1365-2362.1988.tb01053.x.
D. Ammonia and glutamine metabolism in human liver slices: new aspects on the pathogenesis of hyperammonaemia in chronic liver disease. Eur J Clin Invest. 1988; 18 (5): 535 - 542. https://doi.org/10.1111/j.1365-2362.1988.tb01053.x.
206. De Chiara F,  S, Marrone G, Montoliu C, Hamilton-Dutoit S, Ferrandez A et al. Urea cycle dysregulation in non-alcoholic fatty liver disease. J Hepatol. 2018; 69 (4): 905 - 915. https://doi.org/10.1016/j.jhep.2018.06.023.
S, Marrone G, Montoliu C, Hamilton-Dutoit S, Ferrandez A et al. Urea cycle dysregulation in non-alcoholic fatty liver disease. J Hepatol. 2018; 69 (4): 905 - 915. https://doi.org/10.1016/j.jhep.2018.06.023.
207. Алексеенко С.А., Агеева Е.А., Полковникова О.П. Современные подходы к диагностике и лечению гипераммониемии у пациентов с хроническими заболеваниями печени на доцирротической стадии. РМЖ. Медицинское обозрение. 2018; 2 (7-1): 19 - 23. Режим доступа: https://www.rmj.ru/articles/gastroenterologiya/Sovremennye_podhody_k_diagnostike_i_lecheniyu_giperammoniemii_u_pacientov_s_hronicheskimi_zabolevaniyami_pecheni_na_docirroticheskoy_stadii/.
208. Tian LY, Lu LG, Tang CW, Xie Y, Luo HS, Tan SY et al. Aspartate-ornithine granules in the treatment of nonalcoholic steatohepatitis: a multiple-dose parallel controlled clinical trial. Zhonghua Gan Zang Bing Za Zhi. 2013; 21 (7): 528 - 532. (In Chinese) https://doi.org/10.3760/cma.j.issn.1007-3418.2013.07.013.
209. Pichon C, Nachit M, Gillard J, Vande Velde G, Lanthier N, Leclercq IA. Impact of L-ornithine L-aspartate on non-alcoholic steatohepatitis-associated hyperammonemia and muscle alterations. Front Nutr. 2022; 9: 1051157. https://doi.org/10.3389/fnut.2022.1051157.
210. Prikhodko VA, Sysoev YuI, Poveryaeva MA, Bunyat AV, Karev VE, Ivkin DYu et al. Effects of empagliflozin and L-ornithine L-aspartate on behavior, cognitive functions, and physical performance in mice with experimentally induced steatohepatitis. Bulletin of Russian State Medical University. 2020; (3): 49 - 57. https://doi.org/10.24075/brsmu.2020.034.
211. Оковитый С.В., Райхельсон К.Л., Приходько В.А. Комбинированная гепатопротекторная фармакотерапия заболеваний печени. Экспериментальная и клиническая гастроэнтерология. 2022; (7): 5 - 20. https://doi.org/10.31146/1682-8658-ecg-203-7-5-20.
212. Dufour JF, Oneta CM, Gonvers JJ, Bihl F, Cerny A, Cereda JM et al. Randomized placebo-controlled trial of ursodeoxycholic acid with vitamin e in nonalcoholic steatohepatitis. Clin Gastroenterol Hepatol. 2006; 4 (12): 1537 - 1543. https://doi.org/10.1016/j.cgh.2006.09.025.
213. Pietu F, Guillaud O, Walter T, Vallin M, Hervieu V, Scoazec JY, Dumortier J. Ursodeoxycholic acid with vitamin E in patients with nonalcoholic steatohepatitis: long-term results. Clin Res Hepatol Gastroenterol. 2012; 36 (2): 146 - 155. https://doi.org/10.1016/j.clinre.2011.10.011.
214. Balmer ML, Siegrist K, Zimmermann A, Dufour JF. Effects of ursodeoxycholic acid in combination with vitamin E on adipokines and apoptosis in patients with nonalcoholic steatohepatitis. Liver Int. 2009; 29 (8): 1184 - 1188. https://doi.org/10.1111/j.1478-3231.2009.02037.x.
215. Thomsen MN, Skytte MJ, Samkani A, Carl MH, Weber P, Astrup A et al. Dietary carbohydrate restriction augments weight loss-induced improvements in glycaemic control and liver fat in inpiduals with type 2 diabetes: a randomised controlled trial. Diabetologia. 2022; 65 (3): 506 - 517. https://doi.org/10.1007/s00125-021-05628-8.
216. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015; 149 (2): 367 - 378.e5. https://doi.org/10.1053/j.gastro.2015.04.005.
217. Wong C, Lee MH, Yaow CYL, Chin YH, Goh XL, Ng CH et al. Glucagon-Like Peptide-1 Receptor Agonists for Non-Alcoholic Fatty Liver Disease in Type 2 Diabetes: A Meta-Analysis. Front Endocrinol (Lausanne). 2021; 12: 609110. https://doi.org/10.3389/fendo.2021.609110.
218. Fan S, Shi X, Yao J, Zhong M, Feng P. The efficacy of glucagon-like peptide 1 receptor agonists in patients with non-alcoholic fatty liver disease: a systematic review and meta-analysis of randomized controlled trials. Rev Esp Enferm Dig. 2020; 112 (8): 627 - 635. https://doi.org/10.17235/reed.2020.6392/2019.
219. Newsome PN, Buchholtz K, Cusi K, Linder M, Okanoue T, Ratziu V et al. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med. 2021; 384 (12): 1113 - 1124. https://doi.org/10.1056/NEJMoa2028395.
220. Zhu K, Kakkar R, Chahal D, Yoshida EM, Hussaini T. Efficacy and safety of semaglutide in non-alcoholic fatty liver disease. World J Gastroenterol. 2023; 29 (37): 5327 - 5338. https://doi.org/10.3748/wjg.v29.i37.5327.
221. Bandyopadhyay S, Das S, Samajdar SS, Joshi SR. Role of semaglutide in the treatment of nonalcoholic fatty liver disease or non-alcoholic steatohepatitis: A systematic review and meta-analysis. Diabetes Metab Syndr. 2023; 17 (10): 102849. https://doi.org/10.1016/j.dsx.2023.102849.
222. Gu Y, Sun L, Zhang W, Kong T, Zhou R, He Y et al. Comparative efficacy of 5 sodium-glucose cotransporter protein-2 (SGLT-2) inhibitor and 4 glucagon-like peptide-1 (GLP-1) receptor agonist drugs in non-alcoholic fatty liver disease: A GRADE-assessed systematic review and network meta-analysis of randomized controlled trials. Front Pharmacol. 2023; 14: 1102792. https://doi.org/10.3389/fphar.2023.1102792.
223. Parab P, Chaudhary P, Mukhtar S, Moradi A, Kodali A, Okoye C et al. Role of Glucagon-Like Peptide-1 (GLP-1) Receptor Agonists in Cardiovascular Risk Management in Patients With Type 2 Diabetes Mellitus: A Systematic Review. Cureus. 2023; 15 (9): e45487. https://doi.org/10.7759/cureus.45487.
224. Banerjee M, Pal R, Mukhopadhyay S, Nair K. GLP-1 Receptor Agonists and Risk of Adverse Cerebrovascular Outcomes in Type 2 Diabetes: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. J Clin Endocrinol Metab. 2023; 108 (7): 1806 - 1812. https://doi.org/10.1210/clinem/dgad076.
225. Gomes DA, Presume J, de ![]()
 P, Almeida MS, Mendes M, Ferreira J. Association Between the Magnitude of Glycemic Control and Body Weight Loss With GLP-1 Receptor Agonists and Risk of Atherosclerotic Cardiovascular Disease: A Systematic Review and Meta-analyses of Randomized Diabetes Cardiovascular Outcomes Trials. Cardiovasc Drugs Ther. 2024. https://doi.org/10.1007/s10557-024-07547-3. Epub ahead of print.
P, Almeida MS, Mendes M, Ferreira J. Association Between the Magnitude of Glycemic Control and Body Weight Loss With GLP-1 Receptor Agonists and Risk of Atherosclerotic Cardiovascular Disease: A Systematic Review and Meta-analyses of Randomized Diabetes Cardiovascular Outcomes Trials. Cardiovasc Drugs Ther. 2024. https://doi.org/10.1007/s10557-024-07547-3. Epub ahead of print.
226. Cusi K, Orsak B, Bril F, Lomonaco R, Hecht J, Ortiz-Lopez C et al. Long-Term Pioglitazone Treatment for Patients With Nonalcoholic Steatohepatitis and Prediabetes or Type 2 Diabetes Mellitus: A Randomized Trial. Ann Intern Med. 2016; 165 (5): 305 - 315. https://doi.org/10.7326/M15-1774.
227. Musso G, Cassader M, Paschetta E, Gambino R. Thiazolidinediones and Advanced Liver Fibrosis in Nonalcoholic Steatohepatitis: A Meta-analysis. JAMA Intern Med. 2017; 177 (5): 633 - 640. https://doi.org/10.1001/jamainternmed.2016.9607.
228. Ndakotsu A, Vivekanandan G. The Role of Thiazolidinediones in the Amelioration of Nonalcoholic Fatty Liver Disease: A Systematic Review. Cureus. 2022; 14 (5): e25380. https://doi.org/10.7759/cureus.25380.
229. Budd J, Cusi K. Role of Agents for the Treatment of Diabetes in the Management of Nonalcoholic Fatty Liver Disease. Curr Diab Rep. 2020; 20 (11): 59. https://doi.org/10.1007/s11892-020-01349-1.
230. Государственный реестр лекарственных средств. Пиоглар. Номер ЛС-001671, дата регистрации 16.07.2011. Режим доступа: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=66ecaf50-2ba6-41a8-848f-de7e5b8c9220.
231. Gautam A, Agrawal PK, Doneria J, Nigam A. Effects of Canagliflozin on Abnormal Liver Function Tests in Patients of Type 2 Diabetes with Non-Alcoholic Fatty Liver Disease. J Assoc Physicians India. 2018; 66 (8): 62 - 66. Available at: https://pubmed.ncbi.nlm.nih.gov/31324087/.
232. Приходько В.А., Оковитый С.В., Куликов А.Н. Глифлозины при неалкогольной жировой болезни печени: перспективы применения за границами диабета, кардио- и нефропротекции. Терапия. 2023; 9 (7): 130 - 141. https://doi.org/10.18565/therapy.2023.7.130-141.
233. Wei Q, Xu X, Guo L, Li J, Li L. Effect of SGLT2 Inhibitors on Type 2 Diabetes Mellitus With Non-Alcoholic Fatty Liver Disease: A Meta-Analysis of Randomized Controlled Trials. Front Endocrinol (Lausanne). 2021; 12: 635556. https://doi.org/10.3389/fendo.2021.635556.
234. Mo M, Huang Z, Liang Y, Liao Y, Xia N. The safety and efficacy evaluation of sodium-glucose co-transporter 2 inhibitors for patients with non-alcoholic fatty liver disease: An updated meta-analysis. Dig Liver Dis. 2022; 54 (4): 461 - 468. https://doi.org/10.1016/j.dld.2021.08.017.
235. Jin Z, Yuan Y, Zheng C, Liu S, Weng H. Effects of sodium-glucose co-transporter 2 inhibitors on liver fibrosis in non-alcoholic fatty liver disease patients with type 2 diabetes mellitus: An updated meta-analysis of randomized controlled trials. J Diabetes Complications. 2023; 37 (8): 108558. https://doi.org/10.1016/j.jdiacomp.2023.108558.
236. Ong Lopez AMC, Pajimna JAT. Efficacy of sodium glucose cotransporter 2 inhibitors on hepatic fibrosis and steatosis in non-alcoholic fatty liver disease: an updated systematic review and meta-analysis. Sci Rep. 2024; 14 (1): 2122. https://doi.org/10.1038/s41598-024-52603-5.
237.  A, Sahebkar A,
A, Sahebkar A,  M,
M,  LE. Effect of ursodeoxycholic acid on glycemic markers: A systematic review and meta-analysis of clinical trials. Pharmacol Res. 2018; 135: 144 - 149. https://doi.org/10.1016/j.phrs.2018.08.008.
LE. Effect of ursodeoxycholic acid on glycemic markers: A systematic review and meta-analysis of clinical trials. Pharmacol Res. 2018; 135: 144 - 149. https://doi.org/10.1016/j.phrs.2018.08.008.
238. Elhini SH, Wahsh EA, Elberry AA, El Ameen NF, Abdelfadil Saedii A, Refaie SM et al. The Impact of an SGLT2 Inhibitor versus Ursodeoxycholic Acid on Liver Steatosis in Diabetic Patients. Pharmaceuticals (Basel). 2022; 15 (12): 1516. https://doi.org/10.3390/ph15121516.
239. Houttu V, Csader S, Nieuwdorp M, Holleboom AG, Schwab U. Dietary Interventions in Patients With Non-alcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Front Nutr. 2021; 8: 716783. https://doi.org/10.3389/fnut.2021.716783.
240. Koutoukidis DA, Astbury NM, Tudor KE, Morris E, Henry JA, Noreik M et al. Association of Weight Loss Interventions With Changes in Biomarkers of Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-analysis. JAMA Intern Med. 2019; 179 (9): 1262 - 1271. https://doi.org/10.1001/jamainternmed.2019.2248.
241. Ezpeleta M, Gabel K, Cienfuegos S, Kalam F, Lin S, Pavlou V et al. Effect of alternate day fasting combined with aerobic exercise on non-alcoholic fatty liver disease: A randomized controlled trial. Cell Metab. 2023; 35 (1): 56 - 70.e3. https://doi.org/10.1016/j.cmet.2022.12.001.
242. Haufe S, Engeli S, Kast P,  J, Utz W, Haas V et al. Randomized comparison of reduced fat and reduced carbohydrate hypocaloric diets on intrahepatic fat in overweight and obese human subjects. Hepatology. 2011; 53 (5): 1504 - 1514. https://doi.org/10.1002/hep.24242.
J, Utz W, Haas V et al. Randomized comparison of reduced fat and reduced carbohydrate hypocaloric diets on intrahepatic fat in overweight and obese human subjects. Hepatology. 2011; 53 (5): 1504 - 1514. https://doi.org/10.1002/hep.24242.
243. Asrih M, Jornayvaz FR. Diets and nonalcoholic fatty liver disease: the good and the bad. Clin Nutr. 2014; 33 (2): 186 - 190. https://doi.org/10.1016/j.clnu.2013.11.003.
244. Lemstra M, Bird Y, Nwankwo C, Rogers M, Moraros J. Weight loss intervention adherence and factors promoting adherence: a meta-analysis. Patient Prefer Adherence. 2016; 10: 1547 - 1559. https://doi.org/10.2147/PPA.S103649.
245. Scragg J, Hallsworth K, Taylor G, Cassidy S, Haigh L, Boyle M et al. Factors associated with engagement and adherence to a low-energy diet to promote 10% weight loss in patients with clinically significant non-alcoholic fatty liver disease. BMJ Open Gastroenterol. 2021; 8 (1): e000678. https://doi.org/10.1136/bmjgast-2021-000678.
246. Armstrong MJ, Gaunt P, Aithal GP, Barton D, Hull D, Parker R et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016; 387 (10019): 679 - 690. https://doi.org/10.1016/S0140-6736(15)00803-X.
247.  T, Christensen M, Junker AE, Knop FK, Gluud LL. Effects of glucagon-like peptide-1 receptor agonists on weight loss: systematic review and meta-analyses of randomised controlled trials. BMJ. 2012; 344: d7771. https://doi.org/10.1136/bmj.d7771.
T, Christensen M, Junker AE, Knop FK, Gluud LL. Effects of glucagon-like peptide-1 receptor agonists on weight loss: systematic review and meta-analyses of randomised controlled trials. BMJ. 2012; 344: d7771. https://doi.org/10.1136/bmj.d7771.
248. Stokes CS, Gluud LL, Casper M, Lammert F. Ursodeoxycholic acid and diets higher in fat prevent gallbladder stones during weight loss: a meta-analysis of randomized controlled trials. Clin Gastroenterol Hepatol. 2014; 12 (7): 1090 - 1100.e2. https://doi.org/10.1016/j.cgh.2013.11.031.
249. Fearon NM, Kearns EC, Kennedy CA, Conneely JB, Heneghan HM. The impact of ursodeoxycholic acid on gallstone disease after bariatric surgery: a meta-analysis of randomized control trials. Surg Obes Relat Dis. 2022; 18 (1): 77 - 84. https://doi.org/10.1016/j.soard.2021.10.004.
250. Mulliri A, Menahem B, Alves A, Dupont B. Ursodeoxycholic acid for the prevention of gallstones and subsequent cholecystectomy after bariatric surgery: a meta-analysis of randomized controlled trials. J Gastroenterol. 2022; 57 (8): 529 - 539. https://doi.org/10.1007/s00535-022-01886-4.
251. Johansson K,  J, Marcus C, Hemmingsson E, Neovius M. Risk of symptomatic gallstones and cholecystectomy after a very-low-calorie diet or low-calorie diet in a commercial weight loss program: 1-year matched cohort study. Int J Obes (Lond). 2014; 38 (2): 279 - 284. https://doi.org/10.1038/ijo.2013.83.
J, Marcus C, Hemmingsson E, Neovius M. Risk of symptomatic gallstones and cholecystectomy after a very-low-calorie diet or low-calorie diet in a commercial weight loss program: 1-year matched cohort study. Int J Obes (Lond). 2014; 38 (2): 279 - 284. https://doi.org/10.1038/ijo.2013.83.
252. European Association for the Study of the Liver (EASL). EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones. J Hepatol. 2016; 65 (1): 146 - 181. https://doi.org/10.1016/j.jhep.2016.03.005.
253. Uy MC, Talingdan-Te MC, Espinosa WZ, Daez ML, Ong JP. Ursodeoxycholic acid in the prevention of gallstone formation after bariatric surgery: a meta-analysis. Obes Surg. 2008; 18 (12): 1532 - 1538. https://doi.org/10.1007/s11695-008-9587-7.
254. Dongiovanni P, Petta S, Mannisto V, Mancina RM, Pipitone R, Karja V et al. Statin use and non-alcoholic steatohepatitis in at risk inpiduals. J Hepatol. 2015; 63 (3): 705 - 712. https://doi.org/10.1016/j.jhep.2015.05.006.
255. Zhou H, Toshiyoshi M, Zhao W, Zhao Y, Zhao Y. Statins on nonalcoholic fatty liver disease: A systematic review and meta-analysis of 14 RCTs. Medicine (Baltimore). 2023; 102(26): e33981. https://doi.org/10.1097/MD.0000000000033981.
256. Pastori D, Sciacqua A, Marcucci R, Del Ben M, Baratta F, Violi F, Pignatelli P. Non-alcoholic fatty liver disease (NAFLD), metabolic syndrome and cardiovascular events in atrial fibrillation. A prospective multicenter cohort study. Intern Emerg Med. 2021; 16 (8): 2063 - 2068. https://doi.org/10.1007/s11739-021-02682-3.
257. Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020; 41 (1): 111 - 188. https://doi.org/10.1093/eurheartj/ehz455.
258. Pastori D, Pani A, Di Rocco A, Menichelli D, Gazzaniga G, Farcomeni A et al. Statin liver safety in non-alcoholic fatty liver disease: A systematic review and metanalysis. Br J Clin Pharmacol. 2022; 88 (2): 441 - 451. https://doi.org/10.1111/bcp.14943.
259. Abdallah M, Brown L, Provenza J, Tariq R, Gowda S, Singal AK. Safety and efficacy of dyslipidemia treatment in NAFLD patients: a meta-analysis of randomized controlled trials. Ann Hepatol. 2022; 27 (6): 100738. https://doi.org/10.1016/j.aohep.2022.100738.
260. Athyros VG, Boutari C, Stavropoulos K, Anagnostis P, Imprialos KP, Doumas M, Karagiannis A. Statins: An Under-Appreciated Asset for the Prevention and the Treatment of NAFLD or NASH and the Related Cardiovascular Risk. Curr Vasc Pharmacol. 2018; 16 (3): 246 - 253. https://doi.org/10.2174/1570161115666170621082910.
261.  JD,
JD,  L,
L,  F. Statins in Non-alcoholic Steatohepatitis. Front Cardiovasc Med. 2021; 8: 777131. https://doi.org/10.3389/fcvm.2021.777131.
F. Statins in Non-alcoholic Steatohepatitis. Front Cardiovasc Med. 2021; 8: 777131. https://doi.org/10.3389/fcvm.2021.777131.
262. Aithal GP, Watkins PB, Andrade RJ, Larrey D, Molokhia M, Takikawa H e al. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther. 2011; 89 (6): 806 - 815. https://doi.org/10.1038/clpt.2011.58.
263. Марцевич С.Ю., Кутишенко Н.П., Дроздова Л.Ю., Лерман О.В., Невзорова В.А., Резник И.И. и др. Исследование РАКУРС: повышение эффективности и безопасности терапии статинами у больных с заболеваниями печени, желчного пузыря и/или желчевыводящих путей с помощью урсодеоксихолевой кислоты. Терапевтический архив. 2014; 86 (12): 48 - 52. https://doi.org/10.17116/terarkh2014861248-52.
264. Nadinskaya M, Martsevich S, Kutishenko N, Balashov I, Lerman O. P0624 Ursodeoxycholic acid influence on efficacy and safety of statin therapy in patients with high risk of cardiovascular events and nonalcoholic fatty liver disease: the RACURS study (post-hoc analysis). United European Gastroenterol J. 2015; 3 (Suppl. 5): P0624. https://doi.org/10.1177/2050640615601623.
265. Cabezas Gelabert R. Efecto del ![]()
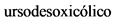 combinado con estatinas para el tratamiento de la hipercolesterolemia: ensayo
combinado con estatinas para el tratamiento de la hipercolesterolemia: ensayo ![]() prospectivo. Rev Clin Esp. 2004; 204 (12): 632 - 635. https://doi.org/10.1016/s0014-2565(04)71566-0.
prospectivo. Rev Clin Esp. 2004; 204 (12): 632 - 635. https://doi.org/10.1016/s0014-2565(04)71566-0.
266. Seo SH, Lee DH, Lee YS, Cho KJ, Park HJ, Lee HW et al. Co-administration of ursodeoxycholic acid with rosuvastatin/ezetimibe in a non-alcoholic fatty liver disease model. Gastroenterol Rep (Oxf). 2022; 10: goac037. https://doi.org/10.1093/gastro/goac037.
267. Nakade Y, Murotani K, Inoue T, Kobayashi Y, Yamamoto T, Ishii N et al. Ezetimibe for the treatment of non-alcoholic fatty liver disease: A meta-analysis. Hepatol Res. 2017; 47 (13): 1417 - 1428. https://doi.org/10.1111/hepr.12887.
268. Lee HY, Jun DW, Kim HJ, Oh H, Saeed WK, Ahn H et al. Ezetimibe decreased nonalcoholic fatty liver disease activity score but not hepatic steatosis. Korean J Intern Med. 2019; 34 (2): 296 - 304. https://doi.org/10.3904/kjim.2017.194.
269. Cho Y, Rhee H, Kim YE, Lee M, Lee BW, Kang ES et al. Ezetimibe combination therapy with statin for non-alcoholic fatty liver disease: an open-label randomized controlled trial (ESSENTIAL study). BMC Med. 2022; 20 (1): 93. https://doi.org/10.1186/s12916-022-02288-2.
270. Lee CH, Fu Y, Yang SJ, Chi CC. Effects of Omega-3 Polyunsaturated Fatty Acid Supplementation on Non-Alcoholic Fatty Liver: A Systematic Review and Meta-Analysis. Nutrients. 2020; 12 (9): 2769. https://doi.org/10.3390/nu12092769.
271. Musazadeh V, Karimi A, Malekahmadi M, Ahrabi SS, Dehghan P. Omega-3 polyunsaturated fatty acids in the treatment of non-alcoholic fatty liver disease: An umbrella systematic review and meta-analysis. Clin Exp Pharmacol Physiol. 2023; 50 (5): 327 - 334. https://doi.org/10.1111/1440-1681.13750.
272. Yan JH, Guan BJ, Gao HY, Peng XE. Omega-3 polyunsaturated fatty acid supplementation and non-alcoholic fatty liver disease: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2018; 97 (37): e12271. https://doi.org/10.1097/MD.0000000000012271.
273. Maciejewska-Markiewicz D, Stachowska E,  V, Stachowska L, Prowans P. The Role of Resolvins, Protectins and Marensins in Non-Alcoholic Fatty Liver Disease (NAFLD). Biomolecules. 2021; 11 (7): 937. https://doi.org/10.3390/biom11070937.
V, Stachowska L, Prowans P. The Role of Resolvins, Protectins and Marensins in Non-Alcoholic Fatty Liver Disease (NAFLD). Biomolecules. 2021; 11 (7): 937. https://doi.org/10.3390/biom11070937.
274. Bhatt DL, Steg PG, Miller M, Brinton EA, Jacobson TA, Ketchum SB et al. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med. 2019; 380 (1): 11 - 22. https://doi.org/10.1056/NEJMoa1812792.
275. Sanyal AJ, Abdelmalek MF, Suzuki A, Cummings OW, Chojkier M. No significant effects of ethyl-eicosapentanoic acid on histologic features of nonalcoholic steatohepatitis in a phase 2 trial. Gastroenterology. 2014; 147 (2): 377 - 384.e1. https://doi.org/10.1053/j.gastro.2014.04.046.
276. Scorletti E, Bhatia L, McCormick KG, Clough GF, Nash K, Hodson L et al. Effects of purified eicosapentaenoic and docosahexaenoic acids in nonalcoholic fatty liver disease: results from the Welcome* study. Hepatology. 2014; 60 (4): 1211 - 1221. https://doi.org/10.1002/hep.27289.
277. Hilleman DE, Wiggins BS, Bottorff MB. Critical Differences Between Dietary Supplement and Prescription Omega-3 Fatty Acids: A Narrative Review. Adv Ther. 2020; 37 (2): 656 - 670. https://doi.org/10.1007/s12325-019-01211-1.
278.  C,
C,  M, Colina F,
M, Colina F,  G, Vargas C,
G, Vargas C,  JA. A pilot trial of fenofibrate for the treatment of non-alcoholic fatty liver disease. Dig Liver Dis. 2008; 40(3): 200 - 205. https://doi.org/10.1016/j.dld.2007.10.002.
JA. A pilot trial of fenofibrate for the treatment of non-alcoholic fatty liver disease. Dig Liver Dis. 2008; 40(3): 200 - 205. https://doi.org/10.1016/j.dld.2007.10.002.
279. Mahmoudi A, Moallem SA, Johnston TP, Sahebkar A. Liver Protective Effect of Fenofibrate in NASH/NAFLD Animal Models. PPAR Res. 2022: 5805398. https://doi.org/10.1155/2022/5805398.
280. Lawitz EJ, Bhandari BR, Ruane PJ, Kohli A, Harting E, Ding D et al. Fenofibrate Mitigates Hypertriglyceridemia in Nonalcoholic Steatohepatitis Patients Treated With Cilofexor/Firsocostat. Clin Gastroenterol Hepatol. 2023; 21 (1): 143 - 152.e3. https://doi.org/10.1016/j.cgh.2021.12.044.
281. Maev IV, Samsonov AA, Palgova LK, Pavlov CS, Shirokova EN, Vovk EI, Starostin KM. Effectiveness of phosphatidylcholine as adjunctive therapy in improving liver function tests in patients with non-alcoholic fatty liver disease and metabolic comorbidities: real-life observational study from Russia. BMJ Open Gastroenterol. 2020; 7 (1): e000368. https://doi.org/10.1136/bmjgast-2019-000368.
282. Dajani AI, Popovic B. Essential phospholipids for nonalcoholic fatty liver disease associated with metabolic syndrome: A systematic review and network meta-analysis. World J Clin Cases. 2020; 8 (21): 5235 - 5249. https://doi.org/10.12998/wjcc.v8.i21.5235.
283. Kuche K, Bhargavi N, Dora CP, Jain S. Drug-Phospholipid Complex - a Go Through Strategy for Enhanced Oral Bioavailability. AAPS PharmSciTech. 2019; 20 (2): 43. https://doi.org/10.1208/s12249-018-1252-4.
284. Оковитый С.В., Болотова В.Ц., Анисимова Н.А., Ивкин Д.Ю., Титович И.А., Сысоев Ю.И., Напалкова С.М. Перспективы применения растительных извлечений для коррекции нарушений жирового и углеводного обмена. Фармация. 2020; 69 (2): 17 - 22. https://doi.org/10.29296/25419218-2020-02-03.
285. Dimakopoulou A, Sfikas G, Athyros V. PCSK9 administration ameliorates non alcoholic fatty disease in patients with heterozygous familial hyperlipidemia. Hell J Atheroscler. 2018; 9: 12. https://doi.org/10.23803/HJA.V9I2.175.G150.
286. Rimbert A, Smati S, Dijk W, Le May C, Cariou B. Genetic Inhibition of PCSK9 and Liver Function. JAMA Cardiol. 2021; 6 (3): 353 - 354. https://doi.org/10.1001/jamacardio.2020.5341.
287. Jang HR, Kang D, Sinn DH, Gu S, Cho SJ, Lee JE et al. Nonalcoholic fatty liver disease accelerates kidney function decline in patients with chronic kidney disease: a cohort study. Sci Rep. 2018; 8 (1): 4718. https://doi.org/10.1038/s41598-018-23014-0.
288. Musso G, Gambino R, Tabibian JH, Ekstedt M, Kechagias S, Hamaguchi M et al. Association of non-alcoholic fatty liver disease with chronic kidney disease: a systematic review and meta-analysis. PLoS Med. 2014; 11 (7): e1001680. https://doi.org/10.1371/journal.pmed.1001680.
289. Targher G, Chonchol M, Bertolini L, Rodella S, Zenari L, Lippi G et al. Increased risk of CKD among type 2 diabetics with nonalcoholic fatty liver disease. J Am Soc Nephrol. 2008; 19 (8): 1564 - 1570. https://doi.org/10.1681/ASN.2007101155.
290. Heda R, Yazawa M, Shi M, Bhaskaran M, Aloor FZ, Thuluvath PJ, Satapathy SK. Non-alcoholic fatty liver and chronic kidney disease: Retrospect, introspect, and prospect. World J Gastroenterol. 2021; 27 (17): 1864 - 1882. https://doi.org/10.3748/wjg.v27.i17.1864.
291. Monteillet L, Gjorgjieva M, Silva M, Verzieux V, Imikirene L, Duchampt A et al. Intracellular lipids are an independent cause of liver injury and chronic kidney disease in non alcoholic fatty liver disease-like context. Mol Metab. 2018; 16: 100 - 115. https://doi.org/10.1016/j.molmet.2018.07.006.
292. Shimano H, Sato R. SREBP-regulated lipid metabolism: convergent physiology - pergent pathophysiology. Nat Rev Endocrinol. 2017; 13 (12): 710 - 730. https://doi.org/10.1038/nrendo.2017.91.
293. Marcuccilli M, Chonchol M. NAFLD and Chronic Kidney Disease. Int J Mol Sci. 2016; 17 (4): 562. https://doi.org/10.3390/ijms17040562.
294. Kwon SY, Park J, Park SH, Lee YB, Kim G, Hur KY et al. MAFLD and NAFLD in the prediction of incident chronic kidney disease. Sci Rep. 2023; 13 (1): 1796. https://doi.org/10.1038/s41598-023-27762-6.
295. Zhang X, Wong GL, Yip TC, Tse YK, Liang LY, Hui VW et al. Angiotensin-converting enzyme inhibitors prevent liver-related events in nonalcoholic fatty liver disease. Hepatology. 2022; 76 (2): 469 - 482. https://doi.org/10.1002/hep.32294.
296. Hirata T, Tomita K, Kawai T, Yokoyama H, Shimada A, Kikuchi M et al. Effect of Telmisartan or Losartan for Treatment of Nonalcoholic Fatty Liver Disease: Fatty Liver Protection Trial by Telmisartan or Losartan Study (FANTASY). Int J Endocrinol. 2013: 587140. https://doi.org/10.1155/2013/587140.
297. Georgescu EF, Georgescu M. Therapeutic options in non-alcoholic steatohepatitis (NASH). Are all agents alike? Results of a preliminary study. J Gastrointestin Liver Dis. 2007; 16 (1): 39 - 46. Available at: https://www.jgld.ro/jgld/index.php/jgld/article/view/2007.1.6.
298. Georgescu EF, Ionescu R, Niculescu M, Mogoanta L, Vancica L. Angiotensin-receptor blockers as therapy for mild-to-moderate hypertension-associated non-alcoholic steatohepatitis. World J Gastroenterol. 2009; 15 (8): 942 - 954. https://doi.org/10.3748/wjg.15.942.
299. Yokohama S, Yoneda M, Haneda M, Okamoto S, Okada M, Aso K et al. Therapeutic efficacy of an angiotensin II receptor antagonist in patients with nonalcoholic steatohepatitis. Hepatology. 2004; 40 (5): 1222 - 1225. https://doi.org/10.1002/hep.20420.
300. Osterreicher CH, Taura K, De Minicis S, Seki E, Penz-Osterreicher M, Kodama Y et al. Angiotensin-converting-enzyme 2 inhibits liver fibrosis in mice. Hepatology. 2009; 50 (3): 929 - 938. https://doi.org/10.1002/hep.23104.
301. Ala M. SGLT2 Inhibition for Cardiovascular Diseases, Chronic Kidney Disease, and NAFLD. Endocrinology. 2021; 162 (12): bqab157. https://doi.org/10.1210/endocr/bqab157.
302. Toyama T, Neuen BL, Jun M, Ohkuma T, Neal B, Jardine MJ et al. Effect of SGLT2 inhibitors on cardiovascular, renal and safety outcomes in patients with type 2 diabetes mellitus and chronic kidney disease: A systematic review and meta-analysis. Diabetes Obes Metab. 2019; 21 (5): 1237 - 1250. https://doi.org/10.1111/dom.13648.
303. Sarafidis P, Ferro CJ, Morales E, Ortiz A, Malyszko J, Hojs R et al. SGLT-2 inhibitors and GLP-1 receptor agonists for nephroprotection and cardioprotection in patients with diabetes mellitus and chronic kidney disease. A consensus statement by the EURECA-m and the DIABESITY working groups of the ERA-EDTA. Nephrol Dial Transplant. 2019; 34 (2): 208 - 230. https://doi.org/10.1093/ndt/gfy407.
304. Musso G, Cassader M, Cohney S, De Michieli F, Pinach S, Saba F, Gambino R. Fatty Liver and Chronic Kidney Disease: Novel Mechanistic Insights and Therapeutic Opportunities. Diabetes Care. 2016; 39 (10): 1830 - 1845. https://doi.org/10.2337/dc15-1182.
305. Heerspink HJL,  BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020; 383 (15): 1436 - 1446. https://doi.org/10.1056/NEJMoa2024816.
BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020; 383 (15): 1436 - 1446. https://doi.org/10.1056/NEJMoa2024816.
306. Herrington WG, Staplin N, Wanner C, Green JB, Hauske SJ, Emberson JR et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023; 388 (2): 117 - 127. https://doi.org/10.1056/NEJMoa2204233.
307. Palmer SC, Tendal B, Mustafa RA, Vandvik PO, Li S, Hao Q et al. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 2021; 372: m4573. https://doi.org/10.1136/bmj.m4573.
308. Greco EV, Russo G, Giandalia A, Viazzi F, Pontremoli R, De Cosmo S. GLP-1 Receptor Agonists and Kidney Protection. Medicina (Kaunas). 2019; 55 (6): 233. https://doi.org/10.3390/medicina55060233.
309. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016; 375 (4): 311 - 322. https://doi.org/10.1056/NEJMoa1603827.
310. Marso SP, Bain SC, Consoli A, Eliaschewitz FG, ![]() E, Leiter LA et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016; 375 (19): 1834 - 1844. https://doi.org/10.1056/NEJMoa1607141.
E, Leiter LA et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016; 375 (19): 1834 - 1844. https://doi.org/10.1056/NEJMoa1607141.
311. Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet. 2019; 394 (10193): 121 - 130. https://doi.org/10.1016/S0140-6736(19)31149-3.
312. Zhang Y, Jiang L, Wang J, Wang T, Chien C, Huang W et al. Network meta-analysis on the effects of finerenone versus SGLT2 inhibitors and GLP-1 receptor agonists on cardiovascular and renal outcomes in patients with type 2 diabetes mellitus and chronic kidney disease. Cardiovasc Diabetol. 2022; 21 (1): 232. https://doi.org/10.1186/s12933-022-01676-5.
313. Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980; 55 (7): 434 - 438. Available at: https://pubmed.ncbi.nlm.nih.gov/7382552/.
314. Powell EE, Cooksley WG, Hanson R, Searle J, Halliday JW, Powell LW. The natural history of nonalcoholic steatohepatitis: a follow-up study of forty-two patients for up to 21 years. Hepatology. 1990; 11 (1): 74 - 80. https://doi.org/10.1002/hep.1840110114.
315. Ajmera V, Belt P, Wilson LA, Gill RM, Loomba R, Kleiner DE et al. Among Patients With Nonalcoholic Fatty Liver Disease, Modest Alcohol Use Is Associated With Less Improvement in Histologic Steatosis and Steatohepatitis. Clin Gastroenterol Hepatol. 2018; 16 (9): 1511 - 1520. e5. https://doi.org/10.1016/j.cgh.2018.01.026.
316. Kimura T, Tanaka N, Fujimori N, Sugiura A, Yamazaki T, Joshita S et al. Mild drinking habit is a risk factor for hepatocarcinogenesis in non-alcoholic fatty liver disease with advanced fibrosis. World J Gastroenterol. 2018; 24 (13): 1440 - 1450. https://doi.org/10.3748/wjg.v24.i13.1440.
317. Younossi ZM, Stepanova M, Ong J, Yilmaz Y, Duseja A, Eguchi Y et al. Effects of Alcohol Consumption and Metabolic Syndrome on Mortality in Patients With Nonalcoholic and Alcohol-Related Fatty Liver Disease. Clin Gastroenterol Hepatol. 2019; 17 (8): 1625 - 1633. e1. https://doi.org/10.1016/j.cgh.2018.11.033.
318. Ekstedt M,  LE, Holmqvist M, Bendtsen P, Mathiesen UL, Bodemar G, Kechagias S. Alcohol consumption is associated with progression of hepatic fibrosis in non-alcoholic fatty liver disease. Scand J Gastroenterol. 2009; 44 (3): 366 - 374. https://doi.org/10.1080/00365520802555991.
LE, Holmqvist M, Bendtsen P, Mathiesen UL, Bodemar G, Kechagias S. Alcohol consumption is associated with progression of hepatic fibrosis in non-alcoholic fatty liver disease. Scand J Gastroenterol. 2009; 44 (3): 366 - 374. https://doi.org/10.1080/00365520802555991.
319. Sookoian S,  GO, Pirola CJ. Modest alcohol consumption decreases the risk of non-alcoholic fatty liver disease: a meta-analysis of 43 175 inpiduals. Gut. 2014; 63 (3): 530 - 532. https://doi.org/10.1136/gutjnl-2013-305718.
GO, Pirola CJ. Modest alcohol consumption decreases the risk of non-alcoholic fatty liver disease: a meta-analysis of 43 175 inpiduals. Gut. 2014; 63 (3): 530 - 532. https://doi.org/10.1136/gutjnl-2013-305718.
320. Cao G, Yi T, Liu Q, Wang M, Tang S. Alcohol consumption and risk of fatty liver disease: a meta-analysis. PeerJ. 2016; 4: e2633. https://doi.org/10.7717/peerj.2633.
321. Chang Y, Cho YK, Kim Y, Sung E, Ahn J, Jung HS et al. Nonheavy Drinking and Worsening of Noninvasive Fibrosis Markers in Nonalcoholic Fatty Liver Disease: A Cohort Study. Hepatology. 2019; 69 (1): 64 - 75. https://doi.org/10.1002/hep.30170.
322. Blomdahl J, Nasr P, Ekstedt M, Kechagias S. Moderate alcohol consumption is associated with significant fibrosis progression in NAFLD. Hepatol Commun. 2023; 7 (1): e0003. https://doi.org/10.1097/HC9.0000000000000003.
323. Ивашкин ВТ, Жаркова МС, Корочанская НВ, Хлынов ИБ, Успенский ЮП. Фенотипы неалкогольной жировой болезни печени в различных регионах Российской Федерации, диагностические и лечебные подходы в клинической практике. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2023; 33 (2): 7 - 18. https://doi.org/10.22416/1382-4376-2023-33-2-7-18.
324. Mato JM,  J,
J,  de Paz J,
de Paz J,  L, Coll S, Caballero A et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial. J Hepatol. 1999; 30 (6): 1081 - 1089. https://doi.org/10.1016/s0168-8278(99) 80263-3.
L, Coll S, Caballero A et al. S-adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo-controlled, double-blind, multicenter clinical trial. J Hepatol. 1999; 30 (6): 1081 - 1089. https://doi.org/10.1016/s0168-8278(99) 80263-3.
325. Rambaldi A, Gluud C. S-adenosyl-L-methionine for alcoholic liver diseases. Cochrane Database Syst Rev. 2006; (2): CD002235. https://doi.org/10.1002/14651858.CD002235.pub2.
326. Lassailly G, Caiazzo R, Buob D, Pigeyre M, Verkindt H, Labreuche J et al. Bariatric Surgery Reduces Features of Nonalcoholic Steatohepatitis in Morbidly Obese Patients. Gastroenterology. 2015; 149 (2): 379 - 388. https://doi.org/10.1053/j.gastro.2015.04.014.
327. Bower G, Toma T, Harling L, Jiao LR, Efthimiou E, Darzi A et al. Bariatric Surgery and Non-Alcoholic Fatty Liver Disease: a Systematic Review of Liver Biochemistry and Histology. Obes Surg. 2015; 25 (12): 2280 - 2289. https://doi.org/10.1007/s11695-015-1691-x.
328. Lee Y, Doumouras AG, Yu J, Brar K, Banfield L, Gmora S et al. Complete Resolution of Nonalcoholic Fatty Liver Disease After Bariatric Surgery: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2019; 17 (6): 1040 - 1060. e11. https://doi.org/10.1016/j.cgh.2018.10.017.
329. Fakhry TK, Mhaskar R, Schwitalla T, Muradova E, Gonzalvo JP, Murr MM. Bariatric surgery improves nonalcoholic fatty liver disease: a contemporary systematic review and meta-analysis. Surg Obes Relat Dis. 2019; 15 (3): 502 - 511. https://doi.org/10.1016/j.soard.2018.12.002.
330. Zhou H, Luo P, Li P, Wang G, Yi X, Fu Z et al. Bariatric Surgery Improves Nonalcoholic Fatty Liver Disease: Systematic Review and Meta-Analysis. Obes Surg. 2022; 32 (6): 1872 - 1883. https://doi.org/10.1007/s11695-022-06011-1.
331. Lazarus JV, Mark HE, Anstee QM, Arab JP, Batterham RL, Castera L et al. Advancing the global public health agenda for NAFLD: a consensus statement. Nat Rev Gastroenterol Hepatol. 2022; 19 (1): 60 - 78. https://doi.org/10.1038/s41575-021-00523-4.
332. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the Management of Non-Alcoholic Fatty Liver Disease. Obes Facts. 2016; 9 (2): 65 - 90. https://doi.org/10.1159/000443344.
333.  T,
T,  M, Vidal C, Barrera F. Lifestyle changes in patients with non-alcoholic fatty liver disease: A systematic review and meta-analysis. PLoS ONE. 2022; 17 (2): e0263931. https://doi.org/10.1371/journal.pone.0263931.
M, Vidal C, Barrera F. Lifestyle changes in patients with non-alcoholic fatty liver disease: A systematic review and meta-analysis. PLoS ONE. 2022; 17 (2): e0263931. https://doi.org/10.1371/journal.pone.0263931.
334. Glass LM, Hunt CM, Fuchs M, Su GL. Comorbidities and Nonalcoholic Fatty Liver Disease: The Chicken, the Egg, or Both? Fed Pract. 2019; 36 (2): 64 - 71. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6411365/.
335. Singh S, Singh PP, Singh AG, Murad MH, Sanchez W. Anti-diabetic medications and the risk of hepatocellular cancer: a systematic review and meta-analysis. Am J Gastroenterol. 2013; 108 (6): 881 - 891. https://doi.org/10.1038/ajg.2013.5.
336. Ma S, Zheng Y, Xiao Y, Zhou P, Tan H. Meta-analysis of studies using metformin as a reducer for liver cancer risk in diabetic patients. Medicine (Baltimore). 2017; 96 (19): e6888. https://doi.org/10.1097/MD.0000000000006888.
337. Zhou YY, Zhu GQ, Liu T, Zheng JN, Cheng Z, Zou TT et al. Systematic Review with Network Meta-Analysis: Antidiabetic Medication and Risk of Hepatocellular Carcinoma. Sci Rep. 2016; 6: 33743. https://doi.org/10.1038/srep33743.
338. Singh S, Singh PP, Singh AG, Murad MH, Sanchez W. Statins are associated with a reduced risk of hepatocellular cancer: a systematic review and meta-analysis. Gastroenterology. 2013; 144 (2): 323 - 332. https://doi.org/10.1053/j.gastro.2012.10.005.
339. Singal A, Volk ML, Waljee A, Salgia R, Higgins P, Rogers MA, Marrero JA. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis. Aliment Pharmacol Ther. 2009; 30 (1): 37 - 47. https://doi.org/10.1111/j.1365-2036.2009.04014.x.
340. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018; 69 (1): 182 - 236. https://doi.org/10.1016/j.jhep.2018.03.019.
341. Machado MV. The Growing Landscape of NAFLD-Associated Hepatocellular Carcinoma and Its Impact in Surveillance. GE Port J Gastroenterol. 2023; 31 (1): 14 - 23. https://doi.org/10.1159/000531397.
342. Younossi Z, Stepanova M, Ong JP, Jacobson IM, Bugianesi E, Duseja A et al. Nonalcoholic Steatohepatitis Is the Fastest Growing Cause of Hepatocellular Carcinoma in Liver Transplant Candidates. Clin Gastroenterol Hepatol. 2019; 17 (4): 748 - 755. e3. https://doi.org/10.1016/j.cgh.2018.05.057.
343. Ducreux M, Abou-Alfa GK, Bekaii-Saab T, Berlin J, Cervantes A, de Baere T et al. The management of hepatocellular carcinoma. Current expert opinion and recommendations derived from the 24th ESMO/World Congress on Gastrointestinal Cancer, Barcelona, 2022. ESMO Open. 2023; 8 (3): 101567. https://doi.org/10.1016/j.esmoop.2023.101567.
344. Adams LA, Lymp JF, St Sauver J, Sanderson SO, Lindor KD, Feldstein A, Angulo P. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 2005; 129 (1): 113 - 121. https://doi.org/10.1053/j.gastro.2005.04.014.
345. Hashimoto E, Yatsuji S, Tobari M, Taniai M, Torii N, Tokushige K, Shiratori K. Hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. J Gastroenterol. 2009; 44 (Suppl. 19): 89 - 95. https://doi.org/10.1007/s00535-008-2262-x.
346. Ascha MS, Hanouneh IA, Lopez R, Tamimi TA, Feldstein AF, Zein NN. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology. 2010; 51 (6): 1972 - 1978. https://doi.org/10.1002/hep.23527.
347. Bertot LC, Jeffrey GP, Wallace M, MacQuillan G, Garas G, Ching HL, Adams LA. Nonalcoholic fatty liver disease-related cirrhosis is commonly unrecognized and associated with hepatocellular carcinoma. Hepatol Commun. 2017; 1 (1): 53 - 60. https://doi.org/10.1002/hep4.1018.
348. Than NN, Ghazanfar A, Hodson J, Tehami N, Coldham C, Mergental H et al. Comparing clinical presentations, treatments and outcomes of hepatocellular carcinoma due to hepatitis C and non-alcoholic fatty liver disease. QJM. 2017; 110 (2): 73 - 81. https://doi.org/10.1093/qjmed/hcw151.
349. Yoo JJ, Park MY, Cho EJ, Yu SJ, Kim SG, Kim YJ, et al. Smoking Increases the Risk of Hepatocellular Carcinoma and Cardiovascular Disease in Patients with Metabolic-Associated Fatty Liver Disease. J Clin Med. 2023 May 8; 12 (9): 3336. doi: 10.3390/jcm12093336.
350. Caussy C, Soni M, Cui J, Bettencourt R, Schork N, Chen CH et al. Nonalcoholic fatty liver disease with cirrhosis increases familial risk for advanced fibrosis. J Clin Invest. 2017; 127 (7): 2697 - 2704. https://doi.org/10.1172/JCI93465.
351. Wijarnpreecha K, Thongprayoon C, Ungprasert P. Coffee consumption and risk of nonalcoholic fatty liver disease: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2017; 29 (2): e8 - e12. https://doi.org/10.1097/MEG.0000000000000776.
352. Hayat U, Siddiqui AA, Okut H, Afroz S, Tasleem S, Haris A. The effect of coffee consumption on the non-alcoholic fatty liver disease and liver fibrosis: A meta-analysis of 11 epidemiological studies. Ann Hepatol. 2021; 20: 100254. https://doi.org/10.1016/j.aohep.2020.08.071.
353. Kennedy OJ, Roderick P, Buchanan R, Fallowfield JA, Hayes PC, Parkes J. Coffee, including caffeinated and decaffeinated coffee, and the risk of hepatocellular carcinoma: a systematic review and dose-response meta-analysis. BMJ Open. 2017; 7 (5): e013739. https://doi.org/10.1136/bmjopen-2016-013739.
354. Shen H, Rodriguez AC, Shiani A, Lipka S, Shahzad G, Kumar A, Mustacchia P. Association between caffeine consumption and nonalcoholic fatty liver disease: a systemic review and meta-analysis. Therap Adv Gastroenterol. 2016; 9 (1): 113 - 120. https://doi.org/10.1177/1756283X15593700.
355. Chen YP, Lu FB, Hu YB, Xu LM, Zheng MH, Hu ED. A systematic review and a dose-response meta-analysis of coffee dose and nonalcoholic fatty liver disease. Clin Nutr. 2019; 38 (6): 2552 - 2557. https://doi.org/10.1016/j.clnu.2018.11.030.
356. Marventano S, Salomone F, Godos J, Pluchinotta F, Del Rio D, Mistretta A, Grosso G. Coffee and tea consumption in relation with non-alcoholic fatty liver and metabolic syndrome: A systematic review and meta-analysis of observational studies. Clin Nutr. 2016; 35 (6): 1269 - 1281. https://doi.org/10.1016/j.clnu.2016.03.012.
357. Ebadi M, Ip S, Bhanji RA, Montano-Loza AJ. Effect of Coffee Consumption on Non-Alcoholic Fatty Liver Disease Incidence, Prevalence and Risk of Significant Liver Fibrosis: Systematic Review with Meta-Analysis of Observational Studies. Nutrients. 2021; 13 (9): 3042. https://doi.org/10.3390/nu13093042.
358. Birerdinc A, Stepanova M, Pawloski L, Younossi ZM. Caffeine is protective in patients with non-alcoholic fatty liver disease. Aliment Pharmacol Ther. 2012; 35 (1): 76 - 82. https://doi.org/10.1111/j.1365-2036.2011.04916.x.
359. Inoue M, Yoshimi I, Sobue T, Tsugane S. Influence of coffee drinking on subsequent risk of hepatocellular carcinoma: a prospective study in Japan. J Natl Cancer Inst. 2005; 97 (4): 293 - 300. https://doi.org/10.1093/jnci/dji040.
360. Johnson S, Koh WP, Wang R, Govindarajan S, Yu MC, Yuan JM. Coffee consumption and reduced risk of hepatocellular carcinoma: findings from the Singapore Chinese Health Study. Cancer Causes Control. 2011; 22 (3): 503 - 510. https://doi.org/10.1007/s10552-010-9725-0.
361. Hu G, Tuomilehto J, Pukkala E, Hakulinen T, Antikainen R, Vartiainen E, Jousilahti P. Joint effects of coffee consumption and serum gamma-glutamyltransferase on the risk of liver cancer. Hepatology. 2008; 48 (1): 129 - 136. https://doi.org/10.1002/hep.22320.
362. Tanaka K, Hara M, Sakamoto T, Higaki Y, Mizuta T, Eguchi Y et al. Inverse association between coffee drinking and the risk of hepatocellular carcinoma: a case-control study in Japan. Cancer Sci. 2007; 98 (2): 214 - 218. https://doi.org/10.1111/j.1349-7006.2006.00368.x.
363. Zhang XL, Wang TY, Targher G, Byrne CD, Zheng MH. Lifestyle Interventions for Non-Obese Patients Both with, and at Risk, of Non-Alcoholic Fatty Liver Disease. Diabetes Metab J. 2022; 46 (3): 391 - 401. doi: 10.4093/dmj.2022.0048.
364. Zhao Y, Zhao W, Wang H, Zhao Y, Bu H, Takahashi H. Pioglitazone on nonalcoholic steatohepatitis: A systematic review and meta-analysis of 15 RCTs. Medicine (Baltimore). 2022; 101 (46): e31508. doi: 10.1097/MD.0000000000031508.
365. Machado FHF, Castro Filho HF, Babadopulos RFAL, Rocha HAL, Rocha JLC, Moraes Filho MO. Ursodeoxycholic acid in the prevention of gallstones in patients subjected to Roux-en-Y gastric bypass1. Acta Cir Bras. 2019 Feb 14; 34 (1): e20190010000009. doi: 10.1590/s0102-865020190010000009. Erratum in: Acta Cir Bras. 2019; 34 (4): e2019004ERRATA. doi: 10.1590/s0102-865020190010000009erratum.
366. Ratziu V, Massard J, Charlotte F, Messous D, Imbert-Bismut F, Bonyhay L, Tahiri M, Munteanu M, Thabut D, Cadranel JF, Le Bail B, de Ledinghen V, Poynard T; LIDO Study Group; CYTOL study group. Diagnostic value of biochemical markers (FibroTest-FibroSURE) for the prediction of liver fibrosis in patients with non-alcoholic fatty liver disease. BMC Gastroenterol. 2006; 6: 6. doi: 10.1186/1471-230X-6-6.
367. Vali Y, Lee J, Boursier J, Spijker R, Verheij J, Brosnan MJ, Anstee QM, Bossuyt PM, Zafarmand MH, On Behalf Of The Litmus Systematic Review Team. FibroTest for Evaluating Fibrosis in Non-Alcoholic Fatty Liver Disease Patients: A Systematic Review and Meta-Analysis. J Clin Med. 2021; 10 (11): 2415. doi: 10.3390/jcm10112415.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Руководители рабочей группы:
Ивашкин Владимир Трофимович - академик РАН, доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней лечебного факультета ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" (Сеченовский университет) Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Драпкина Оксана Михайловна - академик РАН, доктор медицинских наук, профессор, директор ФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России, президент Российского общества профилактики неинфекционных заболеваний. Конфликт интересов отсутствует.
Секретариат рабочей группы:
Маевская Марина Викторовна - доктор медицинских наук, профессор ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Райхельсон Карина Леонидовна - доктор медицинских наук, профессор Научно-клинического и образовательного центра гастроэнтерологии и гепатологии медицинского института Федерального государственного бюджетного образовательного учреждения высшего образования "Санкт-Петербургский государственный университет". Конфликт интересов отсутствует.
Оковитый Сергей Владимирович - доктор медицинских наук, профессор ФГБОУ ВО "Санкт-Петербургский государственный химико-фармацевтический университет" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Жаркова Мария Сергеевна - кандидат медицинских наук, заведующая отделением гепатологии Клиники пропедевтики внутренних болезней, гастроэнтерологии, гепатологии им. В.Х. Василенко ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Гречишникова Василиса Романовна - аспирант, ассистент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО "Первый Московский государственный университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Рабочая группа:
Абдулганиева Диана Ильдаровна - доктор медицинских наук, профессор, заведующая кафедрой госпитальной терапии ФГБОУ ВО "Казанский государственный медицинский университет" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Алексеенко Сергей Алексеевич - доктор медицинских наук, профессор, ФГБОУ ВО "Дальневосточный государственный медицинский университет" Министерства здравоохранения Российской Федерации (ДВГМУ). Конфликт интересов отсутствует.
Ардатская Мария Дмитриевна - доктор медицинских наук, профессор, ФГБУ ДПО "Центральная государственная медицинская академия" Управления делами Президента РФ. Конфликт интересов отсутствует.
Бакулин Игорь Геннадьевич - доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России. Конфликт интересов отсутствует.
Бакулина Наталья Валерьевна - доктор медицинских наук, профессор, проректор по науке и инновационной деятельности, зав. кафедрой внутренних болезней, клинической фармакологии и нефрологии, Северо-Западный государственный медицинский университет им. И.И. Мечникова. Конфликт интересов отсутствует.
Богомолов Павел Олегович - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней и гастроэнтерологии ФГБОУ ВО "МГМСУ им. А.И. Евдокимова", руководитель отделения и ведущий научный сотрудник гепатологического отделения ГБУЗ МО "МОНИКИ им. М.Ф. Владимирского". Конфликт интересов отсутствует.
Бредер Валерий Владимирович - доктор медицинских наук, заведующий отделом лекарственного лечения ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Винницкая Елена Владимировна - доктор медицинских наук, заведующая отделом гепатологии ГБУЗ ДЗМ "Московский клинический научно-практический центр имени А.С. Логинова Департамента здравоохранения города Москвы" (ГБУЗ МКНЦ им. А.С. Логинова, ДЗМ). Конфликт интересов отсутствует.
Гейвандова Наталья Иогановна - доктор медицинских наук, профессор ФГБОУ ВО "Ставропольский государственный медицинский университет" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Голованова Елена Владимировна - доктор медицинских наук, профессор кафедры терапии и профилактической медицины ФГБОУ ВО Российского университета медицины Минздрава России. Конфликт интересов отсутствует.
Гриневич Владимир Борисович - доктор медицинских наук, профессор, заслуженный врач РФ, заведующий 2 кафедрой (терапии усовершенствования врачей) ФГБВОУ ВО "Военно-Медицинская академия имени С.М. Кирова" МО РФ. Конфликт интересов отсутствует.
Дощицин Владимир Леонидович - доктор медицинских наук, профессор "РНИМУ им. Н.И. Пирогова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Дудинская Екатерина Наильевна - доктор медицинских наук, заведующая лабораторией возрастных метаболических и эндокринных нарушений, ОСП "Российский геронтологический научно-клинический центр" ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации, профессор кафедры болезней старения Института непрерывного образования и профессионального развития ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Конфликт интересов отсутствует.
Ершова Екатерина Владимировна - врач высшей категории, кандидат медицинских наук, ведущий научный сотрудник отдела терапевтической эндокринологии ФГБУ "Национальный медицинский исследовательский центр эндокринологии" МЗ РФ. Конфликт интересов отсутствует.
Кодзоева Хава Багаудиновна - врач терапевт терапевтического отделения ФГБУ НМИЦ трансплантологии и искусственных органов им. академика В.И. Шумакова Минздрава России. Конфликт интересов отсутствует.
Козлова Ирина Вадимовна - доктор медицинских наук, профессор, ФГБОУ ВО "Саратовский государственный медицинский университет им. В.И. Разумовского" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Комшилова Ксения Андреевна - кандидат медицинских наук, врач-эндокринолог отделения терапии заболеваний щитовидной железы, надпочечников и ожирения Отдела терапевтической эндокринологии ФГБУ "Национальный медицинский исследовательский центр эндокринологии" МЗ РФ. Конфликт интересов отсутствует.
Конев Юрий Владимирович - доктор медицинских наук, профессор кафедры поликлинической терапии ФГБОУ ВО "Московский государственный медицинский стоматологический университет им. А.И. Евдокимова" МЗ РФ. Конфликт интересов отсутствует.
Корочанская Наталья Всеволодовна - доктор медицинских наук, профессор ГБОУ ВПО Кубанский государственный медицинский университет Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Котовская Юлия Викторовна - доктор медицинских наук, профессор, заместитель директора по научной работе ОСП Российский геронтологический научно-клинический центр ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Конфликт интересов отсутствует.
Кравчук Юрий Алексеевич - доктор медицинских наук, профессор ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Министерства обороны Российской Федерации. Конфликт интересов отсутствует.
Лоранская Ирина Дмитриевна - доктор медицинских наук, профессор, декан терапевтического факультета и зав. кафедрой гастроэнтерологии ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" МЗ РФ. Конфликт интересов отсутствует.
Маев Игорь Вениаминович - академик РАН, доктор медицинских наук, профессор ФГБОУ ВО "Российский университет медицины" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Мартынов Анатолий Иванович - академик РАН, доктор медицинских наук, профессор кафедры госпитальной терапии N 1 лечебного факультета ФГБОУ ВО "Российский университет медицины" Минздрава России, президент Российского научного медицинского общества терапевтов (РНМОТ). Конфликт интересов отсутствует.
Мехтиев Сабир Насрединович - доктор медицинских наук, профессор ФГБОУ ВО "ПСПбГМУ Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Мишина Екатерина Евгеньевна - кандидат медицинских наук, научный сотрудник, врач-эндокринолог ГНЦ РФ ФГБУ "НМИЦ эндокринологии" Минздрава России. Конфликт интересов отсутствует.
Надинская Мария Юрьевна - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и гепатологии ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Никитин Игорь Геннадиевич - доктор медицинских наук, профессор, заведующий кафедрой госпитальной терапии N 2 лечебного факультета, Федеральное автономное государственное учреждение "Национальный медицинский исследовательский центр "Лечебно-реабилитационный центр" Министерства здравоохранения Российской Федерации; Федеральное автономное государственное образовательное учреждение высшего образования "Российский национальный исследовательский медицинский Университет им. Н.И. Пирогова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Осипенко Марина Федоровна - доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней ФГБОУ ВО "Новосибирский государственный медицинский университет" Минздрава России. Конфликт интересов отсутствует.
Остроумова Ольга Дмитриевна - доктор медицинских наук, профессор, заведующий кафедрой терапии и полиморбидной патологии имени академика М.С. Вовси Федеральное государственное бюджетное образовательное учреждение дополнительного профессионального образования "Российская медицинская академия непрерывного профессионального образования" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Павлов Чавдар Савов - доктор медицинских наук, профессор, заведующий кафедрой терапии Института профессионального образования, заместитель директора по научно-организационной работе Института клинической медицины им Н.В. Склифосовского ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет), руководитель клиники терапии ГКБ им. С.П. Боткина ДЗМ. Конфликт интересов отсутствует.
Погосова Нана Вачиковна - доктор медицинских наук, профессор, заместитель генерального директора по научно-аналитической работе и профилактической кардиологии ФГБУ НМИЦ кардиологии им. ак. Е.И. Чазова Минздрава России. Президент Национального общества профилактической кардиологии. Конфликт интересов отсутствует.
Радченко Валерий Григорьевич - доктор медицинских наук, профессор, заслуженный работник Высшей школы РФ, Заслуженный врач РФ, профессор 2 кафедры (терапии усовершенствования врачей) ФГБВОУ ВО "Военно-Медицинская академия имени С.М. Кирова" МО РФ. Конфликт интересов отсутствует.
Ройтберг Григорий Ефимович - академик РАН, доктор медицинских наук, профессор ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Сайфутдинов Рафик Галимзянович - доктор медицинских наук, профессор, КГМА - филиал ФГБОУ ДПО РМАНПО Минздрава России. Конфликт интересов отсутствует.
Самсонов Алексей Андреевич - доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии Лечебного факультета Московского государственного медико-стоматологического университета им. А.И. Евдокимова (МГМСУ) МЗ РФ. Конфликт интересов отсутствует.
Селиверстов Павел Васильевич - кандидат медицинских наук, доцент ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" МО РФ. Конфликт интересов отсутствует.
Ситкин Станислав Игоревич - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии имени С.М. Рысса ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, зав. НИГ эпигенетики и метагеномики Института перинатологии и педиатрии ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России. Конфликт интересов отсутствует.
Тарасова Лариса Владимировна - доктор медицинских наук, профессор ФГБОУ ВО "Чувашский государственный университет им. И.Н. Ульянова". Конфликт интересов отсутствует.
Тарзиманова Аида Ильгизовна - доктор медицинских наук, профессор ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет). Конфликт интересов отсутствует.
Ткачева Ольга Николаевна - доктор медицинских наук, профессор, член-корреспондент РАН, Директор Российского геронтологического научно-клинического центра ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Минздрава России, главный внештатный гериатр Минздрава России. Конфликт интересов отсутствует.
Ткаченко Евгений Иванович - доктор медицинских наук, профессор, Заслуженный деятель науки РФ, заслуженный врач РФ, профессор ГБОУ ВПО Военно-медицинская академия имени С.М. Кирова. Конфликт интересов отсутствует.
Трошина Екатерина Анатольевна - доктор медицинских наук, профессор, член-корреспондент РАН, заместитель директора ГНЦ РФ ФГБУ "НМИЦ эндокринологии" Минздрава России - директор института клинической эндокринологии. Конфликт интересов отсутствует.
Туркина Светлана Владимировна - доктор медицинских наук, профессор ФГБОУ ВО "Волгоградский государственный медицинский университет" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Успенский Юрий Павлович - доктор медицинских наук, профессор, ФГБОУ ВО "Санкт-Петербургский государственный педиатрический медицинский университет" Министерства здравоохранения Российской Федерации, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Фоминых Юлия Александровна - доктор медицинских наук, доцент, ФГБУ "Национальный медицинский исследовательский центр имени В.А. Алмазова" Министерства здравоохранения Российской Федерации, ФГБОУ ВО "Санкт-Петербургский государственный педиатрический медицинский университет" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Хлынова Ольга Витальевна - доктор медицинских наук, профессор, член-корреспондент РАН, заведующая кафедрой госпитальной терапии и кардиологии ФГБОУ ВО "Пермский государственный медицинский университет им. академика Е.А. Вагнера" Минздрава России. Конфликт интересов отсутствует.
Цыганова Юлия Вадимовна - кандидат медицинских наук, доцент ФГБОУ ВО "Чувашский государственный университет им. И.Н. Ульянова". Конфликт интересов отсутствует.
Шамхалова Минара Шамхаловна - доктор медицинских наук, профессор ГУ ФГБУ "НМИЦ эндокринологии" Минздрава России. Конфликт интересов отсутствует.
Шархун Ольга Олеговна - доктор медицинских наук, профессор ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Шестакова Марина Владимировна - доктор медицинских наук, профессор, академик РАН, ГНЦ РФ ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Министерства здравоохранения Российской Федерации. Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе НАЖБП, познакомить с применяющимися в настоящее время алгоритмами диагностики, оценки прогноза и лечения.
Целевая аудитория данных клинических рекомендаций:
1) врачи-гастроэнтерологи;
2) врачи общей практики (семейные врачи).
3) врачи-терапевты;
4) врачи-кардиологи;
5) врачи-эндокринологи.
6) врачи-онкологи.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследование "случай - контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта
Таблица 3. Уровни убедительности рекомендаций с указанием использованной классификации уровней убедительности рекомендаций (УУР)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и (или) их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления КР предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные КР разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Министерства здравоохранения и социального развития Российской Федерации от 12 ноября 2012 г. N 906н "Об утверждении порядка оказания медицинской помощи населению по профилю "Гастроэнтерология".
2. Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи".
3. Приказ Министерства здравоохранения Российской Федерации от 9 ноября 2012 г. N 772н "Об утверждении стандарта медицинской помощи при других заболеваниях печени".
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Алгоритм дифференциального диагноза причин жировой болезни печени
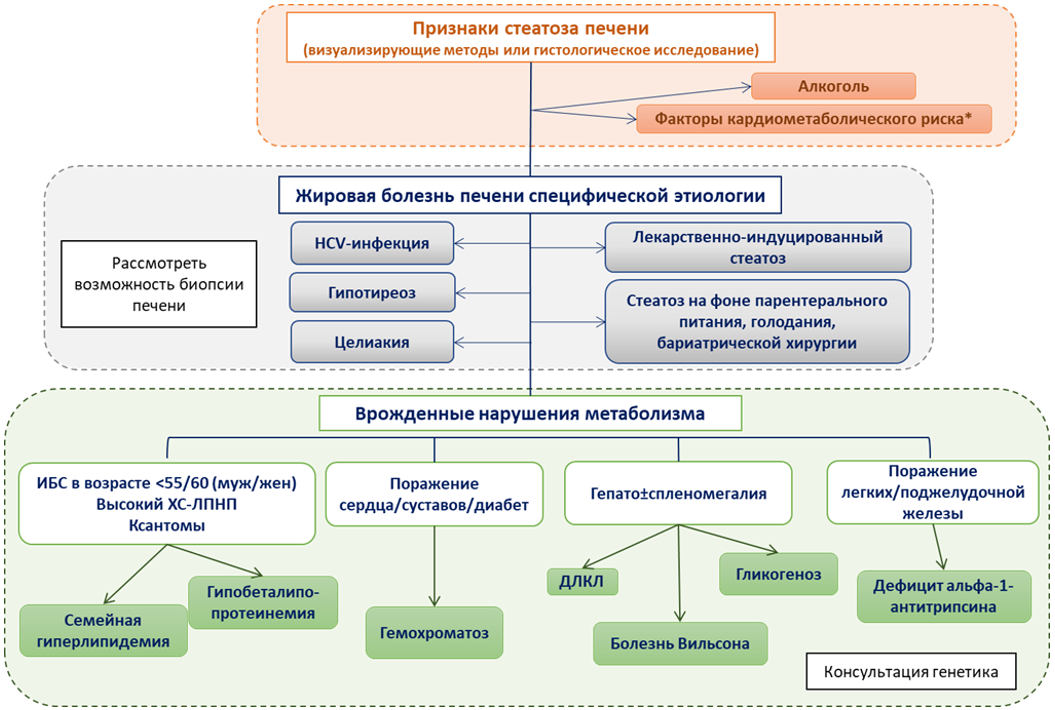
--------------------------------
<*> а) ИМТ > 25 кг/м2 (европеоиды) или 23 кг/м2 (азиаты) или окружность талии > 94 см у мужчин и > 80 см у женщин; б) глюкоза натощак > 5,6 ммоль/л, или постпрандиальная глюкоза > 7,8 ммоль/л, или HbA1c > 5,7%, или уже диагностированный СД 2-го типа, или проводимое лечение СД 2-го типа; в) артериальное давление > 130/85 мм рт. ст. или фармакотерапия уже диагностированной АГ; г) ТГ в плазме >= 1,70 ммоль/л или липидоснижающее лечение; д) ХС-ЛПВП в плазме < 1,0 ммоль/л у мужчин и < 1,3 ммоль/л у женщин или липидоснижающее лечение. ДЛКЛ - дефицит лизосомной кислой липазы.
Алгоритм наблюдения за пациентом с НАЖБП

--------------------------------
<*> С целью своевременной диагностики ГЦР.
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Залог успеха в лечении НАЖБП:
- здоровое питание;
- физическая активность.
Уменьшите размер съедаемых порций, питайтесь по возможности часто, но небольшими порциями.
Исключите из регулярного питания продукты, богатые простыми углеводами (сладости, мучное) и старайтесь употреблять их изредка, в небольших количествах.
Старайтесь несколько раз в день есть овощи и фрукты.
Замените сладкие и газированные напитки водой или несладкими напитками.
Ешьте продукты с высоким содержанием клетчатки, в том числе содержащие цельное зерно.
Избегайте насыщенных жиров, используйте оливковое масло холодного отжима в качестве основного добавленного в блюда источника жира.
Ешьте рыбу 2 - 3 раза в неделю.
Избегайте обработанных продуктов и фастфуда.
Читайте этикетки на пищевых продуктах, чтобы найти скрытый жир, сахар и натрий.
Старайтесь заниматься какой-либо физической активностью не менее 60 минут в день. Это не обязательно должно быть одномоментно. Ходите больше, упражняйтесь, по возможности поднимайтесь по лестнице.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА NAS
(NAFLD ACTIVITY SCORE)
(Bedossa P. Current histological classification of NAFLD: strength and limitations. Hepatol Int. 2013; 7 (Suppl. 2): 765 - 770. https://doi.org/10.1007/s12072-013-9446-z).
Название на русском языке: Шкала оценки активности НАЖБП.
Источник: консенсус экспертов-морфологов CRN (Clinical Research Network, 2005).
Назначение: для полуколичественной оценки тяжести и стадии НАЖБП.
Содержание (шаблон): Шкала оценивает степень морфологических изменений в баллах (от 0 до 8): выраженность стеатоза печени, внутридолькового (лобулярного) воспаления, баллонной дистрофии гепатоцитов и стадию фиброза.
Стеатоз (%)
Лобулярное воспаление <*>
Баллонная дистрофия
< 5 (0 баллов)
Отсутствует (0 баллов)
Отсутствует (0 баллов)
5 - 33 (1 баллов)
< 2 фокусов в поле зрения (1 баллов)
Слабая (1 балл)
34 - 66 (2 балла)
2 - 4 фокуса (2 балла)
Умеренная/выраженная (2 балла)
Фиброз печени (стадии)
1a, 1b - зона 3 ацинуса;
1c - портальный фиброз;
2 - зона 3 ацинуса + портальный/перипортальный фиброз;
3 - фиброзные септы;
4 - ложные дольки, нарушение архитектоники ткани печени (цирроз)
--------------------------------
<*> Наличие скоплений клеток воспалительного инфильтрата при увеличении 20.
Ключ (интерпретация):
NAS 0 - 2 - диагноз НАСГ маловероятен;
NAS 3 - 4 - "серая зона", возможно наличие НАСГ у пациента;
NAS >= 5 - вероятный диагноз НАСГ.
Приложение Г2
ШКАЛА SAF
(Bedossa P. Utility and appropriateness of the fatty liver inhibition of progression (FLIP) algorithm and steatosis, activity, and fibrosis (SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease. Hepatology. 2014; 60(2): 565 - 575. https://doi.org/10.1002/hep.2717310.1002/hep.27173).
Название на русском языке: Шкала для полуколичественной оценки тяжести НАЖБП.
Источник: FLIP Pathology Consortium (2014).
Назначение: для полуколичественной оценки тяжести НАЖБП.
Содержание (шаблон): Шкала включает такие гистологические характеристики НАЖБП, как выраженность стеатоза (S - steatosis), баллонную дистрофию и лобулярное воспаление (A - activity) и стадию фиброза печени (F - fibrosis).
Параметр
Выраженность изменений
Оценка
S - стеатоз (0 - 3)
< 5
0
5 - 33
1
33 - 66
2
> 66 <*>
3
A - активность (0 - 4)
Баллонная дистрофия
Нет
0
Скопления гепатоцитов нормального размера, но округлой формы и с бледной цитоплазмой
1
То же, но встречаются и увеличенные клетки, и их, как минимум, в 2 раза больше, чем нормальных
2
Лобулярное воспаление (>= 2 воспалительных клеток при увеличении 20)
Нет
0
< 2 фокусов в пределах 1 дольки
1
> 2 фокусов в пределах 1 дольки
2
F - фиброз (0 - 4)
Нет
0
Перисинусоидальный или портальный фиброз
1
Перисинусоидальный и портальный фиброз без мостовидного
2
То же и мостовидный фиброз
3
Цирроз
4
Сумма баллов
0 - 11
--------------------------------
<*> Наличие (суб)тотального стеатоза печени у молодых пациентов, особенно без признаков метаболического синдрома, требует оценки активности лизосомальной кислой липазы для исключения болезни накопления эфиров ХС/болезни Вольмана или обследования пациента на предмет болезни Вильсона. Более редкой причиной может быть носительство рецессивных мутаций POLG (DNA Polymerase Subunit Gamma - ДНК-полимеразная субъединица гамма), DGUOK (Deoxyguanosine Kinase - митохондриальная дезоксигуанозин киназа) или MPV17 (Mitochondrial Inner Membrane Protein MPV17 - белок внутренней мембраны митохондрий MPV17), характерных для митохондриальных заболеваний.
Ключ (интерпретация): результат оценки записывается в виде индекса S1A2F3, S2A1F1 и т.п.
Приложение Г3
FIBROSIS-4 INDEX, FIB-4
(Sterling RK, Lissen E, Clumeck N, et. al. Development of a simple noninvasive index to predict significant fibrosis patients with HIV/HCV co-infection. Hepatology 2006; 43: 1317 - 1325).
Название на русском языке: Индекс фиброза-4.
Назначение: неинвазивная оценка возможного фиброза при НАЖБП.
Содержание (шаблон):
FIB-4 = возраст ([годы] x АСТ [ед./л]) / ((тромбоциты [10(9)/л]) x (АЛТ [е/л])(1/2)).
Ключ (интерпретация):
- > 1,3 - риск выраженного фиброза;
- > 3,25 - высокий риск выраженного фиброза.
Приложение Г4
NAFLD FIBROSIS SCORE, NFS
(Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007; 45: 846 - 54)
Название на русском языке: оценка фиброза при неалкогольной жировой болезни печени.
Назначение: неинвазивная оценка возможного фиброза при НАЖБП.
Содержание (шаблон):
NFS = -1.675 + 0.037 x возраст (годы) + 0.094 x ИМТ (кг/м2) + 1.13 x (нарушение толерантности к глюкозе или сахарный диабет [да = 1, нет = 0]) + 0.99 x (отношение АСТ/АЛТ) - 0.013 x тромбоциты (x 109/л) - 0.66 x альбумин (г/дл).
Ключ (интерпретация):
- < 1,455 - низкий риск выраженного фиброза;
- 1,455 - 0,67 - неопределенный результат;
- > 1,455 - высокий риск выраженного фиброза.
