"Клинические рекомендации "Атопический дерматит"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АТОПИЧЕСКИЙ ДЕРМАТИТ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: L20
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 265
Разработчик клинической рекомендации
- Общероссийская общественная организация "Российское общество дерматовенерологов и косметологов"
- Российская ассоциация аллергологов и клинических иммунологов
- Союз педиатров России
- Межрегиональная общественная организация "Национальный альянс дерматовенерологов и косметологов"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ИЛ - интерлейкин
ИФН - интерферон
МКБ - Международная классификация болезней
УФА-1 - ультрафиолетовая терапия дальнего длинноволнового диапазона
УФВ - узкополосная средневолновая ультрафиолетовая терапия
EASI - Eczema Area and Severity Index (Индекс распространенности и тяжести экземы)
IgE - иммуноглобулин E
IGA - Investigator Global Assessment (Общая оценка исследователем)
SCORAD - Scoring of Atopic Dermatitis
# - Применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), при условии подписанного информированного добровольного согласия одним из родителей или иным законным представителем согласно Федеральному закону от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (в ред. Федерального закона от 30.12.2021 N 482-ФЗ).
** - Препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 N 2406-р "Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год, перечня лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций, перечня лекарственных препаратов, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, гемолитико-уремическим синдромом, юношеским артритом с системным началом, мукополисахаридозом I, II и VI типов, лиц после трансплантации органов и (или) тканей и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи" (с изменениями на 09.06.2023).
Термины и определения
Атопический дерматит - мультифакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Атопический дерматит - мультифакторное генетически детерминированное воспалительное заболевание кожи, характеризующееся зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
К генетическим факторам развития атопического дерматита относят наличие мутации гена филаггрина в нарушении функции эпидермального барьера при атопическом дерматите, а также семейный анамнез аллергических заболеваний [1].
С дефектами иммунной системы связано развитие воспалительной реакции в коже с участием T-лимфоцитов. В острую фазу заболевания преобладает Th2-ответ, когда происходит стимуляция Th2-клеток с последующей гиперпродукцией IgE; в хроническую - происходит переключение с Th2- на Th1-иммунный ответ [2]. Ключевыми цитокинами, вовлеченными в патофизиологические механизмы атопического дерматита, являются ИЛ-4, ИЛ-5, ИЛ-13, ИЛ-31 и ИФН-![]() , которым для передачи сигнала требуется участие сигнальной системы JAK/STAT, в том числе Янус-киназы 1 (JAK-1) [3]. Во многих исследованиях описана патогенетическая роль ИЛ-4 в развитии аллерген-специфических IgE-опосредованных реакций при атопическом дерматите, которая заключается в переключении синтеза антител на IgE. ИЛ-4 связывается не только с рецептором ИЛ-4, но и с рецептором ИЛ-13, данные цитокины имеют схожие биологические функции. ИЛ-13 также играет важную роль в развитии Th2-типа иммунного ответа при атопическом дерматите [4].
, которым для передачи сигнала требуется участие сигнальной системы JAK/STAT, в том числе Янус-киназы 1 (JAK-1) [3]. Во многих исследованиях описана патогенетическая роль ИЛ-4 в развитии аллерген-специфических IgE-опосредованных реакций при атопическом дерматите, которая заключается в переключении синтеза антител на IgE. ИЛ-4 связывается не только с рецептором ИЛ-4, но и с рецептором ИЛ-13, данные цитокины имеют схожие биологические функции. ИЛ-13 также играет важную роль в развитии Th2-типа иммунного ответа при атопическом дерматите [4].
Доказана роль аллергии к пищевым аллергенам, к клещам домашней пыли, пыльце растений, энтеротоксинам золотистого стафилококка, плесневым грибам, а также IgE-аутореактивности в механизмах развития заболевания [5, 305, 306].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Атопический дерматит - одно из наиболее распространенных заболеваний (от 20% до 40% в структуре кожных заболеваний), встречающееся во всех странах, у лиц обоего пола и в разных возрастных группах. Распространенность атопического дерматита среди детского населения составляет до 20%, среди взрослого населения - 2 - 8% [6]. Согласно данным Федерального статистического наблюдения, в 2022 году распространенность атопического дерматита составила 384,7 случаев на 100 000 всего населения (0,38%), а заболеваемость (диагноз установлен впервые в жизни) 157,1 случаев на 100 000 всего населения. При этом распространенность АтД среди детей в возрасте от 0 до 14 лет в 2022 году составила 1436,3 случая на 100 000 детского населения (1,4%), заболеваемость 654,3 случая на 100 000 детского населения, а в возрасте от 15 до 17 лет распространенность АтД - 1052,1 случай на 100 000 соответствующего населения (1,05%), заболеваемость - 347,8 случаев на 100 000 соответствующего населения [307]. Заболеваемость атопическим дерматитом среди детей в возрасте от 15 до 17 лет в Российской Федерации составила 1047 случаев на 100 000 соответствующего населения, распространенность - 329 случаев на 100 000 соответствующего населения [7].
Атопический дерматит может быть ассоциирован с респираторной аллергией - с аллергическим ринитом и бронхиальной астмой. Риск развития респираторной аллергии у пациентов, страдающих атопическим дерматитом, по разным данным, составляет 30 - 80%; 60% пациентов с атопическим дерматитом имеют латентную склонность к развитию бронхиальной астмы, а 30 - 40% пациентов заболевают бронхиальной астмой [8, 9]. По данным систематического обзора у 29,5% детей с атопическим дерматитом в возрасте 6 лет или старше диагностирована бронхиальная астма [10]. Поллиноз был выявлен у 48,4% пациентов с атопическим дерматитом по сравнению с 24,4% человек, не страдающих атопическим дерматитом, бронхиальная астма была диагностирована у 24,1% пациентов с атопическим дерматитом по сравнению с 8,9% человек, не страдающих атопическим дерматитом [11].
Риск развития аллергической реакции и бронхиальной астмы существенно выше у детей с пищевой аллергией и атопическим дерматитом [12].
Согласно концепции "атопического марша", у пациентов с атопическим дерматитом и пищевой аллергией может произойти последовательное развитие других атопических заболеваний - аллергического ринита и бронхиальной астмы на протяжении жизни [13, 14]. Взаимосвязь между этими заболеваниями тогда зависит от степени тяжести атопического дерматита: у 20% детей со среднетяжелым течением и у 60% с тяжелым течением могут присоединяться симптомы бронхиальной астмы и аллергического ринита [15]. Предполагается, что существует группа пациентов с атопическим дерматитом, у которых бронхиальная обструкция развивается также рано, как и поражение кожи, или даже предшествует ему, в связи с чем в данном случае нельзя говорить о развитии бронхиальной астмы как итога "атопического марша" [16, 17].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
L20 Атопический дерматит
L20.0 Почесуха Бенье
L20.8 Другие атопические дерматиты: экзема: сгибательная, детская (острая) (хроническая), эндогенная (аллергическая); нейродерматит: атопический (локализованный), (диффузный)
L20.9 Атопический дерматит неуточненный
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Общепринятой клинической классификации не существует.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В большинстве случаев атопический дерматит начинается в раннем детском возрасте (до 2 лет). Для заболевания характерны возрастные особенности клинических проявлений и хроническое рецидивирующее течение с периодическими обострениями и ремиссиями, которые могут продолжаться на протяжении нескольких лет. В анамнезе у пациента могут быть другие атопические заболевания (аллергический ринит, бронхиальная астма). Характерен семейный анамнез аллергических заболеваний (бронхиальная астма, аллергический ринит, атопический дерматит). Для заболевания характерна сезонность обострений с ухудшением состояния в холодное время года и улучшением летом. Обострение процесса может развиться также под влиянием ряда провоцирующих факторов (аллергены, раздражающие вещества, пищевые продукты, эмоциональный стресс и т.д.). При повышенном потоотделении может увеличиться интенсивность зуда.
Клинические проявления атопического дерматита отличаются в разные возрастные периоды. Основные различия заключаются в локализации очагов поражения и соотношении экссудативных и лихеноидных компонентов высыпаний.
Младенческий период атопического дерматита обычно начинается с 2 - 3 месяцев жизни ребенка. В этот период преобладает экссудативная форма заболевания, при которой воспаление носит острый или подострый характер. Отмечаются симметричные эритематозные, папуло-везикулезные высыпания на коже лица и волосистой части головы, экссудация с образованием чешуйко-корок. В дальнейшем высыпания распространяются на кожу наружной поверхности голеней, предплечий, туловища и ягодиц, а также могут появляться в естественных складках кожи. Дермографизм обычно красный или смешанный. Субъективно отмечается зуд кожных покровов различной интенсивности. К концу этого периода очаги сохраняются преимущественно в локтевых и подколенных сгибах, а также в области запястий и шеи. Обострения заболевания в значительной степени связаны с алиментарными факторами. Младенческий период атопического дерматита обычно заканчивается ко второму году жизни ребенка клиническим выздоровлением (у 60% пациентов) или переходит в следующий период (детский).
Детский период атопического дерматита характеризуется высыпаниями, которые носят менее экссудативный характер, чем в младенческом периоде, и представлены воспалительными милиарными и/или лентикулярными папулами, папуло-везикулами и эритематозно-сквамозными элементами, локализующимися на коже верхних и нижних конечностей, в области запястий, предплечий, локтевых и подколенных сгибов, голеностопных суставов и стоп. Характерно наличие зудящих узелков, эрозий и экскориаций, а также незначительная эритема и инфильтрация в области высыпаний на коже туловища, верхних и нижних конечностей, реже - на коже лица. Дермографизм становится розовым, белым или смешанным. Появляются пигментация век, дисхромии, нередко - ангулярный хейлит.
Подростковый и взрослый период атопического дерматита характеризуется высыпаниями преимущественно на сгибательной поверхности конечностей (в области локтевых и коленных сгибов, сгибательных поверхностей голеностопных и лучезапястных суставов), на задней поверхности шеи, в заушных областях. Высыпания представлены эритемой, папулами, шелушением, инфильтрацией, лихенификацией, множественными экскориациями и трещинами. В местах разрешения высыпаний в очагах поражения остаются участки гипо- или гиперпигментации. Со временем у большинства пациентов кожа очищается от высыпаний, пораженными остаются лишь подколенные и локтевые сгибы.
Возможны гиперлинеарность ладоней и подошв, фолликулярный гиперкератоз ("роговые" папулы на боковых поверхностях плеч, предплечий, локтей), хейлит, экзема сосков, складки на передней поверхности шеи. Наблюдается гиперпигментация кожи периорбитальной области, появление складки под нижним веком (линии Денни-Моргана). Отмечается повышенная сухость кожи. Дермографизм белый стойкий или смешанный. Зуд выраженный, постоянный, реже - приступообразный. Нередко у подростков и взрослых преобладает лихеноидная форма заболевания, которая характеризуется сухостью, выраженным рисунком, отечностью и инфильтрацией кожных покровов, крупными, сливающимися очагами лихенизации кожи и упорным стойким зудом. Относительно редко наблюдается пруригинозная форма заболевания, для которой характерны высыпания в виде множественных изолированных плотных отечных папул, на вершине которых могут появляться мелкие пузырьки. Очаги поражения могут иметь распространенный характер с преимущественной локализацией на коже конечностей.
Наиболее тяжелым проявлением атопического дерматита является эритродермия, которая характеризуется универсальным поражением кожных покровов в виде эритемы, инфильтрации, лихенификации, шелушения и сопровождается симптомами интоксикации и нарушением терморегуляции (гипертермия, озноб, лимфоаденопатия).
Клинико-морфологические формы атопического дерматита:
- Экссудативная
- Эритематозно-сквамозная
- Эритематозно-сквамозная форма с лихенификацией
- Лихеноидная
- Пруригинозная
При лабораторном обследовании пациентов с атопическим дерматитом могут быть выявлены эозинофилия периферической крови, повышение содержания общего и аллерген-специфических IgE в сыворотке крови.
Стадии болезни
Стадия обострения или выраженных клинических проявлений характеризуется наличием эритемы, папул, микровезикул, мокнутия, множественных экскориаций, корок, шелушения; зуда разной степени интенсивности.
Стадии ремиссии:
- при неполной ремиссии отмечается значительное уменьшение симптомов заболевания с сохранением инфильтрации, лихенификации, сухости и шелушения кожи, гипер- или гипопигментации в очагах поражения;
- полная ремиссия характеризуется отсутствием всех клинических симптомов заболевания [18].
Распространенность кожного процесса
При ограниченно-локализованном процессе площадь поражения не превышает 10% кожного покрова.
При распространенном процессе площадь поражения составляет от 10% до 50% кожного покрова.
При диффузном процессе площадь поражения составляет более 50% кожного покрова.
Степень тяжести атопического дерматита
Легкое течение заболевания характеризуется преимущественно ограниченно-локализованными проявлениями кожного процесса, незначительным кожным зудом, редкими обострениями (реже 1 - 2 раз в год), продолжительностью рецидива до 1 месяца преимущественно в холодное время года. Длительность ремиссии составляет 8 - 10 месяцев и более. Отмечается хороший эффект от проводимой терапии.
При среднетяжелом течении отмечается распространенный характер поражения. Частота обострений - 3 - 4 раза в год с увеличением их продолжительности. Длительность ремиссий составляет 2 - 3 месяца. Процесс приобретает упорное течение с незначительным эффектом от проводимой терапии.
При тяжелом течении заболевания кожный процесс носит распространенный или диффузный характер с длительными обострениями, редкими и непродолжительными ремиссиями (частота обострений - 5 раз в год и более, длительность ремиссии 1 - 1,5 месяца). Лечение приносит кратковременное и незначительное улучшение. Отмечается выраженный зуд, приводящий к нарушению сна [18].
Осложненные формы атопического дерматита
Течение атопического дерматита часто осложняется присоединением вторичной инфекции (бактериальной, микотической или вирусной). Эта особенность, свойственная пациентам с атопическим дерматитом, отражает нарушение противоинфекционной защиты, обусловленное нарушением синтеза антимикробных пептидов и эпидермального барьера.
1. Наиболее частое инфекционное осложнение атопического дерматита - присоединение вторичной бактериальной инфекции. Оно протекает в виде стрепто- и/или стафилодермии с характерными кожными проявлениями на фоне обострения атопического дерматита. Пиококковые осложнения проявляются в виде различных форм пиодермии: остиофолликулитов, фолликулитов, вульгарного, реже стрептококкового импетиго, иногда - фурункулов.
2. Разнообразная микотическая инфекция (дерматофиты, дрожжеподобные, плесневые и другие виды грибов) также часто осложняет течение атопического дерматита, приводит к более продолжительным обострениям, отсутствию улучшения или к ухудшению состояния. Заболевание приобретает персистирующий характер. Наличие микотической инфекции может изменить клиническую картину атопического дерматита: появляются очаги с четкими фестончатыми, несколько приподнятыми краями, часто рецидивируют заеды (хейлит), отмечаются поражения заушных, паховых складок, ногтевого ложа, гениталий.
3. Пациенты с атопическим дерматитом, независимо от остроты процесса, склонны к поражению вирусной инфекцией (чаще вирусом простого герпеса, вирусом папилломы человека, вирусом контагиозного моллюска). Герпетическая суперинфекция может привести к редкому, но тяжелому осложнению - герпетической экземе Капоши. Заболевание характеризуется распространенными пузырьковыми высыпаниями, сильным зудом, повышением температуры, быстрым присоединением пиококковой инфекции. Возможно поражение центральной нервной системы, глаз, развитие сепсиса.
4. Доброкачественная лимфоаденопатия, как правило, связана с обострениями атопического дерматита и проявляется в виде увеличения лимфатических узлов в шейной, подмышечной, паховой и бедренной областях. Величина узлов может варьировать, они подвижны, эластичной консистенции, безболезненны. Доброкачественная лимфоаденопатия проходит самостоятельно при улучшении состояния, либо на фоне проводимого лечения. Сохраняющееся, несмотря на уменьшение активности заболевания, выраженное увеличение лимфатических узлов требует проведения диагностической биопсии для исключения лимфопролиферативного заболевания.
5. Осложнения атопического дерматита со стороны глаз проявляются в виде рецидивирующих кератоконъюнктивитов, сопровождающихся зудом. В тяжелых случаях хронический конъюнктивит может прогрессировать в эктропион и вызывать постоянное слезотечение. Возможно формирование кератоконуса. Также возможно развитие ранней катаракты, как правило, связанное с частым использованием глюкокортикоидов, применяемых в дерматологии, в периорбитальной зоне.
Возможно развитие неврологических и психиатрических отклонений - нарушения сна, вследствие интенсивного кожного зуда, социальная дезадаптация, обусловленная внешними дефектами, способствуют повышению тревожности, развитию депрессии и иных психиатрических и неврологических нарушений, в том числе - суицидальных мыслей.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
- Рекомендуется для диагностики атопического дерматита пациентам всех возрастных групп использовать диагностические критерии J.M. Hanifin и G. Rajka [19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Для постановки диагноза атопического дерматита необходимо сочетание трех основных и не менее трех дополнительных критериев.
Выделяют основные и дополнительные диагностические критерии J.M. Hanifin и G. Rajka:
Основные диагностические критерии (3 или более):
Дополнительные диагностические критерии (3 или более):
- кожный зуд;
- типичная морфология и локализация поражения кожи: у детей первых лет жизни - покраснение и высыпания на лице и разгибательных поверхностях конечностей, у детей более старшего возраста и взрослых лиц - лихенификация и расчесы в области сгибов конечностей;
- хроническое рецидивирующее течение;
- наличие атопических заболеваний у пациента или его родственников.
- сухость кожи (ксероз);
- гиперлинеарность ладоней ("складчатые") и подошв или фолликулярный гиперкератоз;
- повышение содержания общего и специфических IgE в сыворотке крови;
- начало заболевания в раннем детском возрасте (до 2 лет);
- склонность к кожным инфекциям (S. aureus, H. simplex);
- локализация кожного процесса на кистях и стопах;
- экзема сосков;
- хейлит;
- рецидивирующие конъюнктивиты;
- симптом Денни-Моргана (дополнительная складка нижнего века);
- кератоконус;
- передняя субкапсулярная катаракта;
- гиперпигментация кожи периорбитальной области;
- бледность/эритема лица;
- себорейная экзема;
- складки на передней поверхности шеи;
- зуд при повышенном потоотделении;
- обострение процесса и усиление зуда под влиянием провоцирующих факторов (шерстяная одежда, мыло, аллергены, ирританты, пищевые продукты, эмоциональный стресс и т.д.);
- перифолликулярная акцентуация;
- непереносимость пищи;
- сезонность обострений (ухудшение в холодное время года и улучшение летом);
- белый дермографизм.
Дифференциальный диагноз атопического дерматита проводят с T-клеточной лимфомой кожи, хронической экземой, аллергическим и ирритантным контактным дерматитом, себорейным дерматитом, нуммулярной экземой, чесоткой, псориазом, ихтиозом, питириазом красным волосяным отрубевидным, дерматофитией, иммунодефицитными состояниями (X-сцепленный синдром Вискотта - Олдрича, синдром гипериммуноглобулинемии E) и др.
У детей атопический дерматит следует дифференцировать со всеми вышеперечисленными заболеваниями, а также с пеленочным дерматитом.
2.1 Жалобы и анамнез
Зуд является постоянным симптомом заболевания во всех возрастных периодах [20]. Зуд относится к основному диагностическому критерию атопического дерматита по J.M. Hanifin и G. Rajka.
- Рекомендуется оценивать характер течения заболевания, сроки начала заболевания, наличие атопических заболеваний как у пациента, так и его родственников, сезонность обострений, факторы, провоцирующие обострения дерматита, а также обращать внимание на склонность пациента к развитию бактериальных, вирусных и грибковых инфекций кожи [20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Оценивается соответствие данных анамнеза основным и дополнительным диагностическим критериям атопического дерматита по J.M. Hanifin и G. Rajka.
2.2 Физикальное обследование
Для постановки диагноза основным является проведение визуального осмотра кожных покровов пациента. Проявления заболевания подробно описаны в разделе "Клиническая картина".
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам общий (клинический) анализ крови развернутый для диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапии аброцитинибом, барицитинибом**, упадацитинибом**, циклоспорином** [21, 22] (Приложение Г3).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Контроль показателей общего (клинического) анализа крови необходим во время терапии циклоспорином**, так как циклоспорин** может вызвать развитие нежелательных явлений - лейкопении, анемии, тромбоцитопении [21] и другими иммунодепрессантами или селективными иммунодепрессантами [308, 309]. Во время лечения аброцитинибом, барицитинибом**, упадацитинибом** возможно развитие анемии, лимфопении, тромбоцитопении [22].
- Рекомендуется анализ крови биохимический общетерапевтический пациентам для диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапии аброцитинибом, барицитинибом**, упадацитинибом**, циклоспорином** [21, 22] (Приложение Г3).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Контроль показателей анализа крови биохимического общетерапевтического необходим во время терапии циклоспорином**, так как циклоспорин** может вызвать развитие нежелательных явлений - увеличение концентрации креатинина и мочевины в плазме крови, гиперлипидемию, гиперурикемию, гиперкалиемию, гипомагниемию, гипергликемию, Циклоспорин** может также вызывать дозозависимое обратимое увеличение концентрации билирубина в плазме крови и активности ферментов печени. Возможно гепатотоксическое действие циклоспорина** с развитием холестаза, желтухи, гепатита и печеночной недостаточности [21]. Во время лечения аброцитинибом, барицитинибом**, упадацитинибом** возможно повышение уровня холестерина в крови, повышение активности аланинаминотрансферазы и аспартатаминотрансферазы в крови [22].
- Рекомендуется общий (клинический) анализ мочи пациентам для диагностики заболеваний и состояний, являющихся противопоказаниями к проведению системной терапии атопического дерматита и для контроля безопасности проводимой системной терапии циклоспорином** [21], (Приложение Г3).
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Контроль показателей общего (клинического) анализа мочи необходим во время терапии циклоспорином**, так как циклоспорин** может вызвать токсическое поражение почек и, кроме того, обладая иммуносупрессивным действием, он может способствовать развитию инфекционных поражений почек и мочевыводящих путей [21].
- Рекомендуется в случае отсутствия достаточного для установления диагноза атопического дерматита числа диагностических критериев исследование уровня общего иммуноглобулина E в крови [20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Повышение содержания общего и специфических IgE в сыворотке крови является дополнительным диагностическим критерием атопического дерматита [44, 45]. Рекомендовано определение уровня специфических иммуноглобулинов E в крови (Исследование уровня антител к антигенам растительного, животного и химического происхождения в крови) при первичной диагностике и в процессе динамического наблюдения, с целью идентификации сенсибилизации и возможных триггерных факторов (Исследование уровня антител к антигенам растительного, животного и химического происхождения в крови), в том числе, когда выполнение кожных проб не представляется возможным.
2.4 Инструментальные диагностические исследования
Не применяются.
2.5 Иные диагностические исследования
- Рекомендуется патолого-анатомическое исследование биопсийного (операционного) материала кожи для дифференциальной диагностики в случае наличия у пациента клинических признаков, общих с другими заболеваниями кожи [23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: В случае диагностики атопического дерматита у взрослых пациентов проводится дифференциальная диагностика с T-клеточными лимфомами кожи или другими дерматозами. При атопическом дерматите наблюдается различной степени выраженности акантоз с удлинением эпидермальных выростов и их разветвлением. Могут обнаруживаться участки паракератоза, экзоцитоз. В дерме обнаруживается периваскулярный или сливающийся лимфогистиоцитарный инфильтрат; при хроническом течении инфильтрация незначительная, преобладает фиброз.
- Рекомендуется проведение аллергологического обследования пациентам с атопическим дерматитом с семейным и/или личным анамнезом аллергических заболеваний - пищевой аллергии, аллергического ринита, бронхиальной астмы, а также с указанием на обострение заболевания при контакте с аллергенами [24, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Проведение аллергологического обследования необходимо для подтверждения аллергической природы атопического дерматита, выявления причинно-значимых аллергенов с целью выработки рекомендаций по образу жизни, питанию и определения целесообразности проведения аллерген-специфической иммунотерапии. Аллергологическое обследование может проводиться методом кожного тестирования с небактериальными аллергенами (накожные исследования реакции на аллергены), определения уровня аллерген-специфических IgE антител в сыворотке крови, проведения провокационных тестов. Выбор метода аллергологического обследования определяется доступностью и оснащенностью аллергологического кабинета и наличием/отсутствием противопоказаний к проведению кожного тестирования (обострение заболевания, необходимость приема антигистаминных средств системного действия).
- Рекомендуется проведение накожных исследований реакции на аллергены с бытовыми, пыльцевыми, эпидермальными, грибковыми и пищевыми аллергенами для диагностики сенсибилизации пациентам с атопическим дерматитом [26 - 30].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Объем обследования определяет врач-аллерголог-иммунолог. Кожные пробы проводят в условиях аллергологического кабинета специально обученная медицинская сестра и врач-аллерголог-иммунолог. Наиболее часто применяют prick-тесты (тесты уколом) или скарификационные тесты. Результаты кожного тестирования с аллергенами соотносят с результатами отрицательного и положительного тест-контроля.
- Рекомендуется пациентам с атопическим дерматитом при наличии противопоказаний или иных причин, препятствующих проведению кожного тестирования, сомнительных результатах кожного тестирования, расхождении данных, полученных при сборе анамнеза, с результатами кожного тестирования, исследование уровня аллерген-специфических IgE антител к пыльцевым, бытовым, эпидермальным, грибковым и пищевым аллергенам [28 - 33].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Определение уровня аллерген-специфических IgE антител в сыворотке особенно важно при неубедительных результатах кожных проб либо при невозможности их постановки (например, в период обострения аллергического заболевания или наличии иных противопоказаний). На достоверность результата влияет используемая тест-система, которая может иметь невысокую чувствительность и специфичность, что в свою очередь отражается как в ложноположительном, так и в ложноотрицательном результате. Компонентная (молекулярная) диагностика используется для картирования аллергенной сенсибилизации пациента на молекулярном уровне с применением очищенных натуральных или рекомбинантных аллергенных молекул вместо экстрактов аллергенов. Этот метод может быть использован при расхождении данных анамнеза, результатов накожных исследований реакций на аллергены и результатов определения специфических IgE антител к экстрактам аллергенов, а также при наличии указаний на пищевую анафилаксию, перекрестную пищевую аллергию при неэффективности АСИТ.
- Рекомендуется при необходимости дополнительной количественной оценки степени тяжести атопического дерматита определять общую оценку заболевания исследователем IGA (Приложение Г1) [34].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- Рекомендуется при необходимости дополнительной количественной оценки степени тяжести атопического дерматита использовать индекс SCORAD (Приложение Г2) [6, 35, 36].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: SCORAD является интегральным показателем, включающим балльную оценку шести объективных симптомов: эритема, отек/папулезные элементы, корки/мокнутие, экскориации, лихенификация/шелушение, сухость кожи и двух субъективных показателей (интенсивность зуда и выраженность нарушений сна). Легкая степень тяжести атопического дерматита соответствует значению SCORAD < 25; средняя степень тяжести соответствует значению SCORAD от 25 до 50; тяжелая степень тяжести соответствует значению SCORAD > 50.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Пациентам с атопическим дерматитом может проводиться наружная, системная терапия, а также лечение с помощью лучевого (ультрафиолетового) воздействия. Всем пациентам с атопическим дерматитом показано использование увлажняющих и смягчающих средства (эмолентов). При любой - легкой, средней и тяжелой степени тяжести поражения кожи при атопическом дерматите - проводится наружная лекарственная терапия. Для наружной лекарственной терапии при атопическом дерматите используются глюкокортикоиды, препараты для лечения дерматита, кроме глюкокортикоидов (пимекролимус**, который показан при атопическом дерматите легкой и средней тяжести, и такролимус**, показанный при среднетяжелом и тяжелом атопическом дерматите) и другие дерматологические препараты (пиритион цинк). Для наружного лечения детей предпочтительными являются лекарственные формы в виде крема и монокомпонентные наружные средства: глюкокортикоиды, препараты для лечения дерматита, кроме глюкокортикоидов (такролимус** и пимекролимус**). Многокомпонентные наружные лекарственные препараты - кортикостероиды в комбинации с антибиотиками или кортикостероиды в комбинации с другими средствами - показаны только при клиническом и/или лабораторном подтверждении бактериальной и/или грибковой инфекции. Необоснованное применение многокомпонентных наружных препаратов может способствовать развитию у детей дополнительной сенсибилизации к компонентам топического лекарственного средства.
Системная терапия и лечение с помощью лучевого (ультрафиолетового) воздействия назначаются при атопическом дерматите средней и тяжелой степени тяжести. Для системной терапии пациентов с атопическим дерматитом могут быть использованы препараты для лечения дерматита, кроме глюкокортикоидов (аброцитиниб и дупилумаб**), и селективные иммунодепрессанты (барицитиниб** и упадацитиниб**). Лечение с помощью лучевого (ультрафиолетового) воздействия подразумевает проведение ультрафиолетового облучения кожи различными методами.
Для уменьшения интенсивности зуда пациентам с атопическим дерматитом назначаются антигистаминные средства системного действия. Детям предпочтительно применение пероральных лекарственных форм, при отсутствии противопоказаний, для минимизации болезненных медицинских процедур. Следует избегать рутинного применения антигистаминных средств системного действия при атопическом дерматите у детей. Недостаточно доказательств, подтверждающих эффективность применения препаратов данной группы для купирования зуда при атопическом дерматите. Однако они могут быть использованы, если на фоне терапии глюкокортикоидами, применяемыми в дерматологии, и/или препаратами для лечения дерматита, кроме глюкокортикоидов, противозудный эффект не является достаточным. При необходимости использования антигистаминных средств системного действия в детском возрасте следует отдавать предпочтение препаратам II поколения вследствие лучшего их профиля безопасности по сравнению с препаратами I поколения.
3.1.1. Увлажняющие и смягчающие средства
- Рекомендуется всем пациентам с атопическим дерматитом независимо от степени тяжести: увлажняющие и смягчающие средства (эмоленты) наружно с целью поддержания водно-липидного баланса, барьерных функций кожи, удлинения периода ремиссии [37 - 47].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Эмоленты могут использоваться в форме лосьонов, кремов, мазей, моющих средств, средств для ванн. Выбор препарата и его формы осуществляется индивидуально с учетом предпочтений пациента, индивидуальных особенностей кожи, сезона, климатических условий.
Пациентам с атопическим дерматитом необходимо постоянно, часто и в больших количествах использовать увлажняющие и смягчающие средства (не менее 3 - 4 раз в сутки) как самостоятельно, так и сразу после водных процедур [48 - 50]. Эффективным методом восстановления кожного барьера у пациентов с атопическим дерматитом является применение эмолентов, замещающих дефицит филаггрина [310, 311].
Наиболее выраженный эффект увлажняющих и смягчающих препаратов наблюдается при их постоянном использовании в виде крема, мази, масла для ванны и заменителей мыла. Выбор препарата и его формы осуществляется индивидуально с учетом предпочтений пациента, индивидуальных особенностей кожи, сезона, времени года, климата. Средства на мазевой основе (более жирные) можно использовать в холодное время года, а летом следует применять кремы и гели с высоким содержанием воды. Лосьоны отличаются более высоким содержанием воды, которая может испаряться, поэтому их не следует применять у пациентов с выраженным ксерозом.
Для достижения клинического эффекта необходимо использовать достаточный объем смягчающих препаратов (у взрослого с распространенным поражением кожи расходуется до 600 граммов в неделю, у ребенка - до 250 граммов в неделю) [38].
3.1.2 Наружная терапия
- Пациентам с атопическим дерматитом легкой, средней и тяжелой степени тяжести рекомендуется наружная терапия: глюкокортикоидами, применяемыми в дерматологии, и/или препаратами для лечения дерматита, кроме глюкокортикоидов [6, 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: При легком течении атопического дерматита предпочтительно применение кортикостероидов с низкой активностью (группа I) и умеренной активностью (группа II), применяемых в дерматологии, а при среднетяжелом и тяжелом течении атопического дерматита целесообразно применение кортикостероидов с высокой активностью (группа III) и кортикостероидов с очень высокой активностью (класс IV), в минимальных эффективных дозах (Приложение Г3). Для быстрого лечения обострения атопического дерматита возможно использование средств для наружной терапии и эмолентов с применением влажных повязок. Сначала на пораженные участки кожи наносят наружные средства (глюкокортикоиды и/или эмоленты), затем накладывают влажную хлопчатобумажную или марлевую салфетку, а затем сухую наружную повязку [51 - 54]. Следует соблюдать осторожность при использовании кортикостероидов с умеренной активностью (группа II) и высокой активностью (группа III) с применением влажных повязок, в связи с риском угнетения функции надпочечников [54, 55]. Эффективность наружной терапии оценивают через 2 недели после начала использования нового наружного средства.
Глюкокортикоиды, применяемые в дерматологии
- Рекомендуются глюкокортикоиды для наружной терапии пациентов с атопическим дерматитом:
клобетазол 0,05% крем для наружного применения, 0,05% мазь для наружного применения наносится тонким слоем на пораженные участки кожи 1 - 2 раза в сутки в течение 3 - 4 недель [56 - 59].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием к назначению препарата клобетазол является детский возраст до 1 года. Применять кортикостероиды с очень высокой активностью (группа IV) не следует детям с атопическим дерматитом. Клобетазол рекомендуется для кратковременного применения, не следует применять его под окклюзионные повязки. При необходимости возможно проведение кратких повторных курсов. На лице чаще, чем на других участках тела, могут появляться атрофические изменения кожи в результате длительного применения кортикостериодов [312]. При назначении крема и мази клобетазола детям не следует использовать препарат более 5 дней или наносить его под окклюзионную повязку.
или
бетаметазон** 0,05% мазь для наружного применения 2 раза в сутки наносить на пораженный участок кожи тонким слоем, слегка втирая, в течение 2 - 4 недель [60].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием к назначению препарата бетаметазон** 0,05% мазь для наружного применения является детский возраст до 1 года.
или
бетаметазон** 0,05% крем для наружного применения 1 раз в сутки наносить пациентам с атопическим дерматитом на пораженный участок кожи тонким слоем 2 раза в сутки, слегка втирая, в течение 2 - 4 недель [61 - 63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Противопоказанием к назначению препарата бетаметазон** 0,05% крем для наружного применения является детский возраст до 1 года.
или
триамцинолон 0,1% мазь для наружного применения наносят тонким слоем на пораженные участки кожи 2 - 3 раза в сутки в течение 2 - 4 недель. Возможно использование окклюзионной повязки [64 - 66].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием к назначению препарата #триамцинолон 0,1% мазь для наружного применения является детский возраст до 2 лет.
или
флутиказон 0,05% крем для наружного применения, 0,005% мазь для наружного применения наносить 1 или 2 раза в сутки тонким слоем в количестве, не большем, чем необходимо для покрытия всего пораженного участка, и осторожно втирать, в течение 2 - 4 недель [67 - 69].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием к назначению мази и крема флутиказон является детский возраст до 10 лет.
или
мометазон** крем 0,1%, мазь 0,1% тонким слоем наносят на пораженные участки кожи 1 раз в сутки в течение 2 - 4 недель [70 - 78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием к назначению препарата мометазон** крема 0,1%, мази 0,1% является детский возраст до 2 лет.
или
метилпреднизолона ацепонат 0,1% крем, мазь, эмульсия для наружного применения наносить 1 раз в сутки тонким слоем на пораженные участки кожи в течение 2 - 4 недель [79 - 83].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием к назначению метилпреднизолона ацепоната 0,1% крема, мази, эмульсии для наружного применения является детский возраст до 4 месяцев.
или
алклометазон крем 0,05%, мазь 0,05% наносить пациентам с атопическим дерматитом детского возраста на пораженные участки кожи равномерным слоем 2 - 3 раза в сутки в течение 2 - 4 недель. У детей и в период долечивания возможно использовать препарат 1 раз в сутки [84 - 88].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием к назначению алклометазона 0,05% крема, 0,05% мази для наружного применения является детский возраст до 6 месяцев.
или
#гидрокортизон** 0,1% крем для наружного применения, 0,1% мазь для наружного применения наносить на пораженные участки кожи тонким слоем не чаще 1 - 3 раза в сутки в течение 2 - 4 недель [89 - 97].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Возможно применение 0,1% крема, мази и эмульсии #гидрокортизона** с 6-месячного возраста.
или
преднизолон** 0,5% мазь для наружного применения наносят тонким слоем на пораженные участки кожи 1 - 3 раза в сутки [99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием к назначению преднизолона** 0,5% мази для наружного применения является детский возраст до 1 года. Длительность применения не должна превышать 14 дней.
или
флуоцинолона ацетонид 0,025% мазь, 0,025% линимент для наружного применения взрослым 2 - 4 раза в день, до 25 дней, для детей применение 1 раз в день не более 5 дней. Курс - не более 2 недель, при нанесении на кожу лица - не более 5 дней [97].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Топические препараты, содержащие ингибиторы кальциневрина
- Рекомендуются пациентам с атопическим дерматитом препараты для лечения дерматита, кроме глюкокортикоидов, для наружной терапии:
пимекролимус** 1% крем для наружного применения 2 раза в сутки взрослым и детям старше 3 месяцев с легким и среднетяжелым атопическим дерматитом наносить на пораженную поверхность тонким слоем [100 - 109].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Пимекролимус** крем для наружного применения показан как для кратковременного, так и для длительного лечения атопического дерматита легкой и средней степени тяжести у взрослых, подростков и детей (от 3-х месяцев). Возможно длительное применение по интермиттирующей схеме (1 раз в неделю или реже). Возможно длительное применение до 12 месяцев с перерывами. Противопоказанием к назначению пимекролимуса** является детский возраст до 3 месяцев.
Препарат назначают 2 раза в сутки на пораженные участки кожи любых частей тела, включая голову, лицо, шею, области опрелостей. Особенно показан для чувствительных участков кожи [109]. При первых признаках рецидива атопического дерматита терапию следует возобновить. Если симптомы заболевания сохраняются в течение 6 недель, следует провести повторную оценку состояния пациента. Не следует назначать беременным (не проводились исследования по эффективности и безопасности).
Женщинам в период лактации применять с осторожностью, не наносить на область молочных желез. Во время применения пимекролимуса** следует избегать попадания на кожу солнечных лучей, посещения солярия, ПУВА-терапию, ультрафиолетового облучения кожи УФ-лучами B или A.
или
такролимус** пациентам со средней тяжестью течения и тяжелой формой атопического дерматита - взрослым 0,03% мазь для наружного применения или 0,1% мазь для наружного применения, детям старше 2 лет - 0,03% мазь для наружного применения наносить 2 раза в сутки тонким слоем на пораженные участки кожи [94, 100, 110 - 127].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Продолжительность лечения по данной схеме не должна превышать трех недель. В дальнейшем частота применения уменьшается до одного раза в сутки, лечение продолжается до полного регресса очагов поражения. При отсутствии положительной динамики в течение 14 дней необходима повторная консультация врача для уточнения дальнейшей тактики терапии. Через 12 месяцев поддерживающей терапии (при использовании такролимуса** 2 раза в неделю) следует временно отменить препарат и затем рассмотреть вопрос о необходимости продолжения поддерживающей терапии.
Применение 0,1% мази такролимус** противопоказано детям до 16 лет. Противопоказанием к назначению 0,03% мази такролимус** является детский возраст до 2 лет.
Во время применения такролимуса** следует избегать попадания на кожу солнечных лучей, посещения солярия, ультрафиолетового облучения кожи УФ-лучами B или A, ПУВА-терапии. В течение 2 ч. на участках кожи, на которые наносилась мазь такролимус**, нельзя использовать смягчающие средства.
- Рекомендуются другие дерматологические препараты пациентам с атопическим дерматитом детского возраста для наружной терапии:
пиритион цинк 0,2% крем для наружного применения наносится тонким слоем на пораженные участки кожи 2 раза в сутки детям с 1 года, возможно применение под окклюзионную повязку;
пиритион цинк 0,2% аэрозоль детям с 1 года в случаях выраженного мокнутия распыляют с расстояния 15 см 2 - 3 раза в сутки [128 - 130].
Комментарии: Курс лечения по данной схеме при атопическом дерматите - 3 - 4 недели.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется в случае наличия у пациентов выраженной инфильтрации в очагах поражения:
нафталанская нефть линимент 10% наносят тонким слоем, не втирая, на пораженные участки кожи 2 раза в сутки [131].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Препарат обладает противовоспалительным, противозудным, дезинфицирующим и заживляющим эффектом.
3.1.3 Системная терапия для уменьшения интенсивности зуда
- Рекомендуются антигистаминные средства системного действия пациентам с атопическим дерматитом для уменьшения интенсивности зуда:
клемастин 1 мг, перорально взрослым и детям старше 12 лет - по 1 таблетке (1 мг) утром и вечером в течение 7 - 10 дней. В случаях, трудно поддающихся лечению, суточная доза может составлять до 6 таблеток (6 мг); детям в возрасте 6 - 12 лет - по 1/2 - 1 таблетке перед завтраком и на ночь [99, 132, 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Клемастин в форме таблеток противопоказан в возрасте до 6 лет.
или
хлоропирамин** 25 мг перорально детям в возрасте от 1 месяца до 12 месяцев - по 6,25 мг (1/4 таблетки) 2 - 3 раза в сутки в растертом до порошка состоянии вместе с детским питанием; детям в возрасте от 1 года до 6 лет - по 8,3 мг (1/3 таблетки) 2 - 3 раза в сутки; детям в возрасте от 7 до 14 лет - по 12,5 мг (1/2 таблетки) 2 - 3 раза в сутки; детям в возрасте старше 14 лет и взрослым - по 1 таблетке 3 - 4 раза в сутки (75 - 100 мг в сутки) [134 - 138].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Хлоропирамин** в форме таблеток противопоказан в зависимости от производителя лекарственного препарата в возрасте до 6 месяцев или до 14 лет.
или
хифенадин 10 мг, 25 мг, 50 мг таблетки взрослым по 25 - 50 мг 2 - 4 раза в сутки; детям в возрасте от 3 до 7 лет - по 10 мг перорально 2 раза в сутки, детям в возрасте от 7 до 12 лет - по 10 - 15 мг перорально 2 - 3 раза в сутки, детям в возрасте старше 12 лет и взрослым - по 1 таблетке 25 мг перорально 2 - 3 раза в сутки в течение 10 - 15 дней [99, 139, 140].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Противопоказанием к назначению хифенадина в форме таблеток является детский возраст до 3 лет (для дозировки 10 мг), детский возраст до 18 лет (для дозировки 50 мг).
или
лоратадин** сироп 1 мг/мл, таблетки 10 мг, детям в возрасте от 2 до 12 лет с массой тела менее 30 кг - 5 мг (5 мл) 1 раз в сутки перорально, при массе тела более 30 кг - 10 мг (10 мл) 1 раз в сутки; детям в возрасте старше 12 лет и взрослым - 10 мг (10 мл) 1 раз в сутки перорально в течение 14 - 28 дней [141 - 143].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
или
цетиризин** #капли для приема внутрь 10 мг/мл, таблетки 10 мг - детям в возрасте от 6 до 12 месяцев (только по назначению врача и под строгим медицинским контролем) - 2,5 мг (5 капель) перорально 1 раз в сутки, детям в возрасте от 1 года до 2 лет - 2,5 мг (5 капель) перорально 1 - 2 раза в сутки, детям в возрасте от 2 до 6 лет - 2,5 мг (5 капель) перорально 2 раза в сутки или 5 мг (10 капель) перорально 1 раз в сутки, детям в возрасте старше 6 лет и взрослым - 10 мг перорально 1 раз в сутки в течение 14 - 28 дней [144 - 148, 321, 326, 327].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Цетиризин** в форме таблеток противопоказан в возрасте до 6 лет, цетиризин** в форме капель для приема внутрь противопоказан в возрасте до 6 месяцев или до 1 года в зависимости от производителя.
или
левоцетиризин 5 мг - детям в возрасте старше 6 лет и взрослым - 5 мг перорально 1 раз в сутки в течение 14 - 28 дней [149 - 153].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Противопоказанием к назначению левоцетиризина является детский возраст до 6 лет.
или
левоцетиризин таблетки 5 мг, капли для приема внутрь 5 мг/мл - детям в возрасте от 2 до 6 лет - по 1,25 мг (5 капель) 2 раза в сутки; суточная доза - 2,5 мг (10 капель), детям в возрасте старше 6 лет и взрослым - 5 мг перорально 1 раз в сутки в течение 14 - 28 дней [296 - 301].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Противопоказанием к назначению левоцетиризина в форме таблеток является детский возраст до 6 лет, противопоказанием к назначению левоцетиризина в форме капель является детский возраст до 2 лет.
- Рекомендуется пациентам с выраженным зудом [131]:
клемастин раствор для инъекций 1 мг/мл внутримышечно или внутривенно взрослым 2 мг (2 мл) 2 раза в сутки (утром и вечером); детям - 0,025 мг на кг массы тела в сутки внутримышечно, разделяя на 2 инъекции; в течение 5 - 7 дней [131].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием к назначению клемастина в форме раствора для инъекций является детский возраст до 1 года. Детям предпочтительно применение пероральных лекарственных форм при отсутствии противопоказаний для минимизации болезненных медицинских процедур.
или
хлоропирамин** раствор для инъекций 20 мг/мл детям в возрасте от 1 месяца до 1 года по 5 мг (0,25 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте от 1 года до 6 лет - по 10 мг (0,5 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте от 6 до 14 лет - по 10 - 20 мг (0,5 - 1 мл раствора) внутримышечно 1 раз в сутки; детям в возрасте старше 14 лет и взрослым - по 20 - 40 мг (1 - 2 мл раствора) внутримышечно 1 раз в сутки в течение 5 - 7 дней [131].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Хлоропирамин** в форме раствора для инъекций противопоказан новорожденным. Детям предпочтительно применение пероральных лекарственных форм при отсутствии противопоказаний для минимизации болезненных медицинских процедур. При необходимости использования антигистаминных средств системного действия в детском возрасте следует отдавать предпочтение препаратам II поколения вследствие лучшего их профиля безопасности по сравнению с препаратами I поколения [301 - 302]. При использовании антигистаминных средств системного действия I поколения курс лечения должен быть коротким (не более 10 дней) вследствие высокой вероятности развития нежелательных явлений [303].
3.1.4 Физиотерапевтическое лечение
Пациентам с атопическим дерматитом средней и тяжелой степени тяжести может быть назначено ультрафиолетовое облучение кожи [154 - 165]. Перед назначением фототерапии пациентам с атопическим дерматитом для выявления противопоказаний следует провести комплекс лабораторных исследований, включающий общий (клинический) анализ крови, общий анализ мочи, анализ крови биохимический общетерапевтический, консультацию врача-терапевта или врача-педиатра, врача-эндокринолога, врача-акушера-гинеколога (для женщин). По показаниям рекомендуют обследование у других специалистов [166 - 171].
- Рекомендуется ультрафиолетовое облучение кожи пациентам с атопическим дерматитом средней и тяжелой степени тяжести:
узкополосная средневолновая ультрафиолетовая терапия УФВ-311 терапия, с длиной волны 311 нм взрослым пациентам с атопическим дерматитом [154 - 156].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
или
узкополосная средневолновая ультрафиолетовая терапия УФВ-311 терапия, с длиной волны 311 нм детям с атопическим дерматитом [157, 158].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Данные о применении фототерапии в детском возрасте ограничены, ввиду чего необходимо соблюдать осторожность при использовании. Узкополосная средневолновая ультрафиолетовая терапия назначается детям 5 лет и старше. При назначении узкополосной средневолновой ультрафиолетовой терапии необходимо учитывать психоэмоциональные особенности ребенка, общее состояние, способность самостоятельного нахождения в кабине и выполнения требований медицинского персонала.
или
ультрафиолетовая терапия дальнего длинноволнового диапазона (УФА-1 терапия, длина волны 340 - 400 нм) взрослым [159 - 163].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Ультрафиолетовая терапия дальнего длинноволнового диапазона противопоказана детям до 18 лет.
или
селективная фототерапия (широкополосная средневолновая ультрафиолетовая терапия (УФВ терапия, с длиной волны 280 - 320 нм) взрослым пациентам с атопическим дерматитом [164].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Данные о применении фототерапии в детском возрасте ограничены.
3.1.5 Системная терапия пациентов с атопическим дерматитом
- Рекомендуются препараты для лечения дерматита, кроме глюкокортикоидов, или селективные иммунодепрессанты пациентам с атопическим дерматитом средней и тяжелой степени тяжести для системной терапии:
аброцитиниб таблетки, покрытые пленочной оболочкой, 100 мг или 200 мг 1 раз в сутки перорально взрослым и детям в возрасте от 12 лет [172 - 177].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Аброцитиниб следует принимать примерно в одно и то же время каждый день вне зависимости от приема пищи. Препарат можно применять в сочетании с препаратами для лечения дерматита, кроме глюкокортикоидов, для местного применения или в качестве монотерапии. У взрослых и подростков (12 - 18 лет) с атопическим дерматитом средней или тяжелой степени тяжести аброцитиниб в дозе 100 мг и 200 мг 1 раз в сутки в виде монотерапии или в сочетании с фоновой местной лекарственной терапией продемонстрировал быстрое снижение степени выраженности объективных признаков атопического дерматита и зуда. Доля пациентов, достигших ответа IgA на 12 и/или 16 неделе терапии, среди пациентов, принимавших аброцитиниб в дозах 100 мг или 200 мг 1 раз в сутки, была значительно выше, чем в группе плацебо. Уменьшение интенсивности зуда на 4 балла и более по визуальной аналоговой шкале от 0 до 10 баллов отмечалось значительно чаще у пациентов, получавших терапию аброцитинибом 100 мг и 200 мг 1 раз в сутки по сравнению с группой пациентов, получавших плацебо, причем различия стали значительными уже через 2 недели терапии и сохранялись на 12-ой неделе лечения. Если после 24 недель лечения достаточная терапевтическая эффективность лечения аброцитинибом не достигнута, следует рассмотреть возможность его отмены. Во время лечения аброцитинибом необходим контроль безопасности терапии в связи с возможным развитием лимфопении, тромбоцитопении, повышения уровня холестерина в крови. Лечение аброцитинибом может быть приостановлено, если общий (клинический) анализ крови покажет снижение числа лимфоцитов или тромбоцитов в крови [172 - 178]. Аброцитиниб противопоказан в детском возрасте до 12 лет.
или
барицитиниб** таблетки, покрытые пленочной оболочкой, 2 мг или 4 мг перорально 1 раз в сутки взрослым пациентам [179, 180]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Барицтиниб** можно принимать в любое время назависимо от приема пищи. Барицитиниб** может назначаться в монотерапии или в комбинации с кортикостероидами для местного применения. Совместное применение с кортикостероидами для местного применения может повышать эффективность барицитиниба. Доза 2 мг один раз в сутки подходит для пациентов в возрасте 75 лет и старше, а также может применяться у пациентов с хронической или рецидивирующей инфекцией в анамнезе. Следует рассмотреть назначение барицитиниба** в дозе 2 мг один раз в сутки пациентам, которые достигли устойчивого контроля активности заболевания после применения препарата в дозе 4 мг один раз в сутки и которым можно рекомендовать снижение дозы.
Эффективность барицитиниба** в лечении пациентов с атопическим дерматитом подтверждена результатами клинических исследований [179, 180]. Тяжесть атопического дерматита, которую оценивали по индексу EASI, на фоне терапии барицитинибом** 4 мг 1 раз в сутки перорально у пациентов, не получавших наружную терапию, на 16-ой неделе лечения уменьшилась на 55 - 59%. Если терапия барицитинибом** в дозе 4 мг перорально сопровождалась наружной терапией глюкокортикоидами, применяемыми в дерматологии, тяжесть атопического дерматита по индексу EASI уменьшилась в среднем на 67%. На 16-ой неделе тяжесть атопического дерматита по EASI уменьшилась на 75% и более (EASI75) у 48% пациентов с атопическим дерматитом, получавших лечение барицитинибом** и глюкокортикоидами, применяемыми в дерматологии. Уменьшение зуда у пациентов отмечалось уже на 2-ые сутки терапии, и на 16-ой неделе терапии отмечено уменьшение зуда в среднем на 51,2% [179]. Результаты долгосрочного исследования свидетельствуют о том, что в случае наличия ответа на начальном этапе терапии при поддерживающей терапии эффект сохраняется.
Во время лечения барицитинибом** возможно развитие нежелательных явлений [181]. В связи с этим необходим контроль безопасности терапии барицитинибом**. У пациентов, получающих терапию барицитинибом**, могут возникнуть лимфопения, тромбоцитопения, повышение уровня холестерина в крови, повышение активности аланинаминотрансферазы и аспартатаминотрансферазы в крови, что требует проведения общего (клинического) анализа крови и анализа крови биохимического общетерапевтического. Противопоказано начинать терапию или следует временно прекратить применение барицитиниба** в случае снижения числа нейтрофилов в крови менее 1 x 109/л и абсолютного числа лимфоцитов в крови менее 0,5 x 109/л, снижения уровня общего гемоглобина в крови менее 8 г/дл. В число противопоказаний для назначения барицитиниба** входит детский возраст до 18 лет. В случае выявления повышения активности аланинаминотрансферазы и аспартатаминотрансферазы в крови, вызывающего подозрение на лекарственное поражение печени, применение барицитиниба** следует временно прекратить, пока этот диагноз не будет исключен.
или
дупилумаб** 200 или 300 мг раствор для подкожного введения - пациентам детского возраста в возрасте от 6 лет и старше. Для пациентов с массой тела от 15 до < 30 кг: начальная доза - 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 4 недели; для пациентов с массой тела от 30 до < 60 кг: начальная доза - 400 мг (2 инъекции по 200 мг), далее по 200 мг каждые 2 недели; для пациентов с массой тела 60 кг и более начальная доза - 600 мг (2 инъекции по 300 мг), далее по 300 мг каждые 2 недели [182 - 185].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием к назначению дупилумаба** больным атопическим дерматитом является детский возраст до 6 лет.
или
дупилумаб** 300 мг раствор для подкожного введения в начальной дозе взрослым пациентам с атопическим дерматитом - 600 мг (2 инъекции по 300 мг в разные места для инъекций), далее - по 300 мг каждые 2 недели. В зависимости от индивидуального терапевтического ответа доза может быть увеличена до 300 мг еженедельно [186 - 192]:
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Дупилумаб** может применяться в монотерапии или одновременно с дерматологическими препаратами. Инъекцию препарата может делать себе либо сам пациент, либо лицо, ухаживающее за ним. Необходимо до начала применения дупилумаба** обучить пациентов и/или ухаживающих за ними лиц подготовке и проведению инъекции препарата, согласно указаниям в инструкции по медицинскому применению. Дупилумаб** также может применяться у пациентов с сочетанием среднетяжелого и тяжелого атопического дерматита с тяжелой бронхиальной астмой.
Эффективность дупилумаба** в лечении пациентов с атопическим дерматитом подтверждена результатами клинических исследований [189 - 191]. Тяжесть атопического дерматита, оценивавшаяся по индексу EASI (Eczema Area and Severity Index), на фоне терапии дупилумабом** в режиме 1 инъекция каждые 2 недели на 16-ой неделе уменьшилась на 75% и более (EASI75) у 44 - 51% пациентов, не получавших наружную терапию. В случае, если терапия дупилумабом** в режиме 1 инъекция каждые 2 недели сопровождалась наружной терапией глюкокортикоидами, применяемыми в дерматологии, то эффективность лечения была еще на 10 - 20% выше, чем монотерапия дупилумабом**, и на 16-ой неделе лечения тяжесть атопического дерматита по EASI уменьшилась на 75% и более (EASI75) у 69% пациентов с атопическим дерматитом, получавших лечение дупилумабом** и глюкокортикоидами, применяемыми в дерматологии. Уменьшение зуда у пациентов отмечалось уже на 2-ой неделе терапии, и на 16-ой неделе терапии отмечено уменьшение зуда в среднем на 53,9%. К 52-ой неделе терапии эффект сохранялся, и уменьшение тяжести атопического дерматита на 75% и более по сравнению с исходным уровнем (EASI75) отмечено у 65% пациентов с атопическим дерматитом, получавших дупилумаб** 1 инъекцию каждые 2 недели и наружную терапию глюкокортикоидами, применяемыми в дерматологии [186 - 188].
или
упадацитиниб** таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 15 мг 1 раз в сутки перорально детям в возрасте от 12 лет и старше [193 - 195].]
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Упадацитиниб** противопоказан детям в возрасте до 12 лет и старше.
или
упадацитиниб** таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, 15 мг или 30 мг 1 раз в сутки взрослым пациентам за один прием [193 - 200].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: Принимать препарат можно независимо от приема пищи. Таблетку следует глотать целиком, не разжевывая, не ломая и не измельчая. Упадацитиниб** можно применять в сочетании с глюкокортикоидами, применяемыми в дерматологии, или в монотерапии. На зоны чувствительной кожи (лицо, шея, кожа гениталий и интертригинозные зоны) во время терапии упадацитинибом** можно наносить препараты для лечения дерматита, кроме глюкокортикоидов (пимекролимус**, такролимус**). При атопическом дерматите упадацитиниб** противопоказан детям до 12 лет.
- Рекомендуется при тяжелом течении атопического дерматита у взрослых:
циклоспорин** в начальной дозе 2,5 - 3 мг на кг массы тела в сутки в 2 приема с 12-часовым интервалом. При необходимости доза препарата может быть увеличена до максимальной - 5 мг на кг массы тела в сутки - в зависимости от индивидуального состояния пациента. При достижении положительного результата дозу необходимо постепенно снижать до полной отмены [201 - 206].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: В число противопоказаний для назначения циклоспорина** входит детский возраст до 18 лет для всех показаний, не связанных с трансплантацией за исключением нефротического синдрома.
Степень тяжести атопического дерматита уменьшается на 50% через 6 - 8 недель непрерывного лечения циклоспорином**. У пациентов, которые получают более высокую начальную дозу препарата (4 - 5 мг/кг/сут.), наступает более быстрое улучшение - через 2 недели (снижение тяжести на 40%), чем у пациентов, получавших более низкую начальную дозу (2,5 - 3 мг/кг/сут; снижение тяжести на 22%). Однако через 6 - 8 недель терапии циклоспорином** не было разницы в ответе между пациентами, получавшими препарат в более высоких и в более низких дозах, при этом те пациенты, кто получал более высокую дозу препарата, сообщали о большем количестве побочных эффектов, связанных с циклоспорином** [206, 207]. Длительность непрерывной терапии циклоспорином** предлагается ограничить 2 годами [208].
- Пациентам с тяжелым течением атопического дерматита для лечения обострения рекомендуются кортикостероиды системного действия перорально по схеме - в течение первых 2 - 3 дней [6, 209]:
метилпреднизолон** 16 - 20 мг 1 раз в сутки после завтрака
или
преднизолон** 20 - 25 мг после завтрака и 5 мг после обеда.
Далее 1 раз в сутки после завтрака в течение последующих 2 - 3 дней:
метилпреднизолон** 12 мг
или
преднизолон** 15 мг.
Далее 1 раз в сутки после завтрака в течение последующих 2 - 3 дней:
метилпреднизолон** 8 мг
или
преднизолон** 10 мг 1 раз в сутки.
Далее 1 раз в сутки после завтрака с последующей отменой препарата:
метилпреднизолон** 4 мг
или
преднизолон** 5 мг [99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: При необходимости прием кортикостероидов системного действия можно продолжить еще в течение 2 - 3 дней 1 раз в день после завтрака: метилпреднизолон** 2 мг или преднизолон** 2,5 мг. Кортикостероиды системного действия у детей с атопическим дерматитом не рекомендованы для рутинного применения, но могут использоваться для купирования тяжелых обострений атопического дерматита короткими курсами в дозе не выше 0,5 мг/кг в сутки #преднизолон** [313] или #метилпреднизолон** 0,5 мг/кг/сут. в течение 1 - 2 недель, не более 1 мес. [314, 315, 316, 317]. Риск побочных эффектов ограничивает применение препаратов этой группы у детей. Рандомизированных контролируемых исследований, подтверждающих эффективность этого метода лечения, на данный момент отсутствуют или не проводились, несмотря на его длительное применение в клинической практике [318]. Четких рекомендаций по мониторированию состояния пациентов, получающих кортикостероиды системного действия, в настоящее время нет, необходимые осмотры и/или исследования и меры по коррекции назначаются в индивидуальном порядке в зависимости от длительности курса и клинических проявлений (например, атрофия кожи, увеличение массы тела, нарушение сна, изменения настроения, гипергликемия, пептические язвы/гастриты, остеопороз, повышенная восприимчивость к инфекциям и т.д.). Возможно рассмотреть проведение исследования уровня глюкозы в крови и оценку супрессии надпочечников (по решению врача-эндокринолога/врача-детского эндокринолога) при высокодозовой и/или длительной терапии [319].
3.1.6 Лечение осложненного атопического дерматит
Атопический дерматит часто осложняется развитием бактериальных инфекционных поражений кожи, требующих проведения антибактериальной терапии [210, 211]. При локализованных формах вторичной инфекции достаточно бывает наружной терапии антибиотиками и противомикробными средствами, применяемыми в дерматологии, и/или кортикостероидами в комбинации с антибиотиками или кортикостероидами в комбинации с другими средствами и/или антисептиками и дезинфицирующими средствами или другими лечебными средствами.
При распространенном бактериальном поражении кожи, развившемся у пациентов с атопическим дерматитом, необходимо использование антибактериальных препаратов системного действия. До назначения антибактериальных препаратов системного действия следует провести микробиологическое (культуральное) исследование гнойного отделяемого на аэробные и факультативно-анаэробные микроорганизмы и с целью идентификации возбудителя и микробиологическое (культуральное) исследование отделяемого высыпных элементов кожи на чувствительность к антибактериальным и противогрибковым препаратам. До получения результатов микробиологического исследования в большинстве случаев начинают лечение антибактериальными препаратами системного действия, активными в отношении наиболее часто встречающихся возбудителей, в первую очередь, S. aureus. С высокой эффективностью применяются комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз, цефалоспорины первого или второго поколения, макролиды, у взрослых лиц - фторхинолоны. Продолжительность терапии антибактериальными препаратами системного действия обычно составляет 7 - 10 дней.
3.1.7 Наружная терапия осложненного атопического дерматита
- Рекомендуются антибиотики и противомикробные средства, применяемые в дерматологии, пациентам с атопическим дерматитом, осложненным вторичной инфекцией, для наружной терапии:
фузидовая кислота, 2% крем для наружного применения или 2% мазь для наружного применения наносить на инфицированные очаги поражения 3 раза в сутки в течение 7 - 14 дней [212 - 215].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Ограничений по возрасту для применения 2% крема и 2% мази фузидовой кислоты нет.
или
#бацитрацин + неомицин порошок для наружного применения 2 - 4 раза в сутки, мазь для наружного применения 250 МЕ/г + 5000 МЕ/мг наружно наносить на инфицированные очаги поражения 2 - 3 раза в сутки в течение 7 дней [216, 217].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Ограничений по возрасту для применения порошка и мази бацитрацин + неомицин нет.
или
мупироцин 2% мазь для наружного применения наносить на инфицированные очаги поражения 2 - 3 раза в сутки не более 10 дней [218, 219].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Нет ограничений для применения мази мупироцин по возрасту за исключением пациентов пожилого возраста, у которых имеются состояния, когда возможно всасывание большого количества полиэтиленгликоля, или при наличии умеренной или тяжелой почечной недостаточности.
или
эритромицин мазь для наружного применения (10000 ЕД/г) наружно наносить на инфицированные очаги поражения 2 - 3 раза в сутки 7 - 14 дней [220].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Ограничений по возрасту для применения мази эритромицина нет.
или
сульфатиазол серебра крем для наружного применения 2% наносить на инфицированные очаги поражения 2 - 3 раза в сутки 7 - 14 дней [220, 221].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием для назначения крема сульфатиазола серебра является грудной возраст до 2 месяцев.
- Рекомендуются кортикостероиды в комбинации с антибиотиками или кортикостероиды в комбинации с другими средствами пациентам с атопическим дерматитом при наличии признаков вторичного инфицирования короткими курсами (обычно в течение 1 недели):
гидрокортизон + окситетрациклин мазь для наружного применения, аэрозоль для наружного применения наружно на инфицированные очаги поражения 2 - 4 раза в сутки в течение 7 - 14 дней [99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Противопоказанием для назначения аэрозоля гидрокортизон + окситетрациклин является детский возраст до 18 лет. Противопоказанием для назначения мази гидрокортизон + окситетрациклин является детский возраст до 2 лет.
или
тетрациклин + триамцинолон аэрозоль для наружного применения - орошать струей аэрозоля инфицированные очаги поражения 2 - 4 раза в сутки, держа баллон в вертикальном положении, на расстоянии 15 - 20 см от кожи, в течение 5 - 10 дней [222, 223].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Противопоказанием для назначения аэрозоля тетрациклин + триамцинолон является детский возраст до 3 лет.
или
гидрокортизон + фузидовая кислота крем для наружного применения наносить наружно на инфицированные очаги поражения 3 раза в сутки взрослым и детям в возрасте 2 лет и старше в течение 14 дней [224].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Коментарии: Противопоказанием для назначения крема гидрокортизон + фузидовая кислота является детский возраст до 2 лет.
или
Гентамицин + Декспантенол + Мометазон + Эконазол крем для наружного применения наносить на пораженные участки кожи тонким слоем, осторожно втирая, 2 раза в сутки, длительность лечения обычно составляет 1 - 2 нед., более 4 нед. применять препарат не рекомендуется [225 - 227].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Длительность лечения кремом Гентамицин + Декспантенол + Мометазон + Эконазол обычно составляет 1 - 2 недели. Не следует применять препарат более 4 недель. Противопоказанием для назначения крема Гентамицин + Декспантенол + Мометазон + Эконазол является детский возраст до 18 лет.
или
бетаметазон + фузидовая кислота крем для наружного применения взрослым пациентам с атопическим дерматитом наружно на инфицированные очаги поражения 2 раза в сутки в течение 7 дней [228].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием для назначения крема бетаметазон + фузидовая кислота является детский возраст до 1 года.
или
бетаметазон + гентамицин + клотримазол крем для наружного применения, мазь для наружного применения наружно на инфицированные очаги поражения 2 раза в сутки взрослым и детям в возрасте 2 лет и старше в течение 7 - 14 дней [99, 229 - 233].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
или
гидрокортизон + натамицин + неомицин мазь для наружного применения наносить на инфицированные очаги поражения 2 - 4 раза в сутки [234, 235].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: У детей в возрасте до 1 года мазь гидрокортизон + натамицин + неомицин следует применять с осторожностью.
- Рекомендуются антисептики и дезинфицирующие средства или другие лечебные средства (метилтиониния хлорид) пациентам с дефектами кожи (трещины, экскориации) с целью устранения вторичного инфицирования на местах экскориаций и трещин [131, 220].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
борная кислота + резорцин + фенол + фуксин раствор для наружного применения наносят с помощью тампона или стеклянной палочки на пораженные участки кожи 2 - 4 раза в сутки. После высыхания жидкости на обработанный участок можно наносить мази и пасты [131, 220].
Комментарии: Не следует применять препарат борная кислота + резорцин + фенол + фуксин женщинам во время беременности и в период грудного вскармливания
или
метилтиониния хлорид 1% раствор для местного и наружного применения, [водный] взрослым и детям с момента рождения раствор наносят с помощью тампона или стеклянной палочки на пораженные участки 2 - 3 раза в сутки [131, 220].
Комментарии: Возможно применение водного раствора метилтиониния хлорида во время беременности и в период грудного вскармливания.
3.1.8 Системная антибактериальная терапия
- Рекомендуются антибактериальные препараты системного действия пациентам с атопическим дерматитом для лечения рецидивирующей или распространенной бактериальной инфекции:
амоксициллин + клавулановая кислота** взрослым и детям старше 12 лет (массой 40 кг и более) таблетки, покрытые пленочной оболочкой, 250 мг + 125 мг по 1 таблетке 3 раза в сутки или 875 мг + 125 мг - по 1 таблетке 2 раза в сутки в течение 5 - 14 дней или таблетки диспергируемые взрослым и детям старше 12 лет (массой 40 кг и более) - по 500/125 мг 3 раза в сутки в течение 5 - 14 дней, детям от 2 до 12 лет или с массой тела менее 40 кг - по 125/31,25 мг или по 250/62,5 мг в дозах [236].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Противопоказанием для назначения таблеток, покрытых пленочной оболочкой, амоксициллин + клавулановая кислота** является детский возраст до 12 лет. Противопоказанием для назначения диспергируемых таблеток амоксициллин + клавулановая кислота** является детский возраст до 1 года.
или
цефуроксим** - по 250 мг перорально 2 раза в сутки взрослым и детям в возрасте 3 лет и старше в течение 5 - 10 дней [237 - 239].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 2)
Комментарии: Противопоказанием для назначения таблеток, покрытых пленочной оболочкой, цефуроксим** является детский возраст до 3 лет.
или
цефтриаксон** - по 1 - 2 г в сутки внутримышечно или внутривенно детям старше 12 лет 1 раз в сутки, новорожденным до 2 недель - 20 - 50 мг/кг/сут, детям от 3 недель до 12 лет 20 - 80 мг/кг/сут. в 2 введения [238].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Цефтриаксон** противопоказан недоношенным детям в возрасте до 41 недели включительно. Цефтриаксон** следует назначать с осторожностью в период грудного вскармливания.
- Рекомендуются противовирусные препараты прямого действия пациентам с атопическим дерматитом в случае развития герпетической экземы Капоши [240, 241]:
ацикловир** таблетки 200 мг взрослым и детям от 3 лет внутрь 5 раз в сутки. Курс лечения составляет 5 дней, но может быть продлен при тяжелых инфекциях.
Ацикловир** таблетки 200 - 400 мг взрослым и подросткам внутрь 5 раз в сутки в/в: 5 - 10 мг/кг каждые 8 ч. Курс лечения составляет, в среднем, 7 - 14 дней; детям в/в: дети в возрасте от 12 до 18 дет и взрослые #5 - 10 мг/кг каждые 8 ч., от 3 мес до 12 лет: 20 мг/ кг каждые 8 часов 14 дней, перорально 20 мг/кг x 4 раза в сутки (максимальная доза 800 мг), до 3 мес 20 мг/кг [304].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
или
#Валацикловир таблетки 500 мг, перорально курсом 5 - 7 дней. Взрослым: 2 таблетки (1 г) 2 раза в день или 1 таблетка 500 мг 3 раза в день, детям старше 3 месяцев таблетки перорально 20 мг/кг 2 раза в день (максимальная доза 1000 мг) [304].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: В случае диссеминированного процесса, сопровождающегося повышением температуры тела, явлениями тяжелой интоксикации, необходима госпитализация в стационар с наличием боксированного отделения. В условиях стационара следует проводить внутривенное введение ацикловира**. Наружная терапия заключается в использовании антисептиков и дезинфицирующих средств (борная кислота + резорцин + фенол + фуксин, #метилтиониния хлорид 1% раствор для местного и наружного применения, [водный] на очаги поражения и окружающую кожу 2 - 3 раза в сутки, 3 - 5 суток и др.) [325]
В случае поражения глаз следует применять мазь глазную 3% ацикловир**, которая закладывается в нижний конъюнктивальный мешок 5 раз в сутки. Лечение продолжают на протяжении не менее 3 дней после купирования симптомов.
Противопоказанием к назначению ацикловира** в таблетках является детский возраст до 3 лет.
Для ацикловира** (при коротких и пролонгированных курсах): необходим контроль и мониторирование функции почек (Исследование уровня мочевины в крови, Исследование уровня креатинина в крови, Исследование функции нефронов по клиренсу креатинина (проба Реберга) (клиренс креатинина рассчитывается по формуле Шварца), электролитов (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови), общий (клинический) анализ крови развернутый.
- Рекомендуются препараты кальция пациентам с атопическим дерматитом при развитии экссудации с целью ее устранения [99]:
кальция глюконат** [99].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Кальция глюконат** доступен в форме раствора для внутривенного и внутримышечного введения и в форме таблеток. Раствор для внутривенного и внутримышечного введения кальция глюконат** 100 мг/мл взрослым вводят внутримышечно или внутривенно по 5 - 10 мл раствора 100 мг/мл ежедневно, через день или через 2 дня в зависимости от состояния пациента. Детям вводить внутримышечно раствор для внутривенного и внутримышечного введения кальция глюконат** 100 мг/мл противопоказано. Детям препарат вводят только внутривенно: детям в возрасте до 6 месяцев - 0,1 - 1 мл, 7 - 12 месяцев - 1 - 1,5 мл каждые 2 - 3 дня; старше 1 года вводят, в зависимости от возраста, от 2 до 5 мл раствора 100 мг/мл каждые 2 - 3 дня.
- Рекомендуются другие лечебные средства пациентам с атопическим дерматитом при развитии обострения [99, 242]:
#натрия тиосульфат** раствор для внутривенного введения 300 мг/мл [99, 242, 328, 329].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: #Натрия тиосульфат** вводят внутривенно медленно. Взрослым вводят в разовой дозе 5 - 10 мл раствора, детям из расчета 1 - 2 мл на 10 кг массы тела в течение 5 дней. В детском возрасте препарат следует применять с осторожностью. Применение препарата возможно в комплексной терапии обострения заболевания в сочетании с наружной терапией. При введении в организм оказывает дезинтоксикационное действие; #натрия тиосульфат** обладает антиоксидантными и противовоспалительными свойствами.
3.2. Иное лечение
- Рекомендуется пациентам с наличием сенсибилизации к аллергенам клещей домашней пыли и пыльцевым аллергенам, контакт с которыми вызывает обострение атопического дерматита и респираторные проявления (аллергический ринит, бронхиальная астма), - аллерген-специфическая иммунотерапия (АСИТ) препаратами группы "Аллергены" с целью выработки толерантности [6, 243 - 253]
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
Комментарии: Аллерген-специфическая иммунотерапия может быть проведена аллергенами бытовыми/аллергоидами бытовыми и/или аллергенами деревьев пыльцевыми и/или аллергенами трав пыльцевыми/аллергоидами трав пыльцевыми детям старше 5 лет и взрослым. Существует подкожный и сублингвальный методы АСИТ. Показания, выбор препарата, метода и противопоказания к аллерген-специфической иммунотерапии определяет врач-аллерголог-иммунолог. Аллерген-специфическую иммунотерапию назначают только после купирования обострения атопического дерматита с помощью адекватной терапии, а также санации очагов хронической инфекции и лечения сопутствующих заболеваний. Проводится врачом-аллергологом-иммунологом в условиях аллергологического кабинета или стационара. Продолжительность и схема аллерген-специфической иммунотерапии определяется индивидуально.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Пациентам с атопическим дерматитом в период ремиссии возможно проведение комплексного санаторно-курортного лечения, эффективность которого обусловлена суммацией лечебных эффектов климатотерапии, бальнеотерапии и пелоидотерапии. Возможно направление пациентов на бальнеологические, грязевые или климатические курорты [254 - 256]. Противопоказания к применению бальнеотерапии и грязелечения: все заболевания в острой стадии или в период обострения хронического процесса, инфекционные болезни (туберкулез, сифилис и др.), беременность, кровотечения и предрасположенность к ним, злокачественные новообразования, фибромиома матки, мастопатии, недостаточность кровообращения выше IIA стадии, прогрессирующая стенокардия и стенокардия покоя, сердечная астма, прогностически неблагоприятные нарушения ритма сердечных сокращений и проводимости миокарда.
- Рекомендуются ванны минеральные лечебные пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [257 - 262].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуются ванны радоновые лечебные пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [263].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуются ванны газовые (кислородные, углекислые, азотные) пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [264].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуются грязевые ванны пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [265].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Проводятся аппликационным методом с температурой 38 - 40 °C или 42 - 44 °C и с экспозицией 15 - 20 минут.
- Рекомендуется гелиовоздействие пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [266].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется воздействие климатом пациентам с атопическим дерматитом в период ремиссии в целях медицинской реабилитации [266, 267].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Воздействие климатом способствует улучшению состояния кожи и повышению качества жизни пациентов с атопическим дерматитом. Показано направление пациентов на курорты с морским умеренно-влажным или сильно-влажным климатом, а также с климатом среднегорья.
- Рекомендуется рассмотреть применение ванн лекарственных лечебных (липидовосполняющих ванн) пациентам с атопичским дерматитом в качестве дополнительного лечения с целью поддержания водно-липидного баланса, барьерных функций кожи и удлинения периода ремиссии [320]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется при возможности консультация медицинского психолога пациентам с атопическим дерматитом, особенно при наличии длительно существующих зуда кожи и боли с целью улучшения психологического состояния пациентов, а также возможной ментальной модуляции данных проявлений в дополнение к медикаментозному лечению [169].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Пациентам с атопическим дерматитом с целью снижения влияния стресса на частоту обострений кожного процесса полезно проведение групповой психотерапии, обучение техникам релаксации и модификации поведения. Психологические вмешательства, в том числе аутогенная тренировка, или поведенческая терапия, техники релаксации, медитация могут оказывать положительное влияние на течение атопического дерматита.
- Рекомендуется рассмотреть пациентам с атопическим дерматитом в оздоровительно-профилактических, а также лечебно-реабилитационных целях физиолечение с использованием природных факторов в санаторно-курортных условиях.
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Пациентам с атопическим дерматитом рекомендуется климатотерапия, талассотерапия (комплексное лечение морским климатом и купанием) с целью снижения воздействия аэроаллергенов, поллютантов на организм, а также с целью стимулирующего воздействия природных климатических факторов, приводящих к нормализации и улучшению барьерных свойств кожи, кровоснабжения, потоотделения, сна, снижение зуда, улучшению течения других атопических заболеваний. Традиционно применяются гидрокарбонатно-кальциево-магниевые воды (в т.ч. термальные) в виде лечебных ванн (ванны минеральные лечебные), лечение климатом [45, 211, 340].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется диспансерное наблюдение пациентам со средне-тяжелым и тяжелым атопическим дерматитом [320, 321, 323, 324].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Первичная профилактика атопического дерматита направлена на предупреждение возникновения и воздействия факторов риска развития заболевания и включает в себя комплекс гипоаллергенных мероприятий:
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита беременным женщинам с пищевой аллергией элиминация аллергенного продукта из рациона [268 - 270].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита всем детям на протяжении первых 4 - 6 месяцев жизни грудное вскармливание [271, 272].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита введение прикормов с 4-го по 6-ой месяц жизни ребенка вне зависимости от наследственной отягощенности [272].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: данный возрастной период считается оптимальным и представляет собой так называемое "окно толерантности".
- Рекомендуются в качестве мероприятий первичной профилактики атопического дерматита при необходимости для прикорма детям до 6 месяцев из группы высокого риска профилактические или лечебные (низкогидролизные) смеси [273, 274].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Рекомендуются для прикорма здоровым детям без наследственной отягощенности по аллергическим заболеваниям адаптированные смеси на основе коровьего молока [274].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
- Рекомендуются беременным и новорожденным из групп риска микроорганизмы, продуцирующие молочную кислоту, и/или микроорганизмы, продуцирующие молочную кислоту, в комбинации с другими препаратами [274 - 277].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 1)
- Не рекомендуются ограничительные гипоаллергенные диеты в общей популяции [278].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Убедительных данных об эффективности гипоаллергенных или элиминационных диет в процессе беременности в отношении развития атопического дерматита в общей популяции в настоящее время не получено [271].
- Не рекомендуются элиминационные диеты здоровым женщинам во время лактации [268, 269].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется беременным, детям и взрослым в качестве мероприятий первичной профилактики атопического дерматита с целью контроля за факторами внешней среды исключение воздействия табачного дыма [279].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
Комментарии: Курение недопустимо во время беременности и лактации; пассивное курение исключают с первых дней жизни ребенка.
- Рекомендуется в качестве мероприятий первичной профилактики атопического дерматита у детей с целью контроля за факторами внешней среды поддержание низкой влажности и адекватной вентиляции в помещениях, где находится ребенок (исключение сырости) [280].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется беременным, детям и взрослым в качестве мероприятий первичной профилактики атопического дерматита с целью контроля за факторами внешней среды уменьшение воздействия загрязняющих веществ окружающей среды (поллютантов, аллергенов) [281, 282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется элиминация или удаление причинно-значимых аллергенов. При установленной сенсибилизации к бытовым, эпидермальным, грибковым аллергенам рекомендованы элиминационные мероприятия с целью уменьшения выраженности симптомов атопического дерматита, снижения фармакологической нагрузки и профилактики обострении. При развитии симптомов пищевой аллергии, включая анафилаксию, что нередко наблюдается у детей и взрослых с сенсибилизацией к белкам пищевых аллергенов, установленной с помощью определения аллерген-специфических IgE антител в сыворотке крови, рекомендованы элиминационные диеты с исключением причинно-значимых аллергенов [270, 283].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Вторичная профилактика атопического дерматита - комплекс мероприятий, направленных на устранение выраженных факторов риска, которые при определенных условиях (стресс, ослабление иммунитета, чрезмерные нагрузки на любые другие функциональные системы организма) могут привести к возникновению, обострению и рецидиву заболевания.
- Рекомендуется в качестве мероприятий вторичной профилактики атопического дерматита обучение пациентов с атопическим дерматитом и/или членов их семьи [284 - 288].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- Рекомендуется в качестве мероприятий вторичной профилактики атопического дерматита профилактическое консультирование по коррекции факторов риска развития неинфекционных заболеваний [284 - 288].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: Любые профилактические элиминационные мероприятия, назначаемые на длительное время, могут оказывать негативное влияние на членов семьи, ухудшая качество их жизни.
Третичная профилактика - это комплекс мероприятий, направленных на предотвращение обострений или развития осложнений атопического дерматита.
- Рекомендуется в качестве мероприятий третичной профилактики атопического дерматита уменьшение влияния провоцирующих факторов: ограничение использования мыла, одежды из грубых тканей; минимализация факторов, влияющих на потливость [289, 290].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется в качестве мероприятий третичной профилактики атопического дерматита рациональный уход за кожей [291, 292].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Рекомендуется при проведении плановой вакцинации детей с атопическим дерматитом придерживаться национального календаря профилактических прививок [293 - 295].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Данные исследований показали отсутствие связи вакцинации и последующего развития АтД или его обострений; АтД не является противопоказанием к проведению профилактических прививок. Вакцинация показана пациентам с АтД с целью предотвращения/уменьшения вероятности тяжелого (осложненного) течения вакциноуправляемых инфекций, в том числе затрагивающих кожные покровы (например, ветряной оспы). Вакцинацию осуществляют в соответствии с Приказом МЗ РФ от 06.12.2021 N 1122н "Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок", Методическими указаниями МУ 3.3.1.1095-02 "Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок".
Пациенты, получающие лечение иммунодепрессантами, должны быть проконсультированы врачом перед вакцинацией живыми вакцинами; иммунизацию ослабленными живыми вакцинами желательно провести за 4 недели до инициации терапии иммунодепрессантами. В случаях подтвержденной аллергии на белок куриного яйца перед вакцинацией может быть проведена консультация врача-аллерголога-иммунолога. Вакцинация не проводится в период обострения заболевания.
6. Организация оказания медицинской помощи
- В рамках оказания первичной врачебной медико-санитарной помощи врачи-терапевты участковые, врачи-педиатры участковые, врачи общей практики (семейные врачи) при выявлении у больных высыпаний на коже, кожного зуда, симптомов или признаков атопического дерматита направляют больного в медицинскую организацию дерматовенерологического профиля или кабинет врача аллерголога-иммунолога для оказания ему первичной специализированной медико-санитарной помощи, а также осуществляют оказание медицинской помощи в соответствии с рекомендациями медицинской организации дерматовенерологического профиля и/или врача аллерголога-иммунолога при отсутствии медицинских показаний для направления в нее.
- При невозможности оказания медицинской помощи в рамках первичной специализированной медико-санитарной помощи и наличии медицинских показаний больной направляется в медицинскую организацию, оказывающую специализированную медицинскую помощь.
- Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-дерматовенерологами и/или врачами-аллергологами-иммунологами в стационарных условиях.
Показания для плановой госпитализации в медицинскую организацию:
1) Показания для оказания медицинской помощи в дневном стационаре:
- недостаточная эффективность лечения, проводимого в амбулаторных условиях, у пациентов с ограниченными высыпаниями;
2) Показания для оказания медицинской помощи в стационарных условиях:
- отсутствие эффекта от проводимого лечения в амбулаторных условиях;
- тяжелое течение атопического дерматита, требующее системной терапии или фототерапии;
- присоединение вторичной инфекции, не купируемое в амбулаторных условиях;
- развитие вирусной инфекции (герпетической экземы Капоши).
3) Показания к выписке пациента из медицинской организации:
- частичный или полный регресс высыпаний.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Отсутствует.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень убедительности рекомендаций
Уровень достоверности доказательств
1
Выполнен общий (клинический) анализ крови пациентам с атопическим дерматитом, которым проводится системная терапия аброцитинибом или барицитинибом** или дупилумабом** или упадацитинибом или циклоспорином**.
4
C
2
Выполнен анализ крови биохимический общетерапевтический пациентам с атопическим дерматитом, которым проводится системная терапия аброцитинибом или барицитинибом** или дупилумабом** или упадацитинибом или циклоспорином**.
4
C
3
Выполнен общий (клинический) анализ мочи пациентам с атопическим дерматитом, которым проводится системная терапия циклоспорином**.
4
C
4
Проведена наружная терапия глюкокортикоидами, применяемыми в дерматологии, и/или препаратами для лечения дерматита, кроме глюкокортикоидов, и/или другими дерматологическими препаратами
1
A
5
Проведена системная терапия кортикостероидами системного действия и/или циклоспорином** и/или дупилумабом** и/или барицитинибом** и/или упадацитинибом** и/или аброцитинибом и/или ультрафиолетовое облучение кожи и/или наружная терапия такролимусом** пациентам с атопическим дерматитом средней и тяжелой степени тяжести
2
B
6
Проведена терапия антигистаминными средствами системного действия при зуде
2
B
7
Проведена наружная терапия антибиотиками и противомикробными средствами, применяемыми в дерматологии, и/или кортикостероидами в комбинации с антибиотиками и/или кортикостероидами в комбинации с другими средствами и/или антисептиками и дезинфицирующими средствами и/или другими лечебными средствами и/или антибактериальными препаратами системного действия при вторичном инфицировании
2
C
Список литературы
1. Palmer C.N., Irvine A.D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis. Nat. Genet. 2006; 38 (4): 441 - 446. doi: 10.1038/ng1767
2. McGirt L.Y., Beck L.A. Innate immune defects in atopic dermatitis. J Allergy Clin Immunol. 2006; 118 (1): 202 - 208. doi: 10.1016/j.jaci.2006.04.033
3. Bao L., Zhang H., Chan L.S. The involvement of the JAK-STAT signaling pathway in chronic inflammatory skin disease atopic dermatitis. JAKSTAT. 2013; 2 (3): e24137. doi: 10.4161/jkst.24137
4. Gandhi N.A., Pirozzi G., Graham N.M. Commonality of the IL-4/IL-13 pathway in atopic diseases. Expert Rev Clin Immunol. 2017; 13 (5): 425 - 437. doi: 10.1080/1744666X.2017.1298443
5. Werfel T., Allam J.P., Biedermann T. et al. Cellular and molecular immunologic mechanisms in patients with atopic dermatitis. J Allergy Clin Immunol. 2016; 138: 336 - 349. doi: 10.1016/j.jaci.2016.06.010
6. Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018; 32 (5): 657 - 682. doi: 10.1111/jdv.14891
7. Кубанов А.А., Богданова Е.В. Результаты деятельности медицинских организаций, оказывающих медицинскую помощь по профилю "дерматовенерология", в 2019 - 2021 гг. в Российской Федерации. Вестник дерматологии и венерологии. 2022; 98 (5): 18 - 33.
8. Schneider L., Hanifin J., Boguniewicz M. et al. Study of the atopic march: development of atopic comorbidities. Pediatr Dermatol. 2016; 33 (4): 388 - 398. doi: 10.1111/pde.12867
9. Bieber T. Atopic dermatitis 2.0: from the clinical phenotype to the molecular taxonomy and stratified medicine. Allergy. 2012; 67 (12); 1475 - 1482. doi: 10.1111/all.12049
10. van der Hulst A.E., Klip H., Brand P.L. Risk of developing asthma in young children with atopic eczema: a systematic review. J Allergy Clin Immunol 2007; 120 (3): 565 - 569. doi: 10.1016/j.jaci.2007.05.042
11. Eckert L., Gupta S., Amand C. et al. The burden of atopic dermatitis in US adults: Health care resource utilization data from the 2013 National Health and Wellness Survey. J Am Acad Dermatol. 2018; 78 (1): 54 - 61. doi: 10.1016/j.jaad.2017.08.002
12. Illi S., von Mutius E., Lau S. et al. The pattern of atopic sensitization is associated with the development of asthma in childhood. J Allergy Clin Immunol. 2001; 108 (5): 709 - 714. doi: 10.1067/mai.2001.118786
13. Aw M., Penn J., Gauvreau G.M. et al. Atopic March: Collegium Internationale Allergologicum Update 2020. Int Arch Allergy Immunol. 2020; 181 (1): 1 - 10. doi: 10.1159/000502958
14. Spergel J.M. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin N Am. 2010; 30 (3): 269 - 280. doi: 10.1016/j.iac.2010.06.003
15. Hill D.A., Spergel J.M. The atopic march: Critical evidence and clinical relevance. Ann Allergy Asthma Immunol. 2018; 120 (2): 131 - 137. doi: 10.1016/j.anai.2017.10.037
16. Williams H., Flohr C. How epidemiology has challenged 3 prevailing concepts about atopic dermatitis. J Allergy Clin Immunol. 2006; 118 (1): 209 - 213. doi: 10.1016/j.jaci.2006.04.043
17. Illi S., von Mutius E., Lau S. et al. The natural course of atopic dermatitis from birth to age 7 years and the association with asthma. J Allergy Clin Immunol. 2004; 113 (5): 925 - 931. doi: 10.1016/j.jaci.2004.01.778
18. Атопический дерматит: рекомендации для практических врачей. Российский согласительный национальный документ по атопическому дерматиту. Под ред. Р.М. Хаитова, А.А. Кубановой. М.: Фармакус Принт, 2002. 192 с.
19. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol. 1980; 92 (Suppl): 44 - 47.
20. Eichenfield L.F., Tom W.L., Chamlin S.L. et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014; 70 (2): 338 - 351. doi: 10.1016/j.jaad.2013.10.010
21. Ryan C., Amor K.T., Menter A. The use of cyclosporine in dermatology: part II.J Am Acad Dermatol. 2010; 63 (6): 949 - 972. doi: 10.1016/j.jaad.2010.02.062
22. Samuel C., Cornman H., Kambala A., Kwatra S.G. A Review on the safety of using JAK inhibitors in dermatology: Clinical and laboratory monitoring. Dermatol Ther (Heidelb). 2023 Feb 15: 1 - 21. doi: 10.1007/s13555-023-00892-5
23. Клиническая дерматовенерология: в 2 т./под ред. Ю.К. Скрипкина, Ю.С. Бутова. - М.: ГЭОТАР-Медиа, 2009. - т. II. - 928 с.
24. Wollenberg A,  S, Taieb A, et al. ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children. J Eur Acad Dermatol Venereol. 2020; 34 (12): 2717 - 2744. doi: 10.1111/jdv.16892
S, Taieb A, et al. ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children. J Eur Acad Dermatol Venereol. 2020; 34 (12): 2717 - 2744. doi: 10.1111/jdv.16892
25. Wollenberg A., Kinberger M., Arents B. et al. European guideline (EuroGuiDerm) on atopic eczema: part I - systemic therapy. J Eur Acad Dermatol Venereol. 2022; 36 (9): 1409 - 1431. doi: 10.1111/jdv.18345
26. Eichenfield L.F., Tom W.L., Chamlin S.L. et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014; 70 (2): 338 - 351. doi: 10.1016/j.jaad.2013.10.010
27. Sampson H.A., Albergo R. Comparison of results of skin tests, RAST, and double-blind, placebo-controlled food challenges in children with atopic dermatitis. J Allergy Clin Immunol. 1984; 74 (1): 26 - 33. doi: 10.1016/0091-6749(84)90083-6
28. Arbes S.J. Jr, Gergen P.J., Elliott L., Zeldin D.C. Prevalences of positive skin test responses to 10 common allergens in the US population: results from the third National Health and Nutrition Examination Survey. J Allergy Clin Immunol. 2005; 116 (2): 377 - 383. doi: 10.1016/j.jaci.2005.05.017
29. Roehr C.C., Reibel S., Ziegert M. et al. Atopy patch tests, together with determination of specific IgE levels, reduce the need for oral food challenges in children with atopic dermatitis. J Allergy Clin Immunol. 2001; 107 (3): 548 - 553. doi: 10.1067/mai.2001.112849
30. Darsow U., Laifaoui J., Kerschenlohr K. et al. The prevalence of positive reactions in the atopy patch test with aeroallergens and food allergens in subjects with atopic eczema: a European multicenter study. Allergy. 2004; 59 (12): 1318 - 1325. doi: 10.1111/j.1398-9995.2004.00556.x
31. Cartledge N., Chan S. Atopic dermatitis and food allergy: A paediatric approach. Curr Pediatr Rev. 2018; 14 (3): 171 - 179. doi: 10.2174/1573396314666180613083616
32. Аллергология и иммунология: национальное руководство/Под ред. Хаитова Р.М., Ильиной Н.И. - М.: ГЭОТАР-Медиа, 2009 - 656 с.
33. Matricardi P.M., Kleine-Tebbe J., Hoffmann H.J. et al. EAACI Molecular Allergology User's Guide. Pediatr Allergy Immunol. 2016 May; 27 Suppl 23: 1 - 250. doi: 10.1111/pai.12563
34. Futamura M., Leshem Y.A., Thomas K.S. et al. A systematic review of Investigator Global Assessment (IGA) in atopic dermatitis (AD) trials: Many options, no standards. J Am Acad Dermatol. 2016; 74 (2): 288 - 294. doi: 10.1016/j.jaad.2015.09.062
35. Oranje A.P., Stalder J.F., Taieb A.et al. Scoring of atopic dermatitis by SCORAD using a training atlas by investigators from different disciplines. ETAC Study Group. Early Treatment of the Atopic Child. Pediatr Allergy Immunol. 1997; 8 (1): 28 - 34. doi: 10.1111/j.1399-3038.1997.tb00139.x
36. Schram M.E., Spuls P.I., Leeflang M.M. et al. EASI, (objective) SCORAD and POEM for atopic eczema: responsiveness and minimal clinically important difference. Allergy. 2012; 67 (1): 99 - 106. doi: 10.1111/j.1398-9995.2011.02719.x
37. Giam Y.C., Hebert A.A., Dizon M.V. A review on the role of moisturizers for atopic dermatitis. Asia Pac Allergy. 2016; 6 (2): 120 - 128. doi: 10.5415/apallergy.2016.6.2.120
38. Breternitz M., Kowatzki D., Langenauer M. et al. Placebo-controlled, double-blind, randomized, prospective study of a glycerol-based emollient on eczematous skin in atopic dermatitis: biophysical and clinical evaluation. Skin Pharmacol Physiol. 2008; 21 (1): 39 - 45. doi: 10.1159/000111134
39. Verallo-Rowell V.M., Dillague K.M., Syah-Tjundawan B.S. Novel antibacterial and emollient effects of coconut and virgin olive oils in adult atopic dermatitis. Dermatitis. 2008; 19 (6): 308 - 315.
40. Simpson E., Dutronc Y. A new body moisturizer increases skin hydration and improves atopic dermatitis symptoms among children and adults. J Drugs Dermatol. 2011; 10 (7): 744 - 749.
41. Lindh J.D., Bradley M. Clinical effectiveness of moisturizers in atopic dermatitis and related disorders: a systematic review. Am J Clin Dermatol. 2015; 16 (5): 341 - 359. doi: 10.1007/s40257-015-0146-4
42. Miller D.W., Koch S.B., Yentzer B.A. et al. An over-the-counter moisturizer is as clinically effective as, and more cost-effective than, prescription barrier creams in the treatment of children with mild-to-moderate atopic dermatitis: a randomized, controlled trial. J Drugs Dermatol. 2011; 10 (5): 531 - 537.
43. Grimalt R., Mengeaud V., Cambazard F. The steroid-sparing effect of an emollient therapy in infants with atopic dermatitis: a randomized controlled study. Dermatology. 2007; 214 (1): 61 - 67. doi: 10.1159/000096915
44. Msika P., De Belilovsky C., Piccardi N. et al. New emollient with topical corticosteroid-sparing effect in treatment of childhood atopic dermatitis: SCORAD and quality of life improvement. Pediatr Dermatol. 2008; 25 (6): 606 - 612. doi: 10.1111/j.1525-1470.2008.00783.x
45. Lucky A.W., Leach A.D., Laskarzewski P., Wenck H. Use of an emollient as a steroid-sparing agent in the treatment of mild to moderate atopic dermatitis in children. Pediatr Dermatol. 1997; 14 (4): 321 - 324. doi: 10.1111/j.1525-1470.1997.tb00968.x
46. Eberlein B., Eicke C., Reinhardt H.W., Ring J. Adjuvant treatment of atopic eczema: assessment of an emollient containing N-palmitoylethanolamine (ATOPA study). J Eur Acad Dermatol Venereol. 2008; 22 (1): 73 - 82. doi: 10.1111/j.1468-3083.2007.02351.x
47. Sugarman J.L., Parish L.C. Efficacy of a lipid-based barrier repair formulation in moderate-to-severe pediatric atopic dermatitis. J Drugs Dermatol. 2009; 8 (12): 1106 - 1111.
48. Leung T.N., Chow C.M., Chow M.P. et al. Clinical guidelines on management of atopic dermatitis in children. Hong Kong J Paediatr (new series). 2013; 18: 96 - 104.
49. Darsow U., Wollenberg A., Simon D. et al. ETFAD/EADV Eczema Task Force 2009 position paper on diagnosis and treatment of atopic dermatitis. J Eur Acad Dermatol Venereol. 2010; 24 (3): 317 - 328. doi: 10.1111/j.1468-3083.2009.03415.x
50. Chiang C., Eichenfield L.F. Quantitative assessment of combination bathing and moisturizing regimens on skin hydration in atopic dermatitis. Pediatr Dermatol. 2009; 26 (3): 273 - 278. doi: 10.1111/j.1525-1470.2009.00911.x
51. Dabade T.S., Davis D.M., Wetter D.A. et al. Wet dressing therapy in conjunction with topical corticosteroids is effective for rapid control of severe pediatric atopic dermatitis: experience with 218 patients over 30 years at Mayo Clinic. J Am Acad Dermatol. 2012; 67 (1): 100 - 106. doi: 10.1016/j.jaad.2011.06.025
52. Devillers A.C., Oranje A.P. Efficacy and safety of "wet-wrap" dressings as an intervention treatment in children with severe and/or refractory atopic dermatitis: a critical review of the literature. Br J Dermatol. 2006; 154 (4): 579 - 585. doi: 10.1111/j.1365-2133.2006.07157.x
53. Devillers A.C., de Waard-van der Spek F.B., Mulder P.G., Oranje A.P. Treatment of refractory atopic dermatitis using 'wet-wrap' dressings and diluted corticosteroids: results of standardized treatment in both children and adults. Dermatology. 2002; 204 (1): 50 - 55. doi: 10.1159/000051810
54. Goodyear H.M., Spowart K., Harper J.I. 'Wet-wrap' dressings for the treatment of atopic eczema in children. Br J Dermatol. 1991; 125 (6): 604. doi: 10.1111/j.1365-2133.1991.tb14807.x
55. Brenninkmeijer E.E., Spuls P.I., Lindeboom R. et al. Excimer laser vs. clobetasol propionate 0.05% ointment in prurigo form of atopic dermatitis: a randomized controlled trial, a pilot. Br J Dermatol. 2010; 163 (4): 823 - 831. doi: 10.1111/j.1365-2133.2010.09858.x
56. Pels R., Sterry W., Lademann J. Clobetasol propionate - where, when, why? Drugs Today (Barc). 2008; 44 (7): 547 - 557. doi: 10.1358/dot.2008.44.7.1122221
57. Breneman D., Fleischer A.B. Jr, Kaplan D. et al. Clobetasol propionate 0.05% lotion in the treatment of moderate to severe atopic dermatitis: a randomized evaluation versus clobetasol propionate emollient cream. J Drugs Dermatol. 2005; 4 (3): 330 - 336.
58. Feldman S.R. Relative efficacy and interchangeability of various clobetasol propionate vehicles in the management of steroid-responsive dermatoses. Curr Ther Res Clin Exp. 2005; 66 (3): 154 - 171. doi: 10.1016/j.curtheres.2005.06.010
59. Datz B., Yawalkar S. A double-blind, multicenter trial of 0.05% halobetasol propionate ointment and 0.05% clobetasol 17-propionate ointment in the treatment of patients with chronic, localized atopic dermatitis or lichen simplex chronicus. J Am Acad Dermatol. 1991; 25 (6 Pt 2): 1157 - 1160. doi: 10.1016/0190-9622(91)70316-t
60. Vanderploeg D.E. Betamethasone dipropionate ointment in the treatment of psoriasis and atopic dermatitis: a double-blind study. South Med J. 1976; 69 (7): 862 - 863. doi: 10.1097/00007611-197607000-00017
61. Queille C., Pommarede R., Saurat J.H. Efficacy versus systemic effects of six topical steroids in the treatment of atopic dermatitis of childhood. Pediatr Dermatol. 1984; 1 (3): 246 - 253. doi: 10.1111/j.1525-1470.1984.tb01124.x
62. Cabrera M.E. Treatment of severe or resistant corticosteroid-responsive dermatoses with Diprolene cream. J Int Med Res. 1984; 12 (3): 163 - 169. doi: 10.1177/030006058401200305
63. Lodolo J.C. Diprolene cream in the treatment of severe or resistant corticosteroid-responsive dermatoses. J Int Med Res. 1984; 12 (2): 114 - 120. doi: 10.1177/030006058401200209
64. Peterkin G.A., Morley W.N., Chalmers D. Triamcinolone and fluocinolone acetonide ointments in atopic eczema. Br Med J. 1962; 1 (5289): 1392. doi: 10.1136/bmj.1.5289.1392
65. Hanifin J.M. Atopic dermatitis. Special clinical complications. Postgrad Med. 1983; 74 (3): 188 - 193, 196 - 199. doi: 10.1080/00325481.1983.11698425
66. Cadmus S.D., Sebastian K.R., Warren D. et al. Efficacy and patient opinion of wet-wrap dressings using 0.1% triamcinolone acetonide ointment vs cream in the treatment of pediatric atopic dermatitis: A randomized split-body control study. Pediatr Dermatol. 2019; 36 (4): 437 - 441. doi: 10.1111/pde.13830
67. Wolkerstorfer A., Strobos M.A., Glazenburg E.J. et al. Fluticasone propionate 0.05% cream once daily versus clobetasone butyrate 0.05% cream twice daily in children with atopic dermatitis. J Am Acad Dermatol. 1998; 39 (2 Pt 1): 226 - 231. doi: 10.1016/s0190-9622(98)70080-5
68. Bleehen S.S., Chu A.C., Hamann I. et al. Fluticasone propionate 0.05% cream in the treatment of atopic eczema: a multicentre study comparing once-daily treatment and once-daily vehicle cream application versus twice-daily treatment. Br J Dermatol. 1995; 133 (4): 592 - 597. doi: 10.1111/j.1365-2133.1995.tb02711.x
69. Белоусова Т.А., Горячкина М.В. Опыт применения флутиказона пропионата (Кутивейт) в терапии псориаза, экземы и атопического дерматита. Эффективная фармакотерапия. 2010; 9: 24 - 29.
70. Viglioglia P., Jones M.L., Peets E.A. Once-daily 0.1% mometasone furoate cream versus twice-daily 0.1% betamethasone valerate cream in the treatment of a variety of dermatoses. J Int Med Res. 1990; 18 (6): 460 - 467. doi: 10.1177/030006059001800603
71. Prakash A., Benfield P. Topical mometasone. A review of its pharmacological properties and therapeutic use in the treatment of dermatological disorders. Drugs. 1998; 55 (1): 145 - 163. doi: 10.2165/00003495-199855010-00009
72. Vernon H.J., Lane A.T., Weston W. Comparison of mometasone furoate 0.1% cream and hydrocortisone 1.0% cream in the treatment of childhood atopic dermatitis. J Am Acad Dermatol. 1991; 24 (4): 603 - 607. doi: 10.1016/0190-9622(91)70092-g
73. Lebwohl M. A comparison of once-daily application of mometasone furoate 0.1% cream compared with twice-daily hydrocortisone valerate 0.2% cream in pediatric atopic dermatitis patients who failed to respond to hydrocortisone: mometasone furoate study group. Int J Dermatol. 1999; 38 (8): 604 - 606. doi: 10.1046/j.1365-4362.1999.00759.x
74. Томилова А.Ю., Торшхоева Р.М., Геворкян А.К., Вознесенская Н.И. Эффективность и безопасность применения мометазона фуроата при атопическом дерматите у детей. Педиатрическая фармакология 2009; 6 (4): 123 - 127.
75. Шаипов Т.С., Мазитова Л.П. Применение мометазона фуроата при лечении атопического дерматита у детей. Педиатрическая фармакология. 2007; 4 (5): 41 - 44.
76. Ненашева Н.М. Особенности атопического дерматита у взрослых пациентов Эффективная фармакотерапия. Дерматовенерология и дерматокосметология. 2012; (3): 6 - 15.
77. Lane A.T. Efficacy and safety of topical steroids in paediatric atopic dermatitis. J Eur Acad Dermatol Venereol. 1997; 8: S24-S27.
78. Faergemann J., Christensen O., ![]() P. et al. An open study of efficacy and safety of long-term treatment with mometasone furoate fatty cream in the treatment of adult patients with atopic dermatitis. J Eur Acad Dermatol Venereol. 2000; 14 (5): 393 - 396. doi: 10.1046/j.1468-3083.2000.00099.x
P. et al. An open study of efficacy and safety of long-term treatment with mometasone furoate fatty cream in the treatment of adult patients with atopic dermatitis. J Eur Acad Dermatol Venereol. 2000; 14 (5): 393 - 396. doi: 10.1046/j.1468-3083.2000.00099.x
79. Haneke E. The treatment of atopic dermatitis with methylprednisolone aceponate (MPA), a new topical corticosteroid. J Dermatol Treat. 1992; 3 (Suppl.2): 13 - 15.
80. Luger T.A. Balancing efficacy and safety in the management of atopic dermatitis: the role of methylprednisolone aceponate. J Eur Acad Dermatol Venereol. 2011; 25 (3): 251 - 258. doi: 10.1111/j.1468-3083.2010.03789.x
81. Bieber T., Vick K.,  R. et al. Efficacy and safety of methylprednisolone aceponate ointment 0.1% compared to tacrolimus 0.03% in children and adolescents with an acute flare of severe atopic dermatitis. Allergy. 2007; 62 (2): 184 - 189. doi: 10.1111/j.1398-9995.2006.01269.x
R. et al. Efficacy and safety of methylprednisolone aceponate ointment 0.1% compared to tacrolimus 0.03% in children and adolescents with an acute flare of severe atopic dermatitis. Allergy. 2007; 62 (2): 184 - 189. doi: 10.1111/j.1398-9995.2006.01269.x
82. Кондратьева Ю.С., Кархова В.В. Опыт применения 0,1% метилпреднизолонаацепоната в комплексной терапии стероидчувствительных дерматозов. Вестник дерматологии и венерологии. 2016; 1: 93 - 98.
83. Чикин В.В. Метилпреднизолона ацепонат и декспантенол в топической терапии больных атопическим дерматитом. Вестник дерматологии и венерологии. 2014; 5: 112 - 116.
84. Lassus A. Alclometasone dipropionate cream 0.05% versus clobetasone butyrate cream 0.05%. A controlled clinical comparison in the treatment of atopic dermatitis in children. Int J Dermatol. 1984; 23 (8): 565 - 566. doi: 10.1111/j.1365-4362.1984.tb04214.x
85. Panja S.K., Gangopadhaya A.K., Sharma S.D. A randomised, double-blind comparison of alclometasone dipropionate 0.05% cream in atopic dermatitis and other dermatoses. Indian J Dermatol. 1988; 33 (1): 1 - 4.
86. Макарова И.В., Гайдук И.М., Жиглинская О.В. и др. Применение 0,05% крема алклометазона дипропионата в терапии атопического дерматита у детей раннего возраста. Вопросы современной педиатрии. 2004; 3 (4): 84 - 87.
87. Короткий Н.Г., Тихомиров А.А., Гамаюнов Б.Н. Оценка клинической эффективности современного стероида алклометазона дипропионата (Афлодерма) в наружной терапии атопического дерматита у детей. Клиническая дерматология и венерология. 2007; 6: 24 - 31.
88. Торопова Н.П., Черкасова Л.А., Платонова И.Н. и др. Опыт применения препарата "Афлодерм" (алклометазона дипропионат) в детской дерматологической практике. Российский журнал кожных и венерических болезней. 2003; 3: 39 - 40.
89. Veien N.K., Hattel T., Justesen O. et al. Hydrocortisone 17-butyrate (Locoid) 0.1% cream versus hydrocortisone (Uniderm) 1% cream in the treatment of children suffering from atopic dermatitis. J Int Med Res. 1984; 12 (5): 310 - 313. doi: 10.1177/030006058401200509
90. Rajka G., Verjans H.L. Hydrocortisone 17-butyrate (Locoid) 0.1% fatty cream versus desonide (Apolar) 0.1% ointment in the treatment of patients suffering from atopic dermatitis. J Int Med Res. 1986; 14 (2): 85 - 90. doi: 10.1177/030006058601400206
91. Abramovits A, Oquendo M. Hydrocortisone butyrate 0.1% lipocream in pediatric patients with atopic dermatitis. SKINmed. 2010; 8: 72 - 79.
92. Koopmans B., Lasthein Andersen B., Mork N.J. et al. Multicentre randomized double-blind study of locoid lipocream fatty cream twice daily versus locoid lipocream once daily and locobase once daily. J Dermatol Treat. 1995; 6 (2): 103 - 106.
93. Saki N, Jowkar F, Alyaseen S. et al. Comparison of sertaconazole 2% cream versus hydrocortisone 1% ointment in the treatment of atopic dermatitis. J Dermatolog Treat. 2013; 24 (6): 447 - 449. doi: 10.3109/09546634.2013.782384
94. Reitamo S., Rustin M., Ruzicka T. et al. Efficacy and safety of tacrolimus ointment compared with that of hydrocortisone butyrate ointment in adult patients with atopic dermatitis. J Allergy Clin Immunol. 2002; 109 (3): 547 - 555. doi: 10.1067/mai.2002.121832
95. Matheson R., Kempers S., Breneman D. et al. Hydrocortisone butyrate 0.1% lotion in the treatment of atopic dermatitis in pediatric subjects. J Drugs Dermatol. 2008; 7 (3): 266 - 271.
96. Sears H.W., Bailer J.W., Yeadon A. Efficacy and safety of hydrocortisone buteprate 0.1% cream in patients with atopic dermatitis. Clin Ther. 1997; 19 (4): 710 - 719. doi: 10.1016/s0149-2918(97)80095-1
97. Игнатьев Д.В., Кочергин Н.Г. Местные кортикостероиды в практике врача-дерматолога. Особенности гидрокортизона бутирата (локоида). Дерматология. Приложение к журналу Consilium Medicum. 2007; 1: 50 - 54.
98. Udompataikul M., Limpa-o-Vart D. Comparative trial of 5% dexpanthenol in water-in-oil formulation with 1% hydrocortisone ointment in the treatment of childhood atopic dermatitis: a pilot study. J Drugs Dermatol. 2012; 11 (3): 366 - 374.
99. Сергеев Ю.В., Иванов О.Л., Новиков Д.К. и др. Атопический дерматит: современная диагностика и лечение. Иммунопатология, аллергология, инфектология. 2001; 4: 39 - 63.
100. Ashcroft D.M., Dimmock P., Garside R. et al. Efficacy and tolerability of topical pimecrolimus and tacrolimus in the treatment of atopic dermatitis: meta-analysis of randomised controlled trials. BMJ. 2005; 330 (7490): 516. doi: 10.1136/bmj.38376.439653.D3
101. Van Leent E.J., Graber M., Thurston M. et al. Effectiveness of the ascomycin macrolactam SDZ ASM 981 in the topical treatment of atopic dermatitis. Arch Dermatol. 1998; 134 (7): 805 - 809. doi: 10.1001/archderm.134.7.805
102. Meurer M.,  R., Wozel G. et al. Pimecrolimus cream in the long-term management of atopic dermatitis in adults: a six-month study. Dermatology. 2002; 205 (3): 271 - 277. doi: 10.1159/000065863
R., Wozel G. et al. Pimecrolimus cream in the long-term management of atopic dermatitis in adults: a six-month study. Dermatology. 2002; 205 (3): 271 - 277. doi: 10.1159/000065863
103. Wahn U., Bos J., Goodfield M. et al. Efficacy and safety of pimecrolimus cream in the long-term management of atopic dermatitis in children. Pediatrics. 2002; 110 (1 Pt 1): e2. doi: 10.1542/peds.110.1.e2
104. Ho V.C., Gupta A., Kaufmann R. et al. Safety and efficacy of nonsteroid pimecrolimus cream 1% in the treatment of atopic dermatitis in infants. J Pediatr. 2003; 142 (2): 155 - 162. doi: 10.1067/mpd.2003.65
105. Eichenfield L.F., Lucky A.W., Boguniewicz M. et al. Safety and efficacy of pimecrolimus (ASM 981) cream 1% in the treatment of mild and moderate atopic dermatitis in children and adolescents. J Am Acad Dermatol. 2002; 46 (4): 495 - 504. doi: 10.1067/mjd.2002.122187
106. Langley R.G., Eichenfield L.F., Lucky A.W. et al. Sustained efficacy and safety of pimecrolimus cream 1% when used long-term (up to 26 weeks) to treat children withatopic dermatitis. Pediatr Dermatol. 2008; 25 (3): 301 - 307. doi: 10.1111/j.1525-1470.2008.00671.x
107. Luger T., van Leent E.J., Graeber M. et al. SDZ ASM 981: an emerging safe and effective treatment for atopic dermatitis. Br J Dermatol. 2001; 144 (4): 788 - 794. doi: 10.1046/j.1365-2133.2001.04134.x
108. Eichenfield L.F., Thaci D., de Prost Y. et al. Clinical management of atopic eczema with pimecrolimus cream 1% (Elidel) in paediatric patients. Dermatology. 2007; 215 Suppl.1: 3 - 17. doi: 10.1159/000102116
109. Reda A.M., Elgendi A., Ebraheem A.I, et al. A practical algorithm for topical treatment of atopic dermatitis in the Middle East emphasizing the importance of sensitive skin areas. J Dermatolog Treat. 2019; 30 (4): 366 - 373. doi: 10.1080/09546634.2018.1524823
110. Ruzicka T., Bieber T.,  E. et al. A short-term trial of tacrolimus ointment for atopic dermatitis. N Engl J Med. 1997; 337 (12): 816 - 821. doi: 10.1056/NEJM199709183371203
E. et al. A short-term trial of tacrolimus ointment for atopic dermatitis. N Engl J Med. 1997; 337 (12): 816 - 821. doi: 10.1056/NEJM199709183371203
111. Reitamo S., Wollenberg A.,  E. et al. Safety and efficacy of 1 year of tacrolimus ointment monotherapy in adults with atopic dermatitis. Arch Dermatol. 2000; 136 (8): 999 - 1006. doi: 10.1001/archderm.136.8.999
E. et al. Safety and efficacy of 1 year of tacrolimus ointment monotherapy in adults with atopic dermatitis. Arch Dermatol. 2000; 136 (8): 999 - 1006. doi: 10.1001/archderm.136.8.999
112. Chen S.L., Yan J., Wang F.S. Two topical calcineurin inhibitors for the treatment of atopic dermatitis in pediatric patients: a meta-analysis of randomized clinical trials. J Dermatolog Treat. 2010; 21 (3): 144 - 156. doi: 10.3109/09546630903401470
113.  E.C., Burgdorf W.H., Wollenberg A. Immunomodulatory macrolactams for topical treatment of inflammatory skin diseases. Curr Opin Investig Drugs. 2002; 3 (5): 708 - 712.
E.C., Burgdorf W.H., Wollenberg A. Immunomodulatory macrolactams for topical treatment of inflammatory skin diseases. Curr Opin Investig Drugs. 2002; 3 (5): 708 - 712.
114. Lubbe J. Klinische Erfahrungen mit topischen Calcineurininhibitoren in der Praxis. Hautarzt. 2003; 54 (5): 432 - 439.
115. Reitamo S., Ortonne J.P., Sand C. et al. A multicentre, randomized, double-blind, controlled study of long-term treatment with 0.1% tacrolimus ointment in adults with moderate to severe atopic dermatitis. Br J Dermatol. 2005; 152 (6): 1282 - 1289. doi: 10.1111/j.1365-2133.2005.06592.x
116. Patel R.R., Vander Straten M.R., Korman N.J. The safety and efficacy of tacrolimus therapy in patients younger than 2 years with atopic dermatitis. Arch Dermatol. 2003; 139 (9): 1184 - 1186. doi: 10.1001/archderm.139.9.1184
117. Wollenberg A., Sidhu M.K., Odeyemi I. et al. Economic evaluation of maintenance treatment with tacrolimus 0.1% ointment in adults with moderate to severe atopic dermatitis. Br J Dermatol. 2008; 159 (6): 1322 - 1330. doi: 10.1111/j.1365-2133.2008.08807.x
118. Healy E., Bentley A., Fidler C., Chambers C. Cost-effectiveness of tacrolimus ointment in adults and children with moderate and severe atopic dermatitis: twice-weekly maintenance treatment vs. standard twicedaily reactive treatment of exacerbations from a third party payer (U.K. National Health Service) perspective. Br J Dermatol. 2011; 164 (2): 387 - 395. doi: 10.1111/j.1365-2133.2010.10141.x
119. Reitamo S., Mandelin J., Rubins A. et al. The pharmacokinetics of tacrolimus after first and repeated dosing with 0.03% ointment in infants with atopic dermatitis. Int J Dermatol. 2009; 48 (4): 348 - 355. doi: 10.1111/j.1365-4632.2009.03853.x
120. Reitamo S., Rustin M., Harper J. et al. A 4-year follow-up study of atopic dermatitis therapy with 0.1% tacrolimus ointment in children and adult patients. Br J Dermatol. 2008; 159 (4): 942 - 951. doi: 10.1111/j.1365-2133.2008.08747.x
121. Mandelin J.M., Remitz A., Virtanen H.M. et al. A 10-year open follow-up of eczema and respiratory symptoms in patients with atopic dermatitis treated with topical tacrolimus for the first 4 years. J Dermatolog Treat. 2010; 21 (3): 167 - 170. doi: 10.3109/09546630903493329
122. Mandelin J., Remitz A., Virtanen H.M. et al. One-year treatment with 0.1% tacrolimus ointment versus a corticosteroid regimen in adults with moderate to severe atopic dermatitis: a randomized, double-blind, comparative trial. Acta Derm Venereol. 2010; 90 (2): 170 - 174. doi: 10.2340/00015555-0803
123. Boguniewicz M., Fiedler V.C., Raimer S. et al. A randomized, vehicle-controlled trial of tacrolimus ointment for treatment of atopic dermatitis in children. Pediatric Tacrolimus Study Group. J Allergy Clin Immunol. 1998; 102 (4 Pt 1): 637 - 644. doi: 10.1016/s0091-6749(98)70281-7
124. Елисютина О.Г., Феденко Е.С., Штырбул О.В., Ниязов Д.Д. Применение такролимуса у больных атопическим дерматитом среднетяжелого и тяжелого течения. Первый клинический опыт в России. Российский аллергологический журнал 2011; 6: 68 - 76.
125. Прошутинская Д.В., Бутарева М.М., Иноятова Л.А. Новые возможности терапии атопического дерматита у детей и взрослых. Вестник дерматологии и венерологии 2013; 3: 78 - 82.
126. Самцов А.В., Сухарев А.В., Патрушев А.В., Бондарь О.И. Клиническая эффективность, безопасность и переносимость 0,1% мази такролимус при лечении атопического дерматита средней и тяжелой степени тяжести. Вестник дерматологии и венерологии 2012; 2: 71 - 77.
127. Самцов А.В., Сухарев А.В., Патрушев А.В. Лечение атопического дерматита: преимущества такролимуса перед топическими кортикостероидами. Эффективная фармакотерапия 2014; 19: 4 - 10.
128. Кубанов А.А., Петровский Ф.И. Активированный пиритион цинка (Скин-кап). Механизмы действия. Клиническое применение. Вестник дерматологии и венерологии, 2009; 5: 35 - 42.
129. Фассахов Р.С., Пампура А.Н., Коростовцев Д.С. и др. Скин-Кап в терапии атопического дерматита у детей (по результатам Российского многоцентрового исследования КАДЕТ). Российский Аллергологический Журнал 2007; 2: 75 - 81.
130. Фассахов Р.С., Пампура А.Н., Коростовцев Д.С. и др. Эффективность и безопасность активированного цинк пиритиона (скин-кап) в лечении атопического дерматита у детей (результаты Российского многоцентрового исследования). Вестник педиатрической фармакологии и нутрициологии 2006; 3 (6): 28 - 31.
131. Нейродерматозы. В кн.: Кожные и венерические болезни: Руководство для врачей. В двух томах. - 2-е изд., перераб. и доп. - Т. 2/Под ред. Ю.К. Скрипкина и В.Н. Мордовцева, - М.: Медицина, 1999. - С. 9 - 49.
132. Yoshida H., Niimura M., Ueda H. et al. Clinical evaluation of ketotifen syrup on atopic dermatitis: a comparative multicenter double-blind study of ketotifen and clemastine. Ann Allergy. 1989; 62 (6): 507 - 512.
133. Григорьева И., Сергеев А., Манина И., Кудрявцева Е. Иммунопатология и биохимические основы атопических состояний. Врач. 2012; 4: 86 - 91.
134. Морозова С.В., Лусс Л.В. Хлоропирамин: современные аспекты применения. Вопросы современной педиатрии. 2007; 6 (1): 137 - 140.
135. Горячкина М.В., Белоусова Т.А. Хлоропирамин: клинические аспекты применения. Русский медицинский журнал. Аллергология. 2014; 24: 1785 - 1789.
136. Петрова К.С., Петрова Г.А. Хлоропирамин (Супрастин) - современные аспекты применения в терапии аллергодерматозов. Русский медицинский журнал. Фармакотерапия. 2014; 8: 617 - 620.
137. Ревякина В.А. Антигистаминные препараты в клинической практике. Русский медицинский журнал. Аллергология. 2014; 11: 854 - 856.
138. Behrendt H., Ring J. Histamine, antihistamines and atopic eczema. Clin Exp Allergy. 1990; 20 (Suppl 4): 25 - 30.
139. Феденко Е.С. Фенкарол в комплексной терапии атопического дерматита и хронической крапивницы. Аллергия, астма и клиническая иммунология. 2003; 6: 10 - 12.
140. Тамразова О.Б., Глухова Е.А., Дубовец Н.Ф., Гончарова Л.В. Значение зуда, патогенетические механизмы его формирования и оценка клинических проявлений при атопическом дерматите. Практика педиатра. 2022; 2: 14 - 21.
141. Langeland T., Fagertun H.E., Larsen S. Therapeutic effect of loratadine on pruritus in patients with atopic dermatitis. A multi-crossover-designed study. Allergy. 1994; 49 (1): 22 - 26. doi: 10.1111/j.1398-9995.1994.tb00768.x
142. Monroe E.W. Relative efficacy and safety of loratadine, hydroxyzine, and placebo in chronic idiopathic urticaria and atopic dermatitis. Clin Ther. 1992; 14 (1): 17 - 21.
143. Попова И.С., Матушевская Е.В., Свирщевская Е.В. Двойное слепое плацебо-контролируемое исследование эффективности и переносимости кларотадина при атопическом дерматите. Русс. Мед. Журн. Дерматология, Венерология. 2001; 9 (4): 477 - 483.
144. Hannuksela M., Kalimo K., Lammintausta K. et al. Dose ranging study: cetirizine in the treatment of atopic dermatitis in adults. Ann Allergy. 1993; 70 (2): 127 - 133.
145. La Rosa M., Ranno C., Musarra I. et al. Double-blind study of cetirizine in atopic eczema in children. Ann Allergy. 1994; 73 (2): 117 - 122.
146. Павлова О.В. Опыт применения цетиризина (аллертека) в терапии больных атопическим дерматитом и экземой. Вестник дерматологии и венерологии. 2005; (4): 41 - 43.
147. Макарова И.В., Жиглинская О.В., Михайлова Е.А., Сухорукова В.Г. Сравнительная эффективность препаратов цетиризина дженерика (производство Эгис, Венгрия) и оригинального в форме капель в комплексной терапии атопического дерматита у детей раннего возраста. Вопросы современной педиатрии. 2007; 6 (3): 85 - 88.
148. Самсыгина Г.А. Аллергические болезни у детей. - М.: ГЭОТАР-Медиа, 2019. - 272 с.
149. Делягин В.М., Уразбагамбетов А. Применение Супрастинекса (левоцетиризина) при атопии у детей и подростков. Русский медицинский журнал. Педиатрия 2012; (16): 828 - 830.
150. Елисютина О.Г., Феденко Е.С., Федоскова Т.Г., Лусс Л.В. Эффективность терапии левоцетиризином больных с аллергодерматозами. Росс. Аллергол. Журнал, 2012, 5: 69 - 75
151. Тамразова О.Б. Патогенетическая терапия детей, страдающих тяжелыми формами атопического дерматита. Русский медицинский журнал. Педиатрия. 2013; (2): 108 - 114.
152. Нажмутдинова Д.К., Швец О.И. Левоцетиризин: перезагрузка. Русский медицинский журнал. Дерматология. 2011; 21: 1324 - 1326.
153. Камаев А.В., Трусова О.В., Камаева И.А. Зуд при атопическом дерматите у детей: известные механизмы и возможности его долгосрочного контроля. Русский медицинский журнал. 2015; 3: 142 - 146.
154. Монахов С.А., Коржачкина Н.Б., Олисова О.Ю. Узковолновая фототерапия 311 нм в лечении больных атопическим дерматитом. Российский журнал кожных и венерических болезней. 2012; 3: 25 - 27.
155. Majoie I.M., Oldhoff J.M., van Weelden H. et al. Narrowband ultraviolet B and medium-dose ultraviolet A1 are equally effective in the treatment of moderate to severe atopic dermatitis. J Am Acad Dermatol 2009; 60 (1): 77 - 84. doi: 10.1016/j.jaad.2008.08.048
156. Reynolds N.J., Franklin V., Gray J.C. et al. Narrow-band ultraviolet B and broad-band ultraviolet A phototherapy in adult atopic eczema: a randomised controlled trial. Lancet. 2001; 357 (9273): 2012 - 2016. doi: 10.1016/S0140-6736(00)05114-X
157. Clayton T.H., Clark S.M., Turner D., Goulden V. The treatment of severe atopic dermatitis in childhood with narrowband ultraviolet B phototherapy. Clin Exp Dermatol. 2007; 32 (1): 28 - 33. doi: 10.1111/j.1365-2230.2006.02292.x
158. Seccombe L., Wynne M.D., Clancy C. et al. A retrospective review of phototherapy in children, at a tertiary paediatric dermatology unit. Photodermatol Photoimmunol Photomed. 2021; 37 (1): 34 - 38. doi: 10.1111/phpp.12604
159. Gambichler T., Othlinghaus N., Tomi N.S. et al. Medium-dose ultraviolet (UV) A1 vs. narrowband UVB phototherapy in atopic eczema: a randomized crossover study. Br J Dermatol. 2009; 160 (3): 652 - 658. doi: 10.1111/j.1365-2133.2008.08984.x
160. Bogaczewicz J., Malinowska K., Sysa-Jedrzejowska A., Wozniacka A. Medium-dose ultraviolet A1 phototherapy improves SCORAD index and increases mRNA expression of interleukin-4 without direct effect on human ![]() defensin-1, interleukin-10, and interleukin-31. Int J Dermatol. 2016; 55 (7): e380-e385. doi: 10.1111/ijd.13213
defensin-1, interleukin-10, and interleukin-31. Int J Dermatol. 2016; 55 (7): e380-e385. doi: 10.1111/ijd.13213
161. Tzaneva S., Seeber A., Schwaiger M. et al. High-dose versus medium-dose UVA1 phototherapy for patients with severe generalized atopic dermatitis. J Am Acad Dermatol. 2001; 45 (4): 503 - 507. doi: 10.1067/mjd.2001.114743
162. Malinowska K., Wozniacka A., Bogaczewicz J. The impact of medium dose UVA1 phototherapy on pruritus, DLQI and SCORAD index in patients with atopic dermatitis. Postepy Dermatol Alergol. 2020; 37 (6): 962 - 967. doi: 10.5114/ada.2019.88465
163. Abeck D., Schmidt T., Fesq H. et al. Long-term efficacy of medium-dose UVA1 phototherapy in atopic dermatitis. J Am Acad Dermatol. 2000; 42 (2 Pt 1): 254 - 257. doi: 10.1016/S0190-9622(00)90134-8
164. Pugashetti R., Lim H.W., Koo J. Broadband UVB revisited: is the narrowband UVB fad limiting our therapeutic options? J DermatologTreat. 2010; 21 (6): 326 - 330. doi: 10.3109/09546630903341986
165.  A., Aranegui B.,
A., Aranegui B.,  J.A. et al. Phototherapy in atopic dermatitis: a systematic review of the literature. Actas Dermosifiliogr. 2015; 106 (5): 387 - 401. doi: 10.1016/j.ad.2014.12.017
J.A. et al. Phototherapy in atopic dermatitis: a systematic review of the literature. Actas Dermosifiliogr. 2015; 106 (5): 387 - 401. doi: 10.1016/j.ad.2014.12.017
166. Физическая и реабилитационная медицина. Национальное руководство./Под ред. Г.Н. Пономаренко., М.: ГЭОТАР-Медиа, 2016 г. 688 с.
167. Частная физиотерапия: Учебное пособие/Под ред. Г.Н. Пономаренко. - М.: ОАО "Издательство "Медицина", 2005, 744 с.
168. Patrizi A., Raone B., Ravaioli G.M. Management of atopic dermatitis: safety and efficacy of phototherapy. Clin Cosmet Investig Dermatol. 2015; 8: 511 - 520. doi: 10.2147/CCID.S87987
169. Dogra S., Mahajan R.; Indian Association of Dermatologists, Venereologists and Leprologists. Phototherapy for atopic dermatitis. Indian J Dermatol Venereol Leprol. 2015; 81 (1): 10 - 15. doi: 10.4103/0378-6323.148557
170. Кубанова А.А., Самсонов В.А., Волнухин В.А. и др. Терапия больных псориазом, атопическим дерматитом и витилиго узкополосным средневолновым ультрафиолетовым излучением с длиной волны 311 нм. Медицинская технология N ФС-2006/250 от 15 августа 2006 года. Вестник дерматологии и венерологии 2008; 3: 17 - 20.
171. Thompson K.G., Kim N. Distinguishing myth from fact: photocarcinogenesis and phototherapy. Dermatol Clin. 2020; 38 (1): 25 - 35. doi: 10.1016/j.det.2019.08.003
172. Simpson E.L., Sinclair R., Forman S. et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet. 2020; 396 (10246): 255 - 266. doi: 10.1016/S0140-6736(20)30732-7. PMID: 32711801.
173. Silverberg J.I., Simpson E.L., Thyssen J.P. et al. Efficacy and safety of abrocitinib in patients with moderate-to-severe atopic dermatitis: A randomized clinical trial. JAMA Dermatol. 2020; 156 (8): 863 - 873. doi: 10.1001/jamadermatol.2020.1406
174. Bieber T., Simpson E.L., Silverberg J.I. et al. Abrocitinib versus placebo or dupilumab for atopic dermatitis. N Engl J Med. 2021; 384 (12): 1101 - 1112. doi: 10.1056/NEJMoa2019380
175. Blauvelt A., Silverberg J.I., Lynde C.W. et al. Abrocitinib induction, randomized withdrawal, and retreatment in patients with moderate-to-severe atopic dermatitis: Results from the JAK1 Atopic Dermatitis Efficacy and Safety (JADE) REGIMEN phase 3 trial. J Am Acad Dermatol. 2022; 86 (1): 104 - 112. doi: 10.1016/j.jaad.2021.05.075.
176. Eichenfield L.F., Flohr C., Sidbury R. et al. Efficacy and safety of abrocitinib in combination with topical therapy in adolescents with moderate-to-severe atopic dermatitis: The JADE TEEN Randomized Clinical Trial. JAMA Dermatol. 2021; 157 (10): 1165 - 1173. doi: 10.1001/jamadermatol.2021.2830
177. Reich K., Thyssen J.P., Blauvelt A. et al. Efficacy and safety of abrocitinib versus dupilumab in adults with moderate-to-severe atopic dermatitis: a randomised, double-blind, multicentre phase 3 trial. Lancet. 2022; 400 (10348): 273 - 282. doi: 10.1016/S0140-6736(22)01199-0.
178. Simpson EL, Silverberg JI, Nosbaum A. et al. Integrated safety analysis of abrocitinib for the treatment of moderate-to-severe atopic dermatitis from the phase II and phase III clinical tial program. Am J Clin Dermatol. 2021; 22 (5): 693 - 707. doi: 10.1007/s40257-021-00618-3.
179. Reich K., Kabashima K., Peris K. et al. Efficacy and safety of baricitinib combined with topical corticosteroids for treatment of moderate to severe atopic dermatitis: A randomized clinical trial. JAMA Dermatol. 2020; 156 (12): 1333 - 1343. doi: 10.1001/jamadermatol.2020.3260.
180. Simpson E.L., Lacour J.P., Spelman L. et al. Baricitinib in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: results from two randomized monotherapy phase III trials. Br J Dermatol. 2020; 183 (2): 242 - 255. doi: 10.1111/bjd.18898.
181. Bieber T., Thyssen J.P., Reich K. et al. Pooled safety analysis of baricitinib in adult patients with atopic dermatitis from 8 randomized clinical trials. J Eur Acad Dermatol Venereol. 2021; 35 (2): 476 - 485. doi: 10.1111/jdv.16948.
182. Paller A.S., Siegfried E.C., ![]() D. et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020; 83 (5): 1282 - 1293. doi: 10.1016/j.jaad.2020.06.054
D. et al. Efficacy and safety of dupilumab with concomitant topical corticosteroids in children 6 to 11 years old with severe atopic dermatitis: A randomized, double-blinded, placebo-controlled phase 3 trial. J Am Acad Dermatol. 2020; 83 (5): 1282 - 1293. doi: 10.1016/j.jaad.2020.06.054
183. Paller A.S., Bansal A., Simpson E.L. et al. Clinically meaningful responses to dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: Post-hoc analyses from a randomized clinical trial. Am J Clin Dermatol. 2020; 21 (1): 119 - 131. doi: 10.1007/s40257-019-00478-y
184. Simpson E.L., Paller A.S., Siegfried E.C. et al. Efficacy and safety of dupilumab in adolescents with uncontrolled moderate to severe atopic dermatitis: A phase 3 randomized clinical trial. JAMA Dermatol. 2020; 156 (1): 44 - 56. doi: 10.1001/jamadermatol.2019.3336
185. Cork M.J., ![]() D., Eichenfield L.F. et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension. Br J Dermatol. 2020; 182 (1): 85 - 96. doi: 10.1111/bjd.18476
D., Eichenfield L.F. et al. Dupilumab in adolescents with uncontrolled moderate-to-severe atopic dermatitis: results from a phase IIa open-label trial and subsequent phase III open-label extension. Br J Dermatol. 2020; 182 (1): 85 - 96. doi: 10.1111/bjd.18476
186. Simpson E.L., Bieber T., Guttman-Yassky E. et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2016; 375 (24): 2335 - 2348. doi: 10.1056/NEJMoa1610020
187. Blauvelt A., de Bruin-Weller M., Gooderham M. et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet 2017; 389 (10086): 2287 - 2303. doi: 10.1016/S0140-6736(17)31191-1
188. de Bruin-Weller M., ![]() D., Smith C.H. et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical trial (LIBERTY AD
D., Smith C.H. et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical trial (LIBERTY AD ![]() ). Br J Dermatol. 2018; 178 (5): 1083 - 1101. doi: 10.1111/bjd.16156
). Br J Dermatol. 2018; 178 (5): 1083 - 1101. doi: 10.1111/bjd.16156
189. ![]() D., L Simpson E., Deleuran M. et al. Efficacy and safety of dupilumab monotherapy in adults with moderate-to-severe atopic dermatitis: a pooled analysis of two phase 3 randomized trials (LIBERTY AD SOLO 1 and LIBERTY AD SOLO 2). J Dermatol Sci. 2019; 94 (2): 266 - 275. doi: 10.1016/j.jdermsci.2019.02.002
D., L Simpson E., Deleuran M. et al. Efficacy and safety of dupilumab monotherapy in adults with moderate-to-severe atopic dermatitis: a pooled analysis of two phase 3 randomized trials (LIBERTY AD SOLO 1 and LIBERTY AD SOLO 2). J Dermatol Sci. 2019; 94 (2): 266 - 275. doi: 10.1016/j.jdermsci.2019.02.002
190. Cork M.J., Eckert L., Simpson E.L. et al. Dupilumab improves patient-reported symptoms of atopic dermatitis, symptoms of anxiety and depression, and health-related quality of life in moderate-to-severe atopic dermatitis: analysis of pooled data from the randomized trials SOLO 1 and SOLO 2. J Dermatolog Treat. 2020; 31 (6): 606 - 614. doi: 10.1080/09546634.2019.1612836
191. Snast I., Reiter O., Hodak E. et al. Are biologics efficacious in atopic dermatitis? A systematic review and meta-analysis. Am J Clin Dermatol. 2018; 19 (2): 145 - 165. doi: 10.1007/s40257-017-0324-7
192. Wang F.P., Tang X.J., Wei C.Q. et al. Dupilumab treatment in moderate-to-severe atopic dermatitis: A systematic review and meta-analysis. J Dermatol Sci. 2018; 90 (2): 190 - 198. doi: 10.1016/j.jdermsci.2018.01.016
193. Guttman-Yassky E., Teixeira H.D., Simpson E.L. et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021; 397 (10290): 2151 - 2168. doi: 10.1016/S0140-6736(21)00588-2
194. Reich K., Teixeira H.D., de Bruin-Weller M. et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2021; 397 (10290): 2169 - 2181. doi: 10.1016/S0140-6736(21)00589-4
195. Silverberg J.I., de Bruin-Weller M., Bieber T. et al. Upadacitinib plus topical corticosteroids in atopic dermatitis: Week-52 AD Up study results. J Allergy Clin Immunol. 2022; 149 (3): 977 - 987. e14. doi: 10.1016/j.jaci.2021.07.036
196. Simpson E.L., Papp K.A., Blauvelt A. et al. Efficacy and safety of upadacitinib in patients with moderate to severe atopic dermatitis: Analysis of follow-up data from the Measure Up 1 and Measure Up 2 randomized clinical trials. JAMA Dermatol. 2022; 158 (4): 404 - 413. doi: 10.1001/jamadermatol.2022.0029
197. Blauvelt A., Teixeira H.D., Simpson E.L. et al. Efficacy and safety of upadacitinib vs dupilumab in adults with moderate-to-severe atopic dermatitis: A randomized clinical trial. JAMA Dermatol. 2021; 157 (9): 1047 - 1055. doi: 10.1001/jamadermatol.2021.3023
198. Silverberg J.I., Thyssen J.P., Fahrbach K. et al. Comparative efficacy and safety of systemic therapies used in moderate-to-severe atopic dermatitis: a systematic literature review and network meta-analysis. J Eur Acad Dermatol Venereol. 2021; 35 (9): 1797 - 1810. doi: 10.1111/jdv.17351
199. Pereyra-Rodriguez J.J., Alcantara-Luna S.,  J. et al. Short-term effectiveness and safety of biologics and small molecule drugs for moderate to severe atopic dermatitis: A systematic review and network meta-analysis. Life (Basel). 2021; 11 (9): 927. doi: 10.3390/life11090927
J. et al. Short-term effectiveness and safety of biologics and small molecule drugs for moderate to severe atopic dermatitis: A systematic review and network meta-analysis. Life (Basel). 2021; 11 (9): 927. doi: 10.3390/life11090927
200. Silverberg J.I., Hong H.C., Thyssen J.P. et al. Comparative efficacy of targeted systemic therapies for moderate to severe atopic dermatitis without topical corticosteroids: Systematic review and network meta-analysis. Dermatol Ther (Heidelb). 2022; 12 (5): 1181 - 1196. doi: 10.1007/s13555-022-00721-1
201. Czech W., Brautigam M., Weidinger G.,  E. Body weight independent dosing regimen of cyclosporine microemulsion is effective in severe atopic dermatitis and improves the quality of life. J Am Acad Dermatol 2000; 42 (4): 653 - 659.
E. Body weight independent dosing regimen of cyclosporine microemulsion is effective in severe atopic dermatitis and improves the quality of life. J Am Acad Dermatol 2000; 42 (4): 653 - 659.
202. Harper J.I., Ahmed I., Barclay G. et al. Cyclosporin for severe childhood atopic dermatitis: short course versus continuous therapy. Br J Dermatol 2000; 142 (1): 52 - 58. doi: 10.1046/j.1365-2133.2000.03241.x
203. Granlund H., Erkko P., Remitz A. et al. Comparison of cyclosporin and UVAB phototherapy for intermittent one-year treatment of atopic dermatitis. Acta Derm Venereol 2001; 81 (1): 22 - 27. doi: 10.1080/00015550120235
204. Zurbriggen B., Wuthrich B., Cachelin A.B. et al. Comparison of two formulations of cyclosporin A in the treatment of severe atopic dermatitis. A double-blind, single-centre, cross-over pilot study. Dermatology 1999; 198 (1): 56 - 60. doi: 10.1159/000018065
205. Hijnen D.J., ten Berge O., Timmer-de Mik L. et al. Efficacy and safety of long-term treatment with cyclosporin A for atopic dermatitis. J Eur Acad Dermatol Venereol 2007; 21 (1): 85 - 89. doi: 10.1111/j.1468-3083.2006.01877.x
206. Schmitt J., Schmitt N., Meurer M. Cyclosporin in the treatment of patients with atopic eczema a systematic review and meta-analysis. J Eur Acad Dermatol Venereol 2007; 21 (5): 606 - 619. doi: 10.1111/j.1468-3083.2006.02023.x
207. Amor K.T., Ryan K., Menter A. The use of cyclosporine in dermatology: Part I. J Am Acad Dermatol 2010; 63 (6): 925 - 946. doi: 10.1016/j.jaad.2010.02.063
208. Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018; 32 (6): 850 - 878. doi: 10.1111/jdv.14888
209. Шамов Б.А. Атопический дерматит: клинические проявления и лечение. Дневник Казанской медицинской школы. 2014; 1 (4): 63 - 65.
210. Tognetti L., Martinelli C., Berti S. et al. Bacterial skin and soft tissue infections: review of the epidemiology, microbiology, aetiopathogenesis and treatment: a collaboration between dermatologists and infectivologists. J Eur Acad Dermatol Venereol. 2012; 26 (8): 931 - 941. doi: 10.1111/j.1468-3083.2011.04416.x
211. Petry V., Bessa G.R., Poziomczyck C.S. et al. Bacterial skin colonization and infections in patients with atopic dermatitis. An Bras Dermatol. 2012; 87 (5): 729 - 734. doi: 10.1590/s0365-05962012000500010
212. Jung M.Y., Chung J.Y., Lee H.Y. et al. Antibiotic susceptibility of Staphylococcus aureus in atopic dermatitis: current prevalence of methicillin-resistant Staphylococcus aureus in Korea and treatment strategies. Ann Dermatol. 2015; 27 (4): 398 - 403. doi: 10.5021/ad.2015.27.4.398
213. ![]() J. Secondary infections in patients with atopic dermatitis. Am J Clin Dermatol. 2003; 4 (9): 641 - 654. doi: 10.2165/00128071-200304090-00006
J. Secondary infections in patients with atopic dermatitis. Am J Clin Dermatol. 2003; 4 (9): 641 - 654. doi: 10.2165/00128071-200304090-00006
214. Масюкова С.А., Гладько Е.В., Тарасенко Г.Н. и др. Фузидиевая кислота в лечении пиодермитов и аллергодерматозов, осложненных бактериальной инфекцией. Вестник дерматологии и венерологии. 2007; 6: 54 - 57.
215. Дворянкова Е.В., Корсунская И.М., Захарова А.Б., Жуковский Р.О. Атопический дерматит, осложненный вторичной инфекцией: подходы к терапии. Эффективная фармакотерапия. 2011; 26: 74 - 76.
216. Ларькова И.А. Эффективная терапия атопического дерматита у детей, осложненного вторичной инфекцией. Медицинский совет. 2016; 1: 162 - 167.
217. Матушевская Е.В., Свирщевская Е.В. Атопический дерматит в практике врача-дерматовенеролога: рациональный выбор терапии. Русский медицинский журнал. 2013; 21 (8): 410 - 412.
218. Gong J.Q., Lin L., Lin T. et al. Skin colonization by Staphylococcus aureus in patients with eczema and atopic dermatitis and relevant combined topical therapy: a double-blind multicentre randomized controlled trial. Br J Dermatol. 2006; 155 (4): 680 - 687. doi: 10.1111/j.1365-2133.2006.07410.x
219. Lever R, Hadley K, Downey D, Mackie R. Staphylococcal colonization in atopic dermatitis and the effect of topical mupirocin therapy. Br J Dermatol. 1988; 119 (2): 189 - 198. doi: 10.1111/j.1365-2133.1988.tb03201.x
220. Альбанова В. Наружное лечение атопического дерматита. Врач. 2006; 2: 76 - 78.
221. Батыршина С.В., Хаертдинова Л.А. Концепция местной терапии больных атопическим дерматитом. Практическая медицина. 2009; 35 (3): 41 - 45.
222. Васенова В.Ю., Бутов Ю.С. Применение Полькортолона ТС для лечения зудящих дерматозов, осложненных вторичной инфекцией. Русский медицинский журнал 2013; 21 (22): 1096 - 1098.
223. Скрипкин Ю.К., Хамаганова И.В. Опыт применения аэрозолей оксикорт и полькортолон ТС в лечении аллергических дерматозов, осложненных пиодермией. Вестник дерматологии и венерологии. 2004; 1: 42 - 43.
224. Ramsay C., Savoie J., Gilbert M. et al. The treatment of atopic dermatitis with topical fusidic acid and hydrocortisone acetate. J Eur Acad Dermatol Venereol. 1996; 7 (Suppl. 1): S15 - 22.
225. Кунгуров Н.В., Кохан М.М., Кениксфест Ю.В., Кащеева Я.В., Летаева О.В., Куклин И.А., Стукова Е.И. Инновационное комбинированное наружное средство в терапии осложненных дерматозов: опыт использования. Лечащий врач. 2019; 5: 38 - 50.
226. Перламутров Ю.Н., Ольховская К.Б., Ляпон А.О., Солнцева В.К. Новый шаг к лекарственному контролю атопического дерматита/Клиническая дерматология и венерология. 2019; 18 (3): 302 - 308. DOI 10.17116/klinderma201918031307
227. Касаткин Е.В., Гивировский С.Е., Писарев В.В. и др. Сравнительная оценка терапевтической эффективности и безопасности препаратов Тетрадерм![]() крем и Тридерм
крем и Тридерм![]() крем у пациентов с аллергодерматозами, осложненными вторичной инфекцией. Consilium Medicum. 2021; 23 (8): 676 - 681. DOI: 10.26442/20751753.2021.8.201
крем у пациентов с аллергодерматозами, осложненными вторичной инфекцией. Consilium Medicum. 2021; 23 (8): 676 - 681. DOI: 10.26442/20751753.2021.8.201
228. Hjorth N., Schmidt H., Thomsen K. Fusidic acid plus betamethasone in infected or potentially infected eczema. Pharmatherapeutica 1985; 4 (2): 126 - 131.
229. Тарасова М.В., Марина Т.В., Сорокина Е.А. и др. Целесообразность применения комбинированных топических глюкокортикостероидов в комплексной терапии атопического дерматита. Журнал научных статей Здоровье и образование в XXI веке. 2008; 10 (3): 383.
230. Кубанова А.А. Прошутинская Д.В., Текучева Л.В., Авдиенко И.Н. Интегральный подход к наружной терапии больных атопическим дерматитом. Вестник дерматологии и венерологии. 2010; 1: 20 - 26.
231. Ненашева Н.М. Особенности местной (наружной) терапии осложненного инфекцией атопического дерматита. РМЖ. 2015; 23 (19): 1159 - 1165.
232. Кунгуров Н.В., Кениксфест Ю.В., Кохан М.М. и др. Комбинированная наружная терапия осложненных дерматозов. Клиническая дерматология и венерология. 2005; 2: 33 - 37.
233. Короткий Н.Г., Тихомиров А.А., Гамаюнов Б.Н. Применение антибактериальных и противогрибковых средств в наружной терапии детей с атопическим дерматитом различной степени тяжести, осложненным вторичной инфекцией. Педиатрическая фармакология. 2007; 4 (2): 76 - 80.
234. Кравченя С.С., Игонина И.А., Бакулев А.Л. Комбинированная наружная терапия атопического дерматита. Клиническая дерматология и венерология. 2011; 9(1): 41 - 44;
235. Хамаганова И.В., Шекрота А.Г., Никифорова Г.Д. и др. Комплексное лечение атопического дерматита. Клиническая дерматология и венерология. 2007; 3: 87 - 89.
236. Niebuhr M., Mai U., Kapp A., Werfel T. Antibiotic treatment of cutaneous infections with Staphylococcus aureus in patients with atopic dermatitis: current antimicrobial resistances and susceptibilities. Exp Dermatol. 2008; 17 (11): 953 - 957. doi: 10.1111/j.1600-0625.2008.00734.x
237. Boguniewicz M., Sampson H., Leung S. et al. Effects of cefuroxime axetil on Staphylococcus aureus colonizing and superantigen production in atopic dermatitis. J Allergy Clin Immunol 2001; 108 (4): 651 - 652. doi: 10.1067/mai.2001.118598
238. Тренева М.С., Пампура А.Н. Стратегия выбора антибактериальных препаратов у детей с микробным инфицированием атопического дерматита. Практическая медицина. 2011; 3 (51): 136 - 139.
239. Boguniewicz M., Leung D.Y. Recent insights into atopic dermatitis and implications for management of infectious complications. J Allergy Clin Immunol. 2010; 125 (1): 4 - 13. doi: 10.1016/j.jaci.2009.11.027
240. Wollenberg A. Eczema herpeticum. Chem Immunol Allergy. 2012; 96: 89 - 95. doi: 10.1159/000331892
241. Niimura M., Nishikawa T. Treatment of eczema herpeticum with oral acyclovir. Am J Med. 1988; 85 (2A): 49 - 52.
242. Пенкина Н.И. Анализ эффективности антиоксидантной терапии при обострении атопического дерматита у детей//ПЭМ. 2005. N 18-2. URL: https://cyberleninka.ru/article/n/analiz-effektivnosti-antioksidantnoy-terapii-pri-obostrenii-atopicheskogo-dermatita-u-detey.
243. Bussmann C., Bockenhoff A., Henke H. et al. Does allergen-specific immunotherapy represent a therapeutic option for patients with atopic dermatitis? J Allergy Clin Immunol. 2006; 118 (6): 1292 - 1298. doi: 10.1016/j.jaci.2006.07.054
244. Darsow U., Forer I., Ring J. Allergen-specific immunotherapy in atopic eczema. Curr Allergy Asthma Rep. 2011; 11 (4): 277 - 283. doi: 10.1007/s11882-011-0194-7
245. Bae J.M., Choi Y.Y., Park C.O. et al. Efficacy of allergen-specific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2013; 132 (1): 110 - 117. doi: 10.1016/j.jaci.2013.02.044
246. Ring J. Successful hyposensitization treatment in atopic eczema: results of a trial in monozygotic twins. Br J Dermatol. 1982; 107 (5): 597 - 602. doi: 10.1111/j.1365-2133.1982.tb00412.x
247. Glover M.T., Atherton D.J. A double-blind controlled trial of hyposensitization to Dermatophagoides pteronyssinus in children with atopic eczema. Clin Exp Allergy. 1992; 22 (4): 440 - 446. doi: 10.1111/j.1365-2222.1992.tb00145.x
248. Zachariae H., Cramers M., Herlin T.et al. Non-specific immunotherapy and specific hyposensitization in severe atopic dermatitis. Acta Derm Venereol Suppl (Stockh). 1985; 114: 48 - 54. doi: 10.2340/000155551144854
249. Елисютина О.Г., Феденко Е.С. Место специфической иммунотерапии в лечении больных атопическим дерматитом, осложненным рецидивирующей пиодермией. Физиология и патология иммунной системы. Физиология и патология иммунной системы. 2006; (8): С. 15.
250. Novak N., BieberT., Hoffmann M. et al. Efficacy and safety of subcutaneous allergen-specific immunotherapy with depigmented polymerized mite extract in atopic dermatitis. J Allergy Clin Immunol. 2012; 130 (4): 925 - 931 e4. doi: 10.1016/j.jaci.2012.08.004
251. Pajno G.B., Caminiti L., Vita D. et al. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, double-blind, placebo-controlled study. J Allergy Clin Immunol. 2007; 120 (1): 164 - 170. doi: 10.1016/j.jaci.2007.04.008
252. Qin Y.E., Mao J.R., Sang Y.C., Li W.X. Clinical efficacy and compliance of sublingual immunotherapy with Dermatophagoides farinae drops in patients with atopic dermatitis. Int J Dermatol. 2014; 53 (5): 650 - 655. doi: 10.1111/ijd.12302
253. Liu L., Guo D., Liang Q. et al. The efficacy of sublingual immunotherapy with Dermatophagoides farinae vaccine in a murine atopic dermatitis model. Clin Exp Allergy. 2015; 45 (4): 815 - 822. doi: 10.1111/cea.12417
254. Притуло О.А., Прохоров Д.В., Жумыкина О.И., Испирьян М.Б. Дерматокурортология - актуальное направление медицинской реабилитации населения РФ с учетом санаторно-курортного потенциала Республики Крым. Вестник физиотерапии и курортологии. 2016; 22 (3): 49 - 51.
255. Тлиш М.М. Инновации в системе санаторно-курортной реабилитации больных зудящими дерматозами. Вестник новых медицинских технологий. 2011; 18 (4): 181 - 183.
256. Ефимова А.С. К вопросу о санаторно-курортном лечении больных атопическим дерматитом в Крыму. Вестник физиотерапии и курортологии. 2019; 1: 84 - 92.
257. Farina S., Gisondi P., Zanoni M. et al. Balneotherapy for atopic dermatitis in children at Comano spa in Trentino, Italy. J Dermatolog Treat. 2011; 22 (6): 366 - 371. doi: 10.3109/09546634.2010.512950
258. Huang A, ![]() S, Adar T. The use of balneotherapy in dermatology. Clin Dermatol. 2018; 36 (3): 363 - 368. doi: 10.1016/j.clindermatol.2018.03.010
S, Adar T. The use of balneotherapy in dermatology. Clin Dermatol. 2018; 36 (3): 363 - 368. doi: 10.1016/j.clindermatol.2018.03.010
259. Lio P.A. Non-pharmacologic therapies for atopic dermatitis. Curr Allergy Asthma Rep. 2013; 13 (5): 528 - 538. doi: 10.1007/s11882-013-0371-y
260. Taieb C., Sibaud V., Merial-Kieny C. Impact of ![]() hydrotherapy on the quality of life of atopic and psoriatic patients. J Eur Acad Dermatol Venereol. 2011; 25 Suppl 1: 24 - 29. doi: 10.1111/j.1468-3083.2010.03899.x
hydrotherapy on the quality of life of atopic and psoriatic patients. J Eur Acad Dermatol Venereol. 2011; 25 Suppl 1: 24 - 29. doi: 10.1111/j.1468-3083.2010.03899.x
261. Cacciapuoti S., Luciano M.A., Megna M. et al. The role of thermal water in chronic skin diseases management: A review of the literature. J Clin Med. 2020; 9 (9): 3047. doi: 10.3390/jcm9093047
262. Некипелова А.В., Власов В.Г., Лунева Т.Г. Возможности использования азотно-кремнистых термальных вод в лечении больных хроническими рецидивирующими дерматозами в специализированной больнице восстановительного лечения "Анненские Воды". Здравоохранение Дальнего Востока. 2013. N 2 (56): 51 - 57.
263. Некипелова А.В. К эффективности бальнеотерапии у больных хроническими дерматозами. Тихоокеанский медицинский журнал. 2014; 1: 56 - 58.
264. Казначеева Л.Ф., Массерова В.В., Казначеев К.С., Геращенко Н.В. Клинические особенности течения атопического дерматита у детей при применении "сухих" углекислых ванн. Мать и дитя в Кузбассе. 2011; 2 (45): 17 - 20.
265. Пахнова Л.Р., Самотруева М.А., Башкина О.А. и др. Пелоидотерапия заболеваний кожи. Астраханский медицинский журнал. 2017; 12 (1): 8 - 21.
266. Маньшина Н.В., Севрюкова В.С., Соловьев А.М., Кулешова Л.М. Санаторно-курортное лечение болезней кожи. Медицинский совет 2008; 1 - 2: 67 - 75.
267. Капасакалиди Д., Ковальчук В., Реут В. Атопический дерматит. Терапия и профилактика. Особенности реабилитации в санаторно-курортных условиях. Врач. 2015; 8: 51 - 55.
268. Roduit C., Frei R., Loss G. et al. Development of atopic dermatitis according to age of onset and association with early-life exposures. J Allergy Clin Immunol. 2012; 130 (1): 130 - 136 e5. doi: 10.1016/j.jaci.2012.02.043
269. Caut C., Leach M., Steel A. Dietary guideline adherence during preconception and pregnancy: A systematic review. Matern Child Nutr. 2020; 16 (2): e12916. doi: 10.1111/mcn.12916
270. Sugita K., Akdis C.A. Recent developments and advances in atopic dermatitis and food allergy. Allergol Int. 2020; 69 (2): 204 - 214. doi: 10.1016/j.alit.2019.08.013
271. Perkin M.R., Logan K., Tseng A. et al. Randomized trial of introduction of allergenic foods in breast-fed infants. N Engl J Med. 2016; 374 (18): 1733 - 1743. doi: 10.1056/NEJMoa1514210
272. Prell C., Koletzko B. Breastfeeding and Complementary Feeding. Dtsch Arztebl Int. 2016; 113 (25): 435 - 444. doi: 10.3238/arztebl.2016.0435
273. Alexander D.D., Cabana M.D. Partially hydrolyzed 100% whey protein infant formula and reduced risk of atopic dermatitis: a meta-analysis. J Pediatr Gastroenterol Nutr. 2010; 50 (4): 422 - 430. doi: 10.1097/MPG.0b013e3181cea52b
274. Vandenplas Y., Al-Hussaini B., Al-Mannaei K. et al. Prevention of Allergic Sensitization and Treatment of Cow"s Milk Protein Allergy in Early Life: The Middle-East Step-Down Consensus. Nutrients. 2019 Jun 26; 11 (7): 1444. doi: 10.3390/nu11071444
275. Gruber C. Probiotics and prebiotics in allergy prevention and treatment: future prospects. Exp Rev Clin Immunol. 2012; 8 (1): 17 - 19. doi: 10.1586/eci.11.74
276. Cuello-Garcia C.A., Brozek J.L., Fiocchi A. et al. Probiotics for the prevention of allergy: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2015; 136 (4): 952 - 961. doi: 10.1016/j.jaci.2015.04.031
277. Panduru M., Panduru N.M.,  C.M., Tiplica G.S. Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J Eur Acad Dermatol Venereol. 2015; 29 (2): 232 - 242. doi: 10.1111/jdv.12496
C.M., Tiplica G.S. Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J Eur Acad Dermatol Venereol. 2015; 29 (2): 232 - 242. doi: 10.1111/jdv.12496
278. Muraro A., Halken S., Arshad S.H. et al. EAACI food allergy and anaphylaxis guidelines. Primary prevention of food allergy. Allergy. 2014; 69 (5): 590 - 601. doi: 10.1111/all.12398
279. Kantor R., Kim A., Thyssen J.P., Silverberg J.I. Association of atopic dermatitis with smoking: a systematic review and meta-analysis. J Am Acad Dermatol. 2016; 75 (6): 1119 - 1125 e1. doi: 10.1016/j.jaad.2016.07.017
280. Kathuria P., Silverberg J.I. Association of pollution and climate with atopic eczema in US children. Pediatr Allergy Immunol. 2016; 27 (5): 478 - 485. doi: 10.1111/pai.12543
281. Morgenstern V., Zutavern A., Cyrys J. et al. Atopic diseases, allergic sensitization, and exposure to traffic-related air pollution in children. Am J Respir Crit Care Med. 2008; 177 (12): 1331 - 1337. doi: 10.1164/rccm.200701-036OC
282. Hidaka T., Ogawa E., Kobayashi E.H. et al. The aryl hydrocarbon receptor AhR links atopic dermatitis and air pollution via induction of the neurotrophic factor artemin. Nat Immunol. 2017; 18 (1): 64 - 73. doi: 10.1038/ni.3614
283. Fedenko E., Elisyutina O., Shtyrbul O. et al. Microarray-based IgE serology improves management of severe atopic dermatitis in two children. Pediatr Allergy Immunol. 2016; 27 (6): 645 - 649. doi: 10.1111/pai.12572
284. Ricci G., Bendandi B., Aiazzi R. et al. Three years of Italian experience of an educational program for parents of young children affected by atopic dermatitis: improving knowledge produces lower anxiety levels in parents of children with atopic dermatitis. Pediatr Dermatol. 2009; 26 (1): 1 - 5. doi: 10.1111/j.1525-1470.2008.00813.x
285. Staab D., Diepgen T.L., Fartasch M. et al. Age related, structured educational programmes for the management of atopic dermatitis in children and adolescents: multicentre, randomised controlled trial. BMJ. 2006; 332 (7547): 933 - 938. doi: 10.1136/bmj.332.7547.933
286. Lambert J., Bostoen J., Geusens B. et al. A novel multidisciplinary educational programme for patients with chronic skin diseases: Ghent pilot project and first results. Arch Dermatol Res. 2011; 303 (1): 57 - 63. doi: 10.1007/s00403-010-1082-z
287. Kupfer J., Gieler U., Diepgen T.L. et al. Structured education program improves the coping with atopic dermatitis in children and their parents-a multicenter, randomized controlled trial. J Psychosom Res. 2010; 68 (4): 353 - 358. doi: 10.1016/j.jpsychores.2009.04.014
288. Staab D., von Rueden U., Kehrt R. et al. Evaluation of a parental training program for the management of childhood atopic dermatitis. Pediatr Allergy Immunol. 2002; 13 (2): 84 - 90. doi: 10.1034/j.1399-3038.2002.01005.x
289. Kiriyama T., Sugiura H., Uehara M. Residual washing detergent in cotton clothes: a factor of winter deterioration of dry skin in atopic dermatitis. J Dermatol. 2003; 30 (10): 708 - 712. doi: 10.1111/j.1346-8138.2003.tb00463.x
290. Schmid-Wendtner M.H., Korting H.C. The pH of the skin surface and its impact on the barrier function. Skin Pharmacol Physiol. 2006; 19 (6): 296 - 302. doi: 10.1159/000094670
291. Simpson E., Trookman N.S., Rizer R.L. et al. Safety and tolerability of a body wash and moisturizer when applied to infants and toddlers with a history of atopic dermatitis: results from an open-label study. Pediatr Dermatol. 2012; 29 (5): 590 - 597. doi: 10.1111/j.1525-1470.2012.01809.x
292. Hon K.L., Leung T.F., Wong Y. et al. A survey of bathing and showering practices in children with atopic eczema. Clin Exp Dermatol. 2005; 30 (4): 351 - 354. doi: 10.1111/j.1365-2230.2005.01748.x
293. Wollenberg A., Vogel S., Renner E.D. [Vaccinations with atopic dermatitis and other chronic inflammatory skin diseases]. Hautarzt 2010; 61 (11): 985 - 993. doi: 10.1007/s00105-010-2019-3
294. Bath-Hextall F., Delamere F., Williams H. Dietary exclusions for improving established atopic eczema in adults and children systematic review. Allergy. 2009; 64 (2): 258 - 264. doi: 10.1111/j.1398-9995.2008.01917.x
295. Электронный ресурс https://base.garant.ru/70647158/53f89421bbdaf741eb2d1ecc4ddb4c33/
296. Делягин В.М., Уразбагамбетов А. Применение Супрастинекса (левоцетиризина) при атопии у детей и подростков. Русский медицинский журнал. Педиатрия 2012; (16): 828 - 830.
297. Елисютина О.Г., Феденко Е.С., Федоскова Т.Г., Лусс Л.В. Эффективность терапии левоцетиризином больных с аллергодерматозами. Росс. Аллергол. Журнал, 2012, 5: 69 - 75
298. Simons FE; Early Prevention of Asthma in Atopic Children (EPAAC) Study Group. Safety of levocetirizine treatment in young atopic children: An 18-month study. Pediatr Allergy Immunol. 2007 Sep; 18 (6): 535 - 42. doi: 10.1111/j.1399-3038.2007.00558.x. Epub 2007 Jun 11. PMID: 17561929].
299. Тамразова О.Б. Патогенетическая терапия детей, страдающих тяжелыми формами атопического дерматита. Русский медицинский журнал. Педиатрия. 2013; (2): 108 - 114. 83
300. Нажмутдинова Д.К., Швец О.И. Левоцетиризин: перезагрузка. Русский медицинский журнал. Дерматология. 2011; 21: 1324 - 1326.
301. Камаев А.В., Трусова О.В., Камаева И.А. Зуд при атопическом дерматите у детей: известные механизмы и возможности его долгосрочного контроля. Русский медицинский журнал. 2015; 3: 142 - 146.
302. Fitzsimons R, van der Poel LA, Thornhill W, du Toit G, Shah N, Brough HA. Antihistamine use in children. Arch Dis Child Educ Pract Ed. 2015; 100 (3): 122 - 131
303. Motola D, Donati M, Biagi C, et al. Safety profile of H1-antihistamines in pediatrics: an analysis based on data from VigiBase. Pharmacoepidemiol Drug Saf. 2017; 26 (10): 1164 - 1171. doi: 10.1002/pds.4246.
304. Wang V, Boguniewicz J, Boguniewicz M, Ong PY. The infectious complications of atopic dermatitis. Ann Allergy Asthma Immunol. 2021 Jan; 126 (1): 3 - 12. doi: 10.1016/j.anai.2020.08.002. Epub 2020 Aug 7. PMID: 32771354; PMCID: PMC7411503.
305. Brough H.A. et al. Epicutaneous sensitization in the development of food allergy: What is the evidence and how can this be prevented?//Allergy. 2020. Vol. 75, N 9. P. 2185 - 2205.
306. Gandhi N.A., Pirozzi G., Graham N.M.H. Commonality of the IL-4/IL-13 pathway in atopic diseases//Expert Rev. Clin. Immunol. 2017. Vol. 13, N 5. P. 425 - 437.
307. https://mednet.ru/mediczinskaya-statistika
308. Wollenberg A. et al. European guideline (EuroGuiDerm) on atopic eczema: part I - systemic therapy//J. Eur. Acad. Dermatol. Venereol. JEADV. 2022. Vol. 36, N 9. P. 1409 - 1431.
309. Reich K. et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial//The Lancet. 2021. Vol. 397, N 10290. P. 2169 - 2181.
310. Hou M. et al. Topical apigenin improves epidermal permeability barrier homoeostasis in normal murine skin by pergent mechanisms//Exp. Dermatol. 2013. Vol. 22, N 3. P. 210 - 215.
311. Otsuka A. et al. Possible new therapeutic strategy to regulate atopic dermatitis through upregulating filaggrin expression//J. Allergy Clin. Immunol. 2014. Vol. 133, N 1. P. 139 - 146. e10.
312. Аллергология и иммунология/под ред. Л.С. Намазовой-Барановой, А.А. Баранова, Р.М. Хаитова и др. Москва: Педиатръ 2020. Вып. 4-е изд., испр. и доп. 521 с.
313. Кудрявцева А.В. и др. Лечение системными глюкокортикостероидами детей с тяжелым течением атопического дерматита.//Российский форум "Педиатрия Санкт-Петербурга: Опыт, Инновации, Достижения". 2010. С. 126, Намазова Л.С., Вознесенская Н.И., Мазитова Л.П. Атопический дерматит у детей - проблемы и решения.//Русский медицинский журнал. 2006. N 19. С. 1374/
314. Ларькова И.А. Эффективная терапия атопического дерматита у детей, осложненного вторичной инфекцией. Медицинский совет. 2016; 1: 162 - 167.
315. Матушевская Е.В., Свирщевская Е.В. Атопический дерматит в практике врача-дерматовенеролога: рациональный выбор терапии. Русский медицинский журнал. 2013; 21 (8): 410 - 412.
316. Gong J.Q., Lin L., Lin T. et al. Skin colonization by Staphylococcus aureus in patients with eczema and atopic dermatitis and relevant combined topical therapy: a double-blind multicentre randomized controlled trial. Br J Dermatol. 2006; 155 (4): 680 - 687. doi: 10.1111/j.1365-2133.2006.07410.x
317. Lever R, Hadley K, Downey D, Mackie R. Staphylococcal colonization in atopic dermatitis and the effect of topical mupirocin therapy. Br J Dermatol. 1988; 119 (2): 189 - 198. doi: 10.1111/j.1365-2133.1988.tb03201.x].
318.  K. et al. Prevalence and Medications of Atopic Dermatitis in Germany: Claims Data Analysis//Clin. Epidemiol. 2021. Vol. 13. P. 593 - 602.
K. et al. Prevalence and Medications of Atopic Dermatitis in Germany: Claims Data Analysis//Clin. Epidemiol. 2021. Vol. 13. P. 593 - 602.
319. Wollenberg A. et al. ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children//J. Eur. Acad. Dermatol. Venereol. 2020. Vol. 34, N 12. P. 2717 - 2744, Wollenberg A. et al. European guideline (EuroGuiDerm) on atopic eczema: part I - systemic therapy//J. Eur. Acad. Dermatol. Venereol. JEADV. 2022. Vol. 36, N 9. P. 1409 - 1431.
320. Maarouf M, Hendricks AJ, Shi VY. Bathing Additives for Atopic Dermatitis - A Systematic Review. Dermatitis. 2019 May/Jun; 30 (3): 191 - 197
321. Ю.Г. Левина, Л.С. Намазова-Баранова, А.А. Алексеева, Е.А. Вишнева, К.Е. Эфендиева, А.Ю. Томилова. Клинико-фармакологические особенности применения цетиризина в терапии аллергических болезней у детей. https://cyberleninka.ru/article/n/kliniko-farmakologicheskie-osobennosti-primeneniya-tsetirizina-v-terapii-allergicheskih-bolezney-u-detey/viewer
322. Н.В. Юхтина. Современные представления об атопическом дерматите у детей. https://cyberleninka.ru/article/n/sovremennye-predstavleniya-ob-atopicheskom-dermatite-u-detey/viewer
323. С.А. Вострикова, Н.И. Пенкина, М.А. Иванова. Качество диспансерного наблюдения детей с атопическим дерматитом с периода манифестации заболевания до возраста 13 - 17 лет. Практическая медицина, N 7, 2022 https://cyberleninka.ru/article/n/kachestvo-dispansernogo-nablyudeniya-detey-s-atopicheskim-dermatitom-s-perioda-manifestatsii-zabolevaniya-do-vozrasta-13-17-let/viewer
324. М.М. Тлиш, Т.Г. Кузнецова. Медико-социальные проблемы ведения пациентов с хроническими дерматозами. Лечащий врач N 1/2019; Номера страниц в выпуске: 77 - 81, https://www.lvrach.ru/2019/01/15437199
325. Лечение бактериальных поражений кожи у детей "Журнал практика педиатра", май - июнь 2010, с. 40 - 43, Корсунская, О.Б. Тамразова, И.Л. Соркина, З.А. Невозинская, ЦТП ФХФ РАН, ГКБ N 14 https://medi.ru/info/11566/
326. Корсунская И.М. и др. Опыт применения цетиризина в терапии аллергодерматозов у детей//Вопросы современной педиатрии. - 2007. - Т. 6. - N 2. - С. 136 - 138.
327. Мазитова Л.П. Современные подходы к лечению аллергических заболеваний кожи у детей//Вопросы современной педиатрии. - 2005. - Т. 4. - N 2. - С. 122 - 124.
328. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей/под общ. ред. А.А. Кубановой, В.И. Кисиной; М.: Литтера, 2005; 882.
329. Пенкина Н.И. Анализ эффективности антиоксидантной терапии при обострении атопического дерматита у детей//Проблемы экспертизы в медицине. - 2005. - Т. 5. - N 18 - 2. - С. 36 - 37.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Кубанов Алексей Алексеевич - академик РАН, доктор медицинских наук, профессор, директор ФГБУ "ГНЦДК" Минздрава России, президент ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
2. Намазова-Баранова Лейла Сеймуровна - академик РАН, доктор медицинских наук, профессор, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН Минобрнауки России, президент Союза педиатров России, г. Москва. Конфликт интересов отсутствует.
3. Волнухин Владимир Анатольевич - доктор медицинских наук, профессор, главный научный сотрудник отдела дерматовенерологии и косметологии отдела оказания специализированной медицинской помощи ГБУ "МНПЦДК ДЗМ", член "Национального альянса дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
4. Дворников Антон Сергеевич - доктор медицинских наук, профессор, заведующий кафедрой дерматовенерологии и косметологии ФГБОУ ДО "РМАНПО" Минздрава России, член ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
5. Ильина Наталия Ивановна - доктор медицинских наук, профессор, заместитель директора по клинической работе, главный врач ФГБУ "ГНЦ Институт иммунологии" ФМБА России, вице-президент Российской ассоциации аллергологов и клинических иммунологов, г. Москва. Конфликт интересов отсутствует.
6. Заславский Денис Владимирович - доктор медицинских наук, профессор, профессор кафедры дерматовенерологии ФГБОУ ВО "Санкт-Петербургский государственный педиатрический университет" Минздрава России (ФГБОУ ВО "СПБГПМУ" Минздрава России, ООО "Российское общество дерматовенерологов и косметологов", г. Санкт-Петербург. Конфликт интересов отсутствует.
7. Карамова Арфеня Эдуардовна - кандидат медицинских наук, доцент, заведующий отделом дерматологии ФГБУ "ГНЦДК" Минздрава России, член ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
8. Мартынов Андрей Александрович - доктор медицинских наук, профессор, заведующий кафедрой дерматовенерологии и ксометологии ФГАОУ ВО "РАМНПО" Минздрава России, ведущий научный сотрудник отдела дерматологии ФГБУ "ГНЦДК" Минздрава России", член ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
9. Олисова Ольга Юрьевна - член-корреспондент РАН, доктор медицинских наук, профессор, заведующий кафедрой кожных и венерических болезней им. В.А. Рахманова ФГАОУ ВО "Первый МГМУ имени И.М. Сеченова" Минздрава России, член ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
10. Потекаев Николай Николаевич - доктор медицинских наук, профессор, директор ГБУЗ "Московский научно-практический центр дерматовенерологии и косметологии" ДЗМ (ГБУ "МНПЦДК ДЗМ") президент "Национального альянса дерматовенерологов и косметологов", г. Москва.
11. Селимзянова Лилия Робертовна - кандидат медицинских наук, доцент кафедры педиатрии и детской ревматологии ФГАОУ ВО "Первый МГМУ имени И.М. Сеченова" Минздрава России, член ООО "Союза педиатров России", г. Москва. Конфликт интересов отсутствует.
12. Хаитов Муса Рахимович - член-корреспондент РАН, доктор медицинских наук, профессор, директор ФГБУ "ГНЦ Институт иммунологии" ФМБА России, президент Российской ассоциации аллергологов и клинических иммунологов, г. Москва. Конфликт интересов отсутствует.
13. Чикин Вадим Викторович - доктор медицинских наук, старший научный сотрудник отдела дерматологии ФГБУ "ГНЦДК" Минздрава России, член ООО "Российское общество дерматовенерологов и косметологов", г. Москва. Конфликт интересов отсутствует.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-специалисты: врачи-дерматовенерологи, врачи-аллергологи-иммунологи, врачи-педиатры, врачи общей практики (семейные врачи), врачи-терапевты.
2. Ординаторы и слушатели циклов повышения квалификации по указанным специальностям.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ
И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Порядок оказания медицинской помощи по профилю "дерматовенерология", утвержденный Приказом Министерства здравоохранения Российской Федерации N 924н от 15 ноября 2012 г.
2. Порядок оказания медицинской помощи населению по профилю "аллергология и иммунология", утвержденный Приказом Министерства здравоохранения Российской Федерации N 606н от 7 ноября 2012 г.
Классификация глюкокортикоидов, применяемых в дерматологии
Международное название глюкокортикоидов, применяемых в дерматологии
Концентрация
Кортикостероиды с низкой активностью (группа I)
Гидрокортизон**
0,5%, 1%
Гидрокортизон
0,1%, 0,5%, 1%
Кортикостероиды с умеренной активностью (группа II)
Алклометазон
0,05%
Преднизолон**
0,5%
Флуоцинолона ацетонид
0,025%
Триамцинолон
0,025%
Кортикостероиды с высокой активностью (группа III)
Бетаметазон**
0,05%, 0,1%
Метилпреднизолона ацепонат
0,1%
Мометазон**
0,1%
Триамцинолон
0,1%
Флутиказон
0,005%, 0,05%
Кортикостероиды с очень высокой активностью (группа IV)
Клобетазол
0,05%
Базовый скрининг перед началом терапии циклоспорином**
Перед началом терапии циклоспорином** необходимо провести базовый скрининг, а также на фоне лечения необходимо мониторировать ряд параметров с целью своевременного выявления возможного развития нежелательных явлений терапии [45].
При лечении циклоспорином** требуется регулярный контроль артериального давления. При повышении давления должна быть применена соответствующая антигипертензивная терапия.
Перед началом лечения циклоспорином** следует получить результаты следующих исследований:
- Общий (клинический) анализ крови развернутый для контроля возможного развития нарушений со стороны крови и лимфатической системы (лейкопения, анемия, тромбоцитопения);
- Анализ крови биохимический общетерапевтический для контроля функции почек, состояния печени, обмена веществ (исследование уровня мочевины в крови, исследование уровня креатинина в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глутамилтрансферазы в крови, исследование уровня калия в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня мочевой кислоты в крови).
- Определение антигена (HbsAg) вируса гепатита B в крови;
- Определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C в крови;
- Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 в крови;
- Определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 в крови.
- Общий (клинический) анализ мочи для контроля функции почек.
Для контроля безопасности терапии через 4 месяца лечения циклоспорином** и далее каждые 3 месяца следует выполнять:
- Общий (клинический) анализ крови развернутый;
- Анализ крови биохимический общетерапевтический для контроля функции почек, состояния печени, обмена веществ (исследование уровня мочевины в крови, исследование уровня креатинина в крови, определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, определение активности гамма-глутамилтрансферазы в крови, исследование уровня калия в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня мочевой кислоты в крови).
- Общий (клинический) анализ мочи для контроля функции почек.
Базовый скрининг перед началом терапии аброцитинибом или барицитинибом** или упадацитинибом**
Перед началом терапии аброцитинибом или барицитинибом** или упадацитинибом** пациентам с атопическим дерматитом следует провести базовый скрининг и в дальнейшем проводить мониторирование ряда показателей с целью своевременного выявления возможного развития нежелательных явлений терапии [45, 261].
Необходимо осторожное применение аброцитиниба, упадацитиниба** и барицитиниба** у пациентов в возрасте 65 лет и старше, длительно куривших в настоящее время или в прошлом пациентов, пациентов с атеросклеротическими сердечно-сосудистыми заболеваниями или другими факторами риска сердечно-сосудистых заболеваний, у пациентов с факторами риска злокачественных новообразований, а также у пациентов с известными факторами риска венозной тромбоэмболии, кроме перечисленных выше [261, 262]. Необходимо наблюдение за пациентами на предмет развития признаков или симптомов инфекции и регулярное обследование кожи пациентов с повышенным риском развития рака кожи [261 - 263].
Перед началом терапии аброцитинибом, барицитинибом** или упадацитинибом** следует получить результаты следующих исследований:
- Общий (клинический) анализ крови развернутый для контроля возможного развития нарушений со стороны крови и лимфатической системы (нейтропения, лимфопения, тромбоцитопения). Не следует начинать терапию аброцитинибом, упадацитинибом** или барицитинибом** у пациентов с абсолютным количеством лимфоцитов менее 500 клеток/мм3 и/или абсолютным количеством нейтрофилов менее 1000 клеток/мм3 [263]. Не следует также начинать терапию упадацитинибом** или барицитинибом** при уровне общего гемоглобина в крови ниже 8 г/дл.
- Анализ крови биохимический общетерапевтический для оценки состояния печени и обмена липидов (определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня фосфолипидов в крови, исследование уровня холестерина липопротеинов высокой плотности в крови).
- Общий (клинический) анализ мочи для контроля функции почек.
- Определение антигена (HbsAg) вируса гепатита B в крови;
- Определение суммарных антител классов M и G (anti-HCV IgG и anti-HCV IgM) к вирусу гепатита C в крови;
- Консультация врача-инфекциониста при выявлении у пациента гепатита B или C для уточнения возможности проведения терапии препаратами аброцитиниб, барицитиниб** или упадацитиниб**;
- Консультация врача-фтизиатра.
В процессе терапии аброцитинибом или барицитинибом** или упадацитинибом** через 4 недели от начала терапии и далее каждые 3 месяца следует выполнить следующие исследования для контроля возможного развития нежелательных явлений терапии:
- Общий (клинический) анализ крови развернутый. Следует прекратить терапию аброцитинибом, упадацитинибом** или барицитинибом**, если число нейтрофилов менее 1 x 109 клеток/л и/или число лимфоцитов менее 0,5 x 109 клеток/л. Следует прекратить терапию упадацитинибом** или барицитинибом** при снижении уровня общего гемоглобина в крови ниже 8 г/дл. Лечение можно возобновить, когда число нейтрофилов и/или лимфоцитов и/или уровень общего гемоглобина в крови будут выше этих значений.
- Анализ крови биохимический общетерапевтический для оценки состояния печени и обмена липидов (определение активности аспартатаминотрансферазы в крови, определение активности аланинаминотрансферазы в крови, исследование уровня триглицеридов в крови, исследование уровня холестерина в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня фосфолипидов в крови, исследование уровня холестерина липопротеинов высокой плотности в крови). При подозрении на лекарственное поражение печени по результатам определения активности аспартатаминотрансферазы в крови, определения активности аланинаминотрансферазы в крови в крови лечение барицитинибом** или упадацитинибом** следует прекратить.
В процессе терапии аброцитинибом или барицитинибом** или упадацитинибом** необходимо тщательное наблюдение за пациентами с целью выявления признаков и симптомов туберкулеза, включая пациентов с отрицательным результатом теста на наличие латентной формы туберкулеза до начала терапии.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
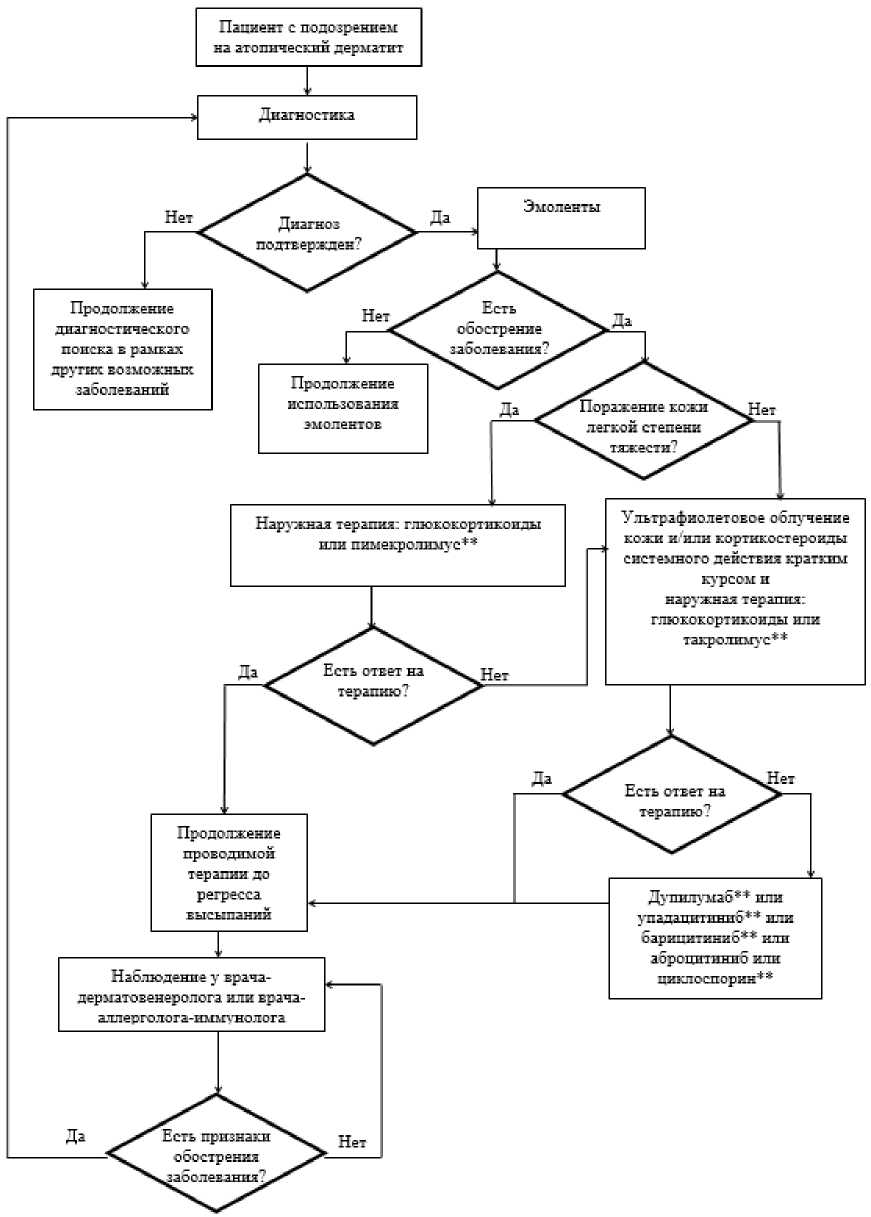
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
1. Учитывая, что атопический дерматит является хроническим заболеванием, для предотвращения рецидивов необходимо проведение регулярной базисной терапии увлажняющими и смягчающими наружными средствами.
2. Во избежание развития побочных эффектов следует избегать самостоятельного бесконтрольного применения кортикостероидов для дерматологического применения.
3. Учитывая, что атопический дерматит является хроническим заболеванием, для предотвращения рецидивов необходим регулярный уход за кожей:
4. Ежедневные водные процедуры с использованием средств лечебной косметики, не содержащих мыла - гели и масла для душа;
5. Ежедневное применение эмолентов после принятия водных процедур на влажную кожу минимум 2 раза в сутки;
6. Регулярно стричь ногти;
7. Соблюдать рекомендации врача по использованию лечебных средств для наружной терапии;
8. Регулярно стирать одежду, полотенца, постельное белье водой с моющим средством перед повторным использованием;
9. При установленной сенсибилизации к клещам домашней пыли, при стирке использовать акарицидные средства;
10. Не держать в комнате ковры;
11. Книги хранить в закрытых шкафах;
12. Мягкие игрушки следует регулярно стирать;
13. Обрабатывать поверхности, покрытые плесенью, специальными средствами;
14. Мыть фильтры кондиционера не реже 1 раза в 2 недели;
15. Не следует разводить домашние цветы;
16. Регулярно пылесосить и проводить ежедневную влажную уборку помещения;
17. При установленной сенсибилизации к аллергенам пушных животных прекратить контакт с ними;
18. Не использовать перьевые и пуховые подушки и одеяла. Подушки должны быть из синтетических волокон, которые легко стирать;
19. Во избежание развития побочных эффектов следует избегать самостоятельного бесконтрольного применения средств для наружной терапии (кортикостероиды, топических ингибиторов кальциневрина, антибактериальных, противогрибковых и противовирусных препаратов).
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ОБЩАЯ ОЦЕНКА ЗАБОЛЕВАНИЯ ИССЛЕДОВАТЕЛЕМ IGA
Оригинальное название: Investigator's global assessment (IGA).
Источник (официальный сайт разработчиков, публикация с валидацией): https://www.eczemacouncil.org/research/investigator-global-assessment-scale/
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): -
Назначение: оценка общей степени тяжести атопического дерматита
Содержание (шаблон):
Баллы
Категория
Описание <*>
0
Чистая кожа
Проявления атопического дерматита полностью исчезли, за исключением остаточных очагов депигментации (поствоспалительная гиперпигментация и/или гипопигментация).
1
Практически чистая кожа
Проявления атопического дерматита в целом не полностью исчезли, а оставшиеся очаги представляют собой светло-розовые (за исключением поствоспалительной гиперпигментации) и/или едва заметные при пальпации твердые участки утолщения кожи и/или папулы и/или едва заметные при пальпации участки лихенизации, экскориации; экссудация/образование струпьев отсутствует.
2
Легкая степень
Проявления атопического дерматита в целом представляют собой очаги светло-красного цвета; с незначительными, но четко выраженными твердыми участками утолщения кожи и/или папулами с незначительными, но четко выраженными линейными или прерывистыми следами расчесывания или проникающего поверхностного поражения; с незначительным, но четко выраженным утолщением кожи, мелкими отметинами на коже и мелкопластинчатым лихеноидным шелушением; экссудация/образование струпьев отсутствует.
3
Средняя степень
Проявления атопического дерматита в целом представляют собой очаги красного цвета; с легко определяемыми при пальпации умеренно выраженными твердыми участками утолщения кожи и/или папулами; с умеренными линейными или прерывистыми следами расчесывания или проникающего поверхностного поражения; с умеренным утолщением кожи, грубыми отметинами на коже и крупнопластинчатым лихеноидным шелушением; с незначительной экссудацией/образованием струпьев.
4
Тяжелая степень
Проявления атопического дерматита в целом представляют собой глубокие очаги темно-красного цвета; с выраженными твердыми участками утолщения кожи и/или папулами; с выраженными линейными или прерывистыми следами расчесывания или проникающего поверхностного поражения; с выраженным утолщением кожи с очень грубыми отметинами на коже и крупнопластинчатым лихеноидным шелушением; с экссудацией/образованием струпьев от средней до тяжелой степени.
<*> Из оценки/подсчета баллов IGA исключаются волосистая часть головы, ладони и подошвы.
Показатель IGA используется для оценки степени тяжести атопического дерматита. Оценивается тяжесть атопического дерматита на момент проведения оценки.
Ключ: Поражение кожи оценивается визуально и пальпаторно. IGA представляет собой оценку по 5-балльной шкале от 0 баллов до 4 баллов и отражает выраженность эритемы, утолщения (уплотнения) кожи и шелушения. Оценка 0 баллов соответствует чистой коже, максимальная оценка 4 балла соответствует атопическому дерматиту тяжелой степени тяжести.
Приложение Г2
ИНДЕКС SCORAD
Индекс SCORAD предназначен для оценки степени тяжести атопического дерматита.
Оригинальное название: Scoring of Atopic Dermatitis (SCORAD).
Источник (официальный сайт разработчиков, публикация с валидацией): Consensus report of the European Task Force on Atopic Dermatitis. Severity of scoring of atopic dermatitis: the SCORAD index. Dermatology. 1993; 186: 23 - 31.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить): -
Назначение: оценка степени тяжести атопического дерматита.
Содержание (шаблон):
A - площадь поражения
(оценивается врачом)
Площадь поверхности отдельных участков тела у детей старше 2 лет и взрослых
Площадь проявлений атопического дерматита на отдельных участках тела
Участки тела
Площадь поражения
Передняя поверхность головы (4,5%)
Задняя поверхность головы (4,5%)
Передняя поверхность туловища (18%)
Задняя поверхность туловища (18%)
Гениталии (1%)
Передняя поверхность левой руки (4,5%)
Задняя поверхность левой руки (4,5%)
Передняя поверхность правой руки (4,5%)
Задняя поверхность правой руки (4,5%)
Передняя поверхность левой ноги (9%)
Задняя поверхность левой ноги (9%)
Передняя поверхность правой ноги (9%)
Показатель A = ______________
Задняя поверхность левой ноги (9%)
Итого
Площадь поверхности отдельных участков тела у детей до 2 лет
B - интенсивность клинических проявлений
(оценивается врачом)
Оценка клинических проявлений атопического дерматита:
Клинические проявления
Оценка в баллах
Способ оценки:
Эритема
0 = отсутствие проявлений
Отек или папулезностъ
1 = легкие проявления
Мокнутие/корки
2 = умеренные проявления
Расчесы
3 = тяжелые проявления
Лихенификация
Сухость
Итого
Показатель B =
_____________
C выраженность субъективных симптомов
(оценивается пациентом)
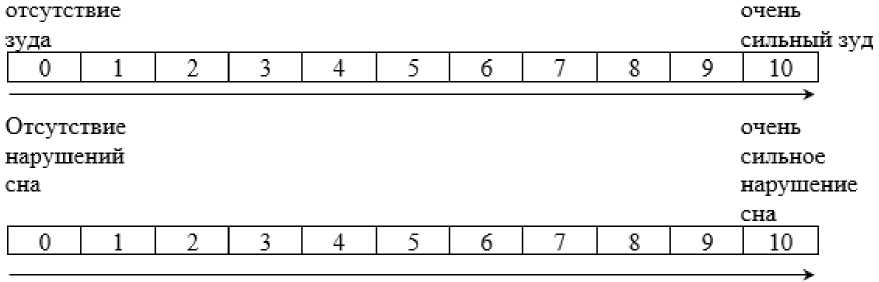
Показатель C = ___________
SCORAD = A / 5 + 7 * B / 2 + C = _______
Ключ (интерпретация
SCORAD предусматривает балльную оценку шести объективных симптомов: эритема, отек/папулезные элементы, корки/мокнутие, экскориации, лихенификация/шелушение, сухость кожи. Интенсивность каждого признака оценивается по 4-уровневой шкале: 0 - отсутствие, 1 - слабая, 2 - умеренная, 3 - сильная. При оценке площади поражения кожного покрова следует использовать правило "девятки", в котором за единицу измерения принята площадь поверхности ладони больного, эквивалентная одному проценту всей поверхности кожи. Цифрами указано значение площади для больных в возрасте старше 2 лет, а в скобках - для детей в возрасте до 2 лет (Рис. 1). Оценку субъективных симптомов (ощущение зуда, нарушение сна) проводят у детей в возрасте старше 7 лет и взрослых; у детей младшего возраста оценку субъективных симптомов проводят с помощью родителей, которым предварительно объясняют принцип оценки.
Расчет индекса SCORAD производится по формуле: SCORAD = A / 5 + 7B / 2 + C,
где: A - распространенность поражения кожи,
B - сумма уровней интенсивности клинических симптомов атопического дерматита,
C - сумма оценок субъективных нарушений по визуальной аналоговой шкале.
На линейке внизу рисунка указывается точка, соответствующая степени выраженности оцениваемого субъективного признака, усредненное за последние 3 суток.
Значения индекса могут варьировать в пределах от 0 (нет заболевания) до 103 (максимально тяжелое течение атопического дерматита).
Атопический дерматит легкой степени тяжести соответствует значению SCORAD < 25
Атопический дерматит средней степени тяжести соответствует значению SCORAD от 25 до 50.
Тяжелый атопический дерматит соответствует значению SCORAD > 50.
