"Клинические рекомендации "Нарушения обмена меди (болезнь Вильсона)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НАРУШЕНИЯ ОБМЕНА МЕДИ (БОЛЕЗНЬ ВИЛЬСОНА)
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E83.0
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 376
Разработчик клинической рекомендации
- Ассоциация медицинских генетиков
- Союз педиатров России
- Некоммерческое Партнерство "Национальное общество по изучению болезни Паркинсона и расстройств движений"
- Российское трансплантологическое общество
- Автономная некоммерческая организация "Общество детских гастроэнтерологов, гепатологов и нутрициологов"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АЛТ - аланинаминотрансфераза
АСТ - аспарагинаминотрансфераза
АТФаза - аденозинтрифосфатаза
БВ - болезнь Вильсона
ГГТ - гамма-глутамилтрансфераза
МНО - международное нормализованное отношение
ОТП - ортотопическая трансплантация печени
ПИ - протромбиновый индекс
УЗИ - ультразвуковое исследование
ЩФ - щелочная фосфатаза
МРТ - магнитно-резонансная томография
ЭЭГ - электроэнцефалография
ЦНС - центральная нервная система
Термины и определения
Хелатирующая терапия (медьхелатирующая терапия) - способ лечения, заключающийся во введении препаратов, связывающих и выводящих из организма ионы тяжелых металлов (например, меди).
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Болезнь Вильсона (БВ) (синонимы: болезнь Вильсона-Коновалова, гепатолентикулярная дегенерация, гепатоцеребральная дистрофия) - редкое тяжелое наследственное мультисистемное заболевание, проявляющееся преимущественно печеночными, неврологическими и психиатрическими нарушениями вследствие чрезмерного отложения меди в органах и тканях [1]. Это заболевание относится к числу трудно диагностируемых в связи с длительным латентным течением и полиморфизмом клинической симптоматики. БВ может клинически манифестировать как в детском и подростковом, так и в более старшем возрасте. При отсутствии медь-элиминирующей терапии это заболевание является фатальным.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
БВ развивается при наличии у человека патогенных вариантов в компаунд-гетерозиготном (чаще) или гомозиготном (реже) состоянии в гене ATP7B, который располагается на длинном плече 13 хромосомы (13q14.3-q21.1) и состоит из 21 экзона и 20 интронов (общая геномная длина гена составляет около 80 тысяч пар оснований).
Ген ATP7B кодирует одноименный медь-транспортирующий белок из группы АТФаз P-типа, который располагается в транс-Гольджи аппарате. Дисфункции белка ATP7B вследствие мутации в гене ATP7B сопровождаются нарушением выведения меди с желчью и накоплением ее сначала в печени, а затем в других тканях, особенно в центральной нервной системе, почках или роговице. Следствием дисфункции белка-переносчика ATP7B также является нарушение переноса меди из аро- в холоцерулоплазмин (основной циркулирующий переносчик меди в организме человека), что приводит к нестабильности белка и снижению доступности меди для клеточных метаболических процессов [153, 154].
Наиболее высокая экспрессия гена ATP7B наблюдается в печени, однако он также экспрессируется в почках, плаценте, молочных железах, головном мозге и легких.
Тип наследования БВ аутосомно-рецессивный. К настоящему времени в гене ATP7B описано более 700 патогенных вариантов [88], большая часть из которых являются миссенс, однако нонсенс, инсерции/делеции и мутации сайтов сплайсинга также встречаются [13, 14]. Наиболее распространенным патогенным вариантом в гене ATP7B среди европеоидной расы является H1069Q. Около 50 - 80% пациентов с БВ, проживающих в странах Центральной, Восточной и Северной Европы являются носителями, по крайней мере, одного аллеля с таким вариантом. По данным ряда исследователей, в России среди пациентов с подтвержденным диагнозом БВ доля больных с вариантом H1069Q в гетерозиготном состоянии составляет 50%, а доля пациентов с этим вариантом в гомозиготном состоянии - 26,3% [17]. В настоящее время четких корреляций между патогенными вариантами и фенотипами БВ неизвестно.
Медь является важным микроэлементом и кофактором нескольких ферментов, по своему общему содержанию в теле человека занимает третье место среди переходных металлов, незаменимых для организма. Она регулирует клеточные процессы, а также является регулятором клеточных сигнальных путей, участвует во многих физиологических процессах, включая энергетический обмен, антиоксидантную защиту и обмен железа. Медьсодержащие металлотионины включают супероксиддисмутазу Cu/Zn, цитохромоксидазу, бета-гидроксилазу допамин и лизилоксидазу, последняя играет важную роль в сшивании коллагена во внеклеточном матриксе и соединительной ткани [155, 156].
Физиологическая потребность в меди для взрослых составляет от 0,9 до 1,7 мг/сутки, для детей в зависимости от возрастной группы - от 0,5 до 1,0 мг/сут [18, 155]. Верхний допустимый уровень потребления составляет 5 мг/сут. В организм медь поступает в основном с пищей. Поступающее в организм количество меди превышает количество, необходимое организму, она обычно выводится с желчью для поддержания гомеостаза меди. Всасыванию в проксимальных отделах тонкой кишки подвергается от 20% (при потреблении более 5 мг/сут) до 50% (при потреблении менее 1 мг/сут) меди, остальное экскретируется с фекальными массами. В крови всосавшаяся медь связывается с альбумином и транскупреином и транспортируется через портальную вену в печень [155].
Наиболее богаты медью печень, моллюски, крабы, креветки, устрицы, лобстеры, соевые бобы, шоколад, орехи, злаки.
Снижение функции медь-транспортирующей АТФазы в результате патогенных вариантов в гене ATP7B в компаунд-гетерозиготном или гомозиготном состоянии приводит к нарушению гепатобилиарной экскреции меди и нарушению ее встраивания в церулоплазмин. Поскольку период полужизни апоцерулоплазмина значительно короче такового у церулоплазмина, нагруженного медью (5 ч против 5,5 сут), при БВ, как правило, в крови наблюдается снижение содержания церулоплазмина. Вместе с тем примерно у трети пациентов с БВ уровень церулоплазмина в крови может быть в пределах нормальных значений. Необходимо отметить, что использование метода определения медь-зависимой оксидазной активности позволяет точнее определить содержания апоцерулоплазмина, в то время как иммунологические тесты могут завышать получаемые значения, т.к. не способны дифференцировать апо- и голоцерулоплазмин.
Основным следствием дефицита медь-транспортирующей АТФазы является накопление меди в различных органах и тканях: первоначально - в печени, а по мере прогрессирования заболевания и при отсутствии лечения, когда способность печени аккумулировать медь исчерпывается, - в головном мозге, роговице глаз и почках. Это обусловливает полиморфизм клинических появлений БВ. Накопление меди в паренхиматозных органах сопровождается снижением содержания общей меди в сыворотке, т.к. в норме около 90% общей меди составляет медь, связанная с церулоплазмином.
Несмотря на важнейшую роль меди во многих физиологических процессах, ее избыток является губительным для организма. Патогенные эффекты избытка меди в клетке опосредованы образованием свободных радикалов с развитием перекисного окисления липидов, повреждением белков, нуклеиновых кислот, митохондрий в сочетании с истощением антиоксидантных систем. Медь может также ингибировать функции многих белков, напрямую связываясь с их тиоловыми и аминогруппами. Кроме того, избыток меди активирует проапоптотические механизмы. Все это в конечном счете приводит к разрушению перегруженных медью клеток, преимущественно гепатоцитов. Лизис таких гепатоцитов обусловливает повышение содержания свободной меди в сыворотке и, следовательно, компенсаторному повышению ее суточной экскреции с мочой и накоплению в других органах-мишенях [19]. Помимо этого, избыток свободной меди в сыворотке может приводить к гемолитическим кризам [4].
Внутриклеточная перегрузка медью индуцирует выработку активных форм кислорода, что приводит к окислительному стрессу, который сопровождается изменениям проницаемости митохондриальных мембран, повреждению ДНК и увеличению экспрессии проапоптотических белков, а затем индуцирует апоптоз [157, 158].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Болезнь Вильсона является редким (орфанным) заболеванием, хотя показатели распространенности варьируют в зависимости от исследования. По данным ряда исследований, ее распространенность составляет около 1 случая на 7 000 - 10 000 населения, в то время как частота гетерозиготного носительства патогенных вариантов в ATP7B составляет около 1:40 [20, 21].
Наиболее часто указывается распространенность 1:30,000 [21, 22, 23, 24, 140]. Более поздние исследования из Китая [141] и Франции [142] свидетельствуют о более низкой распространенности 1:56,000 и 1:66,000, соответственно.
По данным анализа федерального регистра орфанных заболеваний, в России в 2014 и 2015 гг. было зарегистрировано всего 572 и 602 пациента с диагнозом БВ, что составило 0,39 и 0,41 на 100 000 населения соответственно (из них детей 16,9%) [25]. Реальная распространенность заболевания предполагается более высокой.
Хотя в гене ATP7B было обнаружено, что более 700 мутаций вызывают БВ, миссенс-мутация H1069Q является наиболее распространенной (50 - 80%) среди населения Европы и Америки, в то время как мутация R778L более распространена (14 - 49%) в странах Дальневосточной Азии.
Данных о клинической распространенности БВ нет, но глобальная генетическая распространенность оценивается примерно в 1:7026. Согласно прогнозам, гетерозиготность в Великобритании составит 2,5% от общей численности населения. По опубликованным данным базы данных Euro Wilson, с 2005 по 2009 год было зарегистрировано 415 новых случаев, причем примерно половина из них были моложе 18 лет [20].
Значительное несоответствие между количеством клинически выявленных БВ и предполагаемой генетической распространенностью может быть связано с генетической фенотипической гетерогенностью и/или низкой частотой диагностики, особенно в педиатрической возрастной группе, когда у детей наблюдаются едва заметные нейропсихиатрические признаки и симптомы, но БВ не учитывается при дифференциальной диагностике. В этом обзоре будут рассмотрены новые достижения в диагностике и лечении БВ и основное внимание будет уделено нейропсихиатрическим признакам и симптомам у детей с БВ.
В России среди пациентов с подтвержденным диагнозом БВ доля больных с вариантом H1069Q в гетерозиготном состоянии составляет 50%, а доля пациентов с этим вариантом в гомозиготном состоянии - 26,3% [17].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E83.0 - Нарушения обмена меди.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Клиническая картина БВ характеризуется большим полиморфизмом в отношении как неврологических, так и соматических проявлений. Это нашло свое отражение в различных классификациях заболевания [26, 27]. В настоящее время чаще всего используется классификация БВ, в основе которой лежит клинико-патоморфологический принцип [28]. Выделяют следующие формы БВ.
- Бессимптомная форма (около 10% случаев): клинических проявлений нет, диагноз установлен до проявления симптомов.
- Абдоминальная (печеночная) форма (около 40% случаев): раннее начало, преимущественно с острой печеночной недостаточности или признаков хронической печеночной недостаточности; фульминантная печеночная недостаточность, цирроз печени.
- Церебральная (неврологическая) форма (около 40 - 50% случаев): характерны разнообразные экстрапирамидные нарушения (тремор конечностей и головы, дистония, мозжечковая атаксия, паркинсонизм, нарушение почерка, дизартрия, мышечная ригидность, хорея, атетоз), психические нарушения (депрессия, раздражительность, расторможенность поведения, психотические эпизоды).
- Смешанная форма: сочетание неврологических и печеночных проявлений.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина БВ характеризуется многообразием симптомов и манифестирует в возрасте от 3 до 74 лет (средний возраст 13,2 года) [29, 30, 31]. Симптомы заболевания редко появляются в возрасте до 3 лет [2, 7]. Симптомы в возрасте до 3 лет являются необычными, поскольку для развития токсикоза медью в организме требуется время. У большинства детей наблюдается явное заболевание печени, хотя у них уже могут присутствовать скрытые неврологические проявления. У детей чаще всего наблюдаются печеночные проявления заболевания, хотя у некоторых (4 - 6%) они могут сопровождаться незначительными неврологическими симптомами. У пациентов старшего возраста (подростков и взрослых) часто наблюдаются нервно-психические проявления с поражением печени или без него. И диагноз БВ, даже при отсутствии заболеваний печени, не следует упускать из виду.
Развернутая клиническая картина БВ обусловлена избыточным накоплением меди в различных органах и тканях и преимущественно проявляется симптомами поражения печени, центральной нервной системы, глаз, реже почек, костей, сердца, желез внутренней секреции [31, 154, 155, 159, 160].
Неврологическая симптоматика БВ манифестирует позже, чем поражение печени, в большинстве случаев на втором - третьем десятилетии жизни, но может проявляться и в детском возрасте до 10 лет [32, 33]. Неврологические проявления БВ, преимущественно экстрапирамидные, могут развиваться незаметно или стремительно, и тяжесть симптомов часто колеблется, иногда в течение одного и того же дня. Несмотря на то, что неврологические нарушения чаще встречаются у взрослых, они были описаны и в раннем детском возрасте и могут также развиться у пациентов с БВ с заболеваниями печени, которые не придерживаются диеты [161].
Наиболее часто клиническая картина включает в себя дистонию (до 69%), атаксию (до 30%), постурально-кинетический и интенционный тремор (до 90%), паркинсонизм (до 62%), сопровождающиеся на более поздних стадиях слюнотечением, дизартрией и дисфагией; реже наблюдаются хорея (16%), атетоз (14%), эпилепсия (6%) и др. [3, 32, 89]. Другие распространенные неврологические проявления включают брадикинезию, гримасничание лица, дистонию, тремор, ригидность, преднамеренный тремор, недержание мочи, гиперрефлексию и когнитивные нарушения [160].
Дистония при БВ может затрагивать разные части тела. По мере прогрессирования болезни в случае отсутствия лечения фокальная или сегментарная форма дистонии может переходить в генерализованную [89]. Паркинсонизм при БВ характеризуется брадикинезией, ригидностью и постуральной неустойчивостью, при этом эти явления нередко имеют симметричный характер [90]. Тремор является одним из частых неврологических проявлений БВ. Тремор может быть постуральным, интенционным, отмечаться в покое или иметь все перечисленные условия возникновения (тремор Холмса) [32]. Мозжечковая атаксия наблюдается почти у 30% пациентов с БВ [91]. Дизартрия является наиболее частым неврологическим симптомом БВ. Основываясь на преобладающей характеристике нарушения речи, можно выделить несколько типов дизартрии при БВ, включая гипокинетическую, псевдобульбарную (спастическую), гиперкинетическую (дистоническую), атактическую и смешанную [34]. Дисфагия, определяемая как затруднение в любой фазе глотания, встречается примерно у 18% пациентов с ВД и у 50% пациентов с неврологическими симптомами [34, 90]. Может быть затронута любая фаза акта глотания, включая пероральный прием, приготовление/жевание, пероральный транзит и само глотание. Дисфагия может возникнуть из-за нарушения мышечного тонуса (например, при орофациальной дистонии), нарушения координации акта глотания, медлительности и слабости мышц. Слюнотечение относится к наиболее заметным и частым симптомам БВ и наблюдается примерно у 70% пациентов с неврологическими проявлениями заболевания. Очень часто это является следствием дисфагии и (или) неспособности удерживать слюну во рту из-за орофациальной дистонии [34].
У детей ранние неврологические признаки болезни выражаются в поведенческих нарушениях, отставании в учебе, проблемах при выполнении заданий, требующих сочетанной координации работы рук и глаз, ухудшении мелкой моторики, изменяется почерк.
Диагноз нейропсихиатрический проявлений при БВ ставится на основании клинической картины и результатов визуализации головного мозга. В отличие от взрослых с неврологическими расстройствами опорно-двигательного аппарата, признаки и симптомы двигательных расстройств у детей более мягкие, менее заметные и, следовательно, их труднее обнаружить. Кроме того, пациенты/родители могут не сообщать об этих симптомах, поскольку основное внимание уделяется заболеванию печени. Основными двигательными симптомами, описанными у детей, являются тремор, легкая атаксия и дизартрия со слюнотечением. Очень редко наблюдается быстро прогрессирующая дистония. Психические расстройства могут не быть расценены как симптомы БВ. Они часто встречаются у взрослых, у четверти из них симптомы проявляются сразу, и почти все симптомы развиваются в течение заболевания [162, 163].
При проведении МРТ у многих, хотя и не у всех, пациентов с БВ могут быть обнаружены аномалии головного мозга. Изменения могут наблюдаться до выявления неврологических или печеночных проявлений заболевания, а некоторые из них могут измениться после лечения хелаторами меди [2, 40, 41, 42].
Поражения с высокой интенсивностью сигнала в базальных ганглиях на Т1-изображениях обычно отражают поражение печени при БВ, то есть изменения, связанные с хроническим заболеванием печени. Поражения с высокой интенсивностью сигнала на Т2-изображениях отражают поражение головного мозга при БВ. которые обычно включают изменения в глубоком сером веществе (скорлупе, хвостатом ядре и таламусе) и белом веществе головного мозга и моста, а также атрофию (о которой у детей с БВ не сообщалось) [2, 16, 43, 44, 45, 46].
Магнитно-резонансная спектроскопия может выявить значительное накопление меди в веществе головного мозга и является неинвазивным методом исследования. Она выявляет нарушения метаболизма в мозге до того, как структурные изменения станут заметны на МРТ, и применение этого метода исследования хорошо описано у взрослых с БВ. Исследования в педиатрии подтвердили, что этот метод визуализации выявляет ранние неврологические изменения даже при обычной МРТ и может предоставить важную информацию для мониторинга прогрессирования заболевания [47].
Психиатрические проявления. Наряду с поведенческими нарушениями психиатрические проявления включают расторможенное поведение, депрессию, тревожность, психотические симптомы. У детей снижается успеваемость в школе, появляется лабильное настроение, неадекватное, агрессивное поведение. У большинства пациентов с неврологической и (или) психиатрической симптоматикой БВ развивается цирроз печени, длительно протекающий бессимптомно [4, 31, 34].
У взрослых психические расстройства могут проявляться на ранней стадии, а наиболее распространенные симптомы включают депрессию, резкие изменения личности, агрессивность и раздражительность. У подростков эти симптомы часто путают с нормальным подростковым поведением или злоупотреблением психоактивных веществ. У детей изменения могут быть очень незначительными и подпадать под диагностическое определение "трудностей в обучении". В педиатрической практике осведомленность о неврологических признаках и симптомах БВ невелика, поскольку обычно считается, что эти симптомы не проявляются до достижения зрелого возраста. Однако ряд клинических случаев свидетельствует о том, что > 5% детей с печеночной формой БВ уже имеют неврологические нарушения и что > 15% пациентов с БВ развивают неврологические симптомы или признаки в детском возрасте [33]. Поскольку большинство методов лечения основано на нивелировании прогрессирования печеночной недостаточности, менее известно, что нейропсихиатрические симптомы могут развиваться или прогрессировать, несмотря на отличную биохимическую реакцию на лечение. Кроме того, неврологическая форма БВ может протекать без явных признаков поражения печени, и поэтому общее число пациентов детского возраста с БВ может быть выше, чем предполагалось.
Симптомы поражения печени при БВ весьма вариабельны. У детей поражение печени развивается раньше, чем неврологическая симптоматика. Клинический дебют БВ может быть в виде фульминантного гепатита (чаще у детей и подростков), проявляющегося коагулопатией, энцефалопатией, Кумбс-негативной гемолитической анемией, печеночной и почечной недостаточностью [3, 4, 31]. Иногда клинические симптомы крайне напоминают картину острого вирусного гепатита. Этот вариант заболевания без проведения трансплантации печени приводит к практически 100%-й летальности, поэтому таких пациентов необходимо незамедлительно включать в лист ожидания трансплантации печени.
Клиническая картина хронического гепатита при БВ мало отличима от поражения печени другого генеза и без патогенетической терапии приводит к формированию цирроза, что диктует необходимость исключения БВ у всех пациентов как с острым, так и с хроническим поражением печеночной паренхимы с наличием или без признаков цирроза. Характерной чертой хронического гепатита при БВ является умеренное повышение биохимических маркеров цитолиза, холестаза и уровня билирубина с высоким уровнем структурных изменений печеночной паренхимы при морфологическом исследовании биоптатов печени. БВ может клинически протекать по типу аутоиммунного гепатита с повышением сывороточных иммуноглобулинов и неспецифических аутоантител, в связи с чем у пациентов с аутоиммунным гепатитом при неэффективности кортикостероидной терапии следует также исключать БВ [31].
Заболевание печени впервые выявляется у 60% пациентов с БВ во всех возрастных группах. Оно может протекать совершенно бессимптомно и быть обнаруженным случайно или сопровождаться признаками и симптомами любой формы заболевания печени. Прогрессирование может быть медленным или очень быстрым. Скрининг на БВ должен быть частью обследования любого ребенка с патологией печени.
Печеночные проявления при БВ весьма разнообразны и могут варьировать от бессимптомных биохимических изменений, осложнений хронических заболеваний и стеатоза до острого гепатита, острой печеночной недостаточности (ОПН), хронического гепатита и цирроза печени [3]. На ранней стадии у пациентов может не быть симптомов, но может быть случайно обнаружено повышенное содержание печеночных ферментов или аномальные результаты УЗИ печени. По мере прогрессирования заболевания у пациентов могут проявляться признаки и симптомы хронического заболевания печени (например, гепатоспленомегалия) или осложнения цирроза печени (например, асцит и кровотечение из варикозно расширенных вен). Диагноз БВ всегда должен учитываться при дифференциальной диагностике у любого ребенка или молодого взрослого с аномальными печеночными тестами или клиническими признаками неалкогольной жировой болезни печени или аутоиммунного заболевания печени [2, 16, 21, 22].
ОПН это тяжелая форма БВ, характеризующаяся желтухой, гепатитом, гепатомегалией и коагулопатией, с энцефалопатией или без нее, у ранее здоровых детей. Исследовательская группа по изучению острой печеночной недостаточности у детей (Pediatric Acute Liver Failure - PALF) предлагает определять ОПН, когда МНО ![]() 1,5 при наличии энцефалопатии или МНО
1,5 при наличии энцефалопатии или МНО ![]() 2,0 независимо от наличия энцефалопатии [23]. У некоторых детей в анамнезе могут быть заболевания, подобные гепатиту, которые сопровождались рецидивирующей желтухой, гемолитической анемией или повышенным уровнем трансаминаз [4]. Некоторые клиницисты рассматривают это проявление как переход острой печеночной недостаточности в хроническую, поскольку при гистологическом исследовании неизменно обнаруживаются признаки ранее существовавшего хронического поражения печени. Острая или хроническая печеночная недостаточность определяется у пациентов с острым гепатитом, который сопровождается желтухой (общий сывороточный билирубин > 5 мг/дл или 85 мкмоль/л) и коагулопатией (МНО > 1,5), а также асцитом и/или печеночной энцефалопатией в течение 4 недель [24]. Отличительными признаками ОПН при БВ (вильсоновская ОПН) от других причин печеночной недостаточности являются относительно небольшое повышение уровня печеночных ферментов (АСТ, АЛТ), соотношением АСТ/АЛТ, часто превышающим 2, нормальным или субнормальным уровнем щелочной фосфатазы (ЩФ), ассоциациируется с Кумбс отрицательной гемолитической анемией из-за высокого содержания свободной меди, что приводит к высокому уровню общего билирубина, с отношением ЩФ к общему билирубину, как правило, менее 4, коагулопатией, не поддающейся лечению витамином K, энцефалопатией и почечной недостаточностью [2, 4, 16, 20].
2,0 независимо от наличия энцефалопатии [23]. У некоторых детей в анамнезе могут быть заболевания, подобные гепатиту, которые сопровождались рецидивирующей желтухой, гемолитической анемией или повышенным уровнем трансаминаз [4]. Некоторые клиницисты рассматривают это проявление как переход острой печеночной недостаточности в хроническую, поскольку при гистологическом исследовании неизменно обнаруживаются признаки ранее существовавшего хронического поражения печени. Острая или хроническая печеночная недостаточность определяется у пациентов с острым гепатитом, который сопровождается желтухой (общий сывороточный билирубин > 5 мг/дл или 85 мкмоль/л) и коагулопатией (МНО > 1,5), а также асцитом и/или печеночной энцефалопатией в течение 4 недель [24]. Отличительными признаками ОПН при БВ (вильсоновская ОПН) от других причин печеночной недостаточности являются относительно небольшое повышение уровня печеночных ферментов (АСТ, АЛТ), соотношением АСТ/АЛТ, часто превышающим 2, нормальным или субнормальным уровнем щелочной фосфатазы (ЩФ), ассоциациируется с Кумбс отрицательной гемолитической анемией из-за высокого содержания свободной меди, что приводит к высокому уровню общего билирубина, с отношением ЩФ к общему билирубину, как правило, менее 4, коагулопатией, не поддающейся лечению витамином K, энцефалопатией и почечной недостаточностью [2, 4, 16, 20].
Общие признаки и симптомы могут включать боль в животе, анорексию, судороги, желтуху, гепатоспленомегалию, асцит, сосудистый рисунок по типу головы медузы, сосудистую сеть по типу паутины и кровотечение из верхнего отдела желудочно-кишечного тракта. Желтуха проявляется сильнее, чем при других хронических заболеваниях печени, и это может быть вторичным по отношению к сопутствующему внутрисосудистому гемолизу в дополнение к декомпенсации функции печени.
Поражение печени при БВ может имитировать неалкогольную жировую болезнь печени, аутоиммунный гепатит и/или острый инфекционный гепатит.
Гистологически часто обнаруживается цирроз печени. Иногда у пациентов с полностью бессимптомным течением могут быть биохимические или генетические признаки БВ, и это считается "молчащей" БВ [20].
Около 40% пациентов детского возраста с БВ с заболеваниями печени имеют кольца Кайзера-Флейшера.
Поражение органа зрения. Патогномоничным симптомом БВ являются кольца Кайзера-Флейшера - отложение меди в десцеметовой мембране роговицы. У детей с бессимптомным и легким печеночным течением БВ они обычно не визуализируются [39]. Кольца Кайзера-Флейшера выявляются у 95% пациентов с неврологическими симптомами и примерно у половины больных без неврологических нарушений [3]. Для их достоверного определения необходимо проводить осмотр при помощи щелевой лампы [40, 92]. Следует учесть, что кольца Кайзера-Флейшера не всегда специфичны для БВ, и могут формироваться у пациентов с хроническими холестатическими заболеваниями или при холестазе новорожденных [41, 42]. К другим возможным офтальмологическим проявлениям БВ относится передняя субкапсулярная катаракта (так называемая "медная катаракта" по типу подсолнуха) - она тоже выявляется при осмотре при помощи щелевой лампы.
Кольца Кайзера-Флейшера сначала развиваются сверху, затем снизу и, наконец, в латеральной и медиальной областях роговицы. Они встречаются примерно у 50% пациентов с печеночными проявлениями и примерно у 95% пациентов с неврологическими проявлениями. Они обратимы и исчезают со временем при лечении БВ [160].
Гемолитическая анемия
Кумбс-негативная гемолитическая анемия у пациентов с БВ может протекать как единичный острый эпизод или иметь хронический характер. В ряде случаев это может быть единственным симптомом дебюта БВ. Пациенты, у которых в анамнезе отмечалась желтуха до установления диагноза БВ, скорее всего, перенесли ранее нераспознанный гемолиз.
Во время беременности у пациенток с БВ возможно развитие острого гепатита и гемолиза, что требует дифференциальной диагностики с HELLP-синдромом.
Поражения почек, суставов, костно-мышечной, сердечно-сосудистой, репродуктивной систем
Помимо неврологической/психиатрической симптоматики к другим внепеченочным проявлениям относятся:
- голубое окрашивание ногтевых лунок;
- гиперпигментация кожи ног;
- дисфункция почечных канальцев: урикозурия, глюкозурия, аминоацидурия, протеинурия, почечный тубулярный ацидоз [35, 36];
- фосфатурия, кальцийурия, нефролитиаз;
- преждевременный остеопороз, артропатия, хондрокальциноз [37];
- кардиомиопатия, аритмии [38];
- лейкопения, тромбоцитопения (как вследствие гиперспленизма, так и на фоне терапии)
- панкреатит, желчнокаменная болезнь;
- миопатия;
- гипопаратиреоз;
- дисменорея, бесплодие или невынашивание беременности;
- гигантизм.
Основные проявления БВ приведены в Приложении А3.2
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критериями установления диагноза БВ являются:
- снижение уровня церулоплазмина, меди в сыворотке крови,
- Кумбс-негативная гемолитическая анемия,
- повышение содержания меди в биоптатах печени,
- повышение экскреции меди с мочой,
- наличие кольца Кайзера-Флейшера,
- признаки поражения ЦНС и/или изменения на МРТ,
- выявленные патогенные варианты в гене ATP7B в гомозиготном или компаунд-гетерозиготном состоянии.
Критерии оцениваются по диагностической оценочной шкале, основанной на всех доступных методах обследования, утвержденной на 8-м Международном собрании по болезни Вильсона в Лейпциге в 2001 г. - так называемой "Лейпцигской шкале" [26] (см. Приложение Г1). Диагноз считается установленным при наборе 4 и более баллов.
Скрининг на БВ должен проводиться у взрослых и детей старше 1 года, имеющих необъяснимое повышение сывороточных печеночных трансаминаз (аланинаминотрансферазы и аспартатаминотрансферазы), проявления острой печеночной недостаточности, хронического гепатита, цирроза печени, неврологических или психопатологических нарушений неустановленной этиологии, Кумбс-негативной гемолитической анемии, отягощенный семейный анамнез по БВ.
Диагностика БВ базируется на комбинации клинических симптомов, данных лабораторного обследования и молекулярно-генетического тестирования [3, 4, 31, 152].
При наличии колец Кайзера-Флейшера, снижения концентрации церулоплазмина менее 10 мг/дл и повышения суточной экскреции меди с мочой диагноз БВ не вызывает сомнений.
Однако в ряде случаев клинические симптомы могут отсутствовать или быть неспецифичными, а лабораторные данные могу находиться в пределах нормальных значений, что затрудняет скрининговую диагностику БВ и требует дальнейшего углубленного обследования пациентов с проведением молекулярно-генетического тестирования для выявления патогенных вариантов в гене ATP7B и, при необходимости, пункционной биопсии печени с количественной оценкой меди в биоптатах (Приложение А3.3, Приложение А3.4) [4, 12].
2.1 Жалобы и анамнез
Пациенты с БВ могут предъявлять жалобы на симптомы поражения желудочно-кишечного тракта ("гепатологические") и центральной нервной системы. В случае манифестации с поражения печени жалобы пациентов могут включать рвоту, общую слабость, увеличение живота (за счет асцита), отечность ног, желтушность и зуд кожи. При церебральной форме болезни пациенты в первую очередь обращают внимание на тремор, скованность мышц, проблемы с речью, изменения личности, тревожность, также могут отмечаться слуховые и зрительные галлюцинации [29, 31].
При сборе анамнеза и жалоб рекомендовано обратить внимание на:
- отягощенный семейный анамнез (наличие в семье пациента с подтвержденным диагнозом БВ);
- голубое окрашивание ногтевых лунок, гиперпигментация кожи ног;
- рецидивирующую желтуху, асцит;
- слюнотечение;
- двигательные расстройства: тремор, плохую координацию, нарушения мелкой моторики, дистонию, паркинсонизма (маскообразное лицо, мышечная ригидность, брадикинезия, нарушение походки), псевдобульбарный синдром;
- психиатрические расстройства в виде депрессии, невроза, тревожности, снижения интеллекта.
2.2 Физикальное обследование
При осмотре необходимо обратить внимание на основные физикальные проявления:
- желтушность склер и кожного покрова, незначительная или умеренная гепатомегалия, спленомегалия;
- кольцо Кайзера-Флейшера;
- наличия отеков, асцита;
- наличие телеангиэктазий, расширения вен передней брюшной стенки, пальмарной эритемы;
- двигательные нарушения (тремор, паркинсонизм, хорея, дистония, атаксия), слюнотечение, дизартрия, дисфагия;
- психиатрические симптомы заболевания: депрессия, тревожные расстройства, расторможенное поведение, когнитивные нарушения, изменения личности, психоз.
Для точной визуализации колец Кайзера-Флейшера необходимо провести биомикроскопию глаза врачом-офтальмологом. Отсутствие данного признака не исключает диагноз БВ, в том числе у пациентов с выраженной неврологической симптоматикой.
Пациенту с подозрением на БВ необходимо провести неврологический осмотр, обращая внимание на наличие экстрапирамидных нарушений. Следует оценить наличие, вид и характер тремора, оценить тонус мышц, обратить внимание на наличие брадикинезии, псевдобульбарных нарушений, оценить мозжечковые функции и походку [89].
2.3 Лабораторные диагностические исследования
- С целью своевременного выявления анемии, лейкопении, тромбоцитопении всем пациентам с подозрением на БВ рекомендуется проведение общего (клинического) анализа крови развернутого [3, 31, 42, 44].
(УУР - C, УДД - 5)
Комментарий: Лейко- и тромбоцитопения являются проявлением гиперспленизма у пациентов с БВ на стадии цирроза печени. Кроме того, они могут развиваться на фоне терапии пеницилламином**.
В ряде случаев при манифестации БВ выявляется острый гемолиз, возникающий в рамках проявлений основного заболевания, или спровоцированный инфекцией или приемом лекарственных препаратов. Гемолиз является проявлением токсического действия меди при БВ.
Также исследование проводится для контроля терапевтического эффекта и предупреждения нежелательных реакций от лекарственной терапии (см. разделы "3.1.2 Медикаментозная терапия" и "5.2 Диспансерное наблюдение")
- Всем пациентам с подозрением на БВ рекомендуется проведение анализа крови биохимического общетерапевтического (определение активности аланинаминотрансферазы в крови, активности аспартатаминотрансферазы в крови, уровня общего билирубина в крови, уровень билирубина связанного (конъюгированного) в крови, анализ крови по оценке нарушений липидного обмена биохимический (исследование уровня холестерина в крови, исследование уровня липопротеинов в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня триглицеридов в крови), определение активности щелочной фосфатазы в крови, гамма-глютамилтрансферазы в крови, исследование уровня общего белка в крови, исследование альбумина в крови) для подтверждения или исключения печеночной недостаточности [96, 97].
(УУР - C, УДД - 4)
Комментарий: при остром течении БВ с печеночной недостаточностью отмечается повышение уровня общего билирубина (> 300 мкмоль/л, > 17,5 мг/дл) с умеренным повышением активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) (100 - 500 Ед/л), низким уровнем активности щелочной фосфатазы (< 40 МЕ/л) [46].
Для прогностической оценки тяжести печеночной недостаточности следует оценивать индекс щелочная фосфатаза (в Ед/л)/общий билирубин (в мг/дл) < 2,0; индекс АСТ/АЛТ > 2,2. Комбинация указанных индексов имеет высокую диагностическую чувствительность и специфичность при жизнеугрожающем патологическом состоянии [46].
- Всем пациентам с подозрением на БВ рекомендуется определение уровня креатинина в крови, уровня мочевины и мочевой кислоты в крови для подтверждения или исключения почечной недостаточности [93, 143, 144].
(УУР - B, УДД - 3)
- Всем пациентам с подозрением на БВ рекомендуется исследование уровня железа сыворотки крови, исследование уровня трансферрина сыворотки крови, исследование уровня ферритина в крови с целью контроля обмена железа [93, 143, 144].
(УУР - B, УДД - 3)
- Всем пациентам рекомендуется проведение коагулограммы (ориентировочного исследования системы гемостаза): определение протромбинового (тромбопластинового) времени в крови или в плазме и международного нормализованного отношения (МНО) с целью контроля синтетической функции печени и прогнозирования дальнейшей тактики ведения пациента [3, 4, 31, 122, 123].
(УУР - C, УДД - 4)
Комментарий: у пациентов со сниженной функцией печени отмечается снижение протромбинового индекса (ПИ) и повышение международного нормализованного отношения (МНО).
- Всем пациентам старше 1 года с подозрением на БВ рекомендуется проведение исследования уровня церулоплазмина в крови и, опционно, исследование уровня меди в крови/исследование уровня меди в крови методом атомно-абсорбционной спектроскопии с целью установления диагноза БВ [3, 4, 31, 48, 51, 92, 124, 146].
(УУР - A, УДД - 1)
Комментарий: в норме уровень церулоплазмина в крови находится в диапазоне 20 - 40 мг/дл. При уровне церулоплазмина < 10 мг/дл отмечается высокая вероятность течения БВ [3, 31]. Помимо БВ сывороточный церулоплазмин может быть понижен у гетерозиготных носителей, при потере белков с почками, мальабсорбции, при терминальной стадии печеночной недостаточности любой этиологии, ацерулоплазминемии, болезни Менкеса (X-сцепленное заболевание с нарушением транспорта меди) [49].
Концентрация церулоплазмина может быть повышена при остром воспалении, а также при гиперэстрогенемии, например, в период беременности или при приеме эстрогенов [3].
Нормальный уровень церулоплазмина не исключает БВ и требует дальнейшего дообследования. Среди детей с подтвержденным диагнозом БВ, у 20% уровень церулоплазмина не снижен [39, 50, 51]. У новорожденных вплоть до 6 мес. физиологическая концентрация церулоплазмина в крови очень низкая, постепенно с возрастом его уровень повышается, достигая своего пика выше, чем у взрослых, в раннем детстве (примерно 30 - 50 мг/дл), затем он постепенно опускается до стандартных значений. [52] Не следует проводить исследование уровня церулоплазмина в крови для диагностики БВ ранее возраста 1 года из-за его неинформативности. Уровень меди в крови обычно снижен пропорционально снижению уровня церулоплазмина. Следует помнить, что при острой печеночной недостаточности, вызванной БВ, уровень меди может быть заметно повышен (> 200 мкг/дл [31,4 мкмоль/л]) [92]. Общее содержание меди в сыворотке крови (включая медь, не связанную с церулоплазмином, или "свободную медь", а также медь, входящую в состав церулоплазмина) обычно снижается пропорционально снижению уровня церулоплазмина в сыворотке крови. У пациентов с БВ с тяжелым поражением печени содержание меди в сыворотке крови может быть в пределах нормы или заметно повышено на фоне ОПН из-за высвобождения меди из запасов ткани печени и увеличения содержания свободной меди в крови. Концентрацию свободной меди в сыворотке крови можно оценить по уровню общей меди и церулоплазмина в сыворотке крови, но это зависит от адекватности методов измерения как сывороточной меди, так и церулоплазмина. Общее содержание меди в сыворотке крови имеет низкую диагностическую ценность, но может быть полезным для мониторинга фармакотерапии. Очень низкие значения могут свидетельствовать о системном дефиците меди, который может наблюдаться у некоторых пациентов при длительном лечении. в качестве диагностического критерия БВ у детей определение сывороточного церулоплазмина рекомендуется в возрасте старше 1 года.
Однако на уровень церулоплазмина могут влиять другие заболевания печени, неправильное питание и воспалительные состояния, поскольку этот белок в основном вырабатывается печенью и функционирует как белок острой фазы. Например, у пациентов с БВ с активной инфекцией уровень церулоплазмина в сыворотке крови может быть повышен до уровня нормы, или его уровень может быть низким у пациентов без БВ и энтеропатией, приводящей к потере белка [31, 50, 51].
- Всем пациентам с подозрением на БВ рекомендуется определение суточной экскреции меди в моче (Исследование уровня меди в моче) [12, 48, 125 - 127].
(УУР - A, УДД - 1)
Комментарий: у нелеченых пациентов суточная экскреция меди с мочой отражает количество свободной "нецерулоплазминовой" меди в циркулирующей крови. Для точного определения суточной экскреции меди с мочой следует оценить объем суточной мочи и уровень креатинина в моче за сутки [3]. В случае почечной недостаточности данное исследование неприменимо. Диагностически значимый для БВ пороговый уровень экскретируемой меди с мочой за сутки > 100 мкг/24 часа (1,6 мкмоль/24 часа), однако у 25% бессимптомных детей с подтвержденным диагнозом суточная экскреция меди с мочой была ниже [39, 53]. Уже при экскреции меди с мочой > 40 мкг/24 часа (0,65 мкмоль/24 часа) следует провести дообследование на предмет БВ (чувствительность 78,9% и специфичность 87,9%) [54]. Увеличение суточной экскреции меди с мочой возможно и при других заболеваниях печени, а также у некоторых гетерозиготных носителей мутации БВ [3]. Интерпретация показателей суточной экскреции меди с мочой может быть затруднена из-за совпадения с другими типами заболеваний печени, особенно при острой печеночной недостаточности или при хроническом холестазе другой этиологии.
Поскольку экскреция меди с мочой может увеличиваться и при других заболеваниях печени (аутоиммунный гепатит, хронические активные заболевания печени, холестаз, острая печеночная недостаточность другого генеза), в качестве средства повышения чувствительности и специфичности определения суточной экскреции меди в моче была предложена провокационная проба с #пеницилламином** для детей. Проба заключается в приеме #пеницилламина** в дозе 1000 мг/сут в два приема по 500 мг с интервалом 12 часов в течение 24 часов сбора мочи [55]. Если данные по определению суточной экскреции меди с мочой неубедительны, повышение экскреции меди с мочой после провокационной пробы с #пеницилламином** выше 1600 мкг/сут позволяет с большей уверенностью говорить о БВ. Провокационная проба стандартизована только у пациентов детского возраста. Данное исследование используется редко в связи с ненадежностью при исключении БВ у бессимптомных сибсов [55].
- Всем пациентам с биохимическими и клиническими данными, указывающими на БВ, рекомендуется определение вариантов генов в образце биологического материала другом или неуточненном, неклассифицированные в других рубриках, методом секвенирования по Сенгеру/методом высокопроизводительного секвенирования/методом полимеразной цепной реакции/методом множественной лигазно-зависимой амплификации зондов при наличии возможности с целью подтверждения диагноза [20, 48, 128 - 130].
(УУР - C, УДД - 4)
Комментарий: возможен поиск частых мутаций, а в случае их отсутствия - полное секвенирование гена ATP7B, тестирование с использованием методов массового параллельного секвенирования (генные панели, секвенирование экзома, секвенирование генома) (Комплекс исследований для диагностики болезни Вильсона-Коновалова).
При отсутствии патогенных вариантов в гене при наличии высоко убедительных и характерных клинико-лабораторных данных в пользу БВ, заболевание не должно быть исключено, т.к. не все патогенные варианты возможно обнаружить с помощью стандартного метода секвенирования (мутации в глубине интронов, крупные перестройки и т.д.).
- Рекомендовано пациентам при признаках острой печеночной недостаточности для прогнозирования выживаемости и решения вопроса о необходимости проведения трансплантации печени по прогностической шкале при БВ (Приложение Г2) исследование уровня общего билирубина в крови, определение активности аспартатаминотрансферазы (АСТ) в крови, определение международного нормализованного отношения (МНО) расчетным методом, исследование альбумина в крови и определение количества лейкоцитов крови (Исследование количества лейкоцитов в венозной крови автоматизированным методом/Подсчет количества лейкоцитов в венозной крови методом световой микроскопии) [4, 47, 86].
(УУР - C, УДД - 4)
2.4 Инструментальные диагностические исследования
- Всем пациентам с подозрением на БВ рекомендуется проведение ультразвукового исследования (УЗИ) печени, желчного пузыря и протоков, селезенки (Ультразвуковое исследование органов брюшной полости (комплексное)) с целью диагностики поражений гепатобилиарной системы [56, 57].
(УУР - C, УДД - 5)
Комментарий: по данным УЗИ может быть выявлена гепатомегалия с диффузными изменениями паренхимы печени в виде гиперэхогенности и мелкоочаговой диффузной неоднородности. При наличии цирроза в паренхиме визуализируются узлы регенерации, увеличение селезенки, расширение ствола воротной и селезеночной вен, при цветовом допплеровском картировании - признаки портальной гипертензии.
Изменения на УЗИ не являются специфичными для БВ, поэтому данное исследование не имеет диагностического значения, но может быть полезно для неинвазивной оценки структурных изменений в печени и мониторинга эффективности лечения.
- Рекомендуется проведение эластометрии печени с целью выявления цирроза печени у впервые диагностируемых пациентов и для оценки динамики фиброза печени на фоне проводимой терапии [58].
(УУР - B, УДД - 2)
Комментарий: исследование целесообразно для неинвазивной оценки выраженности фиброза печени при БВ. Нельзя полностью полагаться на результаты измерений, если они расходятся с клиническими данными.
- Всем пациентам с неврологической симптоматикой, характерной для БВ, рекомендуется проведение магнитно-резонансной томографии (МРТ) головного мозга с целью выявления патологических изменений в головном мозге [4, 60, 92, 131, 132].
(УУР - B, УДД - 3)
Комментарий: Изменения при МРТ головного мозга выявляются у 90% пациентов с БВ с неврологической симптоматикой, у 40 - 70% с абдоминальной формой БВ и у 20% пациентов с бессимптомной формой [89]. Отсутствие визуализационных изменений у пациентов с признаками поражения ЦНС не исключает диагноз БВ. Наиболее часто при МРТ головного мозга выявляются симметричное двустороннее повышение интенсивности сигнала на Т2-взвешенных изображениях от базальных ядер (хвостатое ядро, скорлупа и бледный шар), таламусов, среднего мозга (симптом "морды гигантской панды") и моста. По мере прогрессирования заболевания выявляются признаки диффузного атрофического процесса головного мозга с равномерным расширением субарахноидальных пространств и желудочковой системы [19, 98, 99]. Изменения МР-сигнала от структур головного мозга могут отсутствовать у 7 - 17% детей со смешанной формой БВ при наличии неврологической симптоматики в виде тремора, дизартрии и изменения мышечного тонуса по экстрапирамидному типу. В то же время изменения на МРТ головного мозга могут опережать развитие неврологической симптоматики в 10% случаев БВ и быть обратимыми на фоне медьхелатирующей терапии.
Исследования могут проводиться в процессе динамического наблюдения по клинической необходимости [100, 101].
По показаниям применяется наркоз.
- Пациентам с подозрением на наличие эпилептического синдрома рекомендуется проведение рутинной электроэнцефалографии (ЭЭГ) с целью своевременной диагностики и контроля лечения эпилептических приступов [102, 133].
(УУР - C, УДД - 4)
Комментарии: также может быть рекомендовано проведение суточной электроэнцефалографии с видеомониторингом.
- Пациентам с подозрением на БВ рекомендуется прием (осмотр, консультация) врача-офтальмолога, проведение биомикроскопии глаза для обнаружения колец Кайзера-Флейшера и (или) катаракты [3, 4, 31, 62].
(УУР - C, УДД - 5)
Комментарий: офтальмологические проявления при БВ включают в себя кольца Кайзера-Флейшера и переднюю субкапсулярную катаракту (так называемая "медная катаракта"). Кольца Кайзера-Флейшера представляют собой отложение меди на внутренней поверхности роговицы в десцеметовой мембране. Визуализация кольца Кайзера-Флейшера производится при офтальмологическом осмотре при помощи щелевой лампы, иногда при помощи гониолинз, в далеко зашедших стадиях заболевания можно видеть кольцо невооруженным взглядом. Гораздо реже при БВ встречается развитие "медной катаракты" в виде "подсолнуха". Катаракта не влияет на остроту зрения и визуализируется при помощи щелевой лампы в виде серого или золотистого диска на передней оболочке хрусталика, от которого радиально отходят лучи на периферию хрусталика [3, 4, 31].
- Рекомендована оценка состоятельности глотания (оценка функции глотания) для объективной оценки наличия аспирации и нарушения глотания у пациентов с дисфагией при решении вопроса о необходимости кормления через зонд [103, 104].
(УУР - C, УДД - 5)
- Рекомендовано регистрация электрокардиограммы и эхокардиография пациентам с БВ с целью выявления патологии со стороны сердца [100, 134 - 136].
(УУР - C, УДД - 4)
Комментарии: могут выявляться гипертрофия левого желудочка или обоих желудочков, ранняя реполяризация, депрессия сегмента ST, инверсия зубца T и различные аритмии.
2.5 Иные диагностические исследования
- При нормальном содержании церулоплазмина в крови и незначительном повышении экскреции меди с мочой с целью дифференциальной диагностики, а также для определения стадии поражения печени рекомендовано проведение пункционной биопсии печени (чрескожная биопсия печени, биопсия печени под контролем ультразвукового исследования) с окраской на медь и количественным определением содержания меди в ткани печени (Чрескожная биопсия печени, Биопсия печени под контролем ультразвукового исследования) с количественным определением содержания меди в ткани печени и гистологическим исследованием биоптата (Патолого-анатомическое исследование биопсийного (операционного) материала пункционной биопсии печени) с целью установления диагноза [3, 31].
(УУР - C, УДД - 5)
Комментарий: Может применяться при спорных результатах молекулярно-генетического исследования!
Образец биоптата должен быть не менее 1 см в длину [3, 4, 31].
Содержание меди в ткани печени > 250 мкг/г (4 мкмоль/г) сухого веса является доказательством наличия БВ. Снижение диагностического порога до 70 - 250 мкг/г (1,2 - 4 мкмоль/г) повышает чувствительность метода с 83% до 96,5%, в то время как специфичность остается достаточно высокой - 95,4% и 98,6% соответственно [63]. Главная проблема данного метода - неравномерное распределение меди в ткани печени, из-за чего результаты анализа могут быть занижены при ошибке в заборе образца, что следует учитывать при интерпретации результатов [3, 4, 40, 63, 64, 65]. Концентрация меди в печени может повышаться при длительно существующем холестазе, при синдромах идиопатического медного токсикоза и др.
Морфологические изменения печени при БВ не являются патогномоничными и включают в себя на ранних стадиях признаки жировой инфильтрации гепатоцитов (крупнокапельной и мелкокапельной), гликогеновой дегенерации ядер и фокальный гепатоцеллюлярный некроз, а также преобладание минимальной и низкой степени активности воспалительного процесса в сочетании с высокой долей выраженных фибротических изменений. Жировая дегенерация гепатоцитов при БВ, вероятно, связана с повреждением митохондрий вследствие окислительного стресса с последующим нарушением обмена липидов, а воспалительные проявления - с перекисным окислением липидов, образованием свободных радикалов и истощением запасов глютатиона в результате накопления избытка меди в гепатоцитах. Описаны гистологические изменения печеночной паренхимы по типу аутоиммунного гепатита, вирусного, алкогольного и лекарственного поражения печени. По мере прогрессирования повреждений паренхимы, формируется фиброз и, впоследствии, цирроз печени. Обычно встречается гистологическая картина крупноузлового цирроза печени в исходе БВ, однако, описаны случаи и мелкоузлового цирроза. Для качественного выявления депозитов меди в печеночной ткани используются различные гистохимические методы окраски (родамин, рубеановая кислота, орсеин, метод Тиммса с серой), однако, все они имеют низкую диагностическую ценность [65, 66, 67, 68].
- Рекомендуется прием (осмотр, консультация) врача-генетика всем пациентам с подозрением на БВ с целью уточнения диагноза молекулярно-генетическими методами, интерпретации результатов исследований, разъяснений особенностей заболевания [3, 4, 31, 44].
(УУР - C; УДД - 5)
- Рекомендуется прием (осмотр, консультация) врача-невролога всем пациентам с подозрением на БВ с целью своевременного выявления неврологической симптоматики, начала терапии [3, 4, 31, 44].
(УУР - C; УДД - 5)
- Рекомендуется участие в диагностике и ведении пациентов с БВ мультидисциплинарной команды специалистов ввиду того, что заболевание характеризуется поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [3, 4, 31, 44].
(УУР - C; УДД - 5)
Комментарий: Диагностика и терапия БВ осуществляется с привлечением следующих специалистов (по клинической необходимости): врач-педиатр/врач-терапевт/врач общей практики (семейный врач), врач-генетик, врач-гастроэнтеролог, врач-офтальмолог, врач-невролог, врач-психиатр, врач-нефролог, врач-гематолог/врач-детский онколог-гематолог, врач-хирург/врач-детский хирург, медицинский психолог, врач-пульмонолог и др.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Стратегии лечения БВ направлены на снижение содержания меди в организме. Обычно это достигается за счет снижения потребления меди с пищей, уменьшения всасывания меди из желудочно-кишечного тракта за счет использования солей цинка, и/или увеличения выведения меди с мочой за счет использования хелатирующих веществ, включая D-пеницилламин и триентин.
Ограничение потребления меди в рационе не может предотвратить ее накопление, однако следует избегать чрезмерного потребления продуктов, богатых медью, до исчезновения симптомов и устранения биохимических нарушений. Целью лечения является либо увеличение выведения меди с мочой или калом, либо блокирование всасывания меди в кишечнике. Лечение следует начинать после установления диагноза [31].
3.1.1 Диетотерапия
- Рекомендовано назначение элиминационной диеты - ограничение употребления продуктов, богатых медью, до наступления ремиссии симптомов и нормализации функции печени всем пациентам, в том числе, получающим хелатирующую терапию с целью ограничения поступления меди в организм и предотвращения ее токсических эффектов [12, 31].
(УУР - C, УДД - 5)
Комментарии: ограничиваются продукты с высоким содержанием меди (печень, креветки, орехи, шоколад, грибы). Как минимум, в течение первого года лечения, используется свободная от меди вода, при необходимости устанавливаются очистительные фильтры для контроля содержания меди в водопроводной воде, т.к. при ее доставке могут использоваться медные трубы. Запрещается использовать медную посуду для приготовления и хранения пищи. Необходимо избегать приема витаминных и минеральных препаратов, содержащих медь. Диетические рекомендации приводят к замедлению прогрессирования заболевания, однако не могут использоваться как единственная линия терапии.
Диетические рекомендации представлены в Приложении А3.4.
Основным методом лечения БВ является медьэлиминирующая терапия, а при резистентности к медикаментозному лечению проводится трансплантация печени. Весь период лечения можно разбить на начальную фазу и фазу поддерживающей терапии. Критерием перехода на поддерживающую терапию является регресс клинических проявлений (исчезновение асцита, желтухи, нормализация менструального цикла, регресс колец Кайзера-Флейшера, стойкая нормализация биохимических показателей в т.ч. обмена меди, "печеночных" ферментов и функции печени.
Начальная фаза назначения медьхелатирующей терапии в терапевтической дозе длится не менее 2 лет.
3.1.2 Медикаментозная терапия
- Если пациенту выставлен диагноз БВ, рекомендовано назначение пеницилламина**, доза подбирается индивидуально, у детей (по инструкции с 3 лет): - 20 мг/кг веса, у взрослых - до 1500 - 2000 мг с целью связывания свободной меди и ускорения ее экскреции с мочой [3, 4, 31, 69, 70, 71].
(УУР - C, УДД - 5)
Комментарий: является препаратом выбора при лечении болезни Вильсона. Пеницилламин** представляет собой производное пенициллина, молекула которого содержит свободную сульфгидрильную группу, с помощью которой осуществляется хелаторная активность данного препарата. Пеницилламин** мобилизует медь из печени и других органов и увеличивает ее мочевую экскрецию, а также индуцирует синтез металлотионеинов. Пеницилламин** назначается за 1 час до приема пищи, т.к. еда снижает кишечную абсорбцию препарата.
Переносимость пеницилламина** можно повысить, начав с постепенного увеличения дозы [3]. Терапевтическая доза пеницилламина** у детей с 3 лет (по инструкции) составляет 20 мг/кг/сут. Начинать лечение необходимо с половинной дозы - #пеницилламин 10 мг/кг/сут в зависимости от возраста (125 - 250 - 500 мг) с постепенным увеличением на 125 - 250 каждые 5 - 7 дней до терапевтической [3, 31, 139]. У взрослых начальные дозы #пеницилламина при терапии составляют 125 - 250 мг в сутки с постепенным (каждые 4 - 7 дней) увеличением дозы на 125 - 250 мг до лечебной дозировки 1000 - 1500 (до 2000) мг в сутки, которая может назначаться в 2 - 4 приема (на практике - чаще 3 - 4 приема) [3].
Коррекция дозы препарата производится по мере снижения экскреции меди с суточной мочой. Терапия назначается пожизненно. Пациенты, прекратившие прием пеницилламина**, находятся в группе риске по развитию декомпенсации функции печени.
Нежелательные реакции на фоне терапии пеницилламином** развиваются примерно в 30% случаев. У пациентов со смешанной (с неврологическими проявлениями) формой БВ в 30% случаев отмечается ухудшение неврологической симптоматики, что связано с индуцированной высокой мобилизацией меди из печени и головного мозга. У части пациентов с БВ на фоне терапии может развиться острая аллергическая реакция в виде сыпи, лихорадки, крапивницы. Возможно развитие подострой токсической реакции в виде протеинурии, угнетения функции костного мозга. Может иметь место также хроническое токсическое действие на кожу (преждевременное старение, дефекты в формировании рубцовой ткани), аутоиммунные заболевания (системная красная волчанка, артриты, повышение антинуклеарного фактора), а также снижение резистентности к инфекциям. При применении пеницилламина** развивается дефицит пиридоксина, что требует назначения #пиридоксина** в дозе 25 - 50 мг/сутки [3].
При своевременном корректном лечении у 90% пациентов отмечается положительная динамика с нормализацией печеночных маркеров в течение 2 - 6 месяцев [72].
Противопоказаниями к применению пеницилламина** являются повышенная чувствительность к пеницилламину** и другим компонентам препарата, агранулоцитоз, почечная недостаточность, нарушения гемопоэза, детский возраст до 3-х лет.
В среднем, контроль терапии проводится 2 раза в месяц на протяжении первого года терапии, далее - ежегодно [100, 92].
Контроль лечения детям проводится, как правило, чаще: 1 раз в неделю на этапе старта терапии (в первый месяц лечения) и в период повышения дозы пеницилламина**, далее лабораторные и инструментальные исследования проводятся каждые 1 - 3 месяца до наступления ремиссии, после - каждые 3 - 6 месяцев (возможно чаще по показаниям) [12].
Несоблюдение режима терапии может привести к угрожающему жизни состоянию, поэтому при низкой комплаентности интервалы между контрольными исследованиями должны быть короче, особенно это касается пациентов подросткового возраста. К контролю терапии относятся:
- Физикальное обследование (выявление новой симптоматики БВ или развитие нежелательных реакций на фоне терапии);
- Исследование содержания меди в суточной моче. Целевой диапазон уровня экскретируемой суточной меди с мочой на фоне поддерживающей хелатной терапии составляет 200 - 500 мкг (3 - 8 мкмоль) в сутки [3, 12, 31];
- Проведение анализа крови биохимического общетерапевтического (определение активности аланинаминотрансферазы в крови, активности аспартатаминотрансферазы в крови, уровня общего билирубина в крови, уровень билирубина связанного (конъюгированного) в крови, определение активности щелочной фосфатазы в крови, гамма-глютамилтрансферазы в крови, уровень креатинина в крови, уровень мочевины в крови). Печеночные показатели на фоне хелатной терапии нормализуются в течение 3 - 12 месяцев [31];
- Оценка общего (клинического) анализа крови развернутого - мониторирование нежелательных реакций на фоне терапии. Могут определяться анемия, нейтропения, тромбоцитопения [44];
- Для своевременного выявления нежелательных реакций на фоне хелатирующей терапии (пеницилламин**), например, протеинурии, следует контролировать общий (клинический) анализ мочи не реже, чем 1 раз в 6 месяцев или чаще по показаниям [3, 45];
- Диспансерный прием (осмотр, консультация) врача-офтальмолога ежегодно с проведением биомикроскопии глаз при помощи щелевой лампы для наблюдения за кольцами Кайзера-Флейшера. Появление колец Кайзера-Флейшера и наличие изменений в биохимических показателях указывают на необходимость коррекции терапии или на несоблюдение терапевтического режима пациентом;
- Проведение неинвазивных инструментальных исследований, таких как ультразвуковое исследование органов брюшной полости (комплексное) не реже 1 раза в 6 - 12 месяцев, эластометрия печени - не реже 1 раза в 1 - 2 года.
- Рекомендована терапия второго ряда препаратами цинка (#цинка сульфат) пациентам с БВ при непереносимости пеницилламина** с целью снижения всасывания меди в кишечнике в дозе 150 мг в сутки элементарного цинка в три приема у взрослых, у детей младше 5 лет - 25 мг элементарного цинка 2 раза в сутки, у детей старше 5 лет - 75 мг/сутки (если ребенок весит менее 50 кг) или 150 мг/сутки (если масса тела более 50 кг) в 3 приема за 30 минут до приема пищи [3, 73, 74, 75, 77, 146].
(УУР - C, УДД - 5)
Комментарий: цинк подавляет всасывание меди в кишечнике и применяется как альтернативное лечение при БВ. Препараты цинка индуцируют металлотионеины энтероцитов, обладающих высоким сродством к меди и связывающих ее в эпителии кишечника. Препараты цинка препятствуют всасыванию меди в системный кровоток и способствуют ее выведению с калом. Препараты цинка менее токсичны, чем хелатирующая терапия [73, 74].
Цинк и пеницилламин** не должны назначаться вместе перед одним приемом пищи.
Эффективность терапии цинком следует оценивать по клиническому и биохимическому улучшению, измерению суточной экскреции меди и цинка с мочой. Уровень экскретируемой меди на поддерживающей терапии должен находиться в диапазоне 30 - 75 мкг в сутки (0,5 - 1,2 мкмоль в сутки); содержание меди в суточной моче ниже 30 мкг указывает на передозировку препаратом. Уровень сывороточного цинка и экскретируемого цинка следует поддерживать выше 125 мкг/дл и 1,5 - 2 г/сутки, соответственно [31, 76]. У пациентов с поражением печени монотерапия препаратами цинка недостаточно эффективна и не должна применяться [31].
Возможные нежелательные реакции: со стороны ЖКТ отмечается раздражение слизистой оболочки желудка, повышение активности трансаминаз в начале лечения. Препараты цинка могут обладать иммуносупрессивным эффектом и уменьшать хемотаксис лейкоцитов. Может произойти повышение активности сывороточной липазы и (или) амилазы без клинических проявлений панкреатита. Усиление неврологической симптоматики при применении препаратов цинка встречается редко. Безопасность высоких доз препаратов цинка для пациентов с нарушениями функции почек пока не определена [78].
- Пациентам с бессимптомным течением БВ рекомендовано рассмотреть вопрос о выборе в качестве препарата первой линии препараты цинка под регулярным диспансерным наблюдением в связи с меньшими нежелательными реакциями по сравнению с пеницилламином** [70, 79, 80, 81, 82, 137].
(УУР - B, УДД - 2)
Комментарий: при решении вопроса о назначении терапии препаратами цинка (#Цинка сульфат) следует принять во внимание, что при наличии клинических проявлений БВ препаратом выбора остается пеницилламин** [3, 4, 31]. При нарастании клинических проявлений и биохимических изменений следует назначить пеницилламин**.
Распространено мнение об эффективности комплексной терапии пеницилламином** и препаратами цинка, однако данных относительно этой точки зрения недостаточно.
Цинк и пеницилламин** не должны назначаться вместе перед одним приемом пищи.
- Рекомендовано назначение триентина пациентам с БВ в качестве препарата второй линии терапии при непереносимости пеницилламина как альтернативного хелатора меди согласно действующей инструкции [146].
(УУР - C, УДД - 5)
Комментарии: триентин не менее эффективен, чем пеницилламин**, связывает и выводит медь с мочой при БВ.
Препарат может быть предпочтительнее для пациентов с БВ, у которых имеется тяжелая тромбоцитопения или нейтропения, которые могут возникать при спленомегалии в рамках синдрома гиперспленизма. Парадоксальное неврологическое ухудшение после начала лечения триентином, по-видимому, встречается реже, чем при приеме пеницилламина**, хотя прямого сравнения никогда не проводилось [146].
Триентин был эффективной начальной терапией для пациентов, даже с первоначально декомпенсированной функцией печени. Имеющиеся данные свидетельствуют о том, что триентин безопасен и эффективен у педиатрических пациентов с БВ.
В большинстве случаев все побочные эффекты пеницилламина** после его отмены проходят и не возобновляются при приеме триентина. Суточная доза препарата составляет 1 - 2 г в три приема за 1 час до или через 3 часа после приема пищи. Взрослым триентин обычно назначается в дозе 750 - 1500 мг/сутки, разделенной на 2 - 4 приема.
Триентин одновременно с медью хелатирует железо, поэтому необходимо избегать совместного введения этого препарата и препаратов железа, так как их комплекс токсичен. Последствием избыточной терапии может стать обратимая сидеробластическая анемия. Показано, что побочные реакции, наблюдаемые при терапии пеницилламином**, уменьшаются при замене его триентином, и их рецидива при длительном приеме препарата не отмечается.
У детей старше 5 лет (в соответствии инструкции) доза составляет 20 мг/кг/ сут. (можно округлить до ближайших 250 мг) в 2 - 3 приема. Препарат принимают за 1 час или через 3 часа после еды, запивая водой. Препарат не стабилен при высокой температуре, поэтому его следует хранить в холодильнике.
Некоторыми исследователями было высказано предположение, что возможно применение триентина 1 раз в день в качестве поддерживающей терапии. В случае подтверждения в более крупных исследованиях такой режим дозирования поможет облегчить качество жизни пациентам. [150].
Контроль эффективности: как при терапии пеницилламином**.
Контроль побочных эффектов: проведение общего (клинического) анализа крови развернутого, Исследование уровня железа сыворотки крови. Частота, в среднем, 1 раз в 3 месяца.
Побочные эффекты: наиболее тяжелым побочным эффектом является сидеробластная анемия. [151].
3.1.3 Симптоматическая терапия неврологических проявлений БВ
У пациентов с умеренной или выраженной дистонией возможно применение S01FA Антихолинергических средств, в соответствии с клиническими рекомендациями "Дистония" [103, 105]. Выбор препарата и метода лечения определяется клинической ситуацией.
- Не рекомендовано при БВ, сопровождающейся легким тремором рутинное назначение специальных вмешательств, т.к. в большинстве случаев данная симптоматика разрешается самостоятельно на фоне терапии основного заболевания [103].
(УУР - C, УДД - 5)
- Рекомендовано при БВ, сопровождающейся тремором, влияющим на повседневную активность назначение лекарственной терапии (например, #пропранолол** (40 - 240 мг/сутки, противопоказан до 18 лет), #клоназепам** (0,5 - 4 мг/сутки), #примидон (62,5 - 750 мг/сутки) [103, 105].
(УУР - C, УДД - 5)
Пациентам с симптомами паркинсонизма показано [105] лечение в соответствии с клиническими рекомендациями "Болезнь Паркинсона, вторичный паркинсонизм и другие заболевания, проявляющиеся синдромом паркинсонизма".
- Взрослым пациентам с БВ и выраженной хореей рекомендовано рассмотреть назначение #тетрабеназина** (стартовая доза 12,5 мг/сутки, средняя доза 50 - 75 мг/сутки), с целью облегчения симптомов [103, 105].
Комментарии: Данные об эффективности симптоматического лечения хореоатетоза при БВ очень ограничены.
- Рекомендовано рассмотреть пациентам с БВ и атаксией проведение физической терапии - лечебной физкультуры, направленной на тренировку контроля ходьбы и равновесия [103, 104].
(УУР - C, УДД - 5)
Комментарии: Услуги по физической терапии: Лечебная физкультура при заболеваниях центральной нервной системы и головного мозга, Лечебная физкультура с использованием аппаратов и тренажеров при заболеваниях центральной нервной системы и головного мозга, Коррекция нарушения двигательной функции при помощи биологической обратной связи, Пособие по восстановлению позо-статических функций, Динамическая проприокоррекция.
- Рекомендовано пациентам с БВ и дизартрией применять методы релаксации в случае дистонической дизартрии, методы, улучшающие скорость речи в случае мозжечковой атаксии, а также громкость и артикуляцию в случае гипокинетической дизартрии [103].
(УУР - C, УДД - 5)
Комментарии: Лечение дизартрии при БВ не является специфическим, но основано на общих правилах лечения дизартрии, и подход в основном зависит от конкретного типа нарушения речи. У пациентов с малопонятной речью терапию следует комбинировать с альтернативными способами коммуникации (например, письмо, жесты, приборы с функцией преобразования письменной речи, компьютер, смартфон и т.п.) с целью повышения качества жизни пациентов.
Логопедические услуги: Медико-логопедическое исследование при дисфагии, Медико-логопедическое исследование при афазии, Медико-логопедическое исследование при дизартрии, Медико-логопедическая процедура при дисфагии, Медико-логопедическая процедура при афазии, Медико-логопедическая процедура при дизартрии, Медико-логопедическая тонально-ритмическая процедура, Медико-логопедическая процедура с использованием интерактивных информационных технологий
- Рекомендовано в качестве стартовой терапии при нетяжелых проявлениях дисфагии проводить коррекцию пищевого поведения и физиотерапию с целью предотвращения аспирационных процессов [103].
(УУР - C, УДД - 5)
Комментарий: Пациентам следует рекомендовать принимать пищу в спокойной обстановке (без просмотра телевизора, не разговаривать во время еды, не принимать пищу, если пациент утомлен и т.п.). Следует есть и пить медленно, тщательно прожевывая пищу, не принимать новую порцию еды пока не проглочена предыдущая.
Пациентам со сниженной подвижностью языка и нарушениями глотания могут быть полезны специальные положения тела, например, положение лежа на боку под углом 45° во время глотания.
Перед началом терапии дисфагии следует, по возможности, прекратить лечение седативными препаратами либо сократить дозы до одной перед сном.
Также следует по возможности отменить R03BB антихолинергическиие средства, назначенные для уменьшения слюноотделения при появлении дисфагии, т.к. сухость во рту может ухудшить глотание.
Следует избегать сухой и липкой пищи.
Возможно использование загустителей на основе крахмала.
- Рекомендовано при тяжелой некорректируемой дисфагии установка назогастрального зонда и проведение кормления через зонд/назогастральный зонд с целью предотвращения аспирации и дефицита питания [103].
(УУР - C, УДД - 5)
Комментарии: Назогастральный зонд может использоваться временно для дополнительного питания у пациентов, которые могут принимать пищу самостоятельно.
- Рекомендовано рассмотреть постановку гастростомы пациентам с постоянной и (или) прогрессирующей дисфагией тяжелой степени при наличии или отсутствии потери массы тела, без признаков улучшения неврологических симптомов после 1 месяца хелатирующей терапии [103, 104].
(УУР - C, УДД - 5)
Комментарии:
Необходимо уточнить наличие/отсутствие меди в составе материала зонда.
- Рекомендовано использование немедикаментозных методов (жевательная резинка или сосание леденцов) при слюнотечении с целью уменьшения симптоматики за счет стимуляции глотания пациентам со слюнотечением [103].
(УУР - C, УДД - 5)
- Рекомендовано пациентам со слюнотечением при неэффективности немедикаментозных методов применение антихолинергических препаратов (например, #тригексифенидил** (стартовая доза 2 мг с постепенным повышением, обычно достаточно 30 мг/сутки), или введение #Ботулинического токсина типа A-гемагглютинин комплекс** в околоушные слюнные железы и (или) поднижнечелюстные слюнные железы с целью уменьшения саливации (эффективные дозы варьируют от 10 до 300 единиц, действие препарата длится 1,5 - 6 месяцев) [103, 138].
(УУР - C, УДД - 5)
- Терапию эпилепсии рекомендовано проводить в соответствии с клиническими рекомендациями "Эпилепсия и эпилептический статус у взрослых и детей" с целью купирования и предотвращения приступов [34, 90, 103, 104].
(УУР - C, УДД - 5)
Комментарии: Для того чтобы не вызвать печеночной дисфункции, следует избегать применения противоэпилептических препаратов с потенциальным гепатотоксическим эффектом (например, вальпроевая кислота**).
- Рекомендуется психопатологические и поведенческие симптомы корректировать так же, как и при подобных нарушениях иной этиологии. При этом следует избегать, по возможности препаратов, основной нежелательной реакцией которых является гепатотоксичность [107].
(УУР - C, УДД - 4)
3.1.4 Терапия во время беременности и грудного вскармливания
Беременность не противопоказана при отсутствии тяжелой портальной гипертензии и печеночной недостаточности. Важно консультировать молодых людей по вопросам фертильности и терапевтического лечения во время беременности и лактации. У женщин с БВ, не получающих лечения или плохо контролируемых, могут наблюдаться нарушения менструального цикла и овуляции из-за дисфункции печени и интоксикации медью определенных ферментов, которые участвуют в нормальном менструальном цикле и механизме овуляции. Это может снизить их фертильность или привести к осложнениям на ранних сроках беременности (например, к самопроизвольному выкидышу). Начав хелаторную терапию для достижения адекватного контроля содержания меди и восстановления функции печени, можно обратить вспять нарушения овуляции. Это также подчеркивает необходимость проведения хелаторной терапии меди до беременности. Беременным женщинам с БВ следует продолжать принимать те же препараты, которые они уже принимали, чтобы избежать обострения симптомов. После родов рекомендуется принимать хелатообразующие вещества в том же количестве, что и до беременности. Регулярное клиническое обследование и оценка функциональных показателей печени, а также мониторинг содержания меди в крови и моче необходимы как во время беременности, так и после нее. Поскольку все хелатообразующие вещества выделяются с грудным молоком, грудное вскармливание в период лактации не рекомендуется [164, 165].
- Рекомендовано продолжить терапию БВ при беременности и в послеродовом периоде с целью сохранения течения БВ в стадии ремиссии, однако, учитывая опасения по поводу потенциальной тератогенности (описана редко - только при приеме высоких доз) и с возможным образованием рубцов после кесарева сечения или эпизиотомии вследствие нарушения синтеза коллагена, следует снизить дозы хелатирующей терапии на протяжении всей беременности на 25 - 50% от исходной. Терапию #цинка сульфатом можно сохранять без корректировки дозы [12, 3, 92, 108].
(УУР - C, УДД - 4)
Комментарий: У беременных максимальная суточная доза не должна превышать 1000 мг/сут, в 3 триместре - 300 - 600 мг пеницилламина** [3]. Необходимо проводить контроль лабораторных показателей обмена меди согласно Инструкции к препарату, но не реже 1 раза в 3 месяца. Если планируется кесарево сечение, то суточная доза должна быть не более 250 мг в последние 6 недель беременности и в послеоперативном периоде до полного заживления.
Категорически нельзя отменять терапию при наступлении беременности в связи с возможностью развития осложнений.
Считается, что триентин во время беременности безопасен, поэтому лечение во время беременности следует продолжить [146].
- Не рекомендуется пациенткам с БВ осуществлять грудное вскармливание на фоне применения хелатирующей терапии, в частности, пеницилламина** и триентина [3, 108, 92, 146].
(УУР - C, УДД - 5)
Комментарий: данных относительно влияния #цинка сульфата (препаратов цинка) на грудного ребенка в настоящее время недостаточно. При этом имеются данные о возможной безопасности применения хелатирующей терапии во время грудного вскармливания [108].
3.2 Хирургическое лечение
3.2.1 Трансплантация печени
Показаниями к трансплантации печени у пациентов с БВ являются быстрое развитие тяжелой печеночной недостаточности с коагулопатией и печеночной энцефалопатией, с прогрессированием печеночной дисфункции до печеночной недостаточности, несмотря на медикаментозную терапию, острая или хроническая печеночная недостаточность [31].
- Рекомендовано проведение трансплантации печени при наличии показаний: развитие острой печеночной недостаточности, неэффективность хелатной терапии в течение нескольких месяцев у пациентов с декомпенсированным циррозом печени; возникновение тяжелой прогрессирующей печеночной недостаточности при самостоятельном прекращении лечения, рассмотреть при прогрессирующих и необратимых неврологических нарушениях [3, 4, 31, 83, 85].
(УУР - C, УДД - 4)
Комментарий: выживаемость пациентов в течение года после ургентной трансплантации по поводу фульминантной печеночной недостаточности при БВ достигает 70%, в отсутствие трансплантации выживаемость составляет единичные случаи. При трансплантации печени на стадии декомпенсированного цирроза печени выживаемость пациентов в течение года составляет 95%, через 5 лет - 83%, через 10 лет - 80%. Улучшение неврологической симптоматики после трансплантации наблюдается более чем в 50% случаев. Однако если неврологическая симптоматика персистирует более 2 лет на фоне лечения, улучшение результатов после проведения ортотопической трансплантации печени или продолжения хелатной терапии маловероятно. Выживаемость пациентов со смешанной формой БВ после проведения трансплантации печени ниже по сравнению с печеночной формой. Трансплантация печени приводит к нормализации обмена меди, повышению уровня церулоплазмина в первые месяцы после операции, снижению экскреции меди с мочой после трансплантации с полной нормализацией данных показателей к 6 - 9 месяцу послеоперационного периода, исчезновению колец Кайзера-Флейшера у большинства пациентов [83, 85].
После трансплантации печени пациенты не нуждаются в терапии БВ [84].
3.2.2 Хирургическое лечение неврологических осложнений
- При тяжелых двигательных (экстрапирамидных) нарушениях, устойчивых к хелатирующей и симптоматической терапии, рекомендовано рассмотреть возможность проведения хирургического лечения:
- при дистонии - хроническая электростимуляция глубоких структур головного мозга (внутреннего сегмента бледного шара), паллидотомия, таламотомия;
- при треморе - хроническая электростимуляция глубоких структур головного мозга (таламуса), паллидотомия, таламотомия;
- при паркинсонизме - хроническая электростимуляция глубоких структур головного мозга или паллидотомия;
с целью коррекции данных состояний [103, 104].
(УУР - C, УДД - 5)
Комментарии: в соответствии с клиническими рекомендациями "Дистония" и "Болезнь Паркинсона, вторичный паркинсонизм и другие заболевания, проявляющиеся синдромом паркинсонизма".
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Медицинская реабилитация пациентов с БВ направлена на компенсацию нарушений функционирования, прежде всего признаков поражения центральной нервной системы. Она включает в себя лечебную физкультуру при заболеваниях центральной нервной системы и головного мозга, лечебную физкультуру с использованием аппаратов и тренажеров при заболеваниях ЦНС и головного мозга, коррекцию нарушения двигательной функции при помощи биологической обратной связи, пособие по восстановлению позо-статических функций, динамическую проприокоррекцию, медико-логопедическую процедуру при дисфагии, медико-логопедическая процедура при дизартрии, медико-логопедическую тонально-ритмическую процедуру, медико-логопедическую процедуру с использованием интерактивных информационных технологий.
Не существует крупных рандомизированных исследований, в которых оценивалась бы эффективность физической терапии (лечебной физкультуры). Однако отдельные сообщения об ее успешном применении при БВ и небольшие серии клинических наблюдений свидетельствуют о том, что физическая терапия может быть полезна в случаях дистонии, для предотвращения контрактур, при паркинсонизме и атаксии, где могут быть полезны методы стабилизации походки и равновесия.
Нейромышечная электростимуляция предпринималась для улучшения дисфагии, и для улучшения питания стандартной практикой является использование чрескожной эндоскопической гастростомы у пациентов, у которых заметно нарушено глотание [105, 109, 110].
Поскольку ожидается, что неврологическое состояние пациента начнет улучшаться примерно через 6 месяцев после начала патогенетической терапии, важно, чтобы пациент в процессе лечения сохранял позитивный настрой и старался сохранить как можно больше физических возможностей.
Если пациент испытывает крайние трудности в общении, могут быть использованы алфавитные доски или электронные устройства коммуникации [111 - 114].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1 Профилактика
- Рекомендуется прием (осмотр, консультация) врача-генетика семьям с пациентом с диагнозом БВ для разъяснений генетического риска, обсуждения возможностей пренатальной и преимплантационной диагностики [3, 4, 31, 48].
(УУР - C, УДД - 5)
Вакцинопрофилактика
Вакцинация должна проводится в соответствии с Национальным календарем профилактических прививок и общими подходами к вакцинопрофилактике. БВ не является противопоказанием к проведению вакцинации [115, 116].
- Рекомендована вакцинация против гепатита A и гепатита B с целью предотвращения данных заболеваний, учитывая наличие поражений печени в рамках основной патологии [117].
(УУР - C, УДД - 5)
Комментарий: вакцинация проводится согласно инструкции по применению препарата.
- Рекомендована, при возможности, вакцинация против иных потенциально опасных для жизни интеркуррентных инфекций с целью предотвращения данных заболеваний, учитывая наличие поражений печени в рамках основной патологии [146].
(УУР - C, УДД - 5)
Комментарий: например, против ветряной оспы, пневмококковой инфекции [146].
5.2 Диспансерное наблюдение
- Рекомендовано в процессе комплексного лечения пациентов с БВ осуществлять контроль показателей общего (клинического) анализа крови развернутого, анализа крови биохимического общетерапевтического (определение активности аланинаминотрансферазы в крови, активности аспартатаминотрансферазы в крови, уровня общего билирубина в крови, уровень билирубина связанного (конъюгированного) в крови, липидограммы (исследование уровня холестерина в крови, исследование уровня липопротеинов в крови, исследование уровня холестерина липопротеинов низкой плотности, исследование уровня триглицеридов в крови), определение активности щелочной фосфатазы в крови, гамма-глютамилтрансферазы в крови, а также проведение коагулограммы (ориентировочного исследования системы гемостаза): определение протромбинового (тромбопластинового) времени в крови или в плазме и международного нормализованного отношения (МНО) не реже 1 раза в 6 - 12 месяцев в период ремиссии или чаще по показаниям [3, 4, 12, 31, 44, 100, 92].
(УУР - C, УДД - 4)
Комментарии: В среднем, контроль терапии проводят 2 р./мес на протяжении первого года терапии, далее - ежегодно [100, 92]. Исследование липидограммы более актуально для взрослых пациентов.
Контроль лечения детям проводится обычно чаще: в среднем 1 раз в неделю на этапе старта терапии (в первый месяц лечения) и в период повышения дозы пеницилламина**/триентина, далее лабораторные и инструментальные исследования проводятся каждые 1 - 3 месяца до наступления ремиссии, после - каждые 3 - 6 месяцев (возможно чаще по показаниям) [12].
- Всем пациентам с БВ рекомендуется в процессе комплексного лечения осуществлять определение уровня креатинина в крови, уровня мочевины в крови не реже 1 раза в 6 - 12 месяцев в период ремиссии или чаще по показаниям [93, 143, 144].
(УУР - B, УДД - 3)
- Всем пациентам с БВ рекомендовано в процессе комплексного лечения исследование уровня меди в моче не реже одного раза в 12 месяцев для контроля лечения (возможно чаще по показаниям) [3, 4, 12, 31, 44].
(УУР - C, УДД - 5)
- Рекомендовано пациентам с БВ проведение ультразвукового исследования (УЗИ) органов брюшной полости и почек (Ультразвуковое исследование органов брюшной полости (комплексное), Ультразвуковое исследование почек) каждые 6 - 12 месяцев, эластометрии печени каждые 1 - 2 года с целью оценки степени поражений и фиброзирования гепатобилиарной системы в период ремиссии (возможно чаще по показаниям) [46, 56, 57, 61, 62, 92, 93, 100, 118 - 121].
(УУР - C, УДД - 5)
Комментарии: с учетом модернизации аппаратуры, некоторые модификации приборов позволяют определять помимо стадии фиброза - степень стеатоза печени, что также актуально при БВ как метаболического заболевания.
- Пациентам с эпилептическим синдромом рекомендуется проведение рутинной электроэнцефалографии (ЭЭГ) с целью контроля лечения эпилептических приступов [102, 61].
(УУР - C, УДД - 5)
Комментарии: также может проводиться суточная электроэнцефалография с видеомониторингом.
- Пациентам с неврологической симптоматикой рекомендуется проведение магнитно-резонансной томографии (МРТ) головного мозга в динамике по показаниям с целью выявления патологических изменений в головном мозге [4, 60, 92, 100, 101].
(УУР - B, УДД - 3)
Комментарии: при необходимости проводится наркоз.
- Рекомендовано проведение электрокардиографии и эхокардиографии пациентам с БВ с целью выявления патологии со стороны сердца [100, 135].
(УУР - C, УДД - 4)
Комментарии: могут выявляться гипертрофия левого желудочка или обоих желудочков, ранняя реполяризация, депрессия сегмента ST, инверсия зубца T и различные аритмии.
- Рекомендовано всем пациентам диспансерный прием (осмотр, консультация) врача-офтальмолога ежегодно с осмотром при помощи щелевой лампы (Биомикроскопия глаза) для оценки состояния органа зрения [3, 4, 31, 44].
(УУР - C, УДД - 5)
- Рекомендован мультидисциплинарный подход к наблюдению и лечению пациентов с БВ специалистами разных профилей (врачом-педиатром, врачом-терапевтом, врачом общей практики (семейным врачом), врачом-генетиком, врачом-неврологом, врачом-офтальмологом, врачом-гастроэнтерологом, врачом-нефрологом, врачом-гематолог/врачом детским онкологом-гематологом, врачом-психиатром, врачом-пульмонологом, врачом-кардиологом, медицинским психологом, и другими по клинической необходимости) с целью обеспечения комплексной терапии и своевременной ее коррекции при необходимости [3].
(УУР - C, УДД - 5)
6. Организация оказания медицинской помощи
Пациентам с БВ, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Диагностика и терапия БВ у детей осуществляется на базе специализированных стационаров гастроэнтерологического (гепатологического) профиля с привлечением следующих специалистов: врач-гастроэнтеролог, врач-офтальмолог, врач-невролог, врач-психиатр, врач-нефролог, врач-гематолог/врач-детский онколог-гематолог, врач-хирург/врач-детский хирург, медицинский психолог и других при клинической необходимости.
Первичная диагностика и начало терапии у детей с БВ осуществляется на базе специализированного стационара с обязательной оценкой метаболизма меди, степени фиброзирования печеночной паренхимы и нарушения психоневрологических функций, с определением показаний для своевременного выполнения ортотопической трансплантации печени [3, 4, 31, 83, 85].
Консервативная терапия проводится на базе круглосуточного или дневного стационара с обязательным контролем лабораторных показателей и последующей преемственностью с амбулаторным звеном здравоохранения.
Специализированное наблюдение осуществляется 1 - 2 раза в год на базе круглосуточного стационара или на базе дневного стационара с амбулаторным наблюдением пациентов по месту жительства врачей специалистов: врача-педиатра/врача-терапевта/врача общей практики (семейного врача) и врача-гастроэнтеролога при печеночной и смешанной формах заболевания, врача-невролога и медицинского психолога при смешанной форме БВ.
Первичная диагностика, начало терапии и наблюдение у взрослых пациентов с БВ осуществляется на базе специализированных амбулаторных или стационарных отделений гастроэнтерологического (гепатологического) и (или) неврологического профиля.
Рекомендуется регулярное амбулаторное наблюдение за пациентами (поликлинический прием или дневной стационар) с госпитализацией в специализированную клинику (круглосуточное отделение) в случае развития осложнений заболевания.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
7.1 Исходы и прогноз
БВ является прогрессирующим заболеванием и при отсутствии своевременно начатой терапии пациенты умирают от осложнений цирроза печени и (или) реже от прогрессирующей неврологической симптоматики. При эффективности хелатной терапии или успешном проведении трансплантации печени прогноз заболевания благоприятный.
Прогноз при БВ связан со степенью декомпенсации печеночных функций, тяжестью неврологической симптоматики и приверженностью терапии. Нормализация печеночных функций происходит на 1 - 2 году терапии и не прогрессирует при полном выполнении всех рекомендаций. Консервативная терапия неэффективна при фульминантном течении заболевания. Был разработан прогностический индекс БВ (Dhawan et al.), согласно которому оценка свыше 11 баллов связана с высокой вероятностью летального исхода при отсутствии срочной ортотопической трансплантации печени (Приложение Г2) [47, 86].
Неврологическая симптоматика БВ лишь частично обратима при терапии хелаторами и проведении трансплантации печени, что связано с необратимым поражением головного мозга токсическими концентрациями меди.
Критерии оценки качества медицинской помощи
Критерии оценки качества первичной медико-санитарной помощи взрослым и детям при нарушении обмена меди (болезни Вильсона) (коды по МКБ-10: E83.0)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнено исследование уровня церулоплазмина в крови (при установлении диагноза пациентам старше 1 года)
Да/Нет
2.
Выполнено исследование уровня меди в моче
Да/Нет
3.
Выполнен общий (клинический) анализ крови развернутый
Да/Нет
4.
Выполнен анализ крови биохимический общетерапевтический (аланинаминотрансфераза, аспартатаминотрансфераза, общий билирубин, билирубин связанный (конъюгированный), холестерин, щелочная фосфатаза, гамма-глютамилтрансфераза, креатинин, мочевина, общий белок, альбумин)
Да/Нет
5.
Выполнена коагулограмма (ориентировочное исследование системы гемостаза) (определение протромбинового (тромбопластинового) времени в крови или в плазме, определение международного нормализованного отношения (МНО))
Да/Нет
6.
Выполнено ультразвуковое исследование органов брюшной полости (комплексное)
Да/Нет
7.
Выполнен прием (осмотр, консультация) врача-невролога первичный
Да/Нет
8.
Выполнен прием (осмотр, консультация) врача-генетика первичный (при установлении диагноза)
Да/Нет
9.
Выполнено назначение пеницилламина** и/или цинка сульфата (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
Да/Нет
10.
Выполнено назначение элиминационной диеты (ЭД) - ограничение употребления продуктов, богатых медью
Да/Нет
Критерии оценки качества специализированной помощи взрослым и детям при нарушении обмена меди (болезни Вильсона) (коды по МКБ-10: E83.0)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнено исследование уровня церулоплазмина в крови (при установлении диагноза пациентам старше 1 года)
Да/Нет
2.
Выполнено исследование уровня меди в моче
Да/Нет
3.
Выполнен общий (клинический) анализ крови развернутый
Да/Нет
4.
Выполнен анализ крови биохимический общетерапевтический (аланинаминотрансфераза, аспартатаминотрансфераза, общий билирубин, билирубин связанный (конъюгированный), холестерин, щелочная фосфатаза, гамма-глютамилтрансфераза, креатинин, мочевина, общий белок, альбумин)
Да/Нет
5.
Выполнена коагулограмма (ориентировочное исследование системы гемостаза) (определение протромбинового (тромбопластинового) времени в крови или в плазме, определение международного нормализованного отношения (МНО))
Да/Нет
6.
Выполнено ультразвуковое исследование органов брюшной полости (комплексное)
Да/Нет
7.
Выполнена магнитно-резонансная томография головного мозга (при наличии неврологических симптомов)
Да/Нет
8.
Выполнено назначение элиминационной диеты (ЭД) - ограничение употребления продуктов, богатых медью
Да/Нет
Список литературы
1. Orphanet website (дата посещения 28.03.2021) URL:https://www.orpha.net/consor/cgi-bin/Disease_Search.php?lng=EN&data_id=134
2. Sturm E., Piersma F.E., Tanner M.S. et al. Controversies and Variation in Diagnosing and Treating Children With Wilson Disease: Results of an International Survey. J Pediatr Gastroenterol Nutr. 2016; 63 (1): 82-7.
3. European Association for Study of Liver. EASL Clinical Practice Guidelines: Wilson"s disease. J Hepatol. 2012; 56 (3): 671-85.
4. Roberts E.A., Schilsky M.L. Diagnosis and treatment of Wilson disease: an update. Hepatology. 2008; 47 (6): 2089-111.
5. Четкина Т.С., Потапов А.С., Цирульникова О.М. и др. Болезнь Вильсона у детей: варианты манифестации и трудности ранней диагностики. Вопросы диагностики в педиатрии. 2011; 3 (1): 41 - 47.
6. Четкина Т.С. Болезнь Вильсона у детей. Автореф. дисс.... канд. мед. Наук. 2011. 24 с.
7. Голованова Е.В., Лазебник Л.Б., Конев Ю.В. и др. Болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия, гепатолентикулярная дегенерация): диагностика, лечение и диспансерное наблюдение. Экспериментальная и клиническая гастроэнтерология. 2015; 7 (119): 108 - 111.
8. Соколов А.А., Дембровский В.Н., Красильникова Е.Ю. Оказание медицинской помощи и лекарственное обеспечения пациентов, страдающих жизнеугрожающими и хроническими прогрессирующими редкими заболеваниями. Болезнь Вильсона (гепатолентикулярная дегенерация). Проблемы стандартизации в здравоохранении. 2015; 5 - 6: 30 - 35.
9. Корой П.В. Болезнь Вильсона. Часть I: этиология, патогенез, клинические проявления и скрининг. Вестник молодого ученого. 2014; 7 (3 - 4): 56 - 63.
10. Корой П.В. Болезнь Вильсона. Часть II: диагностические тесты, диагностика в специфических популяциях. Вестник молодого ученого. 2015; 8 (1): 21 - 30.
11. Корой П.В. Болезнь Вильсона. Часть III: общие принципы терапии, лечение в специальных ситуациях, мониторинг терапии и прогноз. Вестник молодого ученого. 2015; 9 (2): 35 - 44.
12. Saroli Palumbo C., Schilsky M.L. Clinical practice guidelines in Wilson disease. Ann Transl Med. 2019 Apr; 7 (Suppl 2): S65.
13. Kumar M., Gaharwar U., Paul S. et al. WilsonGen a comprehensive clinically annotated genomic variant resource for Wilson"s Disease. Sci Rep. 2020 Jun 3; 10(1): 9037.
14. Балашова М.С., Соловьева О.В., Фастовец С.В. и др. Клиническая ценность секвенирования гена ATP7B в диагностике болезни Вильсона-Коновалова. Медицинская генетика. 2016; 15 (7): 14 - 16.
15. Ferenci P. Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing. Hum Genet. 2006 Sep; 120(2): 151-9.
16. Гернер Е.А., Назаров В.Д., Федорова Т.Ф. и др. Клинико-лабораторная и молекулярно-генетическая диагностика болезни Вильсона-Коновалова. Российский неврологический журнал. 2019; 24(3): 10 - 18
17. Баязутдинова Г.М., Щагина О.А., Поляков А.В. Мутация с. 3207C>A гена ATP7B - наиболее частая причина гепатолентикулярной дегенерации в России: частота и причина распространения. Медицинская генетика. 2018; 17(4): 25 - 30.
18. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. Методические рекомендации МР 2.3.1.2432-08
19. Scheiber I.F., Bruha R., Dusek P. Pathogenesis of Wilson disease. Handb Clin Neurol. 2017; 142: 43 - 55.
20. Coffey A.J., Durkie M., Hague S. et al. A genetic study of Wilson"s disease in the United Kingdom. Brain. 2013 May; 136 (Pt 5): 1476-87.
21. Bandmann O., Weiss K.H., Kaler S.G. Wilson"s disease and other neurological copper disorders. Lancet Neurol. 2015 Jan; 14(1): 103-13.
22. Scheinberg I.H., Sternlieb I. Wilson"s disease. In: Smith LH, ed. Major problems in internal medicine. Vol 23. Philadelphia: WB Saunders, 1984.
23. Park R.H., McCabe P., Fell G.S. et al. Wilson"s disease in Scotland. Gut. 1991 Dec; 32(12): 1541-5.
24. Hahn S.H., Lee S.Y., Jang Y.J. et al. Pilot study of mass screening for Wilson"s disease in Korea. Mol Genet Metab. 2002 Jun; 76(2): 133-6.
25. Красильникова Е.Ю., Соколов А.А. Анализ ситуации в сфере оказания медицинской помощи и лекарственного обеспечения пациентов, страдающих редкими заболеваниями, в период 2013 - 2015 годов. Проблемы стандартизации в здравоохранении. 2016; 3 - 4
26. Ferenci P., Caca K., Loudianos G. et al. Diagnosis and phenotypic classification of Wilson disease. Liver Int. 2003 Jun; 23(3): 139-42.
27. Коновалов Н.В. Гепатолентикулярная дистрофия. M., 1960. 556 с.
28. Hermann W. Classification and differential diagnosis of Wilson"s disease. Ann Transl Med. 2019 Apr; 7 (Suppl 2): S63.
29. Lin L.J., Wang D.X., Ding N.N. et al. Comprehensive analysis on clinical features of Wilson's disease: an experience over 28 years with 133 cases. Neurol Res 2014; 36: 157-63.
30. Wilson D.C., Phillips M.J., Cox D.W. et al. Severe hepatic Wilson"s disease in preschool-aged children. J Pediatr. 2000 Nov; 137(5): 719-22.
31. Socha P., Janczyk W., Dhawan A. et al. Wilson"s Disease in Children: A Position Paper by the Hepatology Committee of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr. 2018 Feb; 66(2): 334 - 344.
32. Machado A., Chien H.F., Deguti M.M., et al. Neurological manifestations in Wilson"s disease: Report of 119 cases. Mov Disord. 2006 Dec; 21(12): 2192-6.
33. Abdel Ghaffar T.Y., Elsayed S.M., Elnaghy S., et al. Phenotypic and genetic characterization of a cohort of pediatric Wilson disease patients. BMC Pediatr. 2011 Jun 17; 11: 56.
34. Lorincz M.T. Neurologic Wilson"s disease. Ann N Y Acad Sci. 2010 Jan; 1184: 173-87.
35. Azizi E., Eshel G., Aladjem M. Hypercalciuria and nephrolithiasis as a presenting sign in Wilson disease. Eur J Pediatr 1989; 148: 548 - 549.
36. Chu C.C., Huang C.C., Chu N.S. Recurrent hypokalemic muscle weakness as an initial manifestation of Wilson's disease. Nephron 1996; 73: 477 - 479.
37. Golding D.N., Walshe J.M. Arthropathy of Wilson's disease. Study of clinical and radiological features in 32 patients. Ann Rheum Dis 1977; 36: 99 - 111.
38. Hlubocka Z., Maracek Z., Linhart A. et al. Cardiac involvement in Wilson disease. J Inherit Metab Dis 2002; 25: 269 - 277.
39. Sanchez-Albisua I., Garde T., Hierro L. et al. A high index of suspicion: the key to an early diagnosis of Wilson's disease in childhood. J Pediatr Gastroenterol Nutr 1999; 28: 186 - 190.
40. Merle U., Schaefer M., Ferenci P., et al. Clinical presentation, diagnosis and long-term outcome of Wilson's disease: a cohort study. Gut 2007; 56: 115-20.
41. Tauber J., Steinert R.F. Pseudo-Kayser-Fleischer ring of the cornea associated with non-Wilsonian liver disease. A case report and literature review. Cornea 1993; 12: 74 - 77.
42. Dunn L.L., Annable W.L., Kliegman R.M. Pigmented corneal rings in neonates with liver disease. J Pediatr 1987; 110: 771 - 776
43. Walshe J.M. The acute haemolytic syndrome in Wilson's disease-a review of 22 patients. QJM 2013; 106: 1003-8.
44. Pfeiffer R.F. Wilson Disease. Continuum (Minneap Minn). 2016 Aug; 22 (4 Movement Disorders): 1246-61.
45. Schilsky M.L. Wilson Disease: Diagnosis, Treatment, and Follow-up. Clin Liver Dis. 2017 Nov; 21(4): 755 - 767.
46. Sallie R., Katsiyiannakis L., Baldwin D., et al. Failure of simple biochemical indexes to reliably differentiate fulminant Wilson's disease from other causes of fulminant liver failure. Hepatology 1992; 16: 1206-11.
47. Nazer H., Ede R.J., Mowat A.P., Williams R. Wilson's disease: clinical presentation and use of prognostic index. Gut 1986; 27: 1377 - 1381.
48. Ryan A., Nevitt S.J., Tuohy O., Cook P. Biomarkers for diagnosis of Wilson"s disease. Cochrane Database Syst Rev. 2019 Nov 19; 2019(11): CD012267.
49. Gong A., Leitold S., Uhanova J., Minuk GY. Non-Wilson"s Disease-Associated Hypoceruloplasminemia. J Clin Exp Hepatol. 2020 Jul-Aug; 10(4): 284 - 289
50. Gromadzka G., Schmidt H.H., Genschel J., et al. Frameshift and nonsense mutations in the gene for ATPase7B are associated with severe impairment of copper metabolism and with an early clinical manifestation of Wilson's disease. Clin Genet 2005; 68: 524-32.
51. Merle U., Eisenbach C., Weiss K.H., et al. Serum ceruloplasmin oxidase activity is a sensitive and highly specific diagnostic marker for Wilson's disease. J Hepatol 2009; 51: 925-30.
52. Kelly J., Raizman J.E., Bevilacqua V., et al. Complex reference value distributions and partitioned reference intervals across the pediatric age range for 14 specialized biochemical markers in the CALIPER cohort of healthy community children and adolescents. Clin Chim Acta 2015; 450: 196 - 202.
53. Giacchino R., Marazzi M.G., Barabino A. et al. Syndromic variability of Wilson"s disease in children. Clinical study of 44 cases. Ital J Gastroenterol Hepatol. 1997 Apr; 29(2): 155-61.
54. Nicastro E., Ranucci G., Vajro P., et al. Re-evaluation of the diagnostic criteria for Wilson disease in children with mild liver disease. Hepatology 2010; 52: 1948-56.
55. Muller T., Koppikar S., Taylor R.M. et al. Re-evaluation of the penicillamine challenge test in the diagnosis of Wilson"s disease in children. J Hepatol. 2007 Aug; 47(2): 270-6.
56. Ивлева С.А., Дворяковская Г.М., Четкина Т.С. и др. Диагностика фиброза печени у детей с болезнью Вильсона. Российский педиатрический журнал. 2014; 17 (3): 9 - 16.
57. Poujois A., Woimant F. Wilson"s disease: A 2017 update. Clin Res Hepatol Gastroenterol. 2018 Dec; 42(6): 512 - 520.
58. Paternostro R., Pfeiffenberger J., Ferenci P. et al. Non-invasive diagnosis of cirrhosis and long-term disease monitoring by transient elastography in patients with Wilson disease. Liver International. 2020; 40: 894 - 904.
59. Karlas T., Hempel M., Troltzsch M. et al. Non-invasive evaluation of hepatic manifestation in Wilson disease with transient elastography, ARFI, and different fibrosis scores. Scand J Gastroenterol. 2012 Nov; 47(11): 1353-61
60. van Wassenaer-van Hall H.N., van den Heuvel A.G., Algra A. et al. Wilson disease: findings at MR imaging and CT of the brain with clinical correlation. Radiology. 1996 Feb; 198(2): 531-6.
61. Czlonkowska A., Litwin T., Chabik G. Wilson disease: neurologic features. Handb Clin Neurol. 2017; 142: 101 - 119.
62. Pandey N., John S. Kayser-Fleischer Ring. 2020 Aug 11. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. PMID: 29083643.
63. Ferenci P., Steindl-Munda P., Vogel W. et al. Diagnostic value of quantitative hepatic copper determination in patients with Wilson"s Disease. Clin Gastroenterol Hepatol. 2005 Aug; 3(8): 811-8.
64. Liggi M., Mais C., Demurtas M. et al. Uneven distribution of hepatic copper concentration and diagnostic value of double-sample biopsy in Wilson"s disease. Scand J Gastroenterol. 2013 Dec; 48(12): 1452-8.
65. Yang X., Tang X.P., Zhang Y.H. Et al. Prospective evaluation of the diagnostic accuracy of hepatic copper content, as determined using the entire core of a liver biopsy sample. Hepatology. 2015 Dec; 62(6): 1731-41.
66. Johncilla M., Mitchell K.A. Pathology of the liver in copper overload. Semin Liver Dis. 2011 Aug; 31(3): 239-44.
67. Волынец Г.В., Евлюхина Н.Н., Потапов А.С. и др. Взаимосвязь степени нарушения функции печени и ее морфологических изменений при болезни Вильсона у детей. Экспериментальная и клиническая гастроэнтерология. 2015; 5 (117): 82.
68. Сурков А.Н., Потапов А.С., Туманова Е.Л. и др. Гистопатологические изменения печени при болезни Вильсона у детей. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2009; 19 (1) s33: 69.
69. Lau J.Y., Lai C.L., Wu P.C. et al. Wilson's disease: 35 years experience. Q J Med. 1990 Jun; 75(278): 597 - 605.
70. Czlonkowska A., Gajda J., Rodo M. et al. Effects of long-term treatment in Wilson's disease with D-penicillamine and zinc sulphate. J Neurol. 1996 Mar; 243(3): 269-73.
71. Weiss K.H., Thurik F., Gotthardt D.N. et al. Efficacy and safety of oral chelators in treatment of patients with Wilson disease. Clin Gastroenterol Hepatol. 2013 Aug; 11(8): 1028-35. e1 - 2.
72. Czlonkowska A., Litwin T., Dusek P. et al. Nature Reviews disease primers article: Wilson disease. 2019 Mar; Nat Rev Dis Primers.; 4(1): 21.
73. Yuzbasiyan-Gurkan V., Grider A., Nostrant T. et al. Treatment of Wilson's disease with zinc: X. Intestinal metallothionein induction. J Lab Clin Med. 1992 Sep; 120(3): 380-6.
74. Sturniolo G.C., Mestriner C., Irato P. et al. Zinc therapy increases duodenal concentrations of metallothionein and iron in Wilson's disease patients. Am J Gastroenterol. 1999 Feb; 94(2): 334-8.
75. Brewer G.J., Dick R.D., Johnson V.D. et al. Treatment of Wilson's disease with zinc: XV Long-term follow-up studies. J Lab Clin Med 1998; 132: 264 - 278.
76. Eda K., Mizuochi T., Iwama I., Inui A., Etani Y., Araki M., Hara S., Kumagai H., Hagiwara S.I., Murayama K., Murakami J., Shimizu N., Kodama H., Yasuda R., Takaki Y., Yamashita Y. Zinc monotherapy for young children with presymptomatic Wilson disease: A multicenter study in Japan. J Gastroenterol Hepatol. 2018 Jan; 33(1): 264 - 269.
77. Brewer G.J., Dick R.D., Johnson V.D. et al. Treatment of Wilson's disease with zinc XVI: Treatment during the pediatric years. J Lab Clin Med 2001; 137: 191 - 198.
78. Wiernicka A., Janczyk W., Dadalski M., Avsar Y., Schmidt H., Socha P. Gastrointestinal side effects in children with Wilson"s disease treated with zinc sulphate. World J Gastroenterol. 2013 Jul 21; 19(27): 4356-62.
79. Mizuochi T., Kimura A., Shimizu N., et al. Zinc monotherapy from time of diagnosis for young pediatric patients with presymptomatic Wilson disease. J Pediatr Gastroenterol Nutr 2011; 53: 365-7.
80. Ranucci G., Di Dato F., Spagnuolo M.I., et al. Zinc monotherapy is effective inWilson's disease patients with mild liver disease diagnosed in childhood: a retrospective study. Orphanet J Rare Dis 2014; 9: 41.
81. Abuduxikuer K., Wang J.S. Zinc mono-therapy in pre-symptomatic Chinese children with Wilson disease: a single center, retrospective study. PLoS One 2014; 9: e86168.
82. Marcellini M., Di Ciommo V., Callea F., et al. Treatment of Wilson's disease with zinc from the time of diagnosis in pediatric patients: a single-hospital, 10-year follow-up study. J Lab Clin Med 2005; 145: 139-43.
83. Ahmad, A., Torrazza-Perez, E. & Schilsky, M.L. Liver transplantation for Wilson disease. Handb Clin. Neurol. 142, 193 - 204 (2017).
84. Michael L Schilsky. Wilson disease: Treatment and prognosis. UpToDate, last updated: Oct 14, 2020.
85. Weiss, K.H. et al. Outcome and development of symptoms after orthotopic liver transplantation for Wilson disease. Clin. Transplant. 27, 914 - 922 (2013).
86. Dhawan A., Taylor R.M., Cheeseman P. et al. Wilson's disease in children: 37-year experience and revised King's score for liver transplantation. Liver Transplant 2005; 11: 441 - 448.
87. Rachel M Taylor, Yuan Chen, Anil Dhawan, EuroWilson Consortium. Triethylene tetramine dihydrochloride (trientine) in children with Wilson disease: experience at King"s College Hospital and review of the literature/(Eur J Pediatr. 2009 Sep; 168(9): 1061-8
88. http://www.hgmd.cf.ac.uk/ac/gene.php?gene=ATP7B
89. Dusek P., Litwin T., Czlonkowska A. Neurologic impairment in Wilson disease. Ann Transl Med. 2019; 7 (Suppl 2): S64. doi: 10.21037/atm.2019.02.43
90. Czlonkowska A., Litwin T., Chabik G. Wilson disease: neurologic features. Handb Clin Neurol 2017; 142: 101-19.10.1016/B978-0-444-63625-6.00010-0
91. Kwo P.Y., Cohen S.M., Lim J.K. ACG Clinical Guideline: Evaluation of Abnormal Liver Chemistries. Am J Gastroenterol. 2017 Jan; 112(1): 18 - 35
92. Wilson disease: Clinical manifestations, diagnosis, and natural history (https://www.uptodate.com/contents/wilson-disease-clinical-manifestations-diagnosis-and-natural-history?search=wilson%20disease&source=search_result&selectedTitle=1%7E150&usage_type=default&display_rank=1#H65234579), last updated: Jul 31, 2023
93. Wang H., Zhou Z., Hu J., Han Y., Wang X., Cheng N., Wu Y., Yang R. Renal impairment in different phenotypes of Wilson disease. Neurol Sci. 2015 Nov; 36(11): 2111-5
94. Gungor S., Selimoglu M.A., Varol F. Nutritional assessment of children with Wilson"s disease: single center experience. Turk Pediatri Ars. 2019 Dec 25; 54(4): 246 - 255
95. Gaffney D., Fell G.S., O"Reilly D.S. ACP Best Practice No 163. Wilson"s disease: acute and presymptomatic laboratory diagnosis and monitoring. J Clin Pathol. 2000 Nov; 53(11): 807-12. doi: 10.1136/jcp.53.11.807
96. Вялова Н.В. "Клинические и молекулярно-генетические особенности гепатолентикулярной дегенерации, оптимизация диагностики и динамического наблюдения", диссертация, 2021 г.
97. Бикбавова Г.Р., Хомутова Е.Ю, Третьякова Т.В., и др "Диагностические особенности семейного случая Болезни Вильсона-Коновалова" - "Трудный пациент". - 2017 - N 4-5 - т. 15. - с. 32 - 35
98. EASL Clinical Practice Guidelines: Autoimmune hepatitis. J Hepatol 2015; 63: 971 - 1004. 20
99. Costa da M., Spitz M., Bacheszhi L., et al. Correlation to pretreatment and posttreatment brain MRI//Neuroradiology.-2009.-Vol.21. - P. 627 - 633
100. Gilroy Richard K. Wilson Disease. Updated: Feb 14, 2019 (https://emedicine.medscape.com/article/183456-overview)
101. Tinaz S., Arora J., Nalamada K., Vives-Rodriguez A., Sezgin M., Robakis D., Patel A., Constable R.T., Schilsky M.L. Structural and functional brain changes in hepatic and neurological Wilson disease. Brain Imaging Behav. 2020 Nov 26
102. Prashanth L.K., Sinha S., Taly A.B., A Mahadevan, Vasudev M.K., Shankar S.K. Spectrum of epilepsy in Wilson"s disease with electroencephalographic, MR imaging and pathological correlates. J Neurol Sci. 2010 Apr 15; 291(1-2): 44 - 51. doi: 10.1016/j.jns.2010.01.007
103. Litwin T., Dusek P., Czlonkowska A. Neurological manifestations in Wilson's disease-possible treatment options for symptoms. Expert Opinion on Orphan Drugs 2016; 4: 719-28
104. Litwin T., Dusek P., Czlonkowska A. Symptomatic treatment of neurologic symptoms in Wilson disease. Handb Clin Neurol 2017; 142: 211-23
105. Holscher S., Leinweber B., Hefter H., et al. Evaluation of the symptomatic treatment of residual neurological symptoms in Wilson disease. Eur Neurol. 2010; 64(2): 83 - 87
106. Hedera P. Treatment of Wilson's disease motor complications with deep brain stimulation. Ann N Y Acad Sci. 2014; 1315: 16 - 23
107. Brewer G.J. Fink J.K. Hedera P. Diagnosis and treatment of Wilson"s disease.Semin Neurol. 1999; 19: 261 - 270
108. Reuner U., Dinger J. Pregnancy and Wilson disease: management and outcome of mother and newborns-experiences of a perinatal centre. Ann Transl Med. 2019 Apr; 7 (Suppl 2): S56
109. Teive H.A., Kluppel L.E., Munhoz R.P. Jaw-opening oromandibular dystonia secondary to Wilson"s disease treated with botulinum toxin type A. Arq Neuropsiquiatr. 2012; 70: 407 - 409
110. Lee S.Y., Yang H.E., Yang H.S. Neuromuscular electrical stimulation therapy for dysphagia caused by Wilson"s disease. Ann Rehabil Med. 2012; 36: 409 - 413
111. Rodriguez-Castro K., Hevia-Urrutia F., Sturniolo G. Wilson"s disease: A review of what we have learned. World Journal Of Hepatology [serial on the Internet]. (2015, Dec 18), [cited April 8, 2016]; 7(29): 2859 - 2870.
112. Wilson Disease Association (WDA) International [Internet]. Wilson Disease Association (WDA) International. [cited 2016 Mar 30]. Retrieved from: http://www.wilsonsdisease.org/
113. Brewer G., Askari F. Wilson"s disease: clinical management and therapy. Journal Of Hepatology [serial on the Internet]. (2005), [cited April 8, 2016]; 42 Suppl (1): S13 - S21.
114. van den Berg-Emons R., van Ginneken B., Nooijen C., Metselaar H., Tilanus H., Kazemier G. et al. Fatigue After Liver Transplantation: Effects of a Rehabilitation Program Including Exercise Training and Physical Activity Counseling. Physical Therapy. 2014; 94(6): 857 - 865
115. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок: Методические указания. - М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002. - 16 с.
116. "Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации" (утв. Минздравом России 12.04.2019)
117. Kathawala M., Hirschfield G.M. Insights into the management of Wilson"s disease. Therap Adv Gastroenterol. 2017 Nov; 10(11): 889 - 905, UpToDate.com
118. Przybylkowski A., Szeligowska J., Januszewicz M., Raszeja-Wyszomirska J., Szczepankiewicz B., Nehring P., Gornicka B., Litwin T., Czlonkowska A. Evaluation of liver fibrosis in patients with Wilson"s disease. Eur J Gastroenterol Hepatol. 2021 Apr 1; 33(4): 535 - 540
119. Stefanescu A.C., Pop T.L., Stefanescu H., Miu N. Transient elastography of the liver in children with Wilson"s disease: Preliminary results. J Clin Ultrasound. 2016 Feb; 44(2): 65 - 71
120. Hoppe B., Neuhaus T., Superti-Furga A., Forster I., Leumann E. Hypercalciuria and nephrocalcinosis, a feature of Wilson"s disease. Nephron. 1993; 65(3): 460-2
121. Di Stefano V., Lionetti E., Rotolo N., La Rosa M., Leonardi S. Hypercalciuria and nephrocalcinosis as early feature of Wilson disease onset: description of a pediatric case and literature review. Hepat Mon. 2012 Aug; 12(8): e6233
122. Schaefer M. et al. Coagulation Parameters in Wilson Disease//Journal of Gastrointestinal & Liver Diseases. - 2015. - Т. 24. - N. 2.
123. Doering E.J., Savage R.A., Dittmer T.E. Hemolysis, coagulation defects, and fulminant hepatic failure as a presentation of Wilson"s disease//American Journal of Diseases of Children. - 1979. - Т. 133. - N. 4. - С. 440 - 441
124. Mak C.M., Lam C.W., Tam S. Diagnostic accuracy of serum ceruloplasmin in Wilson disease: determination of sensitivity and specificity by ROC curve analysis among ATP7B-genotyped subjects//Clinical chemistry. - 2008. - Т. 54. - N. 8. - С. 1356 - 1362
125. Yuce A. et al. Evaluation of diagnostic parameters of Wilson"s disease in childhood//Indian journal of gastroenterology: Official journal of the Indian Society of Gastroenterology. - 2003. - Т. 22. - N. 1. - С. 4 - 6.
126. Da Costa C.M. et al. Value of urinary copper excretion after penicillamine challenge in the diagnosis of Wilson"s disease//Hepatology. - 1992. - Т. 15. - N. 4. - С. 609 - 615.
127. Lopez-Sanroman A. et al. Stimulated urinary copper excretion in the diagnosis of Wilson"s disease//Gastroenterologia y hepatologia. - 2015. - Т. 38. - N. 7. - С. 467 - 467
128. Gromadzka G. et al. p. H1069Q mutation in ATP7B and biochemical parameters of copper metabolism and clinical manifestation of Wilson"s disease//Movement disorders. - 2006. - Т. 21. - N. 2. - С. 245 - 248.
129. Nemeth D. et al. Clinical use of next-generation sequencing in the diagnosis of Wilson's disease//Gastroenterology research and practice. - 2016. - Т. 2016.
130. Okada T. et al. Mutational analysis of ATP7B and genotype-phenotype correlation in Japanese with Wilson"s disease //Human mutation. - 2000. - Т. 15. - N. 5. - С. 454 - 462.
131. Roh J.K. et al. Initial and follow-up brain MRI findings and correlation with the clinical course in Wilson"s disease//Neurology. - 1994. - Т. 44. - N. 6. - С. 1064 - 1064.
132. Sinha S. et al. Sequential MRI changes in Wilson"s disease with de-coppering therapy: a study of 50 patients//The British journal of radiology. - 2007. - Т. 80. - N. 957. - С. 744 - 749.
133. Dening T.R., Berrios G. E., Walshe J. M. Wilson"s disease and epilepsy//Brain. - 1988. - Т. 111. - N. 5. - С. 1139 - 1155.
134. Meenakshi-Sundaram S. et al. Cardiac involvement in Wilson's disease-an electrocardiographic observation//JAPI. - 2004. - Т. 52.
135. Buksinska-Lisik M. et al. Cardiac assessment in Wilson's disease patients based on electrocardiography and echocardiography examination//Archives of medical science: AMS. - 2019. - Т. 15. - N. 4. - С. 857.
136. Karakurt C. et al. Strain and strain rate echocardiography in children with Wilson"s disease//Cardiovascular journal of Africa. - 2016. - Т. 27. - N. 5. - С. 307 - 314.
137. Appenzeller-Herzog C. et al. Comparative effectiveness of common therapies for Wilson disease: A systematic review and meta-analysis of controlled studies//Liver International. - 2019. - Т. 39. - N. 11. - С. 2136 - 2152.
138. Salivary Glands - New Approaches in Diagnostics and Treatment, 2019. eBook (PDF) ISBN: 978-1-83881-358-1.
139. Детская гепатология: [монография] / под ред. Б.С. Каганова" - книга автора Багаева М.Э.. Издано: (2009).
140. Kulkarni A., Sharma V.K. Wilson's disease. In: Quah SR, editor. International encyclopedia of public health, vol. 369. Amsterdam: Elsevier; 2016. p. 424-33. https://doi.org/10.1016/B978-0-12-803678-5.00495-1. 14 Mulligan & Bronstein
141. Cheung K.S., Seto W.K., Fung J., et al. Epidemiology and natural history of Wilson's disease in the Chinese: A territory-based study in Hong Kong between 2000 and 2016. World J Gastroenterol 2017; 23(43): 7716-26
142. Poujois A., Woimant F., Samson S., et al. Characteristics and prevalence of Wilson's disease: A 2013 observational population-based study in France. Clin Res Hepatol Gastroenterol 2018; 42(1): 57 - 63]
143. Gromadzka G., Wierzbicka D., Litwin T., Przyby kowski A. Difference in iron metabolism may partly explain sex-related variability in the manifestation of Wilson"s disease. J Trace Elem Med Biol. 2020 Dec; 62: 126637
144. Gromadzka G., Wierzbicka D., Litwin T., Przyby kowski A. Iron metabolism is disturbed and anti-copper treatment improves but does not normalize iron metabolism in Wilson"s disease. Biometals. 2021 Apr; 34(2): 407 - 414. doi: 10.1007/s10534-021-00289-x
145. Dusek P., Hofer T., Alexander J., Roos P.M., Aaseth J.O. Cerebral Iron Deposition in Neurodegeneration. Biomolecules. 2022 May 17; 12(5): 714
146. Schilsky M.L., Roberts E.A., Bronstein J.M., Dhawan A., Hamilton J.P., Rivard A.M., Washington M.K., Weiss K.H., Zimbrean P.C. A multidisciplinary approach to the diagnosis and management of Wilson disease: 2022 Practice Guidance on Wilson disease from the American Association for the Study of Liver Diseases. Hepatology. 2022 Dec 7. doi: 10.1002/hep.32801
147. Scheinberg I.H., Jaffe M.E., Sternlieb I. The use of trientine in preventing the effects of interrupting penicillamine therapy in Wilson"s disease. N Engl J Med. 1987; 317: 209-13, Saito H., Watanabe K., Sahara M., Mochizuki R., Edo K., Ohyama Y. Triethylene-tetramine (trien) therapy for Wilson"s disease. Tohoku J Exp Med. 1991; 164: 29 - 35
148. Taylor R.M., Chen Y., Dhawan A., on behalf of the EuroWilson Consortium. Triethylene tetramine dihydrochloride (trientine) in children with Wilson disease: experience at King"s College Hospital and review of the literature. Eur J Pediatr. 2009; 168: 1061-8
149. Mayr T., Ferenci P., Weiler M., Fichtner A., Mehrabi A., Hoffmann G.F., et al. Optimized trientine-dihydrochloride therapy in pediatric patients with Wilson disease: is weight-based dosing justified? J Pediatr Gastroenterol Nutr. 2021; 72: 115-22
150. Annu Aggarwal and Mohit Bhatt/Advances in Treatment of Wilson Disease/Tremor Other Hyperkinet Mov (N Y). 2018; 8: 525.
151. Rachel M. Taylor, Yuan Chen, Anil Dhawan, EuroWilson Consortium. Triethylene tetramine dihydrochloride (trientine) in children with Wilson disease: experience at King"s College Hospital and review of the literature/(Eur J Pediatr. 2009 Sep; 168(9): 1061-8
152. Неврология: справочник практ. врача / О.С. Левин, Д.Р. Штульман. - 12-е изд. - М.: МЕДпресс-информ, 2019. - 879 с.
153. Marino Z., Molera-Busoms C., Badenas C., Quintero-Bernabeu J., Torra M., Forns X., Artuch R. Benefits of using exchangeable copper and the ratio of exchangeable copper in a real-world cohort of patients with Wilson disease. J Inherit Metab Dis. 2023; 46(5): 982 - 991. doi: 10.1002/jimd.12639
154. Czlonkowska A., Litwin T., Dusek P., Ferenci P., Lutsenko S., Medici V., Rybakowski J.K., Weiss K.H., Schilsky M.L. Wilson disease. Nat Rev Dis Primers. 2018; 4(1): 21. doi: 10.1038/s41572-018-0018-3
155. Fernando M., van Mourik I., Wassmer E., Kelly D. Wilson disease in children and adolescents. Arch Dis Child. 2020; 105(5): 499 - 505. doi: 10.1136/archdischild-2018-315705
156. Kaplan J.H., Maryon E.B. How mammalian cells acquire copper: an essential but potentially toxic metal. Biophys J. 2016 Jan 5; 110(1): 7 - 13. doi: 10.1016/j.bpj.2015.11.025
157. Rochford G., Molphy Z., Kavanagh K., McCann M., Devereux M., Kellett A., et al. Cu(ii) phenanthroline-phenazine complexes dysregulate mitochondrial function and stimulate apoptosis. Metallomics 2020; 12: 65 - 78. doi: 10.1039/c9mt00187e
158. Shao J., Li M., Guo Z., Jin C., Zhang F., Ou C., et al. TPP-related mitochondrial targeting copper (II) complex induces p53-dependent apoptosis in hepatoma cells through ROS-mediated activation of Drp1. Cell Commun Signal 2019; 17: 149. doi: 10.1186/s12964-019-0468-6
159. Chanpong A., Dhawan A. Wilson disease in children and young adults - State of the art. Saudi J Gastroenterol. 2022; 28(1): 21 - 31. doi: 10.4103/sjg.sjg_501_21
160. Kerkar N., Rana A. Wilson Disease in Children. Clin Liver Dis. 2022; 26(3): 473 - 488. doi: 10.1016/j.cld.2022.03.008
161. Czlonkowska A., Litwin T., Chabik G. Wilson disease: neurologic features. Handb Clin Neurol. 2017; 142: 101 - 119. doi: 10.1016/B978-0-444-63625-6.00010-0
162. Zimbrean P.C., Schilsky M.L. Psychiatric aspects of Wilson disease: a review. Gen Hosp Psychiatry 2014; 36: 53 - 62
163. Litwin T., Dusek P., Szafranski T., et al. Psychiatric manifestations in Wilson's disease: possibilities and difficulties for treatment. Ther Adv Psychopharmacol 2018; 8: 199 - 211
164. Pfeiffenberger J., Beinhardt S., Gotthardt D.N., Haag N., Freissmuth C., Reuner U., Gauss A., Stremmel W., Schilsky M.L., Ferenci P., Weiss KH... Pregnancy in Wilson"s disease: Management and outcome. Hepatology. 2018; 67(4): 1261 - 1269. doi: 10.1002/hep.29490
165. Malik A., Khawaja A., Sheikh L. Wilson"s disease in pregnancy: Case series and review of literature. BMC Res Notes. 2013; 6: 421. doi: 10.1186/1756-0500-6-421
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Аверкина Наталья Анатольевна - к.м.н., врач-гастроэнтеролог, главный специалист ФГБУ "Центральный научно-исследовательский институт организации и информатизации здравоохранения" Минздрава России
Анисимова Инга Вадимовна - к.м.н., заведующая отделом организации медицинской помощи - врач-генетик ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
Багаева Мадлена Энверовна - к.м.н., старший научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетологии Клиники ФГБУН "ФИЦ питания и биотехнологии"
Баранов Александр Александрович - акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б. В. Петровского", профессор кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России
Батышева Татьяна Тимофеевна - д.м.н., профессор, главный внештатный детский специалист по медицинской реабилитации МЗ РФ, главный внештатный детский специалист по неврологии ДЗМ, директор ФГБУГБУЗ Научно-практический Центр Детской психоневрологии ДЗМ, заведующая кафедрой неврологии, физической и реабилитационной медицины детского возраста МИ ФНМО РУДН, заслуженный врач РФ
Быкова Ольга Владимировна - д.м.н., заведующий научно-исследовательским отделом ФГБУГБУЗ Научно-практический Центр Детской психоневрологии ДЗМ, профессор кафедры неврологии, физической и реабилитационной медицины детского возраста ФНМО МИ РУДН
Вашакмадзе Нато Джумберовна - д.м.н., руководитель отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б.В. Петровского", профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, член Союза педиатров России.
Волынец Галина Васильевна - д.м.н., заведующая отделом гастроэнтерологии НИКИ педиатрии и детской хирургии им. академика Ю.Е. Вельтищева ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава России, член общества детских гастроэнтерологов, гепатологов и нутрициологов
Гундобина Ольга Станиславовна - к.м.н., в.н.с., врач-гастроэнтеролог НИИ педиатрии и охраны здоровья детей ЦКБ РАН член Союза педиатров России
Дегтярева Анна Владимировна - д.м.н., профессор, врач высшей категории, заведующая отделом педиатрии, ФГБУ "НМИЦ акушерства, гинекологии и перинатологии им. академика В.И. Кулакова"
Журкова Наталия Вячеславовна - к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б.В. Петровского", член Союза педиатров России, член Ассоциации медицинских генетиков
Захарова Екатерина Юрьевна - д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
Иллариошкин Сергей Николаевич - д.м.н., проф., член-корреспондент РАН, руководитель отдела исследовании мозга, зам. директора по научной работе ФГБНУ "Научный центр неврологии"
Карасева Мария Сергеевна - врач-педиатр, научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б.В. Петровского"
Каркашадзе Георгий Арчилович - к.м.н., врач-невролог, руководитель отдела развития мозга в онтогенезе, формирования когнитивных функций и нейробиологии НИИ педиатрии и охраны здоровья детей ЦКБ РАН, член Союза педиатров России
Куцев Сергей Иванович - академик РАН, д.м.н., директор ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", президент Ассоциации медицинских генетиков
Лаврова Алла Евгеньевна - д.м.н., директор института педиатрии, заведующий педиатрическим отделением N 2, Университетская клиника ФГБОУ ВО "Приволжский исследовательский медицинский университет" МЗ РФ, отличник здравоохранения
Муртазина Айсылу Фанзировна - к.м.н., врач-невролог, врач функциональной диагностики, с.н.с. научно-консультативного отдела ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова"
Назаренко Людмила Павловна - профессор, д.м.н., заместитель директора по научной и лечебной работе, руководитель лаборатории наследственной патологии НИИ медицинской генетики, Томского НИМЦ РАН, член Ассоциации медицинских генетиков
Пашкова Ирина Евгеньевна - к.м.н., заведующая педиатрическим отделением ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова"
Намазова-Баранова Лейла Сеймуровна - академик РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б. В. Петровского", заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
Полякова Светлана Игоревна - д.м.н., профессор кафедры госпитальной педиатрии им. академика В.А. Таболина Педиатрического факультета Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, г. Москва
Потапов Александр Сергеевич - д.м.н., профессор, отделение гастроэнтерологии ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет)
Поляков Александр Владимирович - профессор, чл.-корр РАН, д.б.н., заведующий лабораторией ДНК-диагностики ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова"
Репина Светлана Афанасьевна - к.м.н., врач-генетик отдела организации медицинской помощи ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
Розина Тэя Павловна - к.м.н., доцент кафедры внутренних болезней ФФМ МГУ имени М.В. Ломоносова, доцент кафедры внутренних, профессиональных болезней и ревматологии Первого МГМУ имени И.М. Сеченова Минздрава России
Савостьянов Кирилл Викторович - д.б.н., начальник Медико-генетического центра, заведующий лабораторией медицинской геномики ФГАУ "НМИЦ здоровья детей" Минздрава России, профессор кафедры педиатрии и общественного здоровья ФГАУ "НМИЦ здоровья детей" Минздрава России, член ассоциации медицинских генетиков
Свиридова Валерия Валерьевна - врач-генетик отдела организации медицинской помощи ФГБНУ "Медико-генетический научный центр имени академика Н.П. Бочкова", м.н.с лаборатории мутагенеза ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова"
Сеитова Гульнара Наримановна - к.м.н., главный врач Медико-генетического центра (Генетической клиники) НИИ медицинской генетики, Томского НИМЦ РАН
Селиверстов Юрий Александрович - к.м.н., старший научный сотрудник ФГБНУ "Научный центр неврологии", член образовательного комитета Европейской секции International Parkinson and Movement Disorder Society, член научной панели по двигательным расстройствам Европейской академии неврологии (EAN)
Селимзянова Лилия Робертовна - к.м.н., заведующая отделом НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б.В. Петровского", доцент кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет), доцент кафедры факультетской педиатрии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Союза педиатров России
Скворцова Тамара Андреевна - к.м.н., главный внештатный детский специалист гастроэнтеролог Департамента здравоохранения г. Москва, руководитель Центра детской гастроэнтерологии и Центра ВЗК, заведующая отделением гастроэнтерологии ГБУЗ "Морозовская детская городская клиническая больница ДЗМ"
Смирнова Ольга Яковлевна - врач-генетик, старший научный сотрудник отдела стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б.В. Петровского"
Строкова Татьяна Викторовна - д.м.н., профессор РАН, заведующая отделением педиатрической гастроэнтерологии, гепатологии и диетерапии Клиники ФГБУН "ФИЦ питания и биотехнологии"
Субботин Дмитрий Михайлович - врач-генетик ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
Сурков Андрей Николаевич - д.м.н., заведующий отделением гастроэнтерологии для детей стационара для детей, заведующий отделом научных основ детской гастроэнтерологии, гепатологии и метаболических нарушений НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", профессор кафедры факультетской педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Союза педиатров России
Суханова Нателла Вахтанговна - руководитель аниридийного центра, научный сотрудник НИИ педиатрии и охраны здоровья детей ЦКБ РАН, врач офтальмолог, член ассоциации детских офтальмологов Российской Федерации, член Союза педиатров России
Тепаев Рустэм Фаридович - д.м.н. заведующий реанимацией и интенсивной терапии ФГАУ "Национальный медицинский исследовательский центр здоровья детей" Минздрава России, профессор кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет)
Федосеенко Марина Владиславовна - к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им акад. Б. В. Петровского", доцент кафедры факультетской педиатрии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Союза педиатров России
Хавкин Анатолий Ильич - д.м.н., главный научный сотрудник отдела гастроэнтерологии ОСП Научно-исследовательского клинического института педиатрии им. академика Ю.Е. Вельтищева ФГАОУ ВО Российский национальный исследовательский медицинский университет им. Н.И. Пирогова Минздрава России, Председатель общества детских гастроэнтерологов, гепатологов и нутрициологов
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Клинические рекомендации созданы на основании современных международных клинических рекомендаций по диагностике, лечению и ведению пациентов с болезнью Вильсона.
Болезнь Вильсона относится к редким наследственным заболеваниям, что исключает возможность проведения больших когортных и рандомизированных контролируемых исследований и для создания протоколов диагностики и терапии используются лишь тематические исследования экспертов, опубликованные в последние два десятилетия.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гастроэнтерологи
2. Врачи-педиатры
3. Врачи-неврологи
4. Врачи общей врачебной практики (семейные врачи)
5. Врачи-терапевты
6. Врачи-генетики
7. Врачи ультразвуковой диагностики
8. Врачи-лаборанты
9. Врачи-патологоанатомы
10. Студенты медицинских ВУЗов
11. Обучающиеся в ординатуре и интернатуре
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
СВЯЗАННЫЕ ДОКУМЕНТЫ
Порядки оказания медицинской помощи:
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н "Об утверждении Порядка оказания педиатрической помощи"
Приказ Министерства здравоохранения РФ "Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями" от 15 ноября 2012 г. N 917н
Прочие документы, на основании которых разработаны клинические рекомендации
1. Приказ Министерства здравоохранения Российской Федерации от 14 января 2019 г. N 4н "Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения"
2. Распоряжение Правительства РФ от 31 декабря 2018 г. N 3053-р "Об утверждении перечней медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи и отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг"
3. Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ-10);
4. Приказ МЗ РФ от 20 декабря 2012 г. N 1183н "Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников".
5. Приказ МЗ РФ от 23 июля 2010 г. N 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
6. Федеральный закон от 25.12.2018 N 489 489-ФЗ "О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций".
7. Приказ Минздрава России N 103н от 28.02.2019 г. "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации".
8. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг".
9. Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. N 585н "О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы".
10. Приказ Министерства здравоохранения и социального развития Российской Федерации "О порядке применения лекарственных средств у больных по жизненным показаниям" от 9 августа 2005 г. N 494
11. Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil-informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po-torgovomu-naimenovaniyu);
Информация о лекарственных средствах: https://grls.rosminzdrav.ru/
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи
1. Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 N 18-ФЗ.
2. Приказ Минздрава России N 345н, Минтруда России от 31.05.2019 N 372н "Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья".
3. Приказ Минздрава России N 348н от 31 мая 2019 года "Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому".
4. Приказ Минздрава России N 505н от 10 июля 2019 года "Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи".
5. Приказ МЗ РФ N 831 от 3 октября 2019 года "Об утверждении ведомственной целевой программы "Развитие системы оказания паллиативной медицинской помощи".
Примеры диагнозов:
- Болезнь Вильсона, печеночная форма. Цирроз печени.
- Болезнь Вильсона, смешанная форма, ригидно-аритмогиперкинетическая форма. Цирроз печени.
Приложение А3.2
КЛИНИЧЕСКИЕ ПРИЗНАКИ БВ
Клинические признаки болезни Вильсона
Проявления
Поражение печени
- Гепатомегалия
- Повышение активности печеночных трансаминаз
- Стеатогепатит
- Фульминантный гепатит
- Острая печеночная недостаточность с гемолизом
- Портальная гипертензия: варикозные вены пищевода, спленомегалия, тромбоцитопения
- Цирроз печени
Поражение ЦНС
- Двигательные нарушения (тремор, дистония, паркинсонизм, хорея, атаксия)
- Слюнотечение
- Дизартрия
- Дисфагия
- Дистонические приступы
Псевдобульбарный синдром
Психиатрические симптомы
- Депрессия
- Тревожные расстройства
- Расторможенное поведение
- Когнитивные нарушения
- Изменения личности
- Психоз
Поражение других систем
- Офтальмология: кольца Кайзера-Флейшера, "медная" катаракта
- Гемолитическая анемия
- Дерматологические проявления: голубое окрашивание ногтевых лунок, гиперпигментация кожи ног
- Патология почек: аминоацидурия, нефролитиаз
- Патология скелета: ранний остеопороз, артропатия
- Поражение сердца: кардиомиопатия, нарушения ритма
- Панкреатит, желчнокаменная болезнь
- Гипопаратиреоз, гигантизм
- Нарушение менструального цикла, бесплодие, повторные выкидыши
Приложение А3.3
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ БВ (ПРИЧИНЫ
ЛОЖНООТРИЦАТЕЛЬНЫХ И ЛОЖНОПОЛОЖИТЕЛЬНЫХ РЕЗУЛЬТАТОВ)
Тест
Изменения при болезни Вильсона
Причины ложноположительных результатов
Причины ложноотрицательных результатов
Исследование уровня церулоплазмина в крови
Менее 20 мг/дл
Болезнь Менкеса, печеночная недостаточность, мальабсорбция, длительное парентеральное питание, гетерозиготное носительство патогенных вариантов в ATP7B, ацерулоплазминемия, нефротический синдром, детский возраст менее 2 лет
Острое воспаление, гиперэстрогенемия, беременность, опухоли
Кольца Кайзера-Флейшера
Присутствуют
Хронические холестатические заболевания печени, неонатальный холестаз
Ранние стадии болезни Вильсона, печеночные формы болезни Вильсона
Исследование уровня меди в моче
Более 50 мкг/сут
Хронический активный гепатит, хронические холестатические заболевания печени, загрязнение медью пробы мочи или тары извне
Бессимптомное течение болезни Вильсона, ранние стадии болезни Вильсона, хелатирующая терапия
Исследование уровня меди в моче на фоне пеницилламина**
(500 мг x 2 раза)
Более 1600 мкг/сут
Количественное содержание меди в ткани печени
Более 250 мкг/г
Внутрипеченочный холестаз,
Частичная билиарная атрезия, ПБЦ, ПСХ
Индийский детский цирроз
Идиопатический токсикоз медью
Хелатирующая терапия, недостаточный образец печеночной ткани
Приложение А3.4
ДИЕТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПРИ БВ
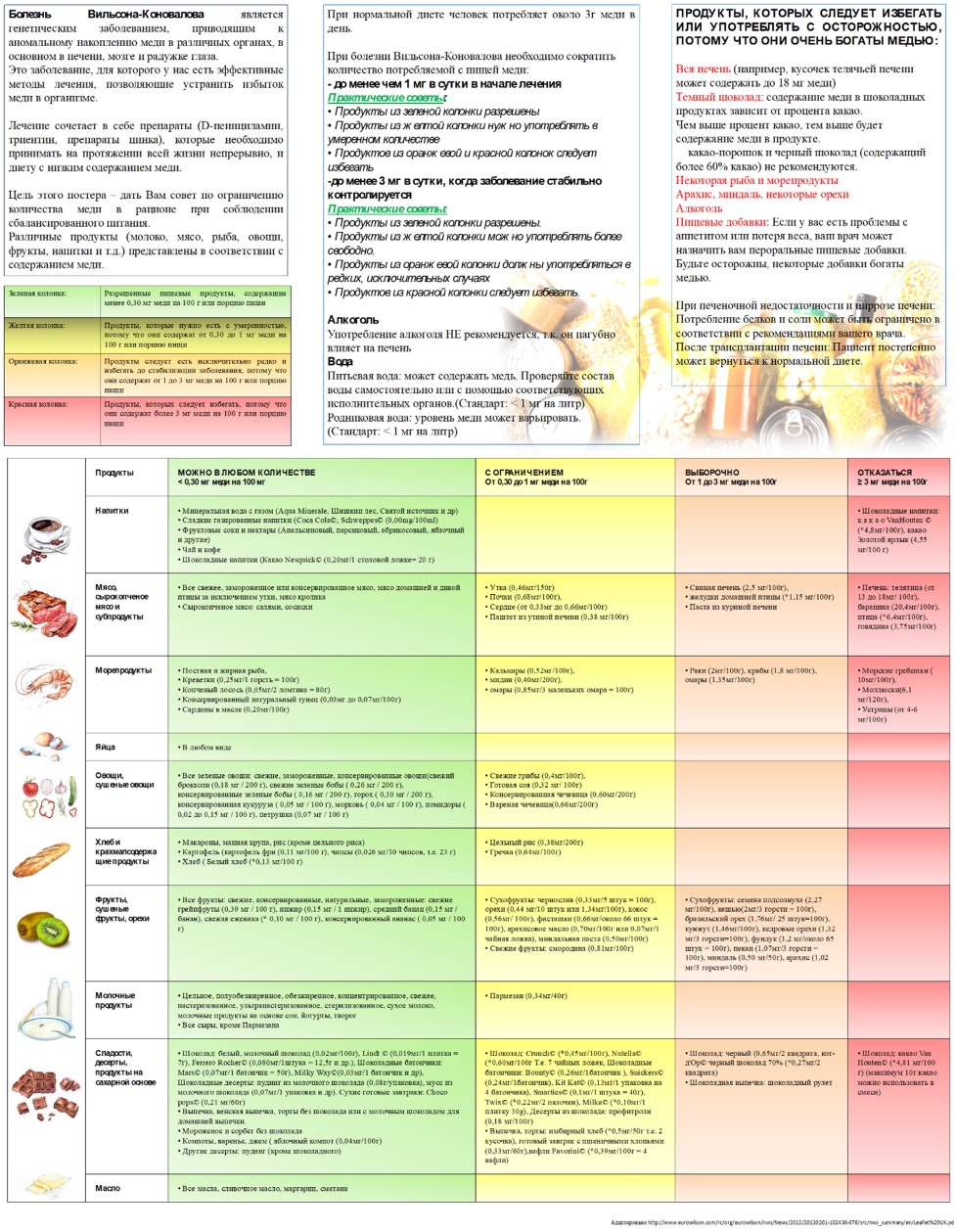
Приложение А3.4
РАСШИФРОВКА ПРИМЕЧАНИЙ
...** - препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 N 2406-р <Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи) (ред. от 09.06.2023)
# - Применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется по решению врачебной комиссии при условии подписанного информированного добровольного согласия (согласно ФЗ N 323-ФЗ от 21.11.2011 г. с изменениями);
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
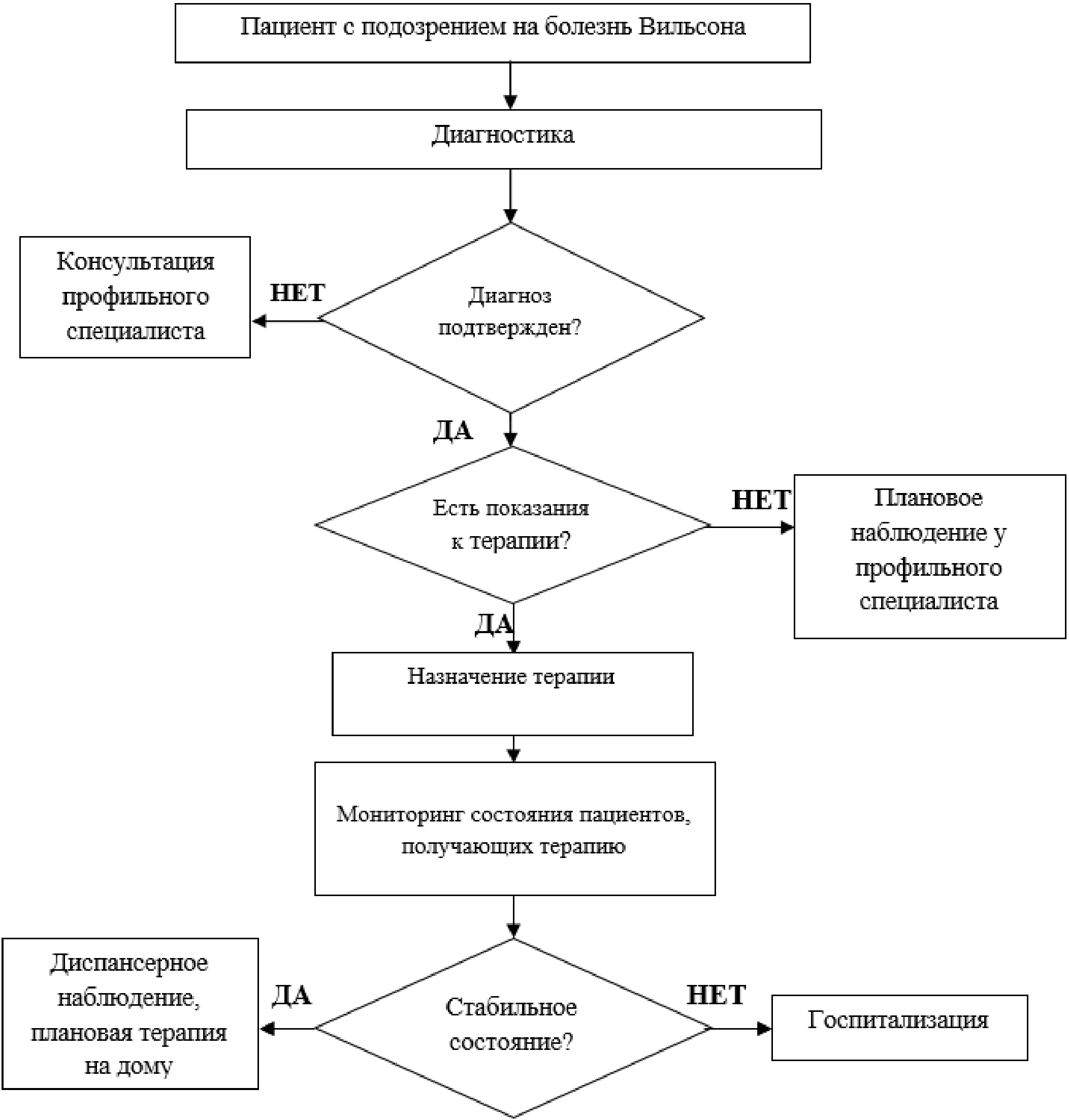
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое болезнь Вильсона?
Болезнь Вильсона (гепато-лентикулярная дегенерация, болезнь Вильсона-Коновалова) относится к тяжелым наследственным болезням центральной нервной системы и внутренних органов, связанных с нарушением обмена меди.
Причиной болезни Вильсона являются мутации в гене ATP7B, который отвечает за синтез медь-транспортирующего белка (ATP7B). При нарушении его работы обмен меди и медьсодержащих белков нарушается, появляется избыток "свободной" меди, которая в больших количествах откладывается в печени, головном мозге, роговице, а также выделяется с мочой. Диагностика болезни базируется на обнаружении характерных нарушений медного обмена. Поражение печени избытком "свободной" меди проявляется циррозом печени. Поражение головного мозга приводит к развитию тяжелой неврологической симптоматики: дрожанию конечностей и всего туловища, повышению мышечного тонуса, иногда сопровождающемуся болезненными спазмами, нарушением речи, глотания, снижению интеллекта. Отложение меди в роговице (по краю радужной оболочки) обусловливает формирование кольца Кайзера-Флейшера имеющего - буро-зеленоватый цвет.
Болезнь Вильсона - редкий пример наследственного нарушения, для которого разработаны высокоэффективные методы лечения: даже при появлении тяжелой неврологической симптоматики систематическое лечение высокоэффективно, вплоть до исчезновения всех симптомов или резкого их уменьшения. Пациенты вновь могут полностью обслуживать себя, вести домашнюю работу, учиться, работать по профессии, создать семью и родить здорового ребенка.
Как проявляется болезнь Вильсона?
Первые симптомы обычно появляются в возрасте 5 - 40 лет, редко (![]() 3%) в более позднем возрасте. Основными органами-мишенями при болезни Вильсона являются нервная система и печень. Клиническая картина болезни очень разнообразна и клинические проявления могут отличаться у разных пациентов. При отсутствии лечения болезнь прогрессирует, может возникнуть печеночная недостаточность, необратимые изменения со стороны нервной системы. Ранняя диагностика и лечение облегчает симптомы и предотвращает осложнения.
3%) в более позднем возрасте. Основными органами-мишенями при болезни Вильсона являются нервная система и печень. Клиническая картина болезни очень разнообразна и клинические проявления могут отличаться у разных пациентов. При отсутствии лечения болезнь прогрессирует, может возникнуть печеночная недостаточность, необратимые изменения со стороны нервной системы. Ранняя диагностика и лечение облегчает симптомы и предотвращает осложнения.
1. Печеночные изменения: отмечаются примерно у 50% пациентов; чаще у детей и подростков - увеличение печени, жировой гепатоз, острый или хронический гепатит (сходный с острым вирусным или аутоиммунным гепатитом), цирроз печени с признаками портальной гипертензии, острая печеночная недостаточность.
2. Неврологические расстройства: у 40 - 50% больных могут развиваться дрожание, паркинсонизм (замедленность движений и мышечная ригидность), атаксия (нарушение координации, шаткость при ходьбе), дистония (от фокальной до генерализованной), дизартрия (смазанная речь), нарушение глотания.
3. Психические изменения: отмечаются у 10% больных; расстройства личности (перепады настроения, проблемы в школе или на работе, импульсивное поведение), аффективные расстройства, психозы.
4. Изменения в других органах и системах: глазные изменения (кольцо Кайзера-Флейшера [отложения меди - видно при исследовании при помощи щелевой лампы, как золотисто-коричневая пигментация лимба роговицы], катаракта), гемолитическая анемия (примерно у 15% пациентов), поражение почек, кардиомиопатия, аритмия, остеомаляция, остеопороз, артрит, панкреатит (воспаление поджелудочной железы), задержка полового развития, бесплодие, аменорея, гипотиреоз или гипопаратиреоз.
Заподозрить раннюю стадию болезни можно на основании следующих признаков: поражение печени (желтуха, повторных кровотечений из носа, кровоточивости десен либо множественных кровоподтеков, сосудистых "звездочек" на коже груди и спины), поражение нервной системы (двигательные расстройства, снижение интеллекта и изменения психики в виде перепадов настроения, трудности усвоения нового материала, проблемы с успеваемостью в школе).
Как наследуется болезнь Вильсона?
Болезнь Вильсона наследуются по аутосомно-рецессивному типу. Это значит, что болезнь проявляется только в том случае, если оба родителя являются носителями болезни и, хотя сами они не болеют, передают ребенку два пораженных гена. Большинство семей, где есть ребенок с этим заболеванием, не сталкивались раньше с подобной проблемой. Риск повторного рождения больного ребенка в семье, где уже есть больные дети, составляет 25% на каждую беременность. Патогенные варианты в гене ATP7B являются причиной этого заболевания.
Братья и сестры больного ребенка, могут быть больными, даже если у них на момент диагностики членов семьи не было симптомов. В данном случае необходимо провести диагностику, чтобы как можно раньше начать терапию и избежать осложнений. Также они могут быть носителями, как их родители. Что касается других членов семьи, то им важно сообщить, что они могут быть носителями. Это значит, что и у них есть риск рождения ребенка с данным заболеванием. Чем раньше начать лечение (в идеале - еще на досимптомной стадии либо на доневрологическом этапе, то есть до появления признаков поражения головного мозга), тем лучше эффект.
Все семьи с болезнью Вильсона должны обязательно пройти медико-генетическое консультирование и получить полную информацию от врача-генетика о риске повторного проявления данного заболевания в семье, обсудить со специалистом все вопросы, связанные с наследованием заболевания. В России медико-генетические консультации работают в каждом регионе.
С целью проведения пренатальной и преимплантационной диагностики супружеской паре предварительно необходимо пройти обследование на носительство мутаций в гене ATP7B, обратившись в специализированные диагностические лаборатории и медицинские центры. Пренатальная диагностика проводится молекулярно-генетическими методами, путем исследования ДНК, выделенной из биоптата ворсин хориона и (или) клеток амниотической жидкости и (или) плодной крови.
Как устанавливается диагноз Вильсона?
На основании клинических признаков врач может заподозрить заболевание, далее проводятся ряд лабораторных и инструментальных методов исследования, которые позволяют подтвердить диагноз.
1. Анализ крови: повышенная активность аминотрансфераз в сыворотке крови (почти у всех пациентов, сначала бессимптомная), сниженная концентрация церулоплазмина в сыворотке крови (у большинства пациентов < 20 мг/дл), снижена концентрация общей меди в сыворотке крови (обычно < 1 мг/л).
2. Анализ мочи: примерно у 80% пациентов суточное выделение меди с мочой > 100 мкг (> 1,6 мкмоль).
3. Визуализирующие исследования: при УЗИ, КТ и МРТ - в зависимости от стадии болезни - увеличение печени или признаки портальной гипертензии (спленомегалия); на МРТ и КТ головного мозга - изменения в области базальных ядер головного мозга и ствола у пациентов с неврологическими симптомами.
4. Генетические исследования: исследование гена ATP7B. Как правило, первые тесты проводят на наиболее частые патогенные варианты, а затем - при необходимости - анализируют весь ген с применением методов секвенирования.
Как лечат пациентов с болезнью Вильсона?
Во-первых, это строгое соблюдение "печеночной" диеты (стол 5а), предполагающей исключение богатых медью продуктов (шоколад, кофе, орехи, бобовые, моллюски и др.). Необходимо избегать употребления алкоголя.
Однако основное лечение - постоянный прием препаратов, выводящих медь из организма. Главным из них является пеницилламин**. Терапию нельзя прекращать без уважительных причин, так же в период беременности.
Эти препараты назначаются по специальной схеме с постепенным увеличением дозы. При длительном многолетнем приеме пеницилламина у некоторых пациентов возникают побочные явления в виде дерматитов, анемии и иных осложнений. Поэтому был предложен альтернативный метод лечения препаратами цинка. Комбинированное лечение пеницилламином** и препаратами цинка дает возможность снизить дозу и избежать побочных явлений. У пациентов на досимптомной стадии достаточно лечения только препаратами цинка.
В тяжелых случаях болезни, не поддающихся консервативному лечению, применяется трансплантация печени. Трансплантация печени показана при острой печеночной недостаточности. При удачном исходе операции пациент не нуждается в дальнейшем приеме препаратов.
Таким образом, при правильной терапии гепатолентикулярной дегенерации - тяжелейшего наследственного заболевания головного мозга и внутренних органов - в 80% случаев возможно клиническое выздоровление либо выраженное улучшение состояния больных при условии своевременной максимально ранней диагностики.
Какой нужно проводить мониторинг?
После начала лечения, сначала раз в 1 - 2 мес., затем 1 - 2 раза/год, нужны регулярные контрольные обследования: неврологический осмотр, общий анализ крови с лейкоцитарной формулой, показатели функции печени и почек, концентрации меди в сыворотке крови и суточной экскреции меди с мочой.
Как пациенты получают лечение в Российской Федерации?
Болезнь Вильсона относится к числу редких наследственных болезней обмена веществ и входит в перечень редких (орфанных) заболеваний, лечение которых проводится за счет средств регионального бюджета. После установления диагноза необходимо включение пациента в региональный сегмент регистра по жизнеугрожающим редким (орфанным) заболеваниям с целью дальнейшего обеспечения необходимым лечебным питанием и лекарственными препаратами. В разных регионах за ведение регистра отвечают разные специалисты, но чаще всего это врачи-генетики, поэтому после установления диагноза обязательно нужно обратиться к региональному врачу-генетику.
Как могут помогать родные и близкие?
Не забывайте - от семьи тоже зависит успех лечения. Нужно соблюдать рекомендации, ни при каких условиях не допускать "срывов" в терапии, следует уделять внимание реабилитации и плановым обследованиям. Все члены семьи должны знать, что пациент нуждается в особом питании и регулярном приеме препаратов.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ДИАГНОСТИЧЕСКАЯ ОЦЕНОЧНАЯ ШКАЛА БОЛЕЗНИ ВИЛЬСОНА
Leipzig, 2001 [3, 26]
Название на русском языке: Диагностическая оценочная шкала Болезни Вильсона, Лейпциг, 2001
Оригинальное название: Scoring system developed at the 8th International Meeting on Wilson's disease, Leipzig 2001
Источник: [26]
Тип: шкала оценки
Назначение: установление диагноза Болезнь Вильсона
Содержание:
I. Типичные для БВ клинические симптомы и признаки
Баллы
II. Другие диагностические исследования
Баллы
1. Кольца Кайзера-Флейшера
5. Количественное определение меди в биоптатах печени (при условии отсутствия холестаза)
- присутствуют
2
- > 250 мкг/г (4 мкмоль/г)
2
- отсутствуют
0
- 50 - 250 мкг/г (0,8 - 4 мкмоль/г)
1
- в норме (ниже 50 мкг/г)
- 1
- Родамин - присутствуют позитивные гепатоциты (при невозможности количественного определения меди в печени)
1
2. Признаки поражения ЦНС и/или изменения на МРТ
6. Экскреция меди с мочой (при отсутствии острого гепатита)
- выраженные
2
- более 2 норм ИЛИ в норме, но увеличение более 5 норм при пробе с #пеницилламином**
2
- умеренные
1
- 1 - 2 нормы
1
- отсутствует
0
- в норме
0
3. Церулоплазмин сыворотки крови
7. Молекулярно-генетический анализ
- гомозигота, компаунд-гетерозигота
4
- в норме > 0,2 г/л (> 20 мг/дл)
0
- гетерозигота
1
- 0,1 - 0,2 г/л (10 - 20 мг/дл)
1
- мутаций не обнаружено
0
- < 0,1 г/л (< 10 мг/дл)
2
4. Кумбс-негативная гемолитическая анемия
- присутствует
1
- отсутствует
0
Ключ (интерпретация):
Суммарные баллы:
4 и более: диагноз Болезнь Вильсона установлен;
3: диагноз Болезнь Вильсона вероятен, но требуется дальнейшее обследование пациента;
2 и менее: диагноз Болезнь Вильсона сомнителен.
Приложение Г2
ПРОГНОСТИЧЕСКИЙ ИНДЕКС БОЛЕЗНИ ВИЛЬСОНА
(в модификации Dhawan et al.) [47, 86]
Название на русском языке: Прогностический индекс болезни Вильсона
Оригинальное название: New Wilson Index for Predicting Mortality
Источник: [47, 86]
Тип: шкала оценки
Назначение: оценка вероятности летального исхода без трансплантации печени при болезни Вильсона.
Содержание:
Показатель
1 балл
2 балла
3 балла
4 балла
Билирубин (мкмоль/л)
100 - 150
151 - 200
201 - 300
> 300
АСТ (Ед/л)
100 - 150
151 - 300
301 - 400
> 400
МНО
1.3 - 1.6
1.7 - 1.9
2.0 - 2.4
> 2.4
Лейкоциты (109)
6.8 - 8.3
8.4 - 10.3
10.4 - 15.3
> 15.3
Альбумин г/л
34 - 44
25 - 33
21 - 24
< 21
Ключ (интерпретация):
Суммарная оценка ![]() 11 баллов связана с высокой вероятностью летального исхода без трансплантации печени.
11 баллов связана с высокой вероятностью летального исхода без трансплантации печени.
