"Клинические рекомендации "Наследственная тирозинемия 1 типа"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
НАСЛЕДСТВЕННАЯ ТИРОЗИНЕМИЯ 1 ТИПА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: E70.2
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2026
ID: 409
Разработчик клинической рекомендации
- Союз педиатров России
- Ассоциация медицинских генетиков
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АФП - Альфа-фетопротеин
АЧТВ - Активированное частичное тромбопластиновое время
АЛТ - Аланинаминотрансфераза
АСТ - Аспартатаминотрансфераза
ГГТП - Гаммаглюкуронилтранспептидаза
ГЦК - Гепатоцеллюлярная карцинома
НТ - Наследственная тирозинемия
НТ 1А - Острая наследственная тирозинемия
НТ 1Б - Хроническая наследственная тирозинемия
КТ - Компьютерная томография
КЩС - Кислотно-щелочное состояние
МРТ - Магнитно-резонансная томография
МРХПГ - Магнитно-резонансная холангиопанкреатография
ПТИ - Протромбиновый индекс
РФП - Радиофармпрепарат
ТМС - Тандемная масс-спектрометрия
ЩФ - Щелочная фосфатаза
FAH - Фумарилацетогидролаза
NTBC - 2-(2-нитро-4-трифлюорометилбензоил)-1,3-циклогексанедион (нитизинон**)
TORCH инфекции - Сокращенное название группы инфекций, передающихся внутриутробно от матери плоду: T - Toxoplasmosis (токсоплазмоз) O - Others (сифилис, гепатит B, варицелла-зостер вирус, другие вирусы и бактерии), R - Rubella (краснуха), C - Cytomegalovirus (цитомегаловирус), H - Herpes simplex virus (вирус простого герпеса)
УЗИ - ультразвуковое исследование
Термины и определения
Синдром Фанкони - генерализованная дисфункция проксимальных канальцев почек, проявляющаяся глюкозурией, аминоацидурией, фосфатурией, почечным канальцевым ацидозом.
Гипертрофическая кардиомиопатия - характеризуется утолщением стенок желудочков (преимущественно левого), нарушением его диастолической функции и нередко сопровождается развитием обструкции выходного отдела.
Тирозинемические кризы - состояния, спровоцированные приемом белковой пищи и сопровождающиеся лихорадкой, рвотой, интоксикацией, кардиомиопатией.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Наследственная тирозинемия 1 типа (НТ1) или гепаторенальная тирозинемия - редкое (орфанное) заболевание с аутосомно-рецессивным типом наследования, обусловленное мутациями в гене FAH, кодирующего фермент фумарилацетогидролазу. Синонимы: дефицит фумарилацетоацетазы, дефицит фумарилацетоацетатгидролазы.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Патогенные варианты гена FAH приводят к снижению активности фермента фумарилацетогидролазы (FAH, EC 3.7.1.2), осуществляющего в норме конечный этап деградации тирозина на нетоксичные фумарат и ацетоацетат. В результате распад тирозина осуществляется по альтернативному патологическому пути, с образованием высокотоксичных и канцерогенных сукцинилацетона, малеилацетоацетата, фумарилацетоацетата (Приложение А3.1).
Ген FAH локализован на длинном плече 15-й хромосомы (15q23-q25) и состоит из 14 экзонов. На сегодняшний день в гене описано около 100 мутаций, частыми из них являются: c.554-1G > T, c.1062+5G > A, c.1025C > T (Pro342Leu) c.1090G > C (Glu364Gln). [13]. Патогенез НТ1 типа заключается в токсичном действии фумарилацетоацетата и малеилацетоацетата и их конечных метаболитов - сукцинилацетона и сукцинилацетоацетата, которые тормозят окислительное фосфорилирование и блокируют цикл Кребса. Накопление этих веществ приводит к прогрессирующему заболеванию печени с развитием печеночной недостаточности, цирроза, тубулопатии с формированием ренальной тубулопатии, гипофосфатемического рахита, синдрома Фанкони [14].
Кроме того, сукцинилацетон ингибирует 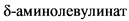 дегидратазу, промежуточный медиатор порфобилиногена, что приводит к нарушению биосинтеза гема и клинически может проявляться симптомами острой перемежающейся порфирии - болями в животе, артериальной гипертензией, периферической полинейропатией.
дегидратазу, промежуточный медиатор порфобилиногена, что приводит к нарушению биосинтеза гема и клинически может проявляться симптомами острой перемежающейся порфирии - болями в животе, артериальной гипертензией, периферической полинейропатией.
Большинство (до 90%) пациентов без специфического лечения (диетотерапия, патогенетические препараты) и трансплантации печени погибали в возрасте до 10 лет. Выживаемость зависит от сроков появления симптомов [15].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Частота НТ1 в различных популяциях колеблется от 1:100 000 - 120 000 живых новорожденных. Четких взаимосвязей между генотипом и фенотипом не установлено, различные клинические варианты могут присутствовать у членов одной семьи с одинаковыми мутациями [1, 4, 10]. Наибольшая распространенность НТ1 обнаружена в регионе Saguenay-Lac-St-Jean (Квебек-Прованс, Канада), где она достигает 1:1846, а 1 из 22 является носителем болезни [13 - 15]. В этой популяции наиболее часто (~ 90%) встречается мутация сайта сплайсинга c.1062+5G > A (IVS12+5G ![]() A) [12, 14, 15]. Высокая частота НТ1 наблюдается в Чеченской Республике - 1:16020, наиболее частой является мутация c.1025C > T (p.Pro342Leu) [16].
A) [12, 14, 15]. Высокая частота НТ1 наблюдается в Чеченской Республике - 1:16020, наиболее частой является мутация c.1025C > T (p.Pro342Leu) [16].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E 70.2 - Нарушения обмена тирозина
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В основу классификации НТ 1 положены клинические варианты течения острая (НТ 1A) и хроническая (НТ 1B).
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
При НТ1 обычно беременность и перинатальный период протекают нормально, и ребенок при рождении выглядит здоровым. Семейный анамнез может быть отягощен, в семьях могут быть случаи ранней детской смерти от кровоизлияний в мозг или острых кровотечений, расцененных как сепсис, внутриутробные инфекции, синдром диссименированного внутрисосудистого свертывания крови.
Острая форма наследственной НТ1 (НТ1A) дебютирует в первые 2 - 3 месяца жизни и характеризуется главным образом тяжелой печеночной недостаточностью, гепато- и спленомегалией, нарушенной свертываемостью крови и гипогликемией, приводящими к смерти в первые месяцы жизни. Дисфункция почечных канальцев сопровождается синдромом Фанкони и рахитом [2, 8]. Пациентам довольно часто ставят ошибочные диагнозы - сепсис, цитомегаловирусный гепатит, фетальный гепатит. У детей с НТ1A выражена интоксикация, гипогликемия, лейкоцитоз, возможен асцит, динамическая непроходимость, парез кишечника. При этом отмечается повышенный уровень сукцинилацетона (>= 10 - 100 раз), альфа-фетопротеина (АФП) (>= 100 - 1000 раз). Цитолиз обычно не превышает трех-четырех норм, умеренная гипербилирубинемия в пределах 100 - 150 мкмоль/л, в равном соотношении прямой и непрямой билирубин. Причиной летального исхода при естественном течении НТ1A обычно становится острая печеночная недостаточность и катастрофическое кровотечение на ее фоне. Диагноз затрудняется такими сопутствующими состояниями, как внутриутробная инфекция, неонатальный гепатит, сепсис.
При острой форме НТ1 на первый план в клинической картине выступают симптомы интоксикации (высокая температура, повышенная возбудимость, по мере нарастания симптоматики наступает нарушение уровня сознания вплоть до комы), а также симптомы поражения печени (увеличение печени, может быть в сочетании с увеличением селезенки, асцит, желтуха - редко), гастроинтестинальный синдром (срыгивания после каждого кормления), тяжелый геморрагический синдром (мелена, кровавая рвота, гематурия, экхимозы, петехии, носовые кровотечения), специфический запах мочи (запах "вареной капусты"). С 3-х недельного возраста, если имеют место частые срыгивания и рвота, остановка в прибавке массы тела, выраженная мышечная гипотония, сонливость, неспецифические симптомы интоксикации, серость кожи, увеличение размеров живота за счет асцита, гепато-спленомегалии, динамическая непроходимость (парез кишечника) при наличии жидких каловых масс, с кровью или без, возможны отеки, пастозность стоп, в лабораторных данных гипогликемия, гипокоагуляция, лейкоцитоз, цитолиз обычно не выше 3 норм, повышен уровень ГГТП, при этом билирубиновый обмен обычно не нарушен, т.е. имеет место холестаз без желтухи, АФП повышен значительно (при норме до 60 нг/мл у детей до 5 мес.) достигал 1 млн. нг/мл, ребенок подлежит селективному скринингу на болезни обмена, в том числе на НТ1.
При хронической форме (НТ1B) отмечается другая клиническая картина, болезнь развивается после годовалого возраста, чаще в 3 - 4 года. НТ1B изначально менее агрессивна, но заболевание неуклонно прогрессирует и может сопровождаться приступами острой метаболической декомпенсации. При этой форме наблюдаются различной степени выраженности поражения печени, почечные канальциевые дисфункции, рахитоподобные изменения скелета, обусловленные гипофосфатемией и гиперфосфатурией, кардиомиопатия, неврологические кризы, сходные с порфирическими (болезненные парестезии, артериальная гипертония, тахикардия, паралитическая непроходимость кишечника, иногда прогрессирующие параличи), гипогликемия, связанная с гиперплазией  поджелудочной железы и гиперсекрецией инсулина. Неврологические кризы обычно длятся 1 - 7 дней, после чего наступает период восстановления.
поджелудочной железы и гиперсекрецией инсулина. Неврологические кризы обычно длятся 1 - 7 дней, после чего наступает период восстановления.
У пациентов наблюдается нарушение функции реабсорбции в почечных канальцах, приводящее к синдрому Фанкони, ацидозу, генерализованной аминоацидурии, резистентному к витамину D гипофосфатемическому рахиту и задержке роста. В ряде случаев у ребенка наблюдается рахит с деформациями конечностей, столь выраженной, что дети перестают ходить. В этом же возрасте диагностируют цирроз, гепатоспленомегалию, могут быть носовые кровотечения, гипопротеинемические отеки. НТ1B характеризуется постепенными изменениями печени, приводящими к циррозу и развитию гепатоцеллюлярной карциномы. Фактически риск развития гепатоцеллюлярной карциномы при этом заболевании считается самым высоким среди всех нарушений обмена веществ [17, 18]. Ранее сообщалось, что гепатоцеллюлярная карцинома формируется у 37% пациентов с наследственной НТ1 старше 2 лет [19], но последующие исследования в Скандинавии [20] и Квебеке [17] показали более низкую частоту гепатоцеллюлярной карциномы (~ 15%), вероятно, вследствие трансплантации печени и улучшения способов лечения. Гепатоцеллюлярная карцинома у пациентов с наследственной тирозинемией 1-го типа развивается в более раннем возрасте, чем при других наследственных болезнях обмена (часто до 5 лет) [18]. Цитолиз минимальный (в пределах трех норм). Уровень АФП повышен в пределах 1000 нг/дл, сукцинилацетона - не более чем в 20 раз [9].
Подострая и хроническая формы болезни встречаются примерно у 20 - 25% больных с дебютом в 4 - 12 мес, клиническая манифестация которой провоцируется внешними факторами. Такими тригерными факторами являются лихорадочные состояния, инфекции, белковая нагрузка, голодание и другие гиперкатаболические состояния. У пациентов обнаруживается прогрессирующее поражение печени с гепато- или гепатоспленомегалией (цирроз, печеночная недостаточность), задержка роста, признаки рахита, мышечная гипотония, коагулопатия. Характерно отставание показателей физического развития. Неврологические симптомы нередко включают гидроцефальную конфигурацию черепа, симптом Грефе, задержку двигательного и психического развития. Могут наблюдаться неврологические кризы (слабость в конечностях, параличи конечностей и диафрагмы, рвота, аутоагрессия и др.), которые в ряде случаев служат поводом для ошибочного диагноза - myasthenia gravis. Неврологические изменения непостоянны. Нередко описывают гиперпигментацию кожи.
Следует отметить, что эта классификация довольно условна, поскольку некоторые дети с острой декомпенсацией в течение первого года жизни выживают и их форма становится "хронической", а пациенты с "хронической" формой остаются в группе риска по развитию метаболических кризов. При этом, возраст дебюта является важным прогностическим показателем. До появления патогенетического лечения в течение 1-го года умерли 60% детей с дебютом заболевания в возрасте до 2 месяцев, 23% при дебюте в возрасте от 2 до 6 месяцев и только 4% детей дебютировавших после 6 месяцев [21]. В некоторых регионах РФ проводятся программы по массовому обследованию на НТ1. Следует отметить, что до 4 дней жизни у доношенных и до 7 дней жизни у недоношенных новорожденных, неонатальный скрининг будет неэффективным, так как в крови у пациентов с НТ1 еще не накапливаются высокие концентрации сукцинилацетона [31, 36].
Печеночные проявления тирозинемии I типа
Основные клинические проявления НТ1 связаны с поражением печени. Могут наблюдаться острая печеночная недостаточность, цирроз печени и гепатоцеллюлярная карцинома [21]. По данным международных исследований 69% смертей были связаны с печеночной недостаточностью и кровотечением, а 16% - с гепатоцеллюлярной карциномой. Синтетическая функция нарушена у большинства пациентов с НТ1. Уровень факторов свертывания заметно снижен при НТ1, и у некоторых пациентов именно нарушения коагуляции являются ведущими, другие признаки поражения печени выражены незначительно, поэтому пациентов обследуют на предмет первичной гематологической проблемы [22]. Протромбиновое и частичное тромбопластиновое время может быть чрезвычайно продолжительным даже у клинически здоровых детей с НТ1, выявленных при скрининге. Применение витамина K только на короткое время может улучшить профиль коагуляции. Уровни трансаминаз в сыворотке варьируют и могут быть нормальными или незначительно повышенными, хотя в некоторых кризисных ситуациях могут наблюдаться уровни более 1000 МЕ/л, что указывает на более существенную степень повреждения гепатоцитов, и как правило заставляет предпринять шаги к экстренной трансплантации печени. Желтуха редко встречается на ранних стадиях гепаторенальной тирозинемии. Тогда как, гамма-глютамилтрансфераза обычно повышена более чем в 2 раза, и соответствует диссоциированному холестазу.
Печеночные кризы могут быть спровоцированы инфекциями и другими катаболическими стрессами как у младенцев, так и у детей старшего возраста. Ребенок раздражителен, ослаблен и часто лихорадит. Часто встречаются асцит, желтуха и желудочно-кишечные кровотечения. Может ощущаться запах "вареной капусты", но запах наблюдается не часто - примерно в 15% случаев. Имеется гепатомегалия различной степени. Криз сопровождается выраженной потливостью, гипергидроз зачастую объясняется течением острого рахита, что не исключает, а лишь подтверждает НТ1. Тремор, гипергидроз и резкая слабость как проявление гипогликемии в период криза встречается чаще, чем вне его. Во время кризов наблюдаться повышение уровня тирозина, метионина, пролина и часто других аминокислот в плазме. Печеночные трансаминазы могут резко повышаться, и может развиваться гипербилирубинемия, что соответствует распаду гепатоцитов. В этот период может усилиться дисфункция почечных канальцев. Хотя многие кризы разрешаются спонтанно, при уменьшении белковой нагрузки, адекватного парентерального питания и детоксикационной терапии, и некоторые прогрессируют до полной печеночной недостаточности и печеночной энцефалопатии.
Между кризами у большинства пациентов наблюдается гепатомегалия легкой или средней степени тяжести. У некоторых пациентов с формирующимся циррозом или гепатомегалией с нарушением гемодинамики и повышением резистентности паренхимы (по ДГ сосудов печени) отмечается спленомегалия. Печеночные трансаминазы в норме или немного повышены, а уровень билирубина в норме. Альфа-фетопротеин повышен (10 - 1 000 000 нг/мл; в норме < 10). Клинически уровни 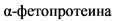 в сыворотке ориентировочно отражают агрессивность заболевания, как и уровни метионина в плазме. Гипербилирубинемия и гипераммониемия являются поздними признаками печеночной недостаточности
в сыворотке ориентировочно отражают агрессивность заболевания, как и уровни метионина в плазме. Гипербилирубинемия и гипераммониемия являются поздними признаками печеночной недостаточности
Цирроз, вероятно, в конечном итоге развивается у всех пациентов с НТ1, и риск гепатоцеллюлярной карциномы чрезвычайно высок [19]. С каждым годом без лечения болезни риск развития ГЦК увеличивается с 14 до 75%. Раннее, до месячного возраста, начало патогенетичсекой терапии снижает риск ГЦК до 1%, и необходимость в трансплантации печени уменьшается с 71% до 26% [15, 23]. Важно, что далеко не каждый случай ГЦК возникает на фоне цирроза. Так в обзоре R.Khanna, 2018, включающем 15 исследований, средняя частота ГЦК у детей составила 0,41 на 1000000, у взрослых - 0,8 на миллион населения [24]. Частота ГЦК при НТ1 превышает в 40 раз ее частоту при других метаболических и инфекционных заболеваниях печени. Риск развития ГЦК при НТ1 возникает при отсутствии терапии нитизиноном и началом терапии позже 1 месячного возраста [25]. Тем не менее, даже при длительном периоде без лечения, часть детей благодарно отвечают на терапию - восстанавливаются структура печени, купируется тубулопатия, восстанавливается минеральная плотность костей и электролитный баланс. Отмечены случаи, когда пациенты были направлены на трансплантацию с предварительной подготовкой NTBC (2-(2-нитро-4-трифлюорометилбензоил)-1,3-циклогексанедион (нитизинон)) для улучшения обменных процессов, курсом на 3 мес., а по прошествии этого периода, показания к трансплантации исчезали. У некоторых детей продолжалась консервативная терапия, стабилизация и/или регресс цирроза.
Большинство инструментальных методов исследования (КТ, УЗИ, ангиография) не позволяют надежно дифференцировать доброкачественные и злокачественные узелковые образования. Для КТ-обнаружения важно выполнять томографию с контрастом и без него, потому что контрастирование может скрывать одни узелки, но выявить другие. Чувствительность УЗИ по крайней мере такая же, как у КТ, но оно во многом зависит от опыта врача. Следует отметить, что поскольку премедикация барбитуратами может спровоцировать порфирийно-подобные кризы, лучше избегать ее использования у пациентов, не получавших NTBC [26].
Неврологические кризисы тирозинемии I типа
Неврологические кризы гепаторенальной тирозинемии - это острые эпизоды периферической невропатии. Клинически кризы делятся на две фазы: (1) активный период с преобладанием болезненных парестезий, вегетативных признаков (например, гипертония, тахикардия, кишечная непроходимость) и иногда прогрессирующего паралича и (2) период восстановления после паралитического криза. Из 48 пациентов франко-канадского происхождения у 20 (42 процента) были описаны неврологические кризы [27]. Периферическая гиперпарестезия проявляется с раннего возраста - младенец отказывается находится на руках у матери, беспокоится при прикосновениях, поглаживаниях, предпочитает находится в кроватке. Болезненные кризы наиболее частый неврологический вариант [28]. Во время продрома, который часто возникает после незначительной инфекции с анорексией и рвотой, ребенок раздражителен и менее активен, чем обычно. Затем у ребенка появляется сильная боль, часто в ногах. Часто пациенты принимают позицию крайнего гиперэкстензии туловища и шеи, которые могут быть ошибочно приняты за опистотонус или менингизм. Гипертонус можно принять за тонические судороги, но на самом деле пациенты находятся в сознании. Также могут наблюдаться настоящие судороги, часто в сочетании с тяжелой гипонатриемией [27]. Кризы могут быть настолько мучительными, что сопровождаются самоповреждениями [27]. Важно отметить, что умственное развитие детей с НТ1 является нормальным и что во время кризисов уровень их сознания не снижается.
Активная фаза обычно длится от 1 до 7 дней. В очень редких случаях во время кризов искусственная вентиляция легких была необходима из-за дыхательной слабости, в одном случае на срок более 3 месяцев [27]. Часто возникают рвота и кишечная непроходимость, которые могут усложнить режим питания. Артериальная гипертония и стойкая тахикардия характерны для ранней стадии неврологического криза. Могут также возникнуть выраженная гипонатриемия, гипофосфатемия и гипокалиемия [27].
Следует отметить, что у 30 российских пациентов не наблюдали подобной острой и тяжелой симптоматики. Неврологические кризы являются основной причиной заболеваемости у пациентов, не получавших NTBC. По данным международного опроса, 10% смертей при НТ1 произошли во время неврологических кризисов. Детей с НТ1 и признаками, указывающими на приближающийся неврологический кризис, следует госпитализировать для постоянного наблюдения за респираторной функцией во время острой фазы.
Патология почек при тирозинемии I типа
У пациентов с НТ1 почти всегда присутствует поражение почек различной степени, от легкой дисфункции канальцев до явной почечной недостаточности. Поражение почек соответствуют вторичному синдрому Фанкони, полному или неполному: снижение уровня кальция в крови; снижение уровня фосфора в крови; повышение уровня щелочной фосфатазы; развитие метаболического ацидоза, нарушение реабсорбции бикарбонатов в проксимальных канальцах; может быть нормальная экскреция кальция с мочой при гипокальцемии; повышение клиренса фосфатов мочи, всасывание фосфатов в кишечнике не страдает; глюкозурия (20 - 30 г/л и выше); развитие генерализованной гипераминоацидурии; нарушение функций аммониоацидогенеза - снижение титрационной кислотности, повышение pH мочи больше 6,0; развитие гипокалиемии.
Тяжесть дисфункции проксимальных канальцев различна и может резко усугубляться в периоды декомпенсации. Гипофосфатемический рахит является основным клиническим признаком дисфункции почечных канальцев при НТ1. У некоторых детей с НТ1 наблюдается почечный канальцевый ацидоз. Генерализованная аминоацидурия встречается чаще, чем глюкозурия. Потеря фосфата с мочой, вероятно, является основным механизмом рахита у этих пациентов, о чем свидетельствуют частые проявления гипофосфатемии и отсутствие гипокальциемии или гипоплазии эмали зубов, что может свидетельствовать о патогенезе, связанном с витамином D [29].
Скелетные изменения при тирозинемии I типа
До появления возможностей патогенетического лечения пациенты с НТ1 имели грубые многоплоскостные деформации скелета, патологические переломы, утрированные проявления рахита в виде гиперплазии хрящей (четки и браслеты), башенного черепа, гипергидроза, синдрома Хвостека, раздражительности, потливости, ломкости ногтей, зубов. При проведении рентгенографии выявляют снижение костного возраста и остеопению, вплоть до остеопороза, расширение дистальных эпифизов трубчатых костей, деформация и истончение кортикального слоя пястных и плюсневых костей, предплечий, голеней, бедер, саблевидные деформации всех костей на которые была нагрузка - если ходил - нижних конечностей, если ползал - и бедер, и плеч, и предплечий. Наблюдаются деформация грудной клетки, ключиц, выраженная гаррисонова борозда, дисплазия и подвывих тазобедренных суставов.
Диагноз наследственной НТ1 следует предполагать при наличии вальгусных (чаще) или варусных искривлений конечностей с сопутствующей гепатомегалией. Некоторые больные до 2 - 3 лет самостоятельно передвигаются, хотя резистентность к нагрузкам у них низкая, а затем перестают ходить, что не редко является поводом для обращения к врачам. Это довольно типично для пациентов из многодетных, социально неблагополучных или плохо говорящих по-русски семей из сельской местности, горных аулов, удаленных районов, где нет специалистов.
Другие клинические проявления и дифференциальная диагностика тирозинемии тип 1
Клинически значимая гипертрофическая кардиомиопатия была зарегистрирована у трех детей с тирозинемией, и у одного она стала причиной смерти [30].
Гипогликемия - симптом типичный для младенцев до года с тяжелым течением заболевания, сопровождавшемся печеночной недостаточностью. Поэтому следует проводить дифференциальный диагноз с гликогенозами, нарушениями бета окисления жирных кислот.
Повышение уровня тирозина также может наблюдаться при других формах наследственной тирозинемии, которые отличаются по спектру клинических проявлений. Недостаточность тирозинаминотрансферазы - первого фермента пути катаболизма тирозина - приводит к развитию наследственной тирозинемии 2-го типа (OMIM 276600), также называемой синдромом Ричнера-Ханхарта. Тирозинемия 2-го типа сопровождается повышением уровня тирозина в крови и моче. Клинический фенотип включает умственную отсталость, болезненные высыпания на роговице, фотофобию, кератит и болезненный пальмоплантарный гиперкератоз [4]. Мутации, приводящие к снижению активности p-гидроксифенилпируватдиоксигеназы - второго фермента катаболизма тирозина, могут способствовать развитию хокинсинурии (OMIM 140350) или наследственной тирозинемии 3-го типа (OMIM 276710).
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз НТ1 устанавливают на основании данных семейного анамнеза, клинических симптомах, данных инструментальных исследований, а также результатах биохимической и ДНК-диагностики
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб рекомендовано обратить внимание на следующие жалобы и анамнестические события:
- отягощенный семейный анамнез (сходные симптомы у сибсов пробанда, близкородственный брак);
- случаи внезапной детской смерти;
- срыгивания, рвота;
- потеря массы тела, плохая прибавка массы тела;
- желтуха;
- носовые кровотечения, кровотечения из мест инъекций;
- увеличение размеров печени, селезенки;
- специфический "капустный" запах тела;
- различные деформации скелета (чаще нижних конечностей);
- эпизоды гипогликемии в анамнезе.
Жалобы и анамнез также описаны в разделе "клиническая картина".
2.2 Физикальное обследование
Пациенту с подозрением на НТ 1 следует провести полноценное физикальное обследование, обращая особое внимание на пальпаторное и перкуторное исследование печени и селезенки.
Острая форма НТ 1A:
- задержка физического развития;
- фебрильная температура;
- рвота, обезвоживание;
- диарея;
- гепато-/гепатоспленомегалия;
- асцит и динамическая непроходимость кишечника;
- желтуха (на стадии острого гепатита);
- острое желудочно-кишечное кровотечение (возможны мелена, рвота кофейной гущей);
- безбелковые отеки, анасарка;
- кровотечения за счет снижения белково-синтетической функции печени;
- иногда специфический "капустный" запах тела;
- гипергидроз, который выражен в период кризов, особенно на фоне лихорадки и гипогликемии;
- гиперестезия (ребенок предпочитает находиться в кроватке, а не на руках у матери) является проявлением полинейропатии.
Хроническая НТ 1B:
- задержка роста, на 3 - 4 года отстает физиологическая смена зубов, задерживается костный возраст;
- гепато-/гепатоспленомегалия;
- асцит и динамическая непроходимость кишечника;
- желтуха (на стадии острого гепатита);
- острое желудочно-кишечное кровотечение (возможны мелена, рвота кофейной гущей);
- безбелковые отеки, анасарка;
- кровотечения за счет снижения белково-синтетической функции печени;
- иногда специфический "капустный" запах тела;
- гипергидроз, который выражен в период кризов, особенно на фоне лихорадки и гипогликемии;
- гиперестезия (ребенок предпочитает находиться в кроватке, а не на руках у матери) является проявлением полинейропатии;
- рахитоподобное заболевание вследствие тяжелой тубулопатии;
- периферическая нейропатия, острые абдоминальные кризы; или так называемые "тирозинемические" кризы, которые провоцируются приемом высокобелковой пищи и сопровождаются лихорадкой, рвотой, интоксикацией;
- кардиомиопатия и артериальная гипертензия проявляются как результат метаболических процессов, так и вторично на фоне поражения почек.
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с клиническими признаками, характерными для НТ1 определение аминокислот и сукцинилацетона в биологических жидкостях методом тандемной масс-спектрометрии (Комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии, Комплексное определение содержания органических кислот в моче) с целью биохимического подтверждения диагноза и дифференциальной диагностики с другими наследственными нарушениями обмена веществ [1, 4, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: Важно помнить, что взятие биологического материала для анализов (мочи на сукцинилацетон и крови для проведения тандемной масс-спектрометрии) должно проводиться до начала инфузионной терапии, особенно введения плазмозамещающих растворов и компонентов крови.
Патогномоничным признаком НТ 1 является высокий уровень сукцинилацетона в моче и плазме крови (норма 0 - 2 мМ/моль креатинина). Небольшое повышение сукцинилацетона в крови и моче может наблюдаться при перекорме белковой пищей, приводящем к функциональной недостаточности FAH. Исследование сукцинилацетона необходимо проводить до начала детоксикационной терапии, переливания плазмы и других компонентов крови.
Высокий уровень метионина приводит к появлению "капустного" запаха, который не так специфичен, как описывалось ранее, и скорее отражает печеночно-клеточную недостаточность. Уровень тирозина выше 200 мкМоль/л и повышение его предшественника фенилаланина при тирозинемии определяются лишь у детей с нормальным нутритивным статусом. У истощенных детей с длительным анамнезом и клиникой белково-энергетической недостаточности содержание тирозина и фенилаланина в крови могут быть в норме. На фоне проведения специфической терапии нитизиноном**, низкобелковой диеты и проведения детоксикационной терапии уровень сукцинилацетона значительно снижается и достигает нормы в течение суток. Следует с осторожностью относиться к интерпретации результатов анализа аминокислот, поскольку повышение уровня фенилаланина, тирозина и метионина часто наблюдается при заболеваниях, сопровождающихся тяжелым поражением печени.
- Рекомендовано всем пациентам с клиническими признаками, характерными для НТ1 определение альфа-фетопротеина (АФП) в сыворотке (или плазме) крови, который является одним из биохимических маркеров НТ1 с целью биохимического подтверждения диагноза и дифференциальной диагностики с другими наследственными нарушениями обмена веществ [1, 4, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: АФП - маркер пролиферации желчных протоков, при НТ 1B повышен в десятки, а у детей с НТ 1A даже в тысячи раз. АФП не специфичный, но очень чувствительный показатель, при нормальном его уровне диагноз НТ 1 сомнителен. В норме у детей от 0 до 3 мес. Концентрация АФП < 1000 нг/мл; от 3 месяцев до 18 лет концентрация АФП < 12 нг/мл.
Другим маркером является повышение 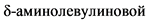 кислоты, так как сукцинилацетон ингибирует дегидрогеназу
кислоты, так как сукцинилацетон ингибирует дегидрогеназу 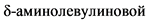 кислоты в печени и эритроцитах. В норме содержание
кислоты в печени и эритроцитах. В норме содержание 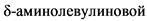 кислоты в разовой пробе мочи составляет < 34 мкмоль/л (формула перерасчета < 4,5 мг/л x 7,626), в суточной моче - от 11,4 до 57,2 мкмоль/сут (1,5 - 7,5 мг/сут).
кислоты в разовой пробе мочи составляет < 34 мкмоль/л (формула перерасчета < 4,5 мг/л x 7,626), в суточной моче - от 11,4 до 57,2 мкмоль/сут (1,5 - 7,5 мг/сут).
Повышение концентрации 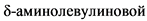 кислоты отмечается также при острых порфириях (острая перемежающаяся, "пестрая", врожденная копропорфирия), отравлении свинцом, дефиците аминолевулинат-дегидратазы (гомозиготы). Умеренное повышение может наблюдаться при диабетическом кетоацидозе, беременности, поздней кожной порфирии и при приеме некоторых противосудорожных средств.
кислоты отмечается также при острых порфириях (острая перемежающаяся, "пестрая", врожденная копропорфирия), отравлении свинцом, дефиците аминолевулинат-дегидратазы (гомозиготы). Умеренное повышение может наблюдаться при диабетическом кетоацидозе, беременности, поздней кожной порфирии и при приеме некоторых противосудорожных средств.
- Рекомендовано всем пациентам с клиническими и биохимическими изменениями характерными для НТ1 исследование гена фумарилацетогидролазы (FAH), с целью молекулярно-генетического подтверждения диагноза [1, 4, 5, 10, 16, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: частыми патогенными вариантами являются: c.554-1G > T, c.1062+5G > A, c.1025C > T (Pro342Leu) c.1090G > C (Glu364Gln).
- Рекомендуется пациентам с клиническими проявлениями НТ1 проведение общего (клинического) анализа крови развернутого (гемоглобин, количество эритроцитов, цветовой показатель, количество лейкоцитов, тромбоцитов, лейкоцитарная формула и скорость оседания эритроцитов), для оценки основных параметров кроветворения и наличия воспалительных процессов [32].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
- Рекомендуется пациентам с клиническими проявлениями НТ1 проведение общего (клинического) анализа мочи для оценки состояния мочевыводящих путей и почек [33].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
- Рекомендуется пациентам с клиническими проявлениями НТ1 проведение биохимического анализа крови (глюкоза, общий белок, белковые фракции (исследование уровня альбумина в крови, определение альбумин/глобулинового соотношения в крови), общий, связанный и свободный билирубин, холестерин, триглицериды, липопротеиды низкой и высокой плотности (исследование уровня липопротеинов в крови), щелочная фосфатаза, гамма-глютамилтрансфераза (ГГТ), креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), кальций общий и ионизированный, натрий, калий, неорганический фосфор, железо и ферритин) для оценки функционального состояния внутренних органов, наличия инфекционных осложнений и нутритивного статуса пациента [1, 4, 5, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: В крови отмечаются умеренно повышенный уровень трансаминаз (в 2 - 3 и более раз), высокий уровень гамма-глютамилтрансферазы (ГГТ) и щелочной фосфатазы (ЩФ), которые являются признаками внутрипеченочного холестаза. При НТ 1A отмечается умеренный внутрипеченочный холестаз, при НТ 1B холестаз может быть диссоциированным: при нормальном уровне билирубина отмечается высокий уровень ГГТ, а также щелочной фосфатазы (ЩФ), увеличение которой может быть проявлением острого рахита.
При наличии рахитоподобного заболевания активность ЩФ превышает норму в 5 и более раз. Выраженность тубулопатии определяется электролитным дисбалансом и проявляется низким уровнем кальция и фосфора в сыворотке крови. Синдром Фанкони может быть, как полным, так и неполным, оптимально он определяется кальций/креатининовым и фосфор/креатининовым коэффициентом в разовой (второй) порции мочи, которые могут быть ложноотрицательными при низком уровне этих электролитов в крови. Признаки синдрома Фанкони включают глюкозурию, генерализованную аминоацидурию, почечный канальцевый ацидоз, фосфатурию. Вторичный гиперпаратиреоз сопряжен с гипокальцемией, гипофосфатемией и соответствующими им кальций- и фосфатурией [1, 4, 7, 9].
- Рекомендуется проведение коагулограммы (АЧТВ, МНО, протромбиновое время, протромбиновый индекс, фибриноген) пациентам с клиническими проявлениями НТ1 для оценки функционального состояния печени и свертывающей системы крови [4].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий: Коагулограмма необходима для выявления витамин K-зависимой коагулопатии, которая характеризуется дефицитом всех печеночных факторов свертывания (II, V, VII, X, IX, XI, XII), удлинением протромбинового и активированного частичного тромбопластинового времени (АЧТВ), снижением протромбинового индекса, фибриногена, антитромбина III. Коагулопатия чаще встречается при острой тирозинемии (НТ 1A), протекает значительно тяжелее, чем при других болезнях печени, при этом активность трансаминаз и изменения содержания билирубина могут быть выражены умеренно и не соответствовать тяжести состояния ребенка [1, 4, 7, 9, 10].
- Рекомендуется пациентам для дифференциальной диагностики НТ1 определение в сыворотке крови: галактозы для исключения галактоземии тип 1, альфа-1-антитрипсина для исключения дефицита альфа-1-антитрипсина; аммиака в плазме крови для исключения нарушений цикла мочевины [32, 36].
Уровень достоверности рекомендации 5 (уровень достоверности доказательств - C)
Комментарии: к заболеваниям, с которыми необходимо проводить дифференциальную диагностику относятся: галактоземия тип 1, нарушения окисления жирных кислот, митохондриальные гепатопатии, нарушения цикла мочевины, болезнь Вильсона, онкологические заболевания печени и другие заболевания, сопровождающиеся синдромом холестаза. Выбор исследований - индивидуально в зависимости от клинической ситуации.
2.4 Инструментальные диагностические исследования
- Рекомендуется проведение ультразвукового исследования (УЗИ) органов брюшной полости и почек (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек) всем пациентам с клиническими признаками НТ1 для выявления гепато-, сплено- и нефромегалии, асцита [1, 2].
Уровень достоверности рекомендации 5 (уровень достоверности доказательств - C)
Комментарии: Визуализация паренхимы печени начинается обычно с ультразвукового исследования, является первым методом описания, желательно с допплеровским исследованием, а при возможности и эластометрии. У всех пациентов при подозрении на НТ1 должно быть выполнено также УЗИ почек. Контрольные УЗИ печени и почек должны проводится каждые 6 мес., при стабильно снижающихся показателях АФП. Если в печени обнаруживаются узлы (как гипер- так и гипоэхогенные), следует провести дальнейшую визуализацию, предпочтительно с помощью МРТ. Однако не существует единого идеального метода. В некоторой степени выбор метода будет зависеть от имеющихся ресурсов и средств.
При наличии фокального или мультифокального поражения паренхимы при НТ1 уже является основанием для решения вопроса о проведении трансплантации печени. Нет необходимости в экстренной операции при диффузных изменениях печени, циррозе без узлов, так как лечение нитизиноном приводит к регрессу цирроза и дает возможность отсрочить трансплантацию.
Если паренхима имеет диффузную гиперэхогенность, неоднородность, но без объемных включений и при нормальном уровне АФП, показано динамическое исследование согласно плану мониторирования с периодичностью 6 мес. [1, 10 - 13]
При появлении гипоэхогенных округлых образований (узлов регенерации) или иных подозрительных на аденому, карциному, или гемангиому образований повышенной плотности, а также дополнительное визуализирующее исследование, кратность исследования АФП возрастает - раз в 3 мес. Всегда следует иметь диски или снимки предыдущих исследований для сравнительной оценки актуального исследования. У всех пациентов должно быть ультразвуковое исследование не только печени, но и почек. Если узлы присутствуют в печени, следует провести дальнейшую визуализацию, предпочтительно с помощью МРТ с внутривенным контрастированием.
- Рекомендуется ультразвуковая допплерография сосудов печени, селезенки, почек (Дуплексное сканирование сосудов печени, Дуплексное сканирование сосудов селезенки, Дуплексное сканирование артерий почек) пациентам с клиническими признаками НТ1 или с установленным диагнозом НТ1 по показаниям с целью оценки скорости кровотока и состояния сосудов печени, выявления признаков портальной гипертензии [4, 10, 12, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: цветовой допплер может использоваться для оценки сосудов печени и портальной гипертензии. Однако не все узелки могут быть обнаружены, и эффективность метода зависит от опыта специалиста. Мульти-детекторное КТ-сканирование является быстрым и обеспечивает многоплоскостную визуализацию с хорошим пространственным разрешением аномалий в печени. Контраст может улучшить детализацию с 66% до 82%, позволяя выявлять злокачественные изменения [14, 17, 18]. Тем не менее, анализ риска и пользы является обязательным, чтобы избежать облучения у детей, уже подверженных риску злокачественного образования, поэтому он требует повторной оценки. Иногда требуется седация, что так же ограничивает исследование.
- Рекомендовано всем пациентам с клиническими признаками НТ1 проведение эластометрии печени (эластографии печени) с целью оценки степени фиброза [1, 4, 5, 6].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Эластометрия - оптимальный неинвазивный ультразвуковой метод количественной оценки плотности ткани печени (в качестве альтернативы - компьютерная томография органов брюшной полости и/или магнитно-резонансная томографии органов брюшной полости).
- Рекомендовано пациентам с клиническими признаками НТ1 по показаниям проведение компьютерной томографии органов брюшной полости и/или компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием и/или магнитно-резонансная томография органов брюшной полости и/или магнитно-резонансная томография органов брюшной полости с внутривенным контрастированием и/или Магнитно-резонансная холангиопанкреатография с целью выявления объемных образований и оценки состояния протоковой системы [1, 4, 5, 6, 11, 31].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Данные методы визуализации необходимы для исключения процесса малигнизации, например, при подозрении на формирование гепатоцеллюлярной карциномы, риск которой очень велик при показателях АФП, превышающих норму в сотни и даже тысячи раз. Выбор за КТ или МРТ с контрастным усилением. Пораженные гепатоциты контраст не накапливают. Детский возраст не является прямым противопоказанием к исследованию, но ограничивает его применение. Временные рамки: артериальная фаза 10 - 20 сек, контрастирование воротной вены на 60 - 80 сек и печеночные вены на 3 - 5 мин. После внутривенного введения контрастного препарата динамические последовательности обеспечивают анализ васкуляризации узлов. Диффузно-взвешенная визуализация может помочь отличить дифференцированные гепатоцеллюлярные карциномы от доброкачественных узелков
- Рекомендовано пациентам с клиническими признаками НТ1 по показаниям проведение радиоизотопного исследования печени (гепатосцинтиграфия статическая и динамическая, гепатобилисцинтиграфия) и почек (сцинтиграфия почек и мочевыделительной системы) с целью оценки функционального состояния органов [1, 4, 6, 11].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Метод сочетает не только визуализацию, но является и функциональным исследованием. Нарушение внутриклеточного транспорта, экскреции радиофармпрепарата (РФП) с желчью, пути выведения его из организма, в том числе, перераспределения печень/селезенка при статической гепатосцинтиграфии, гиперфиксация РФП в селезенке более 15% являются признаком портальной гипертензии. Участки сниженного накопления - это жировая и соединительная ткань, кисты, аденома (доброкачественная опухоль), узлы регенерации с пониженной васкуляризацией.
Реносцинтиграфия позволяет дифференцировано оценить функцию правой и левой почек.
- Не рекомендуется проведение биопсии печени у детей с циррозом и высоковероятной гепатоцеллюлярной карциномой при НТ1, чтобы избежать риска гематогенной диссеминации злокачественных клеток [24].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Диагноз НТ1 морфологически не верифицируется, т.к. изменения не типичны - жировая дистрофия, пролиферация желчных протоков, многоядерные гепатоциты, разрастание соединительной ткани и образование ложных долек.
- Рекомендовано пациентам с клиническими признаками НТ1 проведение рентгеноденситометрии с целью исследования минеральной плотности костной ткани. [4, 6, 9, 11, 31].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Исследование проводится у пациентов с признаками тубулопатии: изменением лабораторных показателей, рахитоподобными костным деформациями. Рентгеноденситометрию назначают, как правило, детям старше 5 лет.
- Рекомендована рентгенография кистей пациентам с клиническими признаками НТ1 для диагностики (в т.ч., в динамическом наблюдении) костных изменений, вызванных гипофосфатемией [32].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: В т.ч., для оценки костного возраста. Рентгенографическое определение костного возраста назначают детям старше 2 лет.
- Рекомендована пациентам с клиническими признаками НТ1 по показаниям ЭКГ, эхокардиография с целью оценки морфофункционального состояния сердца [4].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Данные методы позволяют оценить морфофункциональное состояние сердца и также необходимы при проведении исследований в условиях седации.
2.5 Иные диагностические исследования
- Рекомендуются при постановке диагноза пациентам с клиническими признаками НТ1 применять мультидисциплинарный подход ввиду того, что заболевания характеризуются поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [1, 4].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: показаны первичные и повторные консультации врача-генетика, врача-офтальмолога, врача-невролога, врача-диетолога, врача-гастроэнтеролога, врача-детского хирурга, врача-хирурга со специализацией по трансплантологии, врача-эндокринолога, врача-кардиолога, врача - детского кардиолога, врача - травматолога-ортопеда, врача-нефролога, врача-педиатра, врача-терапевта, а также врачей других специальностей пациентам с НТ1 [1, 4].
2.6. Дифференциальная диагностика
- Рекомендовано проведение дифференциальной диагностики тирозинемии с заболеваниями со сходной симптоматикой с целью установления диагноза [32, 36].
Уровень достоверности рекомендации 5 (уровень достоверности доказательств - C)
Комментарии: Острую НТ 1 следует дифференцировать с другими наследственными нарушениями обмена веществ, особенно при наличии сопутствующего септического состояния, резистентного к терапии антибиотиками широкого спектра действия. Вирус-ассоциированные заболевания (герпес-группы: цитомегаловирус, Эпштейна-Барр вирус, герпес 1, 2 и 6 типов), TORCH инфекции не исключают наличия НТ1 типа [1, 4, 11].
Диагностический поиск при гепатомегалии и гепатите необходимо проводить с галактоземией, фруктоземией, непереносимостью фруктозы, болезнью Ниманна-Пика, болезнью Вильсона, неонатальным гемохроматозом, гемофагоцитарным лимфогистиоцитозом, митохондриальной цитопатией, врожденными болезнями гликозилирования, дефицитом трансальдолазы, ацетаминофеновой (парацетамолом) интоксикацией, инфекциями (сепсисом, сальмонеллезом, туберкулезом, герпес-вирусной, в том числе, цитомегаловирусной инфекцией, вирусными гепатитами A и B), отравлением грибами, лекарственными средствами на растительной основе. Генерализованная аминоацидемия частый признак печеночной недостаточности, нарушения функции ассимиляции [1, 4, 6, 7].
Поражение почек при НТ 1 следует дифференцировать с цистинозом, синдромом Lowe (окулоцереброренальная дистрофия), почечным канальцевым ацидозом, синдромом Фанкони. При рахитоподобных изменениях скелета рекомендовано исключать гипофосфатазию (низкий уровень щелочной фосфатазы и фосфора в сыворотке), дефицит витамина D (нутритивного и генетически обусловленного), синдром Фанкони [1, 4, 9].
Неврологические кризы рекомендовано дифференцировать от проявлений отека мозга и кровоизлияний, бактериального менингита, гипернатрийемического обезвоживания, острой перемежающейся порфирии [1, 4, 9].
При изолированной гипертирозинемии рекомендовано исключать нарушение в пищевом рационе (повышенное употребление пищевого белка), что сопровождается состоянием транзиторного тирозиноза, функциональной недостаточностью фермента FAH. Также рекомендовано исключать тирозинемии II и III типов, другие болезни печени с нарушением синтетической и детоксикационной функции. [1, 2, 8].
Посиндромный дифференциальный диагноз отражен в приложении А3.2.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Консервативное лечение
Основой лечения является применение патогенетической терапии в сочетании с низкобелковой диетой и назначением специализированных продуктов на основе смесей аминокислот, не содержащих тирозин и фенилаланин.
- Для лечения НТ I всем пациентам рекомендована пожизненная патогенетическая терапия препаратом нитизинон** (NTBC, 2-(2-нитро-4-трифлюорометилбензоил)-1,3-циклогексанедион) [2, 8, 9, 10, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Для большей эффективности лечения нитизинон** целесообразно использовать на стадии, предшествующей развитию гепатоцеллюлярной карциномы. Механизм действия препарата заключается в том, что он блокирует 4-гидроксифенилпируват диоксигеназу и препятствует образованию конечных токсических метаболитов, уровень тирозина в сыворотке крови при этом повышается, что является строгим показанием для ограничения в диете натурального пищевого белка, а вместе с ним и фенилаланина (как предшественника тирозина) и тирозина. Дефицит белка компенсируется путем назначения специализированной диеты с ограничением этих аминокислот.
Доза нитизинона** подбирается индивидуально в зависимости от эффективности, которая оценивается по уровню сукцинилацетона в моче и крови, и уровню тирозина в сыворотке крови. Острая форма тирозинемии (НТ 1A) требует назначения нитизинона** в дозе 2 мг/кг, по мере роста и увеличения массы тела ребенка доза снижается до 1 мг/кг [40].
Поддерживающая терапевтическая доза при НТ 1A составляет 1 мг/кг/сутки, при НТ 1B начальная доза 1 - 1,5 мг/кг/сутки, если уровень тирозина менее 600 - 800 мкМоль/л, суточная доза дается в один-два приема внутрь. Период полувыведения составляет 54 часа, что позволяет рекомендовать однократный прием суточной дозы. Коррекция дозы нитизинона** проводится в зависимости от биохимических показателей и нарастания массы тела ребенка. Около 10% пациентов на терапию нитизиноном** не отвечают, что определяется результатами биохимического мониторинга (сукцинилацетона в моче, функциональные пробы печени, альфа-фетопротеин (АФП). Такие пациенты являются потенциальными претендентами на трансплантацию печени.
При высоком уровне билирубина (> 100 мкмоль/л) и острой печеночной недостаточности в сочетании с гипераммониемией (> 100 мкМоль/л) не исключается необходимость в экстренной трансплантации печени.
Снижение уровня сукцинилацетона на фоне терапии нитизиноном** происходит в течение 24 часов, концентрация аминокислот (тирозина и фенилаланина) повышается в зависимости от количества пищевого натурального белка. АФП снижается медленно и зависит от начальных концентраций, не всегда достигает нормы.
Необходимо увеличение дозы нитизинона** до 2 мг/кг/сутки при отсутствии положительной динамики показателей коагулограммы и уровня сукцинилацетона в моче в течение 2 недель, сохраняющемся высоком уровне тирозина в крови (более 800 мкМоль/л). Лечение нитизиноном** должно быть непрерывным. В ходе терапии препаратом концентрация тирозина увеличивается, перерывы в терапии грозят развитием тирозинемических кризов (порфириноподобных неврологических кризов, малигнизацией). Рекомендуемая концентрация NTBC в плазме 30 - 50 мкМоль. Дети с ожирением требуют поддержания чуть меньшей концентрации препарата на 1 кг веса, в среднем 35 мг/м2/день. Эффективность лечения зависит от сроков установления диагноза и своевременного начала лечения. У 90% пациентов на фоне приема нитизинона** печеночная недостаточность становится контролируемой, внепеченочные проявления, как правило, купируются. Мировой опыт применения нитизинона** (NTBC) у детей, начавших лечение в возрасте до 2 месяцев жизни, показал, что риск развития у них гепатоцеллюлярной карциномы снижается с 40 до 5% [1, 4, 9, 40].
- Рекомендовано назначение диетотерапии с ограничением тирозина и фенилаланина всем пациентам с НТ1 пожизненно с целью снижения образования токсичных метаболитов [1, 8].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Потребность в других незаменимых аминокислотах восполняется назначением специализированных смесей без тирозина и фенилаланина, что позволяет повысить квоту потребления белка и добиться нормального роста и развития ребенка, а также снизить концентрацию тирозина в сыворотке, уменьшить частоту и выраженность возможных побочных эффектов.
Расчет лечебного питания (при наличии терапии нитизиноном) для детей первого года жизни производят исходя из потребности в белке, близкой к физиологической (2,2 - 2,3 г/кг массы тела в сутки), данные приведены в таблице 2, приложение А3.3 Не менее 50% - 60% суточной потребности в белке удовлетворяется за счет специализированной смеси аминокислот (таблица 1, приложение А3.3), остальная часть (40 - 50%) компенсируется белком сцеженного материнского молока или детской молочной смеси с низким содержанием белка (1,2 - 1,3 г белка на 100 мл восстановленной смеси), а после 4-х месяцев также низкобелковыми продуктами прикорма (овощные и фруктовые пюре, безмолочные каши с содержанием белка не более 0,5 г на 100 мл готовой каши, специализированные низкобелковые продукты на основе крахмалов, например, саго и др.). При назначении диеты с низким содержанием тирозина и фенилаланина ориентируются на минимальные потребности в этих аминокислотах (таблица 3, приложение А3.3). Дефицит калорийности лечебного рациона компенсируется с помощью добавления жиров (растительного масла, но не более 3,5 - 4 г общего жира на кг массы тела в сутки) и увеличения квоты углеводов за счет добавления вышеуказанных низкобелковых продуктов, а также 5% глюкозы. Аналогичным образом строится лечебный рацион у пациентов старше года, общий белок рассчитывается исходя из безопасных потребностей в белке (не более 1,5 - 1,8 г/кг массы тела в сутки).
При невозможности немедленного назначения терапии нитизиноном** принципы организации диетотерапии остаются те же, но ограничения в белке более жесткие. Расчет производится, исходя из минимальных потребностей в белке на кг массы тела в сутки (на первом году жизни - 1,5 мг/кг массы тела, у детей старше года от 1,5 до 1,2 г/кг массы тела). Для сбалансированности суточного рациона используют низкобелковые натуральные и специализированные продукты на основе крахмалов, а также растительные масла, в этих продуктах желательно учитывать содержание патогенетически значимых аминокислот. Необходимо пожизненное применение диеты с низким содержанием фенилаланина и тирозина, в остром периоде количество общего белка снижается до 1,2 - 1,5 г/кг массы тела до нормализации содержания сукцинилацетона в моче и/или крови. Пример расчета питания и суточный набор продуктов представлены в таблицах 3 - 4. Основные принципы организации лечебного питания, примеры расчетов и информационные материалы представлены в Приложении А3.3
- При лечении пациентов НТ1 не рекомендовано применять белковые препараты с целью предотвращения образования токсичных метаболитов [1, 2, 3, 4, 10].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Производные крови применяются исключительно по жизненным показаниям при проведении экстракорпоральных методов детоксикации, заменном переливании плазмы, исключаются препараты на основе аминокислот (в том числе гепатопротекторы на основе адеметионина, орнитина и др.). Сыворотки могут использоваться в случае крайней необходимости и после назначения нитизинона**.
- Не рекомендовано применять парацетамол**, амоксициллин + [клавулановая кислота]**, диазепам**, вальпроевая кислота** и другие медикаментозные препараты с выраженной гепатотоксичностью для предотвращения ухудшения функционального состояния печени [1, 2, 3, 4, 10].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Парацетамол** экскретируется через систему цитохрома P450. Диазепам**, препараты вальпроевой кислоты и другие препараты с печеночным путем метаболизма могут вызвать передозировку и ухудшение функционального состояния печени.
- Рекомендовано пациентам с клиническими признаками НТ1 и порфирия-подобным неврологическим кризом (боли/дизестезии, гипертонус в конечностях, рвота/симптомы, напоминающие кишечную непроходимость, пароксизмы и/или слабость) проведение срочной интенсивной терапии, в т.ч., срочное введение нитизинона** перорально или через назогастральный зонд [31, 42].
Для детской популяции - Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Для взрослой популяции - Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: кризы обусловлены прекращением терапии нитизиноном** или у нелеченных пациентов (см. раздел 1.6).
Пациенты требуют тщательного наблюдения, кроме обязательного введения нитизинона** проводится внутривенная коррекция электролитных нарушений (гипонатриемии), артериальной гипертензии, боли, респираторная поддержка вплоть до искусственной вентиляции легких
Возможно внутривенное введение раствора 10% декстрозы**/натрия хлорида** 0,9% в дозах, в 1,5 - 2 раза превышающих нормальную поддерживающую норму для данного возраста в качестве начальной терапии, обычно в сочетании с быстродействующими антигипертензивными средствами и терапией для купирования боли. Иногда для лечения рецидивирующей гипонатриемии требуются внутривенные болюсы 2% натрия хлорида.
При регулярной терапии нитизиноном** кризы не развиваются. Неврологические кризы как у младенцев, так и у детей старшего возраста наблюдались после кратковременного прекращения приема нитизинона** (> 1 месяца) без других явных признаков заболевания НТ-1 (изменения АФП, функциональные тесты печени, включая ПВ/аЧТВ, фосфаты, ацидоз).). Это еще раз подчеркивает важность постоянного соблюдения требований и лабораторного мониторинга уровней NTBC в плазме [31].
Также может применяться, аналогично острой порфирии, в том числе, #гемин 3 мг/кг в течение 3 дней [43].
Обычную диету с ограничением фенилаланина и тирозина пациент должен начать получать в течение 24 - до 48 часов от начала лечения криза [42].
3.2 Хирургическое лечение
- При прогредиентном течении патологического процесса в печени пациентам с НТ1 рекомендована трансплантация печени с целью радикального лечения заболевания [4, 7, 8, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: В состоянии острой печеночной недостаточности трансплантацию печени проводят при условии, если профиль коагуляции не улучшается через 1 неделю лечения. В состоянии хронической печеночной недостаточности показанием для трансплантации печени является гепатоцелюлярная карцинома, а именно рецидив повышения уровня альфа-фетопротеина и/или декомпенсация цирроза печени, при котором ведущими являются различные методы визуализации (МРТ, КТ), появление узлов диаметром более 10 мм и количественное их увеличение. Биопсии узлов следует избегать в связи с риском метастазирования. Решение о трансплантации печени принимается консилиумом врачей.
Трансплантация печени является эффективным методом лечения наследственной тирозинемии при невозможности консервативной терапии и при формировании злокачественных образований в печени [13, 17, 19].
Показаниями к трансплантации печени при НТ1 являются:
1. Диагностированная ГЦК.
2. Появление очаговых образований при МРТ или КТ и рецидив увеличения АФП на фоне лечения нитизиноном при хроническом течении НТ1.
3. Отсутствие эффекта от терапии NTBC при острой тирозинемии, заключающееся в сохраняющейся гипокоагуляции на фоне терапии витамином K.
4. Декомпенсированный цирроз, осложненный асцитом, гипокоагуляцией, зависимость пациента от инфузий альбумина, признаки энцефалопатии, гипераммониемия, когда нет времени на появление эффекта от NTBC.
В отличие от пациентов с ГЦК без сопутствующего метаболического заболевания, при НТ1 в сочетании с ГЦК больные должны быть перемещены в приоритетный лист ожидания на трансплантацию, выжидательно-наблюдательная тактика не допускается.
Кроме того, необходимо подчеркнуть, что даже технически резектабельная опухоль (ГЦК, аденома, гемангиома, холангиокарцинома) у пациента с НТ1 требует трансплантации печени, экстренность которой определяется злокачественностью новообразования.
Выживаемость пациентов после трансплантации не зависит от происхождения трансплантата, орган живого родственного донора, так и трупный орган практически равнозначны по 3-х летней выживаемости и составляет 75,5% и 78,9% (по данным анализа с 2002 по 2012 год 2 103 живых и 46 674 трупных трансплантаций) [15, 16]. Последние годы получает распространение сплит-трансплантация, позволяющая использовать один донорский орган для двух реципиентов.
- Рекомендовано назначение нитизинона** перед планируемой трансплантацией печени при гепатоцеллюлярной карциноме (ГЦК), выявленной на поздних стадиях НТ 1 с целью повышения эффективности терапии [4, 7, 8, 31].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
- При любых хирургических вмешательствах у пациентов, не получавших NTBC, рекомендуется избегать использования премедикации барбитуратами поскольку эти препараты могут спровоцировать порфирия-подобные кризы [26, 27].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
3.3 Иное лечение
Не применяется
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендованы реабилитационные мероприятия, направленные на улучшение функции печени, состояния нервной системы, коррекцию скелетных деформаций пациентам с установленным диагнозом НТ1 согласно другим КР [31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
5.1. Профилактика
- Семьям, имеющим ребенка с НТ1 рекомендуется консультация врача-генетика, с целью определения генетических рисков для семьи и прогноза потомства [31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Как и при других аутосомно-рецессивных заболеваниях при НТ1 для каждой беременности риск рождения ребенка составляет 25%. В семьях, где есть ребенок с тирозинемией, существует возможность проведения пренатальной и преимплантационной диагностики. Пренатальная диагностика НТ1 возможна методами прямой или косвенной ДНК-диагностики образцов ДНК, выделенной из биоптата ворсин хориона на 9 - 11 неделе беременности и/или клеток амниотической жидкости на 20 - 22 неделе беременности
- Рекомендовано проведение профилактической вакцинации без ограничений пациентам, получающим нитизинон** с целью формирования иммунной защиты организма от инфекций [32].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: вакцинацию целесообразно проводить с участием специалистов, имеющих опыт работы с пациентами с метаболическими болезнями, или под их контролем.
5.2. Диспансерное наблюдение
- Рекомендовано наблюдение пациентов с НТ1 при лечении нитизиноном** согласно плану мониторинга (приложение А3.4) [32].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарий: план мониторинга имеет целью как предотвращение осложнений НТ1, так и контроль побочных эффектов и раннюю диагностику осложнений НТ1, ГЦК в первую очередь.
- Рекомендуется всем пациентам с НТ1 определение аминокислот и сукцинилацетона в биологических жидкостях методом тандемной масс-спектрометрии с целью контроля изменений, вызванных тубулопатией [1, 4, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: исследование концентрация аминокислот в крови: в начале терапии, затем частота в первые 6 месяцев - 1 раз в месяц, после первых 6 месяцев и далее 1 раз в 3 месяца; исследование сукцинилацетона в моче: в начале терапии, затем частота в первые 6 месяцев - 1 раз в месяц, после первых 6 месяцев и далее 1 раз в 6 месяцев.
- Рекомендовано всем пациентам с НТ1 определение концентрация нитизинона** в крови с целью регуляции суточной дозы препарата для поддержания адекватного его уровня в плазме и оценки удовлетворительности ингибирования проксимального катаболического пути тирозина [32].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: оптимальным уровнем согласно международным рекомендациям, считается уровень от 40 до 60 мкМ.
Проводится в начале терапии, затем частота в первые 6 месяцев - 1 раз в месяц, после первых 6 месяцев и далее 1 раз в 6 месяцев
- Рекомендовано всем пациентам с НТ1 определение альфа-фетопротеина (АФП) в сыворотке (или плазме) крови, который является одним из биохимических маркеров НТ1 с целью ранней диагностики гепатоцеллюлярной карциномы [1, 4, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: проводится в начале терапии, затем частота в первые 6 месяцев - 1 раз в месяц, после первых 6 месяцев и далее 1 раз в 6 месяцев.
- Рекомендуется проведение коагулограммы (АЧТВ, МНО, протромбиновое время, фибриноген) пациентам с НТ1 для оценки функционального состояния печени и свертывающей системы крови [4, 31, 40].
Уровень достоверности рекомендации 5 (уровень достоверности доказательств - C)
Комментарий: проводится при начале терапии, 1 раз в месяц (первые 6 месяцев), далее частота на фоне длительной терапии 1 р в год.
- Рекомендуется пациентам с НТ1 проведение общего (клинического) анализа крови развернутого (гемоглобин, количество эритроцитов, цветовой показатель, количество лейкоцитов, тромбоцитов, лейкоцитарная формула и скорость оседания эритроцитов), для оценки основных параметров кроветворения и наличия воспалительных процессов [32].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: проводится при начале терапии, 1 раз в месяц (первые 6 месяцев), далее частота на фоне длительной терапии не реже 1 р в год.
- Рекомендуется пациентам с НТ1 проведение общего (клинического) анализа мочи для оценки состояния мочевыводящих путей и почек [32].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: проводится при начале терапии, 1 раз в месяц (первые 6 месяцев), далее частота на фоне длительной терапии обычно, в среднем, 1 р в год.
- Рекомендуется пациентам с НТ1 проведение биохимического анализа крови (глюкоза, общий белок, белковые фракции (исследование уровня альбумина в крови, определение альбумин/глобулинового соотношения в крови), общий, связанный и свободный билирубин холестерин, триглицериды, липопротеиды низкой и высокой плотности (исследование уровня липопротеинов в крови), щелочная фосфатаза, гамма-глютамилтрансфераза (ГГТ), креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), кальций общий и ионизированный, натрий, калий, неорганический фосфор, железо и ферритин) для оценки функционального состояния внутренних органов, наличия инфекционных осложнений и нутритивного статуса пациента [1, 4, 5, 10, 31].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: проводится при начале терапии, 1 раз в 3 месяца (первые 6 месяцев), далее частота на фоне длительной терапии не реже 1 р в год.
- Рекомендуется проведение ультразвукового исследования (УЗИ) органов брюшной полости и почек (ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование почек) всем пациентам с НТ1 для выявления гепато-, сплено- и нефромегалии, асцита [1, 2].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5.
Комментарии: У пациентов с НТ-1, сохраняются высокие риски злокачественных новообразований, в том числе на фоне терапии и отчасти после трансплантации печени. Эти риски могут быть существенно снижены до уровня ниже 1%, если лечение NTBC начато в раннем детстве и продолжается без перерыва. Пожизненное наблюдение за этими печеночными осложнениями при НТ-1 является обязательным. Проводится с частотой не реже 1 р в год.
- Рекомендуется ультразвуковая допплерография сосудов печени, селезенки, почек всем пациентам с НТ1 по показаниям с целью оценки скорости кровотока и состояния сосудов печени, выявления признаков портальной гипертензии [4, 10, 12, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Цветовой допплер может использоваться для оценки сосудов печени и портальной гипертензии. Однако не все узелки могут быть обнаружены, и эффективность метода зависит от опыта специалиста. Мультидетекторное КТ-сканирование является быстрым и обеспечивает многоплоскостную визуализацию с хорошим пространственным разрешением аномалий в печени. Контраст может улучшить детализацию с 66% до 82%, позволяя выявлять злокачественные изменения [14, 17, 18]. Тем не менее, анализ риска и пользы является обязательным, чтобы избежать облучения у детей, уже подверженных риску злокачественного образования, поэтому он требует повторной оценки. Иногда требуется седация, что также ограничивает исследование.
- Рекомендовано всем пациентам с НТ1 проведение эластометрии (эластографии) печени с целью оценки состояния ткани печени и эффективности терапии [1, 4, 5, 6].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Фиброэластография - оптимальный неинвазивный ультразвуковой метод количественной оценки плотности ткани печени, позволяет определить эффективность терапии. Частота - ежегодно (в качестве альтернативы - компьютерная томография органов брюшной полости и/или магнитно-резонансная томография органов брюшной полости с магнитно-резонансной холангиопанкреатографией (МРХПГ))
- Рекомендовано всем пациентам с НТ1 использование компьютерной томографии органов брюшной полости и/или магнитно-резонансной томографии органов брюшной полости с магнитно-резонансной холангиопанкреатографией (МРХПГ) с целью выявления объемных образований и оценки состояния протоковой системы [1, 4, 5, 6, 11, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Данные методы визуализации необходимы для исключения процесса малигнизации, например, при подозрении на формирование гепатоцеллюлярной карциномы, риск которой очень велик при показателях АФП, превышающих норму в сотни и даже тысячи раз. Выбор за КТ или МРТ с контрастным усилением, препаратом выбора для МРТ является гадоксетовая кислота (торговое название - примовист). Пораженные гепатоциты контраст не накапливают. Детский возраст не является прямым противопоказанием к исследованию, но ограничивает его применение. Временные рамки: артериальная фаза 10 - 20 сек, контрастирование воротной вены на 60 - 80 сек и печеночные вены на 3 - 5 мин. После внутривенного введения гадоксетовой кислоты динамические последовательности обеспечивают анализ васкуляризации узлов. Диффузно-взвешенная визуализация может помочь отличить дифференцированные гепатоцеллюлярные карциномы от доброкачественных узелков. Показаны при начале терапии и далее с частотой 1 раз в год.
- Рекомендовано всем пациентам с клиническими признаками НТ1 проведение радиоизотопного исследования печени (гепатосцинтиграфия статическая и динамическая, гепатобилисцинтиграфия) и почек (реносцинтиграфия) с целью оценки функционального состояния органов [1, 4, 6, 11].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Метод сочетает не только визуализацию, но является и функциональным исследованием. Нарушение внутриклеточного транспорта, экскреции радиофармпрепарата (РФП) с желчью, пути выведения его из организма, в том числе, перераспределения печень/селезенка при статической гепатосцинтиграфии, гиперфиксация РФП в селезенке более 15% являются признаком портальной гипертензии. Участки сниженного накопления - это жировая и соединительная ткань, кисты, аденома (доброкачественная опухоль), узлы регенерации с пониженной васкуляризацией.
Реносцинтиграфия позволяет дифференцированно оценить функцию правой и левой почек. Частота определяется индивидуально.
- Рекомендовано пациентам с НТ1 проведение рентгеноденситометрии с целью исследования минеральной плотности костной ткани [4, 6, 9, 11, 31].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Исследование проводится у пациентов с признаками тубулопатии: изменением лабораторных показателей, рахитоподобными костным деформациями. Назначают денситометрию - как правило, детям старше 5 лет. Проводится при начале терапии и далее частота по показаниям, в среднем, 1 раз в год.
- Рекомендована рентгенография кистей пациентам с клиническими признаками НТ1 в динамическом наблюдении с целью оценки костных изменений, вызванных гипофосфатемией [32].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: В т.ч., для оценки костного возраста. Рентгенографическое определение костного возраста назначают детям старше 2 лет.
- Рекомендована всем пациентам с клиническими признаками НТ1 рентгенография костей скелета (Рентгенография пораженной части костного скелета) и/или Прицельная рентгенография органов грудной клетки, с целью диагностики ортопедической патологии, вызванной гипофосфатемией [4].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций C).
Комментарии: Показаны при планируемой ортопедической коррекции. Прицельная рентгенография органов грудной клетки показана в случае проведения поднаркозных исследований, при наличии клинических проявлений дыхательной недостаточности, кардиомиопатии.
- Рекомендована всем пациентам с НТ1 по показаниям электрокардиография, эхокардиография с целью оценки морфофункционального состояния сердца [4].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Данные методы позволяют оценить морфофункциональное состояние сердца и также необходимы при проведении поднаркозных исследований. Частота определяется индивидуально.
- Рекомендовано проводить контроль терапии всем пациентам с НТ1 в течение первой недели лечения с целью оценки клинико-лабораторной динамики и коррекции дозы нитизинона** [1, 4, 9, 10].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Контролю подлежат следующие показатели крови: КЩС, функциональные пробы печени (билирубин, АЛТ, АСТ, ГГТП - гаммаглютамилтранспептидаза, щелочная фосфатаза, альбумин), коагулограмма (ПТИ, АЧТВ, фибриноген), мочевина, электролиты, креатинин, кальций, фосфор, клеточный состав крови, аминокислотный спектр, АФП, сукцинилацетон, по возможности, концентрация NTBC, при острой печеночной недостаточности - дополнительно определение аммония, глюкозы; а также показатели мочи: глюкоза, аминокислоты, фосфор- и кальций/креатининовые коэффициенты, альбумин, белок, бета-2-микроглобулин.
В дальнейшем после нормализации показателей интервал между исследованиями составляет не менее 6 месяцев.
- Рекомендован по показаниям пациентам с НТ1 контроль уровня фолатов (Исследование уровня фолиевой кислоты в сыворотке крови), витамина B12 (Определение уровня витамина B12 (цианокобаламин) в крови), сывороточного железа (Исследование уровня железа сыворотки крови) и ферритина (Исследование уровня ферритина в крови), витаминов A, E, D (Исследование уровня 1,25-OH витамина Д в крови), микроэлементов селена, цинка, меди с целью оценки нутритивного статуса и проведения корректирующей терапии [1, 4, 8].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Фолаты крови контролируют при нарушениях свертывающей функции крови и с целью дифференциального диагноза коагулопатий.
- Рекомендуется пациентам с НТ1 прием (осмотр, консультация) врача-офтальмолога (осмотр с помощью щелевой лампы) с целью своевременной диагностики и лечения глазной патологии [1, 4, 10].
Уровень достоверности доказательств - 4 (уровень убедительности рекомендаций C).
Комментарии: Осмотр следует проводить до начала медикаментозной терапии и ежемесячно в течение полугода после начала лечения. Так как возможны побочные эффекты нитизинона** - конъюнктивит, помутнение роговицы, кератит, светобоязнь, обратимая лейкопения, гранулоцитопения и тромбоцитопения. Реже отмечаются лейкоцитоз, блефарит, кожный зуд, эксфолиативный дерматит, эритематозная сыпь. После первых 6 месяцев - частота - по показаниям, в среднем - 1 раз в год.
- Рекомендуется пациентам с НТ1 проведение коррекции лечебного питания и симптоматической терапии с целью исключения белково-энергетической недостаточности [32]
уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: Коррекцию диетотерапии проводят врачи-генетики или врачи-диетологи с частотой 1 р/мес на 1 году жизни, далее 1 р/3 мес и по показаниям до 3 лет; 1 р 6 мес после 3 лет
- Рекомендуются для наблюдения пациентов с установленным диагнозом НТ1 применять мультидисциплинарный подход ввиду того, что заболевания характеризуются поражением многих органов и систем, требует комплексной терапии, что диктует необходимость совместного ведения пациента специалистами разных профилей [12, 13, 15, 28].
уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: показаны повторные и первичные консультации врача-генетика, врача-офтальмолога, врача-невролога, врача-ортопеда, врача-гастроэнтеролога, врача-эндокринолога, врача-кардиолога, врача - детского кардиолога, врача-нефролога, врача-педиатра, врача-терапевта, врача-трансплантолога, а также врачей других специальностей пациентам с НТ1, имеющим нарушения функций соответствующих органов и систем
- Рекомендуется обучение родителей правилам организации терапии в межприступный период и в период угрозы метаболического криза пациентов с НТ1 с целью предотвращения развития повторных метаболических кризов [37, 41].
уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: У родителей ребенка всегда должна быть памятка с указанием неотложных мероприятий в период начинающегося метаболического криза.
6. Организация оказания медицинской помощи
Пациентам с НТ1, в зависимости от необходимости, может быть оказана медицинская помощь любого вида, условия, формы, предусмотренных законодательством Российской Федерации.
Показания для госпитализации в медицинскую организацию:
1. проведение диагностики и лечения, требующие продолжительного (дневное или круглосуточное пребывание) медицинского наблюдения и мониторинга клинико-лабораторных показателей, подготовка к трансплантации печени, трансплантация печени;
2. необходимость проведения различных видов экспертиз или обследования в медицинской организации при невозможности проведения их в амбулаторных условиях (в том числе оформление заключения федерального консилиума/врачебной комиссии);
3. острые угрожающие для жизни и развития осложнений состояния, требующие неотложного лечения, в том числе интенсивной терапии, а также круглосуточного медицинского наблюдения и проведения специальных видов обследования и лечения.
Показания к выписке пациента из медицинской организации:
1. отсутствие угрозы для жизни пациента и угрозы развития осложнений, требующих неотложного лечения при завершение диагностических мероприятий.
2. стабилизация состояния и основных клинико-лабораторных показателей патологического процесса, отсутствие необходимости в продолжительном медицинском наблюдении (дневное или круглосуточное пребывание);
3. выполнен план обследования и лечения пациента, даны рекомендации по дальнейшему наблюдению и лечению.
4. необходимость перевода пациента в другое медицинское учреждение или учреждение социального обеспечения.
Продолжительность госпитализации зависит от скорости верификации диагноза и начала специфической терапии. Ответ на лечение нитизиноном отмечается в первые дни. Продолжительность госпитализации также зависит от скорости восстановления показателей коагулограммы и обычно составляет 30 дней.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дети в возрасте старше года наиболее часто, до установления диагноза, госпитализируются по поводу гепатита, объемного образования печени в хирургическое отделение, обращаются за консультацией к онкологу, инфекционисту и гастроэнтерологу-гепатологу.
Проведение дифференциальной диагностики, установление диагноза и назначение специфической терапии сокращает срок госпитализации. На фоне назначения нитизинона продолжительность стационарного лечения обычно не превышает 14 дней. Пациентов со стабильными показателями мониторинга метаболизма и уровня АФП можно наблюдать в амбулаторно-поликлинических условиях и в дневном стационаре (длительность госпитализации не менее 10 суток).
Ультразвуковое исследование брюшной полости должно проводиться каждые 6 месяцев, а магнитно-резонансная томография (МРТ) печени ежегодно, если выявляются подозрительные узловые образования, показаны методы визуализации с контрастированием (КТ, МРТ, радиоизотопное исследование), позволяющие подтвердить гепатоцеллюлярную карциному. Уровень альфа-фетопротеина должен контролироваться каждые 3 - 6 месяцев, а повторное повышение АФП должно служить поводом для углубленного обследования на предмет ГЦК. Показана консультация онколога.
Контроль терапии нитизиноном включает определение уровня фенилаланина и тирозина. При низком (менее 20 мкМоль/л) уровне фенилаланина необходимо увеличение белка в диете. Уровень тирозина желательно удерживать в диапазоне 200 - 400 мкМоль/л, что не позволяет появиться побочным эффектам. Нежелательные эффекты в виде фотобоязни и чувства "песка в глазах" появляются при увеличении концентрации тирозина в сыворотке крови выше 800 мкМоль/л и обусловлено не столько действием нитизинона, сколько нарушением диеты и низкой комплаентностью родителей.
Заболевание детей, имеющих печеночную недостаточность, часто протекает крайне тяжело с выраженной коагулопатией и асцитами. Назначение нитизинона приводит к клиническому улучшению в течение нескольких дней, при этом 90% пациентов отвечают на терапию. Если коагулограмма не улучшается в течение 1 недели, то дозу нитизинона следует повысить. На фоне лечения у большинства детей, которые имеют клинические проявления цирроза и портальной гипертензии, лечение приводит к компенсации и даже регрессу цирротических изменений.
Функция почечных канальцев нормализуется, прекращаются потери кальция и фосфора с мочой.
Лечение нитизиноном в течение первых 3 месяцев жизни предотвращает развитие кардиомиопатии, при более позднем начале терапии ее течение улучшается независимо от формы заболевания.
Применение нитизинона обеспечивает полное купирование неврологических кризов по типу порфирии.
Терапия нитизиноном переключат фенотип НТ 1 в фенотип тирозинемии II (см. Приложение А3.1). Естественный ход развития НТ II типа, представляет собой генетический дефицит 4-гидроксифенилпируват диоксигеназы, является чрезвычайно редким и плохо описанным в литературе, но задержка интеллектуального развития является общеизвестным компонентом в структуре данного заболевания.
Лечение тубулопатии (синдрома Фанкони) и витамин Д-резистентного рахита наиболее эффективно на ранних стадиях и включает кроме NTBC назначение активных метаболитов витамина Д (кальцитриола**), препаратов кальция и двуосновных фосфатов. Обследование включает определение КЩС (pH крови, стандартных бикарбонатов, дефицит оснований).
Сочетание аминоацидурии, глюкозурии, фосфатурии, почечного канальцевого ацидоза свидетельствует о полном синдроме Фанкони и приводит к тяжелому рахиту, нефрокальцинозу, гломерулосклерозу и хронической почечной недостаточности.
Без лечения нитизиноном подавляющее большинство детей погибает до 15-летнего возраста, определяющим в прогнозе является время дебюта заболевания, т.е. дети с острой и подострой тирозинемией (НТ1A) умирают до 1 года. Использование нитизинона без патогенетической диетотерапии также приводит к медленному прогрессированию нарушений функции печени и почек, изменениям опорно-двигательного аппарата.
Критерии оценки качества медицинской помощи
Таблица 1. Критерии оценки качества первичной медико-санитарной помощи взрослым и детям при наследственной тирозинемии 1 типа (коды по МКБ-10: E70.2)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнено комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии (при установлении диагноза)
Да/Нет
2.
Выполнено молекулярно-генетическое исследование мутаций в гене FAH (при установлении диагноза)
Да/Нет
3.
Выполнен прием (осмотр, консультация) врача-генетика первичный (при установлении диагноза)
Да/Нет
4.
Выполнено назначение нитизинона (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний)
Да/Нет
5.
Выполнено назначение специализированного продукта лечебного питания, лишенного фенилаланина и тирозина
Да/Нет
Таблица 2. Критерии оценки качества специализированной медицинской помощи взрослым и детям при наследственной тирозинемии 1 типа (коды по МКБ-10: E70.2)
N п/п
Критерии оценки качества
Оценка выполнения
1.
Выполнено комплексное определение концентрации на аминокислоты и ацилкарнитины в крови методом тандемной масс-спектрометрии
Да/Нет
2.
Проведено ультразвуковое исследование органов брюшной полости (комплексное)
Да/Нет
3.
Выполнено назначение специализированного продукта лечебного питания, лишенного фенилаланина и тирозина
Да/Нет
Список литературы
1. Баранов А.А., Полякова С.И., Байдакова Г.В., Бушуева Т.В., Вашурина Т.В.. Потапов А.С., Журкова Н.В., Варичкина М.А. Наследственная тирозинемия I типа (серия "Болезни детского возраста от А до Я". Союз педиатров России). - Педиатрия. - 2012 - 60 с.
2. Баранов А.А., Намазова-Баранова Л.С., Боровик Т.Э., Ладодо К.С., Бушуева Т.В., Маслова О.И., Кузенкова Л.М., Журкова Н.В., Звонкова Н.Г. и др. Диетотерапия при наследственных болезнях аминокислотного обмена Методическое письмо. Москва. 2013. 97 с.
3. МР 2.3.1.2432-08 "Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации" (утв. Главным государственным санитарным врачом РФ 18 декабря 2008 г.).
4. Полякова С.И., Савостьянов К.В., Пушков А.А. Наследственная тирозинемия 1-го типа: что нужно знать педиатрам. Журнал Практика педиатра. 2014 - Февраль. - С. 4 - 16.
5. Angileri F, Bergeron A, Morrow G, Lettre F, Gray G, Hutchin T, Ball S, Tanguay RM. Geographical and Ethnic Distribution of Mutations of the Fumarylacetoacetate Hydrolase Gene in Hereditary Tyrosinemia Type 1. JIMD Rep. 2015 Feb 15.
6. Bahador A, Dehghani SM, Geramizadeh B, Nikeghbalian S, Bahador M, Malekhosseini SA, Kazemi K, Salahi H. Liver Transplant for Children With Hepatocellular Carcinoma and Hereditary Tyrosinemia Type 1. Exp Clin Transplant. 2014 Mar 28.
7. Dehghani SM, Haghighat M, Imanieh MH, Karamnejad H, Malekpour A. Clinical and para clinical findings in the children with tyrosinemia referring for liver transplantation. Int J Prev Med. 2013 Dec; 4(12): 1380 - 5.
8. Dorothy E.M. Francis Diet for Sick Children Forth Edition. Dietary management of disoders of amino acid metabolism, organic acidaemias and urea cycle defects 1987.
9. Maiorana A, Malamisura M, Emma F, Boenzi S, Di Ciommo VM, Dionisi-Vici C. Early effect of NTBC on renal tubular dysfunction in hereditary tyrosinemia type 1. Mol Genet Metab. 2014 Nov; 113(3): 188 - 93.
10. Nakamura K, Matsumoto S, Mitsubuchi H, Endo F. Diagnosis and treatment of hereditary tyrosinemia in Japan. Pediatr Int. 2015 Feb; 57(1): 37 - 40.
11. van Ginkel WG, Gouw AS, van der Jagt EJ, de Jong KP, Verkade HJ, van Spronsen FJ. Hepatocellular carcinoma in tyrosinemia type 1 without clear increase of AFP. Pediatrics. 2015 Mar; 135(3): e 749 - 52.
12. Zeybek AC, Kiykim E, Soyucen E, Cansever S, Altay S, Zubarioglu T, Erkan T, Aydin A. Hereditary tyrosinemia type 1 in Turkey: twenty year single-center experience. Pediatr Int. 2015 Apr; 57(2): 281 - 9.
13. Macias I., ![]() A., Bernardo-Seisdedos G. et al. Hereditary tyrosinemia type I-associated mutations in fumarylacetoacetate hydrolase reduce the enzyme stability and increase its aggregation rate. J. Biol. Chem. (2019) 294(35) 13051 - 13060. DOI: https://doi.org/10.1074/jbc.RA119.009367
A., Bernardo-Seisdedos G. et al. Hereditary tyrosinemia type I-associated mutations in fumarylacetoacetate hydrolase reduce the enzyme stability and increase its aggregation rate. J. Biol. Chem. (2019) 294(35) 13051 - 13060. DOI: https://doi.org/10.1074/jbc.RA119.009367
14. Новиков Петр Васильевич. Тирозинемия I типа: клиника, диагностика и лечение//Рос вестн перинатол и педиат. 2012. N Приложение. URL: https://cyberleninka.ru/article/n/tirozinemiya-i-tipa-klinika-diagnostika-i-lechenie
15. Larochelle J., Alvarez F.,  J.F. et al. Effect of nitisinone (NTBC) treatment on the clinical course of hepatorenal tyrosinemia in
J.F. et al. Effect of nitisinone (NTBC) treatment on the clinical course of hepatorenal tyrosinemia in  . Mol. Gen. Metab., 107 (1) (2012), pp. 49 - 54
. Mol. Gen. Metab., 107 (1) (2012), pp. 49 - 54
16. Baydakova GV, Ivanova TA, Mikhaylova SV, et al. The Unique Spectrum of Mutations in Patients with Hereditary Tyrosinemia Type 1 in Different Regions of the Russian Federation. JIMD Reports. 2019; 45: 89 - 93. DOI: 10.1007/8904_2018_144.
17. Russo P.A., Mitchell G.A., Tanguay R.M. Tyrosinemia: a review. Pediatr Dev Pathol 2001; 4(3): 212 - 221
18. Schady D.A., Roy A., Finegold M.J. Liver tumors in children with metabolic disorders. Transl Pediatr 2015; 4(4): 290 - 303. DOI: 10.3978/j.issn.2224-4336.2015.10.08
19. Weinberg A.G., Mize C.E., Worthen H.G. The occurrence of hepatoma in the chronic form of hereditary tyrosinemia. J Pediatr 1976; 88(3): 434 - 438. DOI: 10.1016/s0022-3476(76)80259-4
20. van Spronsen F.J., Berger R., Smit G.P., de Klerk J.B., Duran M., Bijleveld C.M. et al. Tyrosinaemia type I: orthotopic liver transplantation as the only definitive answer to a metabolic as well as an oncological problem. J Inherit Metab Dis 1989; 12 (Suppl 2): 339 - 342. DOI: 10.1007/bf03335416
21. van Spronsen FJ, Thomasse Y, Smit GPA, Leonard JV, Clayton PT, Fidler V, Berger R, et al: Hereditary tyrosinemia type I: A new clinical classification with difference in prognosis on dietary treatment. Hepatology. 1994; 20: 1187.
22. Mitchell GA, Lambert M, Tanguay RM: Hypertyrosinemia, in Scriver CR, Beaudet A, Sly W, Valle D (eds): The Metabolic and Molecular Bases of Inherited Disease, 7th ed. New York, McGraw-Hill, 1995, p 1077
23.  Y., Berthier MT. (2017) Newborn Screening for Hereditary Tyrosinemia Type I in
Y., Berthier MT. (2017) Newborn Screening for Hereditary Tyrosinemia Type I in  : Update. In: Tanguay R. (eds) Hereditary Tyrosinemia. Advances in Experimental Medicine and Biology, vol 959. Springer, Cham
: Update. In: Tanguay R. (eds) Hereditary Tyrosinemia. Advances in Experimental Medicine and Biology, vol 959. Springer, Cham
24. Khanna Rajeev, Verma Sanjeev Kumar. Pediatric hepatocellular carcinoma. World J Gastroenterol. 2018 Sep 21; 24(35): 3980 - 3999. Published online 2018 Sep 21. doi: 10.3748/wjg.v24.i35.3980
25. Bartlett DC, Lloyd C, McKiernan PJ, Newsome PN. Early nitisinone treatment reduces the need for liver transplantation in children with tyrosinaemia type 1 and improves post-transplant renal function. J Inherit Metab Dis. 2014 Sep; 37(5): 745 - 52. doi: 10.1007/s10545-014-9683-x
26. Dubois J, Garel L, Patriquin H, Paradis K, Forget S, Filiatrault D, Grignon A, et al: Imaging features of type 1 hereditary tyrosinemia: A review of 30 patients. Pediatr Radiol. 1996; 26: 845.
27. Mitchell GA, Larochelle J, Lambert M, Michaud J, Grenier A, Ogier H, Gauthier M, et al: Neurologic crises in hereditary tyrosinemia. N Engl J Med. 1990; 322: 432.
28. Strife CF, Zuroweste EL, Emmett EA, Finelli VN, Petering HG, Berry HK: Tyrosinemia with acute intermittent porphyria: Aminolevulinic acid dehydratase deficiency related to elevated urinary aminolevulinic acid levels. J Pediatr. 1977; 90: 400
29. Glorieux FH: Rickets, the continuing challenge. N Engl J Med. 1991; 325: 1875.
30. Lindblad B,  SP,
SP, ![]() S, Nordborg C, Solymar L, Velander H: Cardiomyopathy in fumarylacetoacetase deficiency (hereditary tyrosinaemia): A new feature of the disease. J Inherit Metab Dis. 1987; 10: 319.
S, Nordborg C, Solymar L, Velander H: Cardiomyopathy in fumarylacetoacetase deficiency (hereditary tyrosinaemia): A new feature of the disease. J Inherit Metab Dis. 1987; 10: 319.
31. Chinsky J. M., Singh R., Ficicioglu C. et al. Diagnosis and treatment of tyrosinemia type I: a US and Canadian consensus group review and recommendations Genet Med. 2017 Dec; 19(12)
32. Jeffrey M Chinsky, MD, PhD, Rani Singh, PhD, RD, Can Ficicioglu, MD, PhD, Clara D M van Karnebeek, MD, PhD, Markus Grompe, MD, Grant Mitchell, MD, Susan E Waisbren, PhD, Muge Gucsavas-Calikoglu, MD, Melissa P Wasserstein, MD, Katie Coakley, PhD, RD, and C Ronald Scott, MD Diagnosis and treatment of tyrosinemia type I: a US and Canadian consensus group review and recommendations Genet Med. 2017 Dec; 19(12)
33. https://emedicine.medscape.com/article/949816-workup
34. Faix, J. D. (2013). Biomarkers of sepsis. Critical Reviews in Clinical Laboratory Sciences, 50(1), 23 - 36. doi: 10.3109/10408363.2013.764490
35. Pierrakos C, Velissaris D, Bisdorff M, Marshall JC, Vincent JL. Biomarkers of sepsis: time for a reappraisal. Crit Care. 2020 Jun 5; 24(1): 287
36. Deirdre A. Kelly (Editor)Diseases of the Liver and Biliary System in Children, 4th Edition ISBN: 978-1-119-04690-5 March 2017 Wiley-Blackwell 648 Pages
37. Development of newborn screening connect (NBS connect): a self-reported patient registry and its role in improvement of care for patients with inherited metabolic disorders. Orphanet J Rare Dis. 2017 Jul 19; 12(1): 132, https://depts.washington.edu/tyros/pdfs/New_Parents_Guide_to_Tyrosinemia.pdf
38. Nissenkorn A, Korman SH, Vardi O, Levine A, Katzir Z, Ballin A, Lerman-Sagie T. Carnitine-deficient myopathy as a presentation of tyrosinemia type I. J Child Neurol. 2001 Sep; 16(9): 642 - 4
39. Lisa Sniderman King, MSc, CGC, Cristine Trahms, MS, RD, and C Ronald Scott, MD. In Adam MP, Feldman J, Mirzaa GM, et al., editors. Seattle (WA): University of Washington, Seattle; 1993 - 2024  [Internet]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1515/
[Internet]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1515/
40. de Laet C, Dionisi-Vici C, Leonard JV, McKiernan P, Mitchell G, Monti L, de Baulny HO, Pintos-Morell G,  U. Recommendations for the management of tyrosinaemia type 1. Orphanet J Rare Dis. 2013 Jan 11; 8: 8
U. Recommendations for the management of tyrosinaemia type 1. Orphanet J Rare Dis. 2013 Jan 11; 8: 8
41. Barnby E. Tyrosinemia type 1: an overview of nursing care. Pediatr Nurs. 2014 Mar-Apr; 40(2): 61 - 8, 90. PMID: 24941508
42. Dawson C, Ramachandran R, Safdar S, Murphy E, Swayne O, Katz J, Newsome PN, Geberhiwot T. Severe neurological crisis in adult patients with Tyrosinemia type 1. Ann Clin Transl Neurol. 2020 Sep; 7(9): 1732 - 1737. doi: 10.1002/acn3.51160. Epub 2020 Aug 21. PMID: 32820610; PMCID: PMC7480904
43. Neeleman RA, Wilson JHP, Williams M, Langendonk JG. Heme as an initial treatment for severe decompensation in tyrosinemia type 1. Genet Med. 2020 Feb; 22(2): 437 - 438. doi: 10.1038/s41436-019-0658-z. Epub 2019 Oct 1. PMID: 31570800
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Анисимова Инга Вадимовна, к.м.н., заведующая отделом организации медицинской помощи, врач-генетик ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
2. Багаева Мадлена Энверовна, к.м.н., старший научный сотрудник отделения педиатрической гастроэнтерологии, гепатологии и диетологии Клиники ФГБУН "ФИЦ питания и биотехнологии"
3. Байдакова Галина Викторовна, к.б.н., ведущий научный сотрудник лаборатории наследственных болезней обмена ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Российского общества медицинских генетиков.
4. Баранов Александр Александрович, академик РАН, профессор, д.м.н.; Почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", профессор кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России
5. Бушуева Татьяна Владимировна, д.м.н., ФГАУ "Научный медицинский исследовательский центр здоровья детей" МЗ РФ,
6. Вашакмадзе Нато Джумберовна, д.м.н., доцент кафедры факультетской педиатрии ПФ ФГБОУ ВО РНИМУ имени Н.И. Пирогова, НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", член Союза педиатров России.
7. Гундобина Ольга Станиславовна, к.м.н., в.н.с., врач-гастроэнтеролог НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", член Союза педиатров России
8. Дегтярева Анна Владимировна, д.м.н., профессор, врач высшей категории, заведующая отделом педиатрии, ФГБУ "НМИЦ акушерства, гинекологии и перинатологии им. Ак. В.И. Кулакова"
9. Журкова Наталия Вячеславовна, к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", член Союза педиатров России, член Ассоциации медицинских генетиков (АМГ) mailto:annadim@yahoo.com
10. Захарова Екатерина Юрьевна, д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Российского общества медицинских генетиков, член европейского общества по изучению наследственных болезней обмена веществ (SSIEM).
11. Кондакова Ольга Борисовна, к.м.н., врач-генетик ФГАУ "Научный медицинский исследовательский центр здоровья детей" МЗ РФ
12. Куцев Сергей Иванович, академик РАН, д.м.н., директор ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", Президент Ассоциации медицинских генетиков.
13. Лаврова Алла Евгеньевна, д.м.н., главный научный сотрудник, врач высшей квалификационной категории по специальности "Педиатрия", заведующая 2-м педиатрическим отделением, ФГБОУ ВО "Приволжский исследовательский медицинский университет" МЗ РФ
14. Михайлова Светлана Витальевна, д.м.н., заведующая отделением ФГБУ "Российская Детская Клиническая Больница" МЗ РФ.
15. Мовсисян Гоар Борисовна, к.м.н., врач отделения гастроэнтерологии ФГАУ "Научный медицинский исследовательский центр здоровья детей" МЗ РФ
16. Назаренко Людмила Павловна, профессор, д.м.н., заместитель директора по научной и лечебной работе, руководитель лаборатории наследственной патологии НИИ медицинской генетики, Томского НИМЦ РАН, член Ассоциации медицинских генетиков (АМГ).
17. Намазова-Баранова Лейла Сеймуровна, академик РАН, профессор, д.м.н., Президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
18. Николаева Екатерина Александровна, д.м.н., проф., член Российского общества медицинских генетиков
19. Пашкова Ирина Евгеньевна, к.м.н., заведующая педиатрическим отделением ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова"
20. Первунина Татьяна Михайловна, к.м.н., Директор Института перинатологии и педиатрии, ФГБУ НМИЦ им В.А. Алмазова МЗ РФ mailto:ptm.pervunina@yandex.ru
21. Печатникова Наталья Леонидовна, врач-невролог, заведующий отделением, Морозовская ДГКБ ДЗМ
22. Погосян Нелли Сергеевна, представитель Всероссийского общества орфанных заболеваний
23. Полякова Светлана Игоревна, д.м.н., профессор кафедры госпитальной педиатрии им. академика В.А. Таболина Педиатрического факультета Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, г. Москва
24. Потапов Александр Сергеевич, д.м.н., профессор, отделение гастроэнтерологии ФГАУ "Научный медицинский исследовательский центр здоровья детей" МЗ РФ, кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет)
25. Пушков Александр Алексеевич, к.б.н., ведущий научный сотрудник лаборатории медицинской геномики ФГАУ "Научный медицинский исследовательский центр здоровья детей" Минздрава России, член Ассоциации медицинских генетиков
26. Репина Светлана Афанасьевна, к.м.н., врач-генетик отдела организации медицинской помощи ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова"
27. Савостьянов Кирилл Викторович, д.б.н., начальник Медико-генетического центра, заведующий лабораторией медицинской геномики ФГАУ "НМИЦ здоровья детей" Минздрава России, профессор кафедры педиатрии и общественного здоровья ФГАУ "НМИЦ здоровья детей" Минздрава России, член ассоциации медицинских генетиков
28. Сеитова Гульнара Наримановна, к.м.н., главный врач Медико-генетического центра (Генетической клиники) НИИ медицинской генетики, Томского НИМЦ РАН
29. Свиридова Валерия Валерьевна, врач-генетик отдела организации медицинской помощи ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", м.н.с лаборатории мутагенеза ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова"
30. Селимзянова Лилия Робертовна, к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", доцент кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет)
31. Смирнова Ольга Яковлевна, врач-генетик, старший научный сотрудник отдела стандартизации и изучения основ доказательной медицины НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", член Союза педиатров России, член Ассоциации медицинских генетиков
32. Строкова Татьяна Викторовна, д.м.н., профессор РАН, заведующая отделением педиатрической гастроэнтерологии, гепатологии и диетологии Клиники ФГБУН "ФИЦ питания и биотехнологии"
33. Субботин Дмитрий Михайлович, врач-генетик ФГБНУ "Медико-генетический научный центр им. академика Н.П. Бочкова", член Ассоциации медицинских генетиков
34. Сурков Андрей Николаевич, д.м.н., заведующий отделением гастроэнтерологии для детей стационара для детей, заведующий отделом научных основ детской гастроэнтерологии, гепатологии и метаболических нарушений НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. акад. Б.В. Петровского", профессор кафедры факультетской педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, член Союза педиатров России
35. Тепаев Рустэм Фаридович, д.м.н. заведующий реанимацией и интенсивной терапии ФГАУ "Национальный медицинский исследовательский центр здоровья детей" Минздрава России, профессор кафедры педиатрии и детской ревматологии ФГАОУ "Первый МГМУ им. И.М. Сеченова" Минздрава России (Сеченовский Университет)
36. Федосеенко Марина Владиславовна, к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ N 2 ФГБНУ "РНЦХ им. академика Б.В. Петровского", доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО "РНИМУ им. Н.И. Пирогова" Минздрава России, член Союза педиатров России.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-педиатры;
- врачи-терапевты
- врачи общей семейной практики (семейная медицина);
- врачи-гастроэнтерологи;
- врачи-генетики;
- врачи-диетологи;
- врачи-неврологи;
- врачи-онкологи;
- врачи-онкологи детские;
- медицинские психологи;
- студенты медицинских ВУЗов, интерны, ординаторы;
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 4. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 5. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н "Об утверждении Порядка оказания педиатрической помощи"
2. Приказ Минздрава России от 21.04.2022 N 274н "Об утверждении Порядка оказания медицинской помощи пациентам с врожденными и (или) наследственными заболеваниями"
3. Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru
Основные нормативно-правовые акты, регулирующие оказание паллиативной медицинской помощи
1. Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 N 18-ФЗ.
2. Приказ Минздрава России N 345н, Минтруда России от 31.05.2019 N 372н "Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья".
3. Приказ Минздрава России N 348н от 31 мая 2019 года "Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому".
4. Приказ Минздрава России N 505н от 10 июля 2019 года "Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи".
5. Приказ МЗ РФ N 831 от 3 октября 2019 года "Об утверждении ведомственной целевой программы "Развитие системы оказания паллиативной медицинской помощи".
Прочие нормативно-правовые документы, с учетом которых разработаны клинические рекомендации:
1. Федеральный закон от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (Собрание законодательства Российской Федерации, 2011 г., N 48, ст. 6724);
2. Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ-10);
3. Приказ МЗ РФ от от 02.05.2023 N 205н Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников.
4. Приказ МЗ РФ от 23 июля 2010 г. N 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
5. Федеральный закон от 25.12.2018 N 489 489-ФЗ "О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций".
6. Приказ Минздрава России N 103н от 28.02.2019 г. "Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации".
7. Приказ Минздрава России от 13.10.2017 N 804н "Об утверждении номенклатуры медицинских услуг".
8. Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. N 585н "О классификациях и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы";
9. Приказ Минздрава России (Министерство здравоохранения РФ) от 24 ноября 2021 г. N 1094н "Об утверждении Порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, Порядка оформления указанных бланков, их учета и хранения, форм бланков рецептов, содержащих назначение наркотических средств или психотропных веществ, Порядка их изготовления, распределения, регистрации, учета и хранения, а также Правил оформления бланков рецептов, в том числе в форме электронных документов"
10. Приказ Министерства здравоохранения и социального развития Российской Федерации "О порядке применения лекарственных средств у больных по жизненным показаниям" от 9 августа 2005 г. N 494
11. Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2024 год, утвержденный распоряжением Правительства Российской Федерации 11.12.2023 N N 3551-р
Примеры формулировки диагнозов
- Наследственная тирозинемия 1 А типа (острое течение), осложненное острой печеночной недостаточностью, витамин К зависимой коагулопатией, острой постгеморрагической анемией на фоне катастрофического кровотечения (свершившееся кровотечение из острой язвы желудка и внутрижелудочковое).
- Наследственная тирозинемия 1 А типа (острое течение), осложненная циррозом печени, витамин-Д-резистентным рахитом, неполным синдромом Фанкони. Динамическая непроходимость толстой кишки. Сепсис.
- Наследственная тирозинемия 1 Б типа (хроническое течение), осложненная циррозом печени, портальной гипертензией, деформация костей скелета на фоне полного синдрома Фанкони.
- Наследственная тирозинемия 1 Б типа (хроническое течение), осложненное гепатоцеллюлярной карциномой правой доли печени и фиброзом печени [1, 4, 10].
Расшифровка примечаний
** - лекарственный препарат, входящий в Распоряжение Правительства РФ от 12.10.2019 N 2406-р (ред. от 09.06.2023) "Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи"
# - Применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется по решению врачебной комиссии при условии подписанного информированного добровольного согласия (согласно ФЗ N 323-ФЗ от 21.11.2011 г. с изменениями).
*** - медицинское изделие, имплантируемое в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи;
**** - специализированный продукт лечебного питания, включенный в перечень специализированных продуктов лечебного питания для детей-инвалидов (Перечень специализированных продуктов лечебного питания для детей-инвалидов на 2024 год, утвержденный распоряжением Правительства Российской Федерации 11.12.2023 N 3551-р).
Приложение А3.1
СХЕМА МЕТАБОЛИЧЕСКИХ ПУТЕЙ ПРИ ТИРОЗИНЕМИИ ТИП I
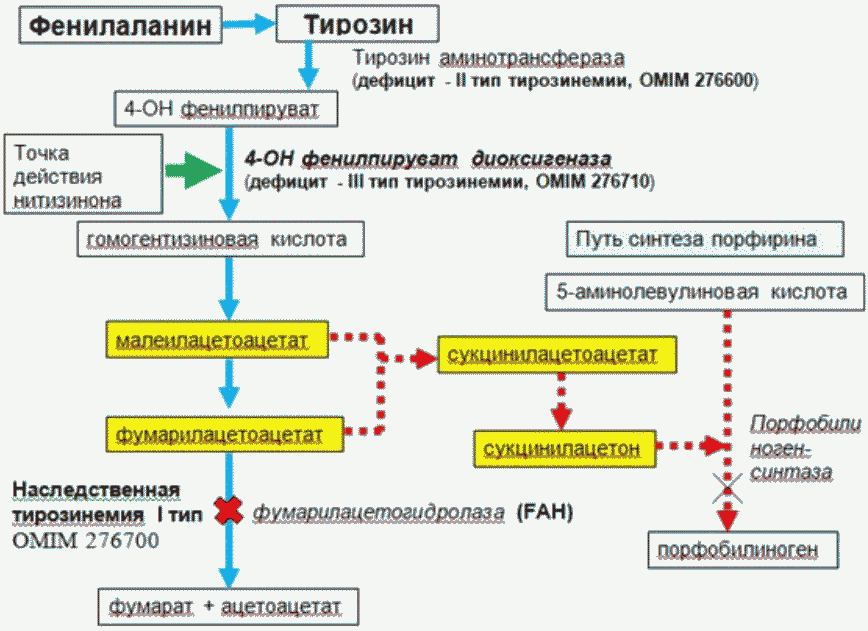
Рис. 1. Пути метаболизма тирозина (сплошная линия - нормальный путь метаболизма, пунктирные - альтернативный путь).
Приложение А3.2
ПОСИНДРОМНЫЙ ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ ТИРОЗИНЕМИИ I ТИП
Таблица 6. Дифференциальная диагностика тирозинемии I типа
Симптом
Возможный диагноз
Гипертирозинемия
Высокое содержание белка в рационе
Тирозинемия II типа
Тирозинемия III типа
Другие болезни печени
Гиперметионинемия
Гомоцистинурия
Нарушение метаболизма метионина
Другие болезни печени
Галактоземия тип 1, 3
Непереносимость фруктозы
Болезнь Нимана-пика тип A/B
Болезнь Вильсона
Неонатальный гемохроматоз
Гемофагоцитарный лимфогистиоцитоз
Заболевание печени
Митохондриальная гепатопатия
Врожденные нарушения гликозилирования
Дефицит трансальдолазы
Ацетаминофеновая интоксикация (ПАРАЦЕТАМОЛОМ**!!)
Бактериальные инфекции (сепсис, сальмонелла, туберкулез)
Вирусные инфекции (CMV, гепатит A, B, герпес)
Отравление грибами (бледной поганкой)
Лекарства из растительного сырья
Идиосинкразия на различные агенты
Инфильтративный или ишемический процесс
Заболевание почек
Синдром Лоу
Цистиноз
Почечный канальцевый ацидоз
Фанкони синдром
Рахит
Гипофосфатазия
Дефицит витамина D (нутритивный или генетически детерминированный)
Гипофосфатемический рахит
Фанкони синдром
Неврологический кризис
Отек мозга, кровоизлияние
Вирусный/бактериальный менингит
Гипернатриемическая дегидратация
Острая перемежающаяся порфирия
Приложение А3.3
ПРИНЦИПЫ ОРГАНИЗАЦИИ ЛЕЧЕБНОГО ПИТАНИЯ ПРИ ТИРОЗИНЕМИИ ТИП I
В Российской Федерации зарегистрированы специализированные продукты отечественного и зарубежного производства на основе аминокислот без фенилаланина и тирозина, предназначенные для пациентов различного возраста (таблица 7). Расчет необходимого количества продукта проводится по белковому эквиваленту
Таблица 7. Химический состав специализированных продуктов лечебного питания для пациентов тирозинемией I тип (в 100 г сухого продукта) <1>
Наименование продукта
Белок (экв.) г
Жир, г
Углеводы, г
Энергетическая ценность, ккал
Возраст применения
Специализированный продукт сухой для диетического лечебного питания детей первого года жизни, больных тирозинемией, "Нутриген 14-tyr, -phe"****
14
23 в т.ч. ДЦПНЖК
50,3
470
0 - 12 мес
Специализированный продукт сухой для диетического лечебного питания детей старше одного года, больных тирозинемией, "Нутриген 20-tyr, -phe"****
20
18
50,2
443
С 1 года
Специализированный продукт сухой для диетического лечебного питания детей старше одного года, больных тирозинемией, "Нутриген 40-tyr, -phe"****
40
13,0
31,4
401
С 1 года
Специализированный продукт сухой для диетического лечебного питания детей старше одного года, больных тирозинемией, "Нутриген 70-tyr, -phe"****
70
0
4,0
296
С 1 года
Специализированный продукт детского диетического лечебного питания для детей первого года жизни от 0 до 12 месяцев в качестве основного питания и в качестве дополнительного питания для детей до 3 лет "TYR Анамикс Инфант" (при тирозинемии)****
13,1
23 в т.ч. ДЦПНЖК
49,5
457
0 - 12 мес
Специализированный продукт диетического лечебного питания для детей старше года "XPHEN TYR TYROSIDON" ("Тирозидон") (при тирозинемии)****
77
0
4,5
326
Дети и взрослые
--------------------------------
<1> - продукты зарегистрированы на территории государств Таможенного Союза и включены в Перечень специализированных продуктов для детей-инвалидов согласно Распоряжению Правительства Российской Федерации от 11.12.2023 N 3551-р
Таблица 8. Рекомендуемые нормы потребления белка для здоровых детей различного возраста [2, 3]
Возраст
RDA США (г/кг/сутки)
ВОЗ (г/кг/сутки)
Евросоюз (г/кг/сутки)
Россия
0 - 6 мес
2,2
1,38
-
2,2 (г/кг/сутки)
6 - 12 мес
1,6
1,21
1,6
2,6 - 2,9 (г/кг/сутки)
1 - 2 года
-
-
-
36 г/сут
2 - 3 года
-
-
-
42 г/сут
1 - 3 года
1,2
0,97
1,1
-
4 - 6 лет
1,1
0,84
1,0
54 г/сут
7 - 10 лет
1,0
0,8
1,0
63 г/сут
Мальчики 11 - 14 лет
1,0
0,79
1,0
75 г/сут
Мальчики 14 - 18 лет
0,9
0,69
0,9
87 г/сут
Девочки 11 - 14 лет
1,0
0,76
0,95
69 г/сут
Девочки 14 - 18 лет
0,8
0,64
0,85
76 г/сут
Таблица 9. Допустимое количество значимых аминокислот в питании детей с наследственными аминоацидопатиями [8].
Возраст детей
Допустимое количество аминокислоты (мг/кг/сутки)
Фенилаланин + тирозин
Метионин
0 - 12 мес
80
25 - 20
1 - 3 года
60
15 - 10
4 - 6 лет
25 - 20
10
старше 7 лет
15 - 10
8
Таблица 10. Пример расчета питания для ребенка 3-х лет с тирозинемией I-го типа.
Масса тела 14 кг [2].
Показатели
Расчет
Примечание
Общее допустимое суточное количество белка
1,5 x 14= 21 г
Общее допустимое суточное количество фенилаланина + тирозин в сутки
25 x 14= 350 мг
на 1 кг массы тела - 25 - 30 мг допускается фенилаланина
Допустимое количество белка за счет естественных продуктов
7 г
1 г белка содержит 50 мг фенилаланина
Количество белка за счет специализированного продукта Нутриген 20-phe, -tir
21 - 7 = 14 г
Суточное количество сухого специализированного продукта Нутриген 20-phe, -tir
(14 x 100) : 20 = 70 г
100 г сухой смеси содержит 20 г белка
Таблица 11. Примерный суточный набор продуктов, его химический состав и энергетическая ценность для детей раннего возраста (1 - 3 года) с тирозинемией I типа [2].
Продукты
Количество мл/г
Химический состав, г
Энергоценность, ккал
Фенилаланин + тирозин, мг
белки
жиры
углеводы
Хлеб б/б
50
0,38
1,25
30,7
135,1
25
Хлебобулочные изделия
13
0,1
1,17
8,4
45,5
5
Сухая смесь "Оладышек"
31
0,5
0,3
28,2
130,3
30
Вермишель б/б
6,8
0,06
0,04
5,7
24,3
4
Саго искусст.
17
0,01
0,03
14,7
61,2
-
Сухой б/б напиток
12
-
2,5
8,6
57
-
Масло слив.
20
0,1
16,5
0,16
149
5
Масло топленое
10
0,03
9,8
0,06
88,7
-
Масло растит.
30
-
29,9
-
269,7
-
Сахар
30
-
-
29,9
113,7
-
Варенье
20
-
-
14,0
56
-
Картофель
50/35
0,7
0,14
5,7
28
35
Капуста свеж.
110/88
1,58
0,1
4,2
23,8
80
Морковь
80/64
0,83
0,06
4,06
21,8
42
Свекла
50/40
0,6
0,04
3,6
16,8
30
Кабачки
20/15
0,09
0,05
0,74
3,5
7
Огурцы
10/9
0,07
0,01
0,23
1,3
3
Салат
5/4
0,06
-
0,09
0,7
3
Помидоры
10/9
0,9
0,02
0,34
2,1
25
Томат-паста
2
0,1
-
0,38
2,0
0,5
Лук репчатый
8/7
0,09
-
0,64
2,9
5,0
Клюква
10
0,05
-
0,38
2,6
2
Соки
100
0,5
-
11,7
47
20
Фрукты свежие
150/127
0,64
0,38
12,45
58,4
45
Фрукты сухие
10
0,3
-
5,05
22,7
10
За счет натур продуктов
-
6,9
62
191
1341
347
Нутриген 20-phe, -tir
70
14
12,6
36,12
314
-
Итого
21
74,6
227,12
1655
347
Приложение А3.4
ПЛАН
МОНИТОРИРОВАНИЯ ПАРАМЕТРОВ КРОВИ И ЧАСТОТА
ИНСТРУМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ НА ФОНЕ КОМПЛЕКСНОЙ ТЕРАПИИ
Таблица 12. План мониторирования параметров лабораторных и инструментальных исследований на фоне комплексной терапии
Исследование
Начало терапии
Первые 6 мес.
После первых 6 мес. и далее
После 5 лет и далее
1 раз/мес.
раз/3 мес.
раз/3 мес.
раз/6 мес.
1 раз в год
Концентрация аминокислот в крови
X
X
X
Каждые 6 мес
Сукцинилацетон в моче
X
X
X
ежегодно
Концентрация нитизинона в крови
X
X
Каждые 6 мес
Общий анализ крови (гемоглобин, гематокрит, тромбоциты, лейкоциты, и др)
X
X
X
ежегодно
исследование печени и ее функций
АФП в сыворотке крови
X
X
X
Каждые 6 мес
Протромбиновое время
X
X
Каждые 6 мес
Частичное тромбопластин. время
X
X
Каждые 6 мес
МНО
X
X
Каждые 6 мес
Фибриноген
X
X
Каждые 6 мес
билирубин
X
+
Каждые 6 мес
АЛТ/АСТ
X
X
+
Каждые 6 мес
ГГТП
X
X
+
Каждые 6 мес
Щелочная фосфатаза
X
X
+
Каждые 6 мес
КТ или МРТ <1>
X
X
ежегодно
почки, скелет
Общий анализ мочи, фосфор- и кальций/креатининовые коэффициенты
X
X
По показаниям
Рентгеноденситометрия (старше 4 лет) или Рентгенография
X
+
По показаниям
осмотр офтальмолога
Осмотр с помощью щелевой лампы, оценка остроты зрения
X
X
X
По показаниям
+ - по показаниям;
--------------------------------
<1> МРТ предпочтительнее с контрастированием при подозрении на аденому, при обнаружении узлов и для оценки размеров почек.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
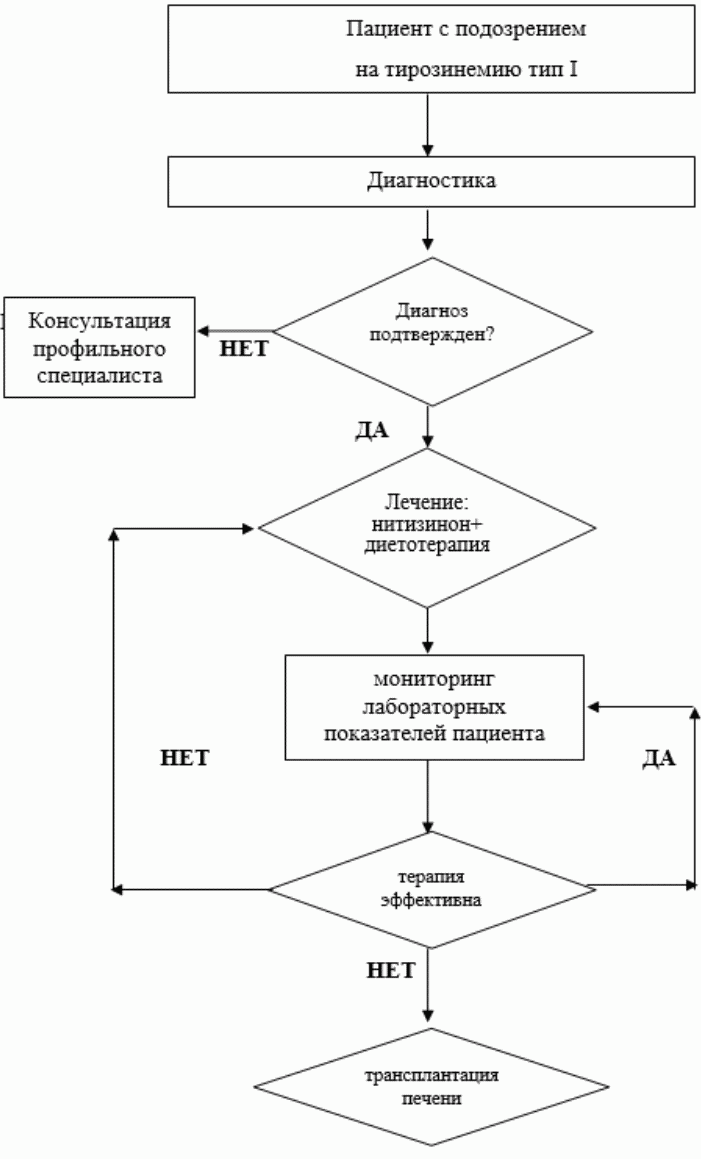
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Тирозинемия I типа - это наследственное заболевание, характеризующееся нарушением метаболизма аминокислоты тирозин и проявляющееся интоксикацией продуктами ее обмена, поражением печени, почек, центральной нервной системы.
Острая форма тирозинемии I типа проявляется в первые недели/месяцы жизни фебрильной лихорадкой, рвотой, диареей, обезвоживанием, желтухой с увеличением размеров печени и селезенки, острым желудочно-кишечным кровотечением, задержкой развития, специфическим "капустным" запахом тела. Хроническая тирозинемия I типа протекает с преимущественным поражением печени (циррозом), почек, с тирозинемическими кризами, которые сопровождаются лихорадкой, рвотой, интоксикацией, кардиомиопатией и провоцируются приемом белковой пищи. При хронической тирозинемии отмечается задержка роста, на 3 - 4 года отстает физиологическая смена зубов, задерживается костный возраст. При отсутствии своевременной диагностики и лечения прогноз заболевания серьезный.
После установления диагноза назначается терапия заболевания с использованием препарата, который препятствует образованию токсических продуктов обмена тирозина и диетотерапии, характеризующейся ограничением в рационе белка и применением специализированных смесей аминокислот. Лечение проводится под строгим контролем врача. Крайне важно четко выполнять все назначения по приему лекарственных препаратов и соблюдению диеты, назначенных врачом.
Учитывая аутосомно-рецессивный тип наследования и высокий риск повторного рождения в семье ребенка с тирозинемией, показано медико-генетическое консультирование семей.
Приложение Г1 - ГN
ШКАЛЫ
ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ
ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не применимо.
