"Клинические рекомендации "Рак ротоглотки"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК РОТОГЛОТКИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C01, C02.4, C05.1, C05.2, C09, C10, D37.0
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 4
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация "Федерация специалистов по лечению заболеваний головы и шеи"
- Некоммерческая организация "Ассоциация онкологических организаций Сибири и Дальнего Востока
- Общероссийская общественная организация "Российское общество клинической онкологии"
- Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи"
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
AUC (area under ROC curve) - площадь под ROC-кривой
ECOG - шкала оценки общего состояния онкологического больного по версии Восточной объединенной группы онкологов
ENE - экстракапсулярная инвазия
IMRT - лучевая терапия с модуляцией интенсивности (volumetric modulated arc therapy)
QUANTEC - практическое руководство для оценки дозолимитирующих параметров критических органов (quantitative analyses of normal tissue effects in the clinic)
TNM (аббревиатура от tumor, nodus и metastasis) - Международная классификация стадий развития раковых опухолей (pT - послеоперационное стадирование опухоли;
pN - послеоперационное стадирование регионарных лимфатических узлов)
VMAT - объемно-модулированная лучевая терапия (volumetric modulated arc therapy)
в/в - внутривенно
ВПЧ - вирус папилломы человека
ДНК - дезоксирибонуклеиновая кислота
ИГХ - иммуногистохимический
ИХТ - индукционная химиотерапия
КТ - компьютерная томография
ЛТ - лучевая терапия
ЛУ - лимфатические узлы
МАТ - моноклональное антитело
МРТ - магнитно-резонансная томография
ПХТ - полихимиотерапия
ПЦР - полимеразная цепная реакция
РНК - рибонуклеиновая кислота
УДД - уровень достоверности доказательности
УЗИ - ультразвуковое исследование
УУР - уровень убедительности рекомендации
ХБС - хронический болевой синдром
ХЛТ - химиолучевая терапия
Термины и определения
Передняя стенка ротоглотки - корень языка, валлекулы.
Боковые стенки ротоглотки - небные миндалины, миндаликовые ямки, передние, задние небные дужки, язычно-миндаликовые борозды.
Задняя стенка ротоглотки - правая, левая сторона.
Верхняя стенка ротоглотки - нижняя поверхность мягкого неба, язычок.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак ротоглотки - злокачественная опухоль, развивающаяся из элементов неороговевающего эпителия ротоглотки [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными этиологическими факторами развития рака ротоглотки считаются [1, 2]:
- вредные привычки: курение, особенно в сочетании с употреблением крепкого алкоголя, жевание различных смесей (нас, бетель и т.д.);
- вирус папилломы человека (ВПЧ), особенно его 16-й и 18-й типы.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В 2021 г. в России было зарегистрировано 2833 случаев злокачественных новообразований ротоглотки, при этом стандартизованный показатель заболеваемости в мужской популяции составил 2,3 случая на 100 тыс. населения, в женской - 0,40 случаев на 100 тыс. населения. Наиболее часто заболевание выявляют в возрасте от 40 до 74 лет. Максимальный показатель заболеваемости приходится на возраст 65 - 69 лет (5,9 случаев на 100 тыс. населения). Ежегодно число впервые выявленных случаев злокачественных новообразований ротоглотки увеличивается в среднем на 3,1% [1, 3].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Кодирование по МКБ-10
C01 - Злокачественное новообразование основания языка
C02.4 - Злокачественное новообразование язычной миндалины
C05.1 - Злокачественное новообразование мягкого неба
C05.2 - Злокачественное новообразование язычка
Злокачественное новообразование миндалины (C09):
C09.0 Злокачественное новообразование миндаликовой ямочки
C09.1 Злокачественное новообразование дужки небной миндалины (передней или задней)
C09.8 Поражение миндалины, выходящее за пределы одной и более вышеуказанных локализаций
C09.9 Злокачественное новообразование миндалины неуточненное
Злокачественное новообразование ротоглотки (C10):
C10.0 Злокачественное новообразование ямки надгортанника
C10.1 Злокачественное новообразование передней поверхности надгортанника
C10.2 Злокачественное новообразование боковой стенки ротоглотки
C10.3 Злокачественное новообразование задней стенки ротоглотки
C10.4 Злокачественное новообразование жаберных щелей
C10.8 Поражение ротоглотки, выходящее за пределы одной и более вышеуказанных локализаций
C10.9 Злокачественное новообразование ротоглотки неуточненное
Новообразование неопределенного или неизвестного характера полости рта и органов пищеварения (D37)
D37.0 Губы, полости рта и глотки
Международная классификация онкологических болезней (МКБ-О, 4-е издание, 2010 г.): классификация опухолей ротоглотки
Злокачественные эпителиальные опухоли:
- 8070/3 Плоскоклеточный рак, без других указаний
- 8051/3 Бородавчатый рак, без других указаний
- 8083/3 Базалоидный плоскоклеточный рак
- 8052/3 Папиллярный плоскоклеточный рак
- 8074/3 Плоскоклеточный рак, веретеноклеточный
- 8075/3 Плоскоклеточный рак, аденоидный
- 8560/3 Железисто-плоскоклеточный рак
- 8082/3 Лимфоэпителиальный рак
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Степень распространенности эпителиальных злокачественных опухолей ротоглотки представлена в международной классификации стадий развития раковых опухолей (TNM) 8-го издания в редакции AJCC и учитывает ВПЧ-статус.
Символ T содержит следующие градации:
p16-отрицательный рак ротоглотки
Tx
Недостаточно данных для оценки первичной опухоли
Tis
Рак in situ
T1
Опухоль до 2 см в наибольшем измерении
T2
Опухоль от 2 см до 4 см в наибольшем измерении
T3
Опухоль более 4 см в наибольшем измерении или с распространением на язычную поверхность надгортанника
T4
Умеренно-распространенный или распространенный локальный процесс
T4a
Умеренно-распространенный локальный процесс
Опухоль поражает гортань, поверхностные мышцы языка, медиальную крыловидную мышцу, твердое небо или нижнюю челюсть <*>
T4b
Распространенный локальный процесс
Опухоль поражает латеральную крыловидную мышцу, крыловидную кость, боковую стенку носоглотки, основание черепа или охватывает сонную артерию
--------------------------------
<*> Примечание: распространение опухоли на слизистую оболочку язычной поверхности надгортанника при первичной локализации в области корня языка и язычных валлекул не свидетельствует о поражении гортани.
Символ N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (ЛУ).
Клиническое стадирование регионарных лимфоколлекторов (cN) при p16-отрицательном раке ротоглотки:
Nx
Недостаточно данных для оценки регионарных ЛУ
N0
Метастазов в регионарные ЛУ нет
N1
Метастазы в одном ЛУ на стороне поражения до 3 см и менее в наибольшем измерении, экстракапсулярная инвазия (ENE) отсутствует
N2
Метастазы в одном ЛУ на стороне поражения более 3 см и менее 6 см в наибольшем измерении и ENE отсутствует или метастазы в нескольких ЛУ шеи на стороне поражения до 6 см в наибольшем измерении и ENE отсутствует;
или с обеих сторон, либо с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует
N2a
Метастазы в одном ЛУ на стороне поражения > 3 см, но не более 6 см в наибольшем измерении, ENE отсутствует
N2b
Метастазы в нескольких ЛУ на стороне поражения до 6 см в наибольшем измерении и ENE отсутствует
N2c
Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует
N3
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует;
или метастазы в любых ЛУ и клинически явная ENE(+)
N3a
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE(-)
N3b
Метастазы в любых ЛУ и клинически явная ENE(+)
Патоморфологическое стадирование регионарных лимфоколлекторов (pN) при p16-отрицательном раке ротоглотки:
Nx
Недостаточно данных для оценки состояния регионарных ЛУ
N0
Нет признаков метастатического поражения регионарных ЛУ
N1
Метастазы в одном ЛУ на стороне поражения до 3 см в наибольшем измерении, ENE отсутствует
N2
Метастазы в одном ЛУ на стороне поражения <= 3 см в наибольшем измерении и ENE(+), или более 3 см и менее 6 см в наибольшем измерении и ENE (-), или метастазы в нескольких ЛУ шеи на стороне поражения до 6 см в наибольшем измерении и ENE (-), или с обеих сторон либо с противоположной стороны до 6 см в наибольшем измерении и ENE (-)
N2a
Метастазы в одном ЛУ на стороне поражения <= 3 см в наибольшем измерении и ENE(+), или более 3 см и менее 6 см в наибольшем измерении и ENE (-)
N2b
Метастазы в нескольких ЛУ на стороне поражения до 6 см в наибольшем измерении и ENE (-)
N2c
Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE(-)
N3
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE(-); или в одном ипсилатеральном ЛУ > 3 см и ENE(+), или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE(+), или единственный контралатеральный метастаз любого размера и ENE(+)
N3a
Метастазы в ЛУ более 6 см в наибольшем измерении и ENE(-)
N3b
Метастазы в одном ипсилатеральном ЛУ > 3 см и ENE(+), или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE(+), или единственный контралатеральный метастаз любого размера и ENE(+)
p16-положительный рак ротоглотки
T0
Первичная опухоль не может быть оценена
T1
Опухоль до 2 см в наибольшем измерении
T2
Опухоль от 2 см до 4 см в наибольшем измерении
T3
Опухоль более 4 см в наибольшем измерении или с распространением на язычную поверхность надгортанника
T4
Умеренно-распространенный локальный процесс
Опухоль поражает гортань, поверхностные мышцы языка, медиальную крыловидную мышцу, твердое небо или нижнюю челюсть или подчелюстное пространство <*>
--------------------------------
<*> Распространение опухоли на слизистую оболочку язычной поверхности надгортанника при первичной локализации в области корня языка и язычных валлекул не свидетельствует о поражении гортани.
Символ N указывает на наличие или отсутствие метастазов в регионарных л/у
Клиническое стадирование регионарных лимфоколлекторов (cN) при p16-положительном раке ротоглотки <*>:
Nx
Недостаточно данных для оценки регионарных лимфоузлов (ЛУ)
N0
Метастазов в регионарные лимфатические узлы нет
N1
Метастазы в одном или нескольких ЛУ на стороне поражения менее 6 см в наибольшем измерении
N2
Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении
N3
Метастазы в ЛУ более 6 см в наибольшем измерении
--------------------------------
<*> Следует отдельно выносить информацию по ENE+ с целью определения параметров химиолучевого лечения в случае его проведения.
Патоморфологическое стадирование регионарных лимфоколлекторов (pN) при p16-положительном раке ротоглотки <*>:
NX
Недостаточно данных для оценки регионарных лимфоузлов (ЛУ)
N0
Метастазов в регионарные лимфатические узлы не
N1
Метастазы в 1 - 4 ЛУ
N2
Метастазы в 5 ЛУ и более
--------------------------------
<*> Следует отдельно выносить информацию по ENE+ с целью определения параметров химиолучевого лечения в случае его проведения.
Символ M характеризует наличие или отсутствие отдаленных метастазов:
M0 Отдаленных метастазов нет
M1 Наличие отдаленных метастазов
Таблица 1. Группировка по стадиям
Стадия
T
N
M
p16-отрицательный
0
is
0
0
I
1
0
0
II
2
0
0
III
3
0
0
1
1
0
2
1
0
3
1
0
IVA
4a
0
0
4a
1
0
4a
2
0
1
2
0
2
2
0
3
2
0
IVB
Любое T
3
0
4b
Любое N
0
IVC
Любое T
Любое N
1
p16-положительный
I
0
1
0
1
0
0
2
0
0
1
1
0
2
1
0
II
0
2
0
1
2
0
2
2
0
3
0
0
3
1
0
3
2
0
III
0
3
0
1
3
0
2
3
0
3
3
0
4
0
0
4
1
0
4
2
0
4
3
0
IV
Любое T
Любое N
1
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления рака ротоглотки зависят от распространенности, локализации и формы роста опухоли (экзофитная, язвенная, инфильтративная). В клинической картине выделяют начальный период, развитой и период запущенности. Наиболее часто (64%) встречается рак небных миндалин. В ранний период пациенты обычно обращаются с жалобами на неловкость при глотании и боль, которые первоначально могут быть расценены как проявления "ангины", по поводу чего проводится безуспешное противовоспалительное лечение. При осмотре пациента чаще всего выявляется плотный бугристый инфильтрат с изъязвлением. Опухоль занимает пораженную миндалину, может распространяться на окружающие ткани и органы (ретромолярную область, корень языка, мягкое небо, небные дужки). Боль может иррадиировать в ухо, соответствующую часть головы. Некротические процессы, возникающие в опухоли, усугубляют воспаление, появляется гнилостный запах изо рта, развивается тризм. Рак ротоглотки характеризуется высоким метастатическим потенциалом. Поражение регионарных ЛУ отмечается у 77 - 80% пациентов. Метастазы обычно располагаются в верхней глубокой яремной цепи, поднижнечелюстных и заглоточных ЛУ, нередко имеют инфильтративный характер. Возникновение метастазов на шее может опережать клинические проявления первичной опухоли. При локализации рака в корне языка, которое наблюдается у 20,8% пациентов, нарушается подвижность языка, имеет место сильная иррадиирущая боль, нарушается глотание. В ряде случаев опухоли миндалины и корня языка могут достигать большого размера, вызывая лишь чувство "неловкости" при глотании. Рак мягкого неба диагностируется у 9,1% пациентов, чаще локализуется в области язычка и по свободному краю, по мере инфильтрации мышц нарушаются акт глотания и речь. На задней стенке ротоглотки рак возникает редко (5,2%), опухоль быстро распространяется по глотке и на подлежащие структуры. Отдаленные метастазы рака ротоглотки возникают у 14 - 30% пациентов и могут локализоваться в легких, костях и других органах [4, 5].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз устанавливается на основании:
1. анамнестических данных, а именно наличие новообразования, не поддающегося консервативному лечению в течение 2 - 3 нед.;
2. физикального обследования, включающего тщательный клинический осмотр, пальпацию образования и прилежащих тканей и регионарных лимфатических узлов (ЛУ);
3. цитологического исследования из первичной опухоли (цитологического исследования отделяемого верхних дыхательных путей и отпечатков, цитологического исследования мазков с поверхности слизистой оболочки верхних дыхательных путей, цитологического исследования микропрепарата тканей верхних дыхательных путей), цитологического исследования биоптатов лимфоузлов (увеличенных или подозрительных), цитологического исследования препарата тканей лимфоузла;
4. патолого-анатомического исследования биопсийного (операционного) материала;
5. инструментального обследований, включая ультразвуковое исследование (УЗИ) шеи, (ультразвуковое исследование мягких тканей (одна анатомическая зона), фиброларингоскопию, эзофагогастроскопию, компьютерную томографию (КТ) лицевого отдела черепа и шеи с внутривенным болюсным контрастированием/магнитно-резонансную томографию (МРТ), лицевого отдела черепа и шеи с внутривенным контрастированием, позитронную эмиссионную томографию, (ПЭТ-КТ), совмещенную с компьютерной томографией с туморотропным РФП с контрастированием, по показаниям
2.1 Жалобы и анамнез
- Рекомендуется всем пациентам с раком ротоглотки проводить сбор жалоб и анамнеза в целях выявления факторов, которые могут повлиять на выбор тактики лечения [1, 2, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Среди факторов риска необходимо выделить вредные бытовые привычки (курение, употребление крепких спиртных напитков), производственные вредности, хроническую инфекцию (хронический фарингит, тонзиллит, частые ангины, вирус папилломы человека (ВПЧ)). При определении стажа курения целесообразно применять критерий количества пачка/лет, подразумевающий накопленный стаж с учетом продолжительности и интенсивности курения.
2.2 Физикальное обследование
- Рекомендуется всем пациентам с раком ротоглотки проводить физикальное обследование, включающее осмотр, в том числе непрямую фарингоскопию, и пальпацию (бимануальную) очага поражения и регионарных ЛУ, оценку нутритивного статуса, оценку состояния зубов (врачом-стоматологом) [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.3 Лабораторные диагностические исследования
- Рекомендуется всем пациентам с раком ротоглотки проводить молекулярно-биологическое исследование биопсийного (операционного) материала на вирус папилломы человека (Papilloma virus) высокого канцерогенного риска (16, 18 тип) методами полимеразной цепной реакции (ПЦР), иммуногистохимическим (ИГХ) и/или гибридизации in situ. [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Суррогатным маркером ВПЧ-ассоциации, предусмотренным в международной классификации для определения стадии процесса и обязательным к исследованию, является экспрессия белка p16 в клетках опухоли ИГХ-методом
- Рекомендуется всем пациентам с раком ротоглотки проводить патолого-анатомическое исследование биопсийного (операционного) материала тканей верхних дыхательных путей с применением гистохимических методов, при этом в заключении рекомендуется отразить все указанные в комментарии параметры (см. ниже) [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: В плановом патолого-анатомическом исследовании должны быть отражены следующие параметры:
- размер опухоли;
- глубина инвазии опухоли
- гистологическое строение опухоли;
- степень дифференцировки опухоли;
- наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
- pT;
- pN (с указанием общего числа исследованных и пораженных ЛУ, признаков экстранодального распространения опухоли);
- наличие поражения краев резекции (отрицательный результат или близкий край резекции также должен быть констатирован);
- статус ВПЧ 16-го и 18-го типов в опухоли методами ПЦР, ИГХ и/или гибридизации in situ.
В клинической практике используется несколько методов. Один из них - определение экспрессии p16 с помощью ИГХ-анализа. Белок p16 представляет собой суррогатный биомаркер, который значимо коррелирует со статусом ВПЧ и определяется за счет выявления экспрессии матриксной рибонуклеиновой кислоты (РНК) E6/E7. Другие методы выявления ВПЧ - ПЦР и гибридизация in situ. Чувствительность ИГХ и ПЦР высокая, однако наибольшей специфичностью обладает гибридизация in situ. Анализ методик диагностики ВПЧ показал, что чувствительность и специфичность ИГХ варьирует от 94 до 97% и от 83 до 84% соответственно, при этом чувствительность и специфичность гибридизации in situ на предмет выявления ВПЧ 16-го типа составляют 85 - 88 и 88 - 95% соответственно. Более низкая специфичность ИГХ может объясняться тем, что у ряда p16-положительных опухолей дезоксирибонуклеиновая кислота (ДНК) ВПЧ отсутствует. Более низкая чувствительность гибридизации in situ может быть вследствие наличия иных типов ВПЧ в опухоли. С учетом различий чувствительности и специфичности разных методов для диагностики статуса инфицированности ВПЧ их можно использовать в комбинации [6, 7, 8, 9, 10].
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на рак ротоглотки проведение фиброларингоскопии, эзофагоскопии с взятием биопсии с поверхности эрозий, изъязвлений с последующим патолого-анатомическим исследованием биопсийного (операционного) материала тканей верхних дыхательных путей; и/или с взятием отделяемого верхних дыхательных путей и отпечатков, мазков с поверхности слизистой оболочки верхних дыхательных путей, микропрепарата тканей верхних дыхательных путей с последующим цитологическим исследованием с целью верификации типа опухоли и исключения вторых опухолей [1, 2, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется выполнить УЗИ лимфатических узлов (одна анатомическая зона) шеи с обеих сторон всем пациентам с раком ротоглотки с пункцией подозрительных ЛУ шеи под контролем УЗИ с целью уточнения распространенности заболевания и планирования лечения [2, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: регионарные метастазы диагностируются в 80% случаев и нередко являются первым клиническим проявлением заболевания. <*> Подозрительными следует считать лимфоузлы с измененной (по данным методов лучевой диагностики) структурой.
- Рекомендуется выполнить МРТ лицевого отдела черепа, шеи с внутривенным контрастированием и/или КТ лицевого отдела черепа, шеи с внутривенным болюсным контрастированием (от основания черепа до верхней апертуры грудной клетки) всем пациентам с раком ротоглотки и при подозрении на рак ротоглотки для оценки распространенности опухолевого процесса [2, 12]
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
Комментарий: при наличии симптомов вовлечения черепно-мозговых нервов МРТ является предпочтительным методом для оценки периневральной инвазии [2]. КТ обладает более высокой информативностью для оценки деструкции кортикального слоя костных структур [2].
- Рекомендуется выполнить КТ органов грудной полости всем пациентам с раком ротоглотки с целью стадирования [2, 12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
Комментарий: при невозможности выполнения КТ органов грудной полости показано выполнение прицельной рентгенографии органов грудной клетки
- Рекомендуется для диагностики отдаленных метастазов у пациентов с местнораспространенными ЗНО ротоглотки и метастатическим поражением регионарных ЛУ (стадия >= III) выполнение позитронной эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП (флудезоксиглюкозой [18F]) с контрастированием или КТ органов грудной и брюшной полостей с внутривенным болюсным контрастированием [2; 13, 14, 15].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
Комментарий: При невозможности проведения ПЭТ-КТ или КТ, в целях стадирования опухолевого процесса и планирования алгоритма лечения показана прицельная рентгенография органов грудной клетки и УЗИ органов брюшной полости [2].
- Рекомендуется пациентам с местно-распространенными ЗНО ротоглотки и метастатическим поражением регионарных ЛУ (стадия >= III) выполнение МРТ головного мозга с контрастированием при наличии клинических подозрений на метастатическое поражение головного мозга с целью его выявления или исключения [2, 16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности выполнения МРТ головного мозга показано КТ головного мозга с внутривенным контрастированием [2].
2.4.1 Планирование лучевой и химиолучевой терапии
- Рекомендуется использовать МРТ лицевого отдела черепа с внутривенным контрастированием и МРТ шеи с внутривенным контрастированием для планирования лучевой терапии для оптимальной визуализации мишени облучения [2, 17, 18, 19].
Уровень убедительности рекомендаций - C, уровень достоверности доказательств - 5
Комментарий: при невозможности проведения МРТ, обладающей более высокой тканевой и пространственный визуализацией, для планирования ЛТ и ХЛТ требуется выполнение КТ лицевого отдела черепа с внутривенным болюсным контрастированием и КТ шеи с внутривенным болюсным контрастированием или ПЭТ-КТ. с туморотропным РФП (флудезоксиглюкозой [18F]) с контрастированием
2.4.2 Оценка эффективности противоопухолевого лечения
- Рекомендуется выполнить МРТ лицевого отдела черепа и шеи с внутривенным контрастированием (от основания черепа до верхней апертуры грудной клетки) через 2 - 3 месяца после окончания ЛТ/ХЛТ для оценки первичной опухоли и зон регионарного метастазирования [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП (флудезоксиглюкозой [18F]) не ранее чем через 3 месяца после окончания ЛТ/ХЛТ, для решения вопроса об отказе от лимфаденэктомии [12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам после ЛТ/ХЛТ через 2 - 3 месяц выполнить пункцию (подозрительных) ЛУ под контролем УЗИ для подтверждения полной резорбции регионарных метастазов с целью решения вопроса об отказе от лимфаденэктомии [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.4.3 Динамическое наблюдение
- Рекомендуется всем пациентам с раком ротоглотки после окончания лечения выполнять адекватный физикальный осмотр зоны интереса, при неинформативности - фиброларингоскопию каждые 1 - 3 месяца в течение первого года, каждые 2 - 6 месяцев в течение второго года, каждые 4 - 8 месяцев в течение третьего - пятого года, далее 1 раз в год [2, 12].
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
- Рекомендуется всем пациентам с раком ротоглотки после окончания лечения выполнять УЗИ ЛУ шеи с 2-х сторон каждые 1 - 3 месяца в течение первого года, каждые 2 - 6 месяцев в течение второго года, каждые 4 - 8 месяцев в течение третьего - пятого года, далее 1 раз в год [2, 20, 21].
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
- Рекомендуется всем пациентам с раком ротоглотки после окончания лечения выполнить КТ или МРТ лицевого отдела черепа и шеи при наличии клинических показаний, а также при невозможности выполнения адекватного физикального осмотра зоны интереса с целью своевременного выявления рецидива [2, 20].
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
- Рекомендуется пациентам с раком ротоглотки при низком риске прогрессирования (I - II стадии) выполнять КТ органов грудной полости каждые 12 месяцев после окончания лечения [2, 20].
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
- Рекомендуется пациентам с раком ротоглотки при высоком риске прогрессировании (III - IV стадии, N+) выполнить КТ органов грудной полости каждые 6 месяцев после окончания лечения до 5 лет, далее 1 раз в год [2, 20]
Комментарий: при невозможности выполнения КТ, показано проведение прицельной рентгенографии органов грудной клетки
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
- Рекомендуется пациентам с раком ротоглотки при наличии симптомов, свидетельствующих о рецидиве заболевания или установленном рецидиве заболевания, выполнение позитронной эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ-КТ) с туморотропным РФП (флудезоксиглюкозой [18F]) или КТ органов грудной и брюшной полостей с внутривенным болюсным контрастированием с целью оценки распространенности опухолевого процесса и выработки тактики лечения [2, 20]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при невозможности выполнения ПЭТ-КТ или КТ органов грудной и брюшной полостей с внутривенным болюсным контрастированием, показано проведение прицельной рентгенографии органов грудной клетки и УЗИ органов брюшной полости (комплексное).
2.5 Иные диагностические исследования
- Рекомендуется всем пациентам с нерезектабельным раком ротоглотки при планировании паллиативного лечения определение уровня экспрессии PD-L1 в образце опухолевой ткани [22].
Уровень убедительности рекомендаций - C (уровень достоверности - 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Специальное противоопухолевое лечение больных раком ротоглотки должно проводиться с учетом опыта и оснащенности клиники, а также предпочтений пациента в свете ожидаемых результатов как с точки зрения эффективности борьбы с онкологическим заболеванием, так и сохранения качества жизни пациентов.
При ранних стадиях (T1-2N0M0) предпочтение должно отдаваться самостоятельному лечению одним методом (либо ЛТ, либо операция). Проведение лечения, впоследствии требующего комбинации с иным методом (адъювантная ЛТ/ХЛТ, спасительная операция) нежелательно в силу ухудшения качества жизни пациентов за счет суммации побочных эффектов каждого из них.
При распространенном раке ротоглотки приоритетом является увеличение выживаемости пациентов в результате проведения как самостоятельного, так и комбинированного/комплексного лечения. Лечение больных с рецидивом должно быть направлено на увеличение выживаемости, а также улучшения качества жизни пациентов за счет применения наиболее эффективных методов с учетом ранее проведенного лечения, а также возраста и соматического состояния больных.
3.1. Общие принципы лечения в зависимости от стадии
- При p16-отрицательном раке T1-2, N0 при отсутствии отдаленных метастазов в случае выбора консервативного лечения рекомендуется проведение самостоятельной ЛТ с целью увеличения выживаемости и сохранения качества жизни [23].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- При p16-отрицательном раке T1-2, N1 при отсутствии отдаленных метастазов в случае выбора консервативного лечения рекомендуется проведение одновременной ХЛТ с целью увеличения выживаемости и сохранения качества жизни [24].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения - динамическое наблюдение [2, 25, 26, 27].
- Рекомендуется при p16-отрицательном раке T1-2, N0-1 при отсутствии отдаленных метастазов в случае выбора оперативного лечения удаление первичной опухоли (предпочтительно выполнение трансорального доступа с целью сохранения качества жизни) и ипсилатеральная (при латерализованном опухолевом процессе), или двусторонняя (при центральной локализации опухолевого процесса или распространенности опухолевого процесса за среднюю линию) шейная лимфодиссекция с целью увеличения выживаемости. [28, 29].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: При выявлении таких неблагоприятных гистологических факторов, как близкий край резекции (менее 5 мм), периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, pN2 или pN3, локализация метастаза в IV или V группе ЛУ шеи, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента).
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака, как экстракапсулярное распространение метастаза/зов, показано проведение адъювантной одновременной ХЛТ.
При наличии положительных краев резекции показано повторное оперативное вмешательство, если это возможно, или одновременная ХЛТ [2, 25, 26, 27, 30].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуется при p16-отрицательном раке T3, T4a, N0-1 при отсутствии отдаленных метастазов одновременная ХЛТ с целью увеличения выживаемости [12, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при p16-отрицательном раке T3, T4a, N0-1 при отсутствии отдаленных метастазов проведение индукционной химиотерапии с последующей ЛТ/ХЛТ с целью повышения выживаемости [12, 31, 32]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 25, 26, 27].
- При p16-отрицательном раке T3, T4, N0-1 в случае наличия противопоказаний к ЛТ/ХЛТ или отказа пациента рекомендуется выполнение оперативного вмешательства с одно- или двусторонней шейной лимфодиссекцией с целью повышения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при отсутствии дополнительных прогностически неблагоприятных факторов в плановом патолого-анатомическом исследовании биопсийного (операционного) материала (удаленного препарата) после хирургического лечения показано проведение адьювантной лучевой терапии.
При выявлении таких неблагоприятных гистологических факторов, как близкий край резекции (менее 5 мм), периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, pN2 или pN3, локализация метастаза в IV или V группе ЛУ шеи, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента).
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака, как экстракапсулярное распространение метастаза/зов, показано проведение адъювантной одновременной ХЛТ.
При наличии положительных краев резекции показано повторное оперативное вмешательство, если это возможно, или одновременная ХЛТ [2, 25, 26, 27]. Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуется при p16-отрицательном раке T1-4a, N2-3 при отсутствии отдаленных метастазов одновременная ХЛТ с целью повышения выживаемости [12, 33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при p16-отрицательном раке T1-4a, N2-3 при отсутствии отдаленных метастазов проведение индукционной химиотерапии с последующей ЛТ/ХЛТ с целью повышения выживаемости [12, 33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [25, 26, 27].
- При p16-отрицательном раке T3, T4, N2-3 в случае наличия противопоказаний к ЛТ/ХЛТ или отказа пациента рекомендуется выполнение оперативного вмешательства с одно- или двусторонней шейной лимфодиссекцией с целью повышения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При отсутствии прогностически неблагоприятных факторов в плановом патолого-анатомическом исследовании удаленного препарата после хирургического лечения показано проведение адъювантной лучевой терапии.
При выявлении таких неблагоприятных гистологических факторов, как близкий край резекции (менее 5 мм), периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, pN2 или pN3, локализация метастаза в IV или V группе ЛУ шеи, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента).
В случае выявления таких неблагоприятных гистологических признаков, как экстракапсулярное распространение метастаза/зов и/или положительные края резекции, показано проведение адъювантной одновременной ХЛТ [2, 25, 46, 27, 30].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- При p16-положительном раке T1-2, N0 в случае выбора консервативного лечения рекомендуется проведение самостоятельной ЛТ с целью увеличения выживаемости и сохранения качества жизни [2, 12, 28, 33].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 25, 26, 27].
- Рекомендуется при p16-положительном раке T1-2, N0 в случае выбора хирургического лечения удаление первичной опухоли +/- ипсилатеральная (при латерализованном опухолевом процессе) или двусторонняя (при центральной локализации опухолевого процесса или распространенности опухолевого процесса за среднюю линию) селективная шейная лимфодиссекция с целью увеличения выживаемости. Для сохранения качества жизни предпочтительно выполнение трансорального оперативного вмешательства [34].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: при выявлении таких неблагоприятных гистологических признаков, как близкий край резекции, периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, один положительный узел > 3 см или несколько положительных узлов, поражение лимфатических узлов IV или V уровня, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента).
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака как экстракапсулярное распространение метастаза/зов +/- положительные края резекции показано проведение адъювантной одновременной ХЛТ.
При наличии положительного края резекции показано повторное оперативное вмешательство, если это возможно, или одновременная ХЛТ [2, 25, 26, 27, 30].
- При p16-положительном раке T0-2, N1 (один ипсилатеральный узел <= 3 см) в случае выбора консервативного лечения рекомендуется проведение ХЛТ с целью повышения выживаемости, либо самостоятельной ЛТ с целью снижения токсичности лечения (применение самостоятельной ЛТ обсуждается в случае применения IMRT/VMAT с учетом опыта и оснащенности клиники) [2, 35, 36]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 25, 26, 27].
- При p16-положительном раке T1-2, N0-1 (один ипсилатеральный узел <= 3 см) в случае выбора хирургического лечения рекомендуется удаление первичной опухоли +/- ипсилатеральная (при латерализованном опухолевом процессе) или двусторонняя (при центральной локализации опухолевого процесса или распространенности опухолевого процесса за среднюю линию) шейная лимфодиссекция с целью увеличения выживаемости [37].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при выявлении таких неблагоприятных гистологических признаков, как близкий край резекции, периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, один положительный узел > 3 см или несколько положительных узлов, поражение лимфатических узлов IV или V уровня, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента)
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака как экстракапсулярное распространение метастаза/зов +/- положительные края резекции показано проведение адъювантной одновременной ХЛТ.
При наличии положительного края резекции показано повторное оперативное вмешательство, если это возможно, или одновременная ХЛТ [2, 25, 26, 27, 30].
- При p16-положительном раке T2, N1 (1 ипсилатеральный метастатический ЛУ более 3 см или 2 и более ипсилатеральных метастатических ЛУ <= 6 см с одной стороны) или T0-2, N2 или T3, N0-2) рекомендуется проведение одновременной ХЛТ с целью увеличения выживаемости [2, 12, 24, 33].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- При p16-положительном раке T2, N1 (1 ипсилатеральный метастатический ЛУ более 3 см или 2 и более ипсилатеральных метастатических ЛУ <= 6 см с одной стороны) или T0-2, N2 или T3, N0-2) в случае выбора консервативного лечения рекомендуется проведение индукционной химиотерапии с последующей ЛТ/ХЛТ с целью увеличения выживаемости [12, 24, 33]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 25, 26, 27].
- При p16-положительном раке T2, N1 (1 ипсилатеральный метастатический ЛУ более 3 см или 2 и более ипсилатеральных метастатических ЛУ <= 6 см с одной стороны) или T0-2, N2 или T3, N0-2) в случае выбора хирургического лечения рекомендовано удаление первичной опухоли и ипсилатеральная (при cN0-3 с одной стороны) или двусторонняя (cN2-3 с обеих сторон) шейная лимфодиссекция с целью увеличения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при выявлении таких неблагоприятных гистологических признаков, как близкий край резекции, периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, один положительный узел > 3 см или несколько положительных узлов, поражение лимфатических узлов IV или V уровня, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента.
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака как экстракапсулярное распространение метастаза/зов +/- положительные края резекции показано проведение адъювантной одновременной ХЛТ.
При наличии положительного края резекции показано повторное оперативное вмешательство, если это возможно, или одновременная ХЛТ [2, 25, 26, 27, 30].
- При p16-положительном раке T0-3, N3 или T4, N0-3 рекомендуется проведение одновременной ХЛТ с целью увеличения выживаемости [12, 31, 38]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при p16-положительном раке T0-3, N3 или T4, N0-3 в случае выбора консервативного лечения рекомендуется проведение индукционной химиотерапии с последующей ЛТ/ХЛТ [12, 33].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуется при p16-положительном раке T0-3, N3 или T4, N0-3 в случае выбора хирургического лечения удаление первичной опухоли и ипсилатеральная (при cN0-3 с одной стороны) или двусторонняя (cN2-3 с обеих сторон) шейная лимфодиссекция [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения рекомендовано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 25, 26, 27].
При выявлении таких неблагоприятных гистологических признаков, как близкий край резекции, периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, один положительный узел > 3 см или несколько положительных узлов, поражение лимфатических узлов IV или V уровня, показана адъювантная ЛТ, либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента)
В случае выявления при плановом патолого-анатомическом исследовании операционного материала такого неблагоприятного гистологического признака как экстракапсулярное распространение метастаза/зов +/- положительные края резекции показано проведение адъювантной одновременной ХЛТ.
При наличии положительного края резекции показано повторное оперативное вмешательство, если это возможно, или одновременной ХЛТ [2, 25, 26, 27, 30].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Локальный рецидив или остаточная опухоль без предшествующей ЛТ.
- В случае локального рецидива или остаточной опухоли без предшествующей ЛТ при резектабельном процессе рекомендовано хирургическое вмешательство с целью улучшения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при выявлении таких неблагоприятных гистологических признаков, как близкий край резекции, периневральная/периваскулярная/лимфатическая инвазия, pT3/pT4, pN2 или pN3, показана адъювантная ЛТ либо одновременная ХЛТ (ХЛТ обсуждается индивидуально при наличии двух и более указанных неблагоприятных факторов с учетом возраста и соматического состояния пациента).
В случае выявления после хирургического вмешательства при плановом патолого-анатомическом исследовании операционного материала таких неблагоприятных гистологических признаков, как экстракапсулярное распространение метастаза/зов и/или положительные края резекции, показано проведение адъювантной одновременной ХЛТ [2, 12, 26, 29, 30].
- В случае локального рецидива или остаточной опухоли без предшествующей ЛТ при резектабельном процессе в случае отказа от операции рекомендована одновременная ХЛТ с целью увеличения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- В случае локального рецидива или остаточной опухоли без предшествующей ЛТ при нерезектабельном процессе рекомендована ХТ с последующим обсуждением возможности проведения ЛТ/ХЛТ с целью увеличения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: При наличии остаточной опухоли и/или метастатических ЛУ после окончания консервативного лечения показано хирургическое лечение. В случае полной регрессии метастатических узлов после использования консервативных методов лечения показано динамическое наблюдение [2, 27, 29, 30].
- В случае локального рецидива или остаточной опухоли после ЛТ при резектабельности опухоли рекомендовано хирургическое вмешательство с целью улучшения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- В случае локального рецидива или остаточной опухоли после ЛТ при нерезектабельности опухоли рекомендовано обсуждение индивидуального плана с возможным применением лекарственной терапии, или повторной ЛТ/одновременной ХЛТ, или симптоматического лечения с целью улучшения выживаемости [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Раздел лекарственное лечение.
Проведение повторной лучевой терапии обсуждается при общем состоянии пациента 0 - 1 по шкале ECOG и не ранее 6 месяцев (предпочтительно не ранее 2 лет) после предшествующего облучения [39]
- Пациентам с локальным рецидивом или остаточной опухолью с отдаленными метастазами для оценки выживаемости и снижения риска осложнений рекомендуется выбор метода лечения в зависимости от общего состояния (ECOG) [2]:
- при оценке общего состояния пациента по шкале оценки общего состояния онкологического больного по версии Восточной объединенной группы онкологов (ECOG) 0 - 1 рекомендовано рассмотреть вопрос о полихимиотерапии (ПХТ) или монотерапии;
- при оценке общего состояния пациента по шкале ECOG 2 рекомендована монохимиотерапия или симптоматическое лечение;
- при оценке общего состояния пациента по шкале ECOG 3 рекомендовано симптоматическое лечение.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.2. Принципы хирургического лечения
Всех пациентов до лечения должен оценивать врач-хирург, специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Хирургическое вмешательство не следует модифицировать на основании клинического ответа, полученного до лечения, при настоящем осмотре (регрессии опухоли), за исключением случаев прогрессии опухоли, которая вынуждает проводить более обширную операцию для охвата всей опухоли во время окончательной резекции [2, 40].
- Хирургическое лечение пациентам с ЗНО ротоглотки не рекомендовано в следующих случаях: стадия T4b, при непосредственном распространении опухоли из регионарных ЛУ на кожу, прямое распространение на структуры средостения предпозвоночную фасцию или шейные позвонки в связи с нерезектабельностью процесса, интра- и послеоперационными рисками, низкой эффективностью и низкой вероятностью радикального характера хирургического лечения [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется удаление первичного очага единым блоком с целью адекватного исследования краев резекции при патолого-анатомическом исследовании биопсийного (операционного) материала и снижения риска локального рецидива [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. Предпочтительно выполнять трансоральные резекции с помощью CO2-лазера и под оптическим увеличением или с использованием роботассистированной хирургии. В случае, если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, рекомендуется диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование операционного материала).
- У пациентов с ЗНО ротоглотки, подлежащим хирургическому лечению, рекомендуется достигать статуса R0 при хирургическом лечении для снижения риска рецидива опухоли [41].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: Адекватное удаление определяется как расстояние от края резекции до макроскопически видимой опухоли >= 1,5 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно. Если зона, макроскопически свободная от опухоли по краю резекции, составляет < 1,5 см, невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет >= 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное < 5 мм. Первичную опухоль следует помечать таким образом, чтобы врач-патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Устранение хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению врача-хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению врача-хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с реконструкцией нижней челюсти или без нее.
Лимфодиссекции.
- При локализации первичной опухоли в ротоглотке в случае выбора хирургического метода лечения рекомендуется проведение селективных лимфодиссекций II - IV уровней с целью повышения выживаемости пациентов [42].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: Профилактическая лимфодиссекция (II - IV уровни) обязательна к выполнению при распространенности первичной опухоли T3-4, а также при локализации первичной опухоли в области миндалины и миндаликовой ямки, начиная с распространенности опухоли T1-2, так как риск поражения регионарных лимфатических узлов достигает 50% [42]. Удаление ЛУ II - V уровней целесообразно при наличии одного из следующих факторов:
- пальпируемый метастаз в IV или V уровне;
- регионарный метастаз > 6 см в диаметре;
- крупные множественные метастазы (> 3 см);
- выраженное экстракапсулярное распространение с поражением значимых анатомических структур (кивательная мышца, внутренняя яремная вена, общая сонная артерия);
- рецидивный процесс
3.3. Принципы лучевой терапии
Всех пациентов до лечения должен оценивать врач-радиотерапевт, предпочтительно специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность морфологической верификации, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность проведения ЛТ/ХЛТ, разработать проспективный план ведения больного, который будет включать санацию орофарингеальной области, в том числе обследование зубов, обеспечение адекватного питания, обезболивания, ранозаживления, а также другие мероприятия, которые необходимы для адекватной и своевременной реабилитации пациентов. Для пациентов, которым проводится ХТ/ХЛТ, необходимо проработать тактику реализации противоопухолевой терапии в полном объеме и в оптимальные сроки.
Лучевая терапия в качестве основного или адъювантного лечения должна проводиться в специализированных учреждениях с соответствующим оснащением и опытом лечения больных раком ротоглотки [43].
Требуется глубокое понимание анатомии, клинической ситуации и визуализации специфических проявлений заболевания. Предпочтительно проведение ЛТ с применением высокопрецизионных способов - IMRT (лучевая терапия с модуляцией интенсивности (volumetric modulated arc therapy)), VMAT (объемно-модулированная лучевая терапия (volumetric modulated arc therapy)). При значительных ограничениях дозы со стороны нормальных тканей рассматривается проведение протонной терапии. Также допустимо проведение 3D-конформной ЛТ.
Оптимальным подходом в клинической практике является подведение запланированных доз ионизирующего излучения в мишень наряду с максимальным снижением дозы на область органов риска. Допустимо обсуждение вопроса о сокращении объема за счет исключения из него жизненно важных структур, свободных от опухолевого поражения, на момент планирования ЛТ, в случае превышения предельно допустимой дозной нагрузки на них согласно критериям QUANTEC (практическое руководство для оценки дозолимитирующих параметров критических органов (quantitative analyses of normal tissue effects in the clinic)) [41]. Объем облучения до радикальных доз не следует модифицировать на основании клинического ответа, полученного до ЛТ (после индукционной ПХТ), за исключением случаев прогрессии опухоли. Анатомические изменения в процессе проведения курса ЛТ (например, быстрое уменьшение размера опухоли, значительная потеря массы тела) могут потребовать повторной диагностической визуализации и повторного планирования (адаптации) лечения.
- ЛТ в самостоятельном варианте рекомендована на первичный очаг и клинически определяемые регионарные метастазы (область высокого риска) в дозе 66 - 70 Гр (2,0 - 2,2 Гр/фракция) ежедневно с понедельника по пятницу в течение 6 - 7 нед.; на локорегионарную область (область промежуточного/низкого риска), включая регионарные ЛУ, в дозе 44 - 50 Гр (2,0 Гр/фракция), либо 54 - 63 Гр (1,6 - 1,8 Гр/фракция) с целью повышения показателей выживаемости [2, 17, 18, 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: В специализированных учреждениях с соответствующим оснащением и опытом лечения больных раком ротоглотки допустимо проведение лучевой терапии по ускоренной схеме до СОД 66 - 70 Гр (2,0 Гр/фракция, 6 фракций в неделю). В случае проведения 3D конформной лучевой терапии настоятельно рекомендуется проведение лечение по схеме традиционного фракционирования (РОД 2 Гр до СОД 50 Гр на локорегионарную область и до СОД 70 Гр на первичный очаг и клинически определяемые регионарные метастазы соответственно
Также при локальном поражении ротоглотки (T1-2N0) возможно проведение брахитерапии по индивидуальному плану [44].
- Одновременная ХЛТ в самостоятельном варианте рекомендована на первичный очаг и клинически определяемые регионарные метастазы (область высокого риска) в дозе 70 Гр (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течение 6 - 7 нед.; на локорегионарную область (область промежуточного/низкого риска), в том числе регионарные ЛУ, - в дозе 44 - 50 Гр (2,0 Гр/фракция), либо 54 - 63 Гр (1,6 - 1,8 Гр/фракция) с учетом риска субклинического распространения и метода ЛТ [2, 17, 18, 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: Стандартом является применение в сочетании с ЛТ цисплатина** в дозе 100 мг/м2 на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (рекомендуемая суммарная доза во время ЛТ - 300 мг/м2). Также возможно применение ЛТ в сочетании с #карбоплатином** в дозе 70 мг/м2 и #фторурацилом** в дозе 600 мг/м2 дни 1 - 4 каждые 3 недели (с учетом высокой токсичности схемы) [45, 46].
После индукционной ПХТ в качестве альтернативы цисплатину** рекомендовано использование цетуксимаба** или карбоплатина** с учетом переносимости ХЛТ и соматического состояния пациента. Цетуксимаб** вводится в нагрузочной дозе 400 мг/м2 за неделю до начала ЛТ, далее в поддерживающей дозе 250 мг/м2 еженедельно в процессе ЛТ.
Отказ от платиносодержащих схем ХЛТ в пользу применения цетуксимаба** целесообразен при высоком риске срыва/неполной реализации плана самостоятельного ХЛТ и высоком риске развития побочных эффектов соединения платины (скорость клубочковой фильтрации < 50 - 60 мл/мин, возраст пациентов > 65 лет, выраженная сопутствующая почечная, сердечно-сосудистая, неврологическая, печеночная патология и/или ослабленное состояние пациента (ECOG > 1)) [36, 47].
Польза применения схем нетрадиционного фракционирования доз при проведении одновременной ХЛТ не подтверждена [48].
- Послеоперационная ЛТ рекомендована на область удаленной первичной опухоли и регионарных метастазов в дозе 60 - 66 Гр (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течение 6 - 6,5 недель, на локорегионарную область, включая неизмененные регионарные ЛУ, - 44 - 50 Гр (2,0 Гр/фракция), либо 54 - 63 Гр (1,6 - 1,8 Гр/фракция) с учетом риска субклинического распространения и метода ЛТ [2, 17, 18, 19].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Предпочтительный интервал после операции составляет <= 6 нед. и не должен превышать 3 мес. Подведение СОД 66 Гр предусматривается на область высокого риска - область положительного края резекции, либо экстракапсулярного распространения метастаза.
- Послеоперационная одновременная ХЛТ рекомендована на область удаленной первичной опухоли и регионарных метастазов в дозе 60 - 66 Гр (2,0 Гр/фракция) ежедневно с понедельника по пятницу в течение 6 - 6,5 недель, на локорегионарную область, включая неизмененные регионарные ЛУ, - 44 - 50 Гр (2,0 Гр/фракция), либо 54 - 63 Гр (1,6 - 1,8 Гр/фракция) с учетом риска субклинического распространения и метода ЛТ [2, 17, 18, 19, 30].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Рекомендуется одновременное проведение ХТ на основе препаратов платины, предпочтительно цисплатин** в дозе 100 мг/м2 каждые 3 нед. [30]. При наличии сопутствующей патологии, препятствующей проведению конкурентной ХЛТ с включением препаратов платины (хроническая почечная недостаточность, выраженная кардиопатология и т.д.), предпочтительным является замена соединений платины на цетуксимаб** на фоне проведения ЛТ [47].
Предпочтительный интервал после операции составляет <= 6 нед. и не должен превышать 3 мес. Подведение СОД 66 Гр предусматривается на область высокого риска - область положительного края резекции, либо экстракапсулярного распространения метастаза.
Польза применения схем нетрадиционного фракционирования доз при проведении одновременной ХЛТ не подтверждена [47].
- Паллиативная ЛТ рекомендована для облегчения или профилактики локорегионарных симптомов в случае невозможности проведения радикального лечения со стандартной ЛТ. Возможен выбор схемы ЛТ по индивидуальному плану с учетом минимизации токсичности лечения, в том числе в дозе 50 Гр (2,5 Гр/фракция) и 30 Гр (3 Гр/фракция) [49, 50, 51, 52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
3.4 Принципы системной химиотерапии
- При выборе индукционной ХТ в качестве первичного метода лечения всем пациентам с раком ротоглотки с целью улучшения выживаемости рекомендуется использовать следующий режим ПХТ:
Предпочтительно: доцетаксел** 75 мг/м2 в 1-й день + цисплатин** 75 мг/м2 в 1-й день + #фторурацил** 1000 мг/м2/сут в 1 - 4-й дни, всего 2 - 3 курса ХТ с интервалом 3 нед. [53].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5
В качестве альтернативного режима индукционной ХТ может быть рассмотрена схема: #паклитаксел** 175 мг/м2 в 1-й день + цисплатин** 100 мг/м2 во 2-й день + #фторурацил** 500 мг/м2 длительная инфузия 2 - 6 дни, всего 3 курса ХТ с интервалом 3 недели [54, 55].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- В качестве конкурентной ХЛТ после индукции всем пациентам с раком ротоглотки с целью повышения выживаемости рекомендовано проведение ХТ с включением цисплатина** 100 мг/м2 1 раз в 3 недели [56].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: С учетом высокой токсичности указанной схемы конкурентной терапии возможно еженедельное введение карбоплатина** AUC 1,5 или цетуксимаба** 400 мг/м2 за неделю до начала ЛТ и 250 мг/м2 еженедельно во время проведения ЛТ. При наличии сопутствующей патологии, препятствующей проведению конкурентной ХЛТ с включением препаратов платины (хроническая почечная недостаточность, выраженная кардиопатология и т.д.), предпочтительным является замена препаратов платины на цетуксимаб** на фоне проведения ЛТ - [47].
- Пациентам с локальным неоперабельным рецидивом или остаточной опухолью, перенесшим ЛТ, а также при наличии отдаленных метастазов для увеличения выживаемости рекомендуется моно- или полихимиотерапия см. табл. N 1 [2].
Таблица N 1. Режимы лекарственной терапии плоскоклеточного рака головы и шеи [51].
Название режима
Схема проведения
PF+ Cet
Цисплатин** 75 - 100 мг/м2 в/в в 1-й день + #фторурацил** 1000 мг/м2/сут. в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. + цетуксимаб** 400 мг/м2 (нагрузочная доза), далее - 250 мг/м2 в/в еженедельно. После 6 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию #цетуксимабом** 250 мг/м2 в/в еженедельно [56, 57]
DC+ Cet
#Доцетаксел** 75 мг/м2 в/в в 1-й день + цисплатин** 75 мг/м2 в/в в 1-й день, каждые 3 нед. + цетуксимаб** 400 мг/м2 (нагрузочная доза) в/в, далее - 250 мг/м2 в/в еженедельно. После 4 циклов ХТ завершается, и в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию #цетуксимабом** 500 мг/м2 в/в 1 раз в 2 недели/ [57]
Цисплатин + Cet
Цисплатин** 75 - 100 мг/м2 1 раз в 3 недели (не более 6 - 8 введений) + цетуксимаб** 400 мг/м2 (нагрузочная доза) в/в в 1 день, далее - 250 мг/м2 в/в еженедельно до прогрессирования или непереносимой токсичности [58]
Pacli + Carbo + Cet
#Паклитаксел** 100 мг/м2 в/в + карбоплатин** AUC 2,5 в/в в 1-й и 8-й дни + цетуксимаб** 400 мг/м2 в/в (2-часовая инфузия) в 1-й день 1-го цикла (нагрузочная доза), далее - 250 мг/м2 в/в (1-часовая инфузия) еженедельно. Длительность цикла 21 день. После завершения 6 циклов ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию #цетуксимабом** 250 мг/м2 в/в еженедельно [59, 60]
Pacli + Carbo + Cet <1>
#Паклитаксел** 80 мг/м2 в/в еженедельно + карбоплатин** AUC 2,0 в/в еженедельно + цетуксимаб** 400 мг/м2 в/в (2-часовая инфузия) в 1-й день 1-го цикла, далее - 250 мг/м2 в/в еженедельно. После завершения ХТ в случае отсутствия прогрессирования рекомендовано продолжить поддерживающую терапию #цетуксимабом** 250 мг/м2 в/в еженедельно. Количество введений определяется индивидуально [61, 62, 63]
PF <2>
Цисплатин** 75 - 100 мг/м2 в/в в 1-й день + #фторурацил** 1000 мг/м2/сут. в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. [62, 63, 64].
Карбоплатин** AUC - 5 в/в в 1-й день + #фторурацил 1000** мг/м2 в/в 96-часовая инфузия в 1 - 4-й дни, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8 [53, 66, 67]
Pacli + Carbo <2>
#Паклитаксел** 175 мг/м2 в/в в 1-й день + карбоплатин** AUC - 5 - 6 в/в в 1-й день каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. [64, 66, 68]
#Паклитаксел** 60 - 80 мг/м2 в/в еженедельно + карбоплатин AUC - 2 в/в еженедельно до прогрессирования или неприемлемой токсичности, но не более 18 недель [69, 70]
DC <2>
#Доцетаксел** 75 мг/м2 в/в в 1-й день + цисплатин** 75 мг/м2 в/в в 1-й день, каждые 3 нед. Общее число циклов 6, при отсутствии токсичности и нарастающей положительной динамике может быть увеличено до 8. [68, 71]
Ниволумаб** <3>
Ниволумаб** 3 мг/кг в/в 1 раз в 2 нед. или 240 мг 1 раз в 2 нед. или 480 мг 1 раз в 4 нед. 60-минутная инфузия (первое введение), далее - 30-минутная инфузия до прогрессирования или неприемлемой токсичности, но не более 2 лет [72]
Пембролизумаб** <4>
#Пембролизумаб** 200 мг в/в 1 раз в 3 нед. (30-минутная инфузия) или 400 мг 1 раз в 6 нед. до прогрессирования или неприемлемой токсичности, но не более 2 лет
PF + Пембролизумаб** <5>
#Пембролизумаб** 200 мг + карбоплатин** AUC 5 или цисплатин** 100 мг/м2 + #фторурацил** 1000 мг/м2 1 - 4 дни 1 раз в 3 недели (6 циклов), далее #пембролизумаб** 200 мг 1 раз в 3 недели или 400 мг 1 раз в 6 нед. Максимум - до 35 введений в целом [53, 73, 74]
Монотерапия для пациентов в общем состоянии по ECOG > 2 баллов
Цисплатин** 60 - 70 мг/м2 в/в 1 раз в 3 нед. Количество введений определяется индивидуально, но целесообразность длительности более 6 - 8 введений представляется сомнительной [58, 73, 74, 75]
Карбоплатин** AUC 5 - 6 в/в 1 раз в 3 нед. или карбоплатин** AUC 2 в/в еженедельно. Количество введений определяется индивидуально. [76]
#Паклитаксел 175 мг/м2 в/в 1 раз в 3 нед. или #паклитаксел 80 мг/м2 в/в еженедельно. Количество введений определяется индивидуально [74, 77, 78]
#Доцетаксел** 70 - 75 мг/м2 в/в 1 раз в 3 нед. Количество введений определяется индивидуально. [53, 78, 79, 80]
#Капецитабин** 2000 мг/м2 внутрь в 2 приема в 1 - 14-й дни, перерыв 1 неделя или 2000 мг/сут. внутрь ежедневно в метрономном режиме. Длительность терапии определяется индивидуально [53, 80, 81]
#Метотрексат** 40 мг/м2 в/в еженедельно. Количество введений определяется индивидуально <6>. [81, 82, 83]
#Цетуксимаб** 400 мг/2 в/в (2-часовая инфузия) в 1-й день 1-го курса, далее - 250 мг/м2 в/в еженедельно [83, 83, 85]
--------------------------------
<1> Для пациентов в общем состоянии по ECOG 2 балла.
<2> Неоптимальные режимы лечения; возможны к применению только в случае абсолютных противопоказаний к назначению анти-EGFR МКА.
<3> Во 2 и последующих линиях терапии при платино-резистентных опухолях. Может назначаться независимо от уровня экспрессии PD-L1.
<4> В качестве 1 линии при наличии экспрессии PD-L1 CPS > 20. При прогрессировании на фоне или после ХТ, включающей препараты платины, при уровне TPS >= 50%. Рекомендуемая длительность применения соответствует дизайну регистрационных исследований.
<5> В качестве 1 линии при экспрессии PD-L1 >= 1%.
<6> Режим соответствует клиническим исследованиям, при плохой переносимости дозу следует редуцировать.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: С учетом общего состояния пациента и/или целей лечения в качестве 1 линии могут быть назначены следующие препараты или их комбинации (количество курсов определяется переносимостью и эффективностью лечения)
3.5. Иное лечение
Порядок и рекомендации по обезболиванию при злокачественных новообразованиях полости рта соответствуют рекомендациям, представленным в клинических рекомендациях "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи"
- Рекомендовано пациентам с местно-распространенным ЗНО ротоглотки при угрозе кровотечения или состоявшемся кровотечении из опухоли и/или регионарных метастатических узлов произвести ангиографию наружной сонной артерии и, при отсутствии противопоказаний, произвести суперселективную внутриартериальную эмболизацию сосудов опухоли с целью снижения рисков кровотечения и фатальных осложнений [86, 87, 88, 89, 90, 91].
Комментарий: риск возникновения кровотечения констатируется в случае наличия изъязвленного местно-распространенного опухолевого процесса с вовлечением соседних структур, полости в области опухоли или рецидива опухоли, близости опухоли к ветвям сонной артерии, незаживающей раны, состоявшегося кровотечение из опухоли.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуются пациентам со злокачественными опухолями ротоглотки программы профилактической гимнастики и обучение тактике глотания до начала лечения для уменьшения нарушения глотания при проведении противоопухолевой терапии [92].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Нутритивно-метаболическая реабилитация рекомендована с целью повышения выживаемости, снижения частоты развития осложнений противоопухолевого лечения, улучшения переносимости лечения и качества жизни пациентов [93].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Нутритивная поддержка при планировании хирургического лечения или лучевой терапии проводится при наличии хотя бы одного из указанных факторов: непреднамеренном снижении массы тела за последние 6 мес. (потеря 5% и более), индексе массы тела < 20 кг/м2, гипопротеинемия < 60 г/л или гипоальбуминемия < 30 г/л, ухудшении возможности приема пищи за последнюю неделю. В случае проведения химиотерапии показаниями являются: индекс массы тела < 20 кг/м2; потеря более 5% массы тела за 6 мес.; гипопротеинемия < 60 г/л или гипоальбуминемия < 30 г/л.; невозможность адекватного питания через рот; энтеропатия средней и тяжелой степени.
4.1. Реабилитация при химиотерапевтическом лечении
- Пациентам с ЗНО ротоглотки, получающим химиотерапевтическое лечение рекомендуется раннее начало физических нагрузок с целью профилактики возникновения и прогрессирования саркопении уменьшения слабости, улучшения качества жизни и психологического состояния пациентов, получающих адъювантную ХТ, увеличения толерантности к физической нагрузке [94].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: Проведение комплекса ЛФК с включением аэробной нагрузки, элементов Тайчи в течение 4 мес. на фоне ХТ приводит к увеличению жизненной емкости легких, насыщенности крови кислородом, силы мышц, объема движений в крупных суставах, снижения индекса массы тела [95].
- Для уменьшения утомляемости и повышения выносливости у пациентов с ЗНО ротоглотки на фоне проведения ХЛТ рекомендуется физическая реабилитация [96].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарий: Сочетание ЛФК (в виде аэробных упражнений средней интенсивности в сочетании с упражнениями на сопротивление) с психологической поддержкой используется в качестве комплексного лечения слабости на фоне ХТ [94]. Помимо этого, целесообразно проведение курса общего массажа медицинского в течение 6 нед. с целью уменьшения слабости на фоне комбинированного лечения [97].
- Рекомендована физическая реабилитация для коррекции полинейропатии [98].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется применение аккупунктуры в лечении периферической полинейропатии на фоне ХТ ЗНО ротоглотки [99, 100, 101, 102, 103, 104].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2).
- Рекомендована низкочастотная магнитотерапия в лечении периферической полинейропатии на фоне ХТ препаратами платины ЗНО ротоглотки [105].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- Рекомендуется низкоинтенсивное лазерное облучение кожи и слизистых в профилактике и лечении мукозитов полости рта на фоне ХТ ЗНО ротоглотки [106, 107].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
4.2. Реабилитация при лучевой терапии
Возможность успешного проведения противоопухолевого лечения и реабилитации зависит от исходного состояния пациента. Так, к факторам риска раннего возникновения и развития тяжелых побочных эффектов можно отнести истощение и тяжелое психологическое состояние больного, пожилой возраст, сопутствующие заболевания, травмы слизистых полости рта и глотки, наличие кариозных зубов, выраженный болевой синдром, курение и прием алкоголя. Подготовка к лечению и адекватное ведение пациентов является настолько важной задачей, что участие профильных смежных специалистов в составе мультидисциплинарной команды паллиативного врача-онколога, специалиста по питанию, врача-стоматолога и др.), а также объем сопроводительной терапии указываются в международных рекомендациях как обязательное условие успешного лечения больных опухолями головы и шеи.
Ведение больных раком ротоглотки, получающих/получивших лучевое лечение, требует комплексного подхода, включающего, как минимум, три базовых компонента терапии сопровождения: ранозаживление, обезболивание, нутритивная поддержка, в сочетании с обеспечением контакта с пациентом и его комплаентности к лечению на всех его этапах. Оговоримся, что методики терапии сопровождения и реабилитации намного разнообразнее и подразумевают также проведение детоксикационной терапии, коррекции гематологической токсичности, противоязвенной, противорвотной, антибиотической терапии и др. Также обязательным является тщательный мониторинг пациентов после лечения и коррекция возможных отсроченных побочных эффектов лучевой терапии (ксеростомия, некроз кости и/или мягких тканей и др.).
Адекватное питание и поддержание водного баланса являются жизненно важным. Борьба с "ятрогенной" нутритивной недостаточностью, возникшей вследствие ЛТ и ХЛТ, является важнейшей задачей в рамках успешного лечения больных с опухолями головы и шеи. Особую роль играет сбалансированность приема пищи, что отражает поддержание стабильной массы тела. Необходимо отметить, что нутритивная поддержка проводится с лечебной целью, поскольку период проведения ЛТ характеризуется повышенной потребностью организма в энергетическом и пластическом обеспечении. У пациентов без выраженной дисфагии, получающих ЛТ и ХЛТ, методом выбора является пероральное энтеральное питание. Нутритивная терапия должна начинаться сразу при выявлении нутритивной недостаточности или при отсутствии достаточного питания через рот в течение 7 дней.
- Рекомендуется рассмотреть возможность проведения профилактической нутритивной поддержки пациентам, которым планируется проведение противоопухолевого лечение с высоким риском нарушения питания (при проведении ХЛТ больным местнораспространенным раком глотки и др.) [108].
Уровень достоверности доказательств - 5 (уровень убедительности рекомендаций - C).
Комментарии: Энтеральное лечебное питание начинают при неадекватности диетического питания через рот (т.е. менее 60% от общих энергетических потребностей в течение 10 дней). Потеря более 10% от исходной массы тела является показанием для назначения энтерального питания. Оптимальным вариантом нутритивной поддержки является сиппинг с использованием высокобелковых смесей (с учетом сопутствующей патологии, в том числе почек). При невозможности адекватного перорального питания следует обеспечить его путем установки назогастрального зонда (при ориентировочных сроках его стояния до 3 - 4 недель), либо путем гастростомии. Также в случае необходимости может быть подключено парентеральное питание. Расчет основных потребностей пациента ориентирован на общее количество потребляемой энергии и количественное соотношение различных субстратов. Необходимое количество калорий чаще всего рассчитывается с учетом его энергетических затрат с ориентиром на предупреждение нарастания дефицита энергии [109, 110, 111]. Основной целью нутритивной поддержки является восполнение потерь как минимум из расчета: белок/аминокислоты: не менее 1,2 г/кг/сут и до 2 г/кг/сут; энергия: 25 - 30 ккал/кг/сут [111]. Пациентам, получающим ЛТ и ХЛТ оптимально применение смесей, обогащенных омега-3 жирными кислотами и пищевыми волокнами, а также совмещение нутритивной поддержки с физическими нагрузками.
С момента проявлений и до полного исчезновения лучевого мукозита показано применение локальных заживляющих средств (A01AD11 Прочие препараты ранозаживляющих местных средств (гели, раствор мочевины мази и др.). При регулярном орошении полости рта изотоническим раствором удаляются остатки пищи и накопившиеся выделения. Для аппликаций в полости рта или для закапывания в нос рекомендуются масла (оливковое, персиковое, облепихи или шиповника). При наличии болевого синдрома применяют местные анестетики ((D04AB): Местные анестетики для наружного применения) и системные обезболивающие средства (N02B другие анальгетики и антипиретики) [110]. Обезболивание должно назначаться в соответствии со шкалой ВОЗ. Чаще всего требуется назначение наркотических анальгетиков (N02A опиоидов), причем следует обратить внимание на трансдермальные формы их применения [112].
С момента проявлений лучевого дерматита и до полного стихания реакций показано применение ранозаживляющих местных средств (D11AX Других препаратов, применяемых в дерматологии, A11CA01 Ретинол (витамин A)) (гели, диоксометилтетрагидропиримидин), а также солнцезащитных средств. Кожу необходимо оберегать от трения и раздражения. Для борьбы с ксерозом используют крем с мочевиной, масляный раствор витамина A. При биолучевом дерматите целесообразно применение крема с витамином K. В постлучевом периоде нормальные ткани, подвергшиеся облучению, очень ранимы, поэтому к ним нужно относиться бережно. В ранние сроки следует избегать инвазивных диагностических процедур и биопсии без крайней необходимости. Показан подбор диеты, при необходимости в сочетании с A02B препаратами для лечения язвенной болезни желудка и двенадцатиперстной кишки и гастроэзофагеальной рефлюксной болезни (ГЭРБ) [113, 114]. Травмы, алкоголь, курение, раздражающая пища легко вызывают изъязвление слизистой оболочки, что нередко сопровождается обнажением кости нижней челюсти с последующим развитием остеомиелита. Частой причиной лучевого остеомиелита является удаление зубов в зоне предшествующего облучения, в связи с чем следует по возможности ограничиваться консервативными методами и только в случае необходимости проводить удаление зубов на фоне антибиотикотерапии.
- Рекомендуется регулярный мониторинг (шкалы MUST, NRS 2002) и коррекция нутритивного статуса с применением специализированного питания у пациентов, которым проводится ЛТ/ХЛТ с целью с целью повышения выживаемости, улучшения качества жизни и переносимости проводимого лечения [115].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам, которым планируется проведение ЛТ/ХЛТ, рекомендуется консультация врача-стоматолога и обследование с последующим сопровождением на всех этапах лечения и реабилитации [116, 117].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам, получающим/получившим ЛТ/ХЛТ, при наличии болевого синдрома рекомендуется консультация альголога (5.1.66. Врач по паллиативной медицинской помощи) с целью обеспечения переносимости лечения, адекватной реабилитации и улучшения качества жизни [118].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЗНО ротоглотки, получающим химиолучевое лечение рекомендуется раннее начало физических нагрузок с целью улучшения качества жизни и переносимости проводимого лечения [119].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Рекомендуется воздействие лазерным низкоинтенсивным излучением на область десен (A22.07.008) и слизистой оболочки полости рта в профилактике и лечении мукозита полости рта/глотки на фоне ХЛТ [120, 121].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1).
- Рекомендован массаж лица медицинский для профилактики тяжелых мукозитов полости рта на фоне ХЛТ ЗНО ротоглотки [122].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 21).
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
С целью профилактики и ранней диагностики необходимо обращать внимание на Первичные симптомы. В частности, на ранних стадиях заболевание протекает бессимптомно. Область ротоглотки доступна для осмотра, при обращении к специалисту первичного звена (врач-оториноларинголог, врач-терапевт, врач-стоматолог и др.) пациенты могут предъявлять жалобы на самостоятельно обнаруженные язвы, узловые новообразования, асимметрию в области ротоглотки. Также возможны жалобы на болезненность и ощущение комка в горле, онемение, дискомфорт при глотании, повышение температуры тела без видимых причин, наличие новообразований на шее, неприятный запах изо рта, изменение голоса, трудности с жеванием, ограничение движений языка, тризм жевательной мускулатуры.
Необходимо учитывать роль канцерогенных факторов: курение (в том числе пассивное), употребление алкоголя, контакт с асбестом, древесной пылью, продуктами нефтепереработки, воздействие ионизирующего облучения, ВПЧ. Врачам первичного звена необходимо проводить образовательную работу среди населения, разъясняя роль указанных факторов в развитии рака, а также обращать внимание на предопухолевые заболевания, к которым относятся хронические воспалительные заболевания, лейкоплакия слизистой оболочки ротоглотки, папилломы.
Диспансерное наблюдение
- Рекомендуется соблюдать следующую периодичность обследования пациента после завершения лечения по поводу ЗНО полости рта для профилактики рецидива заболевания - в 1-й год обследование рекомендуется проводить каждые 1 - 3 мес., во 2-й год - 2 - 6 мес., на сроке 3 - 5 лет - 1 раз в 4 - 8 мес. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Объем обследования включает:
- сбор анамнеза и физикальное обследование;
- УЗИ ЛУ шеи с 2 сторон, органов брюшной полости и малого таза;
- МРТ лицевого отдела черепа и шеи с внутривенным контрастированием/КТ лицевого отдела черепа и шеи с внутривенным болюсным контрастированием;
- фиброларингоскопия;
- прицельная рентгенография органов грудной клетки каждые 12 мес;
- КТ органов грудной и брюшной полостей с внутривенным болюсным контрастированием/магнитно-резонансная томография органов грудной и брюшной полостей с внутривенным контрастированием по показаниям
- Позитронная эмиссионная томография, совмещенная с компьютерной томографией с туморотропными РФП с контрастированием, по показаниям;
- Исследование уровня тиреотропного гормона (ТТГ) в крови каждые 6 - 12 мес, если проводилось облучение шеи в целях оценки функции щитовидной железы.
Задача наблюдения - раннее выявление прогрессирования заболевания в целях раннего начала ХТ или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей головы и шеи.
6. Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 C81 - C96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее - федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики C37, C38, C40 - C41, C45 - C49, C58, D39, C62, C69 - C70, C72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней - онкология (МКБ-О), 3 издания 8936, 906 - 909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка - национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее - онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторами, влияющими на прогноз заболевания, являются:
- размеры и распространенность первичной опухоли;
- глубина инвазии первичной опухоли;
- степень дифференцировки опухоли;
- наличие/отсутствие периваскулярной, перилимфатической, периневральной инвазии;
- статус регионарных ЛУ (pN) (метастазы в ЛУ шеи вдвое снижают выживаемость пациентов)
- экстранодальное распространение опухоли;
- статус краев резекции (R0-1)
- ВПЧ-статус опухоли
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Выполнена биопсия с поверхности эрозий, изъязвлений с последующим патолого-анатомическим исследованием биопсийного (операционного) материала тканей верхних дыхательных путей; и/или взятие отделяемого верхних дыхательных путей и отпечатков, мазков с поверхности слизистой оболочки верхних дыхательных путей, микропрепарата тканей верхних дыхательных путей с последующим цитологическим исследованием при фиброларингоскопии, эзофагоскопии
Да/нет
2.
Выполнена пункция подозрительных ЛУ шеи под контролем УЗИ
Да/нет
3.
Выполнено УЗИ ЛУ шеи (при установлении диагноза)
Да/нет
4.
Выполнено МРТ лицевого отдела черепа, шеи с внутривенным контрастированием и/или КТ лицевого отдела черепа, шеи с внутривенным болюсным контрастированием для оценки распространенности опухолевого процесса (при установлении диагноза)
Да/нет
5.
Выполнена КТ органов грудной полости (при установлении диагноза)
Да/нет
6.
Выполнена шейная лимфодиссекция с удалением II - IV групп шейных ЛУ при хирургическом вмешательстве при N0
Да/нет
7.
Выполнено молекулярно-биологическое исследование биопсийного материала на вирус папилломы человека (Papilloma virus) высокого канцерогенного риска (16 тип)
Да/нет
8.
Проведена послеоперационная ХЛТ при обнаружении опухоли в крае резекции и/или экстракапсулярном распространении
Да/нет
Список литературы
1. Под. Ред. Каприна А.Д., Старинского В.В., Шахзадовой А.О. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность) - М: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, - 2022. - илл. - 252 с.
2. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines(R)). Head and Neck Cancers. Version 4.2024
3. http://gco.iarc.fr/today/online-analysis-table?v=2018&mode=cancer&mode_population=countries&population=900&populations=643&key=asr&sex=0&cancer=39&type=1&statistic=5&prevalence=0&population_group=0&ages_group%5B%5D=0&ages_group%5B%5D=17&nb_items=5&group_cancer=1&include_nmsc=1&include_nmsc_other=1#collapse-by_country
4. Чойнзонов Е.Л., Подвязников С.О., Минкин А.У. и др. Клинические рекомендации. Диагностика и лечение рака ротоглотки. Сибирский онкологический журнал 2016; 15(1): 83 - 7
5. Пачес А.И. Опухоли головы и шеи. 5-е изд., доп. и перераб. М.: Практическая медицина, 2013. С. 155 - 163
6. Jordan R.C., Lingen M.W., Perez-Ordonez B. et al. Validation of methods for oropharyngeal cancer HPV status determination in US cooperative group trials. Am J Surg Pathol 2012; 36: 945 - 54
7. Weinberger P.M., Yu Z., Haffty B.G. et al. Molecular classification identifies a subset of human papillomavirus - associated oropharyngeal cancers with favorable prognosis. J Clin Oncol 2006; 24: 736 - 47
8. Cantley R.L., Gabrielli E., Montebelli F. et al. Ancillary studies in determining human papillomavirus status of squamous cell carcinoma of the oropharynx: a review. Patholog Res Int 2011; 2011: 138469
9. Prigge E.S., Arbyn M., von Knebel Doeberitz M., Reuschenbach M. Diagnostic accuracy of p16INK4a immunohistochemistry in oropharyngeal squamous cell carcinomas: a systematic review and meta-analysis. Int J Cancer 2017; 140: 1186 - 98
10. Singhi A.D., Westra W.H. Comparison of human papillomavirus in situ hybridization and p16 immunohistochemistry in the detection of human papillomavirus-associated head and neck cancer based on a prospective clinical experience. Cancer 2010; 116: 2166 - 73
11. Paleri V, Urbano TG, Mehanna H, et al. Management of neck metastases in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016; 130: S161 - S169.
12. Machiels JP, ![]() Leemans C, Golusinski W, Grau C, Licitra L, Gregoire V; Squamous cell carcinoma of the oral cavity, larynx, oropharynx and hypopharynx: EHNS-ESMO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Nov; 31(11): 1462 - 1475. doi: 10.1016/j.annonc.2020.07.011.
Leemans C, Golusinski W, Grau C, Licitra L, Gregoire V; Squamous cell carcinoma of the oral cavity, larynx, oropharynx and hypopharynx: EHNS-ESMO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Nov; 31(11): 1462 - 1475. doi: 10.1016/j.annonc.2020.07.011.
13. Xu G, Li J, Zuo X, Li C. Comparison of whole body positron emission tomography (PET)/PET-computed tomography and conventional anatomic imaging for detecting distant malignancies in patients with head and neck cancer: a meta-analysis. Laryngoscope. 2012 Sep; 122(9): 1974 - 8. doi: 10.1002/lary.23409. Epub 2012 Jul 2. PMID: 22753007.
14. Senft A, de Bree R, Hoekstra OS, et al. Screening for distant metastases in head and neck cancer patients by chest CT or whole body FDG-PET: A prospective multicenter trial. Radiother Oncol 2008; 87: 221 - 229.
15. Rohde M, Nielsen AL, Johansen J, et al. Head-to-head comparison of chest X-ray/head and neck MRI, chest CT/head and neck MRI, and 18 F-FDG PET/CT for detection of distant metastases and synchronous cancer in oral, pharyngeal, and laryngeal cancer. J Nucl Med 2017; 58: 1919 - 1924.
16. Saiyed FK, Guo T, Johnson F, Myers JN. Characterizing distant metastases and survival in oropharyngeal squamous cell carcinoma. Head Neck. 2021 Jul; 43(7): 2101 - 2109. doi: 10.1002/hed.26678. Epub 2021 Mar 19.
17.  V, Evans M, Le QT. et al. Delineation of the primary tumour Clinical Target Volumes (CTV-P) in laryngeal, hypopharyngeal, oropharyngeal and oral cavity squamous cell carcinoma: AIRO, CACA, DAHANCA, EORTC, GEORCC, GORTEC, HKNPCSG, HNCIG, IAG-KHT, LPRHHT, NCIC CTG, NCRI, NRG Oncology, PHNS, SBRT, SOMERA, SRO, SSHNO, TROG consensus guidelines. Radiother Oncol. 2018 Jan; 126(1): 3 - 24. doi: 10.1016/j.radonc.2017.10.016. Epub 2017 Nov 24. PMID: 29180076.
V, Evans M, Le QT. et al. Delineation of the primary tumour Clinical Target Volumes (CTV-P) in laryngeal, hypopharyngeal, oropharyngeal and oral cavity squamous cell carcinoma: AIRO, CACA, DAHANCA, EORTC, GEORCC, GORTEC, HKNPCSG, HNCIG, IAG-KHT, LPRHHT, NCIC CTG, NCRI, NRG Oncology, PHNS, SBRT, SOMERA, SRO, SSHNO, TROG consensus guidelines. Radiother Oncol. 2018 Jan; 126(1): 3 - 24. doi: 10.1016/j.radonc.2017.10.016. Epub 2017 Nov 24. PMID: 29180076.
18. Стандарты лучевой терапии./под ред. А.Д. Каприна, А.А. Костина, Е.В. Хмелевского. - М.: ГЭОТАР-Медиа, 2019;
19. Husain, Z.A., Kang, J.J., Lee, N.Y., Poon, I. (2022). Oropharyngeal Carcinoma. In: Lee, N.Y., Lu, J.J., Yu, Y. (eds) Target Volume Delineation and Field Setup. Practical Guides in Radiation Oncology. Springer, Cham. https://doi.org/10.1007/978 - 3-030-99590-4.
20. Harris, B.N., Gregory Farwell, D. Frequency of Follow-up of Oral Cavity and Oropharynx Patients and Appropriate Use of Imaging and Other Surveillance Methodology. Curr Otorhinolaryngol Rep 6, 292 - 297 (2018). https://doi.org/10.1007/s40136-018-0204-6
21. Paleri V, Urbano TG, Mehanna H, et al. Management of neck metastases in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016; 130: S161 - S169,
22. Cohen EEW, Bell RB, Bifulco CB, Burtness B, Gillison ML, Harrington KJ, Le QT, Lee NY, Leidner R, Lewis RL, Licitra L, Mehanna H, Mell LK, Raben A, Sikora AG, Uppaluri R, Whitworth F, Zandberg DP, Ferris RL. The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC). J Immunother Cancer. 2019 Jul 15; 7(1): 184. doi: 10.1186/s40425-019-0662-5.
23. ![]() D, Viotti J, Modesto A, Schiappa R, Chamorey E, Dassonville O, Poissonnet G, Guelfucci B, Bizeau A, Vergez S, Dupret-Bories A, Garrel R, Fakhry N, Santini L, Lallemant B, Chambon G, Sudaka A, Peyrade F, Saada-Bouzid E, Benezery K, Jourdan-Soulier F, Chapel F, Ramay AS, Roger P, Galissier T, Coste V, Ben Lakdar A, Guerlain J, Temam S, Mirghani H, Gorphe P, Bozec A. Upfront surgery or definitive radiotherapy for patients with p16-negative oropharyngeal squamous cell carcinoma. A GETTEC multicentric study. Eur J Surg Oncol. 2021 Feb; 47(2): 367 - 374. doi: 10.1016/j.ejso.2020.07.034.
D, Viotti J, Modesto A, Schiappa R, Chamorey E, Dassonville O, Poissonnet G, Guelfucci B, Bizeau A, Vergez S, Dupret-Bories A, Garrel R, Fakhry N, Santini L, Lallemant B, Chambon G, Sudaka A, Peyrade F, Saada-Bouzid E, Benezery K, Jourdan-Soulier F, Chapel F, Ramay AS, Roger P, Galissier T, Coste V, Ben Lakdar A, Guerlain J, Temam S, Mirghani H, Gorphe P, Bozec A. Upfront surgery or definitive radiotherapy for patients with p16-negative oropharyngeal squamous cell carcinoma. A GETTEC multicentric study. Eur J Surg Oncol. 2021 Feb; 47(2): 367 - 374. doi: 10.1016/j.ejso.2020.07.034.
24. Zumsteg Z.S., Kim S., David J.M. et al. Impact of concomitant chemoradiation on survival for patients with T1-2N1 head and neck cancer. Cancer 2017; 123: 1555 - 65
25. Bernier J., Domenge C., Ozsahin M. et al. Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 2004; 350: 1945 - 52
26. Cooper J.S., Pajak T.F., Forastiere A.A. et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N Engl J Med 2004; 350: 1937 - 44
27. Bernier J., Cooper J.S., Pajak T.F. et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501). Head Neck 2005; 27: 843 - 50
28. Nichols AC, Theurer J, Prisman E. et all. Radiotherapy versus transoral robotic surgery and neck dissection for oropharyngeal squamous cell carcinoma (ORATOR): an open-label, phase 2, randomised trial. Lancet Oncol. 2019 Oct; 20(10): 1349 - 1359. doi: 10.1016/S1470-2045(19) 30410-3;
29. Adelstein D.J., Ridge J.A., Brizel D.M. et al. Transoral resection of pharyngeal cancer: summary of a National Cancer Institute Head and Neck Cancer Steering Committee Clinical Trials Planning Meeting, November 6 - 7, 2011, Arlington, Virginia. Head Neck 2012; 34: 1681 - 703
30. Cooper JS, Zhang Q, Pajak TF, et al. Long-term follow-up of the RTOG 9501/intergroup phase III trial: postoperative concurrent radiation therapy and chemotherapy in high-risk squamous cell carcinoma of the head and neck. Int J Radiat Oncol Biol Phys 2012; 84: 1198 - 1205.
31. Haddad R., O'Neill A., Rabinowits G., Tishler R., Khuri F.R., Adkins D., Clark J., Sarlis N., Lorch J., Beitler J.J., et al. Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): A randomised phase 3 trial. Lancet Oncol. 2013; 14: 257 - 264. doi: 10.1016/S1470-2045(13) 70011-1.
32. Merlano M.C., Denaro N., Vecchio S., Licitra L., Curcio P., Benasso M., Bagicalupo A., Numico G., Russi E., Corvo' R., et al. Phase III Randomized Study of Induction Chemotherapy Followed by Definitive Radiotherapy + Cetuximab Versus Chemoradiotherapy in Squamous Cell Carcinoma of Head and Neck: The INTERCEPTOR-GONO Study (NCT00999700) Oncology. 2020; 98: 763 - 770. doi: 10.1159/000507733.
33. Lacas B, Carmel A, Landais C et all. MACH-NC Collaborative Group. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): An update on 107 randomized trials and 19,805 patients, on behalf of MACH-NC Group. Radiother Oncol. 2021 Mar; 156: 281 - 293. doi: 10.1016/j.radonc.2021.01.013.;
34. Tomoya Yokota, Yoshiyuki Iida, Tomoyuki Kamijo. Which treatment strategies are the most promising for locally advanced resectable human papillomavirus-associated oropharyngeal cancers? Journal of Clinical Oncology 2019 37: 15_suppl, e17556 - e17556
35. Kelly J.R., Park H.S., An Y., Yarbrough W.G., Contessa J.N., Decker R., Mehra S., Judson B.L., Burtness B., Husain Z. Upfront surgery versus definitive chemoradiotherapy in patients with human Papillomavirus-associated oropharyngeal squamous cell cancer. Oral Oncol. 2018; 79: 64 - 70. doi: 10.1016/j.oraloncology.2018.02.017.
36. Wang H, Zheng Z, Zhang Y, Bian C, Bao J, Xin Y, Jiang X. Locally advanced head and neck squamous cell carcinoma treatment efficacy and safety: a systematic review and network meta-analysis. Front Pharmacol. 2023 Sep 19; 14: 1269863. doi: 10.3389/fphar.2023.1269863.
37. Howard J, Masterson L, Dwivedi RC, Riffat F, Benson R, Jefferies S, Jani P, Tysome JR, Nutting C. Minimally invasive surgery versus radiotherapy/chemoradiotherapy for small-volume primary oropharyngeal carcinoma. Cochrane Database Syst Rev. 2016 Dec 11; 12(12): CD010963. doi: 10.1002/14651858.CD010963.pub2. PMID: 27943254; PMCID: PMC6463943
38. Pignon J.P., Bourhis J., Domenge C., Designe L. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three meta-analyses of updated inpidual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet 2000; 355: 949 - 55
39. Ward M.C., Riaz N., Caudell J.J. et al. Refining patient selection for reirradiation of head and neck squamous carcinoma in the IMRT era: A multi-institution cohort study by the MIRI Collaborative. Int J Radiat Oncol 2018; 100: 586 - 594
40. DeVita V.T., Hellman S., Rosenberg S.A. eds. Cancer: Principles and Practice of Oncology. 9th edn. Philadelphia, Pa: Lippincott Williams & Wilkins. 2011. Pp. 729 - 780
41. Looser K.G., Shah J.P., Strong E.W. The significance of "positive" margins in surgically resected epidermoid carcinomas. Head Neck Surg 1978; 1: 107 - 11
42. Lim, Y.C., Koo, B.S., Lee, J.S., Lim, J.-Y., & Choi, E.C. (2006). Distributions of Cervical Lymph Node Metastases in Oropharyngeal Carcinoma: Therapeutic Implications for the N 0 Neck. The Laryngoscope, 116(7), 1148 - 1152
43. Boero I.J., Paravati A.J., Xu B et al. Importance of Radiation Oncologist Experience Among Patients With Head-and-Neck Cancer Treated With Intensity-Modulated Radiation Therapy. J Clin Oncol. 2016 Mar 1; 34(7): 684 - 90. doi: 10.1200/JCO.2015.63.9898.
44. Al-Mamgani A., Van Rooij P., Tans L. et al. Toxicity and outcome of intensity-modulated radiotherapy versus 3-dimensional conformal radiotherapy for oropharyngeal cancer: a matched-pair analysis. Technol Cancer Res Treat 2013; 12: 123 - 30
45. Bourhis J, Sire C, Graff P, et al. Concomitant chemoradiotherapy versus acceleration of radiotherapy with or without concomitant chemotherapy in locally advanced head and neck carcinoma (GORTEC 99-02): an open-label phase 3 randomised trial. Lancet Oncol 2012; 13: 145 - 153.
46. Denis F, Garaud P, Bardet E, et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol 2004; 22: 69 - 76.
47. Резолюция экспертного совета по вопросу о роли цетуксимаба в лечении пациентов с плоскоклеточным раком головы и шеи. Опухоли головы и шеи 2019; 8: 71 - 3
48. Lacas B, Bourhis J, Overgaard J. et all. MARCH Collaborative Group. Role of radiotherapy fractionation in head and neck cancers (MARCH): an updated meta-analysis. Lancet Oncol. 2017 Sep; 18(9): 1221 - 1237. doi: 10.1016/S1470-2045(17)30458-8
49. Paris KJ, Spanos WJ Jr, Lindberg RD, et al. Phase I-II study of multiple daily fractions for palliation of advanced head and neck malignancies. Int J Radiat Oncol Biol Phys 1993; 25: 657 - 660
50. Stevens CM, Huang SH, Fung S, et al. Retrospective study of palliative radiotherapy in newly diagnosed head and neck carcinoma. Int J Radiat Oncol Biol Phys 2011; 81: 958 - 963
51. Porceddu SV, Rosser B, Burmeister BH, et al. Hypofractioned radiotherapy for the palliation of advanced head and neck cancer in patients unsuitable for curative treatment-"Hypo Trial." Radiother Oncol 2007; 85: 456 - 462
52. Corry J, Peters LJ, Costa ID, et al. The "QUAD SHOT'--a phase II study of palliative radiotherapy for incurable head and neck cancer. Radiother Oncol 2005; 77: 137 - 142.].
53. Болотина Л.В., Владимирова Л.Ю., Деньгина Н.В., Новик А.В., Романов И.С. Практические рекомендации по лечению злокачественных опухолей головы и шеи//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 71 - 82
54. Hitt R, Lopez-Pousa A, Martinez-Trufero J, et al. Phase III study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer. J Clin Oncol 2005; 23: 8636 - 8645
55. Grau JJ, Caballero M, Verger E, et al. Weekly paclitaxel for platin-resistant stage IV head and neck cancer patients. Acta Otolaryngol 2009; 129: 1294 - 1299.
56. Jae-Sook Ahn, Sang-Hee Cho, Ok-Ki Kim et al. The Efficacy of an Induction Chemotherapy Combination with Docetaxel, Cisplatin, and 5-FU Followed by Concurrent Chemoradiotherapy in Advanced Head and Neck Cancer. Cancer Res Treat. 2007 Sep; 39(3): 93 - 98.
57. Vermorken JB, Mesia R, Rivera F, et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359: 1116 - 1127.
58. Burtness B, Goldwasser MA, Flood W, et al. Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/recurrent head and neck cancer: an Eastern Cooperative Oncology Group study. J Clin Oncol 2005; 23: 8646 - 8654
59. Guigay J, Fayette J, Dillies A-F, et al. Cetuximab, docetaxel, and cisplatin (TPEx) as first-line treatment in patients with recurrent or metastatic (R/M) squamous cell carcinoma of the head and neck (SCCHN): Final results of phase II trial GORTEC 2008-03 [abstract]. J Clin Oncol 2012; 30 (suppl 15): Abstract 5505
60. Tahara M, Kiyota N, Yokota T, Hasegawa Y, Muro K, Takahashi S, Onoe T, Homma A, Taguchi J, Suzuki M, Minato K, Yane K, Ueda S, Hara H, Saijo K, Yamanaka T. Phase II trial of combination treatment with paclitaxel, carboplatin and cetuximab (PCE) as first-line treatment in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck (CSPOR-HN02). Ann Oncol. 2018 Apr 1; 29(4): 1004 - 1009. doi: 10.1093/annonc/mdy040. PMID: 29408977.
61. Herbst RS, Arquette M, Shin DM, et al. Phase II multicenter study of the epidermal growth factor receptor antibody cetuximab and cisplatin for recurrent and refractory squamous cell carcinoma of the head and neck. J Clin Oncol 2005; 23: 5578 - 5587.
62. Leeann Geraghty Thomas E. Schultz Sarah E. Hoffman Kyle Porter Majd Issa Vidhya Karivedu Marcelo Bonomi Weekly vs. 3-weekly paclitaxel, carboplatin, and cetuximab (PCC) in recurrent/metastatic head and neck cancer MOLECULAR AND CLINICAL ONCOLOGY 15: 240, 2021;
63. 930P - Weekly paclitaxel, carboplatin and cetuximab (PCC) as first-line treatment of recurrent and/or metastatic head & neck squamous cell carcinoma (R/M-HNSCC) for patients ineligible to cisplatin based chemotherapy H. Carinato, M. Burgy, C. Fischbach, M. Kalish-Weindling, L. Pabst, V. Frasie, A. Thiery, P. Coliat, M.F. Demarchi, T. Petit, C. Borel Annals of Oncology (2020) 31 (suppl_4): S599 - S628. 10.1016/annonc/annonc277
64. R. Hitt, A. Irigoyen, H. Cortes-Funes, J.J. Grau, J.A.  , J.J. Cruz Hernandez the Spanish Head and Neck Cancer Co Phase II study of the combination of cetuximab and weekly paclitaxel in the first-line treatment of patients with recurrent and/or metastatic squamous cell carcinoma of head and neck. Annals of Oncology 23: 1016 - 1022, 2012 doi: 10.1093/annonc/mdr367 Published online 23 August 2011.
, J.J. Cruz Hernandez the Spanish Head and Neck Cancer Co Phase II study of the combination of cetuximab and weekly paclitaxel in the first-line treatment of patients with recurrent and/or metastatic squamous cell carcinoma of head and neck. Annals of Oncology 23: 1016 - 1022, 2012 doi: 10.1093/annonc/mdr367 Published online 23 August 2011.
65. Gibson MK, Li Y, Murphy B, et al. Randomized phase III evaluation of cisplatin plus fluorouracil versus cisplatin plus paclitaxel in advanced head and neck cancer (E1395): an intergroup trial of the Eastern Cooperative Oncology Group. J Clin Oncol 2005; 23: 3562 - 3567.
66. Forastiere AA, Metch B, Schuller DE, et al. Randomized comparison of cisplatin plus fluorouracil and carboplatin plus fluorouracil versus methotrexate in advanced squamous-cell carcinoma of the head and neck: a Southwest Oncology Group study. J Clin Oncol 1992; 10: 1245 - 1251
67. Denis F, Garaud P, Bardet E, et al. Final results of the 94-01 French Head and Neck Oncology and Radiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol. 2004; 22: 69 - 76.
68. Bourhis J, Sire C, Graff P, et al. Concomitant chemoradiotherapy versus acceleration of radiotherapy with or without concomitant chemotherapy in locally advanced head and neck carcinoma (GORTEC 99-02): an open-label phase 3 randomised trial. Lancet Oncol. 2012; 13: 145 - 153.
69. Paclitaxel and carboplatin in patients with metastatic or recurrent squamous cell carcinoma of the head and neck. A phase II study S. Hiller and H.-G. Mergenthaler Meeting Abstract: 2004 ASCO Annual Meeting Head and Neck Cancer July 15, 200
70. Samlowski WE, Moon J, Kuebler JP, et al. Evaluation of the combination of docetaxel/carboplatin in patients with metastatic or recurrent squamous cell carcinoma of the head and neck (SCCHN): a Southwest Oncology Group Phase II study. Cancer Invest. 2007; 25: 182 - 188
71. Adeline ![]() ,
, ![]() Dalban, Andy Karabajakian, Eve-Marie Neidhardt, Pierre Eric Roux, Marc Poupart, Sophie Deneuve, Philippe Zrounba and
Dalban, Andy Karabajakian, Eve-Marie Neidhardt, Pierre Eric Roux, Marc Poupart, Sophie Deneuve, Philippe Zrounba and  Fayette. Carboplatin in combination with weekly Paclitaxel as first-line therapy in patients with recurrent/metastatic head and neck squamous cell carcinoma unfit to EXTREME schedule. Oncotarget. 2018 Apr 24; 9(31): 22038 - 22046. doi: 10.18632/oncotarget.25157
Fayette. Carboplatin in combination with weekly Paclitaxel as first-line therapy in patients with recurrent/metastatic head and neck squamous cell carcinoma unfit to EXTREME schedule. Oncotarget. 2018 Apr 24; 9(31): 22038 - 22046. doi: 10.18632/oncotarget.25157
72. Ferris RL, Blumenschein G, Jr., Fayette J, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck. N Engl J Med 2016; 375: 1856 - 1867
73. L. Specht, S. Kornum Larsen2, H. Sand Hansen Phase II study of docetaxel and cisplatin in patients with recurrent or disseminated squamous-cell carcinoma of the head and neck. Annals of Oncology 11: 845 - 849, 2000
74. Burtness B, Harrington KJ, Greil R, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915 - 1928
75. Jacobs C, Lyman G, Velez-Garcia E, et al. A phase III randomized study comparing cisplatin and fluorouracil as single agents and in combination for advanced squamous cell carcinoma of the head and neck. J Clin Oncol 1992; 10: 257 - 263.
76. Al-Sarraf M, Metch B, Kish J, et al. Platinum analogs in recurrent and advanced head and neck cancer: a Southwest Oncology Group and Wayne State University Study. Cancer Treat Rep 1987; 71: 723 - 726.
77. Grau JJ, Caballero M, Verger E, et al. Weekly paclitaxel for platin-resistant stage IV head and neck cancer patients. Acta Otolaryngol 2009; 129: 1294 - 1299.
78.  Fayette, Anthony Montella, Sylvie Chabaud, Thomas Bachelot, Pascal Pommier, Didier Girodet,
Fayette, Anthony Montella, Sylvie Chabaud, Thomas Bachelot, Pascal Pommier, Didier Girodet,  Racadot, Xavier Montbarbon, Bertrand Favier, Philippe Zrounba Paclitaxel is effective in relapsed head and neck squamous cell carcinoma: a retrospective study of 66 patients at a single institution Anti-Cancer Drugs 21(5): p 553 - 558, June 2010. | DOI: 10.1097/CAD.0b013e3283388e60
Racadot, Xavier Montbarbon, Bertrand Favier, Philippe Zrounba Paclitaxel is effective in relapsed head and neck squamous cell carcinoma: a retrospective study of 66 patients at a single institution Anti-Cancer Drugs 21(5): p 553 - 558, June 2010. | DOI: 10.1097/CAD.0b013e3283388e60
79. Catimel G, Verweij J, Mattijssen V, et al. Docetaxel (Taxotere): an active drug for the treatment of patients with advanced squamous cell carcinoma of the head and neck. EORTC Early Clinical Trials Group. Ann Oncol. 1994; 5: 533 - 46537.
80. Guardiola E, Peyrade F, Chaigneau L, et al. Results of a randomised phase II study comparing docetaxel with methotrexate in patients with recurrent head and neck cancer. Eur J Cancer. 2004; 40: 2071 - 2076
81. Martinez-Trufero J, Isla D, Adansa JC, et al. Phase II study of capecitabine as palliative treatment for patients with recurrent and metastatic squamous head and neck cancer after previous platinumbased treatment. Br J Cancer 2010; 102: 1687 - 1691.
82. Forastiere AA, Metch B, Schuller DE, et al. Randomized comparison of cisplatin plus fluorouracil and carboplatin plus fluorouracil versus methotrexate in advanced squamous-cell carcinoma of the head and neck: a Southwest Oncology Group study. J Clin Oncol 1992; 10: 1245 - 1251.
83. Stewart JS, Cohen EE, Licitra L, et al. Phase III study of gefitinib compared with intravenous methotrexate for recurrent squamous cell carcinoma of the head and neck [corrected]. J Clin Oncol 2009; 27: 1864 - 1871
84. Vermorken JB, Trigo J, Hitt R, et al. Open-label, uncontrolled, multicenter phase II study to evaluate the efficacy and toxicity of cetuximab as a single agent in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck who failed to respond to platinum-based therapy. J Clin Oncol 2007; 25: 2171 - 2177.
85. Fury MG, Sherman E, Lisa D, et al. A randomized phase II study of cetuximab every 2 weeks at either 500 or 750 mg/m2 for patients with recurrent or metastatic head and neck squamous cell cancer. J Natl Compr Canc Netw 2012; 10: 1391 - 1398.
86. Self EM, Bumpous J, Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngeal squamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr; 139(4): 356 - 61. doi: 10.1001/jamaoto.2013.103. PMID: 23599070.
87. Ziegler C, Wilson L, Potts K. Risk factors for hemorrhage after chemoradiation for oropharyngeal squamous cell carcinoma. JAMA Otolaryngol Head Neck Surg. 2013 Apr; 139(4): 356 - 61. doi: 10.1001/jamaoto.2013.103. PMID: 23599070.
88. Sittel C, Gossmann A,  M,
M,  M. Superselective embolization as palliative treatment of recurrent hemorrhage in advanced carcinoma of the head and neck. Ann Otol Rhinol Laryngol. 2001; 110(12): 1126 - 1128.
M. Superselective embolization as palliative treatment of recurrent hemorrhage in advanced carcinoma of the head and neck. Ann Otol Rhinol Laryngol. 2001; 110(12): 1126 - 1128.
89. Kumar T, Yadav V, Ravi K, Ramaswamy K, Patel MH, Kothari K. External Carotid Artery Ligation in Squamous Cell Carcinomas of the Oral Cavity and Oropharynx: an Oncological Emergency. Indian J Surg. 2015 Dec; 77(Suppl 3): 850-2. doi: 10.1007/s12262-014-1035-4. Epub2014 Jan 23. PMID: 27011469; PMCID: PMC4775627.
90. Taunk NK, Haffty BG, Kostis JB, Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18; 5: 39. doi: 10.3389/fonc.2015.00039. PMID: 25741474; PMCID: PMC4332338.
91. Smith TP. Embolization in the external carotid artery. J VascIntervRadiol. 2006 Dec; 17(12): 1897 - 912; quiz 1913. doi: 10.1097/01.RVI.0000247301.64269.27. PMID: 17185685.
92. Clarke P., Radford K., Coffey M., Stewart M. Speech and swallow rehabilitation in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol 2016; 130(S2): S176 - 80
93. Сытов А.В., Лейдерман И.Н., Ломидзе С.В., Нехаев И.В., Хотеев А.Ж. Практические рекомендации по нутритивной поддержке онкологических больных//Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2018 (том 8). С. 575 - 583
94. Zhao, S.G., Alexander, N.B., Djuric, Z., et al (2015). Maintaining physical activity during head and neck cancer treatment: Results of a pilot controlled trial. Head & Neck, 38(S1), E1086 - E1096
95. Segal R., Zwaal C., Green E. et al. Exercise for people with cancer: a systematic review. Curr Oncol. 2017 Aug; 24(4): e290 - e31
96. Samuel S.R., Maiya G.A., Fernandes D.J. et al. Effectiveness of exercise-based rehabilitation on functional capacity and quality of life in head and neck cancer patients receiving chemo-radiotherapy. Support Care Cancer 2019
97. Kinkead B., Schettler P.J., Larson E.R. et al. Massage therapy decreases cancer-related fatigue: results from a randomized early phase trial. Cancer 2018; 124(3): 546 - 54
98. Kleckner I.R., Kamen C., Gewandter J.S., et al. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer. 2018; 26: 1019 - 1028
99. Molassiotis A., Suen L.K.P., Cheng H.L., et al. A randomized assessor-blinded wait-list-controlled trial to assess the effectiveness of acupuncture in the management of chemotherapy-induced peripheral neuropathy. Integr Cancer Ther. 2019; 18 (1534735419836501);
100. Molassiotis A., Suen L.K.P., Cheng H.L., et al. A randomized assessor-blinded wait-list-controlled trial to assess the effectiveness of acupuncture in the management of chemotherapy-induced peripheral neuropathy. Integr Cancer Ther. 2019; 18 (1534735419836501);
101. Wardley A.M. ACUFOCIN: randomized clinical trial of ACUpuncture plus standard care versus standard care alone for Chemotherapy Induced Peripheral Neuropathy (CIPN); (12003).
102. in: ASCO Virtual Scientific Program. American Society of Clinical Oncology, Alexandria, VA2020
103. Bao T., Patil S., Chen C., et al. Effect of acupuncture vs sham procedure on chemotherapy-induced peripheral neuropathy symptoms: a randomized clinical Trial. JAMA Netw Open. 2020; 3: e200681
104. Bao T., Seidman A.D., Piulson L., et al. A phase IIA trial of acupuncture to reduce chemotherapy-induced peripheral neuropathy severity during neoadjuvant or adjuvant weekly paclitaxel chemotherapy in breast cancer patients. Eur J Cancer. 2018; 101: 12 - 19
105. Rick O., von Hehn U., Mikus E. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: a prospective randomized placebo-controlled phase-III study. Bioelectromagnetics 2016: 38(2): 85 - 94
106. Oberoi S., Zamperlini-Netto G., Beyene J. et al. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014; 9(9): e107418
107. He M., Zhang B., Shen N., Wu N., Sun J. A systematic review and meta-analysis of the effect of low-level laser therapy (LLLT) on chemotherapy-induced oral mucositis in pediatric and young patients. Eur J Pediatr 2018; 177(1): 7 - 17
108. Ross M., Fischer-Cartlidge E. Scalp cooling: a literature review of efficacy, safety, and tolerability for chemotherapy-induced alopecia. Clin J Oncol Nurs 2017; 21(2): 226 - 33
109. Duguet A., Bachmann P., Lallemand Y. Summary report of the standards, options and recommendations for malnutrition and nutritional assessment in patients with cancer. Br J Cancer 2003; 89(1): 92 - 7.
110. Снеговой А.В., Лейдерман И.Н., Салтанов А.И., Стрельчук В.Ю. Основные принципы и технологии клинического питания в онкологии: Методическое руководство для врачей. М., 2006.
111. Bozzetti F., Bozzetti V. Efficacy of enteral and parenteral nutrition in cancer patients. Nestle Nutr Workshop Ser Clin Perform Programme 2005; 10: 127 - 39
112. Сопроводительная терапия в онкологии. Практическое руководство. Под ред. С.Ю. Мооркрафта, Д.Л.Ю. Ли, Д. Каннингэма. Пер. с англ. Под ред. А.Д. Каприна. М.: Гэотар, 2016. 432 с.
113. Rosenthal D.I., Trotti A. Strategies for managing radiation-induced mucositis in head and neck cancer. Semin Radiat Oncol 2009; 19: 29 - 34.
114. Pauloski B.R. Rehabilitation of dysphagia following head and neck cancer. Phys Med Rehabil Clin N Am 2008; 9: 889 - 928
115. Arends J. et al. Cancer cachexia in adult patients: ESMO Clinical Practice Guidelines. 2021, Muscaritoli M. et. al. ESPEN practical guideline: Clinical Nutrition in cancer. Clinical Nutrition 40 (2021) 2898 - 2913
116. Murdoch-Kinch C.A., Zwetchkenbaum S. Dental management of the head and neck cancer patient treated with radiation therapy. J Mich Dent Assoc 2011; 93: 28 - 37;
117. Epstein J.B., Thariat J., Bensadoun R.J., et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship. CA Cancer J Clin 2012; 62: 400 - 422.
118. Каприн А.Д., Абузарова Г.Р., с соавт. Новые клинические рекомендации Всемирной организации здравоохранения по терапии онкологической боли у взрослых и подростков. Исследования и практика в медицине. 2021; 8(2): 90 - 108. https://doi.org/10.17709/2410-1893-2021-8-2-9
119. Zhao, S.G., Alexander, N.B., Djuric, Z., et al (2015). Maintaining physical activity during head and neck cancer treatment: Results of a pilot controlled trial. Head & Neck, 38(S1), E1086 - E1096
120. Oberoi S., Zamperlini-Netto G., Beyene J. et al. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014; 9(9): e107418
121. He M., Zhang B., Shen N., Wu N., Sun J. A systematic review and meta-analysis of the effect of low-level laser therapy (LLLT) on chemotherapy-induced oral mucositis in pediatric and young patients. Eur J Pediatr 2018; 177(1): 7 - 17
122. Yang G, Feng D, Li F, Luo B, Zhu J, Yang Q, Zheng L, Dong Q, Chen M, Xu Z, Li L, Chen P, Sun J. A randomized, controlled phase II trial of maxillofacial and oral massage in attenuating severe radiotherapy-induced oral mucositis and lipid metabolite changes in nasopharyngeal carcinoma. Radiother Oncol. 2021 Oct; 163: 76 - 82. doi: 10.1016/j.radonc.2021.07.024. Epub 2021 Jul 31. PMID: 34343545.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1. Агабабян Татев Артаковна, заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России, к.м.н., Обнинск https://orcid.org/0000-0002-9971-3451
2. Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник отделения радиационной онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
3. Алымов Юрий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения N 5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, исполнительный директор Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"; ORCID: https://orcid.org/0000-0002-6851-9867
4. Артемьева Анна Сергеевна, к.м.н., врач-патоморфолог, руководитель научной лаборатории морфологии опухолей ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова
5. Бойко Анна Владимировна, д.м.н., профессор, заведующая отделением лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
6. Болотин Михаил Викторович, к.м.н., научный сотрудник отделения хирургического N 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
7. Болотина Лариса Владимировна, д.м.н., доцент РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России. Председатель группы опухолей головы и шеи практических рекомендаций Российского общества клинической онкологии, член Правления.
8. Виноградов Вячеслав Вячеславович, д.м.н., профессор, руководитель научно-клинического отдела лор-онкологии ФГБУ "Научно-клинический центр оториноларингологии" ФМБА России.
9. Владимирова Любовь Юрьевна, д.м.н., профессор, руководитель отдела лекарственного лечения опухолей, ФГБУ "НМИЦ онкологии" МЗ РФ
10. Гамеева Елена Владимировна, д.м.н., и.о. генерального директора ФГБУ "Федеральный научный клинический центр медицинской реабилитации и курортологии" ФМБА России
11. Геворков Артем Рубенович, к.м.н., с.н.с., врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
12. Гиршович Михаил Маркович, к.м.н., врач-радиотерапевт ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России; https://orcid.org/0000-0002-7925-9570
13. Гулидов Игорь Александрович, заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России
14. Гузь Александр Олегович, к.м.н., врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ "Челябинский областной клинический центр онкологии и ядерной медицины"
15. Дайхес Николай Аркадьевич, член-корр. РАН, д.м.н., профессор, директор ФГБУ "Научно-клинический центр оториноларингологии" ФМБА России.
16. Дронова Екатерина Леонидовна, врач-радиолог ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
17. Енгибарян Марина Александровна, д.м.н., заведующая отделением опухолей головы и шеи ФГБУ "НМИЦ онкологии" МЗ РФ, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
18. Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России
19. Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения N 5 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи", ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН. ORCID: https://orcid.org/0000-0002-6796-0968
20. Клименко Вероника Викторовна, к.м.н., врач клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России; https://orcid.org/0000-0003-1079-4492
21. Корниецкая Анна Леонидовна, к.м.н., старший научный сотрудник отделения химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
22. Костромина Екатерина Викторовна, к.м.н., врач ультразвуковой диагностики, врач-рентгенолог отделения лучевой диагностики, научный сотрудник научного отделения диагностической и интервенционной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" МЗ РФ, доцент кафедры лучевой диагностики и медицинской визуализации ФП и ДПО ФГБОУ ВО СПбГМУ; https://orcid.org/0000-0002-4245-687X
23. Красильникова Лариса Анваровна, к.м.н., врач-цитолог ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России
24. Кропотов Михаил Алексеевич, д.м.н., заведующий отделением хирургическим отделением N 10 опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России
25. Кутукова Светлана Игоревна, д.м.н., доцент, ФГБОУ ВО "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации, СПб ГБУЗ "Городской клинический онкологический диспансер"
26. Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач-онколог отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ
27. Мордовский Александр Валентинович - к.м.н., научный сотрудник отдела головы, шеи и микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России
28. Новикова Ирина Валерьевна - к.м.н., старший научный сотрудник отдела головы, шеи и микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России
29. Мудунов Али Мурадович, д.м.н., профессор РАН, заведующий отделением хирургических методов лечения N 10 опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
30. Мусин Шамиль Исмагилович, к.м.н., заведующий хирургическим отделением N 6 ГАУЗ РКОД Минздрава РБ
31. Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России, вице-президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи".
32. Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
33. Полькин Вячеслав Викторович, к.м.н. заведующий отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России
34. Поляков Андрей Павлович, д.м.н., доцент, заведующий отделом головы, шеи и микрохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
35. Пономарева Ольга Игоревна, врач-рентгенолог отделения радиотерапии НМИЦ онкологии им. Н.Н. Петрова
36. Раджабова Замира Ахмед-Гаджиевна, д.м.н., доцент РАН, заведующий отделением опухолей головы и шеи ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова
37. Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации "Федерация специалистов по лечению заболеваний головы и шеи"
38. Романов Илья Станиславович, д.м.н, старший научный сотрудник отделения онкоэндокринологии ФГБУ "НМИЦ Онкологии им. Н.Н. Блохина", доцент кафедры онкологии ФДПО, РНИМУ им Н.И. Пирогова
39. Рубцова Наталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена - филиал "НМИЦ радиологии" Минздрава России. Главный внештатный специалист по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации.
40. Рудык Андрей Николаевич, к.м.н., врач-онколог онкологического отделения N 5 (опухолей головы и шеи) ГАУЗ "Республиканский клинический онкологический диспансер Министерства здравоохранения Республики Татарстан имени профессора М.З. Сигала", и.о. заведующего кафедрой челюстно-лицевой хирургии и хирургической стоматологии, доцент кафедры онкологии, радиологии и паллиативной медицины КГМА - филиал ФГБОУ ДПО РМАНПО Минздрава России, доцент кафедры хирургических болезней постдипломного образования ИФМиБ ФГАОУ ВО "Казанский (Приволжский) федеральный университет", г. Казань.
41. Семиглазова Татьяна Юрьевна, д.м.н., профессор, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России
42. Степанова Александра Михайловна, зам. генерального директора ФГБУ "Федеральный научный клинический центр медицинской реабилитации и курортологии" ФМБА России
43. Сукорцева Наталья Сергеевна, ассистент кафедры онкологии, реконструктивной хирургии и радиотерапии, врач онколог Университетской клинической больницы N 1 Сеченовского университета
44. Ткаченко Елена Викторовна, к.м.н., заведующий отделением краткосрочной противоопухолевой лекарственной терапии, научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, https://orcid.org/0000-0001-6375-8335
45. Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России
46. Феденко Александр Александрович, д.м.н., профессор РАН, заведующий Отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
47. Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, врач-радиотерапевт МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
48. Ходжибекова Малика Маратовна, д.м.н., врач-радиолог отделения радионуклидной диагностики МНИОИ им. П.А. Герцена - филиал "НМИЦ радиологии" Минздрава России.
49. Цырлина Евгения Владимировна, к.м.н., врач-эндокринолог отделения функциональной диагностики ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России
50. Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
51. Яковлева Лилия Павловна, к.м.н., врач-онколог, заведующая центром диагностики и лечения опухолей головы и шеи ГБУЗ МКНЦ имени А.С. Логинова МЗ РФ
Конфликта интересов нет
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
- врачи-онкологи;
- врачи-хирурги;
- врачи-радиологи;
- врачи-генетики;
- студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме рака ротоглотки в России и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 3. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 4. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологические качество, их выводы по интересующим вопросам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологические качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным Клиническим рекомендациям, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ
И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Справочные материалы не предусмотрены.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Блок-схема диагностики и лечения пациента с раком ротоглотки
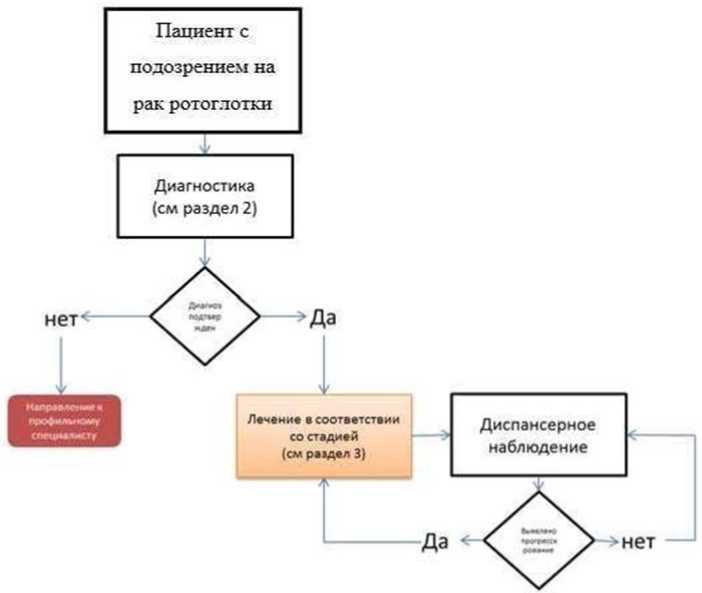
Алгоритм ведения пациента с подозрением на рак ротоглотки
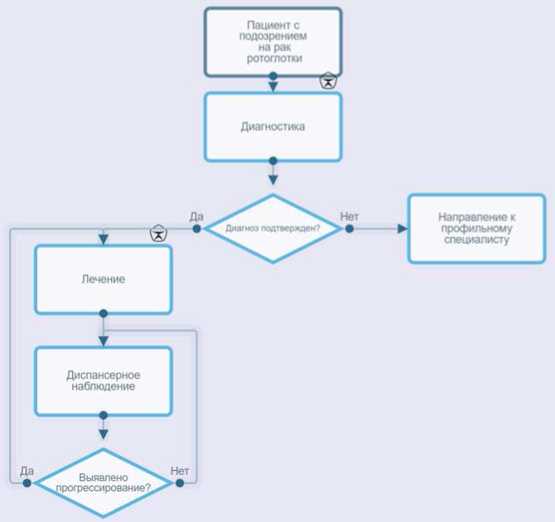
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Рекомендации по наблюдению после завершенного лечения
Наблюдение после завершенного лечения имеет важное значение для поддержания здоровья пациента. Обычно в 1-й год наблюдаться у врача-онколога рекомендуется с частотой каждые 1 - 3 мес., во 2-й год - 2 - 6 мес., на сроке 3 - 5 лет - 1 раз в 4 - 8 мес. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. Тем не менее частота визитов к врачу может быть увеличена в зависимости от характеристик заболевания и ассоциированных рисков и оговаривается индивидуально в каждом конкретном случае. При появлении жалоб, а также возобновлении симптомов, отмечавшихся до лечения, необходимо незамедлительно обратиться к врачу, не дожидаясь очередного срока запланированного визита.
Целью визитов является контроль не только онкологического заболевания, но и побочных эффектов, в том числе отсроченных (например, гипотиреоз после проведенной ЛТ на область шеи, снижения нутритивного статуса, оценка речевой и глотательной функции и т.д.).
Рекомендации относительно образа жизни и питания должны быть индивидуализированы с учетом объема проведенного лечения, рисков и выраженности осложнений, особенностей пациента.
Преимущества отказа от табакокурения и потребления алкоголя:
- более высокие показатели выживаемости;
- большая эффективность лечения;
- меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса);
- ускоренное восстановление общего состояния после лечения;
- ниже риск рецидива;
- меньший риск вторых опухолей;
- меньший риск инфекций;
- выше качество жизни.
Рекомендуется при осложнениях ХТ - связаться с врачом-онкологом (специалистом по химиотерапии).
1. При повышении температуры тела до 38 °C и выше:
- начать прием антибиотиков: по назначению врача-онколога (специалиста по химиотерапии).
2. При стоматите:
- диета - механическое, термическое щажение;
- частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- обрабатывать полость рта по назначению врача-онколога (специалиста по химиотерапии).
3. При диарее:
- диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать препараты по назначению врача-онколога (специалиста по химиотерапии).
4. При тошноте:
- принимать препараты по назначению врача-онколога (специалиста по химиотерапии).
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6): 649 - 655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
5
Смерть
Ключ (интерпретация): приведен в самой шкале
Приложение Г2
ВОПРОСНИК ПРИ ПЕРВИЧНОМ ОБРАЩЕНИИ ПАЦИЕНТА К ВРАЧУ
ПЕРВИЧНОЙ ЛЕЧЕБНОЙ СЕТИ В РАМКАХ ОНКОНАСТОРОЖЕННОСТИ
Название на русском языке: Вопросник при первичном обращении пациента к врачу первичной лечебной сети в рамках онконастороженности
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): https://oncology-association.ru/
Тип (подчеркнуть): вопросник
Назначение: оценка вероятности наличия злокачественных новообразований у пациента
Оценочный инструмент, содержание:
Вопросник при первичном обращении пациента к врачу первичной лечебной сети в рамках онконастороженности (выбрать правильные ответы, нужное подчеркнуть, при необходимости вписать)
Дата заполнения:
Ф.И.О.:
1. У Вас есть профессиональная вредность на работе?
1. Нет
2. Есть
2. Сколько лет Вы работаете/работали с профессиональной вредностью?
1. До 1 года
2. До 3 лет
3. От 3 до 5 лет
4. 6 - 10 лет
5. Более 10 лет
6. Более 15 лет
3. Ваши близкие родственники болели или болеют онкологическими заболеваниями лор-органов?
1. Нет
2. Болел или болеет
3. Не знаю
4. Вы курите (или курили)?
1. Нет
2. Да
3. Более 20 сигарет в день
4. Стаж курения менее 10 лет
5. Стаж курения 10 - 15 лет
6. Стаж курения более 20 лет
5. Вы заметили снижение своей массы тела за последний период времени?
1. Нет
2. Не знаю
3. Да, более чем на 5 кг
4. Да, я соблюдал диету
5. Вас беспокоят повышенная слабость и утомляемость, неадекватная нагрузкам?
1. Нет
2. Более 1 мес.
3. Более 6 ме.
7. Вас беспокоит повышенная общая потливость, возможно усиливающаяся в ночное время?
1. Нет
2. Да, появилась в течение последних 6 - 12 мес.
3. Беспокоила всегда
8. У Вас отмечается бледность или изменение цвета кожных покровов?
1. Нет
2. Да
3. Не знаю
9. Вы отмечали в последнее время появление увеличенных лимфатических узлов или других припухлостей на шее?
1. Нет
2. Да, безболезненные
3. Да, болезненные
10. У Вас есть на коже лица, головы и шеи новообразования или длительно незаживающие язвы?
1. Нет
2. Да
3. Если да, что именно? (впишите свои варианты)
11. Вы заметили в последнее время деформацию лица за счет появившихся образований или припухлостей (изменение формы носа, глаз и т.д.)?
1. Нет
2. Да
3. Если да, что именно? (впишите свои варианты)
12. Вас беспокоит длительный кашель или покашливания?
1. Нет
2. Да
3. С мокротой
4. С примесью крови
13. Вас беспокоит охриплость?
1. Нет
2. Периодически
3. В течение последнего месяца постоянно
4. Да, не обследовался и не лечился
5. Да, проведенное лечение без эффекта
14. Вас беспокоит затруднение дыхания через естественные дыхательные пути?
1. Нет
2. Иногда
3. Часто
4. Затруднение дыхание отмечается в покое
5. При незначительной физической нагрузке
6. При значительной физической нагрузке
15. Вас беспокоит "ощущение кома или инородного тела" в горле?
1. Нет
2. Иногда
3. Часто или постоянно
16. Вас беспокоят неприятный привкус во рту и/или запах изо рта?
1. Нет
2. Иногда
3. Часто или постоянно
17. Вас беспокоят нарушения глотания пищи?
1. Нет
2. Да, только жидкой пищи
3. Да, только твердой пищи
4. Акт глотания болезненный
5. Во время приема пищи появляется поперхивание и кашель
6. В течение последнего месяца
7. Более 3 мес.
18. Вас беспокоит затруднение носового дыхания?
1. Нет
2. Редко
3. Часто (постоянно)
4. Затруднение носового дыхание с обеих сторон
5. Затруднение носового дыхание справа/слева
6. Носовое дыхание отсутствует с обеих сторон
7. Носовое дыхание отсутствует справа/слева
19. Оцените свое обоняние?
1. В норме
2. Снижено
3. Отсутствует
4. С обеих сторон
5. Справа/слева
20. Вас беспокоят выделения из носа и/или стекание слизи по задней стенке глотки?
1. Нет
2. Редко
3. Часто (постоянно)
4. Слизистые или прозрачные
5. Гнойные с неприятным запахом
6. Кровянистые
21. Ощущаете ли Вы дискомфорт или болезненность лица в проекции придаточных пазух носа?
1. Нет
2. Редко
3. Часто (постоянно)
22. Появилось ли в последнее время в полости носа или в горле какое-либо новообразование?
1. Нет
2. Да
3. Безболезненное
4. Болезненное
5. Кровоточащее
Ключ (интерпретация): Утвердительные ответы на вопросы с 1-ого по 8-ой, при наличии симптоматики, описанной в вопросах с 9 по 23, позволяют заподозрить опухолевое заболевание; при этом требуется детальное обследование пациента профильными специалистами.
Приложение Г3
ШКАЛА NRS 2002
Название на русском языке: шкала NRS-2002 для скрининговой оценки нутриционного риска.
Оригинальное название: NRS-2002.
Источник (официальный сайт разработчиков, публикация с валидацией):
Kondrup J., Allison S.P., Elia M., Vellas B., Plauth M. Educational and Clinical Practice Committee, European Society of Parenteral and Enteral Nutrition (ESPEN). ESPEN Guidelines for Nutrition Screening 2002 Clinical Nutrition (2003) 22(4): 415 - 421.
Тип: шкала оценки
Назначение: Европейским обществом клинического питания и метаболизма (ESPEN) рекомендовано использовать шкалу NRS-2002 для скрининговой оценки нутриционного риска, состоящую из двух этапов.
Содержание:
1
Индекс массы тела менее 20,5
ДА
НЕТ
2
Наблюдалась ли у пациента потеря веса на протяжении предыдущих 3 месяцев?
ДА
НЕТ
3
Было ли снижено питание на предыдущей неделе?
ДА
НЕТ
4
Страдает ли пациент серьезным заболеванием (например, проходит интенсивную терапию или противоопухолевое лечение)?
ДА
НЕТ
Заключение
Ответ "Нет" на все вопросы - повторный скрининг проводится через неделю
При наличии ответа "Да" на любой вопрос продолжается скрининг по следующему блоку
Финальный скрининг
Нарушение питательного статуса
Тяжесть заболевания
Нет нарушений - 0 баллов
Нормальный питательный статус
Нет нарушений - 0 баллов
Нормальная потребность в нутриентах
1 балл - легкое
Потеря массы более 5% за последние 3 мес. или потребление пищи в объеме 50 - 75% от обычной нормы в предшествующую неделю
1 балл - легкая
Онкологическое заболевание перелом шейки бедра, цирроз печени, ХОБЛ, хронический гемодиализ, диабет
2 балла - умеренное
Потеря массы более 5% за последние 2 мес. или ИМТ 18,5 - 20,5 + ухудшение общего состояния или потребление пищи в объеме 25 - 60% от обычной нормы в предшествующую неделю
2 балла - средняя
Инсульт, тяжелая пневмония, радикальная абдоминальная хирургия, гемобластоз
3 балла - тяжелое
Потеря массы тела более 5% за 1 мес. или ИМТ 18,5 + ухудшение общего состояния или потребление пищи 0 - 25% от обычной нормы за предшествующую неделю
3 балла - выраженная
Черепно-мозговая травма, трансплантация костного мозга, интенсивная терапия (оценка по шкале APACHE-II > 10)
Общая сумма баллов:
Примечания:
1. Возраст пациента 70 и более лет - прибавить 1 балл к общей сумме.
2. Более 3 балов - высокий риск питательной недостаточности, требующий разработки программы нутритивной поддержки.
3. Менее 3 баллов - повторный скрининг каждую неделю. Если планируется оперативное лечение, то необходима программа предоперационной подготовки.
Пояснения: отсутствуют.
Приложение Г4
УНИВЕРСАЛЬНЫЙ ИНСТРУМЕНТ СКРИНИНГА НЕДОСТАТОЧНОСТИ ПИТАНИЯ
MUST (MALNUTRITION UNIVERSAL SCREENING TOOL)
Название на русском языке: универсальная шкала скрининга недостаточности питания
Оригинальное название (если есть): Malnutrition Universal Screening Tool, MUST
Источник (официальный сайт разработчиков, публикация с валидацией): Stratton R.J., Hackston A., Longmore D., et al. (2004) Malnutrition in hospital outpatients and inpatients: prevalence, concurrent validity and ease of use of the "malnutrition universal screening tool" ("MUST") for adults. Br J Nutr 92, 799 - 808
Тип: шкала
Назначение: скрининг недостаточности питания у пациентов пожилого и старческого возраста
Содержание (шаблон):
Скрининговая часть (пункты А - Е)
А.
Снизилось ли за последние 3 месяца количество пищи, которое вы съедаете, из-за потери аппетита, проблем с пищеварением, из за сложностей при пережевывании и глотании?
серьезное уменьшение количества съедаемой пищи - 0 баллов
умеренное уменьшение - 1 балл
нет уменьшения количества съедаемой пищи - 2 балла
Б.
Потеря массы тела за последние 3 месяца
потеря массы тела более, чем на 3 кг - 0 баллов
не знаю - 1 балл
потеря массы тела от 1 до 3 кг - 2 балла
нет потери массы тела - 3 балла
В.
Подвижность
прикован к кровати/стулу - 0 баллов
способен вставать с кровати /стула, но не выходит из дома - 1 балл
выходит из дома - 2 балла
Г.
Острое заболевание (психологический стресс) за последние 3 месяца
да - 0 баллов
нет - 2 балла
Д.
Психоневрологические проблемы
серьезное нарушение памяти или депрессия - 0 баллов
умеренное нарушение памяти - 1 балл
нет нейропсихологических проблем - 2 балла
Е.
Индекс массы тела
меньше 19 кг/м2 - 0 баллов
19 - 20 кг/м2 - 1 балл
21 - 22 кг/м2 - 2 балла
23 кг/м2 и выше - 3 балла
Сумма баллов за скрининговую часть: ________/14
Интерпретация:
Если сумма баллов за скрининговую часть составила 12 - 14 - баллов нормальный пищевой статус. Если сумма баллов по скрининговой части составила менее 12 баллов - продолжить опрос далее.
Ж.
Живет независимо (не в доме престарелых или больнице)
нет - 0 баллов
да - 1 балл
З.
Принимает более трех лекарств в день
да - 0 баллов
нет - 1 балл
И.
Пролежни и язвы кожи
да - 0 баллов
нет - 1 балл
К.
Сколько раз в день пациент полноценно питается
1 раз - 0 баллов
2 раза - 1 балл
3 раза 2 балла
Л.
Маркеры потребления белковой пищи
одна порция молочных продуктов (1 порция = 1 стакан молока, 60 г творога, 30 г сыра, 3/4 стакана йогурта) в день (да /нет)
если 0 - 1 ответ "да" 0 баллов
если 2 ответа "да" - 0,5 балла
если 3 ответа "да" - 1 балл
две или более порции бобовых яиц в неделю (1 порция = 200 г бобовых, 1 яйцо)
(да /нет)
мясо, рыба или птица каждый день (да /нет)
М.
Съедает две или более порций фруктов или овощей в день (1 порция = 200 г овощей, 1 любой фрукт среднего размера)
нет - 0 баллов
да - 1 балл
Н.
Сколько жидкости выпивает в день
меньше 3 стаканов - 0 баллов
3 - 5 стаканов - 0,5 балла
больше 5 стаканов - 1 балл
О.
Способ питания
не способен есть без помощи - 0 баллов
ест самостоятельно с небольшими трудностями - 1 балл
ест самостоятельно - 2 балла
П.
Самооценка состояния питания
оценивает себя как плохо питающегося - 0 баллов
оценивает свое состояние питания неопределенно - 1 балл
оценивает себя как не имеющего проблем с питанием - 2 балла
Р.
Состояние здоровья в сравнении с другими людьми своего возраста
не такое хорошее - 0 баллов
не знает - 0,5 балла
такое же хорошее 1 балл
лучше - 2 балла
С.
Окружность по середине плеча
20 см и меньше - 0 баллов
21 - 22 см - 0,5 балла
23 см и больше - 1 балл
Т.
Окружность голени
меньше 31 см - 0 баллов
31 см и больше - 1 балл
Общий балл: ___________/30
Интерпретация результатов (полная шкала от А до Т):
> 23,5 баллов - нормальный пищевой статус
17 - 23,5 баллов - риск недостаточности питания (мальнутриции)
< 17 баллов - недостаточность питания (мальнутриция).
