"Клинические рекомендации "Острая кишечная непроходимость опухолевой этиологии"
Утверждено
Общероссийская общественная организация
"Ассоциация колопроктологов России"
Президент АКР, академик РАН
Ю.А.ШЕЛЫГИН
Общероссийский национальный союз
"Ассоциация онкологов России"
Президент АОР, академик РАН
А.Д.КАПРИН
Общероссийская общественная организация
"Российское общество хирургов"
Президент РОХ, академик РАН
А.В.ШАБУНИН
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТРАЯ КИШЕЧНАЯ НЕПРОХОДИМОСТЬ ОПУХОЛЕВОЙ ЭТИОЛОГИИ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: K56.6
Возрастная группа: Взрослые
Год утверждения: 2024
Разработчик клинических рекомендаций:
- Общероссийская общественная организация "Ассоциация колопроктологов России"
- Общероссийский национальный союз "Ассоциация онкологов России"
- Общероссийская общественная организация "Российское общество хирургов"
Список сокращений
АД - артериальное давление
ДН - дыхательная недостаточность
ЖКТ - желудочно-кишечный тракт
КТ - компьютерная томография
КЩС - кислотно-щелочное состояние
ОАК - общий анализ крови
ОКН - острая кишечная непроходимость
УЗИ - ультразвуковое исследование
ХБП - хроническая болезнь почек
ХСН - хроническая сердечная недостаточность
ЧДД - частота дыхательных движений
ЧСС - частота сердечных сокращений
Rg - рентгенография
Scv02 - насыщение венозной крови центральных сосудов кислородом
Sp02 - насыщение артериальной крови кислородом
Термины и определения
Эндотоксикоз, или синдром эндогенной интоксикации - осложнение различных заболеваний, связанное с нарушением гомеостаза вследствие накопления в организме эндогенных токсических веществ, в том числе и бактериальных эндотоксинов, обладающих выраженной биологической активностью.
Карциноматоз брюшины - одна из форм метастазирования рака органов брюшной полости и малого таза, характеризующаяся появлением опухолевых очагов на висцеральной и париетальной брюшине.
1. Краткая информация по заболеванию или состоянию
(группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Кишечная непроходимость опухолевого генеза - синдром, характеризующийся нарушением продвижения содержимого по пищеварительному тракту, обусловленный механическим препятствием, которым является злокачественное или доброкачественное новообразование кишечника.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Острая кишечная непроходимость опухолевой этиологии относится к обтурационной непроходимости и, в преобладающем числе случаев, причина ее располагается в толстой кишке. Значительно реже ОКН бывает вызвана злокачественными новообразованиями тонкой кишки и доброкачественными опухолями кишечника. Обтурация может возникнуть вследствие перекрытия просвета кишки как первичной опухолью кишечника, так и сдавлением извне опухолью, исходящей из соседних органов и тканей.
Наиболее характерно стертое, медленно прогрессирующее начало в виде нарушения транзита в связи с неполным перекрытием просвета кишки. Острое начало может быть обусловлено полной обтурацией суженного участка опухолью или плотными каловыми массами.
В раннюю стадию непроходимости перистальтика усиливается, при этом кишечник своими сокращениями как бы стремится преодолеть появившееся препятствие. На этом этапе перистальтические движения в приводящей петле укорачиваются по протяженности, но становятся чаще. В дальнейшем, в результате гипертонуса симпатической нервной системы, перерастяжения кишечника, резкого угнетения тканевой перфузии, возникает фаза значительного угнетения моторной функции кишечника, а на поздних стадиях непроходимости развивается его полный паралич. Расстройство метаболизма тканей кишечной стенки усугубляет нарастающая эндогенная интоксикация, которая, в свою очередь, увеличивает тканевую гипоксию.
Водно-электролитные нарушения связаны с потерей большого количества жидкости, электролитов и белков. Жидкость теряется с рвотными массами, депонируется в приводящем отделе кишечника, скапливается в отечной кишечной стенке, ее брыжейке, а также в свободной брюшной полости. Потери жидкости в течение суток могут достигать 4 л и более. Происходит нарушение электролитного баланса, прежде всего, потеря калия. Наряду с жидкостью и электролитами теряется значительное количество белков (до 300 г/сут) за счет голодания, рвоты, секвестрации в просвет кишки и брюшную полость. Нарушение барьерной функции кишечной стенки приводят к транслокации бактерий в портальный кровоток, лимфу и перитонеальный экссудат. Эти процессы лежат в основе системной воспалительной реакции и абдоминального хирургического сепсиса, характерных для острой кишечной непроходимости.
В патогенезе кишечной непроходимости значительная роль отводится внутрибрюшной гипертензии - компартмент-синдрому, приводящему к нарушению кровоснабжения внутренних органов, снижению жизнеспособности тканей, полиорганной недостаточности. Основными принципами лечения компартмент-синдрома являются ранняя хирургическая декомпрессия и рациональная инфузионная терапия.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Рак толстой кишки является одной из наиболее распространенных форм злокачественных новообразований как в России, так и во всем мире [1; 2]. Острая кишечная непроходимость является осложнением колоректального рака, которое возникает у 15 - 20% больных, может наблюдаться во всех возрастных группах, но чаще у пациентов старше 50 лет. В Российской Федерации ежегодно регистрируется рост числа пациентов с опухолевой острой кишечной непроходимостью. По данным за 2019 год, в России выявлен 22221 случай ОКН, госпитальная и послеоперационная летальность составила 15,39% и 17,05% соответственно [3].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Класс - Болезни органов пищеварения (XI):
K56.6 - другая и неуточненная кишечная непроходимость
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день общепринятой классификации опухолевой кишечной непроходимости нет.
Рабочей Группой по созданию клинических рекомендаций по лечению больных с ОКН опухолевой этиологии предложено разделять ее в зависимости от степени компенсации [4]:
- компенсированная ОКН: периодически возникающая задержка стула и затруднение отхождения газов; на обзорной рентгенограмме брюшной полости может выявляться пневматизация толстой кишки с единичными уровнями жидкости в ней;
- субкомпенсированная ОКН: задержка стула и газов менее 3 суток, на обзорной рентгенограмме определяются пневматоз и чаши Клойбера - горизонтальные уровни жидкости с куполообразным просветлением (газом) над ними; отсутствуют признаки полиорганных дисфункций; эффективна консервативная терапия;
- декомпенсированная ОКН: задержка стула и газов более 3 суток; рентгенологические признаки как толсто-, так и тонкокишечной непроходимости с локализацией тонкокишечных уровней и арок во всех отделах брюшной полости; рвота застойным содержимым; наличие органных дисфункций.
Однако, научных доказательств обоснованности применения данной классификации для определения хирургической тактики у пациентов с кишечной непроходимостью недостаточно.
Предложенная японской исследовательской группой по безопасности толстокишечных стентов (The Japan Colonic Stent Safety Procedure Research Group - JCSSPRG) классификация ColoRectal Obstruction Scoring System (CROSS) не предусматривает ее применение в качестве инструмента для определения срока и вида лечения кишечной непроходимости [5].
Для определения срочности оперативного лечения необходима стратификация пациентов по стабильности в соответствии с критериями сепсиса (септического шока).
В качестве критериев сепсиса определена органная дисфункция, причиной которой может быть кишечная непроходимость или перфорация. Пациенты с сепсисом вследствие перфорации кишечника на фоне кишечной непроходимости нуждаются в экстренном оперативном лечении. Сообщается, что задержка операции свыше 6 часов у пациентов с септическим шоком вследствие гастро-интестинальной перфорации сопровождается нулевой 60-дневной выживаемостью [6]. Критерии нестабильности пациентов, соответствующие сепсису, предложены при определении тактики лечения опухолевой толстокишечной непроходимости в рекомендациях The World Society of Emergency Surgery (WSES) [7]. Для оценки органной дисфункции рекомендуется применение шкал Sequential Organ Failure Assessment (SOFA) и quick (быстрая) SOFA.
Примеры формулировки диагноза:
1. "Рак сигмовидной кишки, осложненный острой кишечной непроходимостью."
2. "Рак восходящей ободочной кишки, осложненный острой кишечной непроходимостью."
Более точная формулировка диагноза с использованием международной классификации TNM возможна при получении данных о морфологической структуре и распространенности опухолевого процесса.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления ОКН опухолевой природы разнообразны и зависят от многих факторов. Наиболее распространенными из них являются боль в животе, вздутие живота, отсутствие отхождения стула и газов.
2. Диагностика заболевания или состояния (группы
заболеваний или состояний), медицинские показания
и противопоказания к применению методов диагностики
К развитию синдрома острой кишечной непроходимости могут приводить множество различных заболеваний и их клинических форм [98 - 102]. Однако диагноз устанавливается на основании единообразных для всех состояний данных: жалобы и данные клинического осмотра (вздутие живота, схваткообразные боли в животе, прекращение отхождения стула и газов, тошнота, рвота), а также данных лабораторных и инструментальных методов исследования (обзорная рентгенография [103]; УЗИ брюшной полости [104]; компьютерная томография брюшной полости [105]). При этом, диагностические мероприятия универсальны, вне зависимости от заболевания, и сводятся к следующим основным этапам: исключению состояний, требующих немедленного оперативного вмешательства (странгуляция, перфорация, перитонит, и т.д.); дифференциальной диагностике механической и паралитической непроходимости; определению уровня и причины обструкции.
Выявление перфорации, странгуляции и септического шока является приоритетной задачей диагностического этапа у пациентов с кишечной непроходимостью.
Было установлено, что отсрочка оперативного вмешательства более чем на 6 часов при перфорации кишки и септическом шоке сопряжена со 100% 60-дневной летальностью [6], поэтому важной целью первичной диагностики и наблюдения в ходе неоперативного лечения является раннее выявление перфорации или угрозы перфорации ободочной кишки. При этом роль времени до операции у стабильных пациентов без перитонита не следует переоценивать. Прямая связь временной задержки операции при ОКН с 30-, 90-дневной, а также одногодичной летальностью не установлена [8].
2.1 Жалобы и анамнез
Острая кишечная непроходимость чаще возникает внезапно, проявляется отсутствием отхождения газов и вздутием живота. Вздутие живота и отсутствие отхождения газов являются патогномоничными симптомами ОКН.
Боль в животе - непостоянный симптом при ОКН, может быть схваткообразной, с периодами усиления во время волны перистальтики. При прогрессировании заболевания перистальтическая активность кишечника уменьшается из-за чего боль, как правило, на 2 - 3 сутки меняет характер со схваткообразной на постоянную, что служит плохим прогностическим признаком.
Рвота на ранних этапах ОКН может отсутствовать, позднее становится многократной, не приносящей облегчения. В позднем периоде рвотные массы приобретают вид и запах кишечного содержимого.
2.2 Физикальное обследование
При поступлении в стационар больного с подозрением на ОКН в первую очередь проводят клинический осмотр, при котором оценивается состояние кожных покровов, рассчитывается индекс массы тела, осуществляется термометрия, измерение пульса, частоты дыхательных движений и показателей артериального давления. Выполняется аускультация, перкуссия и пальпация живота. Всем больным проводится пальцевое ректальное исследование, у женщин дополнительно выполняется вагинальное исследование.
2.3 Лабораторные диагностические исследования
Специфической лабораторной диагностики ОКН опухолевой этиологии нет.
Основой лабораторной диагностики при ОКН является выявление системных нарушений, требующих коррекции и проведения дополнительной терапии. В клиническом анализе крови необходимо обращать внимание на наличие или отсутствие анемии, что может быть одним из маркеров развития послеоперационных осложнений, признаком хронической кровопотери, на наличие или отсутствие лейкоцитоза, изменений в лейкоцитарной формуле, как маркеров системной воспалительной реакции и транслокации микрофлоры кишечника через его растянутую стенку. Биохимический анализ крови, определение электролитов в сыворотке крови позволяет выявить водно-электролитные расстройства, происходящие при развитии синдрома кишечной недостаточности в результате обтурации просвета кишки, изменение уровня печеночных ферментов и азотистых оснований, что может свидетельствовать о развитии печеночно-почечной недостаточности как следствие рвоты и дегидратации, эндотоксикоза на фоне кишечной недостаточности [9].
2.4 Инструментальные диагностические исследования
- Пациентам с подозрением на острую обтурационную кишечную непроходимость при отсутствии противопоказаний рекомендуется выполнять компьютерную томографию органов грудной клетки, брюшной полости и малого таза в качестве метода выбора [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: выполнение компьютерной томографии брюшной полости у пациентов с подозрением на острую обтурационную кишечную непроходимость, позволяет заподозрить опухолевую природу непроходимости, установить стадию онкологического процесса, наличие отдаленных метастазов, протяженность патологического процесса в толстой кишке [10], исключить свободный газ в брюшной полости и выявить наличие пузырьков газа в периколической клетчатке как ранний рентгенологический симптом перфорации опухолью стенки кишки и другие осложнения ОКН. Ограничениями для метода являются наличие у пациента противопоказаний к использованию рентгенконтрастных средств, содержащих йод (лекарственная непереносимость, повышение уровня мочевины и креатенина крови), невозможность транспортировки пациента в отделение лучевой диагностики. В таком случае предпочтение в диагностике отдается ультразвуковому и/или рентгенологическому исследованию органов брюшной полости [11 - 13].
- Всем пациентам с подозрением на острую обтурационную кишечную непроходимость при невозможности выполнения компьютерной томографии рекомендуется проводить ультразвуковое исследование органов брюшной полости, малого таза и обзорную рентгенографию органов брюшной полости [14].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарии: при отсутствии возможности выполнения компьютерной томографии органов брюшной полости, диагностический алгоритм включает трансабдоминальное ультразвуковое исследование брюшной полости и обзорное рентгенологическое исследование брюшной полости. Ультразвуковое исследование является оператор-зависимым методом исследования, но при наличии опытного врача эффективнее рентгенологического исследования, а также может быть выполнено в госпитальном отделении, что не требует транспортировки пациента [13; 15].
- Всем пациентам с подозрением на острую обтурационную кишечную непроходимость, определяемую по данным ультразвукового и обзорного рентгенологического исследования брюшной полости, при невозможности выполнения компьютерной томографии рекомендуется проводить ирригоскопию с использованием водорастворимых нефротропных высокоосмолярных рентгеноконтрастных средств (V08AA01 Натрия амидотризоат) [16; 17].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2)
Комментарии: при подозрении на острую обтурационную кишечную непроходимость по данным ультразвукового исследования брюшной полости и обзорной рентгенографии живота, отсутствии возможности выполнить компьютерную томографию, целесообразно проведение ирригоскопии (A06.18.001) водорастворимым контрастным средством с целью определения уровня препятствия. Контрастная клизма с бария сульфатом** не рекомендуется, так как затрудняет в дальнейшем визуализацию слизистой оболочки кишки при колоноскопии [17; 18].
- Рекомендуется гемодинамически стабильным пациентам с подозрением на острую обтурационную кишечную непроходимость при отсутствии высокого риска перфорации кишки проводить колоноскопию с целью верификации диагноза и биопсии опухоли [5; 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: при колоноскопии оценивают диаметр опухолевого стеноза и возможность стентирования кишки, выполняется забор опухолевой ткани для патоморфологического исследования. С целью подготовки кишки к осмотру предпочтительно использование очистительных клизм, выполнение которых в ряде случаев позволяет добиться разрешения кишечной непроходимости, вместе с тем, может стать причиной диастатической перфорации проксимальных отделов толстой кишки. Проведение колоноскопии до операции не рекомендуется у нестабильных пациентов, а также при расширении купола слепой кишки более 10 см из-за высокого риска перфорации кишки во время процедуры [20]. В таком случае колоноскопия должна быть выполнена в послеоперационном периоде для исключения новообразований в остальных отделах толстой кишки [7]. С целью уменьшения риска перфорации кишки предпочтительна инсуфляция с использованием CO2 [21].
2.5 Иные диагностические исследования
Нет.
1. Лечение, включая медикаментозную и немедикаментозную
терапию, диетотерапию, обезболивание, медицинские показания
и противопоказания к применению методов лечения
Основной целью медицинской помощи больным с ОКН опухолевой этиологии является ликвидация кишечной непроходимости, которая позволяет создать благоприятные условия для скорейшего начала онкологически обоснованного лечения.
Операция является основным методом лечения опухолевой кишечной непроходимости. Объем, срочность и этапность оперативного лечения зависят от технического обеспечения лечебного учреждения, подготовки хирургической, анестезиологической и реанимационной бригад, функционального статуса и степени операционно-анестезиологического риска пациента, распространенности и наличия осложнений онкологического заболевания, в том числе перфорации с формированием перитонита, абсцесса, сепсиса и септического шока.
3.1 Консервативная терапия
Неоперативное лечение является этапом подготовки к операции и, в отличие от тонкокишечной непроходимости, не рассматривается как самостоятельный окончательный метод лечения опухолевой кишечной непроходимости.
- Пациентам с ОКН без признаков кишечной перфорации может быть рекомендовано начальное неоперативное лечение, целью которого является подготовка к операции в наиболее благоприятных условиях [20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: для достижения наилучших условий необходима коррекции водно-электролитных нарушений, анемии, нутритивного статуса, обеспечения квалифицированной анестезиологической и хирургической бригады. В качестве показания к немедленному оперативному лечению указывается стойкий ацидоз и дилятация купола слепой кишки больше 10 см, что указывает на угрозу перфорации. При отсутствии признаков компрометации кишечной стенки лечение может быть продолжено до оптимальных условий с контролем лабораторных и инструментальных показателей каждые 6 - 12 часов [20].
- Всем пациентам с ОКН следует проводить коррекцию гиповолемии и водно-электролитных нарушений [22, 23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2)
Комментарий: гиповолемия может иметь катастрофические последствия для хирургических пациентов и является основным фактором предотвратимой летальности. Гиповолемия у пациентов перед операцией должна быть устранена всегда, когда это возможно. На начальном этапе коррекции гиповолемии следует отдавать предпочтение сбалансированным кристаллоидным растворам (растворы, влияющие на водно-электролитный баланс, АТХ B05BB) [22].
- Больным с ОКН, демонстрирущим симптомы гастростаза рекомендуется обеспечивать декомпрессию проксимальных отделов ЖКТ путем аспирации содержимого через назогастральный или назоинтестинальный зонд [20; 24].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: хотя в международных рекомендациях [7] при ОКН, в отличии от тонкокишечной непроходимости, процедура декомпрессии ЖКТ на предоперационном этапе не описана, ее применение при тонко-толстокишечной непроходимости позволяет рассчитывать на снижение внутрибрюшного давления, концентрации микробной флоры, токсического действия застойного содержимого желудка и тонкой кишки. Рекомендация по декомпрессии ЖКТ на дооперационном этапе могут быть актуальны, в первую очередь, при опухолях правых отделов ободочной кишки, проявляющихся тонкокишечной непроходимостью с дилятацией проксимальных отделов ЖКТ. При левосторонней ОКН дилятация проксимальной части тонкой кишки и желудка встречается реже, в связи с чем, при отсутствии застойного содержимого в желудке нет необходимости в установке зонда для декомпрессии верхних отделов ЖКТ. В отечественном исследовании влияния декомпрессии желудка на выживаемость пациентов с тонкокишечной непроходимостью не установлено [25]. Однако, предварительная декомпрессия ЖКТ позволяет облегчить манипуляции в брюшной полости. В связи с этим, декомпрессия ЖКТ с помощью назогастрального (интестинального) зонда может быть рекомендована.
- Всем пациентам с ОКН рекомендовано прекращение энтерального питания [26].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: энтеральное питание оказывает трофическое действие на кишечный эпителий, предотвращает атрофию слизистой, препятствует бактериальной транслокации. Однако, энтеральное питание невозможно в случае обструкции желудочно-кишечного тракта, перфорации или ишемии кишечной стенки [26].
- Всем больным с ОКН рекомендуется проводить оценку эффективности проводимого лечения, клиническую - каждые 6 часов, инструментальную (обзорная рентгенография органов брюшной полости или УЗИ) - каждые 12 часов [6; 19; 20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: к наиболее важным клиническим признакам улучшения - консервативного разрешения ОКН следует отнести восстановление отхождения газов и естественного опорожнения кишечника. В качестве критериев прекращения неоперативного лечения следует принимать клинико-рентгенологические данные, указывающие на интраабдоминальные осложнения (перфорация), высокий уровень лактата (сывороточный лактат выше 2 ммоль/л) и лейкоцитоза (более 18 x 109), температура более 38,5 °C, нарастание креатинина (более чем в 2 раза по сравнению с поступлением) [20]. Кроме того, расширение купола слепой кишки более 10 см, неподдающийся коррекции ацидоз следует рассматривать как показания к выполнению срочного оперативного вмешательства [20]. Решение о возможности дальнейшего проведения консервативной терапии должно приниматься каждые 6 часов. Показано, что отсрочка в начале оперативного вмешательства более чем на 6 часов при перфорации кишки и септическом шоке сопряжена со 100% 60-дневной летальностью [6].
- Нестабильным пациентам с ОКН, перитонитом и септическим шоком оперативное вмешательство рекомендуется после интенсивной терапии и стабилизации состояния [27].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 3)
Комментарий: больные с ОКН, перитонитом и септическим шоком нуждаются в интенсивной предоперационной терапии. К факторам риска летального исхода относятся гипотермия (менее 35 °C), метаболический ацидоз, наличие клинических или лабораторных признаков коагулопатии [27]. Кроме того, в интенсивной терапии нуждаются коморбидные больные и лица старше 70 лет [28]. Целевыми показателями стабилизации состояния являются восстановление центрального венозного давления до 8 - 12 мм рт. ст., среднего артериального давления > 65 мм. рт. ст., центральной венозной сатурации до (ScvO2) > 70% [29; 30]. Лечение нестабильных пациентов с ОКН целесообразно проводить в условиях отделения реанимации.
- Пациентам с установленной кишечной перфорацией и перитонитом, рано, как только возможно, должна быть рекомендована антибактериальная терапия [31 - 33].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарии: интраабдоминальные инфекции, обусловленные перфорацией толстой кишки часто вызываются смесью аэробных и анаэробных бактерий. Антимикробная терапия, рекомендуемая при интраабдоминальных инфекциях [31], включает монотерапию препаратом из группы карбапенемов и комбинированную терапию метронидазолом** с цефалоспоринами третьего поколения или фторхинолонами. Хотя метронидазол** используется в качестве стандартной терапии трихомониаза, анаэробных и амебных инфекций во всем мире с 1970-х годов, резистентность к метронидазолу** остается низкой [33]. Показано, что комбинированная терапия метронидазолом** может быть эффективным и безопасным вариантом лечения интраабдоминальных инфекций, подобно монотерапии карбапенемами [32].
- С целью профилактики тромбоэмболических осложнений у пациентов с ОТНК рекомендовано назначение препаратов группы гепарина, использование компрессионного трикотажа [34].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 1)
Комментарий: пациенты, которым выполняется оперативное вмешательство по поводу колоректального рака, относятся к группе высокого риска возникновения тромбоэмболических осложнений. При наличии кишечной непроходимости риск подобных осложнений расценивается как крайне высокий. Применение низкомолекулярных гепаринов (АТХ - группа гепарина) может существенно снизить вероятность возникновения тромбоза глубоких вен нижних конечностей и тромбоэмболию легочной артерии. Использование других препаратов группы гепаринов не отличается по эффективности, однако сопряжено с большим числом геморрагических осложнений и развитием гепарин-индуцированной тромбоцитопении. Дополнительно используются компрессионные чулки, а также терапевтическая система пневматической компрессии. В то же время раннее прекращение постельного режима является одним из условий успешной профилактики венозного тромбоза и практикуется во всех случаях, когда это возможно. У больных, перенесших обширные оперативные вмешательства по поводу онкологических операций, целесообразно проводить профилактические мероприятия, сочетающиеся с введением низкомолекулярных гепаринов как минимум в течение 4 недель [35; 36].
3.2 Неинвазивные методы лечения
Нет.
3.3 Хирургическое лечение
Основной задачей хирургического лечения ОКН является спасение жизни больного от развившегося осложнения рака толстой кишки, а также создание благоприятных условий для скорейшего начала онкологически обоснованного лечения. К операции по удалению опухоли ободочной кишки при ОКН следует прибегать только в тех случаях, когда это необходимо для спасения жизни больного, а также в ситуациях, когда потенциальный риск неблагоприятного исхода этапного лечения превышает выгоду одноэтапного подхода.
Существует два варианта хирургического лечения ОКИ, а именно: 1) начальная декомпрессия толстой кишки с последующей плановой резекцией ободочной кишки; 2) первичная резекция ободочной кишки. С целью декомпрессии толстой кишки может быть сформирована проксимальная кишечная стома, установлен стент или декомпрессионный колоноскопический катетер (колоректальный зонд, в англоязычной литературе "Dennis Colorectal Tube"). К первично резекционным вмешательствам относят обструктивную сегментарную резекцию ободочной кишки без формирования анастомоза (операция по типу Гармана, правосторонняя гемиколэктомия с формированием концевой илеостомы/илеоасцендостомы), субтотальную резекцию ободочной кишки и сегментарную резекцию ободочной кишки с первичным анастомозом. Проблему выбора оптимального хирургического подхода нельзя считать решенной, поиск оптимальных лечебных подходов продолжается.
3.3.1 Эндоскопические декомпрессионные малоинвазивные вмешательства
К малоинвазивным методам хирургического лечения больных с ОКН опухолевой этиологии относят установку саморасширяющегося стента, а также проведение колоноскопического декомпрессионного катетера проксимальнее опухоли толстой кишки. Разрешение кишечной непроходимости позволяет избежать выполнения экстренного или срочного оперативного вмешательства, что дает возможность использовать дополнительные лечебные и диагностические мероприятия для подготовки больного к плановому оперативному лечению, в том числе, лапароскопическим доступом. Ликвидация острой кишечной непроходимости на первом этапе лечения осложненного рака толстой кишки позволяет снизить вероятность возникновения тяжелых осложнений и летального исхода, создает условия для выполнения операции с формированием первичного анастомоза, а в некоторых случаях без наложения превентивной кишечной стомы [37].
3.3.1.1 Эндоскопическое стентирование при опухолевом стенозе
Наиболее распространенным неинвазивным методом лечения, позволяющим купировать ОКН является стентирование кишки саморасширяющейся сетчатой системой (стент для толстой кишки металлический непокрытый), вводимой в просвет кишки на уровень опухоли с помощью эндоскопа.
- При отсутствии признаков перфорации, перитонита, кровотечения, полной окклюзии просвета кишки опухолью левых отделов ободочной кишки рекомендована установка саморасширяющегося металлического стента (стент для толстой кишки металлический непокрытый) [38].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: техническая эффективность метода составляет 80 - 100%, в то время как клиническое улучшение наблюдается у 73 - 89% больных. Наиболее опасным осложнением стентирования является перфорация, которая наблюдается в 12,8% случаев, при этом, "скрытая" перфорация, обнаруживаемая только при инструментальном исследовании, возникает в 26,7% случаев [39]. Перфорация опухоли во время стентирования является фактором неблагоприятного прогноза [40], после стентирования чаще обнаруживается поражение лимфатических узлов и периневральная опухолевая инвазия [41]. Вместе с тем, при наличии достаточного опыта стентирования (не менее 40 процедур) и выполнении радикальной операции по удалению опухоли ободочной кишки в течение 14 дней, общая и безрецидивная выживаемость в группе стентирования и первичной резекции не отличается [38; 42], частота несостоятельности анастомоза и формирования стомы при стентировании ниже [43]. Более ранние рекомендации не допускали рутинное применение этого метода лечения из-за опасений в ухудшении отдаленных результатов лечения [44].
- Во избежание рецидива непроходимости радикальное оперативное вмешательство рекомендовано выполнять в течение 14 - 30 суток с момента ликвидации ОКН у пациентов, не требующих дополнительного лечения, в том числе, неоадъювантной лекарственной и/или лучевой терапии [45].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: после стентирования значимых различий в пострезекционных осложнениях, продолжительности пребывания в стационаре или лапароскопических резекциях при выполнении операции через 11 - 17 дней по сравнению с 5 - 10 днями не наблюдалось. Из осложнений, связанных со стентом, 48% возникли у пациентов, прооперированных в сроки более 17 дней после декомпрессии. По сравнению с вмешательствами, выполненными в течение 14 дней после формирования стомы, операции, осуществленные в период 14 - 28 дней после декомпрессии сопровождались значительно большим количеством лапароскопических резекций, большим числом первичных анастомозов и меньшим койко-днем. Не было продемонстрировано влияния сроков радикального оперативного вмешательства на летальность, безрецидивную или общую выживаемость [45].
- Стентирование опухоли при ОКН на фоне проводимой противоопухолевой терапии препаратами на основе моноклональных антител ингибирующих биологическую активность фактора роста эндотелия сосудов (бевацизумаб**) не рекомендовано [46].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: наличие стента в опухолевом канале у больных, длительно получающих бевацизумаб**, связано с высоким риском перфорации опухоли [46].
- У пациентов с ОКН, обусловленной опухолью нижне-ампулярного и средне-ампулярного отделов прямой кишки стентирование не рекомендовано [47].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: при низкой локализации рака в прямой кишке в зону стентирования может попасть зубчатая линия, что служит причиной появления выраженного болевого синдрома, кровотечения, тенезмов и недержания кишечного содержимого [47].
3.3.1.2 Ретроградное проведение декомпрессионного колоноскопического катетера
Метод заключается в трансанальном проведении декомпрессионного колоноскопического катетера через опухолевый канал с последующим промыванием проксимальных отделов ободочной кишки. Осуществляется во время колоноскопии под контролем рентгеноскопии.
- При отсутствии признаков перфорации, перитонита, кровотечения и полной окклюзии просвета кишки опухолью левых отделов ободочной кишки, в качестве альтернативы стентированию, рекомендована установка декомпрессионного колоноскопического катетера [48].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: проведение рентгеноконтрастной трубки возможно при диаметре опухолевого канала не менее 3 мм. Техническая эффективность метода составляет 80%, клиническая - 72,5%; частота перфорации кишки может достигать 10%.
Потенциальным преимуществом метода является возможность осуществить лаваж проксимальных отделов толстой кишки, и, предположительно, меньшая травматизация кишки в зоне опухоли из-за отсутствия растяжения опухолевого канала, имеющего место при стентировании. Существенным ограничением метода к использованию является отсутствие данных о его онкологической безопасности [43].
3.3.2 Оперативное лечение
Первоочередной задачей хирургического лечения при ОКН является ликвидация кишечной непроходимости и сохранение жизни пациенту. При наличии в лечебном учреждении колоректального хирурга - онколога или колопроктолога решение об объеме оперативного лечения принимается, исходя из индивидуальных особенностей пациента - при отсутствии перитонита допустимо выполнение как резекционных, так и декомпрессивных вмешательств (кишечная стома). Рациональным методом хирургического лечения при ОКН в неспециализированных стационарах является формирование проксимальной стомы с последующим радикальным оперативным вмешательством по удалению опухоли толстой кишки, которое предпочтительно выполнять в специализированных медицинских учреждениях онкоколопроктологического профиля.
- Показанием к прекращению дальнейшей терапии и выполнению срочного оперативного вмешательства следует считать наличие стойкого ацидоза и/или расширение купола слепой кишки более 10 см [20].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: показанием к срочному оперативному лечению является дилятация купола слепой кишки больше 10 см из-за угрозы перфорации, а также неподдающийся коррекции ацидоз [20].
- Всем больным, которым планируется формирование кишечной стомы, перед операцией рекомендована маркировка области предполагаемой стомы [49].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: если пациенту предполагается формирование стомы, то ход самой процедуры и ее последствия должны быть тщательно ему разъяснены. Необходимо выполнить маркировку области, где предполагается сформировать стому. Наиболее оптимальным перед выполнением операции является консультация специалиста по реабилитации стомированных больных. В экстренных ситуациях не всегда возможно соблюдение указанных выше рекомендаций, в таких случаях разметка области предполагаемого выведения стомы должна проводиться оперирующим врачом-хирургом. Разметка производится в положении больного стоя, лежа и сидя, с учетом его индивидуальных и конституциональных особенностей, в соответствии с клиническими рекомендациями по лечению больных с кишечной стомой [50].
- Пациентам, без признаков перфорации кишки, перитонита, абсцедирования, оперируемым по поводу ОКН опухолевой этиологии, рекомендовано проведение антибиотикопрофилактики антибактериальными препаратами системного действия (АТХ J01) [51].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарий: эффективным считается однократное введение антибактериального препарата широкого спектра действия (АТХ: J01CA Пенициллины широкого спектра действия, J01DC Цефалоспорины второго поколения, J01DD Цефалоспорины третьего поколения, J01DE Цефалоспорины четвертого поколения, J01DH Карбапенемы, J01M Антибактериальные препараты производные хинолона) непосредственно перед операцией, а при длительности хирургического вмешательства более 3 ч - его повторное введение. Назначение антибактериальных препаратов системного действия может уменьшать частоту развития инфекционных осложнений, укорачивать сроки пребывания больного в стационаре, снижать затраты на лечение осложнений после хирургических операций [51].
- Всем больным с ОКН рекомендовано осуществление интраоперационной декомпрессии тонкой кишки [49].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: декомпрессия тонкой кишки необходима для устранения абдоминального компартмент синдрома, обеспечения условий для ушивания раны брюшной стенки без натяжения, снижения концентрации микробной флоры, устранения токсического действия застойного содержимого желудка и тонкой кишки, нормализации дыхательной функции, снижения риска аспирационной пневмонии, улучшения перфузии кишечной стенки, восстановления моторной и всасывательной функций кишечника.
По данным систематического обзора, нет статистически значимых различий в результатах лечения больных с ОКН при применении назогастрального зонда с мануальной декомпрессией тонкой кишки или "открытой" декомпрессией кишки [52]. При лечении тонкокишечной непроходимости, по результатам проведенного метаанализа, использование назоинтестинального зонда не имеет преимуществ перед назогастральным [53].
Выбор способа декомпрессии пищеварительного тракта должен решаться индивидуально для каждого больного, основываться на особенностях его заболевания, опыте лечебного учреждения и оперирующего хирурга.
3.3.2.1 Формирование петлевой стомы.
Формирование петлевой илеостомы/колостомы является альтернативой стентированию в стратегии "мост к хирургии", когда лечение направлено только на ликвидацию острой кишечной непроходимости с целью создания оптимальных условий для выполнения основного этапа хирургического вмешательства - удаления опухоли толстой кишки [37; 54].
- При неэффективности проводимого лечения, отсутствии признаков перитонита, а также в качестве альтернативы стентированию рекомендовано выполнение оперативного вмешательства в объеме формирования проксимальной петлевой кишечной стомы [55 - 57].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: преимуществом петлевой стомы является относительная простота операции, надежная декомпрессия толстой кишки, возможность выполнения тотальной колоноскопии (при формировании двуствольной колостомы), позволяющей в 2,3 - 12,4% случаев обнаружить синхронное новообразование [55]. Вопрос о выборе илео- или колостомы решается индивидуально, в зависимости от конкретной клинической ситуации. Частота осложнений при обоих вариантах операции сопоставима, однако, у больных с илеостомой выше риск развития дегидратации [56]. Было показано, что больные, которые первым этапом подвергались формированию петлевой стомы статистически значимо реже имели кишечную стому после операции по удалению опухоли толстой кишки - 29% против 67% в группе стентирования (p < 0,001) [57]. При этом, следует указать на более высокую частоту тяжелых осложнений у стомированных больных - 15,3% против 5,8% в группе стентирования, однако, это не оказывало влияния на общую и безрецидивную выживаемость, которая была сопоставима в группах [57]. В сравнении с первичной резекцией толстой кишки частота кумулятивной летальности и осложнений сопоставимы, однако, в группе больных со стомой чаще удается сформировать межкишечный анастомоз - в 89,3% в отличие от 49,2% при удалении опухоли толстой кишки на первом этапе лечения. В 9,4% случаев больные остаются с постоянной стомой, в то время как в группе первичных резекций этот показатель равен 21,6% [54]. В случае кишечной непроходимости, обусловленной опухолью прямой кишки, от выполнения первичной резекции прямой кишки по Гартману целесообразно отказаться, так как это существенно затрудняет последующую реабилитацию больного. Помимо этого, при локализации опухоли в средне- или нижнеампулярном отделе прямой кишки, особенно в случае местно-распространенных опухолей, выполнение резекционного вмешательства лишает больного возможности проведения неоадъювантной химиолучевой терапии, тем самым дискредитирует принципы онкологического радикализма [58; 59].
- У нестабильных пациентов с опухолевой обтурационной ОКН или при технических трудностях выведения петлевой колостомы в качестве декомпрессионной операции может быть использована пристеночная колостома [60].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: пациентам с опухолевой обтурационной ОКН не рекомендуется формирование пристеночной колостомы, в том числе цекостомы, поскольку она не обеспечивает полного отключения пассажа кишечного содержимого и полноценного купирования осложнений опухолевого процесса. Данная операция может быть оправдана только у ограниченного количества пациентов в критическом состоянии, когда стентирование или формирование петлевой кишечной стомы не могут быть выполнены [60].
3.3.2.2 Резекция толстой кишки
Наиболее часто выполняемое радикальное оперативное вмешательство при раке левой половины ободочной кишки, осложненном ОКН - резекция ободочной кишки с формированием концевой колостомы (операция по типу Гартмана) [12]. При расположении новообразований в правых отделах ободочной кишки выполняются операции с формированием анастомоза, а при необходимости выполнения резекции ободочной кишки без создания анастомоза формируется одноствольная илеостома.
Преимуществом такого рода операций является исключение вероятности развития несостоятельности межкишечного анастомоза, у также, удаление опухоли на начальном этапе лечения. Однако, следует отметить, что резекционные вмешательства сопряжены с высоким уровнем послеоперационной летальности - 9% и послеоперационных осложнений, в том числе, связанных с кишечной стомой. Факторами риска летального исходя являются пожилой возраст больных - старше 70 лет, высокий анестезиологический риск - ASA 3, сердечно-сосудистая недостаточность и неврологические нарушения. Немаловажным является низкая частота выполнения реконструктивно-восстановительных вмешательств - только 35% больным в последующем удается восстановить естественную дефекацию [12]. Было показано, что среднее число лимфатических узлов в удаленном препарате после экстренных вмешательств ниже, чем в плановой хирургии (8,7 против 21) [61].
Следует отметить, что по проблеме выбора оптимальной стратегии хирургического лечения больных с ОКН проведены десятки рандомизированных исследований и метаанализов. При анализе Pubmed за последние 5 лет по запросу "large bowel obstruction" обнаружено 10 метаанализов, посвященных выбору оптимальной первичной операции: стома, стент, резекция. Из них единственное исследование показало, что первичная декомпрессионная операция, в частности стент, имела преимущества перед первичной резекцией по госпитальной - 90-дневной летальности: 6.5% против 8,1% (OP 0,65, P = 0,01) [62]. Одинаковые результаты общей 3-х и 5-летней выживаемости получены при сравнении стомы и стента с первичной резекцией, за исключением единственного метаанализа, где стома и стент имели преимущества. В этом же исследовании установлена более высокая 5-летняя безрецидивная выживаемость при использовании стомы и стента. По 3-летней безрецидивной выживаемости в двух метаанализах установлены преимущества первичной резекции [63; 64]. Явные преимущества имели группы стомы и стента по частоте осложнений и формированию первичного анастомоза, при некотором преимуществе первичной резекции по совокупной длительности стационарного лечения. Количество удаленных лимфоузлов было или равным [63], или имела преимущество группа стома и стент [65].
В целом, по сравнению с экстренной хирургией саморасширяющиеся металлические стенты и стома улучшают краткосрочные результаты хирургического лечения при сопоставимой общей и безрецидивной выживаемости. При этом стабильные пациенты могут получить преимущества от экстренного резекционного вмешательства, в т.ч. с первичным анастомозом, нестабильные - от декомпрессии стомой, стентом или колоректальным зондом [66]. Анализ результатов оперативного лечения ОКН, по данным проспективного национального регистра Нидерландов, показал летальность после экстренной резекции от 2,9% у пациентов < 70 лет до 32,2% у пожилых пациентов с высоким риском. Для немощных пожилых пациентов послеоперационная летальность свыше 30% требует поиска альтернативных стратегий лечения [67].
- У стабильных пациентов с ОКН без перфорации и перитонита, обусловленной опухолью ободочной кишки, при наличии квалифицированной бригады хирургов онкологов или колопроктологов, после дообследования в соответствии с клиническими рекомендациями по лечению рака ободочной кишки и ректосигмоидного отдела возможно выполнение операции по удалению опухоли ободочной кишки [63; 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 1)
Комментарий: учитывая имеющиеся на сегодняшний день данные, к резекционным вмешательствам следует прибегать лишь в тех случаях, когда они выполняются квалифицированной бригадой хирургов, онкологов или колопроктологов, имеются условия для проведения качественного морфологического исследования удаленной опухоли, а также, когда другие варианты лечения не могут быть применены. Обеспечение квалифицированной врачебной бригадой имеет особое значение в случае резекционных вмешательств, которые требуют соблюдения онкологических принципов хирургии. Объем операции при экстренной резекции в условиях отсутствия перфорации и перитонита не должен отличаться от планового вмешательства, за исключением вопроса формирования межкишечного анастомоза. При невозможности операции по установленным принципам лечения рака ободочной кишки у пациентов без перфорации резекционные вмешательства выполняться не должны. Объем операции необходимо ограничить декомпрессионной стомой.
- При обнаружении перфорации, перитонита, абсцедирования, диастатических разрывов и ишемических изменений ободочной кишки рекомендовано выполнение резекции толстой кишки без формирования анастомоза [12; 27].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: существует два основных механизма, приводящих к перфорации кишки и перитониту на фоне ОКН опухолевой этиологии. Во-первых, это образование дефекта стенки кишки на уровне опухоли за счет некроза и распада опухолевой ткани; во-вторых, диастатический разрыв стенки растянутой кишки, расположенной проксимальнее места обструкции. Второй вариант зачастую является более тяжелым и ассоциирован с высокой летальностью за счет диффузной контаминации брюшной полости и быстрого развития тяжелого септического шока [68]. В целом, в этой ситуации необходимо приложить все усилия для резекции пораженного участка кишки вместе с опухолью, однако тактика лечения должна быть сбалансирована и учитывать тяжесть состояния пациента - нестабильные больные могут подвергаться только тем процедурам, которые они могут переносить, и обычно это соответствует технически простым и быстро выполняемым вмешательствам, таким как операция по типу Гартмана или правосторонняя гемиколэктомия без анастомоза, с формированием одноствольной илеостомы, при диастатической перфорации правых отделов ободочной кишки у больных раком левой половины ободочной кишки выполняется субтотальная резекция ободочной кишки без анастомоза [12; 27].
- Операции по удалению злокачественной опухоли толстой кишки с формированием межкишечного анастомоза при ОКН рекомендовано выполнять только после разрешения симптомов ОКН у стабильных пациентов без выраженных сопутствующих заболеваний, при наличии квалифицированной бригады хирургов врачей-онкологов или врачей-колопроктологов, в соответствии с клиническими рекомендациями по лечению больных раком ободочной и прямой кишки [7; 89; 90].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: при ОКН выше риск развития потенциально фатального осложнения несостоятельности межкишечного анастомоза. Частота несостоятельности анастомоза при ОКН составляет 11,2% - 14,3%, летальность при этом достигает 17,1% [69; 70]. Наиболее часто несостоятельность анастомоза возникает после субтотальной колэктомии - 14%, левосторонней гемиколэктомии - 13%, резекции поперечной ободочной кишки - 10,3% [12]. К факторам риска неблагоприятного прогноза при операции с формированием анастомоза относят возраст больного старше 70 лет, высокий анестезиологический риск (ASA > 3), анемию (Hb < 75 г/л), хроническую болезнь почек (скорость клубочковой фильтрации (СКФ) < 45 мл/мин/1.73 м2), хроническую сердечную недостаточность, дыхательную недостаточность, неврологический дефицит. При наличии любого из перечисленных факторов риска от формирования анастомоза следует отказаться в пользу резекционного вмешательства без наложения межкишечного соустья [12; 71]. Осложненное течение послеоперационного периода может быть причиной позднего начала химиотерапии, или вовсе отказа от ее проведения.
3.4 Паллиативное лечение больных с острой обтурационной кишечной непроходимостью
Основной целью лечения больных с раком толстой кишки IV стадии и острой кишечной непроходимостью является увеличение продолжительности жизни пациента и улучшение ее качества. Доступные варианты лечения включают использование кортикостероидов системного действия и стимуляторов моторики желудочно-кишечного тракта, симптоматическое лечение - назогастральную интубацию и парентеральное питание, стентирование кишки и хирургические вмешательства - формирование проксимальной стомы и резекция кишки. Вместе с тем, общая выживаемость низкая, независимо от типа лечения. Повсеместно плохие исходы предполагают, что острую кишечную непроходимость на фоне инкурабельного рака толстой кишки следует рассматривать как предтерминальное событие [72]. В таких ситуациях предпочтителен индивидуализированный мультидисциплинарный подход с расширением участия пациента в выборе объема лечения [73]. При выявлении признаков перфорации, странгуляции и перитонита у больных с IV стадией рака толстой кишки необходимо экстренное оперативное лечение. Следует стремиться к осуществлению минимально возможного объема вмешательства, отдавая предпочтение формированию проксимальной стомы. При выявлении перфорации кишки, ишемии и абсцедирования - выполнять ее резекцию.
У пациентов с диссеминированной формой рака толстой кишки, осложненного компенсированной кишечной непроходимостью возможно выполнение оперативного вмешательства в объеме паллиативной резекции толстой кишки. Основанием для выполнения такой операции служит решение мультидисциплинарного онкологического консилиума. В настоящий момент нет убедительных данных о пользе или недостатке выполнения паллиативной резекции кишки у больных с диссеминированной формой рака. Результаты существующих исследований противоречат друг другу, большинство работ имеют ретроспективный характер, из-за чего многие значимые переменные, такие как число метастазов, их размеры, характеристика органов-мишеней могут быть не учтены, что не позволяет применять точные методы статистической обработки информации [74]. Обоснованиями выполнения паллиативной резекции служат ожидаемое улучшение качества жизни больного и обеспечение оптимальных условий для проведения химиотерапии.
Вопросы контроля болевого синдрома и поддержки нутритивного статуса у паллиативных больных в данных рекомендациях не рассматриваются.
- При опухолевой обтурационной кишечной непроходимости у больных раком толстой кишки IV стадии, короткой ожидаемой продолжительностью жизни рекомендовано применение метода стентирования кишки [75].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарий: стентирование кишки в рамках паллиативного лечения больных с обтурационной ОКН может избавить от необходимости формирования кишечной стомы, что, потенциально, позволяет обеспечить приемлемое качество жизни пациентам [53]. Однако, несмотря на высокую частоту технически успешного стентирования (при наличии только одного опухолевого препятствия) - от 90 до 100% случаев, более короткую продолжительность госпитализации по сравнению с формированием стомы [76], при стентировании чаще наблюдаются ранние послеоперационные осложнения [44]. Частота повторного возникновения острой кишечной непроходимости выше в группе пациентов, подвергшихся стентированию - 20,7% против 9% в группе хирургического лечения [75].
- У пациентов с IV стадией рака при невозможности стентирования кишки, наличии нескольких участков обструкции кишки, а также, в случае, если проводится лекарственное противоопухолевое лечение рекомендовано хирургическое вмешательство в объеме формирования проксимальной колостомы/илеостомы [77].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: основой лечения больных с диссеминированной формой рака толстой кишки является химиотерапия. В связи с тем, что наличие стента в опухолевом канале у больных, длительно получающих бевацизумаб** связано с высоким риском перфорации опухоли, следует использовать другие методы декомпрессии толстой кишки [46]. Формирование стомы является относительно простой и доступной процедурой, позволяющей обеспечить быструю и надежную декомпрессию толстой кишки [77].
4. Медицинская реабилитация и санаторно-курортное лечение,
медицинские показания и противопоказания к применению
методов реабилитации, в том числе основанных
на использовании природных лечебных факторов
- У больных с лапаротомным доступом с целью контроля болевого синдрома рекомендовано использовать эпидуральную анестезию на основе местных анестетиков и опиоидов [78].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: оптимальный режим анальгезии после обширных операций должен обеспечивать достаточный уровень обезболивания, способствовать ранней мобилизации, более активному восстановлению функции кишечника и питания, а также не вызывать осложнений [78]. Предпочтительным является использование мультимодальной анальгезии, сочетающей в себе регионарные методы анестезии, а также, по возможности, отказ от опиоидов во избежание развития побочных эффектов. Применение опиоидных анальгетиков сопровождается сонливостью и адинамичностью больных, парезом кишечника, эпизодами тошноты и рвоты.
При открытой срединной лапаротомии эпидуральная анальгезия является оптимальным методом обезболивания в первые 72 ч после операции, способствуя более раннему восстановлению функции кишечника и уменьшению числа осложнений [79; 80]. Использование 0,2% раствора ропивакаина** в сочетании с фентанилом** обеспечивает оптимальное обезболивание и минимизацию риска моторного блока и гипотонии из-за симпатической блокады [78; 81]. Для устранения гипотензии, вызванной симпатической блокадой, следует назначать вазопрессин и его аналоги при отсутствии гиповолемии. Предпочтительно эпидуральный катетер удалять через 48 - 72 ч после операции.
- После операции и выхода из постнаркозной депрессии рекомендуется назначать нутритивную поддержку в виде перорального, в том числе зондового дополнительного питания, при восстановлении нормальной кишечной перистальтики может быть возобновлен обычный прием пищи [82; 83].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2)
Комментарий: применение энтеральных инфузий солевых, мономерно-солевых и питательных смесей, адсорбирующих кишечных препаратов в послеоперационном периоде способствует более быстрому восстановлению функции ЖКТ [84]. Дополнительное пероральное питание (для удобства используются специальные смеси, в том числе методом сипинга) может увеличить общее потребление пищи, что позволяет достичь целевых алиментарных показателей [85; 86].
- Удаление уретрального катетера рекомендовано после активизации больного, предпочтительно на 2-е сутки после операции [87].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 2)
Комментарий: катетеризация мочевого пузыря используется для точного контроля диуреза, при задержке мочи и неспособности пациента контролировать тазовые функции. Длительное нахождение мочевого катетера увеличивает риск развития мочевой инфекции, препятствует ранней мобилизации. Если пациент способен контролировать тазовые функции, то удаление мочевого катетера возможно уже в 1 - 2-е сутки после операции [87]. Более длительное нахождение мочевого катетера может потребоваться больным с эпидуральной анальгезией.
- Пациентам, оперированным по поводу ОКН рекомендована ранняя мобилизация в послеоперационном периоде [81, 88].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
Комментарий: Длительное нахождение в постели увеличивает частоту тромбоэмболических осложнений, дыхательных расстройств, снижает мышечную силу и увеличивает риск гемодинамических нарушений. Активность пациента определяется как объективными, так и субъективными факторами. Важным является адекватное обезболивание, своевременное удаление дренажей и катетеров. Кроме того, пациенту необходимо объяснить безопасность двигательной активности после операции, успокоить его относительно риска "расхождения швов" в раннем послеоперационном периоде. Подъем пациента с кровати, начиная с 1-х суток после операции и регулярная активность сопровождаются уменьшением частоты послеоперационных осложнений и длительности пребывания в стационаре [88].
5. Профилактика и диспансерное наблюдение, медицинские
показания и противопоказания к применению
методов профилактики
5.1 Профилактика
Профилактика острой обтурационной опухолевой кишечной непроходимости заключена в ранней диагностике рака толстой кишки и должна производиться в соответствии с рекомендациями по лечению рака прямой и ободочной кишки [89; 90].
5.2 Диспансерное ведение
- Все пациенты, перенесшие оперативные вмешательства по поводу острой опухолевой обтурационной кишечной непроходимости подлежат диспансерному наблюдению у врача-онколога или врача-колопроктолога [91 - 93].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: после радикально выполненной резекции кишки по поводу колоректального рака и проведения адъювантной химиотерапии (по показаниям), осуществляется диспансерное наблюдение пациентов, целью которого является выявление возможных осложнений, диагностика рецидива онкологического заболевания, обнаружение синхронных или метахронных новообразований. Анализ данных 18 крупных рандомизированных исследований, в которые суммарно были включены 20898 больных, показал, в первые 3 года после резекции развивается до 80% всех случаев рецидива рака толстой кишки [91], а в течение 5 лет после операции - до 95% всех рецидивов [92].
Для пациентов II - III стадии, перенесших успешное удаление злокачественной опухоли толстой кишки (при отсутствии "резидуальной" опухоли), может быть рекомендовано обследование каждые 3 - 6 месяцев после операции в течение 2 лет, далее - каждые 6 месяцев - до 5 лет. Колоноскопию следует назначать через 1 год после операции (или через 1 - 3 месяца в случае, если на предоперационном этапе обследования не была выполнена тотальная колоноскопия). Эндоскопическое исследование толстой кишки необходимо повторять ежегодно до 3-х лет, а далее - каждые 5 лет [93]. Однако, при выявлении аденоматозного/ворсинчатого полипа или тяжелой дисплазии эпителия колоноскопию следует повторять ежегодно. Более частое эндоскопическое исследование может быть рекомендовано молодым пациентам (до 50 лет). Осуществление колоноскопии в рамках диспансерного наблюдения необходимо прежде всего для диагностики метахронных полипов и их последующего удаления, так как у больных, имевших в анамнезе рак толстой кишки, существует риск развития второго рака, особенно в первые 2 года после операции [94].
Компьютерная томография рекомендована для выявления потенциально резектабельных метастазов, преимущественно в легких и в печени. Из этого следует, что КТ-сканирование может не использоваться рутинно у пациентов с бессимптомно протекающей генерализованной формой онкологического заболевания, которые не являются кандидатами для потенциально-радикального оперативного лечения. Компьютерная томография органов грудной клетки, брюшной полости и малого таза должна выполняться каждые 6 - 12 месяцев вплоть до 5 лет при III стадии, и у больных со II стадией, имеющих высокий риск развития рецидива заболевания [95].
6. Организация оказания медицинской помощи
6.1 Показания для госпитализации в медицинскую организацию
Всех больных с подозрением на кишечную непроходимость необходимо срочно госпитализировать в хирургический стационар. При острой кишечной непроходимости, обусловленной опухолью толстой кишки, помощь носит неотложный характер. Сроки поступления таких пациентов могут определять исход заболевания. Отсрочка начала лечения или нарушение сроков осуществления этапов лечения приводит к снижению показателей общей и безрецидивной выживаемости у этих пациентов и утяжеляет прогноз у конкретного больного.
Проведение диагностических мероприятий на этапе постановки диагноза должно осуществляться в условиях хирургического стационара. Плановое оперативное лечение, лекарственное противоопухолевое лечение, проведение лучевой терапии рабочая группа рекомендует проводить в условиях специализированных отделений стационара (онкологических, колопроктологических).
Все пациенты, которым планируется провести хирургическую манипуляцию по поводу рака толстой кишки, должны дать информированное согласие. Оно подразумевает под собой то, что больному представлена информация о возможной пользе и гипотетических рисках лечения, а также о наличии каких-либо альтернативных методов лечения. По возможности информированное согласие должно быть получено непосредственно оперирующим врачом-хирургом. В соответствии с Законом Российской Федерации от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", получение добровольного информированного согласия - обязательная и необходимая процедура, которая отражает соблюдение юридических и этических прав человека принимать самостоятельное решение, касающееся его здоровья. Условиями возможности получения информированного согласия являются способность больного принимать обдуманные решения относительно лечебных мероприятий, доступное предоставление всей необходимой для принятия решения информации. Основные вопросы: польза и риск предлагаемого лечения, планируемый объем лечебных мероприятий, последствия отказа от лечения.
- Вмешательства по удалению опухоли ободочной кишки при ОКН рекомендовано выполнять на базе хирургического, колопроктологического или онкологического отделения, специалистом, имеющим опыт проведения онкологических операций на толстой кишке [69].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Комментарий: отсутствие специализации врача в области колоректальной хирургии является фактором неблагоприятного прогноза [69]. Было показано, что общая частота послеоперационных осложнений и послеоперационной летальности выше в случае, если операция выполнялась врачом-хирургом, не имеющим специальной подготовки. Несостоятельность межкишечного соустья в стационарах общего хирургического профиля в два раза выше, чем в специализированных медицинских учреждениях (21,3% против 10,3%) [96]. У больных, оперированных в общих хирургических отделениях количество исследованных лимфатических узлов в препарате в 98,3% случаев не соответствует требуемому - 12 и более [96]. Общая и безрецидивная выживаемость статистически значимо ниже в группе больных, оперированных в неспециализированных стационарах. У больных III стадией, оперированных после разрешения ОКН в онкологических отделениях 5-летняя общая выживаемость составляет 50%, в то время как среди оперированных на фоне ОКН в неспециализированных стационарах - 28% (p 0.02) [97].
6.2 Показания к выписке пациента из медицинской организации
При госпитализации по поводу острой кишечной непроходимости сроки выписки пациента из медицинской организации зависят от объема оказанной медицинской помощи, характера оперативного вмешательства, течения послеоперационного периода. Выписка при неосложненном течении послеоперационного периода производится при улучшении состояния больного, восстановлении функции ЖКТ, купировании эндотоксикоза и нормализации показателей красной крови. Выписка из неспециализированного хирургического отделения с обязательным направлением больного в онкологический или колопроктологический стационар производится при купировании симптомов острой кишечной непроходимости посредством стентирования кишки, либо формирования проксимальной петлевой стомы.
В ситуации, когда ОКН разрешилась на фоне консервативного лечения, во избежание рецидива непроходимости, осуществляется перевод больного в специализированный стационар (отделение) онкологического или колопроктологического профиля.
7. Дополнительная информация (в том числе факторы, влияющие
на исход заболевания или состояния)
Отрицательно влияют на исход лечения:
Перфорация кишки
Нерадикальное удаление опухоли
Неполное патоморфологическое описание препарата удаленной опухоли
Отказ от проведения адъювантной химиотерапии при наличии показаний к ее проведению.
Критерии оценки качества медицинской помощи
N
Критерии оценки качества
Оценка выполнения (да/нет)
1.
Выполнено пальцевое ректальное обследование
Да/Нет
2.
Выполнена оценка эффективности проводимой консервативной терапии каждые 6 часов
Да/Нет
3.
Выполнена разметка области выведения кишечной стомы перед хирургическим вмешательством по поводу ОКН
Да/Нет
4.
Выполнена ликвидация кишечной непроходимости
Да/Нет
При выполнении резекционных вмешательств по поводу колоректального рака, осложненного ОКН, оценку качества оказанной медицинской помощи следует производить в соответствии с клиническими рекомендациями по лечению рака ободочной и прямой кишки. [89; 90]
Список литературы
1. Каприн А.Д., Старинский В.В., Шахзадова О.А. Состояние онкологической помощи населению России в 2020 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ "НМИРЦ" Минздрава России; 2021. doi: 10.1017/СВ09781107415324.004
2. Marley AR, Nan H. Epidemiology of colorectal cancer. Int J Mol Epidemiol Genet. 2016; 7(3): 105 - 114. doi: 10.3109/9781420016307-2
3. Ревишвили А.Ш., Оловянный В.Е., Сажин В.П. и соавт. Хирургическая помощь в Российской Федерации. ФГБУ "НМИЦ хирургии им. А.В. Вишневского" Минздрава России; 2021. https://главный-хирург.рф/publication.html
4. Ачкасов Е.Е. Алекперов С.Ф., Шкода А.С., Беляев Л.Б., Волков В.С., Крутилина О.В., Калачев О.А. Классификация обтурационной толстокишечной непроходимости опухолевого генеза. Колопроктология. 2009; 3: 17 - 23.
5. Ohki T, Yoshida S, Yamamoto M, et al. Determining the difference in the efficacy and safety of self-expandable metallic stents as a bridge to surgery for obstructive colon cancer among patients in the CROSS 0 group and those in the CROSS 1 or 2 group: a pooled analysis of data from two Japanese prospective multicenter trials. Surg Today. 2020; 50(9): 984 - 994. doi: 10.1007/S00595-020-01970-3/TABLES/7
6. Azuhata T, Kinoshita K, Kawano D, et al. Time from admission to initiation of surgery for source control is a critical determinant of survival in patients with gastrointestinal perforation with associated septic shock. Crit Care. 2014; 18(3). doi: 10.1186/ccl3854
7. Pisano M, Zorcolo L, Merli C, et al. 2017 WSES guidelines on colon and rectal cancer emergencies: Obstruction and perforation. World J Emerg Surg. 2018; 13(1). doi: 10.1186/s13017-018-0192-3
8. Pedersen T, Watt SK, Tolstrup MB,  I. 30-Day, 90-day and 1-year mortality after emergency colonic surgery. Eur J Trauma Emerg Surg. 2017; 43(3): 299 - 305. doi: 10.1007/S00068-016-0742-X
I. 30-Day, 90-day and 1-year mortality after emergency colonic surgery. Eur J Trauma Emerg Surg. 2017; 43(3): 299 - 305. doi: 10.1007/S00068-016-0742-X
9. Yang XF, Pan K. Diagnosis and management of acute complications in patients with colon cancer: Bleeding, obstruction, and perforation. Chinese J Cancer Res. 2014; 26(3): 331 - 340. doi: 10.3978/j.issn. 1000-9604.2014.06.11
10. Horton KM, Abrams RA, Fishman EK. Spiral CT of colon cancer: Imaging features and role in management. Radiographics. 2000; 20(2): 419 - 430. doi: 10.1148/radiographics.20.2.g00mcl4419
11. Ramanathan S, Ojili V, Vassa R, Nagar A. Large Bowel Obstruction in the Emergency Department: Imaging Spectrum of Common and Uncommon Causes. J Clin Imaging Sci. 2017; 7(1). doi: 10.4103/jcis. JCIS_6_17
12. Mege D, Manceau G, Bridoux V, et al. Surgical management of obstructive left colon cancer at a national level: Results of a multicentre study of the French Surgical Association in 1500 patients. J Vise Surg. 2019; 156(3): 197 - 208. doi: 10.1016/j.jviscsurg.2018.11.008
13. Suri S, Gupta S, Sudhakar PJ, Venkataramu NK, Sood B, Wig JD. Comparative evaluation of plain films, ultrasound and CT in the diagnosis of intestinal obstruction. Acta radiol. 1999; 40(4): 422 - 428. doi: 10.3109/02841859909177758
14. Селина И.Е., Подловченко Т.Г., Скворцова А.В., Калоева О.Х. Рентгено-ультразвуковая диагностика обтурационной непроходимости ободочной кишки. Колопроктология. 2014; S1(47): 69 - 74. Accessed August 29, 2022. https://www.elibrary.ru/item.asp?id=21240547
15. Catena F, De Simone B, Coccolini F, Di Saverio S, Sartelli M, Ansaloni L. Bowel obstruction: A narrative review for all physicians. World J Emerg Surg. 2019; 14(1). doi: 10.1186/s13017-019-0240-7
16. Jacob SE, Lee SH, Hill J. The demise of the instant/unprepared contrast enema in large bowel obstruction. Colorectal Dis. 2008; 10(7): 729 - 731. doi: 10.1111/J.1463-1318.2007.01415.X
17. Chapman AFI, McNamara M, Porter G. The acute contrast enema in suspected large bowel obstruction: Value and technique. Clin Radiol. 1992; 46(4): 273 - 278. doi: 10.1016/S0009-9260(05)80170-9
18. Lopez-Kostner F, Hool GR, Lavery IC. Management and causes of acute large bowel obstruction. Surg Clin North Am. 1997; 77(6): 1265 - 1290. doi: 10.1016/S0039-6109(05)70617-4
19. Harrison ME, Anderson MA, Appalaneni V, et al. The role of endoscopy in the management of patients with known and suspected colonic obstruction and pseudo-obstruction. Gastrointest Endosc. 2010; 71(4): 669 - 679. doi: 10.1016/J.GIE.2009.11.027
20. Costa G, Ruscelli P, Balducci G, et al. Clinical strategies for the management of intestinal obstruction and pseudo-obstruction. Ann Ital Chir. 2016; 87(2): 105 - 117. Accessed September 5, 2022. https://www.researchgate.net/publication/309119357_Clinical_strategies_for_the_management_of _intestinal_obstruction_and_pseudo-obstruction
21. Sajid MS, Caswell J, Bhatti MI, Sains P, Baig MK, Miles WFA. Carbon dioxide insufflation vs conventional air insufflation for colonoscopy: A systematic review and meta-analysis of published randomized controlled trials. Color Dis. 2015; 17(2): 111 - 123. doi: 10.1111/codi. 12837
22. Semler MW, Self WH, Wanderer JP, et al. Balanced Crystalloids versus Saline in Critically ill Adults. N Engl J Med. 2018; 378(9): 829 - 839. doi: 10.1056/NEJMOA1711584
23. Sawai R. Management of colonic obstruction: a review. Clin Colon Rectal Surg. 2012; 25(4): 200 - 203. doi: 10.1055/S-0032-1329533
24. Drinka PJ, Hanlon J. "Aspiration of gastric contents." J Am Med Dir Assoc. 2007; 8(6): 345 - 346. doi: 10.1016/J.JAMDA.2007.02.010
25. Тягунов А.Е., Тягунов А.А., Нечай Т.В., Виноградов В.Н., Курашинова Л.С., Сажин А.В. Факторы риска летального исхода при острой спаечной тонкокишечной непроходимости. Результаты многоцентрового исследования. Хирургия. Журнал им. Н.И. Пирогова. 2021; 3: 26 - 35. Accessed September 6, 2022. https://www.elibrary.ru/item.asp?id=44820324
26. Klek S, Forbes A, Gabe S, et al. Management of acute intestinal failure: A position paper from the European Society for Clinical Nutrition and Metabolism (ESPEN) Special Interest Group. Clin Nutr. 2016; 35(6): 1209 - 1218. doi: 10.1016/J.CLNU.2016.04.009
27. Weber DG, Bendinelli C, Balogh ZJ. Damage control surgery for abdominal emergencies. Br J Surg. 2014; 101(1). doi: 10.1002/bjs.9360
28. Becher RD, Peitzman AB, Sperry JL, et al. Damage control operations in non-trauma patients: Defining criteria for the staged rapid source control laparotomy in emergency general surgery. World J Emerg Surg. 2016; 11(1). doi: 10.1186/s13017-016-0067-4
29. Park SK, Shin SR, Hur M, Kim WH, Oh EA, Lee SH. The effect of early goal-directed therapy for treatment of severe sepsis or septic shock: A systemic review and meta-analysis. J Crit Care. 2017; 38: 115 - 122. doi: 10.1016/j.jcrc.2016.10.019
30. Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345(19): 1368 - 1377. doi: 10.1056/NEJMoa010307
31. Solomkin JS, Mazuski JE, Bradley JS, et al. Diagnosis and management of complicated intra-abdominal infection in adults and children: guidelines by the Surgical Infection Society and the Infectious Diseases Society of America. Clin Infect Dis. 2010; 50(2): 133 - 164. doi: 10.1086/649554
32. Mikamo H, Yuasa A, Wada K, Crawford B, Sugimoto N. Optimal Treatment for Complicated Intra-abdominal Infections in the Era of Antibiotic Resistance: A Systematic Review and Meta-Analysis of the Efficacy and Safety of Combined Therapy With Metronidazole. Open Forum Infect Dis. 2016; 3(3). doi: 10.1093/OFID/OFW143
33. Mikamo H, Matsumizu M, Nakazuru Y, Nagashima M. Efficacy and safety of metronidazole injection for the treatment of infectious peritonitis, abdominal abscess and pelvic inflammatory diseases in Japan. J Infect Chemother. 2015; 21(2): 96 - 104. doi: 10.1016/J.JIAC.2014.10.005
34.  P, Rasmussen MS, Andersen BR, Borly L. Heparins and mechanical methods for thromboprophylaxis in colorectal surgery. Cochrane Database Syst Rev. 2004; (4). doi: 10.1002/14651858.cd001217
P, Rasmussen MS, Andersen BR, Borly L. Heparins and mechanical methods for thromboprophylaxis in colorectal surgery. Cochrane Database Syst Rev. 2004; (4). doi: 10.1002/14651858.cd001217
35. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015; 4(2): 1 - 52. Accessed September 6, 2022. https://elibrary.ru/item.asp?id=27718431
36.  Martin AJ, Gallardo
Martin AJ, Gallardo ![]() E,
E, ![]() Escobar I, et al. SEOM clinical guideline of venous thromboembolism (VTE) and cancer (2019). Clin Transl Oncol. 2020; 22(2): 171 - 186. doi: 10.1007/s12094-019-02263-z
Escobar I, et al. SEOM clinical guideline of venous thromboembolism (VTE) and cancer (2019). Clin Transl Oncol. 2020; 22(2): 171 - 186. doi: 10.1007/s12094-019-02263-z
37. Шабунин А.В., Багателия З.А., Гугнин А.В. Результаты внедрения этапного лечения колоректального рака, осложненного обтурационной кишечной непроходимостью, в стандарты хирургической помощи онкологическим больным г. Москвы. Колопроктология. 2018; 4(66): 7 - 15. Accessed August 8, 2020. https://www.elibrary.ru/item.asp?id=36510275
38. Amelung FJ, Burghgraef TA, Tanis PJ, et al. Critical appraisal of oncological safety of stent as bridge to surgery in left-sided obstructing colon cancer; a systematic review and meta-analysis. Crit Rev Oncol Hematol. 2018; 131: 66 - 75. doi: 10.1016/j.critrevonc.2018.08.003
39. Han SH, Lee JH. Colonic Stent-Related Complications and Their Management. Clin Endosc. 2014; 47(5): 415 - 419. doi: 10.5946/ce.2014.47.5.415
40. Sloothaak DAM, Van Den Berg MW, Dijkgraaf MGW, et al. Oncological outcome of malignant colonic obstruction in the Dutch Stent-In 2 trial. Br J Surg. 2014; 101(13): 1751 - 1757. doi: 10.1002/bjs.9645
41. Sabbagh C, Chatelain D, Troulllet N, et al. Does use of a metallic colon stent as a bridge to surgery modify the pathology data in patients with colonic obstruction? A case-matched study. Surg Endosc. 2013; 27(10): 3622 - 3631. doi: 10.1007/s00464-013-2934-3
42. Jain SR, Yaow CYL, Ng CH, et al. Comparison of colonic stents, stomas and resection for obstructive left colon cancer: a meta-analysis. Tech Coloproctol. 2020; 24(11): 1121 - 1136. doi: 10.1007/s10151-020-02296-5
43. Shimura T, Joh T. Evidence-based clinical management of acute malignant colorectal obstruction. J Clin Gastroenterol. 2016; 50(4): 273 - 285. doi: 10.1097/MCG.0000000000000475
44. Van Hoofit JE, Van Halsema EE, Vanbiervliet G, et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2014; 46(11): 990 - 1002. doi: 10.1055/s-0034-1390700
45. Veld JV, Kumcu A, Amelung FJ, et al. Time interval between self-expandable metal stent placement or creation of a decompressing stoma and elective resection of left-sided obstructive colon cancer. Endoscopy. 2021; 53(9): 905 - 913. doi: 10.1055/A-1308-1487
46. Van Halsema EE, Van Hooft JE, Small AJ, et al. Perforation in colorectal stenting: A meta-analysis and a search for risk factors. Gastrointest Endosc. 2014; 79(6). doi: 10.1016/j.gie.2013.11.038
47. Song HY, Kim JFI, Kim KR, et al. Malignant rectal obstruction within 5 cm of the anal verge: is there a role for expandable metallic stent placement? Gastrointest Endosc. 2008; 68(4): 713 - 720. doi: 10.1016/j .gie.2007.12.051
48. Yamada T, Shimura T, Sakamoto E, et al. Preoperative drainage using a transanal tube enables elective laparoscopic colectomy for obstructive distal colorectal cancer. Endoscopy. 2013; 45(4): 265 - 271. doi: 10.1055/s-0032-1326030
49. Сизоненко Н.А., Суров Д.А., Соловьев И.А. Применение концепции fast track в хир. леч. больных колоректальным раком, осложненным острой обтурационной непроходимостью. Вестник Нац. медико-хирург. Центра им. Н.И. Пирогова. 2018; 2(13): 62 - 67. Accessed September 6, 2022. https://www.gastroscan.ru/literature/authors/11034
50. Клинические рекомендации "Кишечная стома у взрослых." Published 2016. Accessed August 17, 2020. https://legalacts.ru/doc/klinicheskie-rekomendatsii-kishechnaja-stoma-u-vzroslykh-utv-minzdravom-rossii/
51. Nelson RL, Glenny AM, Song F. Antimicrobial prophylaxis for colorectal surgery. Cochrane Database Syst Rev. 2009; (1). doi: 10.1002/14651858.CD001181.pub3
52. Kam MH, Tang CL, Chan E, Lim JF, Eu KW. Systematic review of intraoperative colonic irrigation vs. manual decompression in obstructed left-sided colorectal emergencies. Int J Colorectal Dis. 2009; 24(9): 1031 - 1037. doi: 10.1007/s00384-009-0723-1
53. Dong XW, Huang SL, Jiang ZH, Song YF, Zhang XS. Nasointestinal tubes versus nasogastric tubes in the management of small-bowel obstruction: A meta-analysis. Med (United Statesj. 2018; 97(36). doi: 10.1097/MD.0000000000012175
54. Amelung FJ, Mulder CLJ, Verheijen PM, Draaisma WA, Siersema PD, Consten ECJ. Acute resection versus bridge to surgery with perting colostomy for patients with acute malignant left sided colonic obstruction: Systematic review and meta-analysis. Surg Oncol. 2015; 24(4): 313 - 321. doi: 10.1016/j.suronc.2015.10.003
55. Lee BC, Yu CS, Kim J, et al. Clinicopathological features and surgical options for synchronous colorectal cancer. Med (United States). 2017; 96(9). doi: 10.1097/MD.0000000000006224
56. Chudner A, Gachabayov M, Dyatlov A, Lee H, Essani R, Bergamaschi R. The influence of perting loop ileostomy vs. colostomy on postoperative morbidity in restorative anterior resection for rectal cancer: a systematic review and meta-analysis. Langenbeck's Arch Surg. 2019; 404(2): 129 - 139. doi: 10.1007/s00423-019-01758-1
57. Veld J V., Amelung FJ, Borstlap WAA, et al. Comparison of Decompressing Stoma vs Stent as a Bridge to Surgery for Left-Sided Obstructive Colon Cancer. JAMA Surg. 2020; 155(3): 206 - 215. doi: 10.1001/jamasurg.2019.5466
58. Kapiteijn E, Marijnen CAM, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001; 345(9): 638 - 646. doi: 10.1056/NEJMoa010580
59. Uehara K, Nagino M. Neoadjuvant treatment for locally advanced rectal cancer: a systematic review. Surg Today. 2016; 46(2): 161 - 168. doi: 10.1007/s00595-015-1218-z
60. Tewari SO, Getrajdman GI, Petre EN, et al. Safety and efficacy of percutaneous cecostomy/colostomy for treatment of large bowel obstruction in adults with cancer. J Vasc Interv Radiol. 2015; 26(2): 182 - 188. doi: 10.1016/j.jvir.2014.09.022
61.  E, Hjeurn F, Blomqvist L,
E, Hjeurn F, Blomqvist L, ![]() Y, Pekkari K, Abraham-Nordling M. Emergency management with resection versus proximal stoma or stent treatment and planned resection in malignant left-sided colon obstruction. World J Surg Oncol. 2016; 14(1). doi: 10.1186/sl2957-016-0994-2
Y, Pekkari K, Abraham-Nordling M. Emergency management with resection versus proximal stoma or stent treatment and planned resection in malignant left-sided colon obstruction. World J Surg Oncol. 2016; 14(1). doi: 10.1186/sl2957-016-0994-2
62. Spannenburg L, Sanchez Gonzalez M, Brooks A, et al. Surgical outcomes of colonic stents as a bridge to surgery versus emergency surgery for malignant colorectal obstruction: A systematic review and meta-analysis of high quality prospective and randomised controlled trials. Eur J Surg Oncol. 2020; 46(8): 1404 - 1414. doi: 10.1016/J.EJS0.2020.04.052
63. Gavriilidis P, de'Angelis N, Wheeler J, Askari A, Di Saverio S, Davies JR. Diversion, resection, or stenting as a bridge to surgery for acute neoplastic left-sided colonic obstruction: a systematic review and network meta-analysis of studies with curative intent. Ann R Coll Surg Engl. 2021; 103(4): 235 - 244. doi: 10.1308/RCSANN.2020.7137
64. Foo CC, Poon SHT, Chiu RHY, Lam WY, Cheung LC, Law WL. Is bridge to surgery stenting a safe alternative to emergency surgery in malignant colonic obstruction: a meta-analysis of randomized control trials. Surg Endosc. 2019; 33(1): 293 - 302. doi: 10.1007/S00464-018-6487-3
65. Jain SR, Yaow CYL, Ng CH, et al. Comparison of colonic stents, stomas and resection for obstructive left colon cancer: a meta-analysis. Tech Coloproctol. 2020; 24(11): 1121 - 1136. doi: 10.1007/S10151-020-02296-5
66. Bergamini C, Giordano A, Maltinti G, et al. Obstructive left side colon cancer: time for a tailored operative approach? Minerva Chir. 2020; 75(4): 244 - 254. doi: 10.23736/S0026-4733.20.08299-1
67. Tanis PJ, Paulino Pereira NR, Van Plooft JE, Consten ECJ, Bemelman WA. Resection of Obstructive Left-Sided Colon Cancer at a National Level: A Prospective Analysis of Short-Term Outcomes in 1,816 Patients. Dig Surg. 2015; 32(5): 317 - 324. doi: 10.1159/000433561
68. Hsu CW, Wang JH, Kung YH, Chang MC. What is the predictor of surgical mortality in adult colorectal perforation? The clinical characteristics and results of a multivariate logistic regression analysis. Surg Today. 2017; 47(6): 683 - 689. doi: 10.1007/s00595-016-1415-4
69. Bakker IS, Snijders HS, Grossmann I, Karsten TM, Plavenga K, Wiggers T. High mortality rates after nonelective colon cancer resection: results of a national audit. Color Dis. 2016; 18(6): 612 - 621. doi: 10.1111/codi.13262
70. Battersby N, Bhangu A, Chaudhri S, et al. Relationship between method of anastomosis and anastomotic failure after right hemicolectomy and ileo-caecal resection: an international snapshot audit. Color Dis. 2017; 19(8): e296 - e311. doi: 10.1111/codi.13646
71. van Ommeren-Olijve SJ, Burbach JPM, ![]() EJB, et al. Risk factors for non-closure of an intended temporary defunctioning stoma after emergency resection of left-sided obstructive colon cancer. Int J Colorectal Dis. Published online 2020. doi: 10.1007/s00384-020-03559-l
EJB, et al. Risk factors for non-closure of an intended temporary defunctioning stoma after emergency resection of left-sided obstructive colon cancer. Int J Colorectal Dis. Published online 2020. doi: 10.1007/s00384-020-03559-l
72. Winner M, Mooney SJ, Hershman DL, et al. Management and outcomes of bowel obstruction in patients with stage IV colon cancer: A population-based cohort study. Dis Colon Rectum. 2013; 56(7): 834 - 843. doi: 10.1097/DCR.0b013e318294ed6b
73. Cousins SE, Tempest E, Feuer DJ. Surgery for the resolution of symptoms in malignant bowel obstruction in advanced gynaecological and gastrointestinal cancer. Cochrane Database Syst Rev. 2016; 2016(3). doi: 10.1002/14651858.CD002764.pub2
74. Harji DP, Vallance A, Selgimann J, et al. A systematic analysis highlighting deficiencies in reported outcomes for patients with stage IV colorectal cancer undergoing palliative resection of the primary tumour. Eur J Surg Oncol. 2018; 44(10): 1469 - 1478. doi: 10.1016/j.ejso.2018.06.012
75. Fiori E, Lamazza A, Schillaci A, et al. Palliative management for patients with subacute obstruction and stage IV unresectable rectosigmoid cancer: colostomy versus endoscopic stenting: final results of a prospective randomized trial. Am J Surg. 2012; 204: 321 - 326. doi: 10.1016/j.amjsurg.2011.11.013
76. Ribeiro I, Bernardo W, Martins B, et al. Colonic stent versus emergency surgery as treatment of malignant colonic obstruction in the palliative setting: a systematic review and meta-analysis. Endosc Int Open. 2018; 06(05): E558 - E567. doi: 10.1055/a-0591-2883
77. Pickard C, Thomas R, Robertson I, Macdonald A. Ostomy Creation for Palliative Care of Patients With Nonresectable Colorectal Cancer and Bowel Obstruction. J wound, ostomy, Cont Nurs Off Publ Wound, Ostomy Cont Nurses Soc. 2018; 45(3): 239 - 241. doi: 10.1097/WON.0000000000000424
78. Basse L, Raskov HH, Hjort Jakobsen D, et al. Accelerated postoperative recovery programme after colonic resection improves physical performance, pulmonary function and body composition. Br J Surg. 2002; 89: 446 - 453. doi: 10.1046/j.0007-1323.2001.02044.x
79. Block BM, Liu SS, Rowlingson AJ, Cowan AR, Cowan Jr. JA, Wu CL. Efficacy of postoperative epidural analgesia: a meta-analysis. Jama. 2003; 290: 2455 - 2463. doi: 10.1001/jama.290.18.2455
80. Cook TM, Counsell D, Wildsmith JA. Major complications of central neuraxial block: report on the Third National Audit Project of the Royal College of Anaesthetists. Br J Anaesth. 2009; 102: 179 - 190. doi: 10.1093/bja/aen360
81. Uchida I, Asoh T, Shirasaka C, Tsuji H. Effect of epidural analgesia on postoperative insulin resistance as evaluated by insulin clamp technique. Br J Surg. 1988; 75: 557 - 562.
82. Moya P, Soriano-Irigaray L, Ramirez JM, et al. Perioperative Standard Oral Nutrition Supplements Versus Immunonutrition in Patients Undergoing Colorectal Resection in an Enhanced Recovery (ERAS) Protocol: A Multicenter Randomized Clinical Trial (SONVI Study). Medicine (Baltimore). 2016; 95(21). doi: 10.1097/MD.0000000000003704
83. Bozzetti F. Nutritional support in oncologic patients: where we are and where we are going. Clin Nutr. 2011; 30(6): 714 - 717. doi: 10.1016/J.CLNU.2011.06.011
84. Шавалиев Р.Ф., Миннуллин М.М., Зефиров Р.А. и соавт. Клиническая эффективность применения солевого энтерального раствора в комплексной терапии различных форм острого панкреатита. Креативная хирургия и онкология. 2020; 9(4): 254 - 260. doi: 10.24060/2076-3093-2019-9-4-254-260
85. Aro R, Ohtonen P, Rautio T, et al. Perioperative oral nutritional support for patients diagnosed with primary colon adenocarcinoma undergoing radical surgical procedures-Peri-Nutri Trial: study protocol for a randomized controlled trial. BMC Nutr. 2022; 8(1). doi: 10.1186/s40795-022-00591-y
86. Smedley F, Bowling T, James M, et al. Randomized clinical trial of the effects of preoperative and postoperative oral nutritional supplements on clinical course and cost of care. Br J Surg. 2004; 91: 983 - 990. doi: 10.1002/bjs.4578
87. Zaouter C, Kaneva P, Carli F. Less urinary tract infection by earlier removal of bladder catheter in surgical patients receiving thoracic epidural analgesia. Reg Anesth Pain Med. 2009; 34: 542 - 548.
88. Nygren J, Soop M, Thorell A, Hausel J, Ljungqvist O. An enhanced-recovery protocol improves outcome after colorectal resection already during the first year: a single-center experience in 168 consecutive patients. Dis Colon Rectum. 2009; 52: 978 - 985. doi: 10.1007/DCR.0b013e31819f1416
89. Клинические рекомендации. Злокачественные новообразования ободочной кишки и ректосигмоидного отдела. 2020. Рубрикатор клинических рекомендаций. https://cr.minzdrav.gov.ru/schema/396_3
90. Клинические рекомендации. Рак прямой кишки. 2020. Рубрикатор клинических рекомендаций, https://cr.minzdrav.gov.ru/recomend/554_3
91. Sargent D, Sobrero A, Grothey A, et al. Evidence for cure by adjuvant therapy in colon cancer: observations based on inpidual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol. 2009; 27: 872 - 877. doi: 10.1200/jco.2008.19.5362
92. Seo SI, Lim SB, Yoon YS, et al. Comparison of recurrence patterns between </= 5 years and > 5 years after curative operations in colorectal cancer patients. J Surg Oncol. 2013; 108: 9 - 13. doi: 10.1002/jso.23349
93. Rex DK, Kahi CJ, Levin B, et al. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and US Multi-Society Task Force on Colorectal Cancer. CA Cancer J Clin. 2006; 56: 160 - 166.
94. Liu L, Lemmens VE, De Hingh IH, et al. Second primary cancers in subsites of colon and rectum in patients with previous colorectal cancer. Dis Colon Rectum. 2013; 56: 158 - 168. doi: 10.1097/DCR.0b013e318279eb30
95. Desch CE, Benson 3rd AB, Somerfield MR, et al. Colorectal cancer surveillance: 2005 update of an American Society of Clinical Oncology practice guideline. J Clin Oncol. 2005; 23: 8512 - 8519. doi: 10.1200/jco.2005.04.0063
96. Biondo S, ![]() D, Frago R, et al. Large bowel obstruction: predictive factors for postoperative mortality. Dis Colon Rectum. 2004; 47(11): 1889 - 1897. Accessed May 22, 2017. http://www.ncbi.nlm.nih.gov/pubmed/15622582
D, Frago R, et al. Large bowel obstruction: predictive factors for postoperative mortality. Dis Colon Rectum. 2004; 47(11): 1889 - 1897. Accessed May 22, 2017. http://www.ncbi.nlm.nih.gov/pubmed/15622582
97. Щаева С.Н., Ачкасов С.И. Оценка радикальности экстренных оперативных вмешательств у больных с осложненным колоректальным раком. Колопроктология. 2017; 2(60): 30 - 35. Accessed June 19, 2017. https://elibrary.ru/item.asp?id=29145101
98. Group O.L.o.E.W. "The Oxford 2011 Levels of Evidence" // Oxford Centre for Evidence-Based Medicine. 2011.
99. Ерюхин И.А., Петров В.П. Ханевич М.Д., Кишечная непроходимость. Руководство для врачей. - М.: Медицина, 1999. - С. 443.
100. Савельев В.С. Руководство по неотложной хирургии. - М., 2004. - С. 640.
101. Menzies D., Ellis H. Intestinal obstruction from adhesions - how big is the problem? // Annals of the Royal College of Surgeons of England. - 1990. - Vol. 72. - N 1. - P. 60 - 63.
102. Wang Q., Hu Z.Q., Wang W.J., Zhang J., Wang Y., Ruan C.P. Laparoscopic management of recurrent adhesive small-bowel obstruction: Long-term follow-up // Surg Today. - 2009. - N 39(6). - P. 493 - 499.
103. Harrison M.E. et al. ASGE Standards of Practice Committee. The role of endoscopy in the management of patients with known and suspected colonic obstruction and pseudo-obstruction. Gastrointest Endosc. 2010 Apr; 71(4): 669 - 79. doi: 10.1016/j.gie.2009.11.027. PMID: 20363408.
104. Ступин В.А., Михайлусов С.В., Мударисов Р.Р. Ультразвуковая диагностика кишечной непроходимости // Вестник РГМУ. 2007. Vol. 5, N 58. Р. 13 - 19.
105. Jancelewicz T. et al. Predicting strangulated small bowel obstruction: an old problem revisited // J. Gastrointest. Surg. J Gastrointest Surg, 2009. Vol. 13, N 1. P. 93 - 99.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
N
Ф.И.О.
Ученая степень
Ученое звание
Профессиональная ассоциация
1.
Ачкасов Сергей Иванович
Д.м.н.
Профессор, Член-корр. РАН
Ассоциация колопроктологов России
2.
Багателия Зураб Антонович
Д.м.н.
Доцент
Российское общество хирургов
3.
Багненко Сергей Федорович
Д.м.н.
Профессор, Академик РАН
Российское общество хирургов
4.
Беляев Алексей Михайлович
Д.м.н.
Профессор, Член-корр. РАН
Ассоциация онкологов России
5.
Геворкян Юрий Артушевич
Д.м.н.
Профессор
Ассоциация онкологов России
6.
Денисенко Валерий Ларионович
Д.м.н.
-
Ассоциация колопроктологов России
7.
Затевахин Игорь Иванович
Д.м.н.
Профессор, Академик РАН
Российское общество хирургов
8.
Каприн Андрей Дмитриевич
Д.м.н.
Профессор, Академик РАН
Ассоциация онкологов России
9.
Карачун Алексей Михайлович
Д.м.н.
Профессор
Ассоциация онкологов России
10.
Кит Олег Иванович
Д.м.н.
Профессор, Академик РАН
Ассоциация онкологов России
11.
Мамедли Заман Заурович
Д.м.н.
Доцент
Ассоциация онкологов России
12.
Москалев Алексей Игоревич
К.м.н.
-
Ассоциация колопроктологов России
13.
Назаров Илья Владимирович
К.м.н.
-
Ассоциация колопроктологов России
14.
Ревишвили Амиран Шотаевич
Д.м.н.
Профессор, Академик РАН
Российское общество хирургов
15.
Сажин Александр Вячеславович
Д.м.н.
Профессор, Член-корр. РАН
Российское общество хирургов
16.
Стилиди Иван Сократович
Д.м.н.
Профессор, Академик РАН
Ассоциация онкологов России
17.
Сушков Олег Иванович
Д.м.н.
Ассоциация колопроктологов России
18.
Тимербулатов Виль Мамилович
Д.м.н.
Профессор, Член-корр. РАН,
Ассоциация колопроктологов России
19.
Тотиков Валерий Зелимханович
Д.м.н.
Профессор
Российское общество хирургов
20.
Трифонов Владимир Сергеевич
Д.м.н.
-
Ассоциация онкологов России
21.
Тягунов Александр Евгеньевич
Д.м.н.
-
Российское общество хирургов
22.
Хатьков Игорь Евгеньевич
Д.м.н.
Профессор, Академик РАН
Ассоциация онкологов России
23.
Шабунин Алексей Васильевич
Д.м.н.
Профессор, Академик РАН
Российское общество хирургов
24.
Шелыгин Юрий Анатольевич
Д.м.н.
Профессор, Академик РАН
Ассоциация колопроктологов России
25.
Ярцев Петр Андреевич
Д.м.н.
Профессор
Российское общество хирургов
Все члены рабочей группы являются членами Ассоциации колопроктологов России, Ассоциации онкологов России, Российского общества хирургов. Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
1. Врачи-колопроктологи.
2. Врачи-хирурги.
3. Врачи-онкологи.
4. Врачи-терапевты.
5. Врачи общей практики (семейные врачи).
6. Врачи-эндоскописты.
7. Средний медицинский персонал.
8. Студенты медицинских вузов, ординаторы, аспиранты.
Таблица 1. Шкала оценки УДД (уровней достоверности доказательств) для методов диагностики (диагностических вмешательств).
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки УДД для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
УДД
Расшифровка
1
Систематический обзор РКИ (рандомизированные клинические испытания) с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки УУР (уровней убедительности рекомендаций) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР (клинические рекомендации), но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
- Пунктом 3 Статьи 37 Федерального Закона Российской Федерации от 21.11.2011 N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (с изм. и доп., вступ. в силу с 11.01.2023);
- Приказом Министерства здравоохранения Российской Федерации от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи";
- Приказом Министерства здравоохранения Российской Федерации от 2 апреля 2010 г. N 206н (ред. от 21.02.2020) "Об утверждении порядка оказания медицинской помощи населению с заболеваниями толстой кишки, анального канала и промежности колопроктологического профиля";
- Приказом Министерства здравоохранения Российской Федерации от 19 февраля 2021 г. N 116н "Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях" (в ред. Приказа Минздрава Российской Федерации от 24.01.2022 N 21н);
- Приказом Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. N 922н "Об утверждении Порядка оказания медицинской помощи взрослому населению по профилю "хирургия" (с изменениями на 21 февраля 2020 года)
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
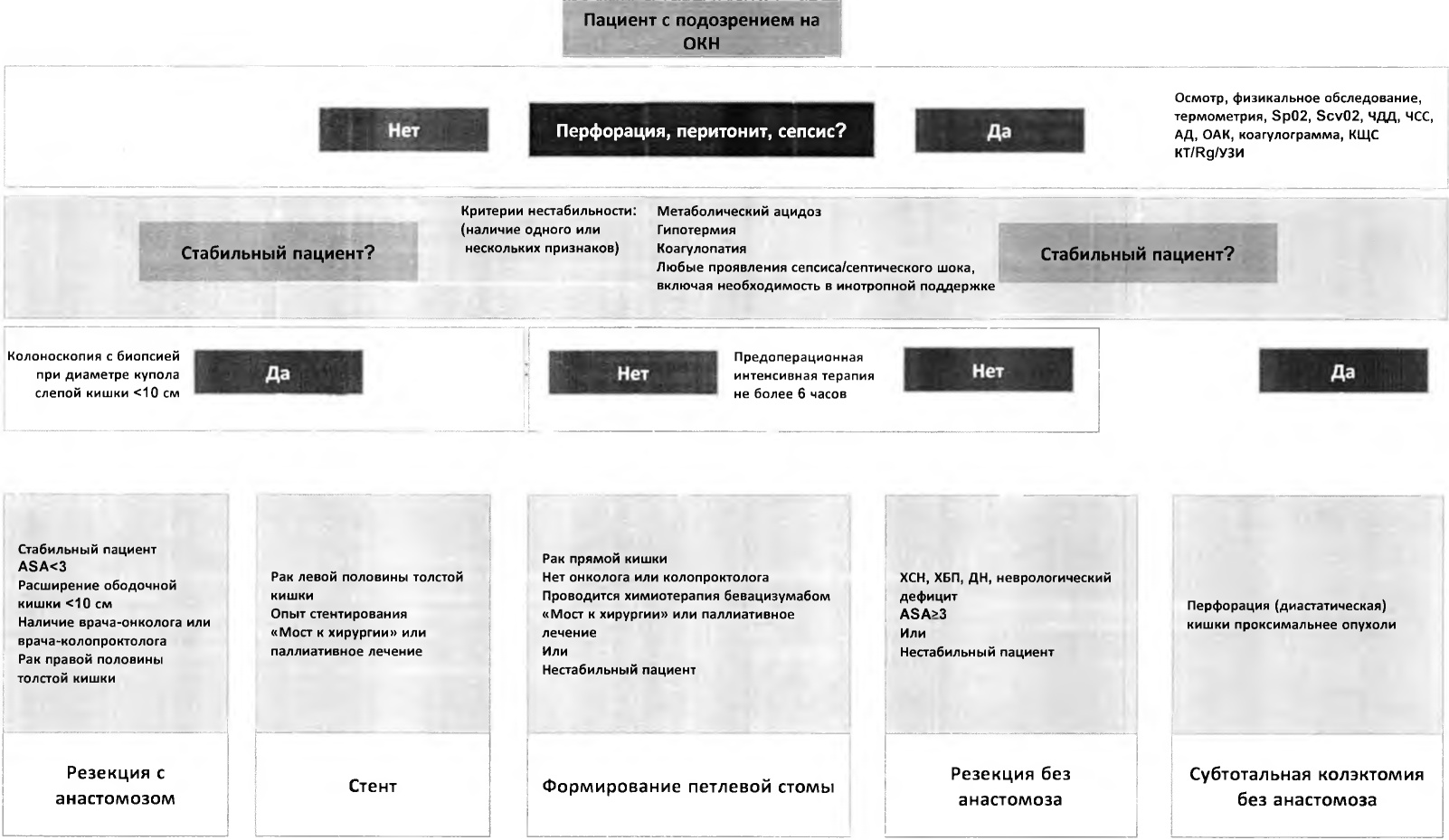
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Информация о заболевании.
Кишечная непроходимость - нарушение пассажа содержимого по кишечнику, вызванное закупоркой его просвета, сдавлением, спазмом, расстройствами гемодинамики или иннервации. Кишечная непроходимость проявляется схваткообразными болями в животе, тошнотой, рвотой, задержкой стула и отхождения газов. При некоторых видах кишечной непроходимости возможна консервативная тактика; в остальных случаях проводится хирургическое вмешательство, целью которого служит восстановление пассажа содержимого по кишечнику или его наружное отведение, резекция пораженного участка кишки. При подозрении на кишечную непроходимость следует незамедлительно обратиться за медицинской помощью. До осмотра врача категорически воспрещается ставить клизмы, вводить обезболивающие средство, принимать слабительные препараты, выполнять промывание желудка.
Информация, необходимая в послеоперационном периоде.
Кишечная непроходимость может быть частичной и полной. В первом случае, как правило, не возникает острых нарушений, требующих немедленной госпитализации, и, после тщательного обследования, пациенту могут быть предложены наиболее оптимальные варианты лечения. Клинически это проявляется, в основном, задержкой стула и отхождения газов. Полное перекрытие просвета кишки приводит к острой кишечной непроходимости. В этом случае к задержке стула и газов присоединяются сильные схваткообразные боли в животе, тошнота, многократная рвота. Острая кишечная непроходимость является жизнеугрожающим состоянием, при котором срочно необходима медицинская помощь в условиях хирургического стационара. При таком развитии событий возможны несколько вариантов действий. Первый вариант - будет выполнена операция по удалению пораженного отдела кишки с опухолью. Второй - в ходе одной операции будет удалена опухоль и наложена кишечная стома. Под наложением стомы понимается операция по выведению какого-либо отдела кишки на переднюю брюшную стенку. Для сбора кишечного содержимого потребуется калоприемник. Третьим вариантом является этапное лечение: сначала будет наложена стома, а затем удалена опухоль. Еще одним вариантом является установка стента, расширяющего просвет кишки, а вторым этапом - удаление опухоли. Прогноз при острой кишечной непроходимости опухолевого генеза напрямую зависит от времени обращения за медицинской помощью - чем раньше, тем благоприятнее.
Как правило, пациенты с острой кишечной непроходимостью, причиной которой явилась опухоль толстой кишки, узнают о своем заболевании либо незадолго до экстренной операции, либо уже после нее. Для определения дальнейшей тактики лечения по поводу злокачественных новообразований всем пациентам необходимо обратиться к врачу-онкологу и обязательно пройти определенный перечень диагностических мероприятий. К таким мероприятиям относится медицинский осмотр, компьютерная томография, тотальная колоноскопия, определение уровня опухолевых маркеров в крови. Обследование методом КТ позволяет правильно установить стадию заболевания, обнаружить возможные метастазы. Рекомендуется сканирование органов грудной клетки, брюшной полости и малого таза. Колоноскопия показана с целью исследования всех отделов толстой кишки, в том числе и не осмотренных ранее из-за кишечной непроходимости. Ее выполнение возможно через 1 - 3 месяца после операции. Уровень опухолевых маркеров также является неотъемлемой частью диагностической программы.
Пациентам, которым наложена кишечная стома, необходимо обратиться к медицинскому работнику, оказывающему помощь стомированным больным. Важно изменить режим физической активности, чтобы в процессе жизнедеятельности не повредить стому, а также обучиться уходу за ней. В дальнейшем в ряде случаев возможно выполнение реконструктивно-восстановительной операции по восстановлению непрерывности кишечника - закрытию стомы.
В послеоперационном периоде важно вести здоровый образ жизни. Основными аспектами здорового образа жизни являются рациональное питание, физические упражнения и отказ от курения.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Нет.
