"Клинические рекомендации "Гиперчувствительный пневмонит"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ГИПЕРЧУВСТВИТЕЛЬНЫЙ ПНЕВМОНИТ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: J67, J84.1
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 783
Разработчик клинической рекомендации
- Российское респираторное общество
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
БАЛ - бронхо-альвеолярный лаваж
КТ - компьютерная томография
ГП - гиперчувствительный пневмонит
ДИ - доверительный интервал
ДКТ - длительная кислородотерапия
ИВЛ - инвазивная вентиляция легких
ИЗЛ - интерстициальные заболевания легких
ИЛФ - идиопатический легочный фиброз
6-МТ - тест с 6-минутной ходьбой
НВЛ - неинвазивная вентиляция легких
НСИП - неспецифическая интерстициальная пневмония
ОИП - обычная интерстициальная пневмония
ТББ - трансбронхиальная биопсия
ТБКБ - трансбронхиальная криобиопсия
ТЭЛА - тромбоэмболия легочной артерии
ФЖЕЛ - форсированная жизненная емкость легких
ХБЛ - хирургическая биопсия легкого
ХОБЛ - хроническая обструктивная болезнь легких
УУР - уровень убедительности рекомендаций
УДД - уровень достоверности доказательств
DLCO - диффузионная способность легких по монооксиду углерода
IgG - иммуноглобулин G
SpO2 - сатурация крови кислородом
Термины и определения
Бронхоэктазы - необратимое расширение просветов бронхов.
Воздушные ловушки - локальная задержка воздуха в дистальных отделах дыхательных путей и альвеолах.
Гиперчувствительный пневмонит - воспалительное и/или фиброзирующее заболевание легочной паренхимы и мелких дыхательных путей, возникающее у предрасположенных лиц в результате иммуноопосредованной реакции на ингаляционные антигены.
Интерстициальные заболевания легких - гетерогенная группа заболеваний и патологических состояний известной и неизвестной природы, характеризующаяся распространенным, как правило, двусторонним поражением респираторных отделов легких (альвеол, респираторных бронхиол).
Идиопатические интерстициальные пневмонии - группа интерстициальных заболеваний легких неизвестной этиологии, сходными признаками которых являются: преимущественное поражение альвеол и интерстициальной ткани, развитие воспалительного и/или фиброзирующего процесса в легких, сопровождающееся нарастающей с течением времени одышкой и рестриктивными нарушениями вентиляционной способности легких.
Идиопатический легочный фиброз - особая форма хронической прогрессирующей фиброзирующей интерстициальной пневмонии неизвестной этиологии, которая возникает преимущественно у людей старшего возраста, поражает только легкие и связана с гистологический и/или компьютерно-томографическим паттерн обычной интерстициальной пневмонии.
Матовое стекло - умеренно выраженное повышение плотности легочной ткани ("полупрозрачное" легкое), на фоне которого видны легочные сосуды и стенки бронхов.
Мозаичная плотность - неравномерная плотность легочной ткани при исследовании на вдохе (инспираторная КТ) в виде изменения воздушности отдельных легочных долек; характеризуется чередованием участков с визуально различной плотностью (различными оттенками серого цвета) размером 1 - 2 см
Неспецифическая интерстициальная пневмония - одна из форм идиопатических интерстициальных пневмоний, характеризующаяся разнообразными гистологическими и компьютерно-томографическими признаками, нередко сходными с идиопатическим легочным фиброзом, но часто с положительным эффектом от кортикостероидов системного действия и более благоприятным прогнозом.
Сотовое легкое - кистозная трансформация легочной ткани, которая характеризуется наличием множественных, мелких (обычно 0,3 - 1,0 см в диаметре) воздушными полостями с толстыми стенками, нередко расположенными в несколько слоев.
Ретикулярные изменения - линейные и кольцевидные структуры в легочной паренхиме, формирующие сеть, обусловленные утолщением междольковых перегородок (ячейки < 1 см) или внутридольковых перегородок (ячейки > 1 см).
Тракционные бронхоэктазы - вид бронхоэктазов, возникающий в результате уменьшения объема (сморщивания и нарушения архитектоники) прилежащей легочной ткани и растяжения (тракции) мелких бронхов или бронхиол со слабо выраженным хрящевым каркасом.
Центрилобулярные очаги - множественные мелкие (обычно до 5 мм) уплотнения в легком, расположенные на расстоянии от висцеральной плевры.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Гиперчувствительный пневмонит (ГП) - воспалительное и/или фиброзирующее заболевание легочной паренхимы и мелких дыхательных путей, возникающее у предрасположенных лиц в результате иммуноопосредованной реакции на ингаляционные антигены [1]. Ранее это заболевание называлось экзогенным аллергическим альвеолитом. Если антиген, вызвавший заболевание, не удается установить, используется термин "криптогенный ГП" или "ГП с неустановленной причиной".
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ГП развивается у предрасположенных лиц после повторных воздействий антигена. В качестве этиотропных антигенов могут выступать антигены грибов, микроорганизмов, животных, птиц, низкомолекулярные неорганические химические вещества, лекарственные препараты [1], с которыми пациент контактирует в быту, на рабочем месту или в других местах. Во многих случаях такое воздействие не удается установить.
Повторные воздействия этиотропного антигена приводят к формированию гуморального (III тип реакций гиперчувствительности) и клеточного (IV тип реакций гиперчувствительности) иммунного ответа с развитием преимущественно лимфоцитарного воспаления с формированием гранулем [2].
Важную роль в развитии иммуноопосредованной реакции на внешнее воздействие играют генотипические особенности пациента, в частности, полиморфизм генов класса II антигенов гистосовместимости HLA (Human Leukocyte antigens), протеосом, транспортеров белков, тканевых ингибиторов матриксных металлопротеиназ [3 - 6], которые ассоциируются с патологической активностью фибробластов и развитием фибротического фенотипа ГП [7].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ГП чаще встречается в возрасте 50 - 60 лет [8], хотя также могут болеть молодые люди и дети [9].
Распространенность ГП варьирует в разных регионах земного шара от 0,3 до 0,9 случаев на 100 000 населения и достигая 54,6 на 100 000 в группах риска [8, 10 - 12].
Описаны спорадические вспышки ГП в различных группах риска, например, среди работников бассейнов, ремонтников автомобилей, контактирующих с полиуретаном, офисных сотрудников, подвергшихся воздействию грибов и микроорганизмов, контаминировавших кондиционеры и системы увлажнения воздуха [1].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Гиперсенситивный пневмонит, вызванный органической пылью (J67):
Другие интерстициальные легочные болезни с упоминанием о фиброзе (J84.1)
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
ГП разделяют на острый (длительность заболевания менее 6 мес.) и хронический (длительность заболевания более 6 мес). Острый и хронический ГП различаются между собой по клинико-рентгенологическим проявлениям и отражают особенности течения заболевания (Приложение А3). Не рекомендуется пользоваться термином "подострый ГП", поскольку это состояние не имеет четких диагностических критериев.
В настоящее время рекомендуется классифицировать хронический ГП на фибротический и нефибротический в зависимости от преобладающих патологических изменений на высокоразрешающей компьютерной томографии (КТ) органов грудной полости и/или при гистологическом исследовании биоптатов легочной ткани (см. раздел 2.4.1., 2.4.2.) так как такая классификация имеет прямую корреляцию с прогнозом [13].
Для фибротического ГП рекомендуется указывать наличие или отсутствие прогрессирования, поскольку от этого зависит тактика лечения [13]. Прогрессирование определяется по скорости нарастания клинических симптомов, снижения легочной функции и усиления фиброзных изменений на КТ органов грудной полости в течение 1 года на основании следующих критериев (Рис. 1) [14, 15]:
- относительное снижение форсированной жизненной емкости легких (ФЖЕЛ) на >= 10% от должного;
- относительное снижение 5% <= ФЖЕЛ < 10% от должного и ухудшение респираторных симптомов;
- относительное снижение 5% <= ФЖЕЛ < 10% от должного и увеличение распространенности фиброза по данным ВРКТ;
- ухудшение респираторных симптомов и увеличение распространенности фиброза по данным КТ органов грудной полости
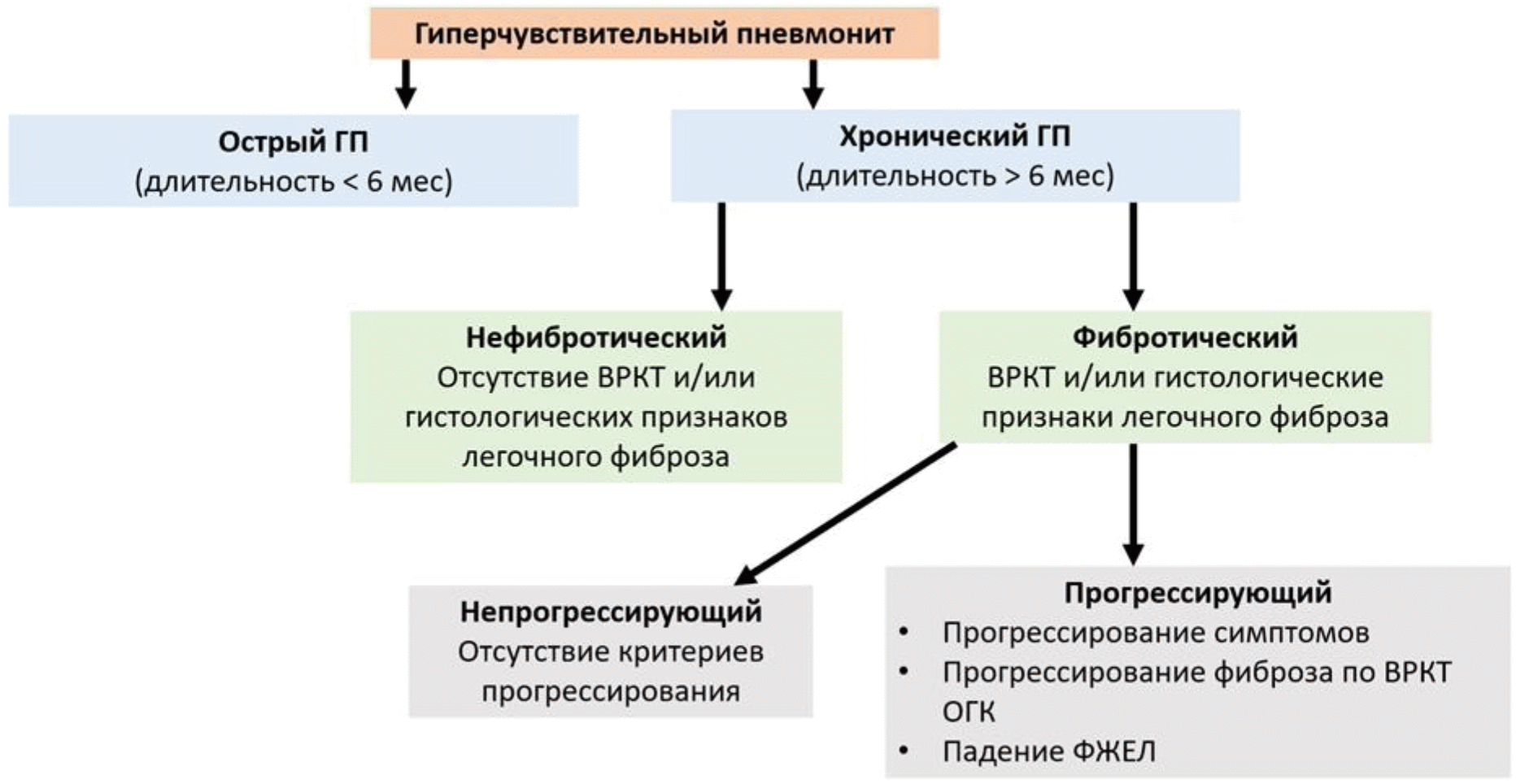
Рис. 1. Классификация ГП [1, 15]
Примеры формулировки диагноза:
Острый гиперчувствительный пневмонит.
Хронический гиперчувствительный пневмонит, фибротический прогрессирующий фенотип.
Хронический гиперчувствительный пневмонит, нефибротический фенотип.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Основными симптомами как нефибротического, так и фибротического ГП являются одышка, непродуктивный кашель, потеря веса, слабость, субфебрильная температура [16 - 18]. Заболевание может начинаться остро в течение нескольких дней или недель (более характерно для нефибротического ГП) [19, 20] либо постепенно, в течение месяцев или лет (более характерно для хронического ГП) [17, 21], однако продолжительность симптомов не имеет четкой корреляции с фибротическим или нефибротическим фенотипом [17].
Течение ГП может быть рецидивирующим. При устранении контакта с этиотропным антигеном возможны стабилизация состояния или полный регресс симптомов; при прогрессирующем фибротическим фенотипе прогноз неблагоприятный, с развитием дыхательной недостаточности и летальным исходом [22].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Подозрение на ГП должно возникать у пациента с рецидивирующими вышеперечисленными симптомами при воздействии предполагаемого антигена в анамнезе; инспираторной крепитацией, иногда - сухими инспираторными "пищащими" хрипами при аускультации легких (squeaks), снижением веса тела [17, 23].
Диагноз ГП устанавливается на основании анамнеза (внешнее воздействие), физикального осмотра, лабораторных данных, результатов высокоразрешающей КТ органов грудной полости, легочных функциональных тестов, патолого-анатомического исследования биопсийного (операционного) материала тканей легкого, цитологическое исследования лаважной жидкости (БАЛ).
Критерии установления диагноза/состояния [24]:
- жалобы на одышку и/или кашель;
- двухсторонняя инспираторная крепитация в базальных отделах легких при аускультации легких;
- воздействие предполагаемого антигена в анамнезе либо обнаружение сывороточных антител IgG к предполагаемому антигену;
- выявление паттерна ГП при КТ органов грудной полости.
2.1 Жалобы и анамнез
Основными симптомами ГП являются одышка при физической нагрузке и кашель, реже встречаются жалобы на общую слабость, снижение веса, субфебрильную лихорадку (последние более характерный для острой формы ГП) [17, 23].
Патогномоничные симптомы ГП отсутствуют.
Для пациента с клиническим подозрением на ГП рекомендуется тщательный сбор анамнеза с целью установления внешних воздействий, которые могли бы быть этиологическими факторами заболевания [17, 21 - 23, 25].
Для выявления внешних воздействий в анамнезе у пациентов с хроническим ГП можно использовать вопросник (Приложение Г1). Отсутствие в анамнезе указаний на контакт с потенциальным этиотропным антигеном не исключает диагноза ГП.
2.2 Физикальное обследование
При аускультации легких у пациентов с ГП наиболее часто выслушиваются инспираторная крепитация и/или сухие "пищащие" инспираторные хрипы ("squeaks") [16, 17, 20, 21, 26, 27].
Сухие "пищащие" инспираторные хрипы могут выслушиваться при
интерстициальном заболевании легких (ИЗЛ) с поражением дистальных дыхательных путей, однако чаще встречаются при ГП [16, 17, 20, 21, 27].
Инспираторная крепитация, может рассматриваться как фактор, повышающий вероятность диагноза ГП (отношение шансов 4,5, 95% доверительный интервал (ДИ) 1,8 - 11,7) [17, 26].
2.3 Лабораторные диагностические исследования
- Для пациентов с подозрением на ГП рекомендуется исследование сывороточных антител IgG к предполагаемому этиотропному антигену с целью подтверждения диагноза и устранения контакта с этиотропным антигеном [16, 28 - 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: в настоящее время отсутствует стандартизация измерения сывороточных IgG к потенциальным антигенам, связанным с развитием ГП. Разные методики, используемые для определения специфических IgG, имеют разные чувствительность и специфичность, что затрудняет интерпретацию результатов [1]. У трети пациентов с ГП этиотропный антиген не удается установить [34].
2.4 Инструментальные диагностические исследования
2.4.1. Рентгенологическая диагностика
- Пациентам с подозрением на ГП для верификации диагноза не рекомендуется выполнение обзорной рентгенографии органов грудной клетки в связи с ее низкой информативностью [35 - 39].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 3)
Комментарии: Обзорная рентгенография уступает КТ органов грудной полости в чувствительности и специфичности при выявлении патологических изменений в легких у пациентов с предполагаемым ГП [40]. Однако рентгенография позволяет выявить пациентов, у которых изменения в легких имеют сходство с картиной ГП, и обосновать направление этих пациентов на КТ органов грудной полости [41].
Следует помнить, что рентгенография легких является наиболее частым видом диагностических рентгенологических исследований, а также часто используется для скрининга скрыто протекающих заболеваний. Поэтому выявление признаков, сопоставимых с ГП имеет важное значение в современной диагностике заболевания (Приложение А3).
- Пациентам с подозрением на ГП рекомендуется проведение КТ органов грудной полости для определения характера изменений в легочной ткани, подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [35 - 37].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: Существуют технические требования к проведению КТ органов грудной полости у пациентов с ГП (Приложение А3).
Различные комбинации рентгенологических признаков формирует КТ картину (паттерн) ГП. В настоящее время принять выделять три основных КТ картины ГП - типичная, вероятная, неопределенная, которые различаются при нефибротическом) и фибротическом фенотипах (Приложение А3).
Типичная картина ГП включает как минимум один признак патологии легочной паренхимы и один признаки патологии мелких дыхательных путей [1]:
- Паренхима: матовое стекло, мозаичная плотность легочной ткани
- Мелкие дыхательные пути: плохо очерченные центрилобулярные очаги, воздушные ловушки
- Распределение: диффузное +/- менее выраженные в базальных сегментах
Вероятная картина ГП включает менее характерные признаки, описанные при ГП
- Паренхима: неравномерное или слабо выраженное матовое стекло, консолидация, воздушные кисты
- Диффузное распределение, в том числе с преобладанием в базальных отделах и перибронховаскулярное
Типичная картина фибротического ГП включает характерные признаки ГП и признаки фиброза легочной ткани: ретикулярные изменения, нарушающие легочную архитектонику (нормальное расположение сосудов и видимых бронхов) и/или тракционные бронхоэктазы; +/- сотовое легкое; хаотичное распределение фиброзных изменений (без отчетливого преобладания) или преобладание в средней легочной зоне (на уровне корней), характерна большая воздушность нижних легочных зон
Вероятная картина фибротического ГП включает отдельные признаки фиброза и воспаления, которые могут наблюдаться при ГП [1].
2.4.2. Морфологическая диагностика
Биопсия легких часто играет ключевую роль в установлении диагноза ГП.
- Морфологический диагноз ГП рекомендуется выставлять пациентам с клиническим подозрением на ГП при выявлении в любых биоптатах легочной ткани специфических признаков (Приложение А3) [1, 42, 43].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: Для нефибротического ГП характерно выявление в биоптатах легочной ткани (Рис. 2) [1, 44 - 46]:
1) интерстициальной пневмонии клеточного типа с бронхиолоцентричным распределением в сочетании с
2) хроническим бронхиолитом клеточного типа;
3) гранулематозным воспалением;
4) при отсутствии гистологических признаков альтернативного заболевания.
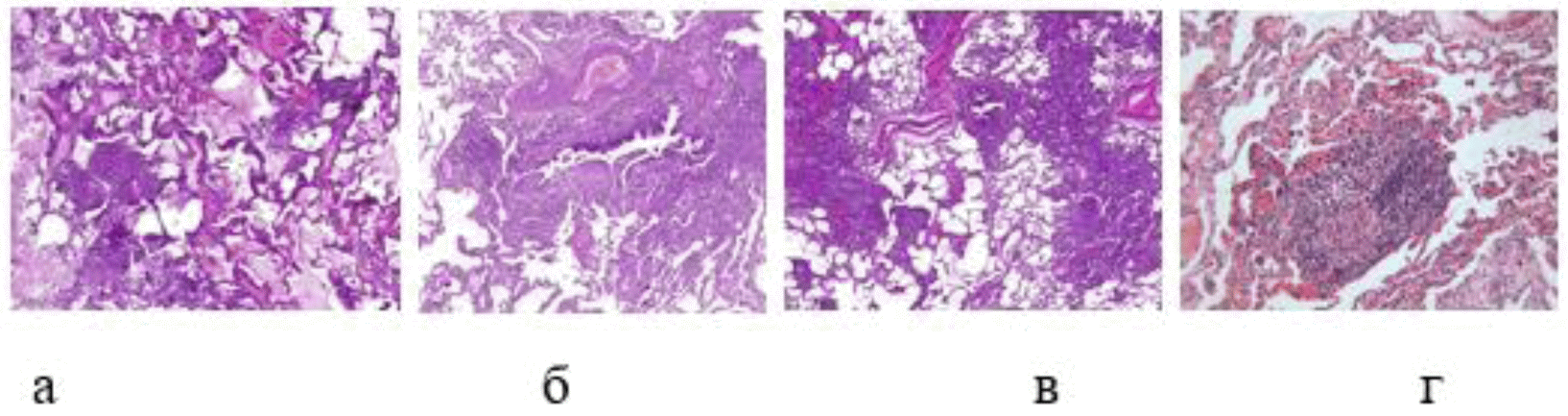
Рис. 2. Гистологические признаки нефибротического ГП: а. Клеточная интерстициальная пневмония, перибронхиолярная инфильтрация и гранулемы с гигантскими многоядерными клетками. б. Перибронхиолярное интерстициальное воспаление, фибробластические фокусы в стенке терминальной бронхиолы. в. Перибронхиолярная инфильтрация организующаяся пневмония. г. Гранулема в стенке терминальной бронхиолы, состоящая из гистиоцитов и лимфоцитов.
Клеточная интерстициальная пневмония представлена инфильтрацией преимущественно малыми лимфоцитами, но также имеет место небольшое число плазмоцитов, изредка - эозинофилов. Могут быть фокусы организующейся пневмонии, локализующиеся исключительно перибронхиолярно.
Гранулемы при ГП, как правило, небольших размеров, рыхлые (плохо сформированные), включающие гистиоциты и гигантские многоядерные клетки, локализующиеся преимущественно в перибронхиолярном интерстиции. Разрозненно лежащие многоядерные гигантские клетки встречаются часто и могут содержать в цитоплазме различные включения, такие как тельца Шауманна, астероидные тела или игольчатые холестериновые структуры [42, 44].
Критерии диагностики для ГП применимы к нефибротическому и фибротическому вариантам, разница заключается в отсутствии или наличии фиброзных изменений.
Фибротический ГП характеризуется наличием хронической интерстициальной пневмонии и/или бронхиолита в сочетании с фиброзом при наличии признаков гранулематозного воспаления (Рис. 3) [1, 45, 47, 48].
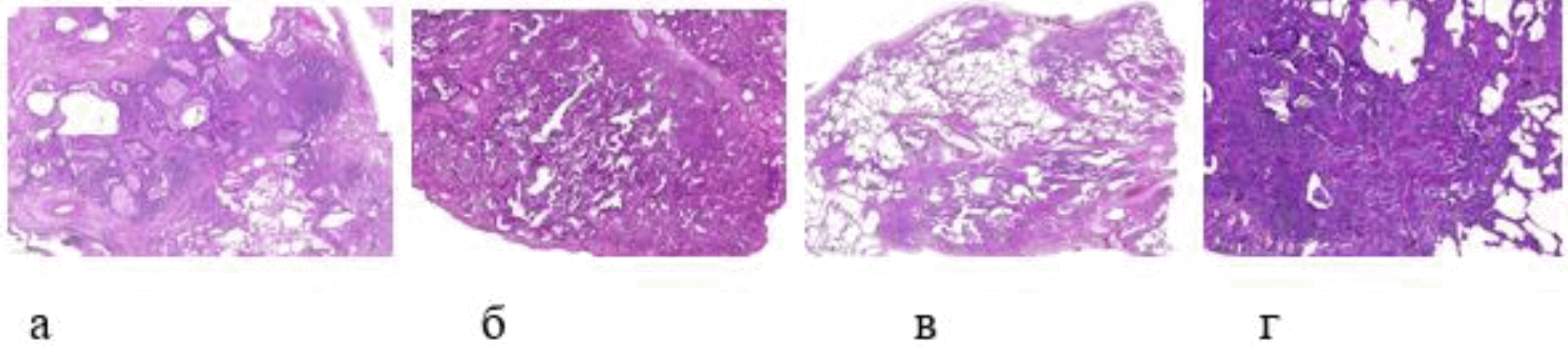
Рис. 3. Гистологические признаки фибротического ГП: а. Хроническая интерстициальная пневмония, картина ОИП с микросотами. б. Хроническая интерстициальная пневмония, картина НСИП. в. "Мостовидный" фиброз. г. Перибронхиолярная метаплазия с пролиферацией гладких мышц, облитерирующий "кисетный" бронхиолит, гигантские многоядерные клетки и холестероловые структуры в просветах микросот.
- Пациентам с подозрением на ГП рекомендуется цитологическое исследование лаважной жидкости (БАЛ) с целью подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [49 - 54].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2).
Комментарии: Наиболее типичным результатом цитологического исследования БАЛ при ГП является выраженный лимфоцитоз. В качестве диагностического критерия рассматривается пороговый уровень более 30% лимфоцитов от общего количества клеток БАЛ [52, 55 - 57]. При этом при нефибротическом ГП доля лимфоцитов в БАЛ в среднем выше (более 30 - 40%), нежели при фибротическом ГП (около 20%) [49; 58].
Определение показателя соотношения CD4+/CD8+ может быть полезно при дифференциальной диагностике ГП и саркоидоза. При ГП отношение CD4+/CD8+ составляет менее 1, тогда как при саркоидозе - более 2 [59].
Разные варианты биопсии легкого (хирургическая биопсия легкого (ХБЛ), криобиопсия, трансбронхиальная биопсия легкого (ТББЛ) имеют разную диагностическую ценность и уровень риска. Вред от процедуры должен быть сопоставлен с потенциально полезной информацией, которая может быть получена, особенно при подозрении на нефибротический ГП или фибротический ГП с выраженным фиброзом.
- Пациентам с подозрением на нефибротический ГП рекомендуется выполнение трансбронхиальной биопсии легкого (ТББЛ) с патолого-анатомическим исследованием биопсийного материала тканей легкого с целью подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [60 - 64].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Комментарии: согласно мета-анализу экспертов Европейского и Японского респираторных обществ и Американского и Латиноамериканского торакальных обществ, диагностическая ценность ТББЛ при ИЗЛ в целом составляет 41 - 68%, но значительно выше при нефибротическом ГП, чем при фибротическом ГП [1]. Среди побочных эффектов описаны пневмоторакс (частота 7%) и легочные кровотечения (4%) [1]. Не зарегистрировано случаев летальных исходов и обострений ГП, связанных с ТББЛ [1].
- Для пациентов с подозрением на нефибротический ГП, у которых окончательный диагноз не достигнут с помощью альтернативных методов диагностики, рекомендуется ХБЛ с патолого-анатомическим исследованием биопсийного материала тканей легкого с целью подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [1, 65 - 75].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: диагностическая ценность ХБЛ как при фибротических, так и при нефибротических ИЗЛ, включая ГП, составляет 96 - 98%, при этом диагноз ГП при подозрении на это заболевание был подтвержден в 91% случаев [1]. В то же время следует учитывать высокий процент осложнений, в том числе летального исхода, связанных с ХБЛ [76 - 78].
- Для пациентов с подозрением на фибротический ГП, у которых окончательный диагноз не достигнут с помощью альтернативных методов диагностики, рекомендуется ХБЛ с патолого-анатомическим исследованием биопсийного материала тканей легкого с целью подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [1, 53, 79 - 83].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3)
Комментарии: диагностическая ценность ХБЛ у пациентов с неуточненными ИЗЛ, которым ранее были выполнены ТББЛ и БАЛ, достигает 100% [75] при частоте послеоперационных осложнений от 7% [75] до 15% [81] и послеоперационной летальности от 0% [75] до 4% [81].
- Для пациентов с подозрением на фибротический ГП рекомендуется выполнение криобиопсии легкого с патолого-анатомическим исследованием биопсийного материала тканей легкого с целью подтверждения диагноза ГП и дифференциальной диагностики с другими ИЗЛ [1, 84].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Учитывая более низкую, чем при нефибротический ГП, диагностическую информативность ТББЛ и высокий риск послеоперационных осложнений при ХБЛ, у пациентов с подозрением на фибротический ГП криобиопсия легкого может рассматриваться как более предпочтительный метод гистологической верификации диагноза [1].
2.4.3. Функциональная диагностика
Легочные функциональные тесты у пациентов с нефибротическим ГП могут выявлять обструктивные вентиляционные нарушения или не иметь отклонений от нормальных значений; тем не менее, диффузионная способность легких (DLCO) может быть единственным сниженным легочным функциональным показателем [85]. При фибротическом ГП развиваются рестриктивные нарушения легочной вентиляции с уменьшением легочных объемов и снижением DLCO [38, 85].
- Всем пациентам с ГП рекомендуется выполнять исследование неспровоцированных дыхательных объемов и потоков для уточнения характера и выраженности нарушений легочной вентиляции, а также мониторирования скорости прогрессирования ИЛФ [38, 85 - 94].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Всем пациентам с фибротическим ГП рекомендуется выполнять тест с 6-минутной ходьбой (6-МТ) для объективной оценки их функционального состояния, потребности в кислородотерапии, определения прогноза, а также оценки эффективности легочной реабилитации [95 - 99].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: В исследованиях с участием пациентов с различными фибротическими ИЗЛ, включая ГП, показано, что уменьшение расстояния, пройденного в 6-МТ, до < 300 м, а также снижение сатурации кислорода ниже 85% к концу 6-МТ являются прогностическими факторами летального исхода [99, 100]. 6-МТ может использоваться для оценки эффективности легочной реабилитации у пациентов с фибротическими ИЗЛ, включая ГП [99].
2.4.4. Пульсоксиметрия
- Всем пациентам с ГП рекомендуется регулярно выполнять пульсоксиметрию для измерения насыщения крови кислородом (SpO2) и определения значимости десатурации крови как в покое, так и при физических нагрузках, например, в 6-МТ [19, 95, 100, 101].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 4)
Комментарии: Выявление десатурации ниже 88% при физической активности является неблагоприятным прогностическим признаком и показанием к назначению кислородотерапии [100].
2.5 Иные диагностические исследования
- Многопрофильное обсуждение рекомендуется проводить для всех пациентов с подозрением на ГП с целью подтверждения диагноза ГП и обсуждения тактики лечения [1, 102].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Многопрофильное обсуждение необходимо всем пациентам с фибротическим ГП для установления диагноза, определения потребности в ХБЛ, а также выбора оптимальной терапии. В состав многопрофильной группы специалистов должны обязательно входить врач-пульмонолог, врач-рентгенолог и врач-патологоанатом с опытом диагностики ГП, также возможно участие врача-профпатолога. Обсуждение может проводиться с помощью телемедицинской коммуникации [1]. Алгоритм диагностики ГП приведен в Приложении Б.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативное лечение
- Всем пациентам с ГП рекомендуется устранить контакт с предполагаемым или подтвержденным этиотропным антигеном для снижения риска прогрессирующего течения и неблагоприятного исхода ГП [33, 88, 103 - 105].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 3)
Комментарии: Устранение контакта с предполагаемым или подтвержденным антигеном является ключевым моментом в лечении ГП, хотя описано немало случаев спонтанного регресса или отсутствия прогрессирования ГП при продолжении контакта с этиотропным антигеном и, наоборот, прогрессирующего течения ГП при устранении контакта с антигеном [106, 17, 108]. Вероятно, в развитии конкретного фенотипа ГП играют роль более сложные взаимосвязи организма человека и внешнесредового фактора [107].
3.1.1. Медикаментозное лечение
- Пациентам с острым и хроническим нефибротическим ГП рекомендуется назначение кортикостероидов системного действия для снижения риска прогрессирующего течения ГП и улучшения прогноза выживаемости [31, 88, 109, 1110, 111].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 3)
Комментарии: терапия кортикостероидами системного действия может уменьшить выраженность симптомов, улучшить легочную функцию и замедлить прогрессирование нефибротического ГП [31, 88, 109]. В отношении фибротического ГП нет единого мнения о влиянии кортикостероидов системного действия на исходы заболевания [31, 88, 109 - 112]. В период обострения фибротического ГП следует рассмотреть возможность применение кортикостероидов системного действия [113, 114].
- При неэффективности или выраженных побочных эффектах кортикостероидов системного действия у пациентов с ГП рекомендуется рассмотреть возможность применения #микофеноловой кислоты** внутрь по 1 - 3 г в сутки в несколько приемов до 24 месяцев (код АТХ: L04AA06) или #азатиоприна** (код АТХ: L04AX01) внутрь по 100 - 150 мг [115, 116] в сутки в несколько приемов до 24 месяцев или #ритуксимаба** (код АТХ: L01FA01) введение по 500 - 1000 мг внутривенно капельно в 0-й, 6-й и 12-й месяцы терапии [117] или введение по 1000 мг внутривенно капельно в 0-й и 14-й день лечения [118].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: В настоящее время отсутствуют данные, позволяющие разработать однозначные рекомендации за или против использования перечисленных лекарственных средств при ГП [111]; опубликованы единичные исследования с противоречивыми результатами [109, 111].
- Пациентам с прогрессирующим течением фибротического ГП рекомендуется назначение нинтеданиба для замедления прогрессирующего снижения легочной функции [94, 119].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
Комментарии: В настоящее время показано, что при ИЗЛ с прогрессирующим фибротическим течением, включая фибротический ГП, нинтеданиб позволяет достоверно замедлить скорость снижения легочной функции (ФЖЕЛ, DLCO) вне зависимости от наличия или отсутствия ВРКТ-паттерна ОИП [94, 119]. Имеются данные о возможном увеличении продолжительности жизни пациентов с прогрессирующим фиброзирующим течением ИЗЛ, включая фибротический ГП, на фоне терапии нинтеданибом до 3,5 лет по сравнению с плацебо [119].
3.1.2. Немедикаментозное лечение
Длительная кислородотерапия (ДКТ) - ингаляторное введение лекарственных препаратов и кислорода.
- Пациентам с фибротическим ГП и клинически значимой гипоксемией в покое (при SpO2 менее 88% в покое при дыхании комнатным воздухом) рекомендуется проведение ДКТ [119].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Косвенные доказательства о пользе ДКТ при ГП основаны на данных, полученных для пациентов с хронической обструктивной болезнью легких (ХОБЛ). Аналогично пациентам с ХОБЛ, при назначении ДКТ пациентам с фибротическим ГП с хронической дыхательной недостаточностью ее длительность должна составлять не менее 15 - 17 часов в сутки, включая период ночного сна [121, 122].
Неинвазивная вентиляция легких
- Применение неинвазивной вентиляции легких (НВЛ) с положительным давлением на вдохе рекомендуется пациентам с фибротическим ГП, хронической дыхательной недостаточностью при недостаточном эффекте от проводимой ДКТ [122 - 126].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
Комментарии: НВЛ с положительным давлением на вдохе и выдохе на фоне повседневной физической активности у пациентов с фибротическими ИЗЛ, включая фибротический ГП, улучшала сатурацию в большей степени, чем оксигенотерапия [121].
Искусственная вентиляция легких (ИВЛ)
В настоящее время недостаточно данных для выработки рекомендаций за или против использования ИВЛ при развитии острой дыхательной недостаточности у пациентов с фибротическим ГП [127, 128].
Опубликованные исследования включали пациентов с различными фиброзирующими ИЗЛ, в том числе с фибротическим ГП, с развившейся острой дыхательной недостаточностью. В систематическом анализе J.A. Huapaya и соавт. летальность пациентов с фибротическими ИЗЛ, находящихся на ИВЛ, составила 27 - 100% [127]. Более того, ИВЛ при фибротических ИЗЛ связана с повышением летальности в течение последующего года (отношение шансов 5,18; 95% ДИ 1,18 - 22,75) [127]. В то же время использование определенных режимов ИВЛ, в частности, достижение целевого давления плато в первые 3 часа от начала ИВЛ (отношение шансов 0,23; 95% ДИ 0,07 - 0,7; p = 0,016), более высокое соотношение PaO2/FiO2 в первые 3 и 48 часов от начала ИВЛ (отношение шансов 0.98; 95% ДИ 0,96 - 0,99; p = 0,002 и 0,98; 0,97 - 0,99; p = 0,018, соответственно) может уменьшить летальность среди этой категории пациентов [128].
3.2. Хирургическое лечение
Трансплантация легких
- Пациентам с фибротическим ГП при наличии соответствующих показателей возможно рекомендовать проведение трансплантации легких [129, 130].
Уровень убедительности рекомендаций C; уровень достоверности доказательств 5.
Комментарии: Трансплантация легких является жизнесберегающей процедурой, хотя и с высоким риском летального исхода [129]. Тем не менее, выживаемость пациентов с ГП после трансплантации легких составляет 96% через 1 год и 89% через 5 лет, что достоверно выше, чем у пациентов с ИЛФ; средняя продолжительность жизни после трансплантации легких составляет 3,6 лет [131].
Показания для трансплантации легких при ГП не разработаны, поэтому эксперты Российского респираторного общества рекомендуют пользоваться показаниями, разработанными для пациентов с ИЛФ в соответствии с клиническими рекомендациями Российского трансплантологического общества [129]:
- снижение ФЖЕЛ на 10% и более в течение 6 мес наблюдения;
- снижение DLCO на 15% и более в течение 6 мес наблюдения;
- снижение SpO2 менее 88% или дистанция менее 250 метров в 6-МТ или отрицательная динамика по дистанции 6-МТ более 50 метров в течение 6 мес наблюдения;
- наличие легочной гипертензии по данным катетеризации правых отделов сердца или по данным эхокардиографического исследования;
- повторные госпитализации по поводу дыхательной недостаточности.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам с фибротическим ГП рекомендуется проводить легочную реабилитацию, объем которой определяется тяжестью состояния пациента [96].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: Легочная реабилитация пациентов с фибротическим ГП должна включать аэробные тренировки скелетной и дыхательной мускулатуры, образовательные программы для пациентов, коррекцию нутритивного статуса и психологическую помощь. Эти меры могут уменьшить одышку, улучшить переносимость повседневных физических нагрузок и качество жизни независимо от тяжести функциональных нарушений [96].
- Для оценки эффективности легочной реабилитации и переносимости физической нагрузки у пациентов с фибротическим ГП рекомендуется использовать шкалу MRC (Приложение Г2) [97, 98].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: По данным нескольких авторов, шкала MRC надежно отражает динамику одышки при повседневной физической активности у пациентов с различными ИЗЛ на фоне легочной реабилитации [97, 98].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Наблюдение за пациентами с ГП необходимо для активного выявления случаев прогрессирующего течения заболевания, оценки динамики симптомов и выявления осложнений терапии [90, 91, 93].
- Всем пациентам с ГП рекомендуется измерять ФЖЕЛ и DLCO (например, 1 раз в 3 - 6 мес) для ежегодной оценки прогноза заболевания и своевременной коррекции терапии [90, 91, 93].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: В отдельных клинических исследованиях подтверждено, что снижение абсолютных значений ФЖЕЛ на 10% является маркером прогрессирующего течения ГП, что требует назначения антифибротической терапии [90, 91, 93].
- При каждом плановом посещении пациента с ГП рекомендуется оценивать SpO2 в покое с помощью пульсоксиметра [132, 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: SpO2 с помощью пульсоксиметра должна оцениваться в покое и при физической нагрузке у всех пациентов вне зависимости от симптомов, для выявления потребности в кислородотерапии. Такие измерения следует выполнять исходно и через каждые 3 - 6 мес наблюдения.
- У всех пациентов с ГП при быстром ухудшении респираторных симптомов рекомендуется исключить обострение заболевания и другие возможные причины, например, тромбоэмболию легочной артерии, пневмоторакс, респираторную инфекцию, аспирацию [124, 125].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: У пациентов с ГП могут развиваться такие сопутствующие состояния, как легочная гипертензия, тромбоэмболия легочной артерии, рак легкого, ишемическая болезнь сердца, которые влияют на выживаемость [125].
6. Организация оказания медицинской помощи
Плановое ведение пациента с ГП осуществляется в условиях первичной специализированной (амбулаторной) медицинской помощи.
Показания для госпитализации в медицинскую организацию:
1) плановая госпитализация в стационар осуществляется для подтверждения диагноза ГП (выполнение ТББЛ или ХБЛ);
2) экстренная госпитализация в стационар осуществляется при обострении ГП (нарастание одышки, ухудшение оксигенации) либо при развитии осложнений ГП (тромбоэмболия легочной артерии, острая инфекция нижних дыхательных путей).
Показания к выписке пациента из медицинской организации
1) стабилизация клинического состояния;
2) SpO2 не ниже 93% в покое при дыхании комнатным воздухом или на фоне кислородотерапии.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует
Критерии оценки качества медицинской помощи
N п/п
Критерии качества
Оценка выполнения
.
Выполнена компьютерная томография органов грудной клетки
Да/Нет
.
Проведена пульсоксиметрия
Да/Нет
.
Проведено исследование неспровоцированных дыхательных объемов и потоков
Да/Нет
.
Выполнен 6-минутный тест
Да/Нет
.
Проведена ДКТ - ингаляторное введение лекарственных препаратов и кислорода (при SpO2 менее 88% в покое при дыхании комнатным воздухом)
Да/Нет
.
Выполнена рекомендация назначения кортикостероидов системного действия при остром и хроническом нефибротическим ГП
Да/Нет
.
Выполнена рекомендация назначения нинтеданиба при прогрессирующем течении фибротического ГП
Да/Нет
Список литературы
1. Raghu G., Remy-Jardin M., Ryerson Ch. J. et al. Diagnosis of hypersensitivity pneumonitis in adults. An Official ATS/JRS/ALAT Clinical Practice Guideline. Am. J. Respir. Crit. Care Med. 2020; V. 202, Iss. 3: p.p. e36 - e69.
2. Selman M., Pardo A., King T.E. Jr. Hypersensitivity pneumonitis: insights in diagnosis and pathobiology. Am. J. Respir. Crit. Care Med. 2012; 186: 314 - 324
3. Camarena A., Juarez A., Mejia M. et al. Major histocompatibility complex and tumor necrosis factor-alpha polymorphisms in pigeon breeder's disease. Am. J. Respir. Crit. Care Med. 2001; 163: 1528 - 1533.
4. Camarena A., Aquino-Galvez A., Falfan-Valencia R. et al. PSMB8 (LMP7) but not PSMB9 (LMP2) gene polymorphisms are associated to pigeon breeder's hypersensitivity pneumonitis. Respir. Med. 2010; 104: 889 - 894.
5. Aquino-Galvez A., Camarena A., Montano M. et al. Transporter associated with antigen processing (TAP) 1 gene polymorphisms in patients with hypersensitivity pneumonitis. Exp. Mol. Pathol. 2008; 84: 173 - 177.
6. Hill M.R., Briggs L., Montano M.M. et al. Promoter variants in tissue inhibitor of metalloproteinase-3 (TIMP-3) protect against susceptibility in pigeon breeders' disease. Thorax 2004; 59: 586 - 590.
7. Jinta T., Miyazaki Y., Kishi M. et al. The pathogenesis of chronic HP in common with IPF. Am. J. Clin. Pathol. 2010; 134: 613 - 620
8. Fernandez Perez E.R., Kong A.M., Raimundo K. et al. Epidemiology of hypersensitivity pneumonitis among an insured population in the United States: a claims-based cohort analysis. Ann. Am. Thorac. Soc. 2018; 15: 460 - 469
9. Hanak V., Golbin J.M., Ryu J.H. Causes and presenting features in 85 consecutive patients with hypersensitivity pneumonitis. Mayo Clin. Proc. 2007; 82: 812 - 816
10. Yoshida K., Suga M., Nishiura Y., Arima K., Yoneda R., Tamura M., et al. Occupational hypersensitivity pneumonitis in Japan: data on a nationwide epidemiological study. Occup Environ Med. (1995) 52: 570 - 4.10.1136/oem.52.9.570
11. Dalphin J.C. Extrinsic allergic alveolitis in agricultural environment. Rev Prat. (1992) 42: 1790-6.
12. Morell F., Villar A., Ojanguren I., Munoz X., Cruz M.J., Sansano I., et al. Hypersensitivity pneumonitis and (Idiopathic) pulmonary fibrosis due to feather duvets and pillows. Arch Bronconeumol. (2021) 57: 87 - 93. 10.1016/j.arbres.2019.12.003
13. Vasakova M., Morell F., Walsh S. et al. Hypersensitivity pneumonitis: perspectives in diagnosis and management. Am. J. Respir. Crit. Care Med. 2017; 196: 680 - 689.
14. Flaherty K.R. Wells A.U., Cottin V. et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N. Engl. J. Med. 2019; 381(18): 1718 - 1727. doi: 10.1056/NEJMoa1908681.
15. Авдеев С.Н., Чикина С.Ю., Тюрин И.Е., Белевский А.С., Терпигорев С.А., Ананьева Л.П., Визель А.А., Болдина М.В., Демко И.В., Лещенко И.В., Трофименко И.Н., Киняйкин М.Ф., Степанян И.Э., Зайцева А.С., Петров Д.В. Хронические фиброзирующие интерстициальные заболевания легких с прогрессирующим фиброзным фенотипом: резолюция Междисциплинарного Совета экспертов. Пульмонология. 2021. Т. 31. N 4. с. 505 - 510.
16. Reich J.M. Chirping rales in bird-fancier's lung. Chest 1993; 104: 326 - 327.
17. Lacasse Y., Selman M., Costabel U. et al. HP Study Group. Clinical diagnosis of hypersensitivity pneumonitis. Am. J. Respir. Crit. Care Med 2003; 168: 952 - 958.
18. Черняк Б.А. Гиперчувствительный пневмонит: от этиологии и патогенеза к диагностике и лечению / Б.А. Черняк, И.И. Воржева, И.Н. Трофименко // Фарматека. - 2021. - Т. 28. - N 5. - С. 17 - 31. - DOI 10.18565/pharmateca.2021.5.17-31.
19. Kumar R., Spalgais S., Ranga V. Hypersensitivity pneumonitis: clinical, radiological and pathological profile of 103 patients from North India. Monaldi Arch. Chest Dis. 2020; 90(3). doi: 10.4081/monaldi.2020.1307.
20. Sakamoto S., Furukawa M., Shimizu H. et al. Clinical and radiological characteristics of ultrasonic humidifier lung and summer-type hypersensitivity pneumonitis. Respir. Med. 2020; 174: 106196. doi: 10.1016/j.rmed.2020.106196.
21. Onishi Y., Kawamura T., Higashino T. et al. Clinical features of chronic summer-type hypersensitivity pneumonitis and proposition of diagnostic criteria. Respir. Investig. 2020 Jan; 58(1): 59 - 67. doi: 10.1016/j.resinv.2019.09.003.
22. Fernandez Perez E.R., Swigris J.J., Forssen A.V. et al. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest 2013; 144: 1644 - 1651.
23. Johannson K.A., Elicker B.M., Vittinghoff E. et al. A diagnostic model for chronic hypersensitivity pneumonitis. Thorax 2016; 71(10): 951-4. doi: 10.1136/thoraxjnl-2016-208286.
24. Авдеев С.Н. Гиперчувствительный пневмонит / С.Н. Авдеев // Пульмонология. - 2021. - Т. 31. - N 1. - С. 88 - 99. - DOI 10.18093/0869-0189-2021-31-1-88-99.
25. Гиперчувствительный пневмонит / И.В. Демко, Н.В. Гордеева, А.Ю. Крапошина [и др.] // Бюллетень физиологии и патологии дыхания. - 2015. - N 58. - С. 109 - 114.
26. Lacasse Y., Girard M., Cormier Y. Recent advances in hypersensitivity pneumonitis. Chest. 2012; 142(1): 208 - 217. doi: 10.1378/chest.11-2479.
27. Pereira C.A.C., Soares M.R., Boaventura R. et al. Squawks in interstitial lung disease prevalence and causes in a cohort of one thousand patients. Medicine (Baltimore) 2019; 98: e16419. doi: 10.1097/MD.0000000000016419.
28. Rodrigo M.J., Benavent M.I., Cruz M.J. et al. Detection of specific antibodies to pigeon serum and bloom antigens by enzyme linked immunosorbent assay in pigeon breeder's disease. Occup. Environ. Med. 2000; 57: 159 - 164. doi: 10.1136/oem.57.3.159.
29. Perez-Padilla R., Salas J., Chapela R. et al. Mortality in Mexican patients with chronic pigeon breeder's lung compared with those with usual interstitial pneumonia. Am. Rev. Respir. Dis. 1993; 148: 49 - 53.
30. Ohtsuka Y., Munakata M., Tanimura K. et al. Smoking promotes insidious and chronic farmer's lung disease, and deteriorates the clinical outcome. Intern. Med. 1995; 34: 966 - 971.
31. De Sadeleer L.J., Hermans F., De Dycker E. et al. Effects of corticosteroid treatment and antigen avoidance in a large hypersensitivity pneumonitis cohort: a single-centre cohort study. J. Clin. Med. 2018; 8 (1). 14. doi: 10.3390/jcm8010014.
32. Sema M., Miyazaki Y., Tsutsui T., Tomita M., Eishi Y., Inase N. Environmental levels of avian antigen are relevant to the progression of chronic hypersensitivity pneumonitis during antigen avoidance. Immun. Inflamm. Dis. 2018; 6 (1): 154 - 162. doi: 10.1002/iid3.202.
33. Tsutsui T., Miyazaki Y., Kuramochi J., Uchida K., Eishi Y., Inase N. The amount of avian antigen in household dust predicts the prognosis of chronic bird-related hypersensitivity pneumonitis. Ann. Am. Thorac. Soc. 2015; 12 (7): 1013 - 1021. doi: 10.1513/AnnalsATS.201412-569OC.
34. Fernandez Perez E.R., Koelsch T.L., Leone P.M. et al. Clinical Decision-Making in Hypersensitivity Pneumonitis: Diagnosis and Management. Semin. Respir. Crit. Care Med. 2020; 41 (2): 214 - 228. doi: 10.1055/s-0040-1701250.
35. Nishimura K., Izumi T., Kitaichi M. et al. The diagnostic accuracy of high-resolution computed tomography in diffuse infiltrative lung diseases. Chest. 1993; 104 (4): 1149 - 1155. doi: 10.1378/chest.104.4.1149.
36. Ahmed Sh., Khanduri S., Husain M. et al. Diagnostic Accuracy of Multidetector CT in Detection of Early Interstitial Lung Disease With Its Role in Characterization. Cureus. 2020; 12 (5): e8253. doi: 10.7759/cureus.8253.
37. Shobeirian F., Mehrian P., Doroudinia A. Hypersensitivity Pneumonitis High-resolution Computed Tomography Findings, and Their Correlation with the Etiology and the Disease Duration. Prague Med. Rep. 2020; 121 (3): 133 - 141. doi: 10.14712/23362936.2020.12.
38. Salisbury M., Gu T., Murray S. et al. Hypersensitivity Pneumonitis: Radiologic Phenotypes Are Associated With Distinct Survival Time and Pulmonary Function Trajectory Chest 2019; 155(4): 699 - 711. doi: 10.1016/j.chest.2018.08.1076.
39. Hodgson M.J., Parkinson D.K., Karpf M. Chest X-rays in hypersensitivity pneumonitis: A metaanalysis of secular trend // American journal of industrial medicine. - 1989. - Т. 16. - N. 1. - С. 45 - 53.
40. Hirschmann J.V., Pipavath S.N., Godwin J.D. Hypersensitivity pneumonitis: a historical, clinical, and radiologic review. Radiographics. 2009; 29 (7): 1921 - 38
41. Glazer C.S., Rose C.S., Lynch D.A. Clinical and radiologic manifestations of hypersensitivity pneumonitis. J Thorac Imaging. 2002; 17 (4): 261-72
42. Клинико-рентгено-морфологическая диагностика гиперчувствительного пневмонита / А.Л. Черняев, Э.В. Кусраева, М.В. Самсонова [и др.] // Бюллетень сибирской медицины. - 2021. - Т. 20. - N 4. - С. 93 - 102. - DOI 10.20538/1682-0363-2021-4-93-102.
43. Wang P., Jones K.D., Urisman A., Elicker B.M., Urbania T., Johannson K.A., et al. Pathologic findings and prognosis in a large prospective cohort of chronic hypersensitivity pneumonitis. Chest 2017; 152: 502 - 509.
44. Castonquay M., Ryu J., Yi E., Tazelaar H. Granulomas and giant cells in hypersensitivity pneumonitis. Hum Pathol 2015; 46: 607 - 613.
45. Chiba S., Tsuchiya K., Akashi T., Ishizuka M., Okamoto T., Furusawa H., et al. Chronic hypersensitivity pneumonitis with a usual interstitial pneumonia-like pattern: correlation between histopathologic and clinical findings. Chest 2016; 149:1473 - 1481.
46. Kitaichi M., Shimizu S., Tamaya M., Takaki M., Inoue Y. Pathology of hypersensitivity pneumonitis. In: Sharma OP, editor. Clinical focus series, hypersensitivity pneumonitis. New Delhi, India: Jaypee Brothers Medical Publishers; 2013. p.p. 22 - 32.
47. Raghu G., Remy-Jardin M., Myers J.L. et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am. J. Respir. Crit. Care Med. 2018; 198 (5): e44 - e68.
48. Akashi T., Takemura T., Ando N., Eishi Y., Kitagawa M., Takizawa T., et al. Histopathologic analysis of sixteen autopsy cases of chronic hypersensitivity pneumonitis and comparison with idiopathic pulmonary fibrosis/usual interstitial pneumonia. Am J Clin Pathol. 2009; 131: 405 - 415
49. Ohtani Y., Saiki S., Kitaichi M., Usui Y., Inase N., Costabel U., Yoshizawa Y. Chronic bird fancier's lung: histopathological and clinical correlation: an application of the 2002 ATS/ERS consensus classification of the idiopathic interstitial pneumonias. Thorax 2005, 60(8): 665 - 671. 10.1136/thx.2004.027326 [PubMed: 16061708]
50. Reynolds H.Y. Present status of bronchoalveolar lavage in interstitial lung disease. Curr. Opin. Pulm. Med. 2009; 15: 479-85.
51. Cordeiro C.R., Jines J.C., Alfaro T., Ferreira A.J. Bronchoalveolar lavage in occupational lung diseases. Semin. Respir. Crit. Care Med. 2007; 28: 504-13.
52. Ohshimo S., Bonella F., Cui A., et al. Significance of bronchoalveolar lavage for the diagnosis of idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med. 2009; 179: 1043-7.
53. Morell F., Villar A., Montero M.A. et al. Chronic hypersensitivity pneumnitis in patients diagnosed with idiopathic pulmonary fibrosis: a prospective case-cohort study. Lancet Respir. Med. 2013; 1: 685 - 694.
54. Nicola Adderley, Christopher J. Humphreys, Hayley Barnes, Brett Ley, Zahra A. Premji, Kerri A. Johannson / Bronchoalveolar lavage fluid lymphocytosis in chronic hypersensitivity pneumonitis: a systematic review and meta-analysis. European Respiratory Journal 2020 56: 2000206; DOI: 10.1183/13993003.00206-2020
55. Welker L., Jorres R.A., Costabel U., Magnussen H. Predictive value of BAL cell differentials in the diagnosis of interstitial lung diseases. Eur. Respir. J. 2004; 24(6): 1000 - 1006.
56. Adams T.N., Newton C.A., Batra K., et al. Utility of bronchoalveolar lavage and transbronchial biopsy in patients with hypersensitivity pneumonitis. Lung. 2018; 196(5): 617 - 622.
57. Tzilas V., Tzouvelekis A., Bouros E. et al. Diagnostic value of BAL lymphocytosis in patients with indeterminate for usual interstitial pneumonia imaging pattern. Eur. Respir. J. 2019; 54(5).
58. Santos V., Martins N., Sousa C., Jacob M., Padrao E., Melo N., et al. Hypersensitivity pneumonitis: main features characterization in a Portuguese cohort. Pulmonology 2019 10 29 [Epub]. PMID: 10.1016/j.pulmoe.2019.09.004.
59. Kebbe J., Abdo T. Interstitial lung diseae: the diagnostic role of bronchoscopy. J Thorac Dis. 2017 Sep; 9 (Suppl 10): S996 - S1010. doi: 10.21037/jtd.2017.06.39. PMID: 29214060; PMCID: PMC5696547.
60. Pajares V., Puzo C., Castillo D. et al. Diagnostic yield of transbronchial cryobiopsy in interstitial lung disease: a randomized trial. Respirology 2014; 19: 900 - 906.
61. Sheth J.S., Belperio J.A., Fishbein M.C. et al. Utility of transbronchial vs surgical lung biopsy in the diagnosis of suspected fibrotic interstitial lung disease. Chest 2017; 151: 389 - 399.
62. Sindhwani G., Shirazi N., Sodhi R., Raghuvanshi S., Rawat J. Transbronchial lung biopsy in patients with diffuse parenchymal lung disease without 'idiopathic pulmonary fibrosis pattern' on HRCT scan: Experience from a tertiary care center of North India. Lung India 2015; 32: 453 - 456.
63. Lacasse Y., Fraser R.S., Fournier M., Cormier Y. Diagnostic accuracy of transbronchial biopsy in acute farmer's lung disease. Chest 1997; 112: 1459 - 1465.
64. Chami H.A., Diaz-Mendoza J., Chua A. et al. Transbronchial Biopsy and Cryobiopsy in the Diagnosis of Hypersensitivity Pneumonitis among Patients with Interstitial Lung Disease. Ann. Am. Thorac. Soc. 2021; 18(1): 148 - 161. doi: 10.1513/AnnalsATS.202005-421OC.
65. Ayed A.K., Raghunathan R. Thoracoscopy versus open lung biopsy in the diagnosis of ILD: a randomised controlled trial. J. Roy Coll. Surg. Edinb, 2000; 45: 159 - 163.
66. Miller J.D., Urschel J.D., Cox G. et al. A randomized, controlled trial comparing thoracoscopy and limited thoracotomy for lung biopsy in interstitial lung disease. Ann Thorac. Surg. 2000; 70: 1647 - 1650.
67. Blewett C.J., Bennett W.F., Miller J.D., Urschel J.D. Open lung biopsy as an outpatient procedure. Ann Thorac Surg 2001; 71: 1113 - 1115.
68. Ayed A.K. Video-assisted thoracoscopic lung biopsy in the diagnosis of diffuse interstitial lung disease: a prospective study. J. Cardiovasc. Surg. (Torino) 2003; 44: 115 - 118.
69. Yamaguchi M., Yoshino I., Suemitsu R. et al. Elective video-assisted thoracoscopic lung biopsy for interstitial lung disease. Asian Cardiovasc. Thorac. Ann. 2004; 12: 65 - 68.
70. Lettieri C.J., Veerappan G.R., Helman D.L., Mulligan C.R., Shorr A.F. Outcomes and safety of surgical lung biopsy for interstitial lung disease. Chest 2005; 127: 1600 - 1605.
71. Coutinho G.F., Pancas R., Magalh es E. et al. Diagnostic value of surgical lung biopsy: comparison with clinical and radiological diagnosis. Eur. J. Cardiothorac. Surg. 2008; 33: 781 - 785.
72. Guerra M., Miranda J.A., Leal F., Vouga L. Interstitial lung disease: diagnostic accuracy and safety of surgical lung biopsy. Rev. Port. Pneumol. 2009; 15: 433 - 442.
73. Fibla J.J., Molins L., Blanco A. et al. Video-assisted thoracoscopic lung biopsy in the diagnosis of interstitial lung disease: a prospective, multi-center study in 224 patients. Arch. Bronconeumol. 2012; 48: 81 - 85.
74. Rotolo N., Imperatori A., Dominioni L. et al. Efficacy and safety of surgical lung biopsy for interstitial disease: experience of 161 consecutive patients from a single institution in Italy. Sarcoidosis Vasc Diffuse Lung Dis 2015; 32: 251 - 258.
75. Samejima J., Tajiri M., Ogura T. et al. Thoracoscopic lung biopsy in 285 patients with diffuse pulmonary disease. Asian Cardiovasc. Thorac. Ann. 2015; 23: 191 - 197.
76. Lettieri C.J., Veerappan G.R., Helman D.L., Mulligan C.R., Shorr A.F. Outcomes and safety of surgical lung biopsy for interstitial lung disease. Chest 2005; 127: 1600 - 1605.
77. Park J.H., Kim D.K., Kim D.S. et al. Mortality and risk factors for surgical lung biopsy in patients with idiopathic interstitial pneumonia. Eur. J. Cardiothorac. Surg. 2007; 31: 1115 - 1119.
78. Kreider M.E., Hansen-Flaschen J., Ahmad N.N. et al. Complications of video-assisted thoracoscopic lung biopsy in patients with interstitial lung disease. Ann. Thorac. Surg. 2007; 83: 1140 - 1144.
79. Hanzawa S., Tateishi T., Takemura T. et al. The Analysis of Surgical Lung Biopsy and Explanted Lung Specimens Sheds Light on the Pathological Progression of Chronic Bird-related Hypersensitivity Pneumonitis. Intern. Med. 2019; 58(8): 1145 - 1150. doi: 10.2169/internalmedicine.1142-18.
80. Wright J.L., Churg A., Hague C.J. et al. Pathologic separation of idiopathic pulmonary fibrosis from fibrotic hypersensitivity pneumonitis. Mod. Pathol. 2020; 33(4): 616 - 625. doi: 10.1038/s41379-019-0389-3.
81. Tibana R.C.C., Soares M.R., Storrer K.M. et al. Clinical diagnosis of patients subjected to surgical lung biopsy with a probable usual interstitial pneumonia pattern on high-resolution computed tomography. BMC Pulm. Med. 2020; 20(1): 299. doi: 10.1186/s12890-020-01339-9.
82. Mooney J.J., Koth L.L. Surgical lung biopsy over bronchoalveolar lavage in chronic hypersensitivity pneumonitis. Am. J. Respir. Crit. Care Med. 2014; 189(3): 371-2. doi: 10.1164/rccm.201309-1736LE.
83. Xu J.F., Shen L., Zhang Y. et al. Lung biopsy-proved hypersensitivity pneumonitis without known offending antigen: characteristics and follow-up. Clin. Respir. J. 2014 Jul; 8(3): 297 - 304. doi: 10.1111/crj.12071.
84. Fernandez Perez E.R., Travis W.D., Lynch D.A., Brown K.K., Johannson K.A., Selman M., Ryu J.H., Wells A.U., Huang Y-C.T., Pereira C.A.C., Scholand M-B., Villar A., Inase N., Evans R.B., Mette S., Frazer-Green L. Executive Summary Diagnosis and Evaluation of Hypersensitivity Pneumonitis CHEST Guideline and Expert Panel Report. CHEST, May 2021, p. 1 - 20
85. Nowicka U., Wiatr E., Radzikowska E. et al. Pulmonary Function Abnormalities in Regard to Age at the Time of Diagnosis of Hypersensitivity Pneumonitis. Adv Exp Med Biol. 2015; 861: 75 - 84. doi: 10.1007/5584_2015_137.
86. Gimenez A., Storrer K., Kuranishi L. et al. Change in FVC and survival in chronic fibrotic hypersensitivity pneumonitis. Thorax. 2018 Apr; 73(4): 391 - 392. doi: 10.1136/thoraxjnl-2017-210035.
87. Nowicka U., Wiatr E., Radzikowska E. et al. Pulmonary Function Abnormalities in Regard to Age at the Time of Diagnosis of Hypersensitivity Pneumonitis. Adv Exp Med Biol. 2015; 861: 75 - 84. doi: 10.1007/5584_2015_137.
88. Gimenez A., Storrer K., Kuranishi L. et al. Change in FVC and survival in chronic fibrotic hypersensitivity pneumonitis. Thorax. 2018 Apr; 73(4): 391 - 392. doi: 10.1136/thoraxjnl-2017-210035.
89. Ziora D., Jastrzebski D., Lubina M et al. High-resolution computed tomography in hypersensitivity pneumonitis - correlation with pulmonary function. Ann. Agric. Environ. Med. 2005; 12(1): 31-4.
90. Schmidt C.D., Jensen R.L., Christensen L.T. et al. Longitudinal pulmonary function changes in pigeon breeders. Chest. 1988; 93(2): 359-63. doi: 10.1378/chest.93.2.359.
91. Ojanguren I., Morell F., Ramon M.A., et al. Long-term outcomes in chronic hypersensitivity pneumonitis. Allergy. 2019; 74(5): 944 - 952. doi: 10.1111/all.13692.
92. Guerrero Zuniga S., Sanchez Hernandez J., Mateos Toledo H. et al. Small airway dysfunction in chronic hypersensitivity pneumonitis. Respirology. 2017; 22(8): 1637 - 1642. doi: 10.1111/resp.13124.
93. Walsh S.L., Sverzellati N., Devaraj A. et al. Chronic hypersensitivity pneumonitis: high resolution computed tomography patterns and pulmonary function indices as prognostic determinants. Eur. Radiol. 2012; 22(8): 1672-9. doi: 10.1007/s00330-012-2427-0.
94. Wells A.U., Flaherty K.R., Brown K.K. et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases-subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet Respir. Med. 2020; 8(5): 453 - 460. doi: 10.1016/S2213-2600(20)30036-9.
95. Dias O.M., Baldi B.G., Ferreira J.G. et al. Mechanisms of exercise limitation in patients with chronic hypersensitivity pneumonitis. ERJ Open Res. 2018; 4(3): 00043-2018. doi: 10.1183/23120541.00043-2018.
96. Dowman L., Hill C.J., Holland A.E. Pulmonary rehabilitation for interstitial lung disease. Cochrane Database Syst Rev. 2014; (10): CD006322. doi: 10.1002/14651858.CD006322.pub3.
97. Tonelli R., Cocconcelli E., Lanini B. et al, Effectiveness of pulmonary rehabilitation in patients with interstitial lung disease of different etiology: a multicenter prospective study. Clini EM. BMC Pulm Med. 2017; 17(1): 130. doi: 10.1186/s12890-017-0476-5.
98. Holland A.E., Hill C.J., Conron M., et al Short term improvement in exercise capacity and symptoms following exercise training in interstitial lung disease. Thorax. 2008; 63(6): 549-54. doi: 10.1136/thx.2007.088070.
99. Alhamad E.H., Cal J.G. Predictors of mortality in interstitial lung disease patients without pulmonary hypertension. Ann. Thorac. Med. 2020; 15 (4): 238 - 243. doi: 10.4103/atm.ATM_438_20.
100. Lama V.N., Flaherty K.R., Toews G.B. et al. Prognostic value of desaturation during a 6-minute walk test in idiopathic interstitial pneumonia. Am. J. Respir. Crit. Care Med. 2003; 168: 1084 - 1090.
101. Trushenko N.V. et al. Predictors of Progression and Mortality in Patients with Chronic Hypersensitivity Pneumonitis: Retrospective Analysis of Registry of Fibrosing Interstitial Lung Diseases // Life. - 2023. - Т. 13. - N. 2. - С. 467.
102. Walters G.I., Mokhlis J.M., Moore V.C. et al. Characteristics of hypersensitivity pneumonitis diagnosed by interstitial and occupational lung disease multi-disciplinary team consensus. Respir. Med. 2019; 155: 19 - 25.
103. Ohtani Y., Inase N., Miyake S. et al. Fatal outcome in chronic bird fancier"s lung. Am. J. Med. 2002; 112(7): 588 - 590.
104. de Gracia J., Morell F., Bofill J.M. et al. Time of exposure as a prognostic factor in avian hypersensitivity pneumonitis. Respir. Med. 1989; 83(2): 139 - 143.
105. Kawamoto Y., Oda S., Tanaka M. Antigen avoidance in people with hypersensitivity pneumonitis: A scoping review. Heart Lung. 2021; 50(3): 407 - 416. doi: 10.1016/j.hrtlng.2021.01.023.
106. Quirce S., Vandenplas O., Campo P. et al. Occupational hypersensitivity pneumonitis: an EAACI position paper. Allergy. 2016; 71(6): 765-79. doi: 10.1111/all.12866.
107. Spagnolo P., Rossi G., Cavazza A. et al. Hypersensitivity Pneumonitis: A Comprehensive Review. J Investig Allergol Clin Immunol 2015; 25 (4): 237 - 250.
108. Cormier Y., Belanger J. Long-term physiologic outcome after acute farmer"s lung. Chest. 1985; 87: 796 - 800.
109. Kokkarinen J.I., Tukiainen H.O., Terho E.O. Effect of corticosteroid treatment on the recovery of pulmonary function in farmer"s lung. Am Rev Respir Dis. 1992; 145(1), 3 - 5.
110. Орлова Г.П. Особенности лечебной тактики при профессиональных интерстициальных заболеваниях легких. Медицина труда и промышленная экология. - 2017. - N 9. - стр. 144.
111. Adegunsoye A., Oldham J.M., Fernandez Perez E.R. et al. Outcomes of immunosuppressive therapy in chronic hypersensitivity pneumonitis. ERJ Open Res. 2017; 3: 00016-2017 doi: org/10.1183/23120541.00016-2017.
112. Alberti M.L., Rincon-Alvarez E., Buendia-Roldan I., Selman M. Hypersensitivity Pneumonitis: Diagnostic and Therapeutic Challenges. Front Med (Lausanne). 2021; 8: 718299. Published 2021 Sep 23. doi: 10.3389/fmed.2021.718299
113. Hayat Syed M.K., Bruck O., Kumar A., Surani S. Acute exacerbation of interstitial lung disease in the intensive care unit: Principles of diagnostic evaluation and management. World J Crit Care Med. 2023 Jun 9; 12(3): 153 - 164. doi: 10.5492/wjccm.v12.i3.153. PMID: 37397591; PMCID: PMC10308341.
114. Jang H.J., Yong S.H., Leem A.Y., Lee S.H., Kim S.Y., Lee S.H., Kim E.Y., Chung K.S., Jung J.Y., Kang Y.A., Kim Y.S., Chang J., Park M.S. Corticosteroid responsiveness in patients with acute exacerbation of interstitial lung disease admitted to the emergency department. Sci Rep. 2021 Mar 11; 11(1): 5762. doi: 10.1038/s41598-021-85539-1. PMID: 33707643; PMCID: PMC7952556.
115. Fiddler Ch.A., Simler N., Thillai M., Parfrey H. Use of mycophenolate mofetil and azathioprine for the treatment of chronic hypersensitivity pneumonitis-A single-centre experience. Clin. Respir. J. 2019; 13(12): 791 - 794. doi: 10.1111/crj.13086.
116. Morisset, Julie et al. "Use of Mycophenolate Mofetil or Azathioprine for the Management of Chronic Hypersensitivity Pneumonitis." Chest vol. 151,3 (2017): 619 - 625. doi: 10.1016/j.chest.2016.10.029.
117. Ferreira, Marion et al. "Efficacy and safety of rituximab in patients with chronic hypersensitivity pneumonitis (cHP): A retrospective, multicentric, observational study." Respiratory medicine vol. 172 (2020): 106146. doi: 10.1016/j.rmed.2020.106146.
118. Keir, Gregory J. et al. "Rituximab in severe, treatment-refractory interstitial lung disease." Respirology (Carlton, Vic.) vol. 19,3 (2014): 353-9. doi: 10.1111/resp.12214
119. Tzilas V., Tzouvelekis A., Bouros E. et al. Clinical experience with antifibrotics in fibrotic hypersensitivity pneumonitis: a 3-year real-life observational study. ERJ Open Res. 2020; 6(4): 00152-2020. doi: 10.1183/23120541.00152-2020.
120. Schaeffer M.R., Molgat-Seon Y., Ryerson C.J., Guenette J.A. Supplemental oxygen for the management of dyspnea in interstitial lung disease. Curr. Opin. Support. Palliat. Care. 2019; 13(3): 174 - 178. doi: 10.1097/SPC.0000000000000434.
121. Ramadurai D., Riordan M., Graney B. et al. The impact of carrying supplemental oxygen on exercise capacity and dyspnea in patients with interstitial lung disease. Respir. Med. 2018; 138: 32 - 37. doi: 10.1016/j.rmed.2018.03.025.
122. Nocturnal Oxygen Therapy Trial Group. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: a clinical trial. Ann Intern Med 1980; 93: 391 - 398.
123. Long-term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema: report of the Medical Research Council Working Party. Lancet 1981; 1: 681 - 686.
124. Cuerpo S., Palomo M., Hernandez-Gonzalez F. et al. Improving home oxygen therapy in patients with interstitial lung diseases: application of a noninvasive ventilation device. Ther. Adv. Respir. Dis. 2020; 14: 1753466620963027. doi: 10.1177/1753466620963027.
125. Faverio P., De Giacomi F., Bonaiti G., et al. Management of Chronic Respiratory Failure in Interstitial Lung Diseases: Overview and Clinical Insights. Int. J. Med. Sci. 2019; 16 (7): 967 - 980. doi: 10.7150/ijms.32752.
126. Diaz de Teran T., Barbagelata E., Cilloniz C., et al. Non-invasive ventilation in palliative care: a systematic review. Minerva Med. 2019; 110 (6): 555 - 563. doi: 10.23736/S0026-4806.19.06273-6.
127. Dreher M., Ekkernkamp E., Schmoor C., et al. Pulmonary rehabilitation and noninvasive ventilation in patients with hypercapnic interstitial lung disease. Respiration 2015; 89(3): 208-13. doi: 10.1159/000369862.
128. Huapaya J.A., Wilfong E.M., Harden C.T. et al. Risk factors for mortality and mortality rates in interstitial lung disease patients in the intensive care unit. Eur. Respir. Rev. 2018; 27 (150): 180061. doi: 10.1183/16000617.0061-2018.
129. Клинические рекомендации "Трансплантация легких, трансплантация комплекса сердце - легкие, наличие трансплантированного легкого, наличие трансплантированного комплекса сердце - легкие, отмирание и отторжение трансплантата легких, отмирание и отторжение сердечно - легочного трансплантата" Российского трансплантологического общества (2020 г.) [https://transpl.ru/upload/medialibrary/6a0/6a0a20b1432851f752a1f40cc9fd6981.pdf]
130. Weill D., Benden C., Corris P.A. et al. A consensus document for the selection of lung transplant candidates: 2014-an update from the Pulmonary Transplantation Council of the International Society for Heart and Lung Transplantation. J. Heart. Lung Transplant. 2015; 34: 1 - 15. doi: 10.1016/j.healun.2014.06.014.
131. Kern R.M., Singer J.P., Koth L. et al. Lung transplantation for hypersensitivity pneumonitis. Chest 2015; 147: 1558 - 1565.
132. Khor Y.H., Farooqi M., Hambly N., Johannson K.A., Marcoux V., Fisher J.H., Assayag D., Manganas H., Khalil N., Kolb M., Ryerson C.J.; Austin ILD Registry and CARE-PF Investigators. Trajectories and Prognostic Significance of 6-Minute Walk Test Parameters in Fibrotic Interstitial Lung Disease: A Multicenter Study. Chest. 2023 Feb; 163(2): 345 - 357. doi: 10.1016/j.chest.2022.08.2233. Epub 2022 Sep 8. PMID: 36089070.
133. Otake K., Misu S., Fujikawa T., Sakai H., Tomioka H. Exertional Desaturation Is More Severe in Idiopathic Pulmonary Fibrosis Than in Other Interstitial Lung Diseases. Phys Ther Res. 2023; 26(1): 32 - 37. doi: 10.1298/ptr.E10218. Epub 2023 Feb 14. PMID: 37181481; PMCID: PMC10169312.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
1
Авдеев С.Н.
Заведующий кафедрой пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); заведующий клиническим отделом, заместитель директора по научной работе Федерального государственного бюджетного учреждения "Научно-исследовательский институт пульмонологии" Федерального медико-биологического агентства Российской Федерации, член-корреспондент Российской Академии наук, профессор, д.м.н.
2
Айсанов З.Р.
Профессор кафедры пульмонологии Федерального государственного бюджетного образовательного учреждения высшего образования "Российский национальный исследовательский медицинский университет имени Н.И. Пирогова" Министерства здравоохранения Российской Федерации, д.м.н.
3
Визель А.А.
заведующий кафедрой фтизиопульмонологии Казанского государственного медицинского университета, главный внештатный пульмонолог Министерства здравоохранения Республики Татарстан, профессор, д.м.н.,
4
Демко И.В.
заведующая кафедрой внутренних болезней и иммунологии с курсом постдипломного образования "Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого", главный пульмонолог-аллерголог Сибирского федерального округа, профессор, д.м.н.
5
Илькович М.М.
Заведующий кафедрой пульмонологии ФПО ПСПб ГМУ имени акад. И.П. Павлова, директор клиники НИИ интерстициальных и орфанных заболеваний легких, д.м.н., профессор
6
Киняйкин М.Ф.
заведующая краевым пульмонологическим центром государственного бюджетного учреждения здравоохранения "Приморская краевая клиническая больница N 1", доцент кафедры госпитальной терапии Федерального государственного бюджетного образовательного учреждения высшего образования "Тихоокеанский государственный медицинский университет" Министерства здравоохранения Российской Федерации, профессор Российской Академии естественных наук, к.м.н.
7
Лещенко И.В.
профессор кафедры фтизиатрии, пульмонологии и торакальной хирургии Федерального государственного бюджетного образовательного учреждения высшего образования "Уральский государственный медицинский университет" Министерства здравоохранения Российской Федерации, д.м.н.
8
Орлова Г.П.
ведущий научный сотрудник Научно-исследовательского института интерстициальных и орфанных заболеваний легких Федерального государственного бюджетного образовательного учреждения высшего образования "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации, д.м.н.
9
Самсонова М.В.
Заведующая лабораторией патологической анатомии и иммунологии Федерального государственного бюджетного учреждения "Научно-исследовательский институт пульмонологии" Федерального медико-биологического агентства Российской Федерации, д.м.н.
10
Титова О.Н.
главный пульмонолог Комитета по здравоохранению Санкт-Петербурга и Северо-Западного федерального округа, директор Научно-исследовательского института пульмонологии Федерального государственного бюджетного образовательного учреждения высшего образования "Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова" Министерства здравоохранения Российской Федерации, профессор, д.м.н.
11
Трушенко Н.В.
Ассистент кафедры пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); научный сотрудник Федерального государственного бюджетного учреждения "Научно-исследовательский институт пульмонологии" Федерального медико-биологического агентства Российской Федерации, к.м.н.
12
Трофименко И.Н.
зав. кафедрой клинической аллергологии и пульмонологии Иркутской государственной медицинской академии последипломного образования, филиала Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования Российская медицинская академия непрерывного профессионального образования Министерства здравоохранения Российской Федерации, доцент, д.м.н.
13
Тюрин И.Е.
руководитель кафедры лучевой диагностики, лучевой терапии и медицинской физики Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования Российская медицинская академия непрерывного профессионального образования Министерства здравоохранения Российской Федерации, ведущий научный сотрудник отдела лучевой диагностики российского онкологического цента им. Н.Н. Блохина, главный внештатный специалист по лучевой диагностике Министерства здравоохранения РФ, профессор, д.м.н.
14
Федотов В.Д.
главный внештатный специалист-пульмонолог Министерства здравоохранения Нижегородской области, доцент кафедры госпитальной терапии им. В.Г. Вогралика Федерального государственного бюджетного образовательного учреждения высшего образования "Приволжский исследовательский медицинский университет" Министерства здравоохранения Российской Федерации, к.м.н.
15
Черняев А.Л.
Заведующий отделом патологии Федерального государственного бюджетного учреждения "Научно-исследовательский институт пульмонологии" Федерального медико-биологического агентства Российской Федерации, профессор, д.м.н.
16
Черняк Б.А.
профессор кафедры клинической аллергологии и пульмонологии Иркутской государственной медицинской академии последипломного образования, филиала Федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования Российская медицинская академия непрерывного профессионального образования Министерства здравоохранения Российской Федерации, профессор, заслуженный врач РФ, член экспертного совета, председатель Иркутского отделения Российского респираторного общества, д.м.н.
17
Чикина С.Ю.
Ассистент кафедры пульмонологии Федерального государственного автономного образовательного учреждения высшего образования "Первый Московский государственный медицинский университет имени И.М. Сеченова" Министерства здравоохранения Российской Федерации (Сеченовский Университет); к.м.н.
18
Шмелев Е.И.
Заведующий отделом дифференциальной диагностики Федеральное государственное бюджетное научное учреждение "Центральный научно-исследовательский институт туберкулеза", д.м.н., заслуженный деятель науки Российской Федерации
Конфликт интересов:
Никто из членов рабочей группы не имеет конфликта интересов, связанного с разработкой и внедрением в клиническую практику данных клинических рекомендаций.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 10 лет.
Методы, использованные для оценки качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости в соответствии с рейтинговой схемой.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-терапевты
2. Врачи общей практики (семейные врачи)
3. Врачи-пульмонологи
4. Врачи-рентгенологи
5. Врачи-патологоанатомы
6. Врачи по медицинской реабилитации
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
1. Авдеев С.Н. Гиперчувствительный пневмонит. Пульмонология. 2021. 31 (1): 88 - 99. https://doi.org/10.18093/0869-0189-2021-31-1-88-99.
2. Авдеев С.Н., Чикина С.Ю., Тюрин И.Е. и соавт. Хронические фиброзирующие интерстициальные заболевания легких с прогрессирующим фиброзным фенотипом: резолюция Междисциплинарного Совета экспертов. Пульмонология. 2021. 31 (4): 505 - 510. https://doi.org/10.18093/0869-0189-2021-31-4-505-510.
3. Инструкция по медицинскому применению препарата Варгатеф(R) /электронный ресурс/ Доступно по ссылке: https://lk.regmed.ru/Register/EAEU_SmPC
Характеристики острого и хронического ГП
Источник: Vasakova M., Morell F., Walsh S. et al. Hypersensitivity pneumonitis: perspectives in diagnosis and management. Am. J. Respir. Crit. Care Med. 2017; 196: 680 - 689.
Авдеев С.Н. Гиперчувствительный пневмонит / С.Н. Авдеев // Пульмонология. - 2021. - Т. 31. - N 1. - С. 88 - 99. - DOI 10.18093/0869-0189-2021-31-1-88-99.
Течение ГП
Клиническое течение
Изменение КТ органов грудной полости
Морфологические изменения
Острый ГП (длительность симптомов обычно менее 6 мес.)
Полностью обратимый
Возможно полное разрешение
Симптомы связаны с экспозицией, могут разрешиться полностью после элиминации антигена (обычно при профессиональном ГП)
"Матовое стекло" в верхних и средних отделах,
Нечетко ограниченные центрилобулярные узелки,
Мозаичное уплотнение
Воздушные ловушки
Реже - консолидаты
Воспалительный (клеточный) ГП
Лимфоплазмлоцитарные/мононуклеарные (макрофагальные) инфильтраты
Бронхоцентричные (перибронхиолярные) лимфоцитарные инфильтраты
Плохоограниченные гранулемы
Хронический ГП (длительность симптомов обычно > 6 мес.)
Потенциально обратимый (неполностью)
Риск прогрессирования
Фиброз в верхних и средних отделах,
Перибронховаскулярный фиброз,
"Сотовое легкое",
Мозаичное уплотнение,
Воздушные ловушки,
Центрилобулярные узелки,
Относительная сохранность нижних отделов
Фибротический ГП
ОИП-подобный
НСИП-фибротический
Бронхоцентрический фиброз
Неклассифицируемый тип
На фоне фиброза могут быть признаки воспалительного ГП
Рентгенографические признаки ГП на разных стадиях заболевания
Источник: Glazer C.S., Rose C.S., Lynch D.A. Clinical and radiologic manifestations of hypersensitivity pneumonitis. J Thorac Imaging. 2002; 17 (4): 261-72
Рентгенографические признаки ГП на ранних стадиях заболевания
Рентгенографические признаки ГП на поздних стадиях заболевания
- Множественные плохо очерченные небольшие (менее 5 мм) очаги в обоих легких, часто при отсутствии изменений в области верхушек и в основании легких
- Изменения паренхимы легкого: обычно представлены диффузным снижением воздушности легких по типу матового стекла, равномерным или в виде рассеянных участков, могут напоминать картину отека легких. Значительно реже наблюдаются участки консолидации
- Картина ретикулярных изменений в виде ячеистой деформации легочного рисунка в верхних и средних легочных зонах.
- Фиброзные изменения часто характеризуются ретикулярными изменениями в верхних и средних легочных зонах, часто с одновременным нарушением расположения легочных сосудов (нарушением архитектоники легкого)
- Признаки уменьшения объема легких или отдельных долей, особенно важные при поражении верхних долей легких
- Признаки легочной артериальной гипертензии (митральная конфигурация сердечной тени, расширение сосудов в корнях легких и, часто, обеднение периферического сосудистого рисунка).
Технические требования к проведению КТ органов грудной полости у пациентов с ГП
Источник: [1, 33]
- тонкие томографические срезы, коллимация <= 1,5 мм), субмиллиметровые срезы повышают качество многопроекционных реформаций;
- алгоритм высокого пространственного разрешения;
- спиральное (объемное) сканирование
- область сканирования: 2 - 3 см выше верхушек легких - до окончания реберно-диафрагмальных синусов;
- сканирование в каудокраниальном направлении (от диафрагмы к верхушкам) для снижения вероятности артефактов от непроизвольных дыхательных движений;
- сканирование на спокойном (не форсированном) задержанном вдохе;
- сканирование на выдохе (экспираторная КТ) обычно не требуется, но может быть выполнено для уточнения изменений в легочной ткани при стандартном сканировании, в частности оценки симптома мозаичной плотности;
- сканирование в положении на животе (прон-позиция) обычно не требуется, но выполняется рентгенологом для дифференциальной диагностики изменений в гравитационно зависимых отделах легких;
- внутривенное контрастирование обычно не требуется, за исключением случаев клинически обоснованных подозрений на тромбоэмболию легочной артерии.
Компьютерно-томографические диагностические категории нефибротического ГП
Источник: Raghu G., et al. Am. J. Respir. Crit. Care Med. 2020; V. 202, Iss. 3: p.p. e36 - e69.
Типичный ГП
Возможный ГП
Сомнительный (неопределенный) ГП
Описание
Паттерн типичного ГП повышает вероятность клинического диагноза ГП. В него входит: а) как минимум один ВРКТ-симптом, указывающий на инфильтрацию паренхимы и б) как минимум один ВРКТ-симптом, указывающий на патологию мелких дыхательных путей; оба признака должны быть распределены диффузно.
Паттерны возможного ГП неспецифичны, но описаны при ГП.
Не описан
Признаки
ВРКТ-признаки паренхиматозной инфильтрации:
- "матовое стекло";
- мозаичная воздушность.
ВРКТ-признаки патологии мелких дыхательных путей:
- центрилобулярные узелки;
- "воздушные ловушки".
Распределение патологии паренхимы:
- диффузное в краниокаудальном направлении (с некоторой сохранностью базальных отделов или без нее);
- диффузное в аксиальном направлении.
Патология паренхимы:
- однородное и слабо выраженное "матовое стекло";
- участки консолидации; - кисты.
Распределение патологии паренхимы:
- диффузное в краниокаудальном направлении (возможно преобладание в базальных отделах);
- диффузное в аксиальном направлении (возможно перибронховаскулярное).
Не описан
Компьютерно-томографические диагностические категории фибротического ГП
1. Источник: Raghu G., et al. Am. J. Respir. Crit. Care Med. 2020; V. 202, Iss. 3: p.p. e36 - e69.
Типичный ГП
Возможный ГП
Сомнительный (неопределенный) ГП
Описание
Паттерн типичного ГП повышает вероятность клинического диагноза ГП. В него входит: а) ВРКТ-паттерн легочного фиброза (см. ниже) и б) как минимум один ВРКТ-симптом, указывающий на патологию мелких дыхательных путей.
О паттернах возможного ГП говорят, когда ВРКТ-паттерн и/или распределение легочного фиброза отличается от типичного паттерна ГП; фиброз должен сопровождаться признаками патологии мелких дыхательных путей.
О паттерне сомнительного ГП говорят, если данные КТ не соответствуют ни типичному, ни возможному паттернам ГП.
Признаки
ВРКТ-признаки легочного фиброза обычно состоят из линейных уплотнений неправильной формы либо грубых ретикулярных изменений с нарушением структуры легочной ткани; тракционные бронхоэктазы и "сотовое легкое" могут присутствовать, но не преобладают.
Распределение фиброза может быть: - хаотичным как в краниокаудальном, так и в аксиальном направлениях или - с преобладанием в средних отделах легких, или - преобладать в верхних и средних отделах при относительной сохранности нижних отделов легких.
ВРКТ-признаки патологии мелких дыхательных путей: - центрилобулярные узелки и/или "матовое стекло"; - мозаичная воздушность легочной ткани, паттерн "трех плотностей" и/или "воздушные ловушки" (часто в долевом распределении).
Варианты паттерна легочного фиброза: - паттерн ОИП: базальное и субплевральное распределение "сотового легкого" с тракционными бронхоэктазами или без них (в соответствии с международными клиническими рекомендациями по диагностике ИЛФ 2018 г.) [34]; - слабо выраженные признаки легочного фиброза на фоне распространенного "матового стекла".
Варианты распределения легочного фиброза:
- в аксиальном направлении: перибронховаскулярное, субплевральное; - в краниокаудальном направлении: преобладание в верхних отделах легких, соответствующее поражению мелких дыхательных путей; - центрилобулярные узелки; - паттерн "трех плотностей" и/или воздушные ловушки.
Возможные паттерны: - паттерн ОИП (в соответствии с международными клиническими рекомендациями по диагностике ИЛФ 2018 г.) [34]; - паттерн вероятной ОИП (в соответствии с международными клиническими рекомендациями по диагностике ИЛФ 2018 г.) [34]; - паттерн фиброзирующей НСИП; - паттерн организующейся пневмонии; - истинно неопределенный паттерн.
Гистологические диагностические категории нефибротического ГП
Источник: Raghu G., et al. Am. J. Respir. Crit. Care Med. 2020; V. 202, Iss. 3: p.p. e36 - e69.
Типичный ГП
Возможный ГП
Сомнительный (неопределенный) ГП
1. Интерстициальная пневмония "клеточного" типа: - бронхиолоцентрическое распределение; - паттерн, подобный НСИП клеточного типа; - преобладание лимфоцитов.
2. Бронхиолит "клеточного" типа: - преобладание лимфоцитов, но не более чем перибронхиолярные лимфоидные фокусы с герминативным центром; - паттерн организующейся пневмонии с тельцами Массона; - "пенистые" макрофаги в терминальных дыхательных путях.
3. Плохо сформированные гранулемы без некроза; - рыхлые скопления эпителиоидных клеток и/или гигантских многоядерных клеток +/- цитоплазматические включения; - расположены в перибронхиолярном интерстиции, терминальных дыхательных путях и/или участках организующейся пневмонии.
4. Отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
1. Интерстициальная пневмония "клеточного" типа: - бронхиолоцентрическое распределение; - паттерн, подобный НСИП клеточного типа; - преобладание лимфоцитов.
2. Бронхиолит "клеточного" типа: - преобладание лимфоцитов, но не более чем перибронхиолярные лимфоидные фокусы с герминативным центром; - паттерн организующейся пневмонии с тельцами Массона; - "пенистые" макрофаги в терминальных дыхательных путях.
3. Отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
- Признаки 1 и 2 из первого столбца; - Отдельные паттерны: паттерн НСИП клеточного типа, паттерн организующейся пневмонии или перибронхиолярная метаплазия без других признаков фиброзирующего ГП
И
отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
Гистологические диагностические категории фибротического ГП
Источник: Raghu G., et al. Am. J. Respir. Crit. Care Med. 2020; V. 202, Iss. 3: p.p. e36 - e69.
Типичный ГП
Возможный ГП
Сомнительный (неопределенный) ГП
1. Хроническая фиброзирующая интерстициальная пневмония: - нарушение архитектоники легочной паренхимы, фибробластические фокусы +/- субплевральное "сотовое легкое"; - паттерн, подобный фиброзирующей НСИП.
2. Бронхоцентрический фиброз: - +/- перибронхиальная метаплазия; - +/- "фиброзные мостики" (между субплевральными и центриацинарными или соседними центриацинарными фокусами фиброза).
3. Плохо сформированные гранулемы без некроза: -+/- интерстициальная пневмония "клеточного" типа; - +/- бронхиолит "клеточного" типа; - +/- паттерн организующейся пневмонии
И
Отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
1. Хроническая фиброзирующая интерстициальная пневмония: - нарушение архитектоники легочной паренхимы, фибробластические фокусы +/- субплевральное "сотовое легкое"; - паттерн, подобный фиброзирующей НСИП.
2. Бронхоцентрический фиброз: - +/- перибронхиальная метаплазия; - +/- "фиброзные мостики" (между субплевральными и центриацинарными или соседними центриацинарными фокусами фиброза).
+/- интерстициальная пневмония "клеточного типа"
+/- паттерн организующейся пневмонии
+/- бронхиолит "клеточного" типа
И
Отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
1. Хроническая фиброзирующая интерстициальная пневмония: - нарушение архитектоники легочной паренхимы, фибробластические фокусы +/- субплевральное "сотовое легкое" - паттерн, подобный фиброзирующей НСИП +/- интерстициальная пневмония "клеточного типа" +/- бронхиолит "клеточного" типа
+/- паттерн организующейся пневмонии
И
Отсутствие признаков альтернативного заболевания; - преобладание плазматических клеток над лимфоцитами; - выраженная лимфоидная гиперплазия; - множественные хорошо сформированные гранулемы или гранулемы с некрозом; - аспирированные частицы.
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
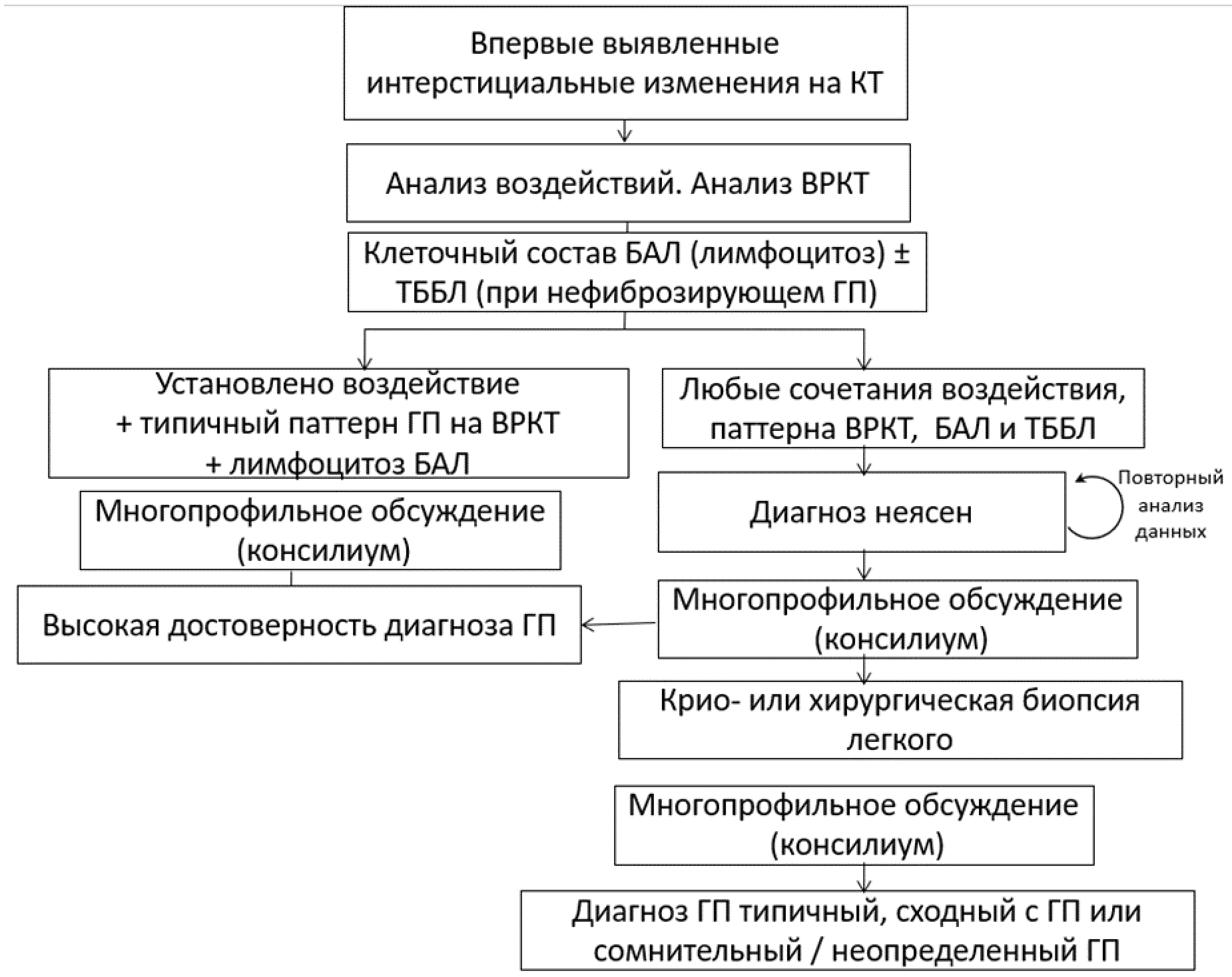
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Гиперчувствительный пневмонит - заболевание легких, возникающее в результате чрезмерной реакции иммунной системы на многократные воздействия на органы дыхания человека различных аллергенов и других неблагоприятных факторов внешней среды. При благоприятном течении гиперчувствительного пневмонита на фоне устранения неблагоприятных воздействий и/или лечения болезнь заканчивается полным выздоровлением; в некоторых случаях, чаще при продолжении неблагоприятного воздействия или несвоевременном начале лечения, болезнь может прогрессировать и приводить к уплотнению (фиброзированию) легочной ткани и необратимому прогрессирующему снижению легочной функции, в первую очередь, способности легких доставлять кислород ко всем органам. Гиперчувствительный пневмонит чаще развивается во второй половине жизни, однако может возникнуть и в более молодом возрасте.
Факторами, с которым связывают риск развития гиперчувствительного пневмонита, являются:
- контакт с пером птиц, включая перо подушки, перьевые и пуховые изделия, птицеводство;
- контакт с сельскохозяйственными и другими животными (мех, шкуры, животноводство);
- контакт с плесенью, включая увлажнители, кондиционеры, бассейны, джакузи, заплесневелое сено, овоще- и зернохранилища, компост, почву, отходы деревообработки, духовые музыкальные инструменты, аппараты для СРАР-терапии, дрожжи, производство сыра, вина, пива, и т.д.;
- контакт с органической пылью (растительная пыль, переработка раковин моллюсков, рыбьей чешуи, мука, соя и т.д.);
- контакт с некоторыми видами бактерий, которые размножаются во влажной среде и загрязняют бассейны, джакузи, кондиционеры, увлажнители воздуха, сточные воды и т.д.;
- контакт с неорганическими соединениями (средства бытовой химии, лак для волос, стоматологические материалы, акрил, эпоксидные смолы, металлы и т.д.).
Симптомы гиперчувствительного пневмонита
Симптомы гиперчувствительного пневмонита неспецифичны и аналогичны проявлениям многих других бронхо-легочных заболеваний: кашель, одышка при физической нагрузке (сначала при более высокой, затем по мере прогрессирования заболевания при меньшей нагрузке), слабость, иногда снижение веса тела, повышение температуры. Заболевание может начинаться остро в течение нескольких дней или недель либо постепенно, в течение месяцев или лет. Нередко первые проявления самостоятельно исчезают или уменьшаются без лечения через несколько дней или недель, но с течением времени могут возобновляться либо усиливаться. После успешного лечения также возможны рецидивы.
Для подтверждения диагноза необходимо вспомнить все возможные неблагоприятные воздействия, даже те, которым Вы подвергались достаточно давно. Помимо этого, для уточнения характера и тяжести поражения легких необходимо выполнить:
При подозрении на гиперчувствительный пневмонит минимальный план обследования включает:
- исследование функции внешнего дыхания (спирография, а при возможности - бодиплетизмография и исследование диффузионной способности легких);
- компьютерную томографию легких. Обычная рентгенограмма легких не подходит для диагностики любых интерстициальных заболеваний легких, включая гиперчувствительный пневмонит, так как не обладает достаточной разрешающей способностью.
Если после тщательного расспроса, осмотра и проведенных исследований у врача остаются сомнения в диагнозе, то проводится биопсия легких. Биопсия - процедура, при которой хирург в ходе хирургической операции получает маленький фрагмент легочной ткани, который затем исследуется под микроскопом. Иногда биопсию можно получить более простым и щадящим способом - при бронхоскопии, однако полученные таким путем фрагменты легочной ткани имеют очень маленький размер и не всегда позволяют оценить изменения в легких.
Лечение гиперчувствительного пневмонита
Лечение гиперчувствительного пневмонита начинается с устранения предполагаемого воздействия и с системной противовоспалительной терапии, к препаратам которой в данном случае относятся кортикостероиды системного действия, микофеноловая кислота**, азатиоприн** и ритуксимаб**. Если, несмотря на такое лечение одышка прогрессирует, легочная функция продолжает снижаться, а на компьютерных томограммах легких увеличиваются фиброзные изменения в легких, то к лечению добавляют нинтеданиб (антифибротическая терапия), который может замедлить дальнейшее ухудшение состояния. Узнайте у своего лечащего врача о возможности наблюдения и лечения в научно-исследовательском учреждении с опытом лечения интерстициальных заболеваний легких, где могут быть доступны современные лекарственные препараты.
При развитии хронической дыхательной недостаточности с развитием гипоксемии (низкого содержания кислорода в крови) назначают длительную кислородотерапию с помощью концентраторов кислорода. Помимо стационарных концентраторов кислорода, имеющих большие размеры и вес, сегодня доступны портативные концентраторы, благодаря которым пациент может выходить из дома на прогулки.
Всем больным с гиперчувствительным пневмонитом необходима легочная реабилитация с применением дыхательных упражнений, которые способствуют уменьшению одышки и улучшению общего состояния.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ
И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ СОСТОЯНИЯ ПАЦИЕНТА,
ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
ВОПРОСНИК ДЛЯ УСТАНОВЛЕНИЯ
ПОТЕНЦИАЛЬНОГО ЭТИОТРОПНОГО ФАКТОРА ХРОНИЧЕСКОГО ГП
Название: Вопросник воздействий при хроническом гиперчувствительном пневмоните
Оригинальное название: Chronic Hypersensitivity Pneumonitis Exposure Questionnaire
Источник: Barnes Y., Morisset J., Molyneaux Ph. et al. A systematically derived exposure assessment instrument for chronic hypersensitivity pneumonitis. Chest 2020; 157(6): 1506 - 1512. doi: 10.1016/j.chest.2019.12.018.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить):_____________________________________________________________
Назначение: выявление потенциального этиотропного фактора хронического ГП у данного пациента
Вопросник воздействий при хроническом гиперчувствительном пневмоните
Часть 1. Вспомните места, где вы регулярно проводите время (дом, работа, другие места, например, гараж, подвал), и отметьте воздействия, которым вы подвергаетесь регулярно.
Видимая плесень
Птицы/птичьи перья/помет
Запах плесени
Заплесневелое сено/силос
Повреждение водой, влажность, протечка
Органические вещества (навоз, компост)
Увлажнители/кондиционеры с водными резервуарами
Изоцианаты (аэрозольная краска, полиуретан, лак)
Джакузи/бассейны/спа
Жидкости для металлообработки (хладоагенты, смазки)
Пуховые или перьевые изделия
Овощеводство (выращивание грибов, сортировка лука)
Испарения/газы/дымы
Производство продуктов питания (сыр)
Духовые музыкальные инструменты
Деревообработка (древесная пыль, плесень на дереве, пробка, клен)
Подвергались ли вы каким-либо другим воздействиям?
Часть 2. Для каждого воздействия, которое вы отметили в части 1, укажите следующие детали:
Воздействие
Дата начала воздействия
(месяц/год)
_____/_________
_____/_________
_____/_________
Дата начала симптомов
(месяц/год)
_____/_________
_____/_________
_____/_________
Уменьшились ли симптомы после устранения воздействия
ДА/НЕТ
ДА/НЕТ
ДА/НЕТ
Как долго продолжалось воздействие?
<1 месяца
1 - 3 месяца
3 - 6 месяцев
6 - 12 месяцев
1 - 5 лет
> 5 лет
<1 месяца
1 - 3 месяца
3 - 6 месяцев
6 - 12 месяцев
1 - 5 лет
> 5 лет
<1 месяца
1 - 3 месяца
3 - 6 месяцев
6 - 12 месяцев
1 - 5 лет
> 5 лет
Ключ (интерпретация): выбранные пациентом воздействия с учетом сроков, длительности воздействия и связи с симптомами заболевания могут рассматриваться в качестве потенциальных этиотропных факторов гиперчувствительного пневмонита у данного пациента.
Пояснения. Вопросник помогает пациенту вспомнить те воздействия, которым он регулярно подвергался, а также установить сроки и длительность этих воздействий и оценить их потенциальную роль в развитии заболевания у данного пациента.
Приложение Г2
ШКАЛА
МЕДИЦИНСКОГО ИССЛЕДОВАТЕЛЬСКОГО СОВЕТА ВЕЛИКОБРИТАНИИ
(MEDICAL RESEARCH COUNCIL) (ШКАЛА MRC)
Источник: Medical Research Council. Committee on research into chronic bronchitis: instruction for use on the questionnaire on respiratory symptoms. Devan, England: W.J. Holman, 1966.
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить):
Назначение: оценка тяжести одышки при повседневной физической активности
Содержание (шаблон):
Балл
Тяжесть
Описание
1
Нет
Одышка не беспокоит, за исключением очень интенсивной нагрузки
2
Легкая
Одышка при быстрой ходьбе или подъеме на небольшую возвышенность
3
Средняя
Одышка заставляет идти медленнее по сравнению с другими людьми того же возраста либо необходимо останавливаться при ходьбе в своем темпе по ровной местности
4
Тяжелая
Необходимо останавливаться из-за одышки через 100 м или через несколько минут спокойной ходьбы по ровной местности
5
Очень тяжелая
Одышка не позволяет выходить из дома либо появляется при одевании и раздевании
Ключ (интерпретация): более высокий балл соответствует более тяжелой одышке при повседневной физической активности.
Пояснения: шкала MRC используется для оценки одышки пациента и мониторирования его состояния на фоне лечения, в частности, легочной реабилитации.
