"Клинические рекомендации "Трансплантация сердца, наличие трансплантированного сердца, отмирание и отторжение трансплантата сердца"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ТРАНСПЛАНТАЦИЯ СЕРДЦА, НАЛИЧИЕ ТРАНСПЛАНТИРОВАННОГО СЕРДЦА,
ОТМИРАНИЕ И ОТТОРЖЕНИЕ ТРАНСПЛАНТАТА СЕРДЦА
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: Z94.1, T86.2
Год утверждения (частота пересмотра): 2023
Возрастная категория: Взрослые, Дети
Пересмотр не позднее: 2025
ID: 762
Разработчик клинической рекомендации
- Российское трансплантологическое общество
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
АВК - аппарат вспомогательного кровообращения
АГ - артериальная гипертония
АД - артериальное давление
Анти-HLA - антитела к антигенам главного комплекса гистосовместимости человека
БКАПС - болезнь коронарных артерий пересаженного сердца
БАБ - бета-адреноблокатор
АРА - ангиотензина II рецепторов антагонист
ВА ЭКМО - вено-артериальная экстракорпоральная мембранная оксигенация
ДД - диуретики
ДЗЛК - давление заклинивания легочной артерии
ДМПК - длительная механическая поддержка кровообращения
АПФ - ангиотензин превращающий фермент
КАГ - коронарография
КДО - конечный диастолический объем
КСО - конечный систолический объем
КТ - компьютерная томография
ЛЖ - левый желудочек
МРТ - магнитно-резонансная томография
ОРИТ - отделение реанимации и интенсивной терапии
СД - сахарный диабет
СИ - сердечный индекс
СКФ - скорость клубочковой фильтрации
ТПГ - транспульмональный градиент
ТС - трансплантация сердца
ОТТС - ортотопическая трансплантация сердца
ФВ - фракция выброса
ФВЛЖ - фракция выброса левого желудочка
ФК - функциональный класс
ЦНС - центральная нервная система
ХСН - хроническая сердечная недостаточность
ESC - Европейское общество кардиологов
ISHLT - Международное общество трансплантации сердца и легких
HLA - (англ., human leukocyte antigen, лейкоцитарные антигены человека) главный комплекс гистосовместимости человека
NYHA - Нью-Йоркская ассоциация сердца
Термины и определения
Трансплантация сердца - кардиохирургическая операция, в результате которой патологически измененное сердце реципиента заменяется на удовлетворительно функционирующее сердце донора.
Отторжение трансплантированного сердца - патологический процесс, при котором иммунная система реципиента распознает сердечный трансплантат как чужеродный объект и активируется система гуморального и/или клеточного воспалительного ответа, что может привести к выраженной дисфункции органа.
Механическая поддержка кровообращения - хирургический метод лечения тяжелой сердечной недостаточности, при котором центральная гемодинамика поддерживается благодаря работе имплантируемого или внешнего устройства механической поддержки кровообращения на основе электрического насоса.
Реципиент трансплантированного сердца - пациент, у которого была выполнена трансплантация сердца.
Потенциальный реципиент сердца - пациент с показаниями к трансплантации сердца, включенный в лист ожидания.
Сердечная недостаточность - синдром, характеризующийся совокупностью симптомов, обусловленных неспособностью сердечно-сосудистой системы обеспечить ткани и органы пациента адекватным количеством крови. При первичной сердечной недостаточности причиной патологического состояния является нарушение функции миокарда или структурные изменения в сердце.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
В настоящее время, несмотря на достижения в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца (ОТТС) является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности (СН), существенно улучшающим прогноз и качество жизни [1, 2, 3].
Улучшение выживаемости без нежелательных событий у реципиентов сердца, обусловлено, в первую очередь, снижением периоперационной и ранней послеоперационной смертности [5]. Факторы, определяющие прогноз пациента, отличаются в зависимости от времени, прошедшего после операции. Факторами, влияющими на смертность и выживаемость пациентов в течение первого года после ОТТС, являются периоперационные (возраст и вес донора, длительность ишемии трансплантата, повторная трансплантация сердца, возраст реципиента, исходная тяжесть его состояния и необходимость в механической поддержке кровообращения в предоперационном и периоперационном периодах, легочная гипертензия в послеоперационном периоде, почечная недостаточность, количество трансплантаций, выполняемых трансплантологическим центром), а также инфекционные осложнения и отторжение трансплантата. Наибольший риск отторжения сердечного трансплантата - в течение первого года, но сохраняется пожизненно. В отдаленные сроки после трансплантации сердца основными причинами необратимой дисфункции сердечного трансплантата и гибели пациентов, помимо отторжения, являются болезнь коронарных артерий трансплантированного сердца и осложнения, связанные с приемом иммуносупрессивной терапии, - инфекции, артериальная гипертония, новообразования, нефропатия, сахарный диабет [6]. Реципиенты трансплантированного сердца получают медицинскую помощь и проходят плановые обследования в специализированных трансплантологических центрах, но находятся под наблюдением врачей-терапевтов участковых (врачей общей практики) и врачей-кардиологов по месту жительства. Своевременное выявление осложнений и сопутствующих заболеваний, а также проведение плановых скрининговых обследований являются факторами, в наибольшей степени определяющими прогноз и качество жизни реципиентов сердца, и здесь роль врачей первичного звена здравоохранения является ключевой.
Настоящие рекомендации предназначены для врачей-хирургов (трансплантологов), врачей-кардиологов и врачей широкого профиля, находятся в соответствии и не противоречат основным положениям рекомендаций Международного общества по трансплантации сердца и легких, а также рекомендациям Европейского общества кардиологов и Российского кардиологического общества, рекомендациям по количественной оценке структуры и функции камер сердца, рекомендациям по диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза, рекомендациям по функциональному состоянию почек и прогнозированию сердечно-сосудистого риска, рекомендациям по кардиоваскулярной профилактике, рекомендациям по прогнозированию и профилактике кардиальных осложнений внесердечных хирургических вмешательств у кардиологических пациентов, рекомендациям по эффективности и безопасности лекарственной терапии при первичной и вторичной профилактике сердечно-сосудистых заболеваний.
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Представлено описание технологии оказания медицинской помощи, предполагающей проведение обследований с целью выбора тактики ведения пациентов с сердечной недостаточностью в терминальной стадии, определения показаний для трансплантации сердца или имплантации устройств механической поддержки кровообращения, определения периоперационного риска и статуса очередности для включения пациентов в лист ожидания трансплантации сердца, а также стабилизацию клинического состояния и оценку возможности восстановления/реабилитации пациента после проведения операции ортотопической трансплантации сердца, ведение пациентов после выполненной трансплантации сердца.
Категория возрастная: взрослые, дети;
Пол: любой;
Фаза: компенсация/декомпенсация, острая;
Стадия: терминальная (Стражеско-Василенко IIБ - III ст.);
Осложнения: Сердечная недостаточность III - IV классов по функциональной классификации Нью-Йоркской ассоциации сердца (NYHA);
Вид медицинской помощи: ВМП, ОМС;
Условия оказания медицинской помощи: стационарно;
Форма оказания медицинской помощи: плановая, неотложная, экстренная.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основным показанием к трансплантации сердца и имплантации устройств механической поддержки кровообращения является критическая острая или декомпенсированная хроническая сердечная недостаточность, развившаяся у пациентов с кардиомиопатией, ишемической болезнью сердца, тяжелыми декомпенсированными заболеваниями клапанов сердца (при невозможности выполнения иных методов хирургического лечения), миокардитами, врожденными пороками сердца, а также другими заболеваниями сердца, которые существенно ограничивают физическую активность и сопровождаются риском смерти в течение года, превышающим 50%.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В настоящее время, несмотря на достижения в области фармакотерапии сердечно-сосудистых заболеваний, операция ортотопической трансплантации сердца (ОТТС) является общепризнанным "золотым" стандартом лечения терминальной СН, существенно улучшающим прогноз и качество жизни [1, 2, 3]. Ежегодно в мире выполняется более 4000 трансплантаций сердца, подавляющее большинство вмешательств - в странах Европы и Северной Америки [4, 7]. В России на протяжении последних лет отмечается значительный рост числа трансплантации сердца и других органов. На фоне увеличения общего количества трансплантаций сердца в нашей стране отмечается существенное снижение периоперационной смертности и улучшение выживаемости в отдаленном периоде [8]. По данным регистра Российского трансплантологического общества, в 2020 г. в РФ трансплантация сердца выполнялась в 16 клинических центрах [480]. Уровень донорской активности в 2020 г. составил 3.9 на 1 млн населения, при этом доля мультиорганных изъятий составила 74.6%, среднее число органов, полученных от одного эффективного донора - 2.9. В 2020 г. на фоне пандемии новой коронавирусной инфекции COVID-19 частота трансплантации сердца снизилась до уровня 2017 года и составила 251 операцию (1.7 на 1 млн населения), из них 6 трансплантаций сердца детям (несовершеннолетним). Трансплантации сердца выполнялись в 16 центрах, из них 190 (75.7%) выполнено в НМИЦ ТИО им. акад. В.И. Шумакова (Москва). В период 2012 - 2020 гг. в РФ по мере увеличения числа трансплантаций органов наблюдается увеличение числа пациентов в листах ожидания: трансплантации почки почти в 2 раза, печени - в 4.6 раза и сердца - в 1.8 раза, при этом средние сроки ожидания трансплантации органов практически не изменились. Смертность в листах ожидания в 2012 - 2019 гг. имеет тенденцию к снижению, в 2020 г. с учетом эпидемии COVID-19 была выше, чем в 2019 г. В листе ожидания трансплантации сердца в течение 2020 г. состояло 708 потенциальных реципиентов, из них 303 были включены в лист ожидания впервые в 2020 году. Показатель смертности в период ожидания трансплантации сердца в России составил 7.5% (53 пациента).
Согласно данным Федерального регистра в РФ, в 2020 г. было 19097 пациентов с трансплантированными органами (130.6 на 1 млн населения), из них после трансплантации сердца - 1524 (10.4 на 1 млн). С 2013 г. (за 7 лет) число пациентов с трансплантированными органами в РФ увеличилось на 1044 (123.3%).
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Данные рекомендации применимы для пациентов с первичным или вторичным поражением сердца, определяющим прогноз жизни при отсутствии сопутствующих заболеваний, которые могут повлиять на риск развития периоперационных осложнений или значимо ухудшить прогноз выживаемости в послеоперационном периоде.
Коды диагнозов заболеваний по МКБ-10, с формированием критической сердечной недостаточности, требующей хирургических методов лечения:
- T86.2 Отмирание и отторжение трансплантата сердца;
- Z94.1 Наличие трансплантированного сердца.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Критическая сердечная недостаточность может быть следствием острой или хронической недостаточности кровообращения.
Для классификации хронической недостаточности кровообращения в Российской Федерации используются функционально-морфологическая классификация Стражеско-Василенко, отражающая степень прогрессирования заболевания сердца, и Нью-Йоркская классификация функционального состояния (NYHA).
Согласно классификации Стражеско-Василенко, выделяют три стадии прогрессирования заболевания: I, II (А и Б) и III. Для I-й стадии характерно появление симптомов сердечной недостаточности только на фоне физической нагрузки и исчезновение в состоянии покоя. При стадии IIА отмечаются умеренные признаки недостаточности кровообращения в состоянии покоя лишь в одном из отделов сердечно-сосудистой системы в малом или большом круге кровообращения, которые купируются на фоне медикаментозной терапии, включающей диуретики, ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II, бета-адреноблокаторы и так называемые "калийсберегающие диуретики", обладающие антиминералкортикоидным действием - спиронолактон и эплеренон. Стадия IIБ характеризуется наличием признаков недостаточности кровообращения как в малом, так и большом кругах кровообращения, в той или иной степени сохраняющимся, несмотря на прием медикаментозной терапии. У пациентов с III-й стадией имеют место выраженные нарушения гемодинамики и признаки венозного застоя в обоих кругах кровообращения, а также значительные нарушения перфузии и метаболизма органов и тканей.
Функциональная классификация хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA, 1964) основана исключительно на функциональной оценке тяжести и включает четыре функциональных класса: I Ф.К. - ограничение в выполнении тяжелой физической нагрузки, обычная физическая нагрузка не сопровождается утомлением, слабостью, одышкой или сердцебиением; II Ф.К. - умеренное ограничение физической активности, в состоянии покоя симптомы отсутствуют, повседневная физическая нагрузка вызывает слабость, утомляемость, тахикардию, одышку и пр.; III Ф.К. - выраженное ограничение физической активности, симптомы отсутствуют в состоянии покоя, но появляются при физической нагрузке небольшой интенсивности; IV Ф.К. - невозможность выполнять какую-либо нагрузку без появления дискомфорта, симптомы сердечной недостаточности имеются в состоянии покоя.
Острая сердечная недостаточность - клинический синдром, характеризующийся быстрым развитием или утяжелением симптомов и признаков недостаточности кровообращения. Острая сердечная недостаточность предполагает необходимость незамедлительного оказания пациенту медицинской помощи.
В основе острой сердечной недостаточности могут лежать многочисленные сердечно-сосудистые и несердечные заболевания с вовлечением различных механизмов патогенеза, что следует учитывать при диагностике, стратификации риска и выборе подходов к лечению.
В настоящее время под эгидой Европейского общества кардиологов (ESC) создана классификация, в которой выделено 6 типов острой сердечной недостаточности:
- ESC-1. Острая декомпенсация ХСН:
Впервые выявленная СН или декомпенсированная ХСН;
Клинические признаки кардиогенного шока, отека легких и гипертонического криза отсутствуют.
- ESC-2. Острая недостаточность кровообращения на фоне гипертонического криза:
Клинические признаки СН на фоне высокого АД на фоне сохранной систолической функции левого желудочка сердца.
- ESC-3. Отек легких:
Клинические признаки отека легких.
- ESC-4. Кардиогенный шок:
Признаки гипоперфузии органов и тканей, артериальная гипотония, олиго/анурия и изменение уровня сознания.
- ESC-5. СН с высоким СВ:
Характеризуется высоким сердечным выбросом, обычно сопровождающимся тахикардией, теплыми конечностями, застоем в малом круге кровообращения, как правило, носит вторичный характер (развивается на фоне инфекционно-токсического шока, тиреотоксикоза, анемии и др.).
- ESC-6. Правожелудочковая СН:
Характеризуется синдромом низкого выброса на фоне повышенного центрального венозного давления, артериальной гипотонией, увеличением размеров печени.
Для описания степени тяжести острой сердечной недостаточности используют классификацию Киллипа (Таблица 1) или классификацию Форрестера (Таблица 2), первая основана на клинических проявлениях заболевания, вторая - на определении гемодинамических показателей.
Таблица 1. Классификация тяжести острой недостаточности кровообращения по Киллипу (Killip)
Класс
Признаки
I
Нет признаков сердечной недостаточности
II
Влажные хрипы, занимающие < 50% легочных полей, III тон,
венозная гипертензия
III
Отек легких (влажные хрипы, занимающие > 50% легочных полей)
IV
Кардиогенный шок
Таблица 2. Классификация тяжести острой недостаточности кровообращения по Форрестеру (Forrester)
Класс
ДЗЛА (мм рт. ст.)
СИ (мм рт. ст.)
Клинические проявления
1
< 18
> 2,2
Норма
2
> 18
> 2,2
Застой в легких
3
< 18
< 2,2
Гиповолемия
Недостаточность ПЖ
Дилатация артериол
4
> 18
< 2,2
Недостаточность ЛЖ
Кардиогенный шок
Критическая недостаточность кровообращения, как правило, предполагает наличие хронической недостаточности кровообращения IIБ - III стадии (Стражеско-Василенко) и III - IV ф.к. (NYHA), либо острой сердечной недостаточности 3 - 4 классов (по Киллипу или Форрестеру).
1.5.1 Классификация отторжения сердечного трансплантата
Отторжение сердечного трансплантата на сегодняшний день является наиболее значимым фактором, определяющим прогноз пациентов после трансплантации сердца. Являясь проявлением защитной реакции организма реципиента против чужеродных клеток, реакция отторжения включает механизмы врожденного, клеточного и гуморального (антителоопосредованного) иммунного ответа. Выделяют сверхострое отторжение, острое клеточное отторжение, острое гуморальное отторжение и хроническое отторжение, проявляющееся васкулопатией трансплантата, или болезнью коронарных артерий пересаженного сердца (БКАПС).
Классификация острого клеточного отторжения (ISHLT 2004):
- Степень 0R - нет данных за отторжение, гистологические и иммунопатологические признаки отрицательные;
- Степень 1R - мононуклеарная инфильтрация миокарда с наличием или отсутствием единичного очага повреждения кардиомиоцитов;
- Степень 2R - мононуклеарная инфильтрация миокарда с множественными очагами повреждения кардиомиоцитов;
- Степень 3R - мононуклеарная инфильтрация с диффузным повреждением кардиомиоцитов и/или признаками отека, кровоизлияний или васкулита.
Классификация острого гуморального отторжения (ISHLT 2013):
Классификация острого гуморального отторжения (pAMR) учитывает наличие как иммуногистохимических, так и гистологических признаков отторжения.
- pAMR0 - гистологические и иммуногистохимические признаки отсутствуют.
- pAMR1 - наличие только гистологических признаков [pAMR1 (H+) или только иммунофлуоресцентных признаков [pAMR1 (I+)], но не обоих.
- pAMR1(H+) - наличие только гистологических признаков: активация эндотелия сосудов, периваскулярного клеточного инфильтрата, периваскулярного отека внутрисосудистых макрофагов, интерстициального отека, возможен некроз кардиомиоцитов.
- pAMR1(I+) - наличие только иммунофлуоресцентных признаков: C4d компонента комплемента в стенке интерстициальных капилляров.
- pAMR2 - сочетание гистологических и иммунофлуоресцентных признаков (pAMR (H+) + pAMR (I+) = pAMR2).
- pAMR3 - выраженные гистологические признаки и распространенное свечение C4d компонента комплемента в стенке капилляров миокарда.
Классификация васкулопатии сердечного трансплантата (ISHLT 2010):
- ISHLT CAV 0 (васкулопатия сердечного трансплантата не значимая): ангиографических изменений не выявлено;
- ISHLT CAV 1 (легкая): стеноз ствола ЛКА < 50%, основных ветвей < 70%, или любой ветви < 70% (включая диффузное сужение) без дисфункции трансплантата;
- ISHLT CAV 2 (умеренная): стеноз ствола ЛКА > 50%, основных ветвей > 70%, или любой ветви второго порядка > 70% без дисфункции трансплантата;
- ISHLT CAV 3 (выраженная): стеноз ствола ЛКА > 50%, двух и более основных ветвей > 70%, или любой ветви второго порядка > 70% во всех трех основных бассейнах; или ISHLT CAV 1, или ISHLT CAV 2 в сочетании с дисфункцией трансплантата (определяемая как ФИЛЖ < 45%, обычно в сочетании с нарушением локальной сократимости ЛЖ), или признаки значимой рестриктивной диастолической дисфункции.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
1.6.1 Клиническая картина сердечной недостаточности
Клиническая картина при сердечной недостаточности включает типичные симптомы (одышка, ортопноэ, пароксизмальная ночная одышка, снижение толерантности к физическим нагрузкам, повышенная утомляемость, отеки лодыжек) и признаки (повышенное давление в яремной вене, гепатоюгулярный рефлюкс, "ритм галопа", смещение верхушечного толчка влево), вызванные нарушением структуры и/или функции сердца.
Критическая сердечная недостаточность может быть следствием острой или хронической недостаточности кровообращения.
Острая сердечная недостаточность - клинический синдром, характеризующийся быстрым развитием или утяжелением симптомов и признаков недостаточности кровообращения. Острая сердечная недостаточность предполагает необходимость незамедлительного оказания пациенту медицинской помощи.
В основе острой сердечной недостаточности могут лежать многочисленные сердечно-сосудистые и несердечные заболевания с вовлечением различных механизмов патогенеза, что следует учитывать при диагностике, стратификации риска и выборе подходов к лечению.
Острая сердечная недостаточность может быть как впервые выявлена у лиц без диагностированных сердечно-сосудистых заболеваний, так и развиваться на фоне декомпенсации хронической сердечной недостаточности.
Относительно специфичные клинические симптомы хронической сердечной недостаточности: ортопноэ, периферические отеки, повышенное яремно-венозное давление, кардиомегалия, сердечные шумы, гепатомегалия. Одышка является единственным симптомом с высокой чувствительностью, но ее специфичность значительно ниже. Причиной одышки при хронической сердечной недостаточности является застойное полнокровие в легких, что приводит к повышению давления в легочных венах и капиллярах. Одышка на начальных стадиях сердечной недостаточности связана с физической нагрузкой (выраженность одышки нарастает при физической нагрузке). По мере прогрессирования переносимость физических нагрузок ухудшается: одышка возникает при меньшем уровне физической нагрузки, появляется повышенная утомляемость, снижается толерантность к физической нагрузке, в дальнейшем развивается ортопноэ. Подтвердить или исключить кардиоваскулярный генез отеков помогают клинические особенности отеков, выявление системной венозной гипертензии и наличие признаков органического заболевания сердца. При хронической сердечной недостаточности отеки локализуются в наиболее низко расположенной части тела (нижние конечности, при нарастании сердечной недостаточности - отеки мошонки, живота, поясницы) и симметричны.
1.6.2 Острое клеточное отторжение
Острое клеточное отторжение чаще всего развивается в течение первых месяцев после трансплантации сердца и обусловлено, в основном, активированными T-лимфоцитами. В течение первого года после трансплантации сердца острое клеточное отторжение развивается у 20 - 40% реципиентов. У большинства пациентов отторжение трансплантата на ранних стадиях не имеет клинических проявлений. Это обусловливает необходимость проведения регулярных плановых биопсий миокарда с целью раннего выявления признаков отторжения и своевременного начала лечения.
Воспаление и гибель клеток, сопровождающие острое отторжение трансплантата, вначале приводят к интерстициальному отеку и снижению эластичности миокарда, что в свою очередь проявляется нарушением диастолической функции. В дальнейшем, при отсутствии адекватного лечения и прогрессировании патологического процесса, развивается нарушение систолической функции и развитие сердечной недостаточности со снижением фракции выброса. Вначале острое отторжение может проявляться неспецифическими симптомами - общим недомоганием, утомляемостью, слабостью, тошнотой, рвотой, повышением температуры. В дальнейшем появляются признаки, патогномоничные для сердечной недостаточности. Правожелудочковая недостаточность может развиваться как вторично, на фоне левожелудочковой недостаточности, так и являться следствием острого клеточного или гуморального отторжения. Синкопальные состояния у пациентов с острым отторжением трансплантата могут быть следствием артериальной гипотонии, развивающейся на фоне нарушений ритма сердца (фибрилляция желудочков) или на фоне острой ишемии миокарда. У ряда пациентов клиническим проявлением отторжения может быть внезапная смерть.
Острое отторжение трансплантата может также проявляться развитием брадиаритмий и атриовентрикулярной блокады. При развитии перикардита может выслушиваться шум трения перикарда, в полости перикарда может выявляться жидкость. На фоне прогрессирования отторжения появляются клинические признаки низкого сердечного выброса или истинного кардиогенного шока.
1.6.3 Острое гуморальное отторжение
Острое гуморальное (антителоопосредованное) отторжение трансплантата встречается реже, чем острое клеточное отторжение, примерно у 10% пациентов, сопровождаясь, как правило, признаками гемодинамической нестабильности (симптомами сердечной недостаточности). Острое гуморальное отторжение сердечного трансплантата в первую очередь обусловлено действием антител реципиента против антигенов сосудистого эндотелия донорского органа. Кроме этого, активированные T-лимфоциты могут стимулировать B-лимфоциты, способствуя их активации, пролиферации и дифференциации в плазмоциты, продуцирующие антитела.
Иммуногистохимически диагноз острого гуморального отторжения основывается на выявлении иммуноглобулинов (IgG, IgM или IgA), фрагментов системы комплемента (C3d, C4d, C1q), макрофагов (CD 68 - позитивных клеток), а также новых циркулирующих антител против донорских молекул главного комплекса гистосовместимости (HLA).
1.6.4 Бессимптомное гуморальное отторжение
Признаки гуморального отторжения могут быть обнаружены при гистологическом исследовании материала плановой эндомиокардиальной биопсии при отсутствии каких-либо клинических симптомов. Бессимптомное гуморальное отторжение способствует прогрессированию васкулопатии трансплантата и является фактором риска смерти. При выявлении признаков бессимптомного гуморального отторжения у пациентов следует оценить эффективность поддерживающей иммуносупрессивной терапии и при необходимости скорректировать дозы лекарственных препаратов.
1.6.5 Смешанное отторжение
Термин "смешанное отторжение" используется в случаях, когда при гистологическом исследовании эндомиокардиального биоптата одновременно выявляются признаки клеточного и гуморального отторжения. При наличии признаков гемодинамических нарушений используется агрессивная тактика лечения, включающая внутривенное введение глюкокортикостероидов и иммуномодулирующих или иммунодепрессивных средств. При легких формах смешанного отторжения без гемодинамических нарушений лечение такое же, как и при остром клеточном отторжении.
1.6.6 Позднее острое отторжение сердечного трансплантата, васкулопатия сердечного трансплантата
Частота и периодичность плановых биопсий миокарда трансплантата сердца в разных центрах трансплантации могут отличаться. В связи с этим частота выявления позднего острого отторжения может быть различной. В то же время, как показали результаты проведенных исследований, более частое проведение плановых биопсий миокарда и связанное с этим более частое выявление бессимптомного острого отторжения аллотрансплантата не сопровождаются увеличением выживаемости пациентов в течение первых 5 лет после трансплантации сердца. В некоторых исследованиях было показано, что бессимптомное позднее острое отторжение может купироваться самостоятельно без дополнительного лечения.
Факторы риска позднего острого отторжения включают молодой возраст, наличие в анамнезе эпизодов острого отторжения, сенсибилизацию к HLA-антигенам, женский пол, эпизоды отторжения, развившиеся в первые месяцы после трансплантации сердца. Недостаточные дозы иммунодепрессивных средств и несоблюдение пациентами режима назначения лекарственных средств также способствуют развитию позднего острого отторжения.
Васкулопатия трансплантата сердца является одним из основных факторов, оказывающих влияние на отдаленный прогноз. На фоне улучшения эффективности цитостатической медикаментозной терапии и снижения частоты отторжения сердечного трансплантата, отмечающихся в последние годы, вероятность развития васкулопатии трансплантата остается неизменной. Вследствие того, что сердечный трансплантат является денервированным органом, ишемия миокарда не сопровождается болезненными ощущениями, и пациенты самостоятельно обращаются за помощью лишь в тех случаях, когда ишемия миокарда приводит к сердечной недостаточности, и это бывает, как правило, при значительных изменениях в коронарных артериях пересаженного сердца. В связи с этим, раннее выявление изменений в сосудах трансплантата имеет важное значение. Неинвазивные методы диагностики обладают низкими чувствительностью и специфичностью и в связи с этим имеют ограниченное применение. Тем не менее при наличии отрицательной динамики показателей диастолической функции ЛЖ, как одного из чувствительных критериев наличия ишемии миокарда, они могут использоваться для назначения внеплановой коронарографии.
Основным методом скринингового обследования для выявления изменений в коронарных артериях пересаженного сердца является ангиографическое исследование. Первую коронарографию, как правило, проводят в течение короткого времени после операции трансплантации сердца с целью выявления возможных патологических изменений в донорском сердце, что особенно важно, если возраст донора > 35 лет. В дальнейшем повторные коронарографии проводятся с частотой 1 - 2 раза в год.
В связи с тем, что изменения в коронарных артериях при васкулопатии трансплантата характеризуются развитием диффузных, протяженных, концентрических стенозов, ангиографическая диагностика может быть затруднена в связи с отсутствием "референсных", неизмененных сегментов. Выявление "неровностей" внутреннего просвета коронарных артерий, использование компьютерных программ для количественного анализа изображений и сравнение с результатами предыдущих исследований позволяют улучшить чувствительность метода. При этом пораженные сегменты с компенсаторной вазодилятацией (негативное ремоделирование артериальной стенки), как правило, не выявляются при коронарографии.
Дополнительное внутрисосудистое ультразвуковое исследование (ВСУЗИ) коронарных артерий повышает чувствительность и специфичность рентгеноангиографического исследования как в выявлении исходных изменений в донорском сердце, так и для ранней диагностики васкулопатии трансплантата. Выявление увеличения толщины интимы коронарных артерий > 0.5 мм в течение 1-го года после трансплантации сердца свидетельствует о высоком риске смерти или развитии гемодинамически значимых сужений просвета артерий трансплантата в течение следующих 5 лет. Недостатками метода ВСУЗИ коронарных артерий являются высокая стоимость, возможность развития перипроцедурных осложнений и необходимость в дополнительной специальной подготовке персонала.
При отсутствии прогрессирования изменений в коронарных артериях трансплантата в течение 5 лет после операции, особенно у пациентов с почечной недостаточностью, повторные коронарографии можно выполнять реже.
Учитывая высокую частоту развития рестенозов и вероятность развития новых очагов поражения у реципиентов сердца, особенно после проведения баллонной ангиопластики, повторную коронарографию следует проводить не позже, чем через 6 месяцев после процедуры ангиопластики.
Дисфункция эндотелия является ранним проявлением васкулопатии сердечного трансплантата и может быть диагностирована при помощи измерения резерва коронарного кровотока и эндотелий-зависимой вазодилятации. Метод оценки резерва коронарного кровотока позволяет диагностировать ранние нарушения в микроциркуляторном русле, даже при отсутствии изменений в крупных эпикардиальных артериях. Показано, что выявление сниженного резерва коронарного кровотока является предиктором развития васкулопатии трансплантата и нарушения сократительной функции желудочков трансплантата в течение последующих 2-х лет.
Сопутствующие заболевания (например, почечная недостаточность) и ряд трудностей технического характера могут затруднить проведение инвазивного ангиографического исследования.
- Среди неинвазивных методов ранней диагностики васкулопатии трансплантата наиболее информативными являются радиоизотопные методы оценки перфузии миокарда, стресс-эхокардиографическое исследование с добутамином** и тканевое допплеровское исследование сократительной функции миокарда.
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарий: Добутамин** в Российской Федерации разрешен к применению при проведении стресс-эхокардиографии в качестве альтернативы пробе с физической нагрузкой. Метаанализ 11-ти исследований показал, что стресс-эхокардиография с добутамином** обладает невысокой чувствительностью (60.2%), но хорошей специфичностью (85.7%) в диагностике васкулопатии сердечного трансплантата [311].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
2.1 Жалобы и анамнез
См. раздел 1.6 Клиническая картина.
2.2 Физикальное обследование
2.2.1 Физикальное обследование потенциального реципиента сердца - больного тяжелой (терминальной) сердечной недостаточностью для принятия решения о включении в лист ожидания трансплантации сердца, а также реципиентов сердца
- В стационаре всем пациентам рекомендован осмотр врачей специалистов: врача-кардиолога, врача - анестезиолога-реаниматолога, врача - сердечно-сосудистого хирурга [11, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При необходимости рекомендуются дополнительные консультации врачей-специалистов: врача-невролога, врача-эндокринолога, врача-нефролога, врача-инфекциониста, врача-уролога, врача-стоматолога [11, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
2.3 Лабораторные диагностические исследования
2.3.1 Лабораторные диагностические исследования потенциального реципиента сердца - больного тяжелой (терминальной) сердечной недостаточностью для принятия решения о включении в лист ожидания трансплантации сердца
- Рекомендуется проведение следующих лабораторных клинических обследований: общий (клинический) анализ крови, анализ крови биохимический общетерапевтический (креатинин, мочевина, билирубин, АЛТ, АСТ, щелочная фосфатаза, ГГТ, холестерин ЛПВП, холестерин ЛПНП, триглицериды, C реактивный белок, альбумин, глюкоза, общий белок), электролиты крови (калий, натрий), коагулограмма (агрегация тромбоцитов, АЧТВ, ПТИ, фибриноген), гормоны щитовидной железы (ТТГ, Т4 своб., Т3), общий (клинический) анализ мочи, определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), молекулярно-биологическое исследование крови на вирус Эпштейна-Барр (Epstein-Barr virus), молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus), молекулярно-биологическое исследование крови на вирус простого герпеса (Herpes simplex virus), определение антител к вирусу иммунодефицита человека (ВИЧ) типов 1, 2, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови, проведение пробы на совместимость по иммунным антителам реципиента и антигенам главного комплекса гистосовместимости донора, определение HLA-антигенов [11, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
2.3.2 Лабораторные диагностические исследования у реципиентов сердца
- Помимо рутинных лабораторных методов исследования, указанных в разделе "2.3.1", всем реципиентам сердца показано регулярное определение уровней циклоспорина** или такролимуса** или эверолимуса** в крови (в зависимости от принимаемой иммуносупрессивной терапии).
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
2.4 Инструментальные диагностические исследования
2.4.1 Инструментальные диагностические исследования потенциального реципиента сердца - больного тяжелой (терминальной) сердечной недостаточностью для принятия решения о включении в лист ожидания трансплантации сердца
- Рекомендуется проведение следующих методов инструментальной диагностики: электрокардиографическое (ЭКГ) исследование в 12-ти отведениях; эхокардиографическое трансторакальное исследование; ультразвуковое исследование органов брюшной полости (комплексное), включая УЗИ брюшной аорты и нижней полой вены; пульсоксиметрия; исследование неспровоцированных дыхательных объемов и потоков; исследование спровоцированных дыхательных объемов; компьютерная томография органов грудной клетки с внутривенным контрастированием по показаниям; компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным контрастированием по показаниям; компьютерная томография головного мозга; эзофагогастродуоденоскопия [11, 18, 19, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Чрезвенозная диагностическая катетеризация правых отделов сердца с определением показателей давления в полостях сердца, а также сердечного выброса (СВ), сердечного индекса (СИ), транспульмонарного градиента (ТПГ) и показателя легочного сосудистого сопротивления (ЛСС) рекомендуется всем потенциальным реципиентам при включении в лист ожидания трансплантации сердца [19, 20, 21, 22, 56, 208].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 5)
Комментарии: Основные задачи чрезвенозной катетеризации правых отделов сердца - получить точные значения показателей, характеризующих сократительную функцию правых и левых отделов сердца и выявить возможные признаки легочной гипертензии, являющейся противопоказанием для проведения ортотопической трансплантации сердца.
- Если при проведении чрезвенозной катетеризации правых отделов сердца выявлены признаки легочной гипертензии, характеризующихся значениями показателей систолического давления в легочной артерии > 50 мм рт. ст., транспульмонарного градиента (ТПГ) > 15 мм рт. ст. и легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, рекомендуется повторить измерения на фоне назначения лекарственных средств, обладающих вазодилятирующим действием на легочные артерии (окись азота, силденафил и др.) [22, 56].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 5)
2.4.1.1. Дополнительные инструментальные диагностические исследования потенциального реципиента сердца - больного тяжелой (терминальной) сердечной недостаточностью для принятия решения о включении в лист ожидания трансплантации сердца
- Холтеровское мониторирование сердечного ритма, ЭКГ с применением лекарственных препаратов (дополнительно к основной ЭКГ); ортостатическая проба при ЭКГ (дополнительно к основной ЭКГ); дуплексное сканирование аорты; дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока; дуплексное сканирование сосудов (артерий и вен) верхних конечностей; дуплексное сканирование сосудов (артерий и вен) нижних конечностей; дуплексное сканирование брюшного отдела аорты, ее висцеральных ветвей, подвздошных и общих бедренных артерий; эхокардиография чреспищеводная; эхокардиография с фармакологической нагрузкой; эхокардиография с физической нагрузкой; сцинтиграфия миокарда; сцинтиграфия миокарда с функциональными пробами; проведение теста с физической нагрузкой с использованием велоэргометра; проведение теста с однократной физической нагрузкой меняющейся интенсивности [11, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
2.5 Иные диагностические исследования
- Рекомендовано проведение перфузионной сцинтиграфии миокарда с тетрофосмином, синхронизированной с ЭКГ; Эндомиокардиальной биопсии - у пациентов с трансплантированным сердцем выполняется в рамках обязательного планового обследования и у пациентов с клиническими признаками дисфункции сердечного трансплантата по показаниям; коронарографии у пациентов с клиническими признаками ишемической кардиопатии с целью выявления возможностей реваскуляризации миокарда как способа лечения сердечной недостаточности, а также у реципиентов трансплантированного сердца в рамках обязательного планового обследования и у пациентов с клиническими признаками дисфункции сердечного трансплантата [19, 20, 21, 22, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Показания и противопоказания к трансплантации сердца
3.1.1 Показания к трансплантации сердца
- Трансплантация сердца показана больным с терминальной (критической) сердечной недостаточностью, сопровождающейся клинически значимыми признаками декомпенсации кровообращения, и неблагоприятным прогнозом жизни, несмотря на назначение максимально переносимой этиотропной медикаментозной терапии и при невозможности выполнения иных органосохраняющих вмешательств и не имеющих противопоказаний [2, 9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Трансплантация сердца выполняется пациентам с конечной стадией сердечной недостаточности (IIБ - III стадии по классификации Василенко-Стражеско) с выраженным ограничением физической активности (III - IV функциональный класс по NYHA) при неэффективности медикаментозной терапии или методов механической поддержки кровообращения, а также невозможности проведения иных методов хирургического лечения, но обладающим потенциалом для достижения ремиссии после трансплантации донорского сердца [1, 2, 7, 9].
- Пациентов, госпитализированных с острой или декомпенсированной хронической сердечной недостаточностью, требующих непрерывной инфузии адренергических и дофаминергических средств или находящихся на механической поддержке кровообращения, рекомендовано включать в приоритетный лист ожидания трансплантации сердца. Пациенты, включенные в лист ожидания и не нуждающиеся в постоянной медикаментозной инотропной или механической поддержке кровообращения, наблюдаемые амбулаторно, должны проходить регулярные обследования для оценки статуса [33 - 37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Критериями неблагоприятного прогноза у пациентов с сердечной недостаточностью рекомендовано считать:
- фракция выброса левого желудочка менее 20%;
- давление заклинивания в легочной артерии > 20 мм рт. ст.;
- снижение максимального O2 < 12 мл/кг/мин у пациентов, не получающих бета-адреноблокаторы и O2 < 14 мл/кг/мин на фоне приема максимально переносимой дозы бета-адреноблокаторов; ретрансплантация, обусловленная выраженной дисфункцией трансплантата;
- признаки тяжелой ишемии миокарда у пациентов с ишемической болезнью сердца, которые значительно ограничивают повседневную деятельность при невозможности проведения реваскуляризации методами коронарного шунтирования или чрескожной ангиопластики коронарных артерий;
- рецидивирующие жизнеугрожающие нарушения ритма, рефрактерные к медикаментозной терапии, а также к электрофизиологическим методам лечения (катетерная абляция и (или) имплантация кардиовертера-дефибриллятора) [2, 9, 19].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.1.2 Относительные противопоказания
- Старший возраст пациента не является противопоказанием для проведения трансплантации сердца, однако, у лиц старше > 65 лет, при наличии сопутствующих клинически значимых синдромов или заболеваний, связанных с повышенным риском периоперационных осложнений, выполнение трансплантации сердца не рекомендовано [2, 31, 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В настоящее время фактором, определяющим возможность выполнения трансплантации сердца, является не столько возраст, сколько наличие сопутствующих заболеваний и способность пациента к достижению ремиссии после перенесенного оперативного вмешательства. Имеются сообщения о выполнении трансплантации сердца лицам старше 80 лет. У лиц старшего возраста используются расширенные критерии для органного донорства.
- Не рекомендована трансплантация сердца пациентам с ожирением, характеризующимся значениями показателя индекса массы тела 30 - 35 кг/м2 [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При наличии сопутствующих заболеваний, повышающих риск развития периоперационных осложнений, трансплантация сердца не рекомендована:
- язвенная болезнь в стадии обострения;
- сахарный диабет с повреждением органов-мишеней (нейропатия, нефропатия или ретинопатия). Относительными противопоказаниями для трансплантации сердца у пациентов с сахарным диабетом являются наличие поражения органов-мишеней (за исключением непролиферативной ретинопатии) и невозможность достижения адекватного контроля гликемии (уровни гликозилированного гемоглобина > 7.5% или 58 ммоль/л);
- наличие гемодинамически значимого атеросклероза артерий головы и шеи, артерий нижних конечностей, почечных артерий, значимый атеросклероз и кальциноз восходящего отдела аорты являются относительными противопоказаниями для трансплантации сердца и имплантации устройств механической поддержки кровообращения;
- острые инфекционные заболевания (за исключением инфекционных осложнений, связанных с устройствами механической поддержки кровообращения);
- хроническая почечная недостаточность с уровнем креатинина > 2,5 мг/дл или клиренсом креатинина < 30 мл/мин/1.73 м2 расценивается как относительное противопоказание для трансплантации сердца. Однако в настоящее время имеется опыт сочетанной трансплантации сердца и почки, в том числе и в России;
- печеночная недостаточность с уровнем билирубина > 2,5 мг/дл, повышение уровня трансаминаз более, чем в 3 раза, МНО > 1,5 без варфарина;
- нарушение функции внешнего дыхания, характеризующееся величиной показателя ОФВ1 < 40%;
- коагулопатия;
- перенесенная инфарктная пневмония в течение предыдущих 6 - 8 недель;
- тяжелые неврологические или нервно-мышечные расстройства;
- кахексия [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Истощение, или кахексия, у пациентов с сердечной недостаточностью является неблагоприятным фактором, связанным с более высоким риском развития нежелательных событий и летальностью. Это может быть обусловлено более почтенным возрастом, большей длительностью и более выраженной тяжестью заболевания, что также может оказывать влияние на риск развития периоперационных осложнений и способность к восстановлению в послеоперационном периоде. Критериями диагноза кахексии являются потеря в весе более 5% в течение последнего года или индекс массы тела при первичном осмотре пациента < 20 кг/м2 и наличие 3 из 5 признаков: снижение мышечной силы, слабость, анорексия, астеническое телосложение, лабораторные показатели (высокие уровни C-реактивного белка или ИЛ-6, анемия, гипоальбуминемия).
- Не рекомендована трансплантация сердца пациентам при наличии состояний и заболеваний, которые могут сопровождаться нарушением режима приема лекарственных средств в послеоперационном периоде:
- неблагоприятный социальный статус или психические заболевания, при которых невозможно достижение ремиссии;
- перенесенное острое нарушение мозгового кровообращения; эпизоды злоупотребления наркотиками или алкоголем в течение последних 6 месяцев; неспособность отказаться от курения табака [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендована трансплантация сердца при наличии хронических инфекционных заболеваний:
- Вирус иммунодефицита человека. Трансплантация сердца может быть выполнена у пациентов с наличием антител к ВИЧ в крови в случае отсутствия оппортунистических инфекций (в течение > 1 месяца), получающих комбинированную этиотропную противовирусную терапию (в течение > 3 месяцев), при отсутствии определяемой в крови РНК ВИЧ (в течение > 3 месяцев) и при отсутствии лимфопении (содержание в крови CD4-положительных клеток > 200 клеток/мкл в течение > 3 месяцев). Пациенты с первичной лимфомой центральной нервной системы или висцеральной саркомой Капоши не рассматриваются в качестве потенциальных реципиентов сердечного трансплантата;
- Вирусы гепатитов B (ВГВ) и C (ВГС). Пациенты с разрешившейся или неактивной инфекцией ВГВ и ВГС могут быть включены в лист ожидания ТС. Пациентам с хронической инфекцией ВГВ и ВГС для решения вопроса о возможности выполнения трансплантации сердца показано проведение биопсии печени. Разрешившаяся инфекция ВГС характеризуется наличием в крови антител в ВГС, отсутствием РНК ВГС, определяемой методом ПЦР, и сохранной синтетической функцией печени. Хроническая инфекция ВГС характеризуется наличием РНК вируса в крови или активным приемом противовирусных лекарственных средств. Неактивная перенесенная инфекция вирусного гепатита B характеризуется наличием HB-антигена и/или HB-антител и отсутствием HB-антигена. Хроническая инфекция ВГВ характеризуется наличием в крови поверхностного HB-антигена [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.1.3 Абсолютные противопоказания
- Не рекомендована трансплантация сердца пациентам в возрасте старше 80 лет и сопутствующими заболеваниями, повышающими периоперационный риск и ограничивающие отдаленный прогноз [2, 31, 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендована трансплантация сердца пациентам при наличии сопутствующих заболеваний, повышающих риск развития периоперационных осложнений:
- выраженные нарушения функции внешнего дыхания (напр., тяжелая обструктивная болезнь легких с ОФВ1 < 1 л/мин);
- легочная гипертензия с транспульмональным градиентом > 15 мм рт. ст. или легочно-сосудистым сопротивлением > 5 единиц Вуда, рефрактерная к медикаментозной терапии (NO, силденафил) и/или механической поддержке кровообращения; выраженные нарушения функции печени и/или почек;
- аутоиммунные заболевания (системная красная волчанка, саркоидоз или системный амилоидоз);
- выраженное ожирение (ИМТ > 35 кг/м2);
- выраженный атеросклероз сонных, мозговых и периферических артерий, сопровождающийся ишемией органов и тканей при невозможности хирургического лечения;
- наличие острой вирусной инфекции, в том числе фульминантных форм гепатитов B и C;
- наличие клинических, радиологических, биохимических или морфологических признаков цирроза печени, портальной гипертензии или гепатоцеллюлярной карциномы [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендована трансплантация сердца пациентам при наличии сопутствующих заболеваний, сопровождающихся риском смерти в течение 5 лет, превышающим 50% (напр., онкологические заболевания с неблагоприятным прогнозом жизни) [2, 56, 208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Не рекомендуется трансплантация сердца пациентам с легочной гипертензией, характеризующейся значениями показателей систолического давления в легочной артерии (СДЛА) > 50 мм рт. ст., транспульмонарного градиента (ТПГ) > 15 мм рт. ст. и легочного сосудистого сопротивления (ЛСС) > 5 единиц Вуда, рефрактерная к назначению средств, обладающих вазодилятирующим действием на легочные артерии, поскольку она является противопоказанием для проведения ортотопической трансплантации сердца [22, 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5) Комментарии: Оценка показателей, характеризующих легочную гипертензию, производится при проведении катететеризации правых отделов сердца. При выявлении признаков легочной гипертензии следует рассмотреть вопрос об использовании устройств механической поддержки кровообращения в качестве альтернативы трансплантации сердца либо медикаментозной терапии с дополнительным назначением препаратов селективного ингибитора циклогуанозинмонофосфат (цГМФ) - специфической фосфодиэстеразы 5-го типа. Исследования показали, что адекватная медикаментозная терапия, включающая средства, снижающие давление в легочных сосудах или имплантация устройств механической поддержки кровообращения может сопровождаться снижением показателя сосудистого легочного сопротивления через 3 - 6 месяцев, после чего может быть выполнена ортотопическая трансплантация сердца.
3.2 Хирургические методики выполнения ортотопической трансплантации сердца
- Рекомендованы следующие хирургические методики: биатриальная (анастомозы накладываются между предсердиями донора и реципиента) и бикавальная (анастомозы накладываются между полыми венами донора и реципиента) для выполнения трансплантации сердца [207, 208].
Уровень достоверности рекомендаций B (уровень достоверности доказательств 3)
3.2.1 Биатриальная методика трансплантации сердца
Выполняют срединную стернотомию и перикардиотомию. Перед началом искусственного кровообращения (ИК) разделяют аорту и основной ствол легочной артерии. После начала ИК накладывают зажим на восходящую аорту.
Начинают иссечение сердца. Отсекают правый желудочек от предсердия от верхнего до нижнего края межпредсердной перегородки на 1 - 2 мм выше предсердно-желудочковой борозды. Правое ушко отсекают для профилактики тромбообразования. Как можно ближе к устьям пересекают аорту и легочную артерию. Левый желудочек отсекают от левого предсердия от верхнего до нижнего края межпредсердной перегородки с иссечением ушка левого предсердия. Пересекают межпредсердную перегородку. Производят осмотр области овальной ямки. При наличии вторичного межпредсердного дефекта или незаращения овального окна их тщательно ушивают.
Первый шов накладывают на левые предсердия в области отсеченного ушка сердца реципиента и левого ушка трансплантата. Одним из концов этой нити выполняют обвивной непрерывный шов нижних краев предсердий изнутри их полостей до нижней держалки на межпредсердной перегородке. Затем другим концом нити шва, наложенного в области ушек левых предсердий, сшивают верхние края левых предсердий. Эту линию шва выполняют снаружи от полостей предсердий. При достижении верхнего шва на межпредсердной перегородке нити связывают.
Перед анастомозированием правых предсердий оценивают соответствие их периметров (длина разреза правого предсердия трансплантата должна соответствовать периметру краев правого предсердия сердца реципиента). Сшивают край правого предсердия трансплантата с межпредсердной перегородкой сердца реципиента.
Перед анастомозированием аорты трансплантата и реципиента также оценивают соответствие их диаметров. При соотношении 1:2 выполняют клиновидное иссечение участка верхней стенки аорты большего диаметра с наложением на края разреза обвивного непрерывного шва или рассечение верхней стенки меньшего диаметра на протяжении 1,5 - 2 см.
После наложения 2 швов-держалок на боковые края срезов аорты сшивают задние стенки аорты донора и реципиента изнутри их просветов. Передние стенки аорты трансплантата и реципиента сшивают снаружи от их просвета. После окончания анастомозирования аорты донора и реципиента выше линии шва для профилактики воздушной эмболии в просвет аорты вводят иглу Дюфо.
Сшивание легочной артерии донора с легочной артерий реципиента выполняют аналогично анастомозированию аорты. Сначала накладывают 2 шва-держалки, затем изнутри сшивают задние стенки, после чего снаружи - передние стенки легочных артерий.
После окончания трансплантации переходят на параллельное кровообращение, которое должно продолжаться из расчета каждые 20 минут на каждый час пережатия аорты.
Прекращают искусственное кровообращение и удаляют венозные и аортальную канюли. Выполняют послойное ушивание раны с оставлением дренажей под задней поверхностью сердца и в переднем средостении [207, 208].
3.2.2 Кава-кавальная методика выполнения ортотопической трансплантации сердца
Отличие этой методики заключается в анастомозировании верхней и нижней полой вены вместо анастомозирования правых предсердий. Использование этой техники позволяет значительно снизить частоту регургитации на трехстворчатом клапане и дисфункции синусового узла пересаженного сердца [207, 208].
3.2.3 Комбинированная методика выполнения ортотопической трансплантации сердца
В отличие от описанных выше методик анастомозируется либо узкий "мостик" между полыми венами реципиента с правым предсердием донора, либо латеральный край разреза нижней полой вены донорского сердца с задней стенкой правого предсердия реципиента латеральнее овальной ямки, а противоположный край разреза нижней полой вены донорского сердца с краем реципиента.
Главным преимуществом биатриальной методики является минимальное время ишемии трансплантата из всех возможных методик трансплантации сердца, а основными недостатками в послеоперационном периоде являются: недостаточность трикуспидального клапана, т.к. биатриальный анастомоз может приводить к аномально расширенной полости и искаженной геометрии правого предсердия, предсердные аритмии и нарушения сократимости предсердий, т.к. сохраняются части предсердий донора и реципиента, что может привести к сохранению двух водителей ритма, предсердные тромбоэмболии, т.к. возможно стенозирование межпредсердных анастомозов и образование тромбов в области длинной циркулярной линии швов предсердий. Недостатками бикавального метода являются более длительное время ишемии трансплантата, по сравнению с биатриальной методикой, а также возможное развитие стеноза либо при анастомозе верхней полой вены, либо анастомозе нижней полой вены, а главными преимуществами бикавальной методики по сравнению с биатриальной методикой являются: снижение количества предсердных аритмий и времени временной стимуляции, снижение частоты трикуспидальной регургитации, т.к. сохраняется нормальная геометрия правого предсердия трансплантата и один синусовый узел, в связи с увеличением послеоперационных сердечных показателей, снижаются послеоперационные потребности в применении альфа-адреномиметиков, а также уменьшается длительность пребывания пациента в стационаре [207, 208].
3.3 Госпитальный послеоперационный период у реципиентов трансплантированного сердца
Существенное влияние на результат операции имеет выбор оптимальной схемы интенсивной терапии при различных вариантах дисфункции сердечного трансплантата. В тщательном подборе кардиотропной и вазоактивной терапии нуждаются те пациенты, которые имеют исходно повышенный уровень легочного сосудистого сопротивления, что традиционно считается фактором риска, отягощающим течение раннего периода после ТС.
Основной задачей раннего периода после ТС является восстановление адекватной, соответствующей метаболическим потребностям организма реципиента сократительной функции сердечного трансплантата. На этом этапе интенсивной терапии необходима комбинация всех современных методов коррекции функций донорского сердца (как медикаментозных, так и с использованием возможностей современных методик вспомогательного кровообращения) на основе постоянного мониторинга параметров центральной гемодинамики, показателей метаболизма, газообменной и кислородтранспортной функции крови, тщательного контроля за состоянием других жизненно важных органов (центральной нервной системы, почек, печени, легких и др.).
Резко выраженная степень нарушения сократительной функции трансплантата отмечается у 10% реципиентов, в этом случае поддержание системной гемодинамики обеспечивается интенсивной медикаментозной терапией и применением различных методов вспомогательного кровообращения (вено-артериальная экстракорпоральная мембранная оксигенация, внутриаортальная баллонная контрпульсация, одно- или бивентрикулярный обход сердца). В крайних случаях при отсутствии восстановления функции пересаженного сердца требуется повторная трансплантация.
3.3.1 Рекомендации по проведению инотропной терапии в перитрансплантационном периоде
- Рекомендовано использование добутамина** при умеренно выраженных нарушениях сократительной функции миокарда сердечного трансплантата и отсутствии выраженной артериальной гипотензии в раннем послеоперационном периоде после ортотопической трансплантации сердца, а также при нарушениях сократительной функции миокарда сердечного трансплантата по правожелудочковому типу [208, 219].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Комментарий: Зарегистрированными показаниями для назначения добутамина** в Российской Федерации являются необходимость инотропной поддержки при состояниях, связанных с сердечной недостаточностью с низким сердечным выбросом, таких как инфаркт миокарда, операции на открытом сердце, кардиомиопатии, септический шок и кардиогенный шок. У пациентов после кардиохирургических вмешательств добутамин** используется с 70-х годов XX-го века благодаря выраженному инотропному действию, повышающему сердечный выброс, не вызывая значительной тахикардии или аритмии [59, 313]. Опрос 839 врачей из 82 стран, проведенный Европейским обществом интенсивной терапии (European Society of Intensive Care Medicine) показал, что добутамин** в качестве средства первой линии при острой сердечной недостаточности используется в 84% случаев [445].
- Рекомендовано использование допамина** в раннем послеоперационном периоде после ортотопической трансплантации сердца при острой сердечно-сосудистой недостаточности, синдроме низкого сердечного выброса, артериальной гипотензии, сопровождающимся низким общим периферическом сосудистом сопротивлении. При гемодинамически значимом нарушении сократительной функции сердечного трансплантата рекомендован базовый препарат эпинефрин** (изолированно или в комбинации с другими адренергическими и дофаминергическими средствами). Потребность в использовании эпинефрина** возрастает после ТС с длительным сроком ишемии сердечного трансплантата. При использовании эпинефрина** рекомендовано учитывать потенциальное сосудосуживающее действие на малый круг, что может оказаться нежелательным у реципиентов с преимущественно правожелудочковой недостаточностью сердечного трансплантата [208, 219, 448, 449].
Уровень убедительности рекомендации C (уровень достоверности доказательств 5)
Комментарий: Допамин** является кардиотоническим средством негликозидной структуры, назначаемым при шоках и острой сердечно-сосудистой недостаточности различного генеза, а также при синдроме низкого сердечного выброса и клинически значимой артериальной гипотензии у кардиохирургических больных. Допамин** и добутамин** являются препаратами выбора для улучшения умеренно сниженной сократительной способности сердца в раннем периоде после трансплантации сердца, при этом допамин** является предпочтительным препаратом у пациентов с гипотензией [446]. Более высокие дозы могут вызвать увеличение частоты сердечных сокращений, усугубляя ишемию миокарда. В многоцентровом рандомизированном слепом исследовании SOAP II [447], сравнивавшим допамин** и норэпинефрин** в качестве начальной вазопрессорной терапии при лечении шока, не было выявлено существенной разницы в уровне смертности через 28 дней между пациентами, получавшими допамин**, и теми, кто получал норэпинефрин**. Допамин** был связан с большим количеством аритмических событий, чем норэпинефрин**, кроме того, допамин** повышал смертность в подгруппе больных с кардиогенным шоком. Показанием для назначения эпинефрина** является артериальная гипотензия, не поддающаяся воздействию адекватных объемов замещающих жидкостей (в т.ч. шок, травма, бактериемия, операции на открытом сердце, почечная недостаточность, хроническая сердечная недостаточность, передозировка лекарственных средств). Эпинефрин** обладает выраженным стимулирующим действием на бета-1-адренорецепторы и умеренным - на бета-2- и альфа-1-адренорецепторами. В небольших дозах эпинефрин** повышает сердечный выброс за счет инотропного и хронотропного эффектов бета-1-адренорецепторов, в то время как вазоконстрикция, вызванная стимуляцией альфа-адренорецепторами, может компенсироваться вазодилатацией вследствие стимуляции бета-2-адренорецепторов. Результатом является повышение сердечного выброса со снижением системного сосудистого сопротивления. Однако при более высоких дозах эпинефрина** преобладает эффект стимуляции альфа-адренорецепторов, что сопровождается повышением системного сосудистого сопротивления в дополнение к увеличению сердечного выброса [448, 449].
- У взрослых рекомендовано применение левосимендана** с целью улучшения сократительной функции миокарда сердечного трансплантата и уменьшения доз адренергических и дофаминергических. Гемодинамическими показаниями для терапии левосименданом являются: ДПП > 12 мм рт. ст., ДЗЛА > 15 мм рт. ст., СИ < 2,5 л/мин/м2 при необходимости в кардиотонической терапии допамином** и/или добутамином** > 15 мкг/кг/мин и эпинефрином** > 100 нг/кг/мин. С учетом возможного системного вазодилатирующего действия рекомендуется введение левосимендана методом постоянной инфузии (100 нг/кг/мин) без предварительного болюсного введения нагрузочной дозы [208, 218, 219].
Уровень убедительности рекомендации B (уровень достоверности доказательств 3)
Комментарий: Левосимендан, относящийся к кардиотоникам негликозидной структуры, является кальцийсенсибилизирующим средством с механизмом действия, отличным от механизмов действия других инотропов, и с пролонгированным действием [442]. Стабилизируя связывание кальция с тропонином C, левосимендан усиливает актин-миозиновое перекрестное связывание и увеличивает силу сердечных сокращений. Он также обладает вазодилятирующим действием, воздействуя на АТФ-чувствительные калиевые каналы гладкой мускулатуры сосудов. В Российской Федерации левосимендан зарегистрирован для кратковременного лечения острой декомпенсации тяжелой хронической сердечной недостаточности в ситуациях, когда обычной терапии недостаточно, и в случаях, когда инотропная поддержка считается целесообразной. В нескольких метаанализах контролируемых исследований [437 - 439] была показана более высокая выживаемость при лечении левосименданом, чем при других схемах лечения, среди пациентов, перенесших кардиохирургические вмешательства. Однако, ни в исследовании LEVO-CTS (исследование левосимендана у пациентов с систолической дисфункцией левого желудочка, перенесших кардиохирургическую операцию, требующую искусственного кровообращения) [440], ни в исследовании CHEETAH [441] у пациентов, которым требовалась периоперационная гемодинамическая поддержка после операции на сердце, низкие дозы левосимендана в дополнение к стандартной терапии не приводили к снижению 30-дневной смертности по сравнению с плацебо. В небольшом ретроспективном исследовании [443] были проанализированы исходы 127 пациентов с тяжелым кардиогенным шоком, находящихся на веноатриальном ЭКМО. Назначение левосимендана позволило более эффективно отлучить пациентов от ЭКМО, и достоверно улучшило выживаемость. В одном из Кокрейновских обзоров упоминается, что левосимендан имеет некоторое краткосрочное преимущество в выживаемости по сравнению с добутамином**, но при этом указывается на низкое качество доказательств использования инотропных средств при кардиогенном шоке [444].
3.3.2 Рекомендации по послеоперационному мониторингу реципиентов пересаженного сердца
- При проведении периоперационного мониторинга реципиентов сердца рекомендуется выполнять непрерывное мониторирование ЭКГ, инвазивный мониторинг артериального давления, давления в правом предсердии или центрального венозного давления заклинивания легочной артерии, периодическое измерение сердечного выброса, измерение сатурации O2, интраоперационная чреспищеводная эхокардиография, постоянная оценка диуреза [208, 218, 219].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.3.3 Регулярные клинические обследования и консультации пациентов после трансплантации сердца
Пожизненное наблюдение центром трансплантации всех пациентов после трансплантации сердца рекомендовано в связи с: 1) с наличием риска острого или хронического отторжения трансплантата, 2) необходимостью в подборе дозировок, мониторировании эффективности и безопасности иммуносупрессивной терапии, 3) высоким риском развития инфекционных осложнений и новообразований, 4) развитием сопутствующих заболеваний и осложнений, требующих вмешательства или коррекции терапии [208, 230];
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
При длительном наблюдении пациентов после трансплантации сердца рекомендован мультидисциплинарный подход с участием врачей-хирургов, врачей-кардиологов, врачей-диетологов, врачей-психотерапевтов и др. Сами пациенты и лечащие врачи должны сознавать, что после трансплантации сердца требуется пожизненное наблюдение специалистов [208, 230]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Наблюдение пациентов в отдаленном периоде после трансплантации сердца рекомендовано осуществлять специалистам центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки [208, 230];
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Местным органам здравоохранения рекомендуется информировать центр трансплантации в случаях: любой госпитализации пациента в лечебное учреждение; изменений медикаментозной терапии, включая назначение любых антибиотиков, противогрибковых или противовирусных средств; перевод на лекарственный препарат другого торгового наименования внутри одного МНН при его центральной закупке допускается при отсутствии данных об индивидуальной непереносимости, строго под наблюдением врача и под контролем концентрации лекарственного препарата в крови; развития артериальной гипотонии или снижения уровней систолического АД более чем на 20 мм рт. ст. по сравнению с прежними уровнями; подъема температуры до 38 °C в течение двух суток; выполнения любых хирургических вмешательств; появления жалоб на одышку; пневмонии или любых инфекционных заболеваний органов дыхания; появления болей в грудной клетке; боли в животе; появления тошноты, рвоты или диареи; клинических признаков нарушения мозгового кровообращения, обморока или изменений когнитивного (ментального) статуса [208, 228 - 230].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Основными задачами регулярной плановой госпитализации пациентов после трансплантации сердца являются выявление признаков отторжения трансплантата и возможных нежелательных событий. Рекомендовано включить в план обследования: полное физикальное обследование; анализ изменений в клинических назначениях и выявление возможной связи изменений в назначениях с изменением клинического статуса пациента; общий и биохимический анализы крови; эхокардиографическое исследование; коронарография (каждые 2 года); проведение эндомиокардиальной биопсии согласно графику; проведение обучения в рамках образовательных программ для пациентов, их родственников и медицинских работников разных специальностей, работающих с пациентом [208, 230];
Уровень убедительности рекомендаций B (уровень достоверности доказательств 5)
- Рекомендовано проведение эндомиокардиальных биопсий планово однократно в первую госпитализацию после трансплантации сердца, в последующие госпитализации проведение биопсии миокарда по показаниям [208, 236, 237].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.3.4 Рекомендации по лечению пациентов с недостаточностью трикуспидального клапана сердечного трансплантата
- При выявлении во время операции регургитации 2 и более степени на трехстворчатом клапане рекомендована повторная оценка с помощью трансторакальной или чрезпищеводной эхокардиографии в течение 24 часов после ТС. В дальнейшем рекомендовано руководствоваться клиническими и гемодинамическими проявлениями [239 - 240].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- Рекомендовано выполнение аннулопластики трикуспидального клапана по методу ДеВега для нормализации размеров фиброзного кольца [238 - 240].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.4 Иммуносупрессивная терапия
Трансплантация органа стимулирует развитие иммунного ответа, который может привести к дисфункции и потере трансплантата. Прием иммуносупрессивной терапии направлен на подавление ответа иммунной системы реципиента и предупреждает развитие отторжения. Лекарственные препараты, рекомендуемые вне показаний (офф-лейбл), возможно использовать только при коде МКБ-10 Z94.8 (в соответствии с распоряжением Правительства РФ от 16.05.2022 N 1180-р "Об утверждении перечня заболеваний или состояний (групп заболеваний или состояний), при которых допускается применение лекарственного препарата в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению")
- Все реципиенты сердечного трансплантата должны получать иммуносупрессивную терапию пожизненно, начиная с момента трансплантации сердца [208, 481 - 483]. Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарий: Риск отторжения сердечного трансплантата сохраняется пожизненно. Успех трансплантации сердца во многом зависит от развития эффективных стратегий иммуносупрессивной терапии. Целью комбинированной иммуносупрессивной медикаментозной терапии у пациентов после трансплантации сердца является профилактика острого отторжения трансплантата, васкулопатии, инфекционных и неинфекционных осложнений послеоперационного периода. В настоящее время выделяют индукционную и поддерживающую иммуносупрессивную терапию, а также дополнительные средства для лечения отторжения трансплантата. Индукционная терапия предполагает периоперационное назначение мощных средств с мощным иммуносупрессивным действием. Необходимость в индукционной периоперационной иммуносупрессии обусловлена тем, что иммунный ответ против донорского органа наиболее выражен в первые часы после трансплантации, что объясняется выраженной экспрессией донорских антигенов, вызванных агональным состоянием, смертью донорского мозга, феноменом ишемии-реперфузии и хирургической травмой. Индукционная иммуносупрессивная терапия позволяет существенно снизить риск отторжения или дисфункции донорского органа. Стандартная поддерживающая иммуносупрессивная терапия подразумевает назначение ингибиторов кальциневрина - такролимуса** или циклоспорина** в комбинации с препаратами микофенолата мофетила** или микофенолата натрия и глюкокортикоидом. Со временем производится коррекция поддерживающей иммуносупрессивной терапии с целью снизить риск развития побочных действий, предполагающая минимизацию (уменьшение доз такролимуса** или циклоспорина** и/или глюкокортикоидов) [511, 512].
3.4.1 Индукционная иммуносупрессивная терапия у реципиентов сердца
- Решение о применении индукционной иммуносупрессивной терапии при проведении трансплантации сердца принимается индивидуально для каждого пациента с учетом риска развития острого отторжения трансплантата, почечной дисфункции, инфекционных осложнений и злокачественных новообразований [208].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 1)
Комментарий: Убедительных доказательств эффективности и безопасности рутинного использования индукционной иммуносупрессивной терапии в настоящее время не получено [468].
- Индукционная иммуносупрессивная терапия с использованием #базиликсимаба** или иммуноглобулина антитимоцитарного** рекомендована реципиентам с высоким риском отторжения сердечного трансплантата (пациенты с донор-специфическими антителами, лица молодого возраста, лица женского пола, особенно рожавшие женщины, и пр.), а также пациентам с нарушением функции почек [451 - 454, 460, 505 - 507].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Целью индукционной иммуносупрессивной терапии является обеспечение интенсивной иммуносупрессии в раннем послеоперационном периоде, когда риск отторжения трансплантата сердца наиболее высок. Основные преимущества использования индукционной иммуносупрессивной терапии заключаются в нефропротективном действии (она позволяет отсрочить назначение нефротоксичных иммуносупрессивных средств), а также в возможности быстрее уменьшить дозы или прекратить прием глюкокортикоидов после трансплантации сердца [451, 452, 453, 454].
По данным Международного общества трансплантации сердца и легких (ISHLT), для индукционной иммуносупрессии у реципиентов сердца наиболее широко в мире используются антагонист рецепторов интерлейкина-2 #базиликсимаб** (примерно в 30% случаев) и иммуноглобулин антитимоцитарный** (20% трансплантаций сердца) [455].
Иммуноглобулин антитимоцитарный** является препаратом поликлональных антител, получаемых путем иммунизации лошадей или кроликов тимоцитами человека. Получаемые антитела, направлены против широкого спектра антигенов T-клеток человека, и вызывают быстрое истощение T-лимфоцитов, индуцируя комплемент-опосредованный цитолиз и клеточно-опосредованную опсонизацию в селезенке и печени. Прямых сравнительных исследований лошадиного и кроличьего иммуноглобулина антитимоцитарного** при трансплантации сердца не проводилось, но данные, полученные при трансплантации почки позволяют предположить, что кроличий иммуноглобулин антитимоцитарный** может более эффективно снижать риск отторжения трансплантированного органа как в раннем послеоперационном периоде, так и в отдаленном, в связи с более выраженной и длительной индуцируемой лимфопенией [456, 457].
Введение препаратов иммуноглобулина антитимоцитарного** может сопровождаться лихорадкой, ознобом, тахикардией, артериальной гипер- или гипотонией, миалгией и сыпью. При развитии этих побочных действий инфузия препарата временно прекращается и может быть возобновлена с более низкой скоростью. Премедикация глюкокортикоидами и антигистаминными средствами может уменьшить тяжесть симптомов или предотвратить их развитие. В отдаленном периоде наблюдается более высокий риск развития оппортунистических инфекций, особенно цитомегаловирусной, и увеличение частоты и агрессивности посттрансплантационных злокачественных новообразований [458, 459].
В последние годы были опубликованы результаты нескольких ретроспективных наблюдательных исследований, показавших, что индукционная иммуносупрессивная терапия, вне зависимости от используемого средства, достоверно улучшает выживаемость и снижает риск развития отторжения. Сравнительный анализ, результаты которого следует интерпретировать с осторожностью, показывает, что использование иммуноглобулина антитимоцитарного** в качестве средства индукционной иммуносупрессии у реципиентов сердца, по сравнению с базилаксимабом, достоверно лучше влияет на отдаленный прогноз, но в течение 1-го года после операции явных различий выявлено не было.
Так, анализ исходов 2275 трансплантаций сердца у детей до 18 лет показал, что применение #базиликсимаба** для индукционной терапии по сравнению с иммуноглобулином антитимоцитарным** было связано с худшей выживаемостью через 5 лет (68% против 76%, соответственно, p < 0.001) и через 10 лет (49% против 65%, соответственно, p < 0.001) после операции. Более высокая смертность на фоне #базиликсимаба** была связана с отторжением сердечного трансплантата (p = 0.013), но не с сердечно-сосудистыми причинами, инфекциями или злокачественными новообразованиями. Многофакторный анализ показал, что применение #базиликсимаба** у детей в качестве индукционной иммуносупрессивной терапии, по сравнению с иммуноглобулином антитимоцитарным**, повышает риск смерти от всех причин (отношение рисков 1.27; 95% ДИ 1.02 - 1.57; p = 0.030) [460].
Ретроспективное изучение исходов 9324 случаев трансплантаций сердца у взрослых, выполненных в период с 2000 по 2011 г., показало, что пяти- и десятилетняя выживаемость реципиентов была достоверно выше среди получивших в качестве индукционной иммуносупрессии препарат иммуноглобулина антитимоцитарного** (77% против 82%, p = 0.005, и 64% против 67%, p = 0.007, соответственно). Авторы исследования отметили, что сравниваемые подгруппы исходно отличались по количеству выявляемых иммунореактивных антител, тяжести состояния и количеству больных с первичным диагнозом ишемической болезни сердца, что могло оказать влияние на прогноз [461].
В другом ретроспективном исследовании, наоборот, использование кроличьего иммуноглобулина антитимоциторного** сопровождалось более высоким риском смерти (ОШ = 1.23; 95% ДИ = 1.05 - 1.46, p = 0.01) по сравнению с #базиликсимабом** или отсутствием индукционной иммуносупрессивной терапии [462].
Tzani A. и соавт. ретроспективно проанализировали исходы трансплантаций сердца, зарегистрированных в системе UNOS США в период с 2010 по 2020 г. Было выявлено 28634 случая, среди которых 50.1% не проводилась индукционная терапия, 21.3% вводился иммуноглобулин антитимоцитарный**, 27.9% антагонисты к рецептору интерлейкина-2, остальные 0.8% получали иные иммуносупрессивные средства. Результаты показали, что назначение индукционной иммуносупрессивной терапии сопровождалось достоверно более низкими показателями риска смерти от всех причин и нефатального отторжения сердечного трансплантата через 30 дней и через год после операции. По сравнению с антагонистами к рецептору интерлейкина-2, использование иммуноглобулина антитимоцитарного** в качестве индукционной иммуносупрессии сопровождалось достоверно более низкой смертностью и частотой нефатальных эпизодов отторжения сердечного трансплантата [463].
- #Базиликсимаб** в качестве индукционной иммуносупрессивной терапии при трансплантации сердца у взрослых рекомендуется вводить дважды в дозе 20 мг - в день трансплантации сердца и на 4-е сутки после операции. [484, 485]
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- #Базиликсимаб** в качестве индукционной иммуносупрессивной терапии при трансплантации сердца у детей рекомендуется вводить дважды в дозе 20 мг - в день трансплантации сердца и на 4-е сутки после операции. [486, 487]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Безопасность, хорошая переносимость и эффективность базиликсимаба** в качестве индукционной терапии при трансплантации сердца при введении в дозе 20 мг в день трансплантации и на 4-е сутки после операции была продемонстрирована в ряде контролируемых рандомизированных исследований [464, 465].
- Рекомендовано использовать #базиликсимаб** реципиентам с ожидаемым повышенным риском развития оппортунистических инфекций в качестве приоритетного средства для индукционной иммуносупрессии [466, 506].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: В 6-месячном проспективном рандомизированном многоцентровом открытом исследовании с участием 80 реципиентов сердца было показано, что использование в качестве индукционной иммуносупрессивной терапии #базиликсимаба** (в дозе 20 мг в день операции и на 4-е сутки после трансплантации сердца) по сравнению с иммуноглобулином антитимоцитарным** (в дозе 2.5 мг/кг/день в течение 3 - 5 дней после операции) сопровождается меньшей частотой возникновения комбинированной конечной точки (смерть, потеря трансплантата, острое клеточное отторжение, острая сердечная недостаточность) и меньшим риском смерти, связанной с инфекционными осложнениями [466].
- Реципиентам с ожидаемым повышенным риском развития оппортунистических инфекций #базиликсимаб** может быть назначен в низкой дозе - 10 мг - в день трансплантации сердца и на 4-е сутки после операции [467].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Kittipibul V. и соавт. изучили эффективность и безопасность #базиликсимаба** в низкой дозе в проспективном исследовании с участием 17 последовательных реципиентов сердца. #Базиликсимаб** в качестве индукционной терапии вводился по 10 мг внутривенно в день трансплантации сердца и через 4 дня после операции. Через 2 недели наблюдения все больные были живы, эпизодов клеточного отторжения острого тяжелее ISHLT >= 2R не отмечалось. К концу 1 года наблюдения 1 (6%) пациент погиб на фоне инфекционных осложнений, выявлено 2 (12%) случая острого клеточного отторжения трансплантата сердца, 6 (35%) случаев бессимптомных цитомегаловирусных инфекций и 4 (25%) случаев инфекций, требовавших лечение [467].
3.4.2 Поддерживающая иммуносупрессивная терапия
- Препараты ингибитора кальциневрина - такролимуса** или циклоспорина** рекомендуются всем пациентам в качестве поддерживающей иммуносупрессивной терапии после трансплантации сердца [249]
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарий: Эффективность и безопасность циклоспорина** изучалась в целом ряде рандомизированных клинических исследований [247 - 254, 469]. Результаты показали сходное влияние такролимуса** и цилоспорина**, на выживаемость пациентов, но более высокую эффективность такролимуса** в снижении частоты случаев острого отторжения сердечного трансплантата [247, 469] более благоприятный профиль переносимости (метаболические нарушения, артериальная гипертония, дислипидемия) при применении такролимуса**. В то же время, в одном из исследований [247] была выявлена более высокая частота посттрансплантационного сахарного диабета при применении такролимуса**.
Прием такролимуса** начинают со 2 - 3-го дня после операции. В течение 1-й недели, контролируя под контролем клиренса креатинина, дозу такролимуса** повышают с 0.05 до 0.1 - 0.2 мг/кг сутки, поддерживая в последующем концентрацию такролимуса** в крови 10 - 15 нг/мл в течение первого года после операции. Через год после трансплантации сердца дозу такролимуса** рекомендовано подбирать таким образом, чтобы концентрация препарата в крови составляла 5 нг/мл. Использование такролимуса** по сравнению с циклоспорином** сопровождается более низким риском развития отторжения сердечного трансплантата [250 - 253]. Такролимус** назначается в сочетании с препаратами #микофенолата мофетила** в дозе 2000 мг/сут, или #микофеноловой кислоты** в дозе 1440 мг/сут) [208, 241, 243, 245, 488, 489].
- Рекомендовано назначать #микофеноловую кислоту** и #миокофенолата мофетил** неопределенно долго в составе комбинированной иммуносупрессивной терапии в сочетании с такролимусом** или циклоспорином** [241, 243, 245, 249, 256, 261, 488, 489].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Препараты микофеноловой кислоты и глюкокортикоиды потенцируют иммуносупрессивное действие такролимуса** или циклоспорина**, позволяют использовать меньшие дозы последних, что снижает их токсичность. #Микофеноловая кислота** и #микофенолата мофетил** заменили азатиоприн** в качестве дополнительного иммуносупрессивного средства [289, 303, 395]. #Микофенолата мофетил** является пролекарством, которое быстро гидролизуется до своей активной формы, микофеноловой кислоты**. #Микофеноловая кислота**, в свою очередь, является обратимым ингибитором инозинмонофосфатдегидрогеназы, критического фермента для синтеза гуаниновых нуклеотидов. Этот фермент является ключевым для лимфоцитов в синтезе РНК и ДНК и подавление его активности избирательно ингибирует пролиферацию T- и B-лимфоцитов. В контролируемом многоцентровом рандомизированном исследовании #микофенолата мофетил** сравнивали с азатиоприном при использовании в сочетании с циклоспорином и глюкокортикоидами у 650 реципиентов сердца. Прием #микофенолата мофетила** был связан с достоверным снижением как смертности (6% против 11%, p = 0,031), так и частоты нефатального отторжения трансплантата сердца (66% против 74%, p = 0,026) через один год после операции [470].
Микофенолат натрия (действующее вещество) представляет собой соль #микофеноловой кислоты** с замедленным высвобождением, покрытую кишечнорастворимой оболочкой, разработанную для улучшения переносимости микофенолата в верхних отделах желудочно-кишечного тракта. В ряде исследований была доказана терапевтическая эквивалентность этого препарата #микофенолата мофетилу** в отношении снижения риска острого отторжения, потери сердечного трансплантата или смерти [471, 472].
#Микофенолата мофетил** в дозе 2000 мг/сут, или #микофеноловая кислота в дозе 1440 мг/сут, назначаются дополнительно к такролимусу** и метилпреднизолону** неопределенно долго. Препараты микофеноловой кислоты, в отличие от азатиоприна**, в комбинации с такролимусом** или циклоспорином** позволяют более эффективно снизить риск отторжения сердечного трансплантата и посттрансплантационной нефропатии.
- Рекомендованы препараты глюкокортикоидов всем пациентам в составе индукционной и поддерживающей иммуносупрессивной терапии после трансплантации сердца, а также при лечении отторжения сердечного трансплантата у взрослых [249, 473 - 475].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Рекомендованы препараты глюкокортикоидов всем пациентам в составе индукционной и поддерживающей иммуносупрессивной терапии после трансплантации сердца, а также при лечении отторжения сердечного трансплантата у детей [490].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Глюкокортикоиды являются неспецифическими противовоспалительными и иммуносупрессивными средствами, которые прерывают несколько этапов иммунной активации, включая презентацию антигена, продукцию цитокинов и пролиферацию лимфоцитов. Хотя глюкокортикоиды высокоэффективны для профилактики и лечения острого отторжения, их длительное применение связано с рядом побочных эффектов, включая развитие или ухудшение сахарного диабета, гиперлипидемию, артериальную гипертензию, задержку жидкости, миопатию, остеопороз и предрасположенность к оппортунистическим инфекциям. Назначение глюкокортикоидов начинают сразу при отключении от аппарата искусственного кровообращения после операции по трансплантации. Метилпреднизолон** обычно назначают в начальной дозе 500 мг, затем по 125 мг каждые восемь часов в течение первых 24 часов после трансплантации. После экстубации продолжается пероральный прием метилпреднизолона**, начиная с 0,5 мг/кг с постепенным снижением к концу 6-й недели после ТС до 0,05 - 0,1 мг/кг. Доза преднизолона** снижается до 0,2 мг/кг/сутки с последующим снижением до 0,05 мг/кг к 4 неделе после ТС. С целью снижения риска развития побочных действий доза метилпреднизолона** в течение 6 - 12 месяцев после операции постепенно снижается до 5 мг в сутки (однократно, перорально) и может быть прекращена примерно у половины пациентов [208, 241, 243, 245].
3.4.3 Минимизация иммуносупрессивной терапии
- Рекомендовано постепенное снижение суточной дозы глюкокортикостероидов у реципиентов сердца с низким риском развития отторжения сердечного трансплантата: суточная доза метилпреднизолона** постепенно снижается до 4 мг в сутки (однократно, перорально) в течение 6 - 12 недель после операции [246, 491 - 493].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарий: У большинства пациентов с низким риском развития отторжения трансплантата поддерживающая иммуносупрессивная терапия будет заключаться в приеме такролимуса** или циклоспорина** в комбинации с #микофеноловой кислотой** и метилпреднизолоном** в дозе 4 мг/сут. Дальнейшее уменьшение доз иммуносупрессивных средств возможно у пациентов с низким риском отторжения. Принимая во внимание узкий терапевтический диапазон иммуносупрессивных средств, высокий риск развития побочных действий и нежелательных лекарственных взаимодействий, иммуносупрессивную терапию рекомендовано подбирать с учетом индивидуальных особенностей пациентов [241]. В связи с тем, что на фоне приема глюкокортикостероидов может отмечаться ряд нежелательных побочных действий, уменьшение дозы принимаемых препаратов было бы желательным, если это снижение не приведет к отторжению трансплантата (если безопасно). Уменьшение дозы глюкокортикоидов в первую очередь возможно у пациентов с низким риском развития отторжения трансплантата. Признаки пациентов с низким риском развития отторжения трансплантата:
- отсутствие циркулирующих антител к лейкоцитарным антигенам человека (HLA);
- нерожавшие женщины;
- отсутствие эпизодов отторжения в анамнезе;
- лица старшего возраста.
- Рекомендована отмена глюкокортикоидов в течение 3 - 6 месяцев после трансплантации сердца у пациентов с низким риском отторжения трансплантата (пациенты без циркулирующих анти-HLA, нерожавшие женщины, пациенты без отторжения в анамнезе, пациенты старшего возраста) [241, 246, 249, 256, 491, 494 - 496].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Минимизация глюкокортикоидов и их отмена рассматривается как благоприятный фактор для увеличения продолжительности и улучшения качества жизни пациентов за счет исключения побочных эффектов длительной терапии глюкокортикоидами.
Прием глюкокортикостероидов может сопровождаться нарушениями углеводного обмена (развития толерантности к глюкозе, сахарного диабета 2-го типа), дислипидемией, артериальной гипертонией, остеопорозом, повышением риска развития инфекционных осложнений.
У пациентов после трансплантации сердца (ТС) большее количество несовпадений по HLA антигенам является важным фактором риска нежелательных событий в случае снижения дозы глюкокортикоидов. Таким образом, при выборе индивидуальной тактики лечения глюкокортикоидами необходимо учитывать степень иммунологического несоответствия между донорским органом и реципиентом.
По данным исследований, ранняя отмена преднизолона** в течение первого месяца после трансплантации сердца была успешна у 49 - 70% пациентов. В связи с тем, что чаще всего острое отторжение трансплантата развивается в течение первых месяцев после трансплантации сердца, отмена глюкокортикоидов по прошествии месяцев может быть успешно проведена у 80% пациентов, даже при отсутствии предшествующей индукционной терапии. Согласно данным регистра Международного общества трансплантации сердца и легких (ISHLT), более 40% пациентов могли успешно обходиться без глюкокортикоидов на протяжении 5-летнего периода. Обычно при отмене глюкокортикоидов руководствуются стандартизированным протоколом и контрольными результатами серийной биопсии миокарда.
3.4.4 Конверсия такролимуса** или циклоспорина** на ингибиторы сигнала пролиферации (m-TORi) #сиролимус или эверолимус**
- С целью снижения риска развития нежелательного нефротоксического действия и васкулопатии коронарных артерий пересаженного сердца спустя 6 месяцев после операции трансплантации сердца некоторым взрослым пациентам может быть рекомендована смена такролимуса** или циклоспорина** на #сиролимус или эверолимус** [255, 260, 261, 258, 497, 508].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- С целью снижения риска развития нежелательного нефротоксического действия и васкулопатии коронарных артерий пересаженного сердца спустя 6 месяцев после операции трансплантации сердца некоторым детям может быть рекомендована смена такролимуса** или циклоспорина** на #сиролимус или #эверолимус** [497, 498].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Ингибиторы сигнала пролиферации, или ингибиторы мишени рапамицина (mTOR) млекопитающих, использовался у отдельных пациентов с нарушением функции почек, васкулопатией сердечного аллотрансплантата или злокачественными новообразованиями с целью замедлить прогрессирование этих осложнений. Однако высокая частота побочных эффектов, связанных с их приемом, включая замедленное заживление послеоперационных ран, ограничивает их широкое использование в раннем периоде после трансплантации сердца [258, 476, 477].
#Сиролимус и эверолимус**, имеют схожие механизмы действия, не зависящие от кальциневрина и обусловленные ингибированием цитоплазменной протеинкиназы - мишени рапамицина млекопитающих (mTOR). Эта протеинкиназа участвует в передаче сигналов от рецептора интерлейкина 2 к ядру, вызывая подавление пролиферации T- и B-лимфоцитов в ответ на сигналы цитокинов.
Эффективность #сиролимуса в качестве альтернативы азатиоприну** оценивалась в проспективном открытом рандомизированном исследовании с участием 136 реципиентов сердца. Пациенты были рандомизированы в соотношении 2:1 для получения одной из двух доз #сиролимуса (3 или 5 мг) или азатиоприна**. Дозы #сиролимуса впоследствии корректировали в обеих группах для достижения сходных целевых уровней в крови. Все больные получали одновременную иммуносупрессию циклоспорином** и глюкокортикостероидами. По сравнению с азатиоприном**, доля пациентов с подтвержденным биопсией эпизодом острого клеточного отторжения средней и тяжелой степени через шесть месяцев была ниже в группах, получавших #сиролимус как в дозе 3 мг/сут (32% против 57%, p = 0.027), так и 5 мг/сут (33% против 57%, p = 0.013). Кроме того, прогрессирование васкулопатии сердечного трансплантата, определяемое с помощью внутрисосудистого ультразвукового исследования, было достоверно ниже в группе, получавшей сиролимус, как через шесть месяцев, так и через два года. Выживаемость пациентов через 12 месяцев была сопоставима между группами [258].
Эффективность эверолимуса** изучалась в ходе 24-месячного многоцентрового рандомизированного исследования с участием 721 реципиента сердца [478]. Пациенты были рандомизированы для получения одной из двух доз эверолимуса** (1.5 мг/день или 3.0 мг/день в несколько приемов) со сниженной дозой циклоспорина** или микофенолата мофетила** со стандартной дозой циклоспорина**. Набор в группу эверолимуса** с более высокой дозой (3.0 мг/день) был преждевременно прекращен из-за более высокой частоты ранней смертности, в основном из-за инфекций. Было обнаружено, что эверолимус** не уступает микофенолата мофетилу** в отношении острого клеточного отторжения, потери трансплантата или смерти. У пациентов, получавших эверолимус**, наблюдалось замедление прогрессирования утолщения интимы коронарных артерий по данным внутрисосудистого ультразвукового исследования через 12 месяцев после трансплантации. В группе эверолимуса** по сравнению с группой миокфенолата мофетила** было зарегистрировано больше нефатальных серьезных нежелательных явлений, особенно перикардиального выпота, и более высокая частота отмены препарата из-за нежелательных явлений.
Начальная доза #эверолимуса** у реципиентов сердца детского и взрослого возраста составляет 0.8 мг дважды в сутки, ее корректируют в зависимости от минимальной концентрации препарата в крови. Целевые уровни в крови составляют от 3 до 8 нг/мл при использовании в сочетании с такролимусом** или циклоспорином** и от 6 до 10 нг/мл при использовании без этих средств. #Сиролимус пациентам назначался в дозе 5 мг дважды в день в течение первых двух дней, далее - по 2 мг ежедневно. Уровни сиролимуса в крови определялись еженедельно пока не была достигнута стабильная концентрация 6 - 12 нг/мл. [436, 479, 498, 508].
- Не рекомендовано назначение #сиролимуса или эверолимуса** в течение первых шести месяцев после трансплантации сердца [259, 262, 476, 498].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3) Комментарий: Высокая частота побочных действий, связанных с приемом этих средств, включая замедленное заживление послеоперационных ран, ограничивает их широкое использование в раннем периоде после трансплантации сердца [476].
Не рекомендована замена микофенолата мофетила** на ингибиторы протеинкиназы с целью уменьшения дозы такролимуса** или циклоспорина** для профилактики нефротоксического действия последних в связи с тем, что #сиролимус и эверолимус** могут потенцировать нефротоксическое действие такролимуса** или циклоспорина** [241, 254, 262].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У отдельных пациентов с низким риском развития отторжения трансплантата рекомендована ранняя отмена глюкокортикоидов и назначение такролимуса** или циклоспорина** в монотерапии [241, 245].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Небольшое количество исследований было посвящено эффективности и безопасности назначения такролимуса** или циклоспорина** пациентам после трансплантации сердца в монотерапии. В одном небольшом исследовании была показана возможность первоначального назначения такролимуса** в комбинации с преднизолоном**, в последующем у 5% пациентов было прекращено назначение преднизолона**, которое сопровождалось приемлемым уровнем отторжения трансплантата и отдаленной выживаемости. В последующем рандомизированном исследовании без индукционной терапии и с ранней отменой глюкокортикостероидов были выявлены сравнимые уровни отторжения трансплантата в группах пациентов, получавших тройную комбинацию и такролимус** или циклоспорин** в монотерапии в течение 1-го года после трансплантации сердца. Однако необходимы дополнительные исследования для оценки влияния такого подхода на риск смерти, отторжения трансплантата, почечной недостаточности, васкулопатии трансплантата и новообразований.
3.4.5 Неиммуносупрессивная (адьювантная) медикаментозная терапия
- Взрослым реципиентам сердца, независимо от уровней холестерина, рекомендовано назначение средств из группы ингибиторов ГМГ-КоА редуктазы (статинов) [265, 266].
Для взрослых: Уровень убедительности рекомендаций A (уровень достоверности доказательств 3)
Для детей: Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано назначать начальные дозы ингибиторов ГМГ-КоА редуктазы ниже, чем рекомендуемые для профилактики нежелательных событий в общей популяции, в связи с учетом особенностей лекарственного взаимодействия [271].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендованы ингибиторы ГМГ-КоА-редуктазы детям и подросткам с высоким риском развития болезни коронарных артерий сердечного трансплантата [268].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендован прием ингибиторов ГМГ-КоА редуктазы пациентам после трансплантации сердца, в связи с тем, что он снижает риск развития БКАПС и улучшает выживаемость без нежелательных событий, включая снижение риска развития злокачественных новообразований и улучшение общей выживаемости [269 - 271].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 3)
3.5 Лечение отторжения сердечного трансплантата
3.5.1 Рекомендации по лечению острого клеточного отторжения
- При подозрении на острое отторжение трансплантата рекомендовано проведение эндомиокардиальной биопсии с проведением патолого-анатомического исследования биопсийного (операционного) материала как можно раньше [284, 434].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентов с клинической картиной криза отторжения рекомендовано госпитализировать, а при наличии сопутствующих гемодинамических нарушений рекомендовано перевести в отделение интенсивной терапии [285].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Внутривенная пульс-терапия глюкокортикоидами в высоких дозах рекомендована как средство первого выбора при наличии клинических симптомов острого клеточного отторжения независимо от степени тяжести отторжения [275].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При сохранении признаков нарушения гемодинамики на фоне проведенной пульс-терапии глюкокортикоидами или отсутствия признаков улучшения в течение 12 - 24 часов после начала введения глюкокортикоидов [278, 499], рекомендовано назначение антитимоцитарного иммуноглобулина**.
Для взрослых: Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
Для детей: Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано проведение внутривенной терапии адренергическими и дофаминергическими средствами для поддержания адекватного сердечного выброса и системного артериального давления до восстановления адекватной сократительной функции трансплантата сердца [230, 284, 500, 501].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Одновременно с пульс-терапией глюкокортикоидами и введением иммуномодулирующих или иммунодепрессивных средств рекомендовано проведение профилактической терапии антибактериальными препаратами системного действия [208, 231].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- С целью снижения риска рецидива отторжения рекомендовано назначение адекватной поддерживающей терапии иммунодепрессантами. Возможные варианты коррекции поддерживающей иммуносупрессивной терапии включают увеличение доз принимаемых иммунодепрессивных средств, добавление нового компонента или замену одного препарата на другой. Также необходимо оценить соблюдение пациентом режима приема лекарственных средств [208, 231].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Следующую эндомиокардиальную биопсию рекомендовано выполнять через 1 - 2 недели от начала лечения острого клеточного отторжения [208, 237].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Для оценки эффективности терапии у пациентов с острым отторжением рекомендовано использование трансторакального эхокардиографического исследования сократительной функции трансплантата сердца [282, 502].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 2)
- У пациентов с клиническими признаками сердечной недостаточности и легкой степенью острого клеточного отторжения, оцененного по результатам гистологического исследования, рекомендовано подозревать острое гуморальное (антителоопосредованное) отторжение [208, 285].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Базиликсимаб** не рекомендовано применять для лечения острого клеточного отторжения трансплантата сердца [208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.5.2 Рекомендации по лечению бессимптомного острого клеточного отторжения
- При выявлении во время проведения планового патолого-анатомического исследования биопсийного материала тканей миокарда гистологических признаков тяжелого острого клеточного отторжения рекомендовано лечение, несмотря на отсутствие симптомов отторжения или дисфункции трансплантата [296].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При тяжелом бессимптомном остром клеточном отторжении (3) рекомендовано проводить внутривенную пульс-терапию глюкокортикоидами [275].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При тяжелом и умеренном бессимптомном остром клеточном отторжении (3 и 2) рекомендована коррекция поддерживающей иммуносупрессивной терапией (увеличение дозы принимаемых иммунодепрессантов, добавление нового компонента или замена на другой лекарственный препарат) [282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- В медикаментозную терапию при лечении отторжения рекомендовано включать профилактическое назначение антибактериальных препаратов системного действия [230, 294].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Повторную эндомиокардиальную биопсию рекомендовано выполнять через 2 - 4 недели от начала лечения тяжелого или умеренного бессимптомного острого клеточного отторжения [282, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Бессимптомное острое клеточное отторжение легкой степени (1) в большинстве случаев не рекомендовано для лечения [280, 281].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Бессимптомное острое клеточное отторжение умеренной степени в сроки более года после ТС также может самостоятельно регрессировать без лечения, но в таком случае рекомендован тщательный мониторинг, включающий оценку клинической картины, эхокардиографию, повторные эндомиокардиальные биопсии [281].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
3.5.3 Рекомендации по лечению возвратного/резистентного клеточного отторжения сердечного трансплантата
- При возвратном или стероидорезистентном остром клеточном отторжении рекомендуется проводить лечение иммуноглобулином антитимоцитарным** [278].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- При развитии у пациента возвратного или стероидорезистентного криза клеточного отторжения схему поддерживающей иммуносупрессивной терапии рекомендовано пересмотреть [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Независимо от наличия и выраженности клинических признаков недостаточности трансплантата сердца, пациентам с возвратным или резистентным к терапии клеточным отторжением рекомендовано проведение регулярных повторных эхокардиографических исследований с целью мониторирования сократительной функции трансплантата [208, 282].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано проведение дополнительного гистологического исследования на наличие гуморального компонента отторжения и определение наличия в крови реципиента анти-HLA [285].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.5.4 Рекомендации по лечению сверхострого отторжения
- Лечение сверхострого отторжения рекомендовано начать незамедлительно с момента выявления, желательно еще в операционной. Лечение может включать: 1) внутривенную пульс-терапию глюкокортикоидами, 2) плазмаферез, 3) внутривенное введение #иммуноглобулина человека нормального** (в дозе 100 - 1,000 мг/кг 1 - 3 раза в неделю), 4) введение иммунодепрессантов, 5) внутривенное введение адренергических и дофаминергических средств, 6) механическую поддержку кровообращения [436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Для подтверждения диагноза сверхострого отторжения рекомендовано выполнение интраоперационной биопсии миокарда с патолого-анатомическим исследованием биопсийного (операционного) материала [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При неэффективности вышеуказанных методов лечения рекомендуется экстренная ретрансплантация сердца. При этом следует учитывать, что летальность у пациентов со сверхострым отторжением трансплантата достаточно высока [326, 503].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
3.5.5 Рекомендации по лечению острого гуморального отторжения сердечного трансплантата
- С целью уменьшения повреждающего действия антител на трансплантат сердца рекомендовано использовать: внутривенное введение глюкокортикоидов в высоких дозах и/или иммунодепрессантов [285, 288, 504].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Для удаления циркулирующих анти-HLA или снижения их активности рекомендовано использовать: плазмаферез, иммуноадсорбция, внутривенное введение препаратов #иммуноглобулина человека нормального** (в дозе 100 - 1,000 мг/кг 1 - 3 раза в неделю) [291, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- Для поддержания адекватного сердечного выброса и артериального давления рекомендовано назначение адренергических и дофаминергическими средствами, использование систем вспомогательного кровообращения [230, 284].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- При подозрении на гуморальное отторжение рекомендовано выполнять патолого-анатомическое исследование биопсийного (операционного) материала тканей миокарда, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для выявления компонентов системы комплемента и специфических антител [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется проведение пробы на совместимость по иммунным антителам реципиента и антигенам главного комплекса гистосовместимости донора [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Повторную эндомиокардиальную биопсию с иммуногистохимическим исследованием рекомендуется проводить через 1 - 4 недели после начала лечения гуморального отторжения [237, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При необходимости рекомендуется провести коррекцию поддерживающей иммуносупрессивной терапии: увеличить дозу принимаемых лекарственных препаратов, добавить новый или заменить один препарат на другой [231, 249, 260].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано назначение антикоагулянтной терапии с целью снижения риска развития тромбоза сосудов трансплантата сердца [85, 208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При неэффективности терапии у пациентов с острым гуморальным отторжением рекомендовано рассмотрение вопроса о возможности выполнения экстренной ретрансплантации [359, 360, 362].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
3.5.6 Рекомендации по лечению позднего острого отторжения трансплантата
- При выявлении признаков острого отторжения сердечного трансплантата рекомендуется оценить адекватность назначений и соблюдение пациентом режима приема иммуносупрессивных лекарственных средств [231, 276, 346].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано составление индивидуального графика проведения плановой биопсии миокарда у пациентов с высоким риском развития острого отторжения трансплантата сердца в отдаленные сроки после операции [237, 295].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендуется обучение пациентов выявлению у себя клинических признаков отторжения трансплантата и разъяснение необходимости тщательного соблюдения режима назначений лекарственной терапии и образа жизни для снижения риска нежелательных событий и улучшению отдаленного прогноза [208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Частое проведение повторных биопсий миокарда у пациентов с низким риском отторжения не рекомендуется, так как не способствует улучшению прогноза, следует учитывать риск осложнений при проведении биопсии миокарда [237, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У пациентов с низким риском развития отторжения трансплантата рекомендуется применение неинвазивных функциональных методов диагностики в отдаленном периоде после трансплантации сердца, так как они могут быть альтернативой частым повторным биопсиям миокарда [208, 225, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.6 Рекомендации по диагностике и лечению болезни коронарных артерий пересаженного сердца
- Рекомендуется проведение коронарографии один или два раза в год, что позволяет оценить состояние коронарных артерий пересаженного сердца и на ранних этапах выявить БКАПС. При отсутствии БКАПС спустя 3 - 5 лет после трансплантации сердца, особенно у пациентов с признаками почечной недостаточности, коронарография может выполняться реже [208, 305].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 4)
- Для выявления возможного атеросклеротического поражения коронарных артерий донорского сердца, до 6 недель после трансплантации сердца рекомендовано выполнять ангиографию коронарных артерий [208, 305, 436].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 5)
- Рекомендуется выполнение внутрисосудистого ультразвукового исследования коронарных артерий спустя 4 - 6 недель после трансплантации сердца и через год после трансплантации сердца, что позволяет оценить отдаленный прогноз, выявить наличие атеросклеротического поражения донорского сердца и диагностировать быстропрогрессирующую БКАПС [304, 305, 308].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При подозрении на БКАПС рекомендуется использовать неинвазивные методы выявления ишемии миокарда - проба с физической нагрузкой, стресс-эхокардиографическое исследование или изотопные неинвазивные методы оценки перфузии миокарда, с целью определения показаний для проведения коронарографии [225].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется выполнение ангиопластики коронарных артерий со стентированием, с использованием стентов с лекарственным покрытием как детям, так и взрослым с БКАПС. Этот метод лечения позволяет добиться эффективной реваскуляризации миокарда при наличии возможности ее выполнения [356, 357].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: В настоящее время возможности медикаментозной терапии в лечении васкулопатии трансплантата ограничены. Результаты небольших пилотных исследований, показавших, что #сиролимус эффективен в лечении васкулопатии трансплантата, не были подтверждены в контролируемых исследованиях. При непротяженных, фокальных поражениях эффективным методом лечения является ангиопластика коронарных артерий трансплантата, однако даже при использовании стентов с антипролиферативным лекарственным покрытием частота рестенозов и необходимость в повторных вмешательствах остаются довольно высокими. Сравнение использования стентов с лекарственным покрытием и стентов без лекарственного покрытия показало, что, несмотря на меньшую частоту развития рестеноза после имплантации стентов с лекарственным антипролиферативным покрытием, смертность в течение года после ангиопластики не отличается и составляет 32%.
- Повторная коронарография рекомендуется пациентам, перенесшим трансплантацию сердца, через полгода после ангиопластики коронарных артерий в связи с более высоким риском развития рестенозов [304, 305, 308].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
3.7 Повторная трансплантация сердца (ретрансплантация)
Согласно международным данным, частота повторных трансплантаций сердца составляет около 3%. Наиболее частые показания для ретрансплантации включают васкулопатию сердечного трансплантата, хроническое отторжение, а также первичную дисфункцию трансплантата и острое отторжение. Более благоприятный прогноз после ретрансплантации сердца отмечается у реципиентов, которым повторная трансплантация была выполнена в связи с васкулопатией первичного трансплантата и хроническим отторжением трансплантата, менее благоприятный - у пациентов с острым отторжением или первичной дисфункцией трансплантата.
- Пациентам с признаками необратимого нарушения сократительной функции миокарда сердечного трансплантата или выраженной БКАПС при отсутствии противопоказаний рекомендовано выполнение повторной трансплантации сердца [359 - 361].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Наиболее эффективным способом лечения васкулопатии трансплантата при невозможности выполнения ангиопластики коронарных артерий, особенно у пациентов с признаками нарушения сократительной функции трансплантата сердца, является ретрансплантация. Следует учитывать, что выживаемость в течение первого года после повторной трансплантации хуже, чем после первичной трансплантации сердца, что обусловлено, по всей видимости, тяжестью пациентов и особенностями периоперационного периода. Согласно данным различных регистров, частота повторных трансплантаций сердца составляет примерно 3%. Наиболее частые показания для ретрансплантации включают васкулопатию сердечного трансплантата, а также первичную дисфункцию и острое отторжение. Выживаемость пациентов после ретрансплантации ниже, чем после первичной трансплантации сердца, и составляет примерно 5% в течение 1-го года и 38% в течение 5 лет. Более благоприятный прогноз после ретрансплантации сердца отмечается у пациентов, которым повторная трансплантация была выполнена в связи с васкулопатией первичного трансплантата, менее благоприятный - у пациентов с острым отторжением или первичной дисфункцией трансплантата.
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с клиническими проявлениями сердечной недостаточности в отсутствие признаков острого отторжения трансплантата [326 - 329].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с выраженными изменениями в коронарных артериях трансплантата при отсутствии либо с небольшими/умеренными признаками сердечной недостаточности [326 - 329].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
- Рекомендуется рассмотрение вопроса ретрансплантации у реципиентов с сердечной недостаточностью, развившейся на фоне острого отторжения трансплантата в течение первых месяцев после первой трансплантации сердца [326 - 329].
Уровень убедительности рекомендации C (уровень достоверности доказательств 4)
3.8 Ведение пациентов с трансплантированным сердцем
Ортотопическая трансплантация сердца является эффективным методом лечения терминальной СН, позволяющим значительно улучшить выживаемость, качество жизни, переносимость физической нагрузки и восстановить трудоспособность пациентов [330].
Особенности ведения пациентов после ОТТС определяются рядом специфических факторов, которые включают:
- взаимодействие организма реципиента и сердечного трансплантата,
- необходимость в пожизненном приеме иммуносупрессивной терапии,
- особенность течения основного заболевания, приведшего к терминальной сердечной недостаточности в дотрансплантационном периоде,
- специфические аспекты психологической, физической и социальной адаптации.
Следует учитывать особенности физиологии трансплантированного сердца, являющегося денервированным органом, а именно отсутствие болезненных ощущений при развитии ишемии миокарда, отсутствие вагусного влияния и зависимость сократительной функции левого желудочка от объема притекающей крови [331]. Во время операции трансплантации сердца пересекаются волокна блуждающего нерва, содержащие эфферентные парасимпатические и афферентные чувствительные волокна, и постсинаптические волокна симпатических нервов. Пересечение этих волокон сопровождается необратимой парасимпатической и афферентной денервацией, в то время как симпатические волокна, по крайней мере частично, спустя несколько лет восстанавливаются. Следствием денервации сердца являются тахикардия в состоянии покоя, нарушение барорефлексов, отсутствие болезненных ощущений при ишемии миокарда, зависимость сократительной функции ЛЖ от объема притекающей крови, а также отсроченная и нарушенная реакция на физическую нагрузку [332]. Повышение частоты сердечных сокращений (ЧСС) в состоянии покоя до 80 - 110 в мин. приводит к увеличению минутного объема, объема сердца и, соответственно, повышению АД. Выполнение физической нагрузки у реципиентов сердца сопровождается отсроченной реакцией ЧСС и уровней АД. Оба эти показателя при кратковременных нагрузках могут практически не изменяться. В то же время при прекращении физической нагрузки может наблюдаться "парадоксальное" увеличение ЧСС и АД.
Эмоциональные и болевые раздражители, употребление даже небольшого количества алкоголя могут приводить к гипертоническим кризам, сопровождающимся высокой ЧСС. Для "изолированного" сердца характерно увеличение чувствительности к катехоламинам. При этом общее число адренорецепторов не изменяется, но развивается относительное преобладание числа ![]() -адренорецепторов над количеством
-адренорецепторов над количеством ![]() -адренорецепторов.
-адренорецепторов.
Высокая ЧСС сопровождается избыточной стимуляцией механорецепторов, расположенных в сосудистом эндотелии, активацией генетических проатерогенных механизмов, дисфункцией эндотелия [333], которые могут приводить к повышению ригидности стенок магистральных артерий и увеличению системного сосудистого сопротивления. Важными факторами, определяющими системное сосудистое сопротивление, являются структурные и функциональные показатели гладкомышечных клеток и соединительной ткани артериальной стенки [334]. Прием препаратов такролимуса или циклоспорина, повышение уровней АД, синусовая тахикардия в состоянии покоя, дислипидемия, гипергликемия, циркулирующие антитела, иммунные комплексы и цитокины способствуют развитию структурного и функционального ремоделирования артерий. В одном из наших исследований было показано, что у реципиентов трансплантированного сердца показатель, характеризующий ригидность стенки общей сонной артерии, существенно выше, чем у практически здоровых лиц и неоперированных пациентов с тяжелой сердечной недостаточностью. Более того, величина показателя ригидности стенки общей сонной артерии значительно возрастала во время кризов отторжения сердечного трансплантата и снижалась на фоне их лечения, что легло в основу метода неинвазивного скрининга острого отторжения сердечного трансплантата [335].
Увеличение скорости проведения пульсовой волны, обусловленной повышением ригидности сосудистой стенки, и тахикардия у реципиентов трансплантированного сердца приводят к развитию феномена десинхронизации прямой и отраженной пульсовых волн. Пульсовая волна, создаваемая в систолу сердца, распространяется по магистральным артериям, а затем отражается, доходя до места ответвления сосудов второго и третьего порядков, возвращаясь к аорте и левому желудочку. У здоровых лиц скорость распространения пульсовой волны не превышает 15 м/с. При такой скорости распространения отраженная пульсовая волна возвращается уже после закрытия аортального клапана, способствуя повышению диастолического АД и повышая коронарный кровоток [336]. У реципиентов трансплантированного сердца скорость распространения пульсовой волны обычно превышает 20 м/с и может достигать 40 - 60 м/с [337], поэтому отраженная пульсовая волна достигает ЛЖ до закрытия аортального клапана, увеличивая постнагрузку в сердце, и, накладываясь на систолическую волну, способствует повышению систолического АД.
У реципиентов сердца, особенно в первый год после ОТТС, отмечается увеличение объема циркулирующей крови [338]. Механизм задержки жидкости у реципиентов трансплантированного сердца полностью не изучен, однако может быть связан с особенностями действия такролимуса или циклоспорина; с денервацией внутрисердечных барорецепторов и нарушением рефлексов, подавляющих активизацию ренин-ангиотензин-альдостероновой системы (РААС).
Так, у реципиентов трансплантированного сердца в отличие от практически здоровых лиц переход тела в горизонтальное положение не сопровождается подавлением активности аргининового вазопрессина, а быстрое внутривенное введение изотонического раствора хлорида натрия не сопровождается подавлением активности РААС [339, 340]. В одном из исследований сравнивалась степень задержки жидкости у реципиентов сердечного и печеночного трансплантата, получавших одинаковые дозы циклоспорина**. Оказалось, что у реципиентов трансплантированного сердца увеличение объема внеклеточной жидкости после трансплантации было на 14% больше, чем у реципиентов печени, несмотря на сопоставимые показатели сердечного выброса и скорости клубочковой фильтрации почек. R.W. Braith и соавторы в перекрестном исследовании показали, что у реципиентов трансплантированного сердца с артериальной гипертонией объем внутрисосудистой жидкости увеличивается в среднем на 12% [341, 342], а назначение блокатора ангиотензинпревращающего фермента (АПФ) каптоприла** восстанавливает эуволюмическое состояние.
Нарушение функции эндотелия и активация РААС после трансплантации сердца индуцируют изменения фенотипа в гладкомышечных клетках сосудистой стенки, которые приобретают секреторные свойства. Эти изменения приводят к аккумуляции коллагена в стенках крупных артерий и к развитию гипертрофии артериол [343]. В результате отмечаются увеличение системного сосудистого сопротивления и повышение чувствительности артерий к вазоконстрикторным стимулам. Ангиотензин II оказывает прямое и косвенное негативное действие, вызывает дисфункцию эндотелия и напрямую способствует развитию гипертрофии миокарда и гладкомышечных клеток сосудистой стенки и ремоделированию сосудов. Являясь мощным вазоконстриктором и индуктором вазопрессина, ангиотензин II обладает способностью повышать уровни альдостерона, активировать симпатическую систему, стимулировать агрегацию тромбоцитов и подавлять активность противосвертывающей системы крови, стимулировать выброс провоспалительных цитокинов и активировать НАДФН-оксидазу, тем самым увеличивая продукцию активных соединений кислорода в несколько раз [344].
Используемая в настоящее время у реципиентов трансплантированного сердца иммуносупрессивная терапия, включающая комбинацию препаратов такролимуса или циклоспорина, препаратов микофеноловой кислоты** и глюкокортикостероидов, позволяет эффективно предупреждать развитие отторжения трансплантированного органа. В то же время побочные действия этих лекарственных средств могут оказывать негативное влияние на прогноз и качество жизни. Наиболее значимыми побочными действиями являются развитие злокачественных новообразований, риск инфекционных осложнений, нефропатия, сахарный диабет, АГ, неврологические нарушения, остеопороз, влияние на репродуктивное здоровье и др.
Отдаленный прогноз пациентов после ТС в первую очередь определяется особенностями взаимодействия организма реципиента и трансплантированного органа, проявляющимися отторжением трансплантата. Будучи максимальным в первые месяцы и снижаясь спустя и более года после операции трансплантации, риск развития отторжения трансплантата сердца сохраняется пожизненно, что определяет необходимость в постоянном приеме иммуносупрессивной терапии. Побочные эффекты действия иммуносупрессивной терапии оказывают негативное влияние на прогноз и качество жизни. Наиболее значимыми побочными действиями являются развитие злокачественных новообразований, риск инфекционных осложнений, нефропатия, сахарный диабет, артериальная гипертония, неврологические нарушения, остеопороз, влияние на репродуктивное здоровье и др.
Являясь проявлением защитной реакции организма донора против чужеродных клеток, реакция отторжения включает механизмы врожденного, клеточного и антителоопосредованного иммунного ответа. Выделяют сверхострое отторжение, острое клеточное отторжение, острое отторжение и хроническое гуморальное отторжение. Болезнь коронарных артерий трансплантированного сердца, имеющую иммунную природу, также считают формой хронического гуморального отторжения.
Клинически отторжение сердечного трансплантата проявляется недостаточностью кровообращения, основным методом диагностики его является эндомиокардиальная биопсия. Воспаление и гибель клеток, сопровождающие острое отторжение трансплантата, вначале приводят к интерстициальному отеку и снижению эластичности миокарда, что в свою очередь проявляется нарушением диастолической функции. В дальнейшем при отсутствии адекватного лечения и на фоне прогрессирования патологического процесса развивается нарушение систолической функции и развитие СН со снижением фракции выброса. Вначале острое отторжение может проявляться неспецифическими симптомами - общим недомоганием, утомляемостью, слабостью, тошнотой, рвотой, повышением температуры. Правожелудочковая недостаточность может развиваться как вторично, на фоне левожелудочковой недостаточности, так и являться следствием острого клеточного или гуморального отторжения. Остро возникшие нарушения ритма и проводимости также могут быть проявлением отторжения сердечного трансплантата.
У большинства пациентов отторжение трансплантата на ранних стадиях не имеет клинических проявлений, и клиническим проявлением отторжения может быть внезапная смерть. Это обусловливает необходимость в проведении регулярных плановых биопсий миокарда с целью раннего выявления признаков отторжения и своевременного начала лечения [345, 346].
Васкулопатия трансплантата сердца является одним из основных факторов, оказывающих влияние на отдаленный прогноз. На фоне улучшения эффективности цитостатической медикаментозной терапии и снижения частоты острого отторжения сердечного трансплантата, отмечающихся в последние годы, вероятность развития васкулопатии трансплантата остается неизменной. Вследствие того, что сердечный трансплантат является денервированным органом, ишемия миокарда не сопровождается болезненными ощущениями, и пациенты самостоятельно обращаются за помощью лишь в тех случаях, когда ишемия миокарда приводит к сердечной недостаточности, и это бывает, как правило, уже при значительных изменениях в коронарных артериях пересаженного сердца. В связи с этим раннее выявление изменений в сосудах трансплантата имеет важное значение [347].
3.9 Рекомендации по проведению хирургических вмешательств у пациентов с трансплантированным сердцем
- Подготовку к операции и анестезиологическому пособию реципиентов пересаженного сердца рекомендуется осуществлять совместно с врачами, прошедшими специальную подготовку или повышение квалификации в трансплантологическом центре [208].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендуется профилактическое назначение антибактериальных препаратов системного действия перед проведением оперативного вмешательства [208, 346].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: При назначении антибиотиков следует избегать препаратов группы аминогликозидов в связи с возможным прогрессированием почечной недостаточности на фоне применения препаратов такролимуса** или циклоспорина**.
- При проведении анестезиологического пособия рекомендуется учитывать, что трансплантат сердца денервирован [353].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: ЧСС в состоянии покоя у реципиентов пересаженного сердца выше, чем у остальных лиц: нормальная ЧСС составляет 90 мин-1, увеличение ЧСС до 130 мин-1 не требует медикаментозной терапии. Атропин** у пациентов с пересаженным сердцем не увеличивает ЧСС в связи с тем, что трансплантат денервирован. Брадиаритмии купируются при помощи электрокардиостимуляции. Самый частый вид нарушений ритма сердца у реципиентов - фибрилляция предсердий. Препаратом выбора для лечения фибрилляции предсердий у реципиентов сердца является амиодарон**.
- Рекомендуется поддержание нормального объема циркулирующей крови у пациентов после трансплантации сердца [208, 341].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Снижение объема циркулирующей крови повышает риск развития почечной недостаточности. Увеличение объема циркулирующей жидкости плохо переносится этими пациентами. При проведении хирургических вмешательств обязательно постоянное мониторирование центрального венозного давления.
- Не рекомендовано изменение назначений иммунодепрессантов без согласования с врачами-хирургами (трансплантологами) в связи с тем, что иммунодепрессанты обладают узким терапевтическим диапазоном [394, 434].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Отмена препаратов такролимуса или циклоспорина возможна в утро перед оперативным вмешательством в связи с повышенным риском развития почечной недостаточности на фоне периоперационной дегидратации. Впоследствии назначение иммуносупрессивных препаратов должно быть продолжено. При отсутствии возможности перорального приема препаратов такролимуса или циклоспорина они могут назначаться внутривенно. Доза такролимуса** при внутривенном введении составляет примерно 1/5 подобранной пероральной суточной дозы. Микофеноловая кислота** или микофенолата мофетил** и глюкокортикостероиды вводятся внутривенно в тех же дозах, что были подобраны для перорального приема.
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Пациентам, перенесшим трансплантацию сердца, рекомендована психологическая, физическая и социальная реабилитации, направленные на лечение и профилактику депрессивных расстройств, социализацию, развитие дисциплинированности в соблюдении врачебных рекомендаций по приему лекарственных средств и образу жизни, а также стимулирование самостоятельности и независимости [361].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарии: Рекомендуется включение пациентов в программы по вторичной профилактике и реабилитации. Правильно построенная программа физической и психологической реабилитации способствует повышению приверженности к медикаментозному лечению и мероприятиям по изменению образа жизни, включающим диету, регулярные физические нагрузки и отказ от курения. После определения индивидуальной переносимости физической нагрузки и оценки связанного с ней риска рекомендуется разработать программу реабилитации, при возможности включающую регулярные аэробные физические нагрузки (тренировки) как минимум 3 раза в неделю продолжительностью как минимум по 30 мин. Пациентов с малоподвижным образом жизни следует активно стимулировать к началу программ физической реабилитации с нагрузками небольшой интенсивности.
4.1 Рекомендации по применению программ лечебной физкультуры и физической реабилитации у пациентов после трансплантации сердца
- Всем пациентам после трансплантации сердца рекомендованы физические тренировки с аэробной нагрузкой [363 - 366].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарий: Физические тренировки улучшают адаптацию к физическим нагрузкам и способствуют модификации факторов риска сердечно-сосудистых заболеваний, таких как ожирение, нарушение толерантности к глюкозе и артериальная гипертония. Влияние физических тренировок на отдаленный прогноз и смертность у пациентов после трансплантации сердца не изучено.
- Тренировки с утяжелениями рекомендованы пациентам с признаками снижения минеральной плотности костной ткани, а также с целью профилактики остеопороза и нежелательного действия на мышечную ткань препаратов глюкокортикостероидов и такролимуса или циклоспорина [368].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Тренировки с утяжелениями являются частью комплексной терапии по профилактике потери минеральной плотности костной ткани и атрофии скелетной мускулатуры.
4.2 Рекомендации по социальной реабилитации пациентов после трансплантации сердца
- Рекомендовано возобновление социальной активности и трудовой деятельности после трансплантации сердца [361, 369].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано возобновление трудовой деятельности пациентами после трансплантации сердца (возможно при поддержке органов социальных служб) [370].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
4.3 Рекомендации по профилактике и лечению депрессивных состояний у пациентов после трансплантации сердца
- Селективные ингибиторы обратного захвата серотонина, особенно циталопрам и антидепрессанты нового поколения, такие как миртазапин, не оказывающие существенного влияния на уровни артериального давления, частоту сердечных сокращений, внутрисердечную проводимость и ритм сердца - рекомендованы как препараты выбора для медикаментозной терапии депрессии у пациентов после трансплантации сердца [371, 372].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- Не рекомендовано назначение лекарственных средств, метаболизирующихся с участием системы цитохрома P-450 (например, таких как Флувоксамин, Тразодон), во избежание лекарственного взаимодействия с циклоспорином** и такролимусом** следует по возможности избегать назначения [372].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- Антидепрессанты из группы трициклических соединений (такие как имипрамин**, амитриптилин**) могут оказывать нежелательные побочные действия на сердечно-сосудистую систему и цитотоксическое действие на миокард (замедление внутрисердечной проводимости, ортостатическая гипотензия, антихолинергическое действие), в связи с чем их рекомендовано назначать только пациентам с признаками тяжелой депрессии, рефрактерной к другим лекарственным средствам [372].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
- При каждом визите пациента рекомендовано оценить правильность выполнения им рекомендаций по приему лекарственных средств и образу жизни [372, 373].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
- Рекомендовано оценивать правильность выполнения рекомендаций любыми способами, такими как: сбор анамнеза, анализ дневниковых записей и информации, полученной от близких родственников и наблюдающего медицинского персонала [371].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано оценивать соответствие приема назначениям не только иммуносупрессивных лекарственных средств, но также всей медикаментозной терапии и немедикаментозных методов профилактики нежелательных событий [371, 373, 375].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано сложности, возникающие при соблюдении приема лекарственных средств, обсуждать вместе с пациентом [375].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано осуществлять наблюдение и ведение пациента в контакте с близкими пациенту людьми, вовлекая их в образовательные программы [375].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано стимулировать стремление пациента к независимости и самообслуживанию [371, 372, 375].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Медицинскому персоналу (врачи и медсестры), наблюдающему пациента по месту жительства, рекомендовано обучиться всем аспектам ведения пациентов после трансплантации сердца [376].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Рекомендовано регулярно обследовать пациента доступными методами для выявления у него признаков депрессии [374].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Среди специалистов, занимающихся ведением пациента после трансплантации сердца, рекомендовано быть медицинскому психологу, специализирующемуся в выявлении и лечении депрессивных состояний [354].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
4.4. Репродуктивное здоровье у реципиентов сердца
4.4.1 Рекомендации по планированию и ведению беременности у реципиентов сердца
- Для ведения и наблюдения беременности у пациентов, перенесших трансплантацию сердца, рекомендован мультидисциплинарный подход с привлечением врачей-специалистов: врачей-акушеров-гинекологов, врачей-неонатологов, врачей-кардиологов, врачей-хирургов (трансплантологов), медицинских психологов и врачей-генетиков [377, 378].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Тактика ведения беременности и разрешения родов разрабатывается с учетом индивидуальных особенностей матери и состояния трансплантированного органа. Рекомендована госпитализация и родоразрешение в центре трансплантологии [378, 379].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При планировании беременности учитываются индивидуальные факторы: риск отторжения трансплантата, риск развития инфекционных осложнений, особенности назначаемых лекарственных средств, которые могут обладать токсическим или тератогенным действием, а также особенности пересаженного органа. При выявлении риска неблагоприятного исхода или осложнения предстоящей беременности, ее рекомендовано предотвратить [208, 378, 379].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Беременность не рекомендовано планировать в течение 1-го года после трансплантации сердца в связи с повышенным риском отторжения трансплантата [208, 378, 379, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У потенциальной матери, планирующей беременность, рекомендовано включать в план обследования электрокардиографическое, эхокардиографическое исследования и коронарография (если не было выполнено в предыдущие месяцы), а в случае клинических показаний - эндомиокардиальную биопсию [208, 378, 379, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У беременных реципиенток пересаженного сердца рекомендовано осуществлять регулярный мониторинг функции печени и почек, измерение уровней артериального давления, посевы мочи, а также необходимые диагностические мероприятия для выявления ранних признаков преэклампсии и гестационного диабета [208, 378, 379, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Прием лекарственных препаратов такролимуса** или циклоспорина** и глюкокортикостероидов беременным реципиенткам рекомендовано продолжить, микофеноловую кислоту** или микофенолата мофетил** рекомендовано отменить [378, 379].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Данные о безопасности азатиоприна** у беременных в качестве альтернативы микофенолата мофетилу** противоречивые. При назначении как микофенолата мофетила**, так и азатиоприна** следует учитывать как риск отторжения трансплантата у матери, так и неблагоприятное воздействие этих лекарственных средств на плод [378, 379].
- В течение беременности рекомендовано проводить тщательный мониторинг уровней такролимуса** или циклоспорина** в крови в связи с высокой вариабельностью фармакодинамики этих лекарственных средств на фоне обусловленных беременностью изменений объема плазмы крови и интерстициальной жидкости, а также функции печени и почек [378, 379].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендованы частые обследования для выявления возможного отторжения трансплантата у беременных. При этом следует избегать проведения эндомиокардиальной биопсии под рентгеновским контролем. При проведении эндомиокардиальной биопсии предпочтение отдается ультразвуковому контролю, при необходимости рентгеновского контроля необходимо тщательное экранирование всех участков тела для защиты плода от рентгеновского облучения [208, 378, 379, 436].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- Грудное вскармливание младенцев не рекомендовано в связи с тем, что безопасность средств, применяемых в настоящее время в качестве иммуносупрессивной терапии, не изучена [380].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
4.4.2 Рекомендации по контрацепции у реципиентов сердца
- Прогестагены и эстрогены рекомендовано назначать после оценки факторов риска возможных тромботических осложнений (тромбоэмболии в анамнезе или у близких родственников) [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано мониторирование концентрации препаратов иммуносупрессивной терапии в крови у пациентов, получающих комбинированную иммуносупрессивную терапию, в связи с тем, что прогестагены и эстрогены (фиксированные сочетания) оказывают ингибирующее действие на CYP3A4 [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Барьерные методы контрацепции не обеспечивают адекватного уровня предохранения от нежелательной беременности. Вместе с тем, они рекомендованы всем пациентам после пересадки сердца, ведущим активную сексуальную жизнь, как средство профилактики заражения инфекциями, передающимися половым путем [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Внутриматочные контрацептивы не рекомендованы для использования у пациентов после трансплантации сердца, особенно у нерожавших женщин, в связи с возможным риском воспалительных и инфекционных осложнений и бесплодия [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Использование депонированной формы медроксипрогестерона** может сопровождаться уменьшением минеральной плотности костной ткани и в связи с этим не рекомендуется у пациентов после трансплантации сердца [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Оральные контрацептивы не рекомендуются пациентам после трансплантации сердца с артериальной гипертонией, БКАПС, эстроген-зависимыми опухолями или заболеваниями печени [380, 381, 382].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
4.4.3 Рекомендации по лечению эректильной дисфункции у реципиентов сердца
- Эректильная дисфункция после трансплантации сердца может быть вызвана ятрогенными причинами. Пациентам с эректильной дисфункцией рекомендуется рассмотреть вопрос о замене лекарственных средств с учетом их эффективности и побочных действий [383].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Селективные ингибиторы циклогуанозинмонофосфат (цГМФ)-специфической фосфодиэстеразы-5 рекомендованы в качестве лекарственных средств для лечения эректильной дисфункции у пациентов после трансплантации сердца. При этом рекомендуется избегать сочетанного назначения ингибиторов фосфодиэстеразы с нитратами (потенцирование гипотензивного действия) [384].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
4.5 Рекомендации по вождению автомобиля и управлению транспортными средствами у пациентов после трансплантации сердца
- Вопросы возможности управления транспортным средством рекомендовано обсуждать с пациентами на раннем послеоперационном этапе [387 - 389].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Вопрос о возможности управления транспортным средством рекомендовано решать на основании неврологического осмотра пациента (исключаются тремор, оценивается устойчивость осанки, исследуется зрение) [387, 388].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У пациентов с брадикардией допуск к управлению автомобилем рекомендуется при наличии искусственного водителя ритма [389].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика нежелательных событий и диспансерное наблюдение играют важную роль в обеспечении благоприятного отдаленного прогноза у реципиентов сердца.
Основные причины смерти после трансплантации сердца - острое отторжение трансплантата, сердечная недостаточность, болезнь коронарных артерий пересаженного сердца, инфекции, почечная недостаточность, онкологические заболевания. Отторжение трансплантата и инфекции являются ведущими причинами смерти в течение первых трех лет после трансплантации сердца, в то время как злокачественные новообразования и БКАПС - в последующем периоде.
Факторы риска нежелательных событий в течение первого года после трансплантации сердца включают дотрансплантационные факторы, периоперационные факторы, факторы риска, связанные с особенностями донора и факторы послеоперационного периода. Исследования, проведенные под эгидой Российского трансплантологического общества, свидетельствуют о том, что наиболее значимыми факторами риска нежелательных событий в течение первого года после ОТТС являются наличие сопутствующих заболеваний у реципиента в дотрансплантационном периоде (почечная недостаточность, периферический атеросклероз), возраст донора, наличие гипертрофии миокарда левого желудочка или атеросклероза коронарных артерий донорского сердца, длительность ишемии сердечного трансплантата, повторная трансплантация сердца, необходимость в механической поддержке кровообращения в периоперационном периоде, возраст реципиента (отмечается U-образная зависимость, наименьший риск у 40-летних реципиентов), индекс массы тела реципиента, уровни билирубина и креатинина в крови, наличие легочной гипертензии и инфекций.
Факторы риска нежелательных событий в течение 5 лет после трансплантации сердца, помимо указанных выше, включают количество трансплантаций, выполняемых трансплантологическим центром, развитие посттрансплантационного сахарного диабета, наличие беременностей в анамнезе, несовместимость трансплантата по HLA антигенам и группе крови.
Одним из наиболее важных модифицируемых факторов риска нежелательных событий у реципиентов сердца является адекватность иммуносупрессивной терапии. Биодоступность иммуносупрессивных средств, определяющая вероятность как побочных действий, так и отторжения, зависит от многих индивидуальных и внешних факторов, в связи с чем необходим четкий мониторинг побочных действий иммуносупрессивной терапии.
5.1 Мониторинг эффективности и безопасности иммуносупрессивной терапии
- У пациентов после трансплантации сердца рекомендовано проводить мониторинг эффективности и безопасности иммуносупрессивной терапии. При развитии специфических побочных действий рекомендовано производить снижение дозы (замену) лекарственных средств при поддержании адекватного уровня иммуносупрессии [262, 393, 394].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Ферментная система цитохрома CYP3A и гастроинтестинального гликопротеина P играют ключевую роль в метаболизме многих иммунодепрессивных средств, таких как циклоспорин**, такролимус**, #сиролимус и эверолимус**. Таким образом, лекарственные средства, изменяющие активность цитохрома или P-гликопротеина, могут приводить к повышению или снижению концентрации иммунодепрессивных средств в крови.
5.2 Рекомендации по профилактике болезни коронарных артерий пересаженного сердца
- Пациентам в качестве первичной профилактики БКАПС после пересадки сердца рекомендуется строгий контроль факторов риска сердечно-сосудистых заболеваний (артериальная гипертония, сахарный диабет, гиперлипидемия, курение, ожирение), а также профилактика цитомегаловирусной инфекции [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Ранняя профилактика является наиболее эффективным методом предупреждения развития нежелательных сердечно-сосудистых осложнений обусловленных васкулопатией трансплантата. Профилактика васкулопатии трансплантата включает предупреждение повреждения эндотелия донорского сердца при его заборе и имплантации, профилактику острого отторжения и цитомегаловирусной инфекции, а также уменьшение воздействия "традиционных" факторов риска сердечно-сосудистых заболеваний. Курение у пациентов после трансплантации сердца является фактором риска развития не только васкулопатии трансплантата, но и онкологических осложнений иммуносупрессивной терапии, и в связи с этим отказ от курения имеет важное значение у этих пациентов. В общей популяции ожирение является фактором риска развития сахарного диабета и сердечно-сосудистых заболеваний. Данные о влиянии ожирения на выживаемость пациентов после трансплантации сердца неоднозначны. С одной стороны, тяжелая застойная сердечная недостаточность, являющаяся основным показанием для трансплантации сердца, сопровождается кахексией и снижением веса тела; в крупных исследованиях было показано, что у пациентов с сердечной недостаточностью корреляция между весом тела и выживаемостью прямая. С другой стороны, у пациентов после трансплантации сердца ожирение развивается на фоне приема глюкокортикостероидов, в меньшей степени - вследствие гиподинамии и избыточного употребления легкоусвояемых углеводов с пищей. В этих случаях доказана связь ожирения с риском развития сахарного диабета, артериальной гипертонии и дислипидемии, которые в свою очередь могут негативно влиять на прогноз. Несмотря на отсутствие доказательств того, что снижение избыточного веса сопровождается снижением риска развития васкулопатии трансплантата, пациентам после пересадки сердца показаны физические тренировки и диета с низким содержанием животных жиров и легкоусвояемых углеводов.
Вирусные инфекции, особенно цитомегаловирусная инфекция, являются фактором риска развития васкулопатии трансплантата. Несмотря на то, что специфические противовирусные средства (ганцикловир и валганцикловир) обладают высокой эффективностью против цитомегаловируса, нет убедительных данных о том, что их применение снижает риск развития васкулопатии трансплантата.
Вероятность развития сахарного диабета у пациентов после трансплантации сердца достаточно высока и достигает 30% в течение 1-го года после операции. Факторами риска развития сахарного диабета являются нарушенная толерантность к глюкозе в предоперационном периоде, семейная предрасположенность, ожирение, а также прием препаратов такролимуса или циклоспорина и глюкокортикостероидов в качестве иммуносупрессивной терапии. В сравнении с циклоспорином**, такролимус** в большей степени повышает риск развития сахарного диабета. В исследованиях показано, что между уровнями гликозилированного гемоглобина в крови и выраженностью васкулопатии в коронарных артериях трансплантированного сердца существует положительная корреляция. В связи с этим, строгий контроль уровней глюкозы в крови является важным фактором профилактики развития васкулопатии трансплантата.
- У пациентов после трансплантации сердца прием ингибиторов ГМГ-КоА редуктазы снижает риск развития БКАПС и улучшает выживаемость без нежелательных событий, включая снижение риска развития злокачественных новообразований и улучшение общей выживаемости. Ингибиторы ГМГ-КоА-редуктазы рекомендованы всем пациентам после трансплантации сердца (взрослым и детям) [269 - 271, 304, 310, 397].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
5.3 Рекомендации по профилактике инфекционного эндокардита после трансплантации сердца
- Специфических рекомендаций по профилактике инфекционного эндокардита у пациентов после трансплантации сердца нет. С учетом высокого риска развития у таких пациентов приобретенной клапанной недостаточности и крайне неблагоприятного прогноза в случае развития инфекционного эндокардита, все стоматологические манипуляции рекомендовано проводить на фоне профилактического назначения антибактериальных препаратов системного действия [188, 189, 191, 208, 436].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарий: Инфекционный эндокардит развивается редко у пациентов после трансплантации сердца, однако сопровождается высокой смертностью (до 80%). Наибольший риск развития инфекционного эндокардита отмечается у пациентов с дефектами клапанов. Основными возбудителями инфекционного эндокардита являются Staphylococus aureus и Aspergillus fumigatus. Staphylococus aureus может быть занесен с катетерами для гемодиализа, а также при воспалении кожи и подкожной клетчатки или при контаминации донорского органа. Эндокардит, вызванный Aspergillus fumigatus, нередко развивается на фоне цитомегаловирусной инфекции и может протекать на фоне диссеминированного аспергилеза, и сопровождаться аспергилезным эндофтальмитом. Чаще всего при эндокардите поражаются митральный и трикуспидальный клапаны. Несмотря на отсутствие клинических доказательств, с целью профилактики инфекционного эндокардита при всех стоматологических вмешательствах показана антибиотикопрофилактика.
5.4 Рекомендации по профилактике, диагностике и лечению новообразований у пациентов после трансплантации сердца
- У пациентов после трансплантации сердца отмечается высокий риск развития кожных новообразований, в связи с чем им рекомендовано проведение профилактических мероприятий, включая участие в образовательных программах и ежегодный осмотр врача-дерматовенеролога [400].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Пациентам после трансплантации сердца рекомендовано пройти первичное обследование и в дальнейшем рекомендовано наблюдение у специалиста с целью раннего выявления и профилактики посттрансплантационных лимфопролиферативных заболеваний [400 - 402].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У пациентов после трансплантации сердца с солидными новообразованиями, не связанными с лимфоидной системой, необходимости в уменьшении дозы иммуносупрессивных лекарственных средств нет. Таким пациентам рекомендовано получать адекватную иммуносупрессивную терапию в полном объеме за исключением случаев, когда имеется необходимость коррекции дозы или отмены отдельных лекарственных средств, обусловленных сопутствующими заболеваниями, например, при развитии лейкопении следует отменить или уменьшить дозы лекарственных средств, подавляющих кроветворную функцию красного костного мозга [399 - 401].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- В отдаленном периоде после трансплантации сердца рекомендовано по возможности уменьшить дозы иммунодепрессантов [208, 400, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Опухолевые новообразования весьма часто развиваются у пациентов после трансплантации солидных органов. У пациентов после трансплантации сердца самыми частыми опухолями являются новообразования кожи, лимфомы, а также раки простаты, легких и груди. Согласно данным регистра ISHLT, факторами риска развития новообразований в течение 5 лет после трансплантации сердца являются длительность периода времени, прошедшего после трансплантации сердца, мужской пол и возраст реципиента (> 60 лет).
Основным этиологическим фактором развития новообразований после трансплантации солидных органов является длительная иммуносупрессия. Показано, что по сравнению с азатиоприном**, назначение микофенолата мофетила** сопровождается более низким риском развития новообразований.
Неходжкинская лимфома, также называемая посттрансплантационным лимфопролиферативным заболеванием, редко встречается у лиц без нарушений иммунной системы, но является одним из неблагоприятных осложнений длительной иммуносупрессивной терапии у пациентов после трансплантации сердца. В большинстве случаев пострансплантационные лимфопролиферативные заболевания являются B-клеточными опухолями и связаны с вирусом Эпштейна-Барр.
Регулярное молекулярно-биологическое исследование крови на содержание вируса Эпштейна-Барр (метод полимеразной цепной реакции, ПЦР) позволяет выявить пациентов с высоким риском развития лимфопролиферативных новообразований. Одним из наиболее эффективных средств профилактики новообразований является индивидуализация и минимизация иммуносупрессивной терапии.
В связи с тем, что раки кожи при их раннем выявлении хорошо поддаются лечению, они редко являются причиной смерти. Пациенты должны быть предупреждены о вреде инсоляции и обучены способам применения солнцезащитных средств, а также знать признаки рака кожи и методы самодиагностики. Скрининговые методы обследования для выявления новообразований, как то: маммография, Жидкостное цитологическое исследование микропрепарата шейки матки, колоноскопия, определение уровней простата-специфического антигена (ПСА), пальпация лимфатических узлов, рентгенография грудной клетки и дерматологические обследования - должны проводиться регулярно.
Лечение новообразований, в особенности лимфом, у пациентов после трансплантации сердца имеет ряд особенностей и должно осуществляться под контролем трансплантационного центра. Тактика лечения таких пациентов включает минимизацию иммуносупрессивной терапии.
Ритуксимаб** является эффективным средством для лечения неходжкинских лимфом, однако данных о том, как он влияет на выживаемость пациентов, в настоящее время нет.
Результаты исследований, опубликованных в последние годы, свидетельствуют о том, что назначение ингибиторов ГМГ-КоА редуктазы, помимо снижения риска развития васкулопатии трансплантата, может сопровождаться снижением риска развития злокачественных новообразований.
5.5 Рекомендации по профилактике, диагностике и лечению почечной недостаточности у пациентов после трансплантации сердца
- Рекомендуется выполнять всем пациентам после трансплантации сердца оценку скорости клубочковой фильтрации, рассчитанной по формуле, общий анализ (клинический) мочи и оценку соотношения [альбумин в моче]/[креатинин сыворотки крови] не реже 1 раза в год [405 - 407].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Нарушение выделительной функции почек часто выявляется у пациентов после трансплантации сердца и оказывает влияние на прогноз. Выделительная функция почек характеризуется величиной показателя скорости клубочковой фильтрации (СКФ), рассчитываемого с учетом содержания креатинина в крови, веса, возраста и пола пациента. Снижение выделительной функции почек характеризуется значениями показателя СКФ ниже 30 мл/мин/1.7 2м и спустя 5 лет после трансплантации сердца выявляется примерно у 10% пациентов, сопровождаясь четырехкратным повышением риска смерти.
Ухудшение выделительной функции почек, характеризующееся снижением величины показателя СКФ на 30 - 50%, развивается, как правило, спустя первые 6 месяцев после трансплантации сердца. Затем значение показателя СКФ стабилизируется или снижается более медленно.
Факторы риска развития почечной недостаточности после трансплантации сердца включают:
- артериальная гипертония
- атеросклероз коронарных и/или периферических артерий;
- сахарный диабет;
- старший возраст;
- женский пол;
- назначение высоких доз препаратов такролимуса или циклоспорина;
- сниженная функция почек у реципиента до операции трансплантации сердца.
Почечная недостаточность у пациентов после трансплантации сердца приводит к таким же последствиям, что и в общей популяции: развитию прогрессирования атеросклероза коронарных и периферических артерий, артериальной гипертонии, анемии и остеопорозу.
Наиболее эффективным методом лечения тяжелой почечной недостаточности у пациентов после пересадки сердца является трансплантация почки, после которой отдаленный прогноз существенно лучше, чем на фоне гемодиализа.
- Реципиентам после трансплантации сердца со значениями показателя СКФ < 30 мл/мин/1.73 м2 или протеинурией > 500 мг/сут, или с быстрым снижением значения показателя СКФ > 4 мл/мин/1.7 3м в год рекомендовано обследование и лечение под наблюдением врача-нефролога с целью коррекции метаболических нарушений и других осложнений почечной недостаточности. При выраженной почечной недостаточности рекомендовано рассмотреть вопрос о трансплантации почки [404 - 410].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- У всех реципиентов донорского сердца с признаками почечной недостаточности рекомендовано снизить дозы препаратов такролимуса** или циклоспорина** до минимального уровня, необходимого для поддержания адекватной иммуносупрессии. У пациентов, принимающих азатиоприн**, это может быть достигнуто путем замены азатиоприна** на микофенолата мофетил** [264, 403 - 406].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Если на фоне снижения дозировки или отмены препаратов такролимуса** или циклоспорина** явления почечной недостаточности не уменьшаются, назначение этих лекарственных средств рекомендуется возобновить или продолжить в связи с более высокой эффективностью в профилактике отторжения трансплантата [262].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У пациентов после трансплантации сердца рекомендованы контроль гликемии, нормализация артериального давления, использование АПФ блокаторов или блокаторов ангиотензиновых рецепторов. У пациентов с сахарным диабетом тактика лечения должна соответствовать имеющимся рекомендациям по профилактике и лечению сахарного диабета. Целевые уровни артериального давления должны соответствовать принятым клиническим рекомендациям [208, 404, 405].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Общий анализ крови и оценка содержания гемоглобина у пациентов с ХБП после трансплантации сердца рекомендовано выполнять не реже 1 раза в год. У пациентов с анемией (уровни гемоглобина в крови Hb < 13,5 г/дл у мужчин и Hb < 12 г/дл у женщин) следует оценить содержанием железа в крови и назначить лекарственные средства, стимулирующие гемопоэз для поддержания целевых уровней гемоглобина в крови в пределах 11 - 13 г/дл [208, 404, 406].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- У пациентов после трансплантации сердца при развитии тяжелой почечной недостаточности рекомендовано рассмотреть вопрос о трансплантации почки, предпочтительно от живого донора [208, 404 - 406, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с признаками почечной недостаточности рекомендованными и антигипертензивными средствами являются АПФ блокаторы или АРА; при их непереносимости или противопоказаниях целесообразно использовать блокаторы кальциевых каналов [404, 405].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
5.6 Рекомендации по профилактике и лечению артериальной гипертонии после трансплантации сердца
- Адекватная антигипертензивная терапия рекомендована пациентам после трансплантации сердца, так как эффективно снижает риск развития нежелательных сердечно-сосудистых событий, включая смерть, инсульт, инфаркт миокарда, сердечную недостаточность, нарушения ритма [411].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Распространенность артериальной гипертонии (АГ) спустя 5 лет после трансплантации сердца может достигать 95%. Развитие АГ после трансплантации сердца в первую очередь связано с приемом препаратов такролимуса** или циклоспорина**, при этом прием циклоспорина** в большей степени связан с развитием АГ, чем такролимус**. Длительный прием глюкокортикоидов также сопровождается повышением уровней артериального давления (АД). Помимо иммуносупрессивной терапии, причинами развития АГ после трансплантации сердца являются нарушение барорефлексов (повышение активности) и прогрессирование ригидности аорты и периферических артерий. У пациентов после трансплантации сердца чаще отмечается так называемая "скрытая артериальная гипертония" (синоним - "изолированная амбулаторная гипертония"), характеризующаяся тем, что при измерении на приеме у врача уровни АД ниже, чем при измерении в домашних условиях или при суточном мониторировании АД.
Чаще всего при суточном мониторировании АД у пациентов после трансплантации сердца выявляют повышение систолического АД в ночное время и постоянное повышение уровней диастолического АД.
- Рекомендованные первичные целевые уровни для медикаментозной терапии: 140/90 мм рт. ст. [411 - 413].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендованные антигипертензивные средства у реципиентов сердца: ингибиторы АПФ (АПФ блокаторы) или при их непереносимости - антагонисты рецепторов ангиотензина II (АРА) и блокаторы кальциевых каналов [412, 509, 510].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендована комбинированная антигипертензивная терапия, так как позволяет использовать низкие дозы антигипертензивных средств и более эффективна, чем монотерапия [412].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано лечение сахарного диабета и контроль уровней липидов у всех пациентов АГ [419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано регулярное измерение АД, суточное мониторирование пациентам после трансплантации сердца с целью выявления гипертонии [411 - 412].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
5.7 Рекомендации по лечению неврологических осложнений после трансплантации сердца
- Рекомендовано включать в лечение эпилептоидных припадков/обмороков у пациентов после трансплантации сердца уменьшение дозы или отмену препаратов такролимуса** или циклоспорина** (при сохранении адекватной иммуносупрессии) и коррекцию гипомагниемии (если таковая выявлена) [414 - 415].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: У пациентов, перенесших трансплантацию сердца, нередко могут развиваться неврологические осложнения, которые оказывают неблагоприятное влияние на прогноз пациента и существенно ухудшают качество жизни. Как правило, неврологические осложнения не являются основной причиной смерти пациентов, перенесших трансплантацию сердца. Самые частые неврологические осложнения самой операции по пересадке сердца включают ишемический инсульт мозга, геморрагический инсульт, преходящие судорожные припадки, развитие энцефалопатии, инфекции центральной нервной системы, периферические нейропатии. Самыми частыми побочными действиями такролимуса** или циклоспорина** со стороны нервной системы являются головные боли, тремор, нарушения сна.
Побочные действия такролимуса** или циклоспорина** зависят от дозы и уменьшаются при снижении дозы лекарственного средства. На фоне общей тенденции неврологических осложнений трансплантации сердца к снижению, вероятность их развития в раннем периоперационном периоде остается неизменной. Частота очаговых нарушений мозгового кровообращения у пациентов, перенесших трансплантацию сердца, составляет примерно 9%, в то время как риск этих осложнений при проведении других хирургических вмешательств составляет по данным разных авторов 1 - 5%. Повышенный периоперационный риск развития неврологических осложнений при пересадке сердца может быть обусловлен использованием средств механической поддержки кровообращения. Имеются данные о безопасности назначения ацетилсалициловой кислоты** после операции трансплантации сердца, однако влияние такого назначения на риск развития ишемического мозгового инсульта неизвестно.
Эпилептические припадки могут развиваться у 15% пациентов, они развиваются, как правило, в периоперационном периоде вследствие локального ишемического повреждения головного мозга во время операции (аноксической энцефалопатии), токсического побочного действия такролимуса** или циклоспорина** или метаболических нарушений. Эпилептические припадки, развивающиеся в течение первого месяца после оперативного вмешательства, как правило, являются следствием токсического воздействия на ЦНС или оппортунистической инфекции ЦНС. Гипомагнезиемия, гипонатриемия и артериальная гипотония могут повышать риск развития эпилептических припадков, в то время как отмена препаратов такролимуса** или циклоспорина** или уменьшение их дозы может снижать риск их развития.
Длительное назначение противосудорожной терапии используется редко. В случае показаний к противосудорожной терапии следует учитывать, что определенные противосудорожные средства, такие как карбамазепин**, фенитоин** и фенобарбитал**, могут ускорять метаболизм такролимуса** или циклоспорина**, скорее всего, вследствие индукции ферментов, относящихся к системе печеночного цитохрома p-450 (CUP-450). В случае назначения вышеперечисленных лекарственных средств необходимо проводить мониторирование содержания такролимуса** или циклоспорина** в крови и коррекцию их дозы.
Энцефалопатии, развивающиеся в ранний постоперационный период, как правило, имеют множественные причины, в то время как энцефалопатии, развивающиеся в позднем периоде, являются следствием какого-то определенного неврологического нарушения. Циклоспорин** и возможно, такролимус** могут вызывать так называемый обратимый лейкоэнцефалопатический синдром с поражением задних отделов мозга (PRES-синдром). Этот синдром проявляется головными болями, нарушениями зрения и обмороками и характеризуется появлением очаговых повреждений в кортикальном и субкортикальном слое головного мозга, выявляемых при помощи методов магнитно-резонансной томографии. Уменьшение дозы или отмена такролимуса** или циклоспорина** (или замена на другое лекарственное средство) в большинстве случаев сопровождается купированием этого синдрома, однако следует иметь в виду, что недостаточной и неадекватной иммуносупрессии следует избегать.
Частоту развития интракраниальных инфекций удалось снизить на фоне снижения доз иммуносупрессивных лекарственных средств (уменьшения иммуносупрессивной терапии). Инфекционные агенты, вызывающие эти инфекции, различаются в зависимости от периода времени, прошедшего после трансплантации сердца.
Заболевания периферической нервной системы могут развиваться как в раннем, так и в позднем периоде после трансплантации сердца. Брахиальная плексопатия вследствие особенности положения пациента во время операционного вмешательства или повреждение малоберцового нерва, вызванное установкой внутриаортального баллона, являются интраоперационными осложнениями. Сенсорная полинейропатия может развиваться у пациентов после трансплантации сердца на фоне сахарного диабета, почечной недостаточности или амилоидоза. Габапентин и антидепрессанты из группы трициклических соединений в данном случае назначаются достаточно часто, однако их влияние на отдаленный прогноз изучено недостаточно.
- При развитии энцефалопатии в отдаленном периоде после трансплантации сердца рекомендована консультация врача-невролога и проведение методов интракраниальной визуализации (КТ, МРТ) для выявления возможных причин [414 - 415].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При развитии обратимого лейкоэнцефалопатического синдрома с поражением задних отделов мозга (PRES-синдрома) рекомендовано уменьшение дозы препаратов такролимуса** или циклоспорина** или их замена на другие лекарственные средства [414 - 416].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- При сохранении эпизодов эпилептических припадков/обмороков на фоне уменьшения доз препаратов такролимуса** или циклоспорина** рекомендована отмена препаратов такролимуса** или циклоспорина** и замена на ингибиторы протеинкиназы (#сиролимус, эверолимус**) [414 - 416].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
5.8 Рекомендации по диагностике, профилактике и лечению сахарного диабета у пациентов после трансплантации сердца
- Учитывая высокий риск развития сахарного диабета, оказывающего неблагоприятное влияние на прогноз и качество жизни, рекомендовано включать в программу ведения пациентов после трансплантации сердца мероприятия по профилактике и ранней диагностике этого заболевания; пациенты с сахарным диабетом должны получать адекватную терапию [416, 417].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Сахарный диабет (СД) достаточно распространен у пациентов, перенесших трансплантацию сердца (32% через 5 лет после трансплантации), и приводит к развитию и прогрессированию болезни коронарных артерий пересаженного сердца, повышает риск инфекционных осложнений и дисфункции сердечного трансплантата.
Факторы риска СД у реципиентов сердца:
1. "Дотрансплантационные" факторы:
- наследственная предрасположенность к СД;
- нарушенная толерантность к глюкозе;
- ожирение и метаболический синдром.
2. "Посттрансплантационные" факторы:
- иммуносупрессивная терапия;
- глюкокортикостероиды;
- препараты такролимуса или циклоспорина (на фоне приема такролимуса** СД может развиваться чаще, чем на фоне приема циклоспорин**).
- Рекомендованные скрининговые исследования для выявления сахарного диабета включают определение уровней гликозилированного гемоглобина, определение уровней глюкозы в крови натощак и тест на толерантность к глюкозе. Периодичность этих измерений определяется индивидуальными факторами риска пациента и особенностями иммуносупрессивной терапии [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Рекомендовано проводить медикаментозную терапию сахарного диабета совместно с врачом-эндокринологом и в соответствии с современными рекомендациями по лечению сахарного диабета [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- В немедикаментозную терапию для профилактики и лечения сахарного диабета у реципиентов сердечного трансплантата рекомендовано включать поддержание нормального веса тела, соблюдение диеты и физические тренировки [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- При выявлении факторов риска или установке диагноза сахарного диабета рекомендовано пересмотреть режим иммуносупрессии и по возможности снизить дозировку или исключить лекарственные средства, обладающие диабетогенным действием, но только в том случае, если изменения в медикаментозной терапии не будут ухудшать эффективности иммуносупрессии [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Глюкокортикостероиды и такролимус** или циклоспорин** снижают толерантность к глюкозе и обладают диабетогенным действием, в связи с этим у реципиентов сердечного трансплантата с сахарным диабетом и высоким риском развития сахарного диабета указанные лекарственные средства рекомендовано назначать в невысоких дозах или заменять на альтернативные [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Артериальная гипертония и дислипидемия существенно ухудшают прогноз у пациентов с сахарным диабетом и повышают риск развития осложнений; рекомендована адекватная антигипертензивная терапия, прием ингибиторов ГМГ-КоА редуктазы и немедикаментозные методы профилактики, которые позволяют снизить риск нежелательных событий у реципиентов сердечного трансплантата с сахарным диабетом [397, 411, 417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам после трансплантации сердца с сахарным диабетом не реже одного раза в год рекомендовано проведение обследования с целью выявления возможных осложнений сахарного диабета [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам после трансплантации сердца при выявлении в скрининговых анализах крови повышенных уровней глюкозы или гликозилированного гемоглобина рекомендована консультация врача-эндокринолога [417 - 419].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
5.9 Рекомендации по профилактике остеопороза при трансплантации сердца
- У всех пациентов, ожидающих трансплантацию сердца, рекомендовано проводить первичный скрининг/обследование с целью выявления существующих заболеваний костной ткани. Целесообразно выполнять рентгенденситометрическое исследование с оценкой минеральной плотности костной ткани в области поясничного отдела позвоночника и шейки бедренной кости [420 - 427].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
Комментарий: Остеопороз часто выявляется у пациентов, ожидающих трансплантацию сердца. Факторами риска развития остеопороза у пациентов с сердечной недостаточностью, ожидающих трансплантацию сердца, являются кахексия, связанная с сердечной недостаточностью, сниженная подвижность/физическая активность, низкие уровни 25-гидроксивитамина D в плазме крови, гипогонадизм, длительное назначение гепарина натрия**, длительный прием диуретиков, почечная недостаточность, вторичный гиперпаратиреоидизм.
- Выявление снижения минеральной плотности костной ткани или компрессионного перелома позвонков предполагает тщательное клиническое обследование и выявление вероятных причин. Лечение остеопороза рекомендовано начинать до трансплантации сердца. Бифосфонаты являются наиболее эффективными лекарственными средствами для лечения остеопороза [422, 423, 426].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
Комментарий: Бисфосфонаты являются лекарственными средствами первой линии для лечения постменопаузального остеопороза, остеопороза у мужчин, остеопороза, развившегося на фоне приема глюкокортикостероидов. У этих пациентов назначение бифосфанатов существенно повышает минеральную плотность кости и снижает риск развития переломов.
- Рекомендовано потреблять адекватное количество кальция (1000 - 1500 мг/сут в зависимости от возраста и наличия менопаузы) и препаратов витамина D и его аналогов (400 - 1000 МЕ/сут) всем пациентам, ожидающим трансплантацию сердца, и реципиентам для поддержания концентрации 25-гидроксивитамина D в крови выше 30 нг/мл или 75 нмоль/л) [422, 423, 426].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Рекомендовано назначить физические тренировки с биологической обратной связью пациентам после трансплантации сердца по гемодинамическим показателям (ЧСС, артериальное давление) [420, 422, 423].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 5)
- Рекомендован профилактический прием бифосфанатов на протяжении как минимум первого года после трансплантации сердца всем пациентам после трансплантации сердца в течение года [422, 424, 426].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Рекомендовано применение лекарственных препаратов бифосфанатов в комбинации с препаратами кальция и препаратов витамина D и его аналогами, что предотвращает потерю костной ткани и снижает риск развития переломов у пациентов после трансплантации сердца [208, 422, 426].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Рекомендовано всем взрослым пациентам, ожидающим трансплантацию сердца, рентгеновское исследование позвоночника с целью выявления травматических переломов костей конечностей и компрессионных переломов позвоночника [420].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Если через год после трансплантации сердца глюкокортикоиды отменены, минеральная плотность костной ткани остается в пределах нормальных значений (значение показателя T > 1.5), рекомендовано отменить препараты бифосфанатов [427].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Длительность непрерывного приема препаратов бифосфанатов не рекомендована более 5 лет [208, 422 - 426].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Денситометрия минеральной плотности костной ткани рекомендована всем реципиентам донорского сердца через год после трансплантации. Дальнейшее ежегодное обследование с оценкой минеральной плотности костной ткани показано пациентам, получающим глюкокортикостероиды, имеющим признаки остеопороза и принимающим бисфосфонаты. В дальнейшем рентгенденситометрическое исследование следует повторять через каждые два - три года [420, 422].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Рекомендовано назначение лекарственных препаратов витамина D и его аналогов в качестве средств первой линии у пациентов со сниженной минеральной плотностью костной ткани. В случае назначения этих лекарственных средств показано регулярное измерение содержания уровней кальция в крови и моче (кальциемия, кальциурия - побочное действие этой группы лекарственных средств) [208, 422 - 426].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- Препараты кальцитонина в качестве средства для профилактики остеопороза не рекомендованы пациентам после трансплантации сердца [421, 422].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
6. Организация оказания медицинской помощи
- Пациентам после трансплантации сердца рекомендовано находиться под постоянным наблюдением центра трансплантации и получать необходимую медицинскую помощь по месту жительства [208, 431].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Наблюдение пациентов в отдаленном периоде после трансплантации сердца рекомендовано осуществлять специалистами центра трансплантации в сотрудничестве с местными органами здравоохранения и социальной поддержки [208, 436].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Местным органам здравоохранения рекомендовано проинформировать центр трансплантации в случаях:
- любой госпитализации пациента в лечебное учреждение;
- изменений медикаментозной терапии, включая назначение любых антибиотиков, противогрибковых или противовирусных средств;
- развития артериальной гипотонии или снижения уровней систолического АД более чем на 20 мм рт. ст. по сравнению с прежними уровнями;
- увеличения ЧСС более чем на 10 мин-1;
- подъема температуры до 38 °C в течение 2 суток;
- снижения веса более чем на 0.9 - 1.0 кг в неделю или на 2 - 2.5 кг в течение неопределенного периода времени;
- выполнения любых хирургических вмешательств;
- появления жалоб на одышку;
- пневмонии или любых инфекционных заболеваний органов дыхания;
- появления болей в грудной клетке;
- снижения показателя объема форсированного выдоха за 1 сек более чем на 10%;
- боли в животе;
- появления тошноты, рвоты или диареи;
- клинических признаков нарушения мозгового кровообращения, обморока или изменений когнитивного (ментального) статуса [208, 436]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Всем реципиентам сердца рекомендовано пожизненно стоять на учете и наблюдаться в трансплантологическом центре, где им была выполнена трансплантация сердца [434].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Пожизненное наблюдение реципиентов сердца в трансплантационном центре обусловлено, в первую очередь, наличием врачей-специалистов, имеющих специальную подготовку и большой опыт ведения реципиентов сердца. Постановка на учет в трансплантологический центр не исключает необходимости наблюдения пациента по месту жительства. При длительном наблюдении пациентов после трансплантации сердца требуется мультидисциплинарный подход с участием врачей-хирургов, врачей-кардиологов, врачей-диетологов, врачей-психотерапевтов и др. Сами пациенты и лечащие врачи должны сознавать, что после трансплантации сердца требуется пожизненное наблюдение специалистов.
6.1 Показания для плановой госпитализации
Реципиенты сердца нуждаются в регулярных плановых обследованиях. Регулярные плановые обследования реципиентов сердца включают амбулаторные обследования по месту жительства или в трансплантологическом центре и плановые обследования в условиях стационара.
- Рекомендовано выполнять плановые амбулаторные обследования не реже 1 раза в 3 месяца [244, 434].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Данная рекомендация обусловлена следующими факторами: 1) наличием пожизненного риска острого или хронического отторжения трансплантата; 2) необходимостью в подборе дозировок, мониторировании эффективности и безопасности иммуносупрессивной терапии; 3) высоким риском развития инфекционных осложнений и новообразований; 4) развитием сопутствующих заболеваний и осложнений, требующих вмешательства или коррекции терапии. Отторжение сердечного трансплантата может вовремя не распознаваться по причине неспецифических проявлений, а нередко и бессимптомного течения, что повышает риск развития жизнеугрожающих аритмий, нарушений гемодинамики и необратимых изменений трансплантата. "Золотым стандартом" выявления отторжения сердечного трансплантата является биопсия миокарда, недостатками которой, несмотря на высокую чувствительность и специфичность, является инвазивность, а также необходимость в специализированном оборудовании и высококвалифицированном персонале. Использование неинвазивных и доступных методов скрининга улучшает раннюю диагностику отторжения сердечного трансплантата, болезни коронарных артерий пересаженного сердца, побочных действий иммуносупрессивной терапии и иных осложнений, и тем самым способствует улучшению отдаленного прогноза у реципиентов сердца [349].
- Профилактические врачебные осмотры следует выполнять не реже 1 раза в десять дней в течение первого месяца после выписки из стационара, не реже 2-х раз в течение 2-го месяца, ежемесячно в течение 1-го года и каждые 3 - 6 месяцев по прошествии 1 года после трансплантации сердца [434].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: Частота повторных визитов у каждого пациента определяется индивидуально и зависит от особенностей (осложнений) послеоперационного периода и количества времени, прошедшего после вмешательства.
6.2 Показания для экстренной госпитализации
Основным поводом для экстренной госпитализации являются жизнеугрожающие состояния или выявление клинических признаков, не исключающих их развитие. Следует отметить, что как отторжение, так и ишемия сердечного трансплантата на ранних стадиях могут не иметь четких клинических проявлений или проявляться неспецифическими симптомами - "общим недомоганием", утомляемостью, слабостью, тошнотой, рвотой, повышением температуры. Опасность таких состояний заключается в скоротечном, молниеносном развитии острой сердечной недостаточности и гибели пациента.
Показания для экстренной госпитализации:
- признаки отторжения сердечного трансплантата;
- признаки острой или хронической ишемии сердечного трансплантата;
- развитие артериальной гипотонии или снижение уровней систолического АД более чем на 20 мм рт. ст. по сравнению с прежними уровнями;
- увеличение или уменьшение средней ЧСС более чем на 10 мин-1;
- подъем температуры до 38 °C в течение суток;
- снижение веса более чем на 1.0 кг в неделю или на 2 - 2.5 кг в течение неопределенного периода времени;
- возникновение необходимости в выполнении любых хирургических вмешательств;
- жалобы на одышку вне зависимости от условий возникновения и купирования;
- возникновение любых заболеваний органов дыхания, включая острые респираторные вирусные инфекции;
- появление болей в грудной клетке;
- снижение показателя объема форсированного выдоха за 1 сек более чем на 10%;
- "неспецифические" симптомы, связанные с органами пищеварения: боли в животе, тошнота, рвота, диарея;
- клинические признаки нарушения мозгового кровообращения, обморока или изменения когнитивного статуса.
6.3 Показания к выписке пациента из стационара
- Отсутствие показаний для экстренного или неотложного инвазивного вмешательства или исследования;
- Низкий риск развития нежелательных событий.
6.4 Иные организационные технологии: мультидисциплинарный подход в наблюдении за пациентами после трансплантации сердца
- Врачам-хирургам (трансплантологам) рекомендуется предоставлять необходимую контактную информацию врачам, наблюдающим реципиента трансплантированного сердца по месту жительства, позволяющую связаться с центром трансплантологии в любое время и гарантировать адекватную помощь, связанную с наблюдаемым пациентом [208, 428 - 431].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Врачам, наблюдающим пациента по месту жительства, рекомендуется иметь полную информацию о необходимых плановых консультациях и госпитализациях в центр трансплантологии [208, 428 - 431].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Врачам, наблюдающим реципиента донорского сердца, рекомендуется предоставлять информацию о результатах обследования пациента и дальнейших планах по наблюдению и лечению [208, 428 - 431].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Особенности ведения пациентов после трансплантации сердца определяются рядом специфических факторов, которые включают взаимодействие организма реципиента и сердечного трансплантата, необходимость в пожизненном приеме иммуносупрессивной терапии, особенность течения основного заболевания, приведшего к терминальной сердечной недостаточности в дотрансплантационном периоде, а также специфические аспекты психологической, физической и социальной адаптации. При этом следует учитывать и особенности физиологии трансплантированного сердца, являющегося денервированным органом, а именно отсутствие болезненных ощущений при развитии ишемии миокарда, отсутствие вагусного влияния и зависимость сократительной функции левого желудочка от объема притекающей крови (преднагрузки).
Отдаленный прогноз у пациентов после трансплантации сердца в первую очередь определяется особенностями взаимодействия организма реципиента и трансплантированного органа, проявляющимися отторжением трансплантата. Будучи максимальным в первые месяцы и снижаясь спустя год и более после операции трансплантации, риск развития отторжения трансплантата сердца сохраняется пожизненно, что определяет необходимость в постоянном приеме иммуносупрессивной терапии. Побочные эффекты действия иммуносупрессивной терапии оказывают негативное влияние на прогноз и качество жизни. Наиболее значимыми побочными действиями являются развитие злокачественных новообразований, риск инфекционных осложнений, нефропатия, сахарный диабет, артериальная гипертония, неврологические нарушения, остеопороз, влияние на репродуктивное здоровье и др. Для поддержания баланса между адекватной иммуносупрессией и профилактикой побочных действий необходим тщательный мониторинг иммуносупрессивной терапии, включающий измерение концентрации лекарственных препаратов в крови. У пациентов, получающих иммуносупрессивную терапию, следует учитывать особенности взаимодействий лекарств, опасность которых заключается как в вероятности развития побочных действий, так и в уменьшении эффективности иммуносупрессии. В связи с этим любые изменения в назначениях лекарственных средствах должны согласовываться с центром трансплантации, к которому прикреплен пациент.
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи пациентам с критической сердечной недостаточностью, реципиентам трансплантированного сердца и реципиентам трансплантированного сердца с клиническими признаками отторжения/дисфункции сердечного трансплантата представлены в Табл. 3 - 5.
Таблица 3. Критерии оценки качества медицинской помощи пациентам с критической сердечной недостаточностью
N пп.
Критерий
Оценка выполнения
1.
Выполнен осмотр врачом-кардиологом
Да/Нет
2.
Выполнен осмотр врачом - сердечно-сосудистым хирургом
Да/Нет
3.
Выполнен осмотр врачом-анестезиологом-реаниматологом
Да/Нет
4.
Определены группа крови системе AB0 и антиген D системы Резус (резус-фактор)
Да/Нет
5.
Выполнен общий (клинический) анализ крови
Да/Нет
6.
Выполнен анализ крови биохимический общетерапевтический (креатинин, мочевина, билирубин, АЛТ, АСТ, щелочная фосфатаза, ГГТ, холестерин ЛПВП, холестерин ЛПНП, триглицериды, C реактивный белок, альбумин, глюкоза, общий белок)
Да/Нет
7.
Выполнен анализ крови на гормоны щитовидной железы (ТТГ, Т4 своб., Т3)
Да/Нет
8.
Выполнен анализ электролитного состава крови (калий, натрий)
Да/Нет
9.
Выполнен анализ крови на гормоны щитовидной железы (ТТГ, Т4 своб., Т3)
Да/Нет
10.
Выполнено исследование свертывающей системы крови (агрегация тромбоцитов, АЧТВ, ПТИ, фибриноген)
Да/Нет
11.
Выполнено молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein-Barr virus), цитомегаловирус (Cytomegalovirus), вирус простого герпеса (Herpes simplex virus)
Да/Нет
12.
Выполнено определение антител к вирусу иммунодефицита человека (ВИЧ) типов 1, 2 и антигена p24, антигена (HbsAg) вируса гепатита B (Hepatitis B virus), антител к вирусу гепатита C (Hepatitis C virus) в крови
Да/Нет
13.
Выполнено электрокардиографическое (ЭКГ) исследование в 12-ти отведениях
Да/Нет
14.
Выполнено эхокардиографическое трансторакальное исследование
Да/Нет
15.
Выполнено ультразвуковое исследование органов брюшной полости (комплексное), включая УЗИ брюшной аорты и нижней полой вены
Да/Нет
16.
Выполнена пульсоксиметрия
Да/Нет
17.
Выполнено исследование неспровоцированных дыхательных объемов и потоков; исследование спровоцированных дыхательных объемов
Да/Нет
18.
Выполнена компьютерная томография органов грудной клетки
Да/Нет
19.
Выполнена компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным контрастированием по показаниям
Да/Нет
20.
Выполнена компьютерная томография головного мозга
Да/Нет
21.
Выполнена эзофагогастродуоденоскопия
Да/Нет
22.
Чрезвенозная диагностическая катетеризация правых отделов сердца с определением показателей давления в полостях сердца, а также сердечного выброса (СВ), сердечного индекса (СИ), транспульмонарного градиента (ТПГ) и показателя легочного сосудистого сопротивления (ЛСС)
Да/Нет
23.
Назначено лечение в соответствии с актуальными утвержденными клиническими рекомендациями по лечению сердечной недостаточности и сопутствующих (фоновых) заболеваний
Да/Нет
24.
Принято мотивированное решение о включении или невключении пациента в лист ожидания ортотопической трансплантации сердца
Да/Нет
Таблица 4. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца
N пп.
Критерий
Оценка выполнения
1.
Принято решение о введении средства индукционной иммуносупрессивной терапии при выполнении трансплантации сердца
Да/Нет
2.
Выполнена ортотопическая трансплантация сердца
Да/Нет
3.
Введен метилпреднизолон** 1000 мг внутривенно перед снятием зажима с аорты
Да/Нет
4.
Выполнен осмотр врачом - сердечно-сосудистым хирургом
Да/Нет
5.
Выполнен осмотр врачом-кардиологом
Да/Нет
6.
Выполнен осмотр врачом-анестезиологом-реаниматологом
Да/Нет
7.
Выполнен общий анализ крови
Да/Нет
8.
Выполнен анализ крови биохимический общетерапевтический (креатинин, мочевина, билирубин, АЛТ, АСТ, холестерин, ЛПВП, ЛПНП, триглицериды, щелочная фосфатаза, ГГТ, C реактивный белок, альбумин, глюкоза, общий белок)
Да/Нет
9.
Выполнен анализ электролитного состава крови (калий, натрий, магний)
Да/Нет
10.
Выполнено ЭКГ
Да/Нет
11.
Выполнено ЭхоКГ
Да/Нет
12.
Выполнено Холтеровское мониторирование, длительностью мониторирования до 24 часов (при наличии показаний)
Да/Нет
13.
Выполнена коронарангиография
Да/Нет
14.
Выполнена биопсия миокарда
Да/Нет
15.
Назначены препараты ингибиторов кальциневрина - такролимуса** или циклоспорина**
Да/Нет
16.
Назначены микофеноловая кислота** или микофенолата мофетил**
Да/Нет
17.
Выполнено определение концентрации такролимуса** в крови (при использовании)
Да/Нет
18.
Выполнено определение концентрации циклоспорина** в крови (при использовании)
Да/Нет
19.
Выполнено определение концентрации эверолимуса** в крови (при использовании)
Да/Нет
20.
Подобрана дозировка такролимуса** (при использовании)
Да/Нет
21.
Подобрана дозировка циклоспорина** (при использовании)
Да/Нет
22.
Подобрана дозировка эверолимуса** (при использовании)
Да/Нет
Таблица 5. Критерии оценки качества медицинской помощи реципиентам трансплантированного сердца с клиническими признаками отторжения/дисфункции сердечного трансплантата
N пп.
Критерий
Оценка выполнения
1.
Выполнен осмотр врачом-кардиологом
Да/Нет
2.
Выполнен осмотр врачом - сердечно-сосудистым хирургом
Да/Нет
3.
Выполнен осмотр врачом-анестезиологом-реаниматологом
4.
Выполнен общий анализ крови
Да/Нет
5.
Выполнен анализ крови биохимический общетерапевтический (креатинин, мочевина, билирубин, АЛТ, АСТ, холестерин, ЛПВП, ЛПНП, триглицериды, щелочная фосфатаза, ГГТ, C реактивный белок, альбумин, глюкоза, общий белок)
Да/Нет
6.
Выполнен анализ электролитного состава крови (калий, натрий, магний)
Да/Нет
7.
Выполнено ЭКГ
Да/Нет
8.
Выполнено ЭхоКГ
Да/Нет
9.
Выполнена чрезвенозная катетеризация правых отделов сердца (при наличии показаний)
Да/Нет
10.
Выполнена коронарангиография
Да/Нет
11.
Выполнена биопсия миокарда
Да/Нет
12.
Выполнено Холтеровское мониторирование, длительностью мониторирования до 24 часов, при наличии показаний
Да/Нет
13.
Выполнено определение концентрации такролимуса** или циклоспорина** или эверолимуса** в крови
Да/Нет
14.
Выполнена внутривенная пульс-терапия глюкокортикостероидами (при наличии показаний)
Да/Нет
15.
Выполнена имплантация системы механической поддержки кровообращения, дополненной экстракорпоральной мембранной оксигенацией (при наличии показаний)
Да/Нет
16.
Выполнена ретрансплантация сердца (при наличии показаний)
Да/Нет
17.
Проведен плазмаферез, иммуноадсорбция (при наличии показаний)
Да/Нет
18.
Выполнена контрольная биопсия миокарда после проведенной терапии
Да/Нет
Список литературы
1. Maddox T.M., Januzzi J.L., Allen L.A., et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2021; 77 (6): 772 - 810.
2. McDonagh T.A., Metra M., Adamo M., et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2021; 42 (36): 3599 - 3726.
3. Готье С.В., Шевченко А.О., Кормер А.Я, Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Захаревич В.М. Три десятилетия трансплантации сердца в ФНЦ ТИО имени академика В.И. Шумакова: отдаленные результаты. Вестник трансплантологии и искусственных органов. 2015. Т. 15. N 2. С. 70 - 73.
4. Lund et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Heart Transplantation Report-2015. J Heart Lung Transplant 2015; 34: 1244 - 1254.
5. Готье С.В., Шевченко А.О., Попцов В.Н., Саитгареев Р.Ш., Захаревич В.М., Шумаков Д.В., Акопов Г.А. Опыт 800 трансплантаций сердца в НМИЦ трансплантологии и искусственных органов им. акад. В.И. Шумакова. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 52 - 53.
6. Gautier SV, Shevchenko AO, et al. Thirty-Year Dynamics of Survival among Heart Recipients: A Single Center Russian Experience. Transplantation. 2018; 102: S827. DOI: 10.1097/01.tp.0000543875.50643.83.
7. Клинические рекомендации "Хроническая сердечная недостаточность", одобрены Научно-практическим Советом Минздрава РФ в 2020. https://cr.minzdrav.gov.ru/schema/156_1#doc_a1
8. Готье С.В., Шевченко А.О., Кормер А.Я., Попцов В.Н., Шевченко О.П. Перспективы улучшения отдаленных результатов трансплантации сердца. Вестник трансплантологии и искусственных органов. 2014. Т. XVI. N 3. С. 23 - 30.
9. Готье С.В., Захаревич В.М., Халилулин Т.А, Шевченко А.О, Попцов В.Н, Р.Л. Ахмадзай, Гольц А.М., Закирьянов А.Р., Колоскова Н.Н., Захаревич Н.Ю., Никитина Е.А., Поздняков О.А., Кирьяков К.С. Трансплантация сердца как радикальный метод восстановление качества жизни у реципиентов с терминальной стадии сердечной недостаточности. Вестник трансплантологии и искусственных органов. 2019. Т. XXI. N 2. С. 70 - 73.
10. Levy WC, Mozaffarian D, Linker DT, et al. The Seattle Heart Failure Model: prediction of survival in heart failure. Circulation 2006; 113: 1424 - 33.
11. Goda A, Williams P, Mancini D, Lund LH. Selecting patients for heart transplantation: comparison of the Heart Failure Survival Score (HFSS) and the Seattle heart failure model (SHFM). J Heart Lung Transplant 2011; 30: 1236 - 43.
12. Levy WC, Mozaffarian D, Linker DT, Farrar DJ, Miller LW. Can the Seattle heart failure model be used to risk-stratify heart failure patients for potential left ventricular assist device therapy? J Heart Lung Transplant 2009; 28: 231 - 6.
13. Kalogeropoulos AP, Georgiopoulou VV, Giamouzis G, et al. Utility of the Seattle Heart Failure Model in patients with advanced heart failure. J Am Coll Cardiol 2009; 53: 334 - 42.
14. Herz MI. The Registry of the International Society for Heart and Lung Transplantation-Introduction to the 2012 annual reports: new leadership, same vision. J Heart Lung Transplant. 2012; 31: 1045 - 1051.
15. Arias M, Rush DN, Wiebe C, Gibson IW, Blydt-Hansen TD, Nickerson PW. et al. Antibody-mediated rejection: analyzing the risk, proposing solutions. Transplantation. 2014; 98: 3 - 21. [(Suppl 3)].
16. Mehra MR. Contemporary concepts in prevention and treatment of cardiac allograft vasculopathy. Am J Transplant. 2006; 6: 1248 - 1256.
17. Mitchell RN, Libby P. Vascular remodeling in transplant vasculopathy. Circ Res. 2007; 100: 967 - 978.
18. Tuzcu EM, Kapadia SR, Sachar R, Ziada KM, Crowe TD, Feng J. et al. Intravascular ultrasound evidence of angiographically silent progression in coronary atherosclerosis predicts long-term morbidity and mortality after cardiac transplantation. J Am Coll Cardiol. 2005; 45: 1538 - 1542.
19. Goda A, Williams P, Mancini D, Lund LH. Selecting patients for heart transplantation: comparison of the Heart Failure Survival Score (HFSS) and the Seattle heart failure model (SHFM). J Heart Lung Transplant 2011; 30: 1236 - 43.
20. Patel P., Glumova A., LaPorte K., Mahle W.T., Deshpande S.R. High Pulmonary Vascular Resistance in Pediatric Heart Transplant Patients and Role of Sildenafil. The Journal of Heart and Lung Transplantation, Vol. 36, Issue 4, S270.
21. Ardehali A, Hughes K, Sadeghi A, et al. Inhaled nitric oxide for pulmonary hypertension after heart transplantation. Transplantation 2001; 72: 638 - 41.
22. Auler Junior JO, Carmona MJ, Bocchi EA, et al. Low doses of inhaled nitric oxide in heart transplant recipients. J Heart Lung Transplant 1996; 15: 443 - 50.
23. De Santo LS, Mastroianni C, Romano G, et al. Role of sildenafil in acute posttransplant right ventricular dysfunction: successful experience in 13 consecutive patients. Transplant Proc 2008; 40: 2015 - 8.
24. Mikus E, Stepanenko A, Krabatsch T, et al. Reversibility of fixed pulmonary hypertension in left ventricular assist device support recipients. Eur J Cardiothorac Surg 2011; 40: 971 - 7.
25. Kutty RS, Parameshwar J, Lewis C, et al. Use of centrifugal left ventricular assist device as a bridge to candidacy in severe heart failure with secondary pulmonary hypertension. Eur J Cardiothorac Surg 2013; 43: 1237 - 42.
26. Попцов В.Н., Спирина Е.А., Ухренков С.Г., Алиев Э.З., Хатуцкий В.М., Догонашева А.А. Механическая поддержка кровообращения при ранней дисфункции сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 58.
27. Готье С.В., Попцов В.Н., Захаревич В.М., Шевченко А.О., Спирина Е.А., Ухренков С.Г., Масютин С.А., Алиев Э.З., Воронков В.Ю., Чибисов Н.С., Устин С.Ю., Бондаренко Д.М. Пятилетний опыт применения периферической вено-артериальной экстракорпоральной мембранной оксигенации как метода механической поддержки кровообращения у потенциальных реципиентов сердца.// Вестник трансплантологии и искусственных органов. 2016. Т. 18. N 4. С. 16 - 25.
28. Попцов В.Н., Спирина Е.А., Ухренков С.Г., Бондаренко Д.М., Догонашева А.А., Алиев Э.З. Временная механическая поддержка кровообращения у потенциальных реципиентов сердца. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N 4. С. 113 - 123.
29. Готье С.В., Попцов В.Н., Спирина Е.А., Саитгареев Р.Ш., Захаревич В.М., Акопов Г.А., Шумаков Д.В., Закирьянов А.Р., Халилулин Т.А., Гольц А.М., Шевченко А.О., Колоскова Н.Н. Сравнительный анализ факторов, потенциально влияющих на результаты трансплантации сердца, в группах пациентов, ранее оперированных на открытом сердца и ранее не оперированных. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 55 - 56.
30. Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Акопов Г.А., Тарабарко Н.Н., Анискевич Г.В. Пересадка сердца после коррекции клапанной патологии сердечного трансплантата.// Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 65 - 66.
31. Попцов В.Н., Спирина Е.А., Масютин С.А., Пчельников В.В., Ухренков С.Г., Алиев Э.З., Устин С.Ю., Хатуцкий В.М., Догонашева А.А. Периоперационный период при трансплантации сердца от доноров 55 лет и старше. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 62.
32. Taylor DO, Edwards LB, Boucek MM, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-fourth official adult heart transplant report - 2007. J Heart Lung Transplant 2007; 26: 769.
33. Taylor DO, Stehlik J, Edwards LB, et al. Registry of the International Society for Heart and Lung Transplantation: twenty-sixth official adult heart transplant report - 2009. J Heart Lung Transplant 2009; 28: 1007.
34. Leprince P, Aubert S, Bonnet N, et al. Peripheral extracorporeal membrane oxygenation (ECMO) in patients with posttransplant cardiac graft failure. Transplant Proc 2005; 37: 2879.
35. Taylor DO, Edwards LB, Boucek MM, Trulock EP, Waltz DA, Keck BM, et al. Registry of the International Society for Heart and Lung Transplantation: Twenty-third official adult heart transplantation report-2006. JHLTX 2006; 25: 869 - 79.
36. Gardner RS, McDanagh TA, MacDonald M, Dargie HJ, Murday AJ, Petrie MC. Who needs a heart transplant? Eur Heart J 2006; 27: 770 - 2.
37. Hunt SA, Kouretas PC, Balsam LB, Robbins RC. Heart transplantation. In Zipes DP, Libby P, Bonow RO, Braunwald E. Braunwald's Heart Disease. 7 th edition. Elsevier Saunders 2005.
38. Packer M, Coats AJ, Fowler MB, et al. Effect of carvedilol on survival in severe chronic heart failure. N Engl J Med 2001; 344: 1651 - 8.
39. Lewis EF, Tsang SW, Fang JC, et al. Frequency and impact of delayed decisions regarding heart transplantation on long-term outcomes in patients with advanced heart failure. J Am Coll Cardiol 2004; 43: 794 - 802.
40. Feldman D. et al. The 2013 International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support. The Journal of Heart and Lung Transplantation, 2013 Vol. 32, Issue 2, p 157 - 187.
41. Иткин Г.П., Попцов В.Н. Механизмы правожелудочковой недостаточности в условиях левожелудочкового вспомогательного кровообращения и методы бивентрикулярного обхода сердца. Вестник трансплантологии и искусственных органов. 2013. Т. X. N 4. С. 126 - 135.
42. Kirklin J.K., Naftel D.C., Pagani F.D., et al. Seventh INTERMACS annual report: 15,000 patients and counting. J. Heart Lung Transplant. 2015; 34: 1495 - 1504.
43. Готье С.В., Иткин Г.П., Шемакин С.Ю., Саитгареев Р.Ш, Попцов В.Н., Захаревич В.М., Акопов Г.А., Кормер А.Я., Халилулин Т.А., Шевченко О.П., Невзоров А.М., Филатов И.А., Селищев С.В. Первый опыт клинического применения отечественного аппарата вспомогательного кровообращения на базе имплантируемого осевого насоса для двухэтапной трансплантации сердца. Вестник трансплантологии и искусственных органов. 2013. Т. X. N 3. С. 92 - 101
44. Taylor Clare J, 
![]() M, Roalfe Andrea K, Lay-Flurrie Sarah, Jones Nicholas R, Marshall Tom et al. Trends in survival after a diagnosis of heart failure in the United Kingdom 2000 - 2017: population based cohort study BMJ 2019; 364: l223
M, Roalfe Andrea K, Lay-Flurrie Sarah, Jones Nicholas R, Marshall Tom et al. Trends in survival after a diagnosis of heart failure in the United Kingdom 2000 - 2017: population based cohort study BMJ 2019; 364: l223
45. Brown KN, Kanmanthareddy A. Heart Transplantation Patient Selection. [Updated 2020 Oct 12]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537090/.
46. Ravichandran AK, Cowger J. Left ventricular assist device patient selection: do risk scores help?. J Thorac Dis. 2015; 7(12): 2080 - 2087. doi: 10.3978/j.issn.2072-1439.2015.11.02
47. S. Li, et al. Validity of the Seattle Heart Failure Model after heart failure hospitalization. ESC Heart Fail., 6 (3) (2019), pp. 509 - 515.
48. Gorodeski EZ, Chu EC, Chow CH, Levy WC, Hsich E, Starling RC. Application of the Seattle Heart Failure Model in ambulatory patients presented to an advanced heart failure therapeutics committee. Circ Heart Fail 2010; 3: 706 - 14.
49. Pamboukian SV, Tallaj JA, Brown RN, et al. Comparison of observed survival with assist device versus predicted survival without device using the Seattle heart failure model. ASAIO J 2012; 58: 93 - 7.
50. Aaronson KD, Schwartz JS, Chen TM, Wong KL, Goin JE, Mancini DM. Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997; 95: 2660 - 7.
51. Parikh MN, Lund LH, Goda A, Mancini D. Usefulness of peak exercise oxygen consumption and the heart failure survival score to predict survival in patients 465 years of age with heart failure. Am J Cardiol 2009; 103: 998 - 1002.
52. Goda A, Lund LH, Mancini DM. Comparison across races of peak oxygen consumption and heart failure survival score for selection for cardiac transplantation. Am J Cardiol 2010; 105: 1439 - 44.
53. Green P, Lund LH, Mancini D. Comparison of peak exercise oxygen consumption and the Heart Failure Survival Score for predicting prognosis in women versus men. Am J Cardiol 2007; 99: 399 - 403.
54. Lund LH, Aaronson KD, Mancini DM. Validation of peak exercise oxygen consumption and the Heart Failure Survival Score for serial risk stratification in advanced heart failure. Am J Cardiol 2005; 95: 734 - 41.
55. Mancini DM, Eisen H, Kussmaul W, Mull R, Edmunds LH Jr, Wilson JR. Value of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation 1991; 83: 778 - 86.
56. Mehra MR, Kobashigawa J, Starling R, et al. Listing criteria for heart transplantation: International Society for Heart and Lung Transplantation guidelines for the care of cardiac transplant candidates-2006. J Heart Lung Transplant 2006; 25: 1024 - 42.
57. Stevenson LW, Miller LW, Desvigne-Nickens P, et al. Left ventricular assist device as destination for patients undergoing intravenous inotropic therapy: a subset analysis from REMATCH (Randomized Evaluation of Mechanical Assistance in Treatment of Chronic Heart Failure). Circulation 2004; 110: 975 - 81.
58. Hershberger RE, Nauman D, Walker TL, Dutton D, Burgess D. Care processes and clinical outcomes of continuous outpatient support with inotropes (COSI) in patients with refractory endstage heart failure. J Card Fail 2003; 9: 180 - 7.
59. Fellahi J.L. et al. Perioperative Use of Dobutamine in Cardiac Surgery and Adverse Cardiac Outcome: Propensity-adjusted Analyses. Anesthesiology. 2008; 108: 979 - 987.
60. Rao V, Oz MC, Flannery MA, Catanese KA, Argenziano M, Naka Y. Revised screening scale to predict survival after insertion of a left ventricular assist device. J Thorac Cardiovasc Surg 2003; 125: 855 - 62.
61. Lietz K, Long JW, Kfoury AG, et al. Outcomes of left ventricular assist device implantation as destination therapy in the post-REMATCH era: implications for patient selection. Circulation 2007; 116: 497 - 505.
62. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13: 818 - 29.
63. Schaffer JM, Allen JG, Weiss ES, et al. Evaluation of risk indices in continuous-flow left ventricular assist device patients. Ann Thorac Surg 2009; 88: 1889 - 96.
64. Teuteberg J, Ewald G, Adamson R, et al. Application of the destination therapy risk score to HeartMate II clinical trial data [abstract] [manuscript in press, JACC]. J Heart Lung Transplant 2011; 30: S31.
65. Boyle AJ, Ascheim DD, Russo MJ, et al. Clinical outcomes for continuous-flow left ventricular assist device patients stratified by pre-operative INTERMACS classification. J Heart Lung Transplant 2011; 30: 402 - 7.
66. Cowger J, Sundareswaran K, Rogers J, et al. The HeartMate II risk score: Predicting survival in candidates for left ventricular assist device support [abstract]. J Heart Lung Transplant 2011; 30: S31
67. S.G. Al Kindi, M. Farhoud, et al. Left ventricular assist devices or inotropes for decreasing pulmonary vascular resistance in patients with pulmonary hypertension listed for heart transplantation J. Card. Fail., 23 (2017), pp. 209 - 215.
68. Jennifer Cowger et al. 70 The HeartMate II Risk Score: Predicting Survival in Candidates for Left Ventricular Assist Device Support. April 2011 The Journal of Heart and Lung Transplantation 30(4).
69. Pagani FD, Miller LW, Russell SD, et al. Extended mechanical circulatory support with a continuous-flow rotary left ventricular assist device. J Am Coll Cardiol 2009; 54: 312 - 21.
70. Goodwin M, Nemeh HW, Borgi J, Paone G, Morgan JA. Resolution of Mitral Regurgitation With Left Ventricular Assist Device Support Ann Thorac Surg. 2017 Sep; 104(3): 811 - 818.
71. Schweiger Ml, Stepanenko A, Vierecke J, Drews T, Potapov E, Hetzer R, Krabatsch T. Biological mitral valve prosthesis in a patient supported with a permanent left ventricle assist device. ASAIO J. 2011 Nov - Dec; 57(6): 550 - 2.
72. Choi JH, Luc JGY, Moncho  E, Phan K, Rizvi SSA, Patel S, Entwistle JW, Morris RJ, Massey HT, Tchantchaleishvili V. Impact of Concomitant Mitral Valve Surgery With LVAD Placement: Systematic Review and Meta-Analysis Artif Organs. 2018 Dec; 42(12): 1139 - 1147
E, Phan K, Rizvi SSA, Patel S, Entwistle JW, Morris RJ, Massey HT, Tchantchaleishvili V. Impact of Concomitant Mitral Valve Surgery With LVAD Placement: Systematic Review and Meta-Analysis Artif Organs. 2018 Dec; 42(12): 1139 - 1147
73. Oezpeker C, Zittermann A, Paluszkiewicz L, Piran M, Puehler T, Sayin AO, Ensminger S, Milting H, Morshuis M, Gummert JF. Tricuspid valve repair in patients with left-ventricular assist device implants and tricuspid valve regurgitation: propensity score-adjusted analysis of clinical outcome. Interact Cardiovasc Thorac Surg. 2015 Dec; 21(6): 741 - 7
74. Lahpor JR, de Jonge N, van Swieten HA, Wesenhagen H,  C, Geertman JH, Oosterom A, Rodermans B, Kirkels JH. Left ventricular assist device as bridge to transplantation in patients with end-stage heart failure: Eight-year experience with the implantable HeartMate LVAS. Neth Heart J. 2002 Jun; 10(6): 267 - 271
C, Geertman JH, Oosterom A, Rodermans B, Kirkels JH. Left ventricular assist device as bridge to transplantation in patients with end-stage heart failure: Eight-year experience with the implantable HeartMate LVAS. Neth Heart J. 2002 Jun; 10(6): 267 - 271
75. Morgan JA, Tsiouris A, Nemeh HW, Hodari A, Karam J, Brewer RJ, Paone G. Impact of concomitant cardiac procedures performed during implantation of long-term left ventricular assist devices. J Heart Lung Transplant. 2013 Dec; 32(12): 1255 - 61
76. Kittipibul V, Rattanawong P, Kewcharoen J, Chongsathidkiet P, Vutthikraivit W, Kanjanahattakij N. Atrial Fibrillation Is Not Associated With Thromboembolism in Left Ventricular Assist Device Patients: A Systematic Review and Meta-Analysis. ASAIO J. 2018 Jun 5
77. Johnsson P, Algotsson L, Ryding E, Stahl E, Messeter K. Cardiopulmonary perfusion and cerebral blood flow in bilateral carotid artery disease. Ann Thorac Surg 1991; 51: 579 - 84.
78. Selim M. Angioplasty and stenting of asymptomatic carotid stenosis before cardiac surgery: more study is needed. Arch Neurol 2008; 65: 1672 - 4.
79. Lazar HL, Menzoian JO. Coronary artery bypass grafting in patients with cerebrovascular disease. Ann Thorac Surg 1998; 66: 968 - 74.
80. Kato TS, Schulze PC, Yang J, et al. Pre-operative and post-operative risk factors associated with neurologic complications in patients with advanced heart failure supported by a left ventricular assist device. J Heart Lung Transplant 2012; 31: 1 - 8.
81. Wadia Y, Etheridge W, Smart F, Wood RP, Frazier OH. Pathophysiology of hepatic dysfunction and intrahepatic cholestasis in heart failure and after left ventricular assist device support. J Heart Lung Transplant 2005; 24: 361 - 70.
82. Levy JH, Winkler AM. Heparin-induced thrombocytopenia and cardiac surgery. Curr Opin Anaesthesiol 2010; 23: 74 - 9.
83. Morel-Kopp MC, Aboud M, Tan CW, Kulathilake C, Ward C. Whole blood impedance aggregometry detects heparin-induced thrombocytopenia antibodies. Thromb Res 2010; 125: e23 - 9.
84. Warkentin TE, Greinacher A, Koster A. Heparin-induced thrombocytopenia in patients with ventricular assist devices: are new prevention strategies required? Ann Thorac Surg 2009; 87: 1633 - 40.
85. Zucker MJ, Sabnani I, Baran DA, Balasubramanian S, Camacho M. Cardiac transplantation and/or mechanical circulatory support device placement using heparin anti-coagulation in the presence of acute heparin-induced thrombocytopenia. J Heart Lung Transplant 2010; 29: 53 - 60.
86. Butler J, Howser R, Portner PM, Pierson RN 3rd. Diabetes and outcomes after left ventricular assist device placement. J Card Fail 2005; 11: 510 - 5.
87. Topkara VK, Dang NC, Martens TP, et al. Effect of diabetes on short- and long-term outcomes after left ventricular assist device implantation. J Heart Lung Transplant 2005; 24: 2048 - 53.
88. Uriel N, Naka Y, Colombo PC, et al. Improved diabetic control in advanced heart failure patients treated with left ventricular assist devices. Eur J Heart Fail 2011; 13: 195 - 9.
89. Kolesar A, Sabol F, Luczy J, Bajmoczi M. Use of left ventricle assist device in a pregnant woman with acute aortic and coronary dissections. Interact Cardiovasc Thorac Surg 2010; 11: 194 - 5.
90. LaRue S, Shanks A, Wang IW, Ewald G, Anderson D, Joseph S. Left ventricular assist device in pregnancy. Obstet Gynecol 2011; 118: 426 - 8.
91. Oles D, Berryessa R, Campbell K, Bhatti MA. Emergency redo mitral valve replacement in a 27-year-old pregnant female with a clotted prosthetic mitral valve, preoperative fetal demise and postoperative ventricular assist device: a case report. Perfusion 2001; 16: 159 - 64. The Journal of Heart and Lung Transplantation, Vol 32, No 2, February 2013 180
92. Sims DB, Vink J, Uriel N, et al. A successful pregnancy during mechanical circulatory device support. J Heart Lung Transplant 2011; 30: 1065
93. Dew MA, DiMartini AF, Steel J, et al. Meta-analysis of risk for relapse to substance use after transplantation of the liver or other solid organs. Liver Transpl 2008; 14: 159 - 72
94. Holman WL, Kormos RL, Naftel DC, et al. Predictors of death and transplant in patients with a mechanical circulatory support device: a multi-institutional study. J Heart Lung Transplant 2009; 28: 44 - 50.
95. Adamson RM, Stahovich M, Chillcott S, et al. Clinical strategies and outcomes in advanced heart failure patients older than 70 years of age receiving the HeartMate II left ventricular assist device: a community hospital experience. J Am Coll Cardiol 2011; 57: 2487 - 95.
96. Park SJ, Milano CA, Tatooles AJ, et al. Outcomes in advanced heart failure patients with left ventricular assist devices for destination therapy. Circ Heart Fail 2012; 5: 241 - 8
97. Raymond AL, Kfoury AG, Bishop CJ, et al. Obesity and left ventricular assist device driveline exit site infection. ASAIO J 2010; 56: 57 - 60.
98. Zahr F, Genovese E, Mathier M, et al. Obese patients and mechanical circulatory support: weight loss, adverse events, and outcomes. Ann Thorac Surg 2011; 92: 1420 - 6.
99. Brewer RJ, Lanfear DE, Sai-Sudhakar CB, et al. Extremes of body mass index do not impact mid-term survival after continuous-flow left ventricular assist device implantation. J Heart Lung Transplant 2012; 31: 167 - 72
100. Gelow JM, Desai AS, Hochberg CP, Glickman JN, Givertz MM, Fang JC. Clinical predictors of hepatic fibrosis in chronic advanced heart failure. Circ Heart Fail 2010; 3: 59 - 64.
101. Matthews JC, Pagani FD, Haft JW, Koelling TM, Naftel DC, Aaronson KD. Model for end-stage liver disease score predicts left ventricular assist device operative transfusion requirements, morbidity, and mortality. Circulation 2010; 121: 214 - 20.
102. Concha PM, Mertz KV. [Perioperative risk among patients with cirrhosis]. Rev Med Chil 2010; 138: 1165 - 71.
103. Modi A, Vohra HA, Barlow CW. Do patients with liver cirrhosis undergoing cardiac surgery have acceptable outcomes? Interact Cardiovasc Thorac Surg 2010; 11: 630 - 4.
104. Frazier OH, Rose EA, Oz MC, et al. Multicenter clinical evaluation of the HeartMate vented electric left ventricular assist system in patients awaiting heart transplantation. J Thorac Cardiovasc Surg 2001; 122: 1186 - 95.
105. Khan MA, Hussain SF. Pre-operative pulmonary evaluation. J Ayub Med Coll Abbottabad 2005; 17: 82 - 6.
106. Wright DJ, Khan KM, Gossage EM, Saltissi S. Assessment of a low-intensity cardiac rehabilitation programme using the six-minute walk test. Clin Rehabil 2001; 15: 119 - 24.
107. Smetana GW. Preoperative pulmonary evaluation. N Engl J Med 1999; 340: 937 - 44.
108. Smetana GW, Lawrence VA, Cornell JE. Preoperative pulmonary risk stratification for noncardiothoracic surgery: systematic review for the American College of Physicians. Ann Intern Med 2006; 144: 581 - 95.
109. Miller LW, Lietz K. Candidate selection for long-term left ventricular assist device therapy for refractory heart failure. J Heart Lung Transplant 2006; 25: 756 - 64.
110. Miller MR, Crapo R, Hankinson J, et al. General considerations for lung function testing. Eur Respir J 2005; 26: 153 - 61.
111. Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26: 948 - 68.
112. Rady MY, Ryan T. Perioperative predictors of extubation failure and the effect on clinical outcome after cardiac surgery. Crit Care Med 1999; 27: 340 - 7.
113. Samuels LE, Kaufman MS, Morris RJ, Promisloff R, Brockman SK. Coronary artery bypass grafting in patients with COPD. Chest 1998; 113: 878 - 82.
114. Dimick JB, Chen SL, Taheri PA, Henderson WG, Khuri SF, Campbell DA Jr.. Hospital costs associated with surgical complications: a report from the private-sector National Surgical Quality Improvement Program. J Am Coll Surg 2004; 199: 531 - 7.
115. Bapoje SR, Whitaker JF, Schulz T, Chu ES, Albert RK. Preoperative evaluation of the patient with pulmonary disease. Chest 2007; 132: 1637 - 45.
116. Arozullah AM, Daley J, Henderson WG, Khuri SF. Multifactorial risk index for predicting postoperative respiratory failure in men after major noncardiac surgery. The National Veterans Administration Surgical Quality Improvement Program. Ann Surg 2000; 232: 242 - 53.
117. Canet J, Gallart L, Gomar C, et al. Prediction of postoperative pulmonary complications in a population-based surgical cohort. Anesthesiology 2010; 113: 1338 - 50.
118. Kroenke K, Lawrence VA, Theroux JF, Tuley MR, Hilsenbeck S. Postoperative complications after thoracic and major abdominal surgery in patients with and without obstructive lung disease. Chest 1993; 104: 1445 - 51.
119. Culver BH. How should the lower limit of the normal range be defined? Respir Care 2012; 57: 136 - 45.
120. Sandner SE, Zimpfer D, Zrunek P, et al. Renal function and outcome after continuous flow left ventricular assist device implantation. Ann Thorac Surg 2009; 87: 1072 - 8.
121. Butler J, Geisberg C, Howser R, et al. Relationship between renal function and left ventricular assist device use. Ann Thorac Surg 2006; 81: 1745 - 51.
122. Topkara VK, Dang NC, Barili F, et al. Predictors and outcomes of continuous veno-venous hemodialysis use after implantation of a left ventricular assist device. J Heart Lung Transplant 2006; 25: 404 - 8.
123. Ootaki C, Yamashita M, Ootaki Y, et al. Reduced pulsatility induces periarteritis in kidney: role of the local renin-angiotensin system. J Thorac Cardiovasc Surg 2008; 136: 150 - 8.
124. Radovancevic B, Vrtovec B, de KE, Radovancevic R, Gregoric ID, Frazier OH. End-organ function in patients on long-term circulatory support with continuous- or pulsatile-flow assist devices. J Heart Lung Transplant 2007; 26: 815 - 8.
125. Letsou GV, Myers TJ, Gregoric ID, et al. Continuous axial-flow left ventricular assist device (Jarvik 2000) maintains kidney and liver perfusion for up to 6 months. Ann Thorac Surg 2003; 76: 1167 - 70.
126. Russell SD, Rogers JG, Milano CA, et al. Renal and hepatic function improve in advanced heart failure patients during continuous-flow support with the HeartMate II left ventricular assist device. Circulation 2009; 120: 2352 - 7.
127. Miller LW, Pagani FD, Russell SD, et al. Use of a continuous-flow device in patients awaiting heart transplantation. N Engl J Med 2007; 357: 885 - 96.
128. Slaughter MS, Pagani FD, Rogers JG, et al. Clinical management of continuous-flow left ventricular assist devices in advanced heart failure. J Heart Lung Transplant 2010; 29: S1 - 39.
129. Singh M, Shullo M, Kormos RL, et al. Impact of renal function before mechanical circulatory support on posttransplant renal outcomes. Ann Thorac Surg 2011; 91: 1348 - 54.
130. Cupples S, Dew MA, Grady KL, et al. Report of the Psychosocial Outcomes Workgroup of the Nursing and Social Sciences Council of the International Society for Heart and Lung Transplantation: present status of research on psychosocial outcomes in cardiothoracic transplantation: review and recommendations for the field. J Heart Lung Transplant 2006; 25: 716 - 25.
131. Eshelman AK, Mason S, Nemeh H, Williams C. LVAD destination therapy: applying what we know about psychiatric evaluation and management from cardiac failure and transplant. Heart Fail Rev 2009; 14: 21 - 8.
132. Levenson JL, Olbrisch ME. Psychosocial evaluation of organ transplant candidates. A comparative survey of process, criteria, and outcomes in heart, liver, and kidney transplantation. Psychosomatics 1993; 34: 314 - 23.
133. Olbrisch ME, Benedict SM, Ashe K, Levenson JL. Psychological assessment and care of organ transplant patients. J Consult Clin Psychol 2002; 70: 771 - 83.
134. Olbrisch ME, Levenson JL. Psychosocial assessment of organ transplant candidates. Current status of methodological and philosophical issues. Psychosomatics 1995; 36: 236 - 43.
135. De Geest S, Abraham I, Moons P, et al. Late acute rejection and subclinical noncompliance with cyclosporine therapy in heart transplant recipients. J Heart Lung Transplant 1998; 17: 854 - 63.
136. De Geest S, Dobbels F, Martin S, Willems K, Vanhaecke J. Clinical risk associated with appointment noncompliance in heart transplant recipients. Prog Transplant 2000; 10: 162 - 8.
137. De Geest S, Dobbels F, Fluri C, Paris W, Troosters T. Adherence to the therapeutic regimen in heart, lung, and heart-lung transplant recipients. J Cardiovasc Nurs 2005; 20: S88 - 98.
138. Dew MA, Roth LH, Thompson ME, Kormos RL, Griffith BP. Medical compliance and its predictors in the first year after heart transplantation. J Heart Lung Transplant 1996; 15: 631 - 45.
139. Nagele H, Kalmar P, Rodiger W, Stubbe HM. Smoking after heart transplantation: an underestimated hazard? Eur J Cardiothorac Surg 1997; 12: 70 - 4
140. Pagani FD, Lynch W, Swaniker F, et al. Extracorporeal life support to left ventricular assist device bridge to heart transplant: A strategy to optimize survival and resource utilization. Circulation 1999; 100: II206 - 10.
141. Aziz TA, Singh G, Popjes E, et al. Initial experience with CentriMag extracorporal membrane oxygenation for support of critically ill patients with refractory cardiogenic shock. J Heart Lung Transplant 2010; 29: 66 - 71.
142. Bagai J, Webb D, Kasasbeh E, et al. Efficacy and safety of percutaneous life support during high-risk percutaneous coronary intervention, refractory cardiogenic shock and in-laboratory cardiopulmonary arrest. J Invasive Cardiol 2011; 23: 141 - 7.
143. Cleveland JC Jr, Naftel DC, Reece TB, et al. Survival after biventricular assist device implantation: an analysis of the Interagency Registry for Mechanically Assisted Circulatory Support database. J Heart Lung Transplant 2011; 30: 862 - 9.
144. Krabatsch T, Schweiger M, Stepanenko A, et al. Mechanical circulatory support-results, developments and trends. J Cardiovasc Transl Res 2011; 4: 332 - 9.
145. Thiele H, Sick P, Boudriot E, et al. Randomized comparison of intraaortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005; 26: 1276 - 83.
146. Engstrom AE, Cocchieri R, Driessen AH, et al. The Impella 2.5 and 5.0 devices for ST-elevation myocardial infarction patients presenting with severe and profound cardiogenic shock: the Academic Medical Center intensive care unit experience. Crit Care Med 2011; 39: 2072 - 9.
147. Koeckert MS, Jorde UP, Naka Y, Moses JW, Takayama H, Impella LP. 2.5 for left ventricular unloading during venoarterial extracorporeal membrane oxygenation support. J Card Surg 2011; 26: 666 - 8.
148. Meyns B, Dens J, Sergeant P, Herijgers P, Daenen W, Flameng W. Initial experiences with the Impella device in patients with cardiogenic shock-Impella support for cardiogenic shock. Thorac Cardiovasc Surg 2003; 51: 312 - 7.
149. Siegenthaler MP, Brehm K, Strecker T, et al. The Impella Recover microaxial left ventricular assist device reduces mortality for postcardiotomy failure: a three-center experience. J Thorac Cardiovasc Surg 2004; 127: 812 - 22
150. Feldman D, Menachemi DM, Abraham WT, Wexler RK. Manage-ment strategies for stage-D patients with acute heart failure. Clin Cardiol 2008; 31: 297 - 301.
151. Farrar DJ. Ventricular interactions during mechanical circulatory support. Semin Thorac Cardiovasc Surg 1994; 6: 163 - 8.
152. Farrar DJ, Compton PG, Hershon JJ, Fonger JD, Hill JD. Right heart interaction with the mechanically assisted left heart. World J Surg 1985; 9: 89 - 102.
153. Dang NC, Topkara VK, Mercando M, et al. Right heart failure after left ventricular assist device implantation in patients with chronic congestive heart failure. J Heart Lung Transplant 2006; 25: 1 - 6.
154. Kavarana MN, Pessin-Minsley MS, Urtecho J, et al. Right ventricular dysfunction and organ failure in left ventricular assist device recipients: a continuing problem. Ann Thorac Surg 2002; 73: 745 - 50.
155. Ochiai Y, McCarthy PM, Smedira NG, et al. Predictors of severe right ventricular failure after implantable left ventricular assist device insertion: analysis of 245 patients. Circulation 2002; 106: I198 - 202.
156. Fitzpatrick JR 3rd, Frederick JR, Hiesinger W, et al. Early planned institution of biventricular mechanical circulatory support results in improved outcomes compared with delayed conversion of a left ventricular assist device to a biventricular assist device. J Thorac Cardiovasc Surg 2009; 137: 971 - 7
157. Tsukui H, Teuteberg JJ, Murali S, et al. Biventricular assist device utilization for patients with morbid congestive heart failure: a justifiable strategy. Circulation 2005; 112: I65 - 72.
158. Kukucka M, Stepanenko A, Potapov E, et al. Right-to-left ventricular end-diastolic diameter ratio and prediction of right ventricular failure with continuous-flow left ventricular assist devices. J Heart Lung Transplant 2011; 30: 64 - 9.
159. Matthews JC, Koelling TM, Pagani FD, Aaronson KD. The right ventricular failure risk score a pre-operative tool for assessing the risk of right ventricular failure in left ventricular assist device candidates. J Am Coll Cardiol 2008; 51: 2163 - 72.
160. Kirklin JK, Naftel DC, Kormos RL, et al. Second INTERMACS annual report: more than 1,000 primary left ventricular assist device implants. J Heart Lung Transplant 2010; 29: 1 - 10.
161. Pagani FD. Continuous-flow rotary left ventricular assist devices with "3rd generation" design. Semin Thorac Cardiovasc Surg. 2008 Fall; 20(3): 255 - 63. doi: 10.1053/j.semtcvs.2008.08.002. PMID: 19038736.
162. Daniel W. Ross, Gerin R. Stevens, Rimda Wanchoo, David T. Majure, Sandeep Jauhar, Harold A. Fernandez, Massini Merzkani, Kenar D. Jhaveri. Left Ventricular Assist Devices and the Kidney. CJASN Feb 2018, 13 (2) 348 - 355; doi: 10.2215/CJN.04670417.
163. Tosto, C., Adamo, L., Craddock, H. et al. Relationship between device acceptance and patient-reported outcomes in Left Ventricular Assist Device (LVAD) recipients. Sci Rep 9, 10778 (2019). https://doi.org/10.1038/s41598-019-47324-z.
164. Furukawa K, Motomura T, Nose Y. Right ventricular failure after left ventricular assist device implantation: the need for an implantable right ventricular assist device. Artif Organs 2005; 29: 369 - 77.
165. Fitzpatrick JR 3rd, Frederick JR, Hsu VM, et al. Risk score derived from pre-operative data analysis predicts the need for biventricular mechanical circulatory support. J Heart Lung Transplant 2008; 27: 1286 - 92.
166. Kormos RL, Teuteberg JJ, Pagani FD, et al. Right ventricular failure in patients with the HeartMate II continuous-flow left ventricular assist device: incidence, risk factors, and effect on outcomes. J Thorac Cardiovasc Surg 2010; 139: 1316 - 24
167. Tedford RJ, Hemnes AR, Russell SD, et al. PDE5A inhibitor treatment of persistent pulmonary hypertension after mechanical circulatory support. Circ Heart Fail 2008; 1: 213 - 9.
168. Matamis D, Pampori S, Papathanasiou A, et al. Inhaled NO and sildenafil combination in cardiac surgery patients with out-of-proportion pulmonary hypertension: acute effects on postoperative gas exchange and hemodynamics. Circ Heart Fail 2012; 5: 47 - 53.
169. Rose EA, Gelijns AC, Moskowitz AJ, et al. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med 2001; 345: 1435 - 43.
170. Martin J, Friesewinkel O, Benk C, Sorg S, Schultz S, Beyersdorf F. Improved durability of the HeartMate XVE left ventricular assist device provides safe mechanical support up to 1 year but is associated with high risk of device failure in the second year. J Heart Lung Transplant 2006; 25: 384 - 90.
171. Starling RC, Naka Y, Boyle AJ, et al. Results of the post-U.S. Food and Drug Administration-approval study with a continuous flow left ventricular assist device as a bridge to heart transplantation: a prospective study using the INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll Cardiol 2011; 57: 1890 - 8.
172. John R, Kamdar F, Eckman P, et al. Lessons learned from experience with over 100 consecutive HeartMate II left ventricular assist devices. Ann Thorac Surg 2011; 92: 1593 - 9.
173. Cadeiras M, Nagaraj H, Kirklin JK, Holman WL, Pamboukian SV, Misra VK. Use of a vascular plug to percutaneously occlude the outflow conduit of a dysfunctional left ventricular assist device. J Heart Lung Transplant 2011; 30: 733 - 4.
174. Chrysant GS, Horstmanshof DA, Snyder T, et al. Successful percutaneous management of acute left ventricular assist device stoppage. ASAIO J 2010; 56: 483 - 5
175. Holman WL, Skinner JL, Waites KB, Benza RL, McGiffin DC, Kirklin JK. Infection during circulatory support with ventricular assist devices. Ann Thorac Surg 1999; 68: 711 - 6.
176. International Society for Heart and Lung Transplantation. A 2010 working formulation for the standardization of definitions of infections in patients using ventricular assist devices (VADs).
177. Gordon RJ, Quagliarello B, Lowy FD. Ventricular assist device-related infections. Lancet Infect Dis 2006; 6: 426 - 37.
178. Kimball PM, Flattery M, McDougan F, Kasirajan V. Cellular immunity impaired among patients on left ventricular assist device for 6 months. Ann Thorac Surg 2008; 85: 1656 - 61.
179. Shoham S, Miller LW. Cardiac assist device infections. Curr Infect Dis Rep 2009; 11: 268 - 73.
180. Gristina AG, Dobbins JJ, Giammara B, Lewis JC, DeVries WC. Biomaterial-centered sepsis and the total artificial heart. Microbial adhesion vs tissue integration. JAM 1988; 259: 870 - 4.
181. Padera RF. Infection in ventricular assist devices: the role of biofilm. Cardiovasc Pathol 2006; 15: 264 - 70.
182. Gordon SM, Schmitt SK, Jacobs M, et al. Nosocomial bloodstream infections in patients with implantable left ventricular assist devices. Ann Thorac Surg 2001; 72: 725 - 30.
183. Hanna HA, Raad II, Hackett B, et al. Antibiotic-impregnated catheters associated with significant decrease in nosocomial and multidrugresistant bacteremias in critically ill patients. Chest 2003; 124: 1030 - 8.
184. Mermel LA, Allon M, Bouza E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 49: 1 - 45.
185. O'Grady NP, Alexander M, Dellinger EP, et al. Guidelines for the prevention of intravascular catheter-related infections. Infect Control Hosp Epidemiol 2002; 23: 759 - 69.
186. Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guideline for prevention of surgical site infection, 1999. Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidemiol 1999; 20: 250 - 78.
187. Darouiche RO, Wall MJ Jr, Itani KM, et al. Chlorhexidine-alcohol versus povidone-iodine for surgical-site antisepsis. N Engl J Med 2010; 362: 18 - 26.
188. Edwards FH, Engelman RM, Houck P, Shahian DM, Bridges CR. The Society of Thoracic Surgeons Practice Guideline Series: antibiotic prophylaxis in cardiac surgery, part I: duration. Ann Thorac Surg 2006; 81: 397 - 404.
189. Harbarth S, Samore MH, Lichtenberg D, Carmeli Y. Prolonged antibiotic prophylaxis after cardiovascular surgery and its effect on surgical site infections and antimicrobial resistance. Circulation 2000; 101: 2916 - 21.
190. Eyler RF, Butler SO, Walker PC, et al. Vancomycin use during left ventricular assist device support. Infect Control Hosp Epidemiol 2009; 30: 484 - 6.
191. Engelman R, Shahian D, Shemin R, et al. The Society of Thoracic Surgeons practice guideline series: antibiotic prophylaxis in cardiac surgery, part II: antibiotic choice. Ann Thorac Surg 2007; 83: 1569 - 76.
192. Perl TM. Prevention of Staphylococcus aureus infections among surgical patients: beyond traditional perioperative prophylaxis. Surgery 2003; 134: S10 - 7.
193. Holman WL, Park SJ, Long JW, et al. Infection in permanent circulatory support: experience from the REMATCH trial. J Heart Lung Transplant 2004; 23: 1359 - 65.
194. Myers TJ, Khan T, Frazier OH. Infectious complications associated with ventricular assist systems. ASAIO J 2000; 46: S28 - 36.
195. Pasque MK, Hanselman T, Shelton K, et al. Surgical management of Novacor drive-line exit site infections. Ann Thorac Surg 2002; 74: 1267 - 8.
196. Zierer A, Melby SJ, Voeller RK, et al. Late-onset driveline infections: the Achilles' heel of prolonged left ventricular assist device support. Ann Thorac Surg 2007; 84: 515 - 20.
197. Chinn R, Dembitsky W, Eaton L, et al. Multicenter experience: prevention and management of left ventricular assist device infections. ASAIO J 2005; 51: 461 - 70.
198. Garatti A, Giuseppe B, Russo CF, Marco O, Ettore V. Drive-line exitsite infection in a patient with axial-flow pump support: successful management using vacuum-assisted therapy. J Heart Lung Transplant 2007; 26: 956 - 9.
199. Hravnak M, George E, Kormos RL. Management of chronic left ventricular assist device percutaneous lead insertion sites. J Heart Lung Transplant 1993; 12: 856 - 63.
200. Makdisi G, Jan MY, Dungy-Poythress L, Wang IW, Caccamo MA. Successful Delivery in a Patient With Left Ventricular Assist Device and Unplanned Pregnancy. Ann Thorac Surg. 2017 Jul; 104(1): e31 - e33. doi: 10.1016/j.athoracsur.2017.01.071. PMID: 28633256.
201. Westcott JM, Yaghoubian Y, Williams MR, Roman AS, Hughes F, Rosner M. Prophylactic percutaneous left ventricular assist device in pregnancy. Obstetric Medicine. 2019; 12(3): 151 - 152.
202. Desai, N, Chaudhry, K, Aji, J. Impella left ventricular assist device in cardiac arrest after spinal anaesthesia for caesarean section. BMJ Case Rep 2015. DOI: 10.1136/bcr-2015-211958.
203. Seyed Hamed Hosseini Dehkordi et al. Successful pregnancy and delivery with centrifugal flow left ventricular assist device. J Am Coll Cardiol. 2020 Mar, 75.
204. A.K. Johnson et al. Substance Abuse and Left Ventricular Assist Device Outcomes: Does a History and Type of Use Matter?. The Journal of Heart and Lung Transplantation. Abstract. Volume 34, Issue 4, Supplement, S191 - 192, april 01, 2015.
205. Holmes EC. Outpatient management of long-term assist devices. Cardiol Clin 2003; 21: 93 - 9.
206. Wilson SR, Givertz MM, Stewart GC, Mudge GH Jr. Ventricular assist devices: the challenges of outpatient management. J Am Coll Cardiol 2009; 54: 1647 - 59.
207. Morgan JA, Edwards NM. Orthotopic cardiac transplantation: comparison of outcome using biatrial, bicaval, and total techniques. J Card Surg. 2005; 20: 102 - 106.
208. Трансплантация сердца. Руководство для врачей /Под ред. С.В. Готье, В.Н. Попцова, А.О. Шевченко. - М. - Тверь: ООО "Издательство "Триада". - 2014.
209. Chen EP, Bittner HB, Davis RD, Van TP. Hemodynamic and inotropic effects of milrinone after heart transplantation in the setting of recipient pulmonary hypertension. J Heart Lung Transplant 1998; 17: 669 - 78.
210. Leyh RG, Kofidis T, Struber M, et al. Methylene blue: the drug of choice for catecholamine-refractory vasoplegia after cardiopulmonary bypass? J Thorac Cardiovasc Surg 2003; 125: 1426 - 31.
211. Argenziano M, Choudhri AF, Oz MC, et al. A prospective randomized trial of arginine vasopressin in the treatment of vasodilatory shock after left ventricular assist device placement. Circulation 1997; 96(9 suppl): II-90.
212. Morales DL, Garrido MJ, Madigan JD, et al. A double-blind randomized trial: prophylactic vasopressin reduces hypotension after cardio-pulmonary bypass. Ann Thorac Surg 2003; 75: 926 - 30.
213. Armitage JM, Hardesty RL, Griffith BP. Prostaglandin E1: an effective treatment of right heart failure after orthotopic heart transplantation. J Heart Transplant 1987; 6: 348 - 51.
214. Pascual JM, Fiorelli AI, Bellotti GM, Stolf NA, Jatene AD. Prostacyclin in the management of pulmonary hypertension after heart transplantation. J Heart Transplant 1990; 9: 644 - 51.
215. Theodoraki K, Tsiapras D, Tsourelis L, et al. Inhaled iloprost in eight heart transplant recipients presenting with post-bypass acute right ventricular dysfunction. Acta Anaesthesiol Scand 2006; 50: 1213 - 7.
216. J. Patel, M. Kittleson, L. Czer, T. Aintablian, R. Sharoff, G. Rodriguez, B. Kearney, N. Perry, A. Hage, F. Esmailian, J.A. Kobashigawa. Severity of Hypertension After Heart Transplant: Does It Impact Outcome?. The Journal of Heart and Lung Transplantation. April 2016. doi: 10.1016/j.healun.2016.01.840.
217. Tanveer A. Khan MD et. al. A prospective, randomized, crossover pilot study of inhaled nitric oxide versus inhaled prostacyclin in heart transplant and lung transplant recipients. The Journal of Thoracic and Cardiovascular Surgery. Volume 138, Issue 6, December 2009, Pages 1417 - 1424. doi: 10.1016/j.jtcvs.2009.04.063.
218. R.K. Singh et al. The Use of Oral Sildenafil for Management of Right Ventricular Dysfunction After Pediatric Heart Transplantation. American Journal of Transplantation 2014; 14: 453 - 458.
219. Kirklin JK, Young JB, McGiffin DC. Heart transplantation. Philadelphia: Churchill Livingstone, 2002.
220. Bauer J, Dapper F, Demirakca S, et al. Perioperative management of pulmonary hypertension after heart transplantation in childhood. J Heart Lung Transplant 1997; 16: 1238 - 47
221. Addonizio LJ, Gersony WM, Robbins RC, et al. Elevated pulmonary vascular resistance and cardiac transplantation. Circulation 1987; 76: V52 - 5.
222. Gao SZ, Hunt SA, Wiederhold V, Schroeder JS. Characteristics of serial electrocardiograms in heart transplant recipients. Am Heart J 1991; 122: 771 - 4.
223. Holt ND, McComb JM. Cardiac transplantation and pacemakers: when and what to implant. Card Electrophysiol Rev 2002; 6: 140 - 51.
224. Vaseghi M, Boyle NG, Kedia R, et al. Supraventricular tachycardia after orthotopic cardiac transplantation. J Am Coll Cardiol 2008; 51: 2241 - 9.
225. Kemkes BM, Schutz A, Engelhardt M, Brandl U, Breuer M. Noninvasive methods of rejection diagnosis after heart transplantation. J HeartLungTransplant 1992; 11: S221 - 31.
226. Keteyian S, Shepard R, Ehrman J, et al. Cardiovascular responses of heart transplant patients to exercise training. J ApplPhysiol 1991; 70: 2627 - 31.
227. Kobashigawa JA, Leaf DA, Lee N, et al. A controlled trial of exercise rehabilitation after heart transplantation. N Engl J Med 1999; 340: 272 - 7.
228. Kavanagh T, Yacoub MH, Kennedy J, Austin PC. Return to work after heart transplantation: 12-year follow-up. J HeartLungTransplant 1999; 18: 846 - 51.
229. Paris W, Woodbury A, Thompson S, et al. Social rehabilitation and return to work after cardiac transplantation-a multicenter survey. Transplantation 1992; 53: 433 - 8.
230. Mc Cartney S.L., Patel C., Del Rio J.M. Long-term outcomes and management of the heart transplant recipient. Best Pract Res Clin Anaesthesiol. 2017; 31(2): 237 - 248. doi: 10.1016/j.bpa.2017.06.003.
231. Lindenfeld J, Miller GG, Shakar SF, Zolty R, Lowes BD, Wolfel EE, Mestroni L, Page RL 2nd, Kobashigawa J. Drug therapy in the heart transplant recipient: part I: cardiac rejection and immunosuppressive drugs. Circulation. 2004 Dec 14; 110(24): 3734 - 40. doi: 10.1161/01.CIR.0000149745.83186.89.
232. Tsunoda SM, Aweeka FT. Drug concentration monitoring of immunosuppressive agents: focus on tacrolimus, mycophenolate mofetil and sirolimus. BioDrugs 2000; 14: 355 - 69.
233. Hyunyoung Jeong, Bruce Kaplan. Therapeutic Monitoring of Mycophenolate Mofetil. CJASN Jan 2007, 2 (1) 184 - 191; DOI: 10.2215/CJN.02860806.
234. Kaczmarek I. et al. Tacrolimus with mycophenolate mofetil or sirolimus compared with calcineurin inhibitor-free immunosuppression (sirolimus/mycophenolate mofetil) after heart transplantation: 5-year results. The Journal of Heart and Lung Transplantation. Volume 32, issue 3, p277 - 284, march 01, 2013.
235. Baran DA, Zucker MJ, Arroyo LH, et al. Randomized trial of tacrolimus monotherapy: tacrolimus in combination, tacrolimus alone compared (the TICTAC trial). J Heart Lung Transplant 2007; 26: 992 - 7.
236. Murphy J, Frantz R, Cooper L. Endomyocardial biopsy. In: Murphy J, Lloyd M, editors. Mayo Clinic Cardiology Concise Textbook. Minnesota: Rochester; 2007. p. 1481.
237. Strecker T et al. Endomyocardial biopsy for monitoring heart transplant patients: 11-years-experience at a german heart center. Int J Clin Exp Pathol. 2013; 6(1): 55 - 65
238. Murray H. Kwon, Richard J. Shemin; Tricuspid valve regurgitation after heart transplantation; Ann Cardiothorac Surg. 2017 May; 6(3): 270 - 274.
239. Briasoulis A, Inampudi C, Pala M, Asleh R, Alvarez P, Bhama J. Induction immunosuppressive therapy in cardiac transplantation: a systematic review and meta-analysis. Heart Fail Rev. 2018 Sep; 23(5): 641 - 649. doi: 10.1007/s10741-018-9691-2.
240. Daniel Marelli, MD, Fardad Esmailian, MD, Fardad Esmailian, MD, Samantha Y. Wong, BS, Jon A. Kobashigawa, MD, Murray H. Kwon, MD, Ramin E. Beygui, MD, Hillel Laks, MD, Mark D. Plunkett, MD, Abbas Ardehali, MD, Richard J. Shemin, MD; Tricuspid valve regurgitation after heart transplantation; The Journal of Thoracic and Cardiovascular Surgery; June 2009 Volume 137, Issue 6, Pages 1557 - 1559.
241. Koloskova N.N., Poptsov V.N., Shevchenko A.O. The inpidual tailoring of immunosuppressive therapy after heart transplantation. Vestnik transplantologii i iskusstvennyh organov 2018; (926): 127 - 137. DOI: 10.15825/1995-1191-2018-1-127-137.
242. Zuckermann A, Schulz U, Deuse T, Ruhpawar A et al. Thymoglobulin induction in heart transplantation: patient selection and implications for maintenance immunosuppression. Transpl. Int. 2015 Mar; 28 (3): 259 - 269.
243. Schweiger M. Immunosuppressive Therapy After Cardiac Transplantation. Medical University Graz, Department for Surgery, Division for Transplantation Surgery, Austria. 4 - 5.
244. Lars H Lund, Leah B Edwards, Anna Y Kucheryavaya et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-second Official Adult Heart Transplantation Report-2015; Focus Theme: Early Graft Failure. The Journal of Heart and Lung Transplantation. 2015; 34 (10): 1245 - 1253.
245. Taylor DO, Bristow MR, O'Connell JB, Price GD, Hammond EH, Doty DB, Karwande SV, Gay WA Jr, Jones KW, Lappe D, Renlund DG. Improved long-term survival after heart transplantation predicted by successful early withdrawal from maintenance corticosteroid therapy. J Heart Lung Transplant. 1996; 15: 1039 - 1046.
246. Kobashigawa JA, Stevenson LW, Brownfield ED, Gleeson MP, Moriguchi JD, Kawata N, Minkley R, Drinkwater DC, Laks H. Corticosteroid weaning late after heart transplantation: relation to HLA-DR mismatching and long-term metabolic benefits. J Heart Lung Transplant. 1995; 14: 963 - 967
247. Grimm M, Rinaldi M, Yonan NA, et al. Superior prevention of acute rejection by tacrolimus vs. cyclosporine in heart transplant recipients-a large European trial. Am J Transplant 2006; 6:1387.
248. Groetzner J, Meiser BM, Schirmer J, et al. Tacrolimus or cyclosporine for immunosuppression after cardiac transplantation: which treatment reveals more side effects during long-term follow-up? Transplant Proc 2001; 33: 1461.
249. Lindenfeld J, Miller GG, Shakar SF, et al. Drug therapy in the heart transplant recipient: part II: immunosuppressive drugs. Circulation 2004; 110: 3858 - 65.
250. Meiser BM, Uberfuhr P, Fuchs A, et al. Single-center randomized trial comparing tacrolimus (FK506) and cyclosporine in the prevention of acute myocardial rejection. J Heart Lung Transplant 1998; 17: 782.
251. Rinaldi M, Pellegrini C, Martinelli L, et al. FK506 effectiveness in reducing acute rejection after heart transplantation: a prospective randomized study. J Heart Lung Transplant 1997; 16: 1001.
252. Reichart B, Meiser B, Vigano M., et al. European Multicenter Tacrolimus (FK506) Heart Pilot Study: one-year results-European Tacrolimus Multicenter Heart Study Group. J Heart Lung Transplant 1998; 17: 775.
253. Taylor DO, Barr ML, Radovancevic B, et al. A randomized, multicenter comparison of tacrolimus and cyclosporine immunosuppressive regimens in cardiac transplantation: decreased hyperlipidemia and hypertension with tacrolimus. J Heart Lung Transplant 1999; 18: 336.
254. Kobashigawa JA, Miller LW, Russell SD, et al. Tacrolimus with mycophenolate mofetil (MMF) or sirolimus vs. cyclosporine with MMF in cardiac transplant patients: 1-year report. Am J Transplant 2006; 6: 1377 - 86.
255. Eisen HJ, Tuzcu EM, Dorent R, et al. Everolimus for the prevention of allograft rejection and vasculopathy in cardiac-transplant recipients. N Engl J Med 2003; 349: 847 - 58.
256. Halloran PF, Gourishankar S. Principles and overview of immunosuppression. In: Norman DJ, Laurel NJ, editors. Primer on transplantation. Mt Laurel, NJ: American Society of Transplantation; 2001. p. 87 - 98.
257. Baran DA, Zucker MJ, Arroyo LH, et al. Randomized trial of tacrolimus monotherapy: tacrolimus in combination, tacrolimus alone com-pared (the TICTAC trial). J Heart Lung Transplant 2007; 26: 992 - 7.
258. Keogh A, Richardson M, Ruygrok P, et al. Sirolimus in de novo heart transplant recipients reduces acute rejection and prevents coronary artery disease at 2 years: a randomized clinical trial. Circulation 2004; 110: 2694 - 700.
259. Lehmkuhl H, Livi U, Arizon J, et al. Results of a 12-month, multicenter, randomized trial of everolimus with reduced-exposure cyclosporine versus mycophenolate mofetil and standard exposure cyclosporine in de novo cardiac transplantation recipients. J Heart Lung Transplant 2008; 27(2S): S65.
260. Raichlin E, Khalpey Z, Kremers W, et al. Replacement of calcineurin-inhibitors with sirolimus as primary immunosuppression in stable cardiac transplant recipients. Transplantation 2007; 84: 467 - 74.
261. Groetzner J, Meiser B, Landwehr P, et al. Mycophenolate mofetil and sirolimus as calcineurin inhibitor-free immunosuppression for late cardiac-transplant recipients with chronic renal failure. Transplantation 2004; 77: 568 - 74.
262. Stenton SB, Partovi N, Ensom MH. Sirolimus: the evidence for clinical pharmacokinetic monitoring. Clin Pharmacokinet 2005; 44: 769 - 86.
263. Brandhorst G, Tenderich G, Zittermann A, et al. Everolimus exposure in cardiac transplant recipients is influenced by concomitant calcineurin inhibitor. Ther Drug Monit 2008; 30: 113 - 6.
264. Kopp JB, Klotman PE. Cellular and molecular mechanisms of cyclosporin nephrotoxicity. J Am Soc Nephrol 1990; 1: 162 - 79.
265. Mahle WT, Vincent RN, Berg AM, Kanter KR. Pravastatin therapy is associated with reduction in coronary allograft vasculopathy in pediatric heart transplantation. J Heart Lung Transplant 2005; 24: 63 - 6.
266. Mehra MR, Uber PA, Vivekananthan K, et al. Comparative beneficial effects of simvastatin and pravastatin on cardiac allograft rejection and survival. J Am Coll Cardiol 2002; 40: 1609 - 14.
267. Kobashigawa JA, Moriguchi JD, Laks H, et al. Ten-year follow-up of a randomized trial of pravastatin in heart transplant patients. J Heart Lung Transplant 2005; 24: 1736 - 40.
268. Chin C, Lukito SS, Shek J, Bernstein D, Perry SB. Prevention of pediatric graft coronary artery disease: atorvastatin. Pediatr Transplant 2008; 12: 442 - 6.
269. Муминов И.И., Шевченко А.О. Клиническая эффективность и безопасность ингибиторов ГМГ-КоА-редуктазы у реципиентов трансплантированного сердца Трансплантология: итоги и перспективы. Том VIII. 2016 год Под ред. С.В. Готье. - М. - Тверь: ООО "Издательство "Триада", 2017. - 368 с.
270. Шевченко А.О., Халилулин Т.А., Шевченко О.П. Механизмы нелипидного действия статинов у реципиентов сердца. Вестн. транспл. и искусств. орг. 2013; 2: 142 - 147.
271. Gazi I., Liberopoulos E., Athyros V. et al. Statins and solid organ transplantation // Curr. Pharm. Des. - 2006; 12: 4771 - 83.
272. Hedman M, Neuvonen PJ, Neuvonen M, Holmberg C, Antikainen M. Pharmacokinetics and pharmacodynamics of pravastatin in pediatric and adolescent cardiac transplant recipients on a regimen of triple immunosuppression. Clin Pharmacol Ther 2004; 75: 101 - 9.
273. Mahle WT, Vincent RN, Berg AM, Kanter KR. Pravastatin therapy is associated with reduction in coronary allograft vasculopathy in pediatric heart transplantation. J Heart Lung Transplant 2005; 24: 63 - 6.
274. Chin C, Lukito SS, Shek J, Bernstein D, Perry SB. Prevention of pediatric graft coronary artery disease: atorvastatin. Pediatr Transplant 2008; 12: 442 - 6.
275. Heublein B, Wahlers T, Haverich A. Pulsed steroids for treatment of cardiac rejection after transplantation. What dosage is necessary? Circulation1989; 80: III97 - 9.
276. Lonquist JL, Radovancevic B, Vega JD, et al. Reevaluation of steroid tapering after steroid pulse therapy for heart rejection. J Heart Lung Transplant 1992; 11: 913 - 9.
277. Haverty TP, Sanders M, Sheahan M. OKT3 treatment of cardiac allograft rejection. J Heart Lung Transplant 1993; 12: 591 - 8.
278. Crow S. et al. Efficacy and Safety of Anti-thymocyte Globulin for the Treatment of Acute Cellular Rejection in Orthotopic Heart Transplant. Journal of Cardiac Failure. 2015; 21 (8): S117 - S118
279. Onsager DR, Canver CC, Jahania MS, et al. Efficacy of tacrolimus in the treatment of refractory rejection in heart and lung transplant recipients. J Heart Lung Transplant 1999; 18: 448 - 55.
280. Chan MC, Kwok BW, Shiba N, et al. Conversion of cyclosporine to tacrolimus for refractory or persistent myocardial rejection. Transplant Proc 2002; 34: 1850 - 2.
281. Hutter JA, Wallwork J, English TA. Management of rejection in heart transplant recipients: does moderate rejection always require treatment? J Heart Transplant. 1990; 9(2): 87 - 91
282. Carrier M. Noninvasive assessment of cardiac transplant rejection. A critical look at the approach to acute rejection. 1991 Dec; 34(6): 569 - 72
283. Keogh AM, Arnold RH, Macdonald PS, et al. A randomized trial of tacrolimus (FK506) versus total lymphoid irradiation for the control of repetitive rejection after cardiac transplantation. J Heart Lung Transplant 2001; 20: 1331 - 4.
284. Ibrahim M, Hendry P, Masters R, et al. Management of acute severe perioperative failure of cardiac allografts: a single-centre experience with a review of the literature. Can J Cardiol 2007; 23: 363 - 7.
285. Takemoto SK, Zeevi A, Feng S, et al. National conference to assess antibody-mediated rejection in solid organ transplantation. Am J Transplant 2004; 4: 1033 - 41.
286. Grauhan O, Knosalla C, Ewert R, et al. Plasmapheresis and cyclophosphamide in the treatment of humoral rejection after heart transplantation. J Heart Lung Transplant 2001; 20: 316 - 21.
287. Kaczmarek I, Deutsch MA, Sadoni S, et al. Successful management of antibody-mediated cardiac allograft rejection with combined immunoadsorption and anti-CD20 monoclonal antibody treatment: case report and literature review. J Heart Lung Transplant 2007; 26: 511 - 5.
288. Garrett HE Jr, Duvall-Seaman D, Helsley B, Groshart K. Treatment of vascular rejection with rituximab in cardiac transplantation. J Heart Lung Transplant 2005; 24: 1337 - 42.
289. Rose ML, Smith J, Dureau G, Keogh A, Kobashigowa J. Mycophenolate mofetil decreases antibody production after cardiac transplantation. J Heart Lung Transplant 2002; 21: 282 - 5.
290. Itescu S, Burke E, Lietz K, et al. Intravenous pulse administration of cyclophosphamide is an effective and safe treatment for sensitized cardiac allograft recipients. Circulation 2002; 105: 1214 - 9.
291. Leech SH, Lopez-Cepero M, LeFor WM, et al. Management of the sensitized cardiac recipient: the use of plasmapheresis and intravenous immunoglobulin. Clin Transplant 2006; 20: 476 - 84.
292. Kfoury AG, Hammond ME, Snow GL, et al. Early screening for antibody-mediated rejection in heart transplant recipients. J Heart Lung Transplant 2007; 26: 1264 - 9.
293. Michaels PJ, Espejo ML, Kobashigawa J, et al. Humoral rejection in cardiac transplantation: risk factors, hemodynamic consequences and relationship to transplant coronary artery disease. J Heart Lung Transplant 2003; 22: 58 - 69.
294. Miller LW, Wesp A, Jennison SH, et al. Vascular rejection in heart transplant recipients. J Heart Lung Transplant 1993; 12: S147 - 52.
295. Brunner-La Rocca HP, Schneider J, Kunzli A, Turina M, Kiowski W. Cardiac allograft rejection late after transplantation is a risk factor for graft coronary artery disease. Transplantation 1998; 65: 538 - 43.
296. Klingenberg R, Koch A, Schnabel PA, et al. Allograft rejection of ISHLT grade #/#3A occurring late after heart transplantation-a distinct entity? J Heart Lung Transplant 2003; 22: 1005 - 13.
297. The task force for the diagnosis and treatment of chronic heart failure of the European Society of Cardiologie. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005). Eur Heart J 2005; 26: 1115 - 40
298. Krum H, Roecker EB, Mohacsi P, et al. Effects of Initiating Carvedilol in Patients With Severe Chronic Heart Failure: Results From the COPERNICUS Study. JAMA. 2003; 289(6): 712 - 718. doi: 10.1001/jama.289.6.712.
299. Amedeo Chiribiri, MD et al. Long-term Follow-up of Patients Eligible, Deferred, or Ineligible for Heart Transplantation. Clinical heart transplantation; volume 27, issue 4, p380 - 386, april 01, 2008. doi: 10.1016/j.healun.2008.01.011.
300. Mancini D, Pinney S, Burkhoff D, et al. Use of rapamycin slows progression of cardiac transplantation vasculopathy. Circulation 2003; 108: 48 - 53.
301. Kahan BD, Julian BA, Pescovitz MD, Vanrenterghem Y, Neylan J. Sirolimus reduces the incidence of acute rejection episodes despite lower cyclosporine doses in caucasian recipients of mismatched primary renal allografts: a phase II trial. Rapamune Study Group. Transplantation. 1999 Nov 27; 68(10): 1526 - 32. doi: 10.1097/00007890-199911270-00016.
302. Sheila A Doggrell. Is everolimus useful in preventing allograft rejection and vasculopathy after heart transplant?. J. Expert opinion on investigational drugs. Volume 13, 2004 - Issue 2.
303. Kobashigawa JA, Tobis JM, Mentzer RM, et al. Mycophenolate mofetil reduces intimal thickness by intravascular ultrasound after heart transplant: reanalysis of the multicenter trial. Am J Transplant 2006; 6: 993 - 7.
304. Kapadia SR, Nissen SE, Ziada KM, et al. Development of transplantation vasculopathy and progression of donor-transmitted atheroscle rosis: comparison by serial intravascular ultrasound imaging. Circulation 1998; 98: 2672 - 8.
305. Johl M et al. Use of the Annual Angiogram After Heart Transplantation: Are They All Necessary? Circulation. 2017; 136: A18380
306. Kobashigawa JA, Tobis JM, Starling RC, et al. Multicenter intravascular ultrasound validation study among heart transplant recipients: outcomes after five years. J Am Coll Cardiol 2005; 45: 1532 - 7.
307. Nicolas RT, Kort HW, Balzer DT, et al. Surveillance for transplant coronary artery disease in infant, child and adolescent heart transplant recipients: an intravascular ultrasound study. J Heart Lung Transplant 2006; 25: 921 - 7.
308. Kuhn MA, Jutzy KR, Deming DD, et al. The medium-term findings in coronary arteries by intravascular ultrasound in infants and children after heart transplantation. J Am Coll Cardiol 2000; 36: 250 - 4.
309. Farzaneh-Far A. Electron-beam computed tomography in the assessment of coronary artery disease after heart transplantation. Circulation 2001; 103: E60.
310. Pichler P, Loewe C, Roedler S, et al. Detection of high-grade stenoses with multislice computed tomography in heart transplant patients. J Heart Lung Transplant 2008; 27: 310 - 6.
311. Elkaryoni A et al Diagnostic accuracy of dobutamine stress echocardiography in the detection of cardiac allograft vasculopathy in heart transplant recipients: A systematic review and meta-analysis study. Echocardiography. 2019; 36(3): 528 - 536. doi: 10.1111/echo.14268.
312. Hacker M, Hoyer HX, Uebleis C, et al. Quantitative assessment of cardiac allograft vasculopathy by real-time myocardial contrast echo-cardiography: a comparison with conventional echocardiographic analyses and [Tc99m]-sestamibi SPECT. Eur J Echocardiogr 2008; 9: 494 - 500.
313. Sakamoto T, Yamada T. Hemodynamic effects of dobutamine in patients following open heart surgery. Circulation. 1977. 1977; 55: 525 - 533
314. Mehra MR. Contemporary concepts in prevention and treatment of cardiac allograft vasculopathy. Am J Transplant 2006; 6: 1248 - 56.
315. Botha P, Peaston R, White K, et al. Smoking after cardiac transplantation. Am J Transplant 2008; 8: 866 - 71.
316. McDonald K, Rector TS, Braulin EA, Kubo SH, Olivari MT. Association of coronary artery disease in cardiac transplant recipients with cytomegalovirus infection. Am J Cardiol 1989; 64: 359 - 62.
317. Simmonds J, Fenton M, Dewar C, et al. Endothelial dysfunction and cytomegalovirus replication in pediatric heart transplantation. Circulation 2008; 117: 2657 - 61.
318. Hussain T, Burch M, Fenton MJ, et al. Positive pretransplantation cytomegalovirus serology is a risk factor for cardiac allograft vasculopathy in children. Circulation 2007; 115: 1798 - 1805.
319. Kato T, Chan MC, Gao SZ, et al. Glucose intolerance, as reflected by hemoglobin A1c level, is associated with the incidence and severity of transplant coronary artery disease. J Am Coll Cardiol 2004; 43: 1034 - 41.954
320. Schroeder JS, Gao SZ, Alderman EL, et al. A preliminary study of diltiazem in the prevention of coronary artery disease in heart-transplant recipients. N Engl J Med 1993; 328: 164 - 70.
321. Erinc K, Yamani MH, Starling RC, et al. The effect of combined Angiotensin-converting enzyme inhibition and calcium antagonism on allograft coronary vasculopathy validated by intravascular ultra-sound. J Heart Lung Transplant 2005; 24: 1033 - 8.
322. Halle AA, III, DiSciascio G, Massin EK, et al. Coronary angioplasty, atherectomy and bypass surgery in cardiac transplant recipients. J Am Coll Cardiol 1995; 26: 120 - 8.
323. Aqel RA, Wells BJ, Hage FG, et al. Re-stenosis after drug-eluting stents in cardiac allograft vasculopathy. J Heart Lung Transplant 2008; 27: 610 - 5.
324. Radovancevic B, McGiffin DC, Kobashigawa JA, et al. Retransplantation in 7,290 primary transplant patients: a 10-year multi-institutional study. J Heart Lung Transplant 2003; 22: 862 - 8.
325. Farzaneh-Far A. Electron-beam computed tomography in the assessment of coronary artery disease after heart transplantation. Circulation 2001; 103: E60.
326. Cardiac retransplantation is an efficacious therapy for primary cardiac allograft failure / P. Atluri, W. Hiesinger, R.C. Gorman et al. // J. Cardiothoracic Surg. - 2008. - 7. - P. 3 - 26. doi: 10.1186/1749-8090-3-26.
327. Retransplantation in 7290 primary transplant patients: a 10-year multi-institutional study / B. Radovancevic, D.C. McGiffin, J.A. Kobashigawa, et al. // J. Heart Lung Transplant. - 2003. - 22. - P. 862 - 8.
328. Ross retransplant and medical therapy for cardiac allograft vasculopathy: International Society for Heart and Lung Transplantation registry analysis /L.A. Goldraich, J. Stehlik, A.Y. Kucheryavaya, L.B. Edwardsand // American Journal of Transplantation. - 2016. - 16. - P. 301 - 309.
329. Heart retransplantation / M.R. Johnson, K.D. Aaronson, C.E. Canter et al. //Am J Transplant. - 2007. - 7. - P. 2075 - 81.
330. Андрющенко А.В., Арутюнов Г.П., Атьков О.Ю., Балахонова Т.В., Баранова Е.И., Большакова О.О., Васичкина Е.С., Васюк Ю.А., Галявич А.С., Гордеев М.Л., Готье С.В., Гудкова А.Я., Гурщенков А.В., Демин А.А., Демченко Е.А., Дземешкевич С.Л., Звартау Н.Э., Земцовский Э.В., Золотухин И.А., Карпов Р.С., Шевченко А.О. и др. КАРДИОЛОГИЯ. НАЦИОНАЛЬНОЕ РУКОВОДСТВО. Краткое издание / Москва, 2018. (2-е издание, переработанное и дополненное).
331. Шевченко А.О., Никитина Е.А., Тюняева И.Ю. Артериальная гипертония у реципиентов трансплантированного сердца. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N 2. С. 114 - 125.
332. Ambrosi P, Kreitmann B, Habib G. Does heart rate predict allograft vasculopathy in heart transplant recipients? Int. J. Cardiol. 2010; 145: 256 - 257.
333. Lehoux S, Tedgui A. Signal transduction of mechanical stresses in the vascular wall. Hypertension. 1998; 32: 338 - 345.
334. Васюк Ю.А., Иванова С.В., Школьник Е.Л., Котовская Ю.В., Милягин В.А., Олейников В.Э., Орлова Я.А. и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016; 15 (2): 4 - 19. Vasyuk YuA, Ivanova SV, Shkol'nik EL, Kotovskaya YuV, Milyagin VA, Oleynikov VE, Orlova YaA i dr. Soglasovannoe mnenie rossiyskikh ekspertov po otsenke arterial'noy zhestkosti v klinicheskoy praktike. Kardiovaskulyarnaya terapiya i profilaktika. 2016; 15 (2): 4 - 19.
335. Shevchenko AO, Tunyaeva IU, Nasyrova AA. Common carotid artery wall rigidity index is a marker of cardiac allograft rejection. The Journal of Heart and Lung Transplantation. 2015; 4S: S298.
336. Nichols WW, Denardo SJ, Wilkinson IB, McEniery CM, Cockcroft J, O'Rourke MF. Effects of arterial stiffness, pulse wave velocity, and wave reflections on the central aortic pressure waveform. J. Clin. Hypertens. (Greenwich). 2008; 10 (4): 295 - 303.
337. Насырова А.А., Шевченко А.О. Функциональные показатели магистральных артерий и риск отторжения трансплантированного сердца. Трансплантация: итоги и перспективы. Том VII. 2015 год. Под ред. С.В. Готье. М.-Тверь: Триада, 2016: 331 - 350. Nasyrova AA, Shevchenko AO. Funktsional'nye pokazateli magistral'nykh arteriy i risk ottorzheniya transplantiro-vannogo serdtsa. Transplantatsiya: itogi i perspektivy. Tom VII. 2015 god. Pod red. S.V. Gautier. M.-Tver': Triada, 2016: 331 - 350.
338. Бойцов С.А. Изучение патогенеза гипертонической болезни продолжается. Терапевтический архив. 2006; 78 (9): 1 - 12. Boytsov SA. Izuchenie patogeneza gipertonicheskoy bolezni prodolzhaetsya. Terapevticheskiy arkhiv. 2006; 78 (9): 1 - 12.
339. Braith RW, Mills RM, Wilcox CS et al. Breakdown of blood pressure and body fluid homeostasis in heart transplant recipients. J. Am. Coll. Cardiol. 1996; 27: 375 - 383.
340. Braith RW, Mills RM, Wilcox CS et al. Fluid homeostasis after heart transplantation: the role of cardiac denervation. J. Heart Lung Transplant. 1996; 15: 872 - 880.
341. Braith RW, Mills RM, Wilcox CS et al. High dose angiotensin-converting enzyme inhibition prevents fluid volume expansion in heart transplant recipients. Journal of the American College of Cardiology. 2000; 36 (2): 487 - 492.
342. Zimmer RJ, Lee MS. Transplant Coronary Artery Disease. JACC: Cardiovascular Interventions. 2010; 3 (4): 367 - 377.
343. Borgese L, Potena L, Resciniti E et al. Influence of angiotensin-type1-receptor antibodies in chronic vascular injury on heart transplant patients. The Journal of Heart and Lung Transplantation. 2015; 34 (4): 99 - S100.
344. Canzanello VJ, Textar SC, Taler SJ et al: Late hypertension after liver transplantation: A comparison of cyclosporine and tacrolimus (FK 506). Liver Transpl Surg, 1998; 4: 328 - 34.
345. Можейко Н.П., Ильинский И.М., Миронков Б.Л., Попцов В.Н., Колоскова Н.Н., Шевченко А.О., Шевченко О.П. Острое клеточное отторжение в поздние сроки после трансплантации сердца. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 77.
346. Шевченко А.О., Тюняева И.Ю., Насырова А.А., Миронков Б.Л., Ильинский И.М., Можейко Н.П., Муминов И.И., Шевченко О.П. Отторжение сердечного трансплантата и неинвазивные показатели функционального состояния стенки общей сонной артерии. Вестник трансплантологии и искусственных органов. 2015. Т. 17. N 1. С. 5 - 11.
347. Саховский С.А., Изотов Д.А., Колоскова Н.Н., Муминов И.И., Ахмадзай Р.Л., Фараджов Р.А., Спирина Е.А., Попцов В.Н., Миронков Б.Л., Шевченко А.О. Ангиографическая оценка атеросклеротического поражения коронарных артерий сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2018. Т. 20. N 4. С. 22 - 29.
348. Попцов В.Н., Спирина Е.А., Ухренков С.Г., Мебония Н.З., Пчельников В.В., Масютин С.А., Воронков В.Ю., Алиев Э.З. Анестезия и интенсивная терапия при трансплантации сердца у возрастных реципиентов. Вестник трансплантологии и искусственных органов. 2016. Т. 18. N S. С. 29.
349. Шевченко А.О., Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Захаревич В.М., Шумаков Д.В. Тридцатилетняя динамика показателей выживаемости больных терминальной сердечной недостаточностью после трансплантации сердца по данным регистра ФНЦТИО им. ак. В.И. ШУМАКОВА. Евразийский кардиологический журнал. 2016. N 3. С. 171 - 172.
350. Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Захаревич В.М., Спирина Е.А. Научно-технологические и организационные решения по повышению эффективности и своевременности выполнения трансплантации сердца. Вестник трансплантологии и искусственных органов. 2014. Т. 16. N 3. С. 14 - 22.
351. Габриэлян Н.И., Савостьянова О.А., Горская Е.М., Батыршина Л.Р., Ромашкина Л.Ю., Попцов В.Н., Акимкин В.Г. Эпидемиологическая и микробиологическая характеристика послеоперационного периода у пациентов старшего возраста в кардиохирургии. Эпидемиология и вакцинопрофилактика. 2015. Т. 14. N 5 (84). С. 51 - 55.
352. Романова Н.И., Горская Е.М., Есенова Н.М., Захаревич В.М., Саитгареев Р.Ш., Габриэлян Н.И. Микрофлора внешней среды как угроза развития инфекционной патологии у пациентов после ортотопической трансплантации сердца. Медицинский алфавит. 2016. Т. 1. N 6 (269). С. 47 - 55.
353. Blasco LM, Parameshwar J, Vuylsteke A. Anaesthesia for noncardiac surgery in the heart transplant recipient. Curr Opin Anaesthesiol 2009; 22: 109 - 13.
354. Dobbels F, Van Damme-Lombaert R, Vanhaecke J, De GS. Growing pains: non-adherence with the immunosuppressive regimen in adolescent transplant recipients. Pediatr Transplant 2005; 9: 381 - 90.
355. Aqel RA, Wells BJ, Hage FG, et al. Restenosis after drug-eluting stents in cardiac allograft vasculopathy. J Heart Lung Transplant 2008; 27: 610 - 5.
356. Миронков Б.Л. Эндоваскулярные вмешательства у пациентов с трансплантированным сердцем. Вестник трансплантологии и искусственных органов. 2015. Т. 17. N 2. С. 77 - 79.
357. Миронков Б.Л., Честухин В.В., Тюняева И.Ю., Рядовой И.Г., Остроумов Е.Н., Шевченко А.О., Миронков А.Б., Кормер А.Я. Клиническая эффективность реваскуляризации миокарда при васкулопатии сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2014. Т. 16. N 4. С. 5 - 10.
358. Halle AA, III, DiSciascio G, Massin EK, et al. Coronary angioplasty, atherectomy and bypass surgery in cardiac transplant recipients. J Am Coll Cardiol 1995; 26: 120 - 8.
359. Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Шумаков Д.В., Захаревич В.М., Халилулин Т.А., Гольц А.М., Акопов Г.А., Закирьянов А.Р., Миронков Б.Л., Шевченко А.О., Можейко Н.П. Стратегия ретрансплантации сердца: результаты и проблемы. Вестник трансплантологии и искусственных органов. 2016. Т. 18. N S. С. 32.
360. Готье С.В., Попцов В.Н., Саитгареев Р.Ш., Захаревич В.М., Шевченко А.О., Акопов Г.А., Халилулин Т.А., Гольц А.М., Закирьянов А.Р., Колоскова Н.Н. Ретрансплантация сердца - единственный эффективный метод лечения терминальной дисфункции сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 63 - 64.
361. Paris W, Woodbury A, Thompson S, et al. Social rehabilitation and return to work after cardiac transplantation - a multicenter survey. Transplantation 1992; 53: 433 - 8.
362. Саитгареев Р.Ш., Захаревич В.М., Гольц А.М., Халилулин Т.А., Борисов Д.В. Ретрансплантация сердца. Вестник трансплантологии и искусственных органов. 2016. Т. 18. N 2. С. 142 - 151.
363. Keteyian S, Shepard R, Ehrman J, et al. Cardiovascular responses of heart transplant patients to exercise training. J Appl Physiol 1991; 70: 2627 - 31.
364. Kobashigawa JA, Leaf DA, Lee N, et al. A controlled trial of exercise rehabilitation after heart transplantation. N Engl J Med 1999; 340: 272 - 7.
365. Braith RW, Schofield RS, Hill JA, Casey DP, Pierce GL. Exercise training attenuates progressive decline in brachial artery reactivity in heart transplant recipients. J Heart Lung Transplant 2008; 27: 52 - 9.
366. Pierce GL, Schofield RS, Casey DP, et al. Effects of exercise training on forearm and calf vasodilation and proinflammatory markers in recent heart transplant recipients: a pilot study. Eur J Cardiovasc Prev Rehabil 2008; 15: 10 - 8.
367. Haykowsky M, Taylor D, Kim D, Tymchak W. Exercise training improves aerobic capacity and skeletal muscle function in heart transplant recipients. Am J Transplant 2009; 9: 734 - 9.
368. Braith RW, Magyari PM, Fulton MN, et al. Resistance exercise training and alendronate reverse glucocorticoid-induced osteoporosis in heart transplant recipients. J Heart Lung Transplant 2003; 22: 1082 - 90.
369. Braith RW, Welsch MA, Mills RM Jr, Keller JW, Pollock ML. Resistance exercise prevents glucocorticoid-induced myopathy in heart transplant recipients. Med Sci Sports Exerc 1998; 30: 483 - 9.
370. White-Williams C, Jalowiec A, Grady K. Who returns to work after heart transplantation? J Heart Lung Transplant 2005; 24: 2255 - 61.
371. Волкова О.В. Социальная реабилитация как направление социальной работы. Психолого-педагогический журнал Гаудеамус. 2006. Т. 2. N 10. С. 171 - 177.
372. Fusar-Poli P, Picchioni M, Martinelli V, et al. Anti-depressive therapies after heart transplantation. J Heart Lung Transplant 2006; 25: 785 - 93.
373. Dew MA, DiMartini AF, De Vito DA, et al. Rates and risk factors for nonadherence to the medical regimen after adult solid organ transplantation. Transplantation 2007; 83: 858 - 73.
374. Havik OE, Sivertsen B, Relbo A, et al. Depressive symptoms and all-cause mortality after heart transplantation. Transplantation 2007; 84: 97 - 103.
375. Lawrence K, Stilley CS, Olshansky E, Bender A, Webber SA. Further exploration: maturity and adherence in adolescent and young adult heart transplant recipients. Prog Transplant 2008; 18: 50 - 4.
376. De Bleser L, Matteson M, Dobbels F, Russell C, De GS. Interventions to improve medication-adherence after transplantation: a systematic review. Transpl Int 2009; 22: 780 - 97.
377. Wray J, Waters S, Radley-Smith R, Sensky T. Adherence in adolescents and young adults following heart or heart-lung transplantation. Pediatr Transplant 2006; 10: 694 - 700.
378. Coscia LA, Constantinescu S, Moritz MJ, et al. Report from the National Transplantation Pregnancy Registry (NTPR): outcomes of pregnancy after transplantation. Clin Transpl 2007; 29 - 42.
379. Sibanda N, Briggs JD, Davison JM, Johnson RJ, Rudge CJ. Pregnancy after organ transplantation: a report from the UK Transplant pregnancy registry. Transplantation 2007; 83: 1301 - 7.
380. Transfer of drugs and other chemicals into human milk. Pediatrics 2001; 108: 776 - 89.
381. Estes CM, Westhoff C. Contraception for the transplant patient. Semin Perinatol 2007; 31: 372 - 7.
382. Sucato GS, Murray PJ. Gynecologic health care for the adolescent solid organ transplant recipient. Pediatr Transplant 2005; 9: 346 - 56.
383. McKay DB, Josephson MA, Armenti VT, et al. Reproduction and transplantation: report on the AST Consensus Conference on Reproductive Issues and Transplantation. Am J Transplant 2005; 5: 1592 - 9.
384. Schofield RS, Edwards DG, Schuler BT, et al. Vascular effects of sildenafil in hypertensive cardiac transplant recipients. Am J Hypertens 2003; 16: 874 - 7.
385. Halinen MO, Jaussi A. Fatal road accidents caused by sudden death of the driver in Finland and Vaud, Switzerland. Eur Heart J 1994; 15: 888 - 94.
386. Ostrom M, Eriksson A. Natural death while driving. J Forensic Sci. 1987; 32: 988 - 98.
387. McFarland RA, Moore RC. Accidents and accident prevention. In Annual Review of Medicine Vol. 13. ed. Rystand DA, Creger WP. Palo Alto CA. Annual Reviews, Inc. 1962.
388. Petch MC. Task Force Report. Driving and heart disease. Eur Heart J. 1998; 19: 1165 - 1177.
389. Petch M, Irvine J. Cardiovascular disorders and vocational driving. The Practitioner. 1995; 239: 37 - 39.
390. Miles W. Driving issues related to arrhythmic syncope. Cardiol. Clinics. 1997; 15: 327 - 39.
391. Australasian Faculty of Occupational Medicine. Medical examinations of commercial vehicle drivers. National Road Transport Commission and the Federal Office of Road Safety. April 1997.
392. Cooper R, Cutler J, Desvigne-Nickens P, et al. Trend and disparities in coronary heart disease, stroke and other cardiovascular diseases in the United States: Findings of the National Conference on Cardiovascular Disease Prevention. Circulation. 2000; 102: 3137 - 47.
393. Cupples LA, Gaglon DR, Kannel WB. Long and short term risks of coronary death. Circulation. 1992; 85 (Supplement 1): 11 - 18.
394. Tsunoda SM, Aweeka FT. Drug concentration monitoring of immunosuppressive agents: focus on tacrolimus, mycophenolate mofetil and sirolimus. BioDrugs 2000; 14: 355 - 69.
395. Knight SR, Morris PJ. Does the evidence support the use of mycophenolate mofetil therapeutic drug monitoring in clinical practice? A systematic review. Transplantation 2008; 85: 1675 - 85.
396. Michaels PJ, Espejo ML, Kobashigawa J, et al. Humoral rejection in cardiac transplantation: risk factors, hemodynamic consequences and relationship to transplant coronary artery disease. J Heart Lung Transplant 2003; 22: 58 - 69.
397. Шевченко А.О. Гиполипидемическая терапия у реципиентов сердца: статины. Вестник трансплантологии и искусственных органов 2016; Том XVIII. - N 2. - С 171 - 176.
398. Randhawa P, Brennan DC. BK virus infection in transplant recipients: an overview and update. Am J Transplant 2006; 6: 2000 - 5.
399. Kubak BM, Gregson AL, Pegues DA, et al. Use of hearts transplanted from donors with severe sepsis and infectious deaths. J Heart Lung Transplant 2009; 28:260 - 5.
400. Crespo-Leiro MG, onso-Pulpon L, Vazquez de Prada JA, et al. Malignancy after heart transplantation: incidence, prognosis and risk factors. Am J Transplant 2008; 8: 1031 - 9.
401. O'Neill JO, Edwards LB, Taylor DO. Mycophenolate mofetil and risk of developing malignancy after orthotopic heart transplantation: analysis of the transplant registry of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2006; 25: 1186 - 91.
402. Valantine H. Is there a role for proliferation signal/mTOR inhibitors in the prevention and treatment of de novo malignancies after heart transplantation? Lessons learned from renal transplantation and oncology. J Heart Lung Transplant 2007; 26: 557 - 64.
403. Webber SA, Naftel DC, Fricker FJ, et al. Lymphoproliferative disorders after paediatric heart transplantation: a multi-institutional study. Lancet 2006; 367: 233 - 9.
404. Bloom RD, Doyle AM. Kidney disease after heart and lung transplantation. Am J Transplant 2006; 6: 671 - 9.
405. Wilkinson AH, Cohen DJ. Renal failure in the recipients of nonrenal solid organ transplants. J Am Soc Nephrol 1999; 10: 1136 - 44.
406. Ojo AO. Renal disease in recipients of nonrenal solid organ transplantation. Semin Nephrol 2007; 27: 498 - 507.
407. Поз Я.Л., Строков А.Г., Попцов В.Н., Копылова Ю.В., Крышин К.Н. Повреждение почек и заместительная почечная терапия у реципиента сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N 1. С. 52 - 56.
408. Raichin E, Kushwaha SS, Daly RC et al. Combined heart and kidney transplantation provides excellent survival and decreased risk of cellular rejection and coronary allograft vasculopathy. Transplant Proc. 2011; 43: 1871 - 1776.
409. Trachiotis GD, Vega JD, Jonhnston TS et al. Ten-year follow-up in patients with combined heart and kidney transplantation. J Thorac Cardiovasc Surg. 2003; 123: 2065 - 2071.
410. Gill J, Shah T, Hristea I et al. Outcomes of simultaneous heart-kidney transplant in the US: a retrospective analysis using OPTN/UNOS data. Am J Transplant. 2009; 9: 844 - 852.
411. Шевченко А.О., Никитина Е.А., Можейко Н.П., Тюняева И.Ю., Колоскова Н.Н. Распространенность и предикторы артериальной гипертонии у реципиентов сердца. Вестник трансплантологии и искусственных органов. 2017; Том XIX. - N 3. - С. 33 - 39.
412. Шевченко А.О., Тюняева И.Ю., Никитина Е.А., Орлов В.И. Назначение ингибиторов ангиотензинпревращающего фермента улучшает прогноз у реципиентов сердца с гипертрофией миокарда сердечного трансплантата. Вестник трансплантологии и искусственных органов. 2017 Т. XIX. - С. 85.
413. Калинина А.М., Бойцов С.А., Кушунина Д.В., Горный Б.Э., Дроздова Л.Ю., Егоров В.А. Артериальная гипертензия в реальной практике здравоохранения: что показывают результаты диспансеризации. Артериальная гипертензия. 2017. Т. 23. N 1. С. 6 - 16.
414. van de Beek D, Kremers W, Daly RC, et al. Effect of neurologic complications on outcome after heart transplant. Arch Neurol 2008; 65: 226 - 31.
415. Zierer A, Melby SJ, Voeller RK, et al. Significance of neurologic complications in the modern era of cardiac transplantation. Ann Thorac Surg 2007; 83: 1684 - 90.
416. Mayer TO, Biller J, O'Donnell J, Meschia JF, Sokol DK. Contrasting the neurologic complications of cardiac transplantation in adults and children. J Child Neurol 2002; 17: 195 - 9.
417. Marchetti P. New-onset diabetes after transplantation. J Heart Lung Transplant 2004; 23 (5 suppl): S194 - 201
418. Hathout EH, Chinnock RE, Johnston JK, et al. Pediatric posttransplant diabetes: data from a large cohort of pediatric heart-transplant recipients. Am J Transplant 2003; 3: 994 - 8.
419. Pham PT, Pham PC, Lipshutz GS, Wilkinson AH. New onset diabetes mellitus after solid organ transplantation. Endocrinol Metab Clin North Am 2007; 36: 873 - 90.
420. Leidig-Bruckner G, Hosch S, Dodidou P, et al. Frequency and predictors of osteoporotic fractures after cardiac or liver transplantation: a follow-up study. Lancet 2001; 357: 342 - 7.
421. Kapetanakis EI, Antonopoulos AS, Antoniou TA, et al. Effect of long-term calcitonin administration on steroid-induced osteoporosis after cardiac transplantation. J Heart Lung Transplant 2005; 24: 526 - 32.
422. Pisani B, Mullen GM. Prevention of osteoporosis in cardiac transplant recipients. Curr Opin Cardiol 2002; 17: 160 - 4.
423. Guo CY, Johnson A, Locke TJ, Eastell R. Mechanisms of bone loss after cardiac transplantation. Bone 1998; 22: 267 - 71.
424. Shane E, Addesso V, Namerow PB, et al. Alendronate versus calcitriol for the prevention of bone loss after cardiac transplantation. N Engl J Med 2004; 350: 767 - 76.
425. Braith RW, Magyari PM, Fulton MN, et al. Comparison of calcitonin versus calcitonin plus resistance exercise as prophylaxis for osteoporosis in heart transplant recipients. Transplantation 2006; 81: 1191 - 5.
426. Van Cleemput J, Daenen W, Geusens P, et al. Prevention of boneloss in cardiac transplant recipients. A comparison of biphosphonates and vitamin D. Transplantation 1996; 61: 1495 - 9.
427. Cohen A, Addesso V, McMahon DJ, et al. Discontinuing antiresorptive therapy one year after cardiac transplantation: effect on bone density and bone turnover. Transplantation 2006; 81: 686 - 91.
428. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2017 году X сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2018. Т. 20. N 2. С. 6 - 28.
429. Готье С.В. Инновации в трансплантологии: развитие программы трансплантации сердца в Российской Федерации. Патология кровообращения и кардиохирургия. 2017. Т. 21. N 3S. С. 61 - 68.
430. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2016 году IX сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N 2. С. 6 - 26.
431. Готье С.В., Хомяков С.М. Совершенствование нормативно-правовой базы в области донорства и трансплантации органов и тканей человека на уровне субъекта Российской Федерации. Вестник трансплантологии и искусственных органов. 2017. Т. 19. N S. С. 8 - 9.
432. Готье С.В., Шевченко А.О., Саитгареев Р.Ш., Захаревич В.М., Попцов В.Н., Зубкова Е.А., Донцов В.В. Сравнительный анализ краткосрочного и отдаленного прогноза выживаемости реципиентов трансплантированного сердца, оперированных в разные годы. Вестник трансплантологии и искусственных органов. 2016. Т. 18. N S. С. 26 - 27.
433. Lund LH et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report - 2016. The Journal of Heart and Lung Transplantation. 2016; 35 (10): 1158 - 1169.
434. Готье СВ, Шевченко АО, Попцов ВН. Пациент с трансплантированным сердцем (ISBN: 978-5-94789-648-0). М. -Тверь: Триада, 2014: 144. Gautier SV, Shevchenko AO, Poptsov VN. Patsient s transplantirovannym serdtsem (ISBN: 978-5-94789-648-0). M.-Tver: Triada, 2014: 144
435. Cousino MK, Miller VA, Smith C, Uzark K, Lowery R, Rottach N, Blume ED, Schumacher KR. Medical and end-of-life decision making in adolescents" pre-heart transplant: A descriptive pilot study. Palliat Med. 2020 Mar; 34(3): 272 - 280. doi: 10.1177/0269216319874689
436. Costanzo MR, Dipchand A, Starling R, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010; 29: 914.
437. Pollesello P, Parissis J, Kivikko M, Harjola VP. Levosimendan meta-analyses: is there a pattern in the effect on mortality? Int J Cardiol 2016; 209: 77 - 83
438. Landoni G, Mizzi A, Biondi-Zoccai G, et al. Reducing mortality in cardiac surgery with levosimendan: a meta-analysis of randomized controlled trials. J Cardiothorac Vasc Anesth 2010; 24: 51 - 57
439. Harrison RW, Hasselblad V, Mehta RH, Levin R, Harrington RA, Alexander JH. Effect of levosimendan on survival and adverse events after cardiac surgery: a meta-analysis. J Cardiothorac Vasc Anesth 2013; 27: 1224 - 1232
440. Mehta RH, Leimberger JD, van Diepen S, et al. Levosimendan in patients with left ventricular dysfunction undergoing cardiac surgery. N Engl J Med 2017; 376: 2032 - 2042
441. Landoni G, Lomivorotov VV, Alvaro G, et al. Levosimendan for hemodynamic support after cardiac surgery. N Engl J Med 2017; 376: 2021 - 2031
442. Papp Z, ![]() I, Fruhwald S, et al. Levosimendan: molecular mechanisms and clinical implications: consensus of experts on the mechanisms of action of levosimendan. Int J Cardiol 2012; 159: 82 - 87
I, Fruhwald S, et al. Levosimendan: molecular mechanisms and clinical implications: consensus of experts on the mechanisms of action of levosimendan. Int J Cardiol 2012; 159: 82 - 87
443. Zipfel S, Reiter B, Barten M, Rybczinski M, Schrage B, Westermann D, et al. Levosimendan effects benefit weaning from veno-arterial extracorporeal life support. J Heart Lung Transplant. 2018; 37: S383.
444. Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, Thiele H, et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. Cochrane Database Syst Rev. 2018; 1: CD009669.
445. Scheeren T.W.L. et al. Current use of inotropes in circulatory shock. Ann. Intensive Care. 2021; 11:21 https://doi.org/10.1186/s13613-021-00806-8
446. Bart Hiemstra, Geert Koster, ![]() Wetterslev, Christian Gluud, Janus C. Jakobsen, Thomas W. L. Scheeren, Frederik Keus, Iwan C. C. van der Horst. Dopamine in critically ill patients with cardiac dysfunction: A systematic review with meta-analysis and trial sequential analysis. Acta Anaesthesiologica Scandinavica. 2019; 63(4): 424 - 437.
Wetterslev, Christian Gluud, Janus C. Jakobsen, Thomas W. L. Scheeren, Frederik Keus, Iwan C. C. van der Horst. Dopamine in critically ill patients with cardiac dysfunction: A systematic review with meta-analysis and trial sequential analysis. Acta Anaesthesiologica Scandinavica. 2019; 63(4): 424 - 437.
447. De Backer D et al. Comparison of Dopamine and Norepinephrine in the Treatment of Shock. N Engl J Med 2010; 362: 779 - 789
448. Simsch O. et al. The intensive care management of patients following heart transplantation at the Deutsches Herzzentrum Berlin. Applied Cardiopulmonary Pathophysiology. 2011; 15: 230 - 240
449. Freeman R. et al. Cardiac Transplant Postoperative Management and Care. Critical Care Nursing Quarterly. 2016; 39(3): 214 - 226. doi: 10.1097/CNQ.0000000000000116
450. Higgins R, Kirklin JK, Brown RN, et al. To induce or not to induce: do patients at greatest risk for fatal rejection benefit from cytolytic induction therapy? J Heart Lung Transplant 2005; 24: 392.
451. Rosenberg PB, Vriesendorp AE, Drazner MH, et al. Induction therapy with basiliximab allows delayed initiation of cyclosporine and preserves renal function after cardiac transplantation. J Heart Lung Transplant. 2005; 24(9): 1327.
452. Yamani MH, Taylor DO, Czerr J, et al. Thymoglobulin induction and steroid avoidance in cardiac transplantation: results of a prospective, randomized, controlled study. Clin Transplant 2008; 22: 76.
453. Cantarovich M, Giannetti N, Barkun J, Cecere R. Antithymocyte globulin induction allows a prolonged delay in the initiation of cyclosporine in heart transplant patients with postoperative renal dysfunction. Transplantation 2004; 78: 779.
454. Anselm A., Cantarovich M., Davies R., et al. Prolonged basiliximab use as an alternative to calcineurin inhibition to allow renal recovery late after heart transplantation. J Heart Lung Transplant. 2008; 27: 1043 - 1045
455. Khush KK, Cherikh WS, Chambers DC, et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. J Heart Lung Transplant 2019; 38: 1056.
456. Hardinger KL, Rhee S, Buchanan P, et al. A prospective, randomized, double-blinded comparison of thymoglobulin versus Atgam for induction immunosuppressive therapy: 10-year results. Transplantation 2008; 86: 947.
457. Brennan DC, Flavin K, Lowell JA, et al. A randomized, double-blinded comparison of Thymoglobulin versus Atgam for induction immunosuppressive therapy in adult renal transplant recipients. Transplantation 1999; 67: 1011.
458. El-Hamamsy I, Stevens LM, Carrier M, et al. Incidence and prognosis of cancer following heart transplantation using RATG induction therapy. Transpl Int 2005; 18: 1280.
459. Carrier M, Leblanc MH, Perrault LP, et al. Basiliximab and rabbit anti-thymocyte globulin for prophylaxis of acute rejection after heart transplantation: a non-inferiority trial. J Heart Lung Transplant 2007; 26: 258.
460. Ansari D. et al. Comparison of Basiliximab and Anti-Thymocyte Globulin as Induction Therapy in Pediatric Heart Transplantation: A Survival Analysis. J Am Heart Assoc. 2016; 5: e002790. https://doi.org/10.1161/JAHA.115.002790
461. Ansari D., Lund L.H., Stehlik J., et al. Induction with anti-thymocyte globulin in heart transplantation is associated with better long-term survival compared with basiliximab. Journal of Heart and Lung Transplantation. 2015; 34 (10): 1283 - 1291.
462. Amin A.A., Araj F.G., Ariyamuthu, et al. Impact of induction immunosuppression on patient survival in heart transplant recipients treated with tacrolimus and mycophenolic acid in the current allocation era. Clinical Transplantation. 2019; 33 (8): e13651
463. Tzani A., Van den Eynde J., Doulamis I.P., et al. Impact of induction therapy on outcomes after heart transplantation. Clinical Transplantation. 2021; 35 (10): e14440
464. Mehra M.R., Zucker M.J., Wagoner L., et al. A multicenter, prospective, randomized, double-blind trial of basiliximab in heart transplantation. J Heart Lung Transplant. 2005; 24: 1297 - 1304
465. Chou N.K., Wang S.S., Chen Y.S., et al. Induction Immunosuppression With Basiliximab in Heart Transplantation. Transplantation Proceedings. 2008; 40 (8): 2623 - 2625.
466. Mattei M.F. et al. Lower risk of infectious deaths in cardiac transplant patients receiving basiliximab versus anti-thymocyte globulin as induction therapy. J Heart Lung Transplant. 2007; 26(7): 693 - 9. doi: 10.1016/j.healun.2007.05.002.
467. Kittipibul V., Tantrachoti P., Ongcharit P., et al. Low-dose basiliximab induction therapy in heart transplantation. Clinical Transplantation 2017; 31 (12): e13132
468. Briasoulis A., Inampudi C., Pala, M., et al. Induction immunosuppressive therapy in cardiac transplantation: a systematic review and meta-analysis. Heart Failure Reviews. 2018; 23 (5): 641 - 649.
469. Kobashigawa JA, Patel J, Furukawa H, et al. Five-year results of a randomized, single-center study of tacrolimus vs microemulsion cyclosporine in heart transplant patients. J Heart Lung Transplant 2006; 25: 434.
470. Kobashigawa J, Miller L, Renlund D, et al. A randomized active-controlled trial of mycophenolate mofetil in heart transplant recipients. Mycophenolate Mofetil Investigators. Transplantation 1998; 66: 507.
471. Kobashigawa JA, Renlund DG, Gerosa G, et al. Similar efficacy and safety of enteric-coated mycophenolate sodium (EC-MPS, myfortic) compared with mycophenolate mofetil (MMF) in de novo heart transplant recipients: results of a 12-month, single-blind, randomized, parallel-group, multicenter study. J Heart Lung Transplant 2006; 25: 935
472. Lehmkuhl H, Hummel M, Kobashigawa J, et al. Enteric-coated mycophenolate-sodium in heart transplantation: efficacy, safety, and pharmacokinetic compared with mycophenolate mofetil. Transplant Proc 2008; 40: 953.
473. Cohen DJ. Action, efficacy and toxicities: corticosteroids. In: Norman DJ, Turka LA, eds. Primer on Transplantation. Mt Laurel, NJ: American Society of Transplantation; 2001: 146 - 151.
474. Auphan N, DiDonato JA, Rosette C, Helmberg A, Karin M. Immunosuppression by glucocorticoids: inhibition of NF-kappa B activity through induction of I kappa B synthesis. Science. 1995; 270: 286 - 290.
475. Hosenpud JD, Norman DJ, Pantely GA. Low-dose oral prednisone in the treatment of acute cardiac allograft rejection not associated with hemodynamic compromise. J Heart Transplant. 1990; 9: 292 - 296
476. Kuppahally S, Al-Khaldi A, Weisshaar D, et al. Wound healing complications with de novo sirolimus versus mycophenolate mofetil-based regimen in cardiac transplant recipients. Am J Transplant 2006; 6: 986.
477.  F, de Prada JA, Exposito V, et al. Avoidance of calcineurin inhibitors with use of proliferation signal inhibitors in de novo heart transplantation with renal failure. J Heart Lung Transplant 2008; 27: 1135.
F, de Prada JA, Exposito V, et al. Avoidance of calcineurin inhibitors with use of proliferation signal inhibitors in de novo heart transplantation with renal failure. J Heart Lung Transplant 2008; 27: 1135.
478. Eisen HJ, Kobashigawa J, Starling RC, et al. Everolimus versus mycophenolate mofetil in heart transplantation: a randomized, multicenter trial. Am J Transplant 2013; 13: 1203.
479. Andreassen AK, Andersson B, Gustafsson F, et al. Everolimus initiation and early calcineurin inhibitor withdrawal in heart transplant recipients: a randomized trial. Am J Transplant 2014; 14: 1828.
480. Готье С.В., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2020 году XIII сообщение регистра Российского трансплантологического общества. Вестник трансплантологии и искусственных органов. 2021; 23(3): 8 - 34. https://doi.org/10.15825/1995-1191-2021-3-8-34
481. Ueyama H. et al. Maintenance immunosuppression in heart transplantation: insights from network meta-analysis of various immunosuppression regimens //Heart Failure Reviews. - 2020. - С. 1 - 9.
482. Castel M.A. et al. Primary immunosuppression and outcome differences after heart transplantation: tacrolimus versus cyclosporine //Transplantation proceedings. - Elsevier, 2011. - Т. 43. - N. 6. - С. 2244 - 2246.
483. Nassetta K. et al. A Systematic Review of Adherence to Immunosuppression among Pediatric Heart Transplant Patients //Journal of Cardiovascular Development and Disease. - 2022. - Т. 9. - N. 5. - С. 165.
484. Briasoulis A. et al. Induction immunosuppressive therapy in cardiac transplantation: a systematic review and meta-analysis //Heart Failure Reviews. - 2018. - Т. 23. - N. 5. - С. 641 - 649.
485. Segovia J. et al. A randomized multicenter comparison of basiliximab and muromonab (OKT3) in heart transplantation: SIMCOR study //Transplantation. - 2006. - Т. 81. - N. 11. - С. 1542 - 1548.
486. Ford K.A. et al. Initial data on basiliximab in critically ill children undergoing heart transplantation //The Journal of heart and lung transplantation. - 2005. - Т. 24. - N. 9. - С. 1284 - 1288.
487. Butts R.J. et al. Comparison of basiliximab vs antithymocyte globulin for induction in pediatric heart transplant recipients: an analysis of the International Society for Heart and Lung Transplantation database //Pediatric Transplantation. - 2018. - Т. 22. - N. 4. - С. e13190.
488. Dipchand A.I. et al. Mycophenolate mofetil in pediatric heart transplant recipients: a single-center experience //Pediatric transplantation. - 2001. - Т. 5. - N. 2. - С. 112 - 118.
489. Crowley K.L., Webber S. Immunosuppressive Agents in Pediatric Heart Transplantation //Handbook of Pediatric Cardiovascular Drugs. - Springer, London, 2014. - С. 329 - 363.
490.  G. et al. Long-term survivors of pediatric heart transplantation: a multicenter report of sixty-eight children who have survived longer than five years //The Journal of pediatrics. - 1997. - Т. 130. - N. 6. - С. 862 - 871.
G. et al. Long-term survivors of pediatric heart transplantation: a multicenter report of sixty-eight children who have survived longer than five years //The Journal of pediatrics. - 1997. - Т. 130. - N. 6. - С. 862 - 871.
491. Baraldo M., Gregoraci G., Livi U. Steroid-free and steroid withdrawal protocols in heart transplantation: the review of literature //Transplant International. - 2014. - Т. 27. - N. 6. - С. 515 - 529.
492. Backer C.L. et al. Intermediate term results of infant orthotopic cardiac transplantation from two centers //The Journal of Thoracic and Cardiovascular Surgery. - 1991. - Т. 101. - N. 5. - С. 826 - 832.
493. Rider A. K. et al. The status of cardiac transplantation, 1975 //Circulation. - 1975. - Т. 52. - N. 4. - С. 531 - 539.
494. Taylor D. O. et al. Improved long-term survival after heart transplantation predicted by successful early withdrawal from maintenance corticosteroid therapy //The Journal of heart and lung transplantation: the official publication of the International Society for Heart Transplantation. - 1996. - Т. 15. - N. 10. - С. 1039 - 1046.
495. Opelz G. et al. Long-term prospective study of steroid withdrawal in kidney and heart transplant recipients //American Journal of Transplantation. - 2005. - Т. 5. - N. 4. - С. 720 - 728.
496. Felkel T.O. et al. Survival and incidence of acute rejection in heart transplant recipients undergoing successful withdrawal from steroid therapy //The Journal of heart and lung transplantation. - 2002. - Т. 21. - N. 5. - С. 530 - 539.
497. Hunt J. et al. Improvement of renal dysfunction by conversion from calcineurin inhibitors to sirolimus after heart transplantation //The Journal of heart and lung transplantation. - 2005. - Т. 24. - N. 11. - С. 1863 - 1867.
498. Crowley K.L., Webber S. Immunosuppressive Agents in Pediatric Heart Transplantation //Handbook of Pediatric Cardiovascular Drugs. - Springer, London, 2014. - С. 329 - 363.
499. Bansal N. et al. Clinical approach to acute cellular rejection from the pediatric heart transplant society //Pediatric Transplantation. - 2022. - Т. 26. - N. 8. - С. e14393.
500. Chan J.B. et al. Cellular rejection of the conduction system after orthotopic heart transplantation for congenital atrioventricular block //The Journal of heart and lung transplantation. - 2006. - Т. 25. - N. 11. - С. 1371 - 1375.
501. Fabrizio C. et al. Treatment of Anti-Body Mediated Rejection Complicated by Cardiogenic Shock with a Temporary Left Ventricular Assist Device as a Bridge to Recovery //The Journal of Heart and Lung Transplantation. - 2021. - Т. 40. - N. 4. - С. S533.
502. Ciliberto G.R. et al. Acute rejection after heart transplantation: noninvasive echocardiographic evaluation //Journal of the American College of Cardiology. - 1994. - Т. 23. - N. 5. - С. 1156 - 1161.
503. Dearani J.A. et al. Pediatric cardiac retransplantation: intermediate-term results //The Annals of thoracic surgery. - 2001. - Т. 71. - N. 1. - С. 66 - 70.
504. Uber W.E. et al. Acute antibody-mediated rejection following heart transplantation //American Journal of Transplantation. - 2007. - Т. 7. - N. 9. - С. 2064 - 2074.
505. Briasoulis A. et al. Induction immunosuppressive therapy in cardiac transplantation: a systematic review and meta-analysis //Heart Failure Reviews. - 2018. - Т. 23. - N. 5. - С. 641 - 649.
506. Ford K.A. et al. Initial data on basiliximab in critically ill children undergoing heart transplantation //The Journal of heart and lung transplantation. - 2005. - Т. 24. - N. 9. - С. 1284 - 1288.
507. Butts R.J. et al. Comparison of basiliximab vs antithymocyte globulin for induction in pediatric heart transplant recipients: an analysis of the International Society for Heart and Lung Transplantation database //Pediatric Transplantation. - 2018. - Т. 22. - N. 4. - С. e13190.
508. Gullestad L. et al. Two-year outcomes in thoracic transplant recipients after conversion to everolimus with reduced calcineurin inhibitor within a multicenter, open-label, randomized trial //Transplantation. - 2010. - Т. 90. - N. 12. - С. 1581 - 1589.09/
509. Minghelli G. et al. Uricosuric effect of the angiotensin ii receptor antagonist losartan in heart transplant recipients1 //Transplantation. - 1998. - Т. 66. - N. 2. - С. 268 - 271.
510. Weinrauch L.A., D"Elia J.A. Use of calcium channel blockers after heart transplantation //The American Journal of Cardiology. - 2017. - Т. 120. - N. 3. - С. 512.
511. Lobach N.E. et al. Sirolimus immunosuppression in pediatric heart transplant recipients: a single-center experience //The Journal of heart and lung transplantation. - 2005. - Т. 24. - N. 2. - С. 184 - 189.
512. Irving C.A., Webber S.A. Immunosuppression therapy for pediatric heart transplantation //Current treatment options in cardiovascular medicine. - 2010. - Т. 12. - N. 5. - С. 489 - 502.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Акопов
Григорий Александрович
врач - сердечно-сосудистый хирург кардиохирургического отделения N 2 ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н.
Анискевич
Георгий Владимирович
врач - сердечно-сосудистый хирург кардиохирургического отделения N 1 ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н.
Барбараш
Ольга Леонидовна
директор ФГБНУ "Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний" (г. Кемерово), д.м.н., профессор, член-корреспондент РАН
Барбухатти
Кирилл Олегович
заведующий кардиохирургическим отделением N 2 ГБУЗ "Краевая клиническая больница N 1 им. проф. С.В. Очаповского", главный внештатный специалист сердечно-сосудистый хирург Краснодарского края (г. Краснодар), д.м.н., профессор
Баутин
Андрей Евгеньевич
заведующий НИЛ анестезиологии и реаниматологии, профессор кафедры анестезиологии и реаниматологии Института медицинского образования Центра Алмазова (г. Санкт-Петербург), д.м.н., доцент
Гичкун
Ольга Евгеньевна
ведущий научный сотрудник отдела регуляторных механизмов в трансплантологии ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н., доцент
Гордеев
Михаил Леонидович
заведующий НИО кардиоторакальной хирургии, заведующий кафедрой хирургических болезней Института медицинского образования ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России (г. Санкт-Петербург), главный внештатный врач - сердечно-сосудистый хирург Минздрава России по Северо-Западному федеральному округу, д.м.н., профессор
Готье
Сергей Владимирович
директор ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), академик РАН, главный специалист трансплантолог Минздрава России, председатель ОООТ "Российское трансплантологическое общество", д.м.н., профессор, академик РАН
Зайнутдинов
Зайнудин Мусаевич
главный врач клиники ФГБУН "ФИЦ питания и биотехнологии" (г. Москва), д.м.н.
Захаревич
Вячеслав Мефодьевич
заведующий кардиохирургическим отделением N 3 ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н.
Карпенко
Михаил Алексеевич
первый заместитель генерального директора ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России (г. Санкт-Петербург), д.м.н., профессор
Климушева
Наталья Федоровна
заместитель главного врача по стационару ГУЗ "Свердловская областная клиническая больница N 1", главный внештатный специалист трансплантолог Минздрава России в УФО (г. Екатеринбург), д.м.н.
Колоскова
Надежда Николаевна
заведующая кардиологическим отделением ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н.
Коробка
Вячеслав Леонидович
главный врач ГБУ РО "Ростовская областная клиническая больница" (г. Ростов-на-Дону), главный трансплантолог Ростовской области, д.м.н.
Космачева
Елена Дмитриевна
заместитель главного врача по медицинской части ГБУЗ "Краевая клиническая больница N 1 им. проф. С.В. Очаповского", главный внештатный специалист кардиолог Краснодарского края (г. Краснодар), д.м.н., профессор
Левит
Александр Львович
заведующий отделением анестезиологии-реанимации ГАУЗ Свердловской области "Свердловская областная клиническая больница N 1" (г. Екатеринбург), профессор кафедры анестезиологии, реаниматологии, токсикологии ФГБОУ ВО "Уральский государственный медицинский университет" Минздрава России, главный внештатный врач - анестезиолог-реаниматолог министерства здравоохранения Свердловской области и УРФО, д.м.н.
Левит
Дмитрий Александрович
врач - анестезиолог-реаниматолог отделения анестезиологии-реанимации ГАУЗ Свердловской области "Свердловская областная клиническая больница N 1" (г. Екатеринбург), к.м.н.
Минина
Марина Геннадьевна
заместитель главного врача, руководитель Московского координационного центра органного донорства, ГБУЗ "Городская клиническая больница имени С.П. Боткина" Департамента здравоохранения Москвы (г. Москва), д.м.н, профессор РАН
Миронков
Борис Леонтьевич
заведующий отделением рентгенохирургических методов диагностики и лечения ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н.
Можейко
Наталья Павловна
заведующая патологоанатомическим отделением ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н.
Николаев
Герман Викторович
руководитель НИЛ торакальной хирургии ФГБУ "НМИЦ им. В.А. Алмазова" Минздрава России, врач - торакальный хирург, главный внештатный специалист трансплантолог Комитета по здравоохранению Санкт-Петербурга (г. Санкт-Петербург), к.м.н.
Островский
Юрий Петрович
заместитель директора по инновационному развитию и высоким технологиям ГУ "Республиканский научно-практический центр "Кардиология" (г. Минск, Республика Беларусь), д.м.н., профессор, академик НАН Беларуси
Попцов
Виталий Николаевич
заместитель директора по реализации высокотехнологических программ ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н., профессор
Порханов
Владимир Алексеевич
главный врач ГБУЗ "НИИ - Краевая клиническая больница N 1 им. профессора С.В. Очаповского" Минздрава Краснодарского края (г. Краснодар), д.м.н., профессор, академик РАН
Пустовойтов
Андрей Владимирович
главный внештатный специалист сердечно-сосудистый хирург министерства здравоохранения Красноярского края, заведующий отделением кардиохирургии КГБУЗ "Краевая клиническая больница" (г. Красноярск)
Симоненко
Мария Андреевна
научный сотрудник НИЛ кардиопульмонального тестирования, врач - кардиолог-трансплантолог Клинико-диагностического центра Центра Алмазова (г. Санкт-Петербург)
Спирина
Екатерина Александровна
врач - анестезиолог-реаниматолог отделения анестезиологии-реанимации ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н.
Стаханова
Екатерина Анатольевна
заведующая отделом координации и мониторинга научных программ ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.б.н.
Федотов
Петр Алексеевич
ведущий научный сотрудник НИО сердечной недостаточности, заведующий НИЛ высокотехнологичных методов лечения сердечной недостаточности, доцент кафедры Кардиология Института медицинского образования Центра Алмазова (г. Санкт-Петербург), к.м.н.
Халилулин
Тимур Абдулнаимович
врач - сердечно-сосудистый хирург кардиохирургического отделения N 3 ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н.
Хомяков
Сергей Михайлович
заместитель директора - руководитель центра организационно-методического руководства учреждениями, осуществляющими деятельность, связанную с трансплантацией органов и (или) тканей человека, ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н.
Цирульникова
Ольга Мартеновна
врач-терапевт терапевтического отделения ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России, профессор кафедры трансплантологии и искусственных органов ФГАОУ ВО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздрава России (Сеченовский Университет) (г. Москва), д.м.н.
Чернявский
Александр Михайлович
генеральный директор ФГБУ "НМИЦ им. ак. Е.Н. Мешалкина" Минздрава России (г. Новосибирск), д.м.н., профессор, Заслуженный деятель науки Российской Федерации
Шаталов
Константин Валентинович
Заведующий отделением неотложной хирургии врожденных пороков сердца с группой вспомогательного кровообращения (НХ ВПС), заместитель директора ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" по научной работе (г. Москва), д.м.н., профессор
Шевченко
Алексей Олегович
руководитель Центра персонифицированных трансляционных технологий лечения критических состояний ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н., профессор, член-корреспондент РАН
Шевченко
Ольга Павловна
заместитель директора по научной работе, руководитель отдела Отдел регуляторных механизмов в трансплантологии ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), д.м.н., профессор
Шляхто
Евгений Владимирович
генеральный директор ФГБУ "НМИЦ им. В.А. Алмазова" (г. Санкт-Петербург) Минздрава России, д.м.н., профессор, академик РАН, Президент РКО
Шмерко
Наталья Петровна
заведующая клинико-диагностической лабораторией и лабораторией иммунологического мониторинга ФГБУ "Национальный медицинский исследовательский центр трансплантологии и искусственных органов им. ак. В.И. Шумакова" Минздрава России (г. Москва), к.м.н.
Конфликт интересов.
Рабочая группа заявляет об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
Врачи следующих специальностей:
1. Кардиология
2. Терапия
3. Общая врачебная практика (семейная медицина)
4. Анестезиология-реаниматология
5. Детская кардиология
6. Патологическая анатомия
7. Сердечно-сосудистая хирургия
8. Рентгенэндоваскулярные диагностика и лечение
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Классификация рекомендаций и степени доказанности
Таблица N 6. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица N 7. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением метаанализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица N 8. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представлены медицинскими некоммерческими профессиональными организациями.
Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ, ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ
К ПРИМЕНЕНИЮ И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ
И ДОЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Актуальные инструкции по применению лекарственных препаратов расположены на официальном сайте Минздрава России http://grls.rosminzdrav.ru/Default.aspx
Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 31.04.2021) "Об основах охраны здоровья граждан в Российской Федерации", Статья 47. Донорство органов и тканей человека и их трансплантация (пересадка)
Приказ Минздрава России "Об утверждении Порядка оказания медицинской помощи по профилю "хирургия (трансплантация органов и (или) тканей человека)" от 31 октября 2012 г. N 567н С изменениями и дополнениями от 12 декабря 2018 г.
Приказы Минздравсоцразвития России "О медицинском заключении о необходимости трансплантации органов и (или) тканей человека" от 25 мая 2007 г. N 358
Приказы Минздрава России "Об утверждении перечня видов высокотехнологичной медицинской помощи" от 29 декабря 2012 г. N 1629н
Приказ МЗ РФ от 29.12.2012 N 1653н "Об утверждении стандарта первичной медико-санитарной помощи при наличии трансплантированного сердца"
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
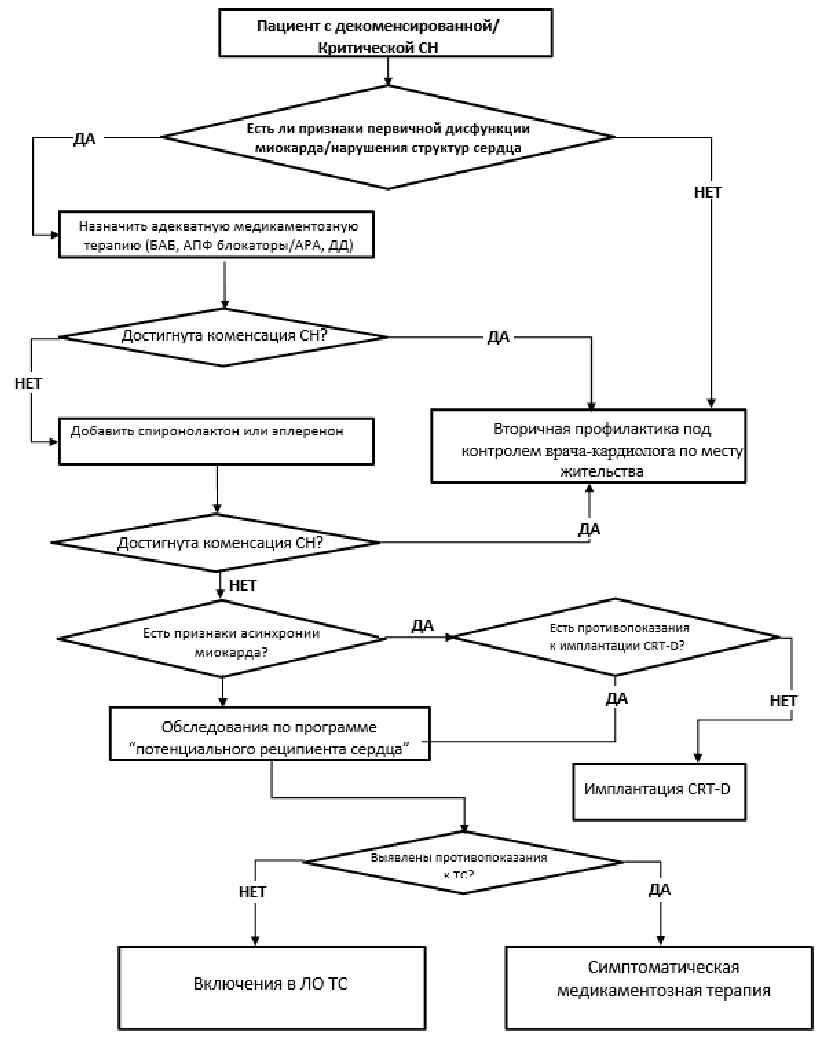
Алгоритм действий врача при возникновении жизнеугрожающих ситуаций у реципиентов сердца
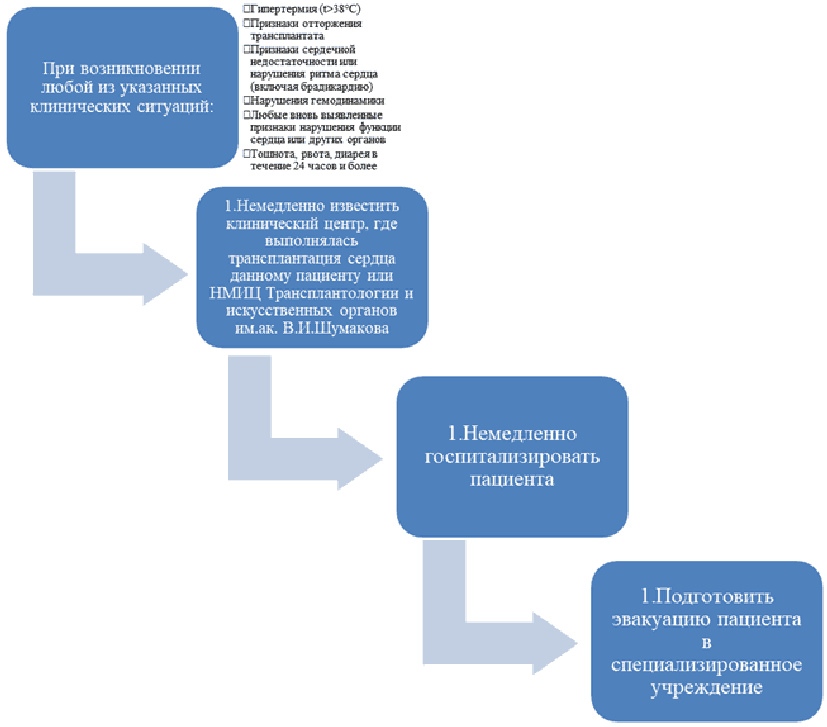
Типичные симптомы и клинические признаки отторжения сердечного трансплантата:
Симптомы
Клинические признаки
- Одышка
- Ортопноэ
- Снижение толерантности к физическим нагрузкам
- Утомляемость, слабость
- Задержка жидкости, отеки
- Ощущение "тяжести" в левом подреберье, эпигастрии
- Эпизоды потери сознания, нарушения когнитивной функции
- Застой в легких (хрипы, рентгенологическая картина)
- Периферические отеки
- Вновь возникшая брадикардия, "необъяснимая" тахикардия
- Развитие мерцательной аритмии
- Экстрасистолия, эпизоды желудочковой тахикардии
- Впервые выявленные нарушения проводимости
- Набухшие яремные вены
- Гепатомегалия
- Ритм галопа (S3)
- Кардиомегалия
- Снижение уровней АД
- Снижение ФВ ЛЖ, нарушения гемодинамики
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Что такое трансплантация сердца?
Операция ортотопической трансплантации сердца является общепризнанным золотым стандартом лечения терминальной сердечной недостаточности, существенно улучшающим прогноз и качество жизни. Суть операции заключается в замене пораженного нежизнеспособного органа пациента донорским органом. В нашей стране подобные операции выполняются с 1987 года.
Имплантируемый аппарат вспомогательного кровообращения может быть эффективной альтернативой у ряда пациентов, или может использоваться в качестве "моста" у пациентов, ожидающих трансплантацию сердца.
Как проходит трансплантация сердца?
На основании комплексного обследования врачи выбирают наиболее оптимальную тактику лечения заболевания, и если принимается решение о необходимости выполнения трансплантации сердца, пациент включается в лист ожидания, ему даются рекомендации по лечению и образу жизни в период ожидания операции.
Как проходит операция?
Операция трансплантации сердца совершенно безболезненна для пациента. Несмотря на то, что сама операция может длиться много часов, пациент не ощущает ни боли, ни дискомфорта, поскольку он спит, находясь под действием комбинации лекарственных препаратов.
После пробуждения в течение нескольких дней пациент находится в отделении реанимации и, как только позволит его состояние, переводится в отделение кардиологии и кардиохирургии, где будет находиться еще две-три недели.
В течение раннего послеоперационного периода пациент под наблюдением врачей восстанавливается, проходит необходимые обследования, позволяющие оценить функцию трансплантата и предупредить возможные послеоперационные осложнения. Тогда же происходит подбор иммуносупрессивной терапии.
Сколько живут пациенты с трансплантированным сердцем?
Анализ регистра ФГБУ "НМИЦ трансплантологии и искусственных органов им. ак. В.И. Шумакова", где наблюдается подавляющее большинство реципиентов пересаженного сердца, свидетельствует о том, что средняя продолжительность жизни пациентов, оперированных в 2010 - 2019 годах, должна составить 25 лет. Здесь следует принять во внимание тот факт, что трансплантация сердца выполняется лишь пациентам, чья ожидаемая продолжительность жизни, по причине болезни, не превышает 1 - 2 года. Также необходимо понимать, что дисфункция сердечного трансплантата - это не приговор. Существует целый ряд методов, вплоть до повторной трансплантации сердца, позволяющий не только сохранить жизнь пациенту, но и поддержать его физическую активность и трудоспособность.
Как жить с трансплантированным сердцем?
Трансплантация сердца позволяет восстановить физическую и социальную активность пациента. При этом пациенты должны постоянно принимать назначенные лекарственные средства и регулярно проходить профилактические обследования по индивидуальному плану, что, впрочем, не оказывает существенного влияния на трудоспособность и возможность жить полноценной активной жизнью.
Приложение Г1 - ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
КЛАССИФИКАЦИЯ ХСН НЬЮ-ЙОРКСКОЙ АССОЦИАЦИИ СЕРДЦА (NYHA)
Название на русском языке: Классификация ХСН Нью-Йоркской ассоциации сердца (NYHA)
Оригинальное название (если есть): the New York Heart Association (NYHA) Functional Classification
Источник: https://www.heart.org/en/health-topics/heart-failure/what-is-heart-failure/classes-of-heart-failure
Тип: шкала оценки
Назначение: классификация ХСН по функциональному классу
Содержание:
Таблица N 9. Классификация ХСН Нью-Йоркской ассоциации сердца (NYHA)
Функциональный класс
Характеристика
I
Заболевание сердца не ограничивает физическую активность. Обычная физическая нагрузка не сопровождается выраженной одышкой, утомляемостью или сердцебиением.
II
Заболевание сердца приводит к незначительному ограничению физической активности. В покое симптомы отсутствуют. Обычная физическая нагрузка вызывает выраженную одышку, утомляемость или сердцебиение.
III
Заболевание сердца приводит к значительному ограничению физической активности. В покое симптомы отсутствуют. Активность менее обычной вызывает выраженную одышку, утомляемость или сердцебиение.
IV
Заболевание сердца приводит к значимому ограничению любой физической активности. Жалобы могут быть в покое. При любой активности симптомы усиливаются.
Приложение Г2
КЛАССИФИКАЦИЯ ХСН Н.Д. СТРАЖЕСКО И В.Х. ВАСИЛЕНКО (1935)
Название на русском языке: Классификация ХСН Н.Д. Стражеско и В.Х. Василенко (1935)
Оригинальное название (если есть): Классификация ХСН Н.Д. Стражеско и В.Х. Василенко (1935)
Источник:
Тип: шкала оценки
Назначение: оценка хронической недостаточности кровообращения
Содержание:
Таблица N 10. Классификация ХСН Н.Д. Стражеско и В.Х. Василенко (1935)
Стадия
Период
Клинико-морфологическая характеристика
I стадия (начальная)
В покое изменения гемодинамики отсутствуют и выявляются только при физической нагрузке.
II стадия
Нарушения гемодинамики в виде застоя крови в малом и/или большом кругах кровообращения сохраняются в покое.
Стадия IIА
Признаки ХСН в покое выражены умеренно. Гемодинамика нарушена лишь в одном из отделов сердечно-сосудистой системы (в малом или большом круге кровообращения).
Стадия IIБ
Окончание длительной стадии прогрессирования ХСН. Выраженные гемодинамические нарушения, в которые вовлечена вся сердечно-сосудистая система (и малый, и большой круги кровообращения).
III стадия
Выраженные нарушения гемодинамики и признаки венозного застоя в обоих кругах кровообращения, а также значительные нарушения перфузии и метаболизма органов и тканей.
Приложение Г3
КЛАССИФИКАЦИЯ ОСТРОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ ПО KILLIP
Название на русском языке: Классификация острой сердечной недостаточности по Killip
Оригинальное название (если есть): The Killip classification
Источник:
Тип: шкала оценки
Назначение: оценка острой сердечной недостаточности
Содержание:
Таблица N 11. Классификация острой сердечной недостаточности по Killip
Класс
Характеристика
I
Симптомы и признаки сердечной недостаточности отсутствуют
II
Сердечная недостаточность, включающая в себя влажные хрипы, занимающие не более половины поверхности легочного поля, третий тон сердца, венозную легочную гипертензию
III
Отек легких (влажные хрипы занимают более половины поверхности легочного поля)
IV
Кардиогенный шок
Приложение Г4
КЛАССИФИКАЦИЯ ОСТРОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ ПО ДАННЫМ
ЦЕНТРАЛЬНОЙ ГЕМОДИНАМИКИ (FORRESTER)
Название на русском языке: Классификация острой сердечной недостаточности по данным центральной гемодинамики (Forrester)
Оригинальное название (если есть): The Forrester classification
Источник:
Тип: шкала оценки
Назначение: оценка острой сердечной недостаточности по данным центральной гемодинамике
Содержание:
Таблица N 12. Классификация острой сердечной недостаточности по данным центральной гемодинамики (Forrester)
Класс
ДЗЛА (мм рт. ст.)
СИ (л/мин/м2)
Клинические проявления
I
<= 18
> 2,2
Норма
II
> 18
> 2,2
Застойные явления в легких
III
<= 18
<= 2,2
Гиповолемия, недостаточность ПЖ, дилатация артериол
IV
> 18
<= 2,2
Недостаточность ЛЖ, кардиогенный шок
Приложение Г5
КЛАССИФИКАЦИЯ ОСТРОГО КЛЕТОЧНОГО ОТТОРЖЕНИЯ (ISHLT 2004)
Название на русском языке: Классификация острого клеточного отторжения (ISHLT 2004)
Оригинальное название (если есть): ISHLT 2004 Acute cellular Rejection Granding Scheme
Источник:
Тип: шкала оценки
Назначение: оценка острого клеточного отторжения в эндомиокардиальном биоптате
Содержание:
Таблица N 13. Классификация острого клеточного отторжения (ISHLT 2004)
Степени
Морфологическая картина
Степень 1R
Мононуклеарная инфильтрация миокарда с наличием или отсутствием единичного очага повреждения кардиомиоцитов
Степень 2R
Мононуклеарная инфильтрация миокарда с множественными очагами повреждения кардиомиоцитов
Степень 3R
Мононуклеарная инфильтрация с диффузным повреждением кардиомиоцитов и/или признаками отека, кровоизлияний или васкулита
Приложение Г6
КЛАССИФИКАЦИЯ ОСТРОГО ГУМОРАЛЬНОГО ОТТОРЖЕНИЯ (ISHLT 2013)
Название на русском языке: Классификация острого гуморального отторжения (ISHLT 2013)
Оригинальное название (если есть): ISHLT 2013 Acute Humoral Rejection Granding Scheme
Источник:
Тип: шкала оценки
Назначение: оценка острого гуморального отторжения в эндомиокардиальном биоптате
Содержание:
Таблица N 14. Классификация острого гуморального отторжения (ISHLT 2013)
Степени
Морфологическая картина
pAMR0
Гистологические и иммуногистохимические признаки отсутствуют
pAMR-1 (I+)
Наличие только иммунофлуоресцентных признаков: C4d компонента комплемента в стенке интерстициальных капилляров сосуда
pAMR-1 (H+)
Наличие только гистологических признаков: активация эндотелия сосудов, периваскулярного клеточного инфильтрата, периваскулярного внутрисосудистых макрофагов, интерстициального отека, возможен некроз кардиомиоцитов
pAMR-2
Сочетание гистологических и иммунофлуоресцентных признаков (pAMR (H+) + pAMR (I+) = pAMR2)
pAMR-3
Выраженные гистологические признаки и распространенное свечение C4d компонента комплемента в стенке капилляров миокарда
Приложение Г7
КЛАССИФИКАЦИЯ ВАСКУЛОПАТИИ СЕРДЕЧНОГО ТРАНСПЛАНТАТА
(ISHLT 2010)
Название на русском языке: Классификация васкулопатии сердечного трансплантата (ISHLT 2010)
Оригинальное название (если есть):
Источник
Тип: шкала оценки
Назначение: оценка васкулопатии сердечного трансплантата по данным ангиографического исследования
Содержание:
Таблица N 15. Классификация васкулопатии сердечного трансплантата (ISHLT 2010)
Степень
Ангиографические критерии
ISHLT CAV 0 (васкулопатия незначимая)
Ангиографических изменений не выявлено
ISHLT CAV 1 (легкая)
Стеноз ствола ЛКА < 50%, основных ветвей <70%, или любой ветви < 70% (включая диффузное сужение) без дисфункции трансплантата
ISHLT CAV 2 (умеренная)
Стеноз ствола ЛКА > 50%, основных ветвей > 70%, или любой ветви второго порядка > 70% без дисфункции трансплантата
ISHLT CAV 3 (выраженная)
Стеноз ствола ЛКА > 50%, двух и более основных ветвей > 70%, или любой ветви второго порядка > 70% во всех трех основных бассейнах; или ISHLT CAV 1, или ISHLT CAV 2 в сочетании с дисфункцией трансплантата (определяемая как ФИЛЖ < 45%, обычно в сочетании с нарушением локальной сократимости ЛЖ), или признаки значимой рестриктивной диастолической дисфункции
Приложение Г8
ОПРЕДЕЛЕНИЕ СТАТУСА НЕОТЛОЖНОСТИ ПАЦИЕНТОВ В ЛИСТЕ
ОЖИДАНИЯ ТРАНСПЛАНТАЦИИ СЕРДЦА (ПО UNOS)
Название на русском языке: Определение статуса неотложности пациентов в листе ожидания трансплантации сердца (по UNOS)
Оригинальное название (если есть):
Источник:
Тип: шкала оценки
Назначение: степень неотложности оперативного вмешательства (трансплантации сердца) пациенту в листе ожидания
Содержание:
Таблица N 16. Определение статуса неотложности пациентов в листе ожидания трансплантации сердца (по UNOS)
Статус по UNOS
Критерии
1A
1. Пациенты, находящиеся на механической поддержке кровообращения (лево- и/или правожелудочковый обход менее 30 дней, искусственное сердце, внутриаортальная баллонная контрпульсация, ЭКМО), сопровождающейся тромбоэмболическими, инфекционными осложнениями, угрожающими жизни желудочковыми аритмиями, техническими повреждениями систем механической поддержки кровообращения.
2. Пациенты, находящиеся на искусственной вентиляции легких, требующие применения в высоких дозах внутривенных кардиотонических средств негликозидной структуры, либо применения нескольких кардиотонических средств.
3. Пациенты, требующие непрерывного гемодинамического мониторинга (более 7 дней), с предполагаемым сроком жизни менее 7 дней, при регулярном переосвидетельствовании врачами каждые 7 дней.
1B
Пациенты, находящиеся на лево- и/или правожелудочковой механической циркуляторной поддержке более 30 дней без осложнений и/или требующие непрерывной инфузии кардиотонических средств негликозидной структуры в терапевтических дозах
2
Все остальные пациенты, находящиеся в листе ожидания трансплантации сердца.
