"Клинические рекомендации "Лимфома из клеток мантии"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЛИМФОМА ИЗ КЛЕТОК МАНТИИ
МКБ 10: C83.1
Год утверждения (частота пересмотра): 2020
ID: КР136/1
URL
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России" - Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество" - Региональная общественная организация "Общество онкогематологов"
Одобрено Научно-практическим Советом Минздрава РФ
Ключевые слова
Список сокращений
EBMT - Европейское общество трансплантации костного мозга
MIPIb (Mantle cell lymphoma International Prognostic Index) - международный прогностический индекс лимфомы из клеток мантийной зоны биологический
R-поддержка - поддерживающая терапия ритуксимабом**
аллоТКМ - аллогенная трансплантация костного мозга
аутоТГСК - аутологичная трансплантация гемопоэтических стволовых клеток
БРВ - безрецидивная выживаемость
БСВ - бессобытийная выживаемость
ЖКТ - желудочно-кишечный тракт
ИГХ - иммуногистохимический
ИФТ - иммунофенотипирование
КТ - компьютерная томография
ЛДГ - лактатдегидрогеназа
ЛКМ - лимфома из клеток мантии
ЛУ - лимфатический узел
ОВ - общая выживаемость
ОО - общий ответ
ПР - полная ремиссия
ПХТ - полихимиотерапия
ПЭТ - позитронно-эмиссионная томография
СОД - суммарная очаговая доза
ТОТ - тотальное облучение тела
УЗИ - ультразвуковое исследование
ЦНС - центральная нервная система
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
ECOG - оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) - см. приложение Г1.
B-симптомы - неспецифичиеские симптомы опухолевой интоксикации, включающие лихорадку выше 38 °C не менее трех дней подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
1. Краткая информация
1.1. Определение заболевания или состояния (группы заболеваний или состояний)
Лимфома из клеток мантии (ЛКМ; син.: мантийноклеточная лимфома) - это зрелоклеточная B-клеточная лимфома из мелких и среднего размера лимфоидных клеток с неправильным контуром ядер. В более чем 95% случаев выявляется транслокация с участием гена CCND1. Большинство случаев ЛКМ характеризует агрессивное течение, но описаны и индолентные варианты [1].
1.2. Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Главным (первичным) онкогенным событием в патогенезе ЛКМ считается транслокация t(11;14) (q13;q32). Ген CCND1, находящийся в 13 локусе длинного плеча 11 хромосомы, переносится в область энхансера конституционально гиперэкспрессированных в B-лимфоцитах генов IgVH [2, 3]. В результате развивается гиперэкспрессия белка-регулятора клеточного цикла циклина D1. Установление факта избыточной экспрессии циклина D1 является одним из основных иммунологических маркеров ЛКМ. Анализ точек разрыва в 11q13 и 14q32 показал, что транслокация происходит во время первичной перестройки генов иммуноглобулинов в костномозговой клетке-предшественнице B-лимфопоэза между одним из D- и J-сегментов генов иммуноглобулинов. Около 50% перестроек в 11q13 происходят в регионе, обозначенном как главный кластер транслокации. Оптимальным способом определения t(11;14)(q13;q32) является флуоресцентная гибридизация in situ (FISH): частота выявления транслокации этим методом при ЛКМ достигает 99% [4]. Партнером для гена, кодирующего циклин D1, могут стать и локусы легких цепей иммуноглобулинов: t(2;11)(p11;q13) и t(11;22)(q13;q11). Вариантные транслокации встречаются менее чем в 1% случаев ЛКМ. Циклин D1 в комплексе с циклин-зависимыми киназами 4 и 6 (CDK4/6) является регулятором перехода клеток из G1 в S-фазу клеточного цикла. Активный комплекс циклин D1/CDK4(6) фосфорилирует ретинобластомный протеин (RB), белок-блокатор транскрипционного фактора E2F. Комплекс циклин D1/CDK4 имеет и киназа-независимые функции, связываясь, в частности, с белком-блокатором клеточного цикла p27kip, который, в свою очередь, титрует из ядра комплекс циклина E/CDK2. Это дополнительно способствует ускорению клеточного цикла. При ЛКМ циклин-зависимые киназы CDK4 и CDK6, необходимые для реализации циклина D1a, часто гиперэкспрессированы. В случае CDK4 это достигается за счет амплификации гена CDK4, а в случае CDK6 отмечается снижение экспрессии микроРНК-29. Это ведет к стабилизации транскрипта CDK6 и способствует гиперэкспрессии белка, что ассоциируется с более короткой выживаемостью пациентов. В цитоплазме циклин D1 полиубиквитинируется через Е3 лигазу SKp1-Cul1-F (SCF;  Crystallin) и деградируется через протеасому. Мутации T268A и мутации в E3 убиквитино-лигазном комплексе увеличивают ядерную экспрессию циклина D1. Несмотря на отсутствие описаний таких мутаций при ЛКМ, PI3K/Akt-зависимое ингибирование
Crystallin) и деградируется через протеасому. Мутации T268A и мутации в E3 убиквитино-лигазном комплексе увеличивают ядерную экспрессию циклина D1. Несмотря на отсутствие описаний таких мутаций при ЛКМ, PI3K/Akt-зависимое ингибирование  имеет схожий эффект и создает вклад в дисрегуляцию циклина D1 при ЛКМ [5].
имеет схожий эффект и создает вклад в дисрегуляцию циклина D1 при ЛКМ [5].
1.3. Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Лимфома из клеток мантии (ЛКМ) составляет около 3 - 10% всех вновь диагностированных случаев неходжкинских лимфом [6]. В Западной Европе, Скандинавии и США ее частота варьирует от 0,5 до 0,7 на 100 000 населения, причем у людей старше 65 лет заболеваемость возрастает до 3,9 на 100 000. Болеют преимущественно мужчины старше 60 лет (медиана возраста 65 - 75 лет, М:Ж - > 2:1). В США ежегодно заболевают от 5000 до 6000 человек, что косвенным образом свидетельствует о том, что в РФ ежегодно должно выявляться не менее 2500 новых случаев.
1.4. Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C83.1 - лимфома клеток мантии.
1.5. Классификация заболевания или состояния (группы заболеваний или состояний)
ЛКМ может классифицироваться по стадиям и по группам прогноза.
Существует условное разделение в зависимости вариантов течения ЛКМ: агрессивное и индолентное. Для опухоли с индолентным течением характерны наличие лимфатического лейкоцитоза в крови, спленомегалия в отсутствии лимфаденопатии, невысокая опухолевая нагрузка, низкий уровень пролиферативной активности (Ki67 менее 10%). Указанное разделение имеет значение при планировании программы лечения.
Стадирование
Для стадирования ЛКМ используется модифицированная классификация по стадиям Ann Arbor (табл. 1), как при лимфоме Ходжкина и большинстве других лимфопролиферативных заболеваний [1, 2].
Таблица 1. Стадирование ЛКМ по Ann-Arbor
Стадия I
Вовлечение одной группы лимфатических узлов (ЛУ) - I или локализованное поражение одного экстралимфатического органа или ткани - I E.
Стадия II
Вовлечение >= 2 групп ЛУ по одну сторону диафрагмы - II или локализованное поражение одного экстралимфатического органа или ткани с вовлечением >=1 группы ЛУ по ту же сторону диафрагмы - II E.
Стадия III
Вовлечение групп ЛУ по обе стороны диафрагмы с/без локализованного поражения экстралимфатического органа или ткани - III E, селезенки - III S, или того и другого - III S + E.
Стадия IV
Диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлечения ЛУ.
1.6. Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В 90% случаев диагноз устанавливается в III или IV стадии с присутствием лимфоаденопатии, гепатоспленомегалии и поражения костного мозга [10, 11].
Часто имеются B-симптомы - лихорадка (гипертермия), ночные поты, потеря массы тела более 10% за последние полгода. Спленомегалия наблюдается более чем у 50% пациентов. Часто выявляется лейкоцитоз с наличием клеток ЛКМ в крови. Наиболее распространенной экстранодальной локализацией при ЛКМ является поражение желудочно-кишечного тракта: лимфоматозные полипы толстой кишки или желудка. Следует помнить, что даже при отсутствии явных полипов или видимых изменений слизистой оболочки при гистологическом исследовании биоптатов могут выявляться участки опухолевой инфильтрации. Может наблюдаться также поражение мочеполовой системы, легких и мягких тканей, в том числе мягких тканей головы и шеи, периорбитальных тканей глаза. Поражение центральной нервной системы редко диагностируется в дебюте и может развиться у пациентов с ЛКМ в рецидиве или прогрессировании заболевания. Также у небольшой части пациентов, особенно с бластоидным вариантом ЛКМ, встречаются изолированные ЦНС-рецидивы после первоначально успешного лечения. Частота возникновения ЦНС-рецидивов увеличилась в последнее время в связи с появлением более эффективной системной терапии и увеличением продолжительности выживания пациентов с ЛКМ [12 - 14].
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии со шкалами оценки уровней достоверности доказательств и уровней убедительности рекомендаций) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза: диагноз ЛКМ устанавливают на основании патологоанатомического исследования биопсийного или операционного материала с применением иммуногистохимических методов.
2.1. Жалобы и анамнез
- Всем пациентам с подозрением на ЛКМ, а также всем пациентам с верифицированной ЛКМ при каждом приеме рекомендуется сбор анамнеза и жалоб при заболеваниях органов кроветворения и крови для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. При сборе анамнеза заболевания и семейного анамнеза выяснять следующее: установление предшествующих развитию заболевания факторов - бактериальная или вирусная инфекция, стресс, сопутствующие заболевания, пересадка органов в анамнезе; семейный анамнез - болезни системы кроветворения у кровных родственников.
2.2. Физикальное обследование
- Всем пациентам с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической, определение общего состояния по шкале ECOG (см. приложение Г), а также осмотр миндалин и полости рта для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Следует обращать внимание на такие факторы: гипертермия, снижение массы тела и симптомы интоксикации, гепато- и спленомегалия, лимфаденопатия, патология молочных желез, сердца, вен нижних конечностей, врожденные аномалии.
2.3. Лабораторные диагностические исследования
- У всех пациентов с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии через 2 мес. терапии, при контрольных обследованиях, при подозрении на рецидив/прогрессирование, перед проведением 1-й линии противоопухолевой терапии рекомендуется выполнить развернутый общий (клинический) анализ крови, для верификации диагноза, уточнения активности заболевания, оценки состояния пациента и выработки адекватной терапевтической тактики [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; обязателен оптический подсчет количества тромбоцитов (по Фонио), исследование морфологии эритроцитов, тромбоцитов, нейтрофилов по мазку, скорости оседания эритроцитов.
- У всех пациентов с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии через 2 мес. терапии, при контрольных обследованиях, при подозрении на рецидив/прогрессирование рекомендуется выполнение анализа крови биохимического общетерапевтического для оценки функционального состояния внутренних органов и выявления сопутствующей патологии [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий. Включает обязательное определение следующих параметров: ЛДГ, мочевая кислота, мочевина, креатинин, общий белок, альбумин, общий и прямой билирубин, АСТ, АЛТ, щелочная фосфатаза, натрий, калий, хлориды, общий кальций.
- У всех пациентов с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии через 2 мес. терапии, при контрольных обследованиях, при подозрении на рецидив/прогрессирование, рекомендуется выполнение общего (клинического) анализа мочи для выявления сопутствующей патологии и выработки адекватной терапевтической тактики [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- У всех пациентов с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии через 2 мес. терапии, при контрольных обследованиях, при подозрении на рецидив/прогрессирование рекомендуется выполнение коагулограммы (ориентировочного исследования системы гемостаза) для оценки функционального состояния тромбоцитов и свертывающей системы [2, 3].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Коагулограмма должна включать определение следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время.
- Всем пациентам с ЛКМ перед проведением 1-й линии противоопухолевой терапии рекомендуется молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости проведения антиретровирусной терапии [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ перед проведением терапии 1-й линии противоопухолевой терапии рекомендуется выполнение развернутого вирусологического обследования для выявления маркеров вируса гепатита B с целью уточнения риска и, в случае необходимости, профилактики реактивации вирусного гепатита, которое должно включать:
-
-
-
- определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
- определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
- определение антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
- определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом полимеразной цепной реакции, качественное исследование (только при положительных тестах HBsAg и/или HBcAg) [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ перед проведением 1-й линии противоопухолевой терапии рекомендуется выполнить определение Core-антигена вируса гепатита C (Hepatitis C virus) в крови с целью уточнения риска и, в случае необходимости, профилактики реактивации вирусного гепатита [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ перед проведением 1-й линии противоопухолевой терапии рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора), определение фенотипа антигенов эритроцитов для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЛКМ перед проведением 1-й линии противоопухолевой терапии при клинических или лабораторных признаках гемолиза рекомендуется выполнение прямого антиглобулинового теста (прямой пробы Кумбса) для уточнения причины гемолиза [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ с лимфоцитозом в общем анализе крови или в миелограмме (независимо от числа лейкоцитов) рекомендуется исследование биологического материала (периферической крови или костного мозга) методом проточной цитофлуориметрии для уточнения распространенности заболевания и определения стратегии лечения [3 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Выполнение ИФТ обязательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов) или в миелограмме, а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента.
Выполнение ИФТ клеток костного мозга позволяет выявить поражение даже в случае отсутствия убедительных признаков морфологического поражения по данным миелограммы. Минимальная ИФТ-панель должна включать CD3, CD19, CD20, CD10, CD5, CD23, ![]() ,
, ![]() . Дополнительно при возможности полезно оценить CD200. Экспрессию циклина D1 можно изучить только при иммуногистохимическом (ИГХ) анализе трепанобиоптата костного мозга.
. Дополнительно при возможности полезно оценить CD200. Экспрессию циклина D1 можно изучить только при иммуногистохимическом (ИГХ) анализе трепанобиоптата костного мозга.
Материалом для ИФТ могут служить клетки крови, костного мозга, выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы и т.д.), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
- Пациентам с ЛКМ при первичном обследовании и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнить получение гистологического препарата костного мозга, патологоанатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов для оценки объема поражения костного мозга и состояния остальных ростков кроветворения [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Исследование пунктата костного мозга (стернального или др.) не заменяет патологоанатомическое исследование трепанобиоптата. Отсутствие морфологических признаков поражения костного мозга не исключает наличие минимального поражения костного мозга, что выявляется с помощью метода полимеразной цепной реакции.
- Пациентам с ЛКМ при бластоидном варианте +/- гиперлейкоцитоз, общемозговая симптоматика при первичном обследовании рекомендуется выполнение спинномозговой пункции, цитологическое исследование клеток спинномозговой жидкости и/или исследование биологического материала (спинномозговой жидкости) методом проточной цитофлуориметрии для исключения нейролейкемии [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Профилактическое введение лекарственных препаратов в спинномозговой канал - на усмотрение лечащего врача.
2.4. Инструментальные диагностические исследования
- Всем пациентам с ЛКМ для подтверждения диагноза перед проведением 1-й линии противоопухолевой терапии и при подозрении на рецидив/прогрессирование заболевания рекомендуется обязательное выполнение биопсии лимфоузла или другого очага поражения [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Диагноз лимфомы устанавливают только на основании морфологического исследования биоптата. Морфологическое исследование проводится с помощью гистологического и иммуногистохимического методов. В части случаев необходимо проведение цитологического, молекулярно-биологических и генетических тестов. Одно цитологическое исследование пунктатов или мазков-отпечатков лимфатических узлов или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах) объектом исследования может быть тканевой материал, полученный с помощью "пистолетной" ("кор"-) биопсии.
- Пациентам с ЛКМ при наличии клинических признаков опухолевого поражения головного мозга (очаговая симптоматика, общемозговая симптоматика) рекомендуется перед спинномозговой пункцией выполнить магнитно-резонансную томографию головного мозга с контрастированием для выявления или исключения опухолевого поражения головного мозга [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЛКМ при первичном обследовании рекомендуется выполнение колоноскопии с обязательными биопсиями слизистых толстой кишки, даже при отсутствии визуальных признаков вовлечения органа ("слепые" биопсии) для исключения опухолевого поражения толстой кишки [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ перед началом терапии 1-й или последующих линий рекомендуется выполнение электрокардиограммы для оценки функционального состояния сердечно-сосудистой системы [2, 3].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛКМ перед началом терапии, после ее завершения, а также при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение компьютерной томографии (КТ) шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для уточнения наличия и распространенности лимфаденопатии или оценки противоопухлевого эффекта, если исследование выполнено в динамике [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств 5).
- Пациентам с ЛКМ перед началом терапии, при оценке ремиссии после завершения терапии (если имелось поражение лимфатических узлов области средостения и/или легочной ткани), а также при подозрении на рецидив/прогрессирование заболевания, при наличии противопоказаний к КТ рекомендуется выполнить рентгенографию органов грудной клетки в двух проекциях для уточнения наличия и распространенности лимфаденопатии [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЛКМ перед началом терапии, при оценке ремиссии после завершения терапии (если имелось поражение лимфатических узлов области средостения и/или легочной ткани), а также при подозрении на рецидив/прогрессирование заболевания, при наличии противопоказаний к КТ рекомендуется выполнить ультразвуковое исследование лимфатических узлов и внутренних органов для уточнения наличия и распространенности лимфаденопатии [2 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. При ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза.
- Пациентам с ЛКМ при оценке ремиссии рекомендуется выполнение позитронной эмиссионной томографии (ПЭТ) всего тела с туморотропными радиофармпрепаратами (РФП) (18F-фтордезоксиглюкозой) при сохранении остаточных образований после завершения высокодозной терапии и аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК) с целью решения вопроса о проведении лучевой терапии [6 - 8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии. Роль ПЭТ недостаточно определена из-за большой вероятности получения ложноотрицательных результатов у пациентов с ЛКМ. Это связанно с тем, что уровень пролиферативной активности опухолевых клеток в значительной части случаев близок к нормальному, и повышенного накопления радиофармпрепарата не происходит. Исходная чувствительность метода достигает только 67%, особенно много ложноотрицательных результатов при вовлечении ЖКТ.
2.5. Иные диагностические исследования
- Всем пациентам с ЛКМ для подтверждения диагноза перед проведением 1-й линии противоопухолевой терапии и при подозрении на рецидив/прогрессирование заболевания рекомендуется обязательное выполнение патолого-анатомического исследования биопсийного (операционного) материала лимфоузла или другого очага поражения с применением иммуногистохимических методов [2 - 5, 9].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Обязательно определение экспрессии следующих антигенов: CD3, CD5, CD10, CD20, CD23, BCL6, BCL2, CyclinD1 и Ki67. При возможности необходимо также определять SOX11, TP53 и LEF1 (для выделения индолентных и агрессивных форм и дифференциальной диагностики ХЛЛ соответственно).
- Пациентам с ЛКМ перед проведением 1-й и последующих линий противоопухолевой терапии рекомендуется осмотр (консультация) врача-кардиолога, врача-эндокринолога, врача-невролога, врача-инфекциониста и других врачей-специалистов в зависимости от сопутствующей патологии [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3. Лечение
Следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Основу современного лечения ЛКМ составляет иммунохимиотерапия с последующей консолидацией и/или поддерживающей терапией (табл. 2) [3 - 5].
Особенностью заболевания является рецидивирующее течение, несмотря на различные режимы терапии. Применение (R)CHOP-подобных курсов эффективно только в достижении общего ответа (ОО): полные ремиссии (ПР) достигаются в трети случаев, а медиана бессобытийной выживаемости (БСВ) составляет 16 - 20 мес. [10 - 12].
Основными тенденциями в терапии ЛКМ за последнее десятилетие являются:
1. интенсификация индукционной терапии высокими дозами цитарабина** (3 курса по 12 г/м2/курс) для пациентов моложе 60 лет [13];
2. широкое распространение аутоТГСК в качестве консолидации 1-й ремиссии у пациентов моложе 60 - 65 лет [14 - 16];
3. применение комбинаций средних доз цитарабина** с бендамустином**, препаратами соединениями платины [17, 18];
4. постепенное исключение из протоколов интенсивной терапии высоких доз метотрексата**, в первую очередь из-за отсутствия убедительных данных о его эффективности и высокой токсичности у пациентов старшей возрастной группы [19];
5. замена #винкристина** на бортезомиб** в CHOP-подобном режиме для пациентов старше 60 - 65 лет [20];
6. использование поддерживающей терапии моноклональными антителами после аутоТГСК и среднедозной индукционной терапии (R-CHOP) [21, 22];
7. внедрение ингибиторов тирозинкиназы Брутона (АТХ-группа - ингибиторы протеинкиназ) и иммуномодуляторов (АТХ-группа - прочие иммунодепрессанты) в клиническую практику [23, 24].
Основываясь на результатах различных исследований использование моноклональных антител, высокодозной индукционной терапии и аутологичной трансплантации стволовых кроветворных клеток (аутоТГСК) превратились в наиболее эффективный способ достижения полных ремиссий, длительной бессобытийной и общей выживаемости у пациентов моложе 65 лет [14 - 16].
Введение высоких доз цитарабина** в схемы индукционной терапии позволяет достигать ОО в 90 - 95%, а ПР не менее чем в половине случаев. Целью высокодозной консолидации с поддержкой аутоТГСК является достижение молекулярной ремиссии, что коррелирует с более длительной безрецидивной выживаемостью (БРВ). Плато на кривой БСВ не регистрируется, но около половины пациентов после высокодозной терапии переживают 10-летний рубеж [25].
Использование высоких доз цитарабина** и метотрексата** сопряжено с развитием гематологической токсичности IV степени, высоким риском тяжелых инфекционных осложнений и острой почечной недостаточности. Медиана возраста пациентов с ЛКМ, которым предполагается проведение интенсивной индукционной полихимиотерапии (ПХТ), колеблется от 50 до 60 лет, что приводит к невыполнению высокодозной ПХТ в полном объеме у 30 - 50% пациентов. В результате редукции объема терапии у меньшего числа пациентов достигаются ПР, укорачивается БСВ и ОВ.
Снижение дозы цитарабина** в индукционной ПХТ с 12 до 4 г/м2 ведет к уменьшению сроков медианы БСВ с 5 до 3 лет, хотя ПР достигаются в 89 и 84% случаев соответственно. Это подталкивает на поиск оптимальной по переносимости и эффективности индукционной ПХТ у пациентов с сопутствующей патологией в возрасте 55 - 65 лет. Альтернативой высоким дозам цитарабина** и метотрексата** могут быть курсы ПХТ, включающие средние дозы цитарабина** с цисплатином** (R-DHAP), бендамустином** (R-BAC) и/или бортезомибом** (R-HAD+B); комбинации #гемцитабина** и #оксалиплатина**. Их высокая эффективность продемонстрирована не только в терапии рецидивов и резистентных форм, но и у первичных пациентов [11, 19, 26].
Медиана возраста пациентов с ЛКМ колеблется около 65 лет, что ограничивает проведение интенсивной терапии не менее чем в половине случаев. Постоянный поиск новых схем иммунополихимиотерапии не позволяет выделить "золотой" стандарт, однако любая интенсификация сопряжена с токсичностью. Например, добавление средних доз цитарабина** к схеме ритуксимаб**-бендамустин** (R-BAC) позволяет значительно улучшить результаты индукционной терапии, но только у соматически сохранных пациентов в возрасте до 75 лет. При невозможности применения среднедозных режимов терапии (R-CHOP или R-B) у пациентов с неудовлетворительным соматическим статусом возможно использование #кладрибина с ритуксимабом** или метрономной терапии, такой как R-PEPC. В ряде случаев возможно использование лучевой терапии, особенно при I - II стадиях заболевания. Неудовлетворительные результаты среднедозной терапии подталкивают к активному внедрению в клиническую практику новых таргетных препаратов, таких как ингибиторы тирозинкинзы Брутона (ибрутиниб**), механизм действия которых направлен на блокирование передачи сигнала от B-клеточного рецептора к ядру клетки [23].
Высокая токсичность флударабина**, связанная, в первую очередь, с развитием гипоплазии и аплазии костномозгового кроветворения, привела к исключению данного препарата из терапии 1-й линии как у молодых пациентов, так и у пациентов старшей возрастной группы.
Важной особенностью терапии ЛКМ является медленное достижение ответа и, как следствие, необходимость в проведении от 6 до 8 курсов индукционной терапии. Таким образом, выбор терапии, в первую очередь, зависит от возраста пациента и его соматического статуса.
Таблица 2. Терапия пациентов с ЛКМ в зависимости от возраста и соматического статуса (см. Приложение А3)
< 60 - 65 лет, кандидаты для высокодозной химиотерапии и аутоТГСК
> 60 - 65 лет, не кандидаты для высокодозной химиотерапии и аутоТГСК
1-я линия терапии
1. Интенсивная индукция:
R-(Maxi)CHOP/R-HD-AraC
R-HyperCVAD/R-HMA
R-CHOP/R-DHAP
2. Консолидация: аутоТГСК
3. +/- R-поддержка 375 мг/м2 1 раз в 2 - 3 мес 2 - 3 года (всего 12 введений)
1. Среднедозная индукция:
R-BAC, R-B
R-CHOP, R-CVP
VR-CAP
#Кладрибин+R или PEPC при тяжелом соматическом статусе
Клинические исследования
2. R-поддержка 375 мг/м2 1 раз в 2 - 3 мес 2 - 3 года (всего 12 введений)
Рецидив/прогрессия
R-BAC
R-HAD+/-B (AraC 1 - 2 г/м2 x 4 +/- бортезомиб**)
Ибрутиниб**
Аллогенная трансплантация костного мозга (аллоТКМ) (при достижении ответа)
АутоТГСК (при отсутствии на более раннем этапе и достижении ответа) R-B (после R-CHOP)
Бортезомиб** (лучше в комбинации)
Клинические исследования
R-PEPC
Лучевая терапия (особенно при локальном рецидиве)
R-HAD+/-B (AraC 1 г/м2 x 4 +/- бортезомиб)
R-B, R-BAC (после CHOP)
Ибрутиниб**
Бортезомиб** +/- ритуксимаб**
R-PEPC
Клинические исследования
Лучевая терапия (особенно при локальном рецидиве)
3.1. Локальные (I - II) стадии
- Пациентам с верифицированной ЛКМ I - II стадии и бессимптомным индолентным течением рекомендуется использование тактики "watch and wait" - "наблюдай и жди" [3 - 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с верифицированной ЛКМ с I - II стадией без массивного вовлечения лимфоузлов и факторов риска в качестве терапии 1-й линии возможно применение 4 - 6 курсов ПХТ по схеме R-CHOP и локальной лучевой терапии в суммарной очаговой дозе (СОД) 30 Гр при достижении полной ремиссии или СОД 36 - 40 Гр при частичном ответе [5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. С появлением высокочувствительных методов диагностики I - II стадия у пациентов с ЛКМ устанавливается исключительно редко (в 1 - 3% случаев). Стандартная терапия не разработана. При применении комбинированного химиолучевого лечения ремиссии достигаются у 95% пациентов.
- Пациентам с верифицированной ЛКМ с I - II стадией моложе 60 лет при массивном вовлечении лимфоузлов и/или при наличии факторов неблагоприятного прогноза (см. раздел 7.1) рекомендовано проводить индукционную терапию по принципам лечения распространенных стадий [4, 5].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.2. Пациенты моложе 65 лет с сохранным соматическим статусом, являющиеся кандидатами для проведения высокодозной терапии и аутоТГСК
3.2.1. Первая линия терапии
- Пациентам с верифицированной ЛКМ моложе 65 лет без значимой коморбидности, являющимся кандидатами для проведения высокодозной терапии и аутоТГСК, рекомендуется проведение индукционной терапии с использованием высоких доз цитарабина** [27].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии. Принимая во внимание медиану возраста пациентов старше 50 лет, необходимость в проведении 6 - 8 циклов терапии длительностью 21 - 28 дней, высокодозные режимы чередуются (альтернируются) с CHOP-подобными схемами: R-HyperCVAD/R-HMA [13, 28, 29], R-MaxiCHOP/R-HD-AraC [30, 31] - см. приложение А3. При высоком риске развития синдрома лизиса опухоли, особенно при гиперлейкоцитозе более 50,0 x 109/л, возможно исключение из первого курса терапии ритуксимаба** или проведение предфазы циклофосфамидом** и дексаметазоном**. Ряд европейских исследователей придерживаются схем индукционной терапии, включающих средние дозы цитарабина** в комбинации с цисплатином** (R-CHOP/R-DHAP) [32]. Однако снижение дозы в индукционной терапии нивелируется добавлением цитарабина** к тотальному облучению тела (ТОТ) во время предтрансплантационного кондиционирования.
- Пациентам с верифицированной ЛКМ моложе 65 лет без значимой коморбидности, являющимся кандидатами для проведения высокодозной терапии и аутоТГСК, рекомендуется при достижении ЧР или ПР проведение аутоТГСК в данном алгоритме:
- сбор аутологичных стволовых кроветворных клеток (получение костномозговой взвеси или цитаферез гемопоэтических клеток) с очисткой трансплантата in vivo от возможной контаминации CD20+ клетками ритуксимабом**;
- проведение режима кондиционирования режимом по выбору трансплантационного центра;
- трансплантация аутологичных гемопоэтических стволовых клеток (аутоТГСК) [14 - 16, 27].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии. В качестве кондиционирования (высокодозной консолидации) при ЛКМ в используются ТОТ в дозе 12 - 14 Гр со снижением дозы над легкими до 8 Гр в комбинации с цитостатическими препаратами (циклофосфамид**, этопозид**, мелфалан**, цитарабин**) или высокодозные схемы ПХТ.
Рандомизированных исследований различных режимов кондиционирования не существует. При анализе регистра EBMT (Европейского общества трансплантации костного мозга) преимущество ТОТ продемонстрировано только у пациентов с частичной ремиссией заболевания. При достижении полной ремиссии лучшей эффективностью и безопасностью обладает кондиционирование по схеме BEAM+/-R. В реальной клинической практике в России тотальное облучение тела на сегодняшний день практически не используется. В связи с нерегулярностью поставок кармустина** в режиме кондиционирования возможно использование ломустина** или бендамустина** 140 - 200 мг/м2 однократно.
- Пациентам с верифицированной ЛКМ моложе 65 лет без значимой коморбидности после проведения высокодозной терапии и аутоТГСК рекомендуется проведение поддерживающей терапии ритуксимабом** 375 мг/м2 в/в 1 раз в 2 месяца в течение 3 лет [33].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии. В рандомизированном исследовании Le Gouill с соавторами в группе пациентов, получавших поддерживающую терапию ритуксимабом** с началом через 3 месяца после аутоТГСК, отмечено статистически достоверное улучшение БСВ и ОВ по сравнению с пациентами без поддерживающей терапии.
- Пациентам с верифицированной ЛКМ моложе 65 лет без значимой коморбидности после проведения высокодозной терапии и аутоТГСК рекомендуется проведение контрольных обследований - КТ, при необходимости - ультразвуковое исследование (УЗИ), а также контроль минимальной остаточной болезни в периферической крови и костном мозге [4, 5, 34, 35].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: эндоскопические методы исследования, особенно фиброколоноскопию, целесообразно выполнять у пациентов с вовлечением ЖКТ 1 раз в 6 мес. Большинство рецидивов возникают в течение первых 3 лет после аутоТГСК. Динамическое наблюдение после аутоТГСК проводится не менее 5 лет с интервалом 3 - 6 мес.
- Пациентам моложе 65 лет с верифицированной ЛКМ с бластоидным вариантом заболевания, гиперлейкоцитозом и/или при наличии симптомов вовлечения ЦНС рекомендуется профилактика нейролейкемии - спинномозговые пункции с введением стандартного набора препаратов в спинномозговой канал в соответствии с рекомендациями для агрессивных B-клеточных нефолликулярных лимфом с высоким риском поражения ЦНС [3, 36].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам моложе 65 лет с ЛКМ с бластоидным вариантом, сочетающимся с высоким риском по шкале MIPIb и гиперлейкоцитозом более 40 - 50 x 109/л, которые расцениваются как пациенты крайне высокого риска, после выполнения интенсивной индукционной терапии и аутоТГСК рекомендуется консультация в трансплантологическом центре с целью рассмотрения возможности выполнения трансплантации аллогенного костного мозга в 1-й ремиссии болезни ("тандемной" трансплантация) [37].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.2.2. Терапия рецидивов
Противорецидивная терапия определяется схемой индукционной терапии и продолжительностью ремиссии.
- Пациентам с рецидивом ЛКМ рекомендуется один из следующих терапевтических подходов (описание режимов - см. приложение А3) [38]:
- высокие/средние дозы цитарабина** + бортезомиб** (R-HAD-B) у пациентов, получавших в качестве 1-й линии терапии только CHOP-подобные или флударабин**-содержащие схемы [39];
- платиносодержащие курсы терапии (R-GemOx, R-GIFOX) у пациентов с рецидивами после высокодозного цитарабина и аутоТГСК [40 - 42];
- комбинации бендамустина** с ритуксимабом** (BR) и/или цитарабином** (R-BAC) или бортезомибом** у пациентов с рецидивами после высокодозного цитарабина и аутоТГСК [17, 18, 43];
- ибрутиниб** в монорежиме или в комбинации с ритуксимабом** [44 - 47];
- леналидомид** в монорежиме или в комбинации с ритуксимабом** [48, 49].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Пациентам с рецидивом ЛКМ после длительной (более 3 лет) ремиссии, ранее не получавшим высокодозную химиотерапию с аутоТГСК, в случае ответа на терапию 2-й линии рекомендуется консолидация высокодозной химиотерапией с аутоТГСК [38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам моложе 60 лет с рецидивом ЛКМ рекомендуется консультация в трансплантологическом центре относительно возможности выполнения аллогенной трансплантации костного мозга и, в случае наличия возможности (отсутствие противопоказаний, наличие подходящего донора, химиочувствительный рецидив), - выполнение аллоТКМ с немиелоаблативным режимом кондиционирования [50].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии. АллоТКМ является единственным методом, позволяющим вылечить пациента с ЛКМ. Возможность ее проведения определяется химиочувствительностью опухоли, возрастом и коморбидностью пациента, а также наличием донора. Длительная ОВ после аллоТКМ достигает 40 - 50%. Ранние рецидивы после интенсивной индукционной терапии и аутоТГСК фактически некурабельны. Выполнение аллоТКМ в этой группе пациентов не позволяет достигнуть ремиссии, в первую очередь, из-за отсутствия достаточного времени для развития реакции трансплантата против опухоли. Возможно, эффект будет достигнут после включения в схемы противорецидивной терапии новых препаратов, например ибрутиниба.
3.3. Распространенные стадии у пациентов старше 65 лет и пациентов, не являющихся кандидатами для проведения интенсивной терапии
3.3.1. Первая линия терапии
Целью терапии в этой группе является достижение ремиссии и ее поддержание нехимиотерапевтическими агентами. Выбор тактики, в первую очередь, определяется соматическим статусом пациента, наличием сопутствующей патологии и признаков почечной недостаточности. Проводится 6 - 8 курсов индукционной ПХТ с последующей поддержкой ритуксимабом**. В ряде случаев у соматически сохранных пациентов в возрасте до 70 лет возможно выполнение аутоТГСК (режим кондиционирования BEAM-R) [51].
- Пациентам с верифицированной ЛКМ старше 65 лет в удовлетворительном соматическом состоянии, однако не являющимся кандидатами для проведения интенсивной терапии, рекомендовано проведение одного из следующих режимов терапии (на выбор лечащего врача, описание режимов - см. приложение А3):
- бендамустин-содержащие режимы RB, R-BAC, RiBVD [17, 18, 52, 53];
- R-CHOP [20];
- VR-CAP [54].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии. В проспективном рандомизированном исследовании эффективность режима R-B оказалась выше R-CHOP при более благоприятном профиле токсичности: медиана беспрогрессивной выживаемости составила 35,4 мес против 22,1 мес соответственно. Однако при более длительном наблюдении эффективность обоих режимов оказалась схожей. Применение флударабина** в 1-й линии терапии нецелесообразно из-за высокой токсичности. К более интенсивным вариантам индукции можно отнести схему R-BAC (ритуксимаб** 375 мг/м2 в 0 или 1 дни, бендамустин** 70 мг/м2 в 1 - 2 дни и цитарабин ** 500 мг/м2 в 1 - 3 дни 1 р/д). Применение более интенсивных режимов терапии сопряжено с высокой токсичностью и невыполнимостью плана терапии, что негативно сказывается на возможности достижения ЧР и ПР. Другим, довольно интенсивно применяемым во Франции режимом терапии является комбинация RiBVD - ритуксимаб** 375 мг/м2 в 1 день, бендамустин** 90 мг/м2 в 1 - 2 дни, бортезомиб** 1,3 мг/м2 в 1, 4, 8 и 11 дни и дексаметазон** 40 мг во 2 день однократно, шесть 28-дневных циклов. Частота достижения полных ремиссий составляет 75%, а беспрогрессивная выживаемость достигает 70% в течение 2 лет. Схема VR-CAP, подразумевающая включение бортезомиба** в дозе 1,3 мг/м2 п/к в 1, 4, 8 и 11 дни в режим R-CHOP (с исключением #винкристина**) продемонстрировала улучшение не только БСВ, но ОВ с умеренным увеличением токсичности и обратимыми эпизодами полинейропатии.
- Пациентам с верифицированной ЛКМ старше 65 лет с тяжелой сопутствующей патологией рекомендовано проведение одного из следующих режимов терапии (на выбор лечащего врача; описание режимов - см. приложение А3):
- R-CVP [20, 52];
- #кладрибин 0,12 мг/кг в 2 - 6 дни + ритуксимаб** 375 мг/м2 в/в в 1-ый день, цикл 28 дней [55].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии. Менее интенсивные схемы для пациентов с наличием тяжелой сопутствующей патологии: R-CVP, комбинации аналогов пуринов (#кладрибин) с ритуксимабом**, метрономная терапия R-PEPC. Возможно участие в клинических исследованиях 1-й линии терапии, так как применение новых малотоксичных таргетных препаратов позволит, по всей видимости, увеличить общую выживаемость в этой группе пациентов.
- Пациентам с верифицированной ЛКМ старше 65 лет и не являющихся кандидатами для проведения интенсивной терапии в случае достижения ремиссии после 1-й линии лечения рекомендуется поддерживающая терапия ритуксимабом** каждые 2 мес. в дозе 375 мг/м2 в течение 2 лет или до прогрессирования болезни [56].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2).
- Пациентам старше 65 лет с верифицированной ЛКМ с бластоидным вариантом заболевания, гиперлейкоцитозом и/или при наличии симптомов вовлечения ЦНС рекомендуется профилактика нейролейкемии - спинномозговые пункции с введением стандартного набора препаратов в спинномозговой канал в соответствии с рекомендациями для агрессивных B-клеточных нефолликулярных лимфом с высоким риском поражения ЦНС [3, 36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
3.3.2. Терапия рецидивов
- Пациентам старше 65 лет с верифицированной ЛКМ и не являющимся кандидатами для проведения интенсивной терапии при рецидиве рекомендовано применение одного из следующих терапевтических подходов (в зависимости от предшествующей терапии и состояния/коморбидности пациента, по решению лечащего врача; описание режимов - см. приложение А3):
- платиносодержащие курсы терапии (R-GemOx, R-GIFOX) [40, 41];
- комбинации бендамустина** с ритуксимабом** и/или цитарабином** или бортезомибом** у пациентов с рецидивами после высокодозного цитарабина и аутоТГСК [17, 43];
- #кладрибин + ритуксимаб** (если не применялся в 1-й линии) [57];
- ибрутиниб** в монорежиме или в комбинации с ритуксимабом** [44 - 47];
- леналидомид** в монорежиме или в комбинации с ритуксимабом** [48, 49]
- PEPC [58].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии. при развитии раннего рецидива наибольшей эффективностью обладает ибрутиниб**.
3.4 Сопроводительная терапия
- Пациентам с ЛКМ, получающим эметогенную терапию, рекомендуется профилактика тошноты и рвоты в соответствии с существующими профильными рекомендациями [59].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Всем пациентам с ЛКМ с исходно массивным поражением, получающим противоопухолевую терапию, рекомендовано проведение профилактики синдрома лизиса опухолей согласно существующим профильным рекомендациям [60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с ЛКМ со сниженной концентрацией гемоглобина крови рекомендовано лечение анемии осуществлять согласно существующим профильным рекомендациям [61, 62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Обезболивание
- Пациентам с ЛКМ при возникновении острого или хронического болевого синдрома рекомендуется уточнение этиологии боли; при выявлении очага воспаления - проведение необходимых мероприятий по лечению очага воспаления согласно соответствующим клиническим рекомендациям (включая при необходимости хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии), в том числе по показаниям - с применением опиоидных анальгетиков и психолептических лекарственных препаратов с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [63, 64].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Диетотерапия
Не применяется.
3.5 Оценка ответа на лечение
- Всем пациентам с ЛКМ в середине (после 2 - 3 цикла химиотерапии) и после индукционного курса лечения, а также после завершения всей программы лечения (химио- или химиолучевой терапии, поддерживающей терапии и т.д.) рекомендуется оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом (см. раздел 7.2 данных рекомендаций) [2, 65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии. Дополнительное обследование в процессе индукционного курса для оценки эффекта терапии проводится при наличии показаний - подозрении на недостаточную эффективность.
4. Реабилитация
- Всем пациентам с ЛКМ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация [66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии. Реабилитация пациентов с ЛКМ должна носить комплексный характер, охватывая медицинские и социально-психологические аспекты адаптации пациента к нормальной жизни. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
5. Профилактика
Методов профилактики ЛКМ в настоящее время не существует, поскольку неизвестны этиологические факторы, ведущие к развитию заболевания.
- Всем пациентам с ЛКМ на протяжении всей жизни пациента - как в период лечения, так и вне лечения - рекомендуется соблюдать предписания врача-гематолога по лечению, избегать провоцирующих заболевание факторов, изменить виды и условия труда на невредные и облегченные, ограничить инсоляции и физиотерапевтические методы лечения, планировать беременность [3, 38].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии. Диспансерное наблюдение врачом-гематологом или врачом-онкологом осуществляется в период лечения и после достижения ремиссии лимфомы.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ЛКМ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении ЛКМ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза ЛКМ (в случае отсутствия медицинских показаний к проведению патологоанатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с ЛКМ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ЛКМ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "онкология" определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по тяжести состояния, обусловленного опухолью, или по причине рисков осложнений, сопряженных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, в том числе включающее биопсии и инвазивные вмешательства в случаях, когда оно не может быть проведено амбулаторно.
Показания для экстренной госпитализации:
1. Развитие тяжелой инфекции (не обязательна госпитализация в гематологический стационар).
2. Развитие угрожающих жизни цитопений (глубокая анемия, геморрагический синдром, нейтропения).
3. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к выписке пациента из стационара:
1. Завершение курса терапии.
2. Завершение обследования.
3. Достижение ожидаемого эффекта от лечения.
4. В случаях, когда по решению врачебной комиссии пребывание пациента в стационаре не показано в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Определение групп прогноза
Клинической системой прогноза ЛКМ является международный прогностический индекс лимфомы из клеток мантии (MIPI). Его модификациями являются упрощенный индекс (sMIPI - табл. 3) или комбинированные индексы, учитывающие дополнительно количество клеток, экспрессирующих Ki-67 - MIPI-c и MIPIb [67].
Низкий риск по шкале MIPI - 5-летняя общая выживаемость (ОВ) составляет 60%. Промежуточный риск по шкале MIPI - медиана ОВ составляет 51 мес. Высокий риск по шкале MIPI - медиана ОВ составляет 29 мес.
Таблица 3. Упрощенный вариант международного прогностического индекса ЛКМ sMIPI
Баллы
Возраст, годы
ECOG
ЛДГ,
X/верхняя граница нормы
Лейкоциты, X x 109/л
0
< 50
0 - 1
< 0,67
< 6,7
1
50 - 59
-
0,67 - 0,99
6,7 - 9,9
2
60 - 69
2 - 4
1,00 - 1,49
10,0 - 14,9
3
>= 70
-
>= 1,50
>= 15,0
Каждый прогностический фактор оценивается от 0 до 3 баллов, которые потом суммируются (максимально 11 баллов). Пациенты, набравшие от 0 до 3 баллов, относятся к группе низкого риска; 4 - 5 баллов - к группе промежуточного риска; 6 - 11 баллов - к группе высокого риска. Влияние концентрации ЛДГ оценивалось путем деления концентрации ЛДГ сыворотки пациента на значение верхней нормы лаборатории (например, у пациента концентрация ЛДГ на момент установления диагноза 390 Е/л, а лабораторные нормы составляют 250 - 480 Е/л; тогда проводится деление 390 / 480 = 0,81, что соответствует 1 баллу).
Расчет комбинированного биологического варианта международного прогностического индекса ЛКМ MIPIb [68]:
MIPIb = 0,03535 x возраст (годы)
+ 0,6978 (если ECOG > 1)
+ 1,367 x log10 (ЛДГ/верхняя граница нормы ЛДГ)
+ 0,9393 x log10 (число лейкоцитов)
+ 0,02142 x Ki-67 (%)
Группы риска при расчете MIPIb:
1. Низкий: MIPIb < 5,7.
2. Промежуточный: 5,7 < MIPIb < 6,5.
3. Высокий: MIPIb > 6,5.
Применение индекса MIPIb позволяет избежать случаев включения молодых пациентов с бластоидным вариантом заболевания в группу низкого риска.
Другими независимыми факторами неблагоприятного прогноза являются бластоидный вариант заболевания, высокий (Ki-67 > 30%) пролиферативный индекс, делеции и мутации TP53.
Другими, наиболее часто выделяемыми факторами неблагоприятного прогноза являются бластоидный вариант заболевания и высокий (Ki-67 > 30%) пролиферативный индекс, а также высокий уровень ![]() микроглобулина.
микроглобулина.
6.2 Оценка ответа на лечение
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по лимфомам в 2007 году [65].
Полная ремиссия (ПР):
1. Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
2. Размеры лимфатических узлов:
a. <= 1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см
b. <= 1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1 см
3. Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
4. Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 2 недель или констатируется дальнейшее улучшение.
Неуверенная полная ремиссия (ПРн) констатируется только у пациентов, которым не выполнялась ПЭТ-КТ для оценки эффекта:
1. Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших ее диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
2. По другим показателям - соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
1. Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3 см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 см, достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
2. Отсутствие новых очагов поражения, отсутствие признаков увеличение какого-либо из ранее диагностированных очагов поражения.
3. В случае исходного поражения костного мозга, статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Пациенты с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация
Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации)
1. Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
2. Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении - увеличение до 1,5 см и более.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Пациенту с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии после завершения терапии, при контрольных обследованиях, при подозрении на рецидив заболевания выполнен развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов
Да/Нет
2
Пациенту с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии после завершения терапии, при контрольных обследованиях, при подозрении на рецидив заболевания выполнен биохимический анализ крови (общий белок, альбумин, мочевина, креатинин, мочевая кислота, аланинамитотрансфераза, аспартатаминотрансфераза, общий и прямой билирубин, лактатдегидрогеназа, щелочная фосфатаза, натрий, калий, хлориды, общий кальций)
Да/Нет
3
Пациенту с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии после завершения терапии, при контрольных обследованиях, при подозрении на рецидив заболевания выполнена компьютерная томография шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием), или, при наличии противопоказаний к КТ, рентгенография органов грудной клетки в двух проекциях и ультразвуковое исследование лимфатических узлов и внутренних органов
Да/Нет
4
Первичному пациенту с подозрением на ЛКМ выполнена биопсия лимфоузла или другого очага поражения и патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла или другого очага поражения с применением иммуногистохимических методов
Да/Нет
5
Пациенту с ЛКМ с лимфоцитозом в общем анализе крови или в миелограмме (независимо от числа лейкоцитов) выполнено исследование биологического материала (периферической крови или костного мозга) методом проточной цитофлуориметрии
Да/Нет
6
Первичному пациенту с подозрением на рецидив ЛКМ выполнено получение гистологического препарата костного мозга, патологоанатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов
Да/Нет
7
Пациенту с подозрением на ЛКМ или с выявленной ЛКМ при первичном или повторном приеме, при оценке ремиссии после завершения терапии, при контрольных обследованиях, при подозрении на рецидив заболевания выполнена электрокардиография
Да/Нет
Список литературы
1. Carbone P.P. et al. Report of the Committee on Hodgkin's Disease Staging Classification//Cancer Res. 1971. Vol. 31, N 11. P. 1860 - 1861.
2. Демина Е.А. et al. Общие принципы диагностики лимфом//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9 - 27.
3. Воробьев В.И., Тумян Г.С. Лимфома из клеток мантии//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 68 - 80.
4. Zelenetz A.D. et al. B-cell lymphomas. NCCN Clinical Practice Guidelines in Oncology. Version 5. 2019.
5. Dreyling M. et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up//Ann. Oncol. 2017. Vol. 28, N Supplement 4. P. iv62 - iv71.
6. Gill S. et al. [18F]Fluorodeoxyglucose positron emission tomography scanning for staging, response assessment, and disease surveillance in patients with mantle cell lymphoma//Clin. Lymphoma Myeloma. Cancer Information Group, LP, 2008. Vol. 8, N 3. P. 159 - 165.
7. Sun T. et al. Fluorescence in situ hybridization: method of choice for a definitive diagnosis of mantle cell lymphoma.//Am. J. Hematol. 2003. Vol. 74, N 1. P. 78 - 84.
8. Alavi A. et al. Fluorodeoxyglucose-positron-emission tomography findings in mantle cell lymphoma//Clin. Lymphoma, Myeloma Leuk. 2011. Vol. 11, N 3. P. 261 - 266.
9. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in Cancer (IARC)/ed. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p.
10. Howard O.M. et al. Rituximab and CHOP Induction Therapy for Newly Diagnosed Mantle-Cell Lymphoma: Molecular Complete Responses Are Not Predictive of Progression-Free Survival//J. Clin. Oncol. 2002. Vol. 20, N 5. P. 1288 - 1294.
11. LaCasce A.S. et al. Comparative outcome of initial therapy for younger patients with mantle cell lymphoma: an analysis from the NCCN NHL Database.//Blood. 2012. Vol. 119, N 9. P. 2093 - 2099.
12. Lenz G. et al. Immunochemotherapy with rituximab and cyclophosphamide, doxorubicin, vincristine, and prednisone significantiy improves response and time to treatment failure, but not long-term outcome in patients with previously untreated mantle cell lymphoma: Results of a prospective randomized trial of the German Low Grade Lymphoma Study Group (GLSG)//J. Clin. Oncol. 2005. Vol. 23, N 9. P. 1984 - 1992.
13. Bernstein S.H. et al. A phase II multicenter trial of hyperCVAD MTX/Ara-C and rituximab in patients with previously untreated mantle cell lymphoma; SWOG 0213//Ann. Oncol. 2013. Vol. 24, N 6. P. 1587 - 1593.
14. Damon L.E. et al. Immunochemotherapy and autologous stem-cell transplantation for untreated patients with mantle-cell lymphoma: CALGB 59909//J. Clin. Oncol. 2009. Vol. 27, N 36. P. 6101 - 6108.
15. Dreyling M. et al. Early consolidation by myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission significantly prolongs progression-free survival in mantle-cell lymphoma: results of a prospective randomized trial of the European MCL Network.//Blood. 2005. Vol. 105, N 7. P. 2677 - 2684.
16. Fenske T.S., Carreras T., Zhang M. Outcome of patients with mantle-cell lymphoma undergoing autologous versus reduced-intensity allogenic transplantation//Ann. Oncol. 2011. Vol. 22, N Suppl. 4. P. Abstract 018.
17. Visco C. et al. Combination of rituximab, bendamustine, and cytarabine for patients with mantle-cell non-Hodgkin lymphoma ineligible for intensive regimens or autologous transplantation//J. Clin. Oncol. 2013. Vol. 31, N 11. P. 1442 - 1449.
18. Rummel M.J. et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: An open-label, multicentre, randomised, phase 3 non-inferiority trial//Lancet. Lancet Publishing Group, 2013. Vol. 381, N 9873. P. 1203 - 1210.
19. Geisler C.H. Front-line therapy of mantle cell lymphoma//Haematologica. 2010. Vol. 95. P. 1241 - 1243.
20. Kluin-Nelemans H.C. et al. Treatment of older patients with mantle-cell lymphoma//N. Engl. J. Med. Massachussetts Medical Society, 2012. Vol. 367, N 6. P. 520 - 531.
21. Kahl B.S. et al. Maintenance rituximab following induction chemoimmunotherapy may prolong progression-free survival in mantle cell lymphoma: A pilot study from the Wisconsin Oncology Network//Ann. Oncol. 2006. Vol. 17, N 9. P. 1418 - 1423.
22. Hilal T. et al. Rituximab maintenance therapy for mantle cell lymphoma: A systematic review and meta-analysis.//Am. J. Hematol. 2018. Vol. 93, N 10. P. 1220 - 1226.
23. Rule S. et al. Outcomes in 370 patients with mantle cell lymphoma treated with ibrutinib: a pooled analysis from three open-label studies.//Br. J. Haematol. 2017. Vol. 179, N 3. P. 430 - 438.
24. Ruan J. et al. Five-year follow-up of lenalidomide plus rituximab as initial treatment of mantle cell lymphoma//Blood. American Society of Hematology, 2018. Vol. 132, N 19. P. 2016 - 2025.
25. Romaguera J.E. et al. Ten-year follow-up after intense chemoimmunotherapy with Rituximab-HyperCVAD alternating with Rituximab-high dose methotrexate/cytarabine (R-MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma.//Br. J. Haematol. 2010. Vol. 150, N 2. P. 200 - 208.
26. Martin P. et al. Outcome of deferred initial therapy in mantle-cell lymphoma//J. Clin. Oncol. 2009. Vol. 27, N 8. P. 1209 - 1213.
27. Hermine O. et al. Addition of high-dose cytarabine to immunochemotherapy before autologous stem-cell transplantation in patients aged 65 years or younger with mantle cell lymphoma (MCL Younger): a randomised, open-label, phase 3 trial of the European Mantle Cell Lymphoma Network//Lancet. Lancet Publishing Group, 2016. Vol. 388, N 10044. P. 565 - 575.
28. Merli F. et al. Rituximab plus HyperCVAD alternating with high dose cytarabine and methotrexate for the initial treatment of patients with mantle cell lymphoma, a multicentre trial from Gruppo Italiano Studio Linfomi.//Br. J. Haematol. 2012. Vol. 156, N 3. P. 346 - 353.
29. Chihara D. et al. Rituximab plus hyper-CVAD alternating with MTX/Ara-C in patients with newly diagnosed mantle cell lymphoma: 15-year follow-up of a phase II study from the MD Anderson Cancer Center.//Br. J. Haematol. 2016. Vol. 172, N 1. P. 80 - 88.
30. Geisler C.H. et al. Nordic MCL2 trial update: Six-year follow-up after intensive immunochemotherapy for untreated mantle cell lymphoma followed by BEAM or BEAC + autologous stem-cell support: Still very long survival but late relapses do occur//Br. J. Haematol. 2012. Vol. 158, N 3. P. 355 - 362.
31. Eskelund C.W. et al. 15-year follow-up of the Second Nordic Mantle Cell Lymphoma trial (MCL2): prolonged remissions without survival plateau.//Br. J. Haematol. 2016. Vol. 175, N 3. P. 410 - 418.
32. Pott C. et al. R-CHOP/R-DHAP Compared to R-CHOP Induction Followed by High Dose Therapy with Autologous Stem Cell Transplantation Induces Higher Rates of Molecular Remission In MCL: Results of the MCL Younger Intergroup Trial of the European MCL Network//Blood. 2010. Vol. 116, N 21.
33. Le Gouill S. et al. Rituximab after autologous stem-cell transplantation in mantle-cell lymphoma//N. Engl. J. Med. Massachussetts Medical Society, 2017. Vol. 377, N 13. P. 1250 - 1260.
34. Hoster E., Pott C. Minimal residual disease in mantle cell lymphoma: insights into biology and impact on treatment.//Hematol. Am. Soc. Hematol. Educ. Progr. 2016. Vol. 2016, N 1. P. 437 - 445.
35. Cheminant M. et al. Minimal residual disease monitoring by 8-color flow cytometry in mantle cell lymphoma: an EU-MCL and LYSA study.//Haematologica. 2016. Vol. 101, N 3. P. 336 - 345.
36. Gatt M.E., Grisaro S. Central nervous system prophylaxis in mantle cell lymphoma//Blood. American Society of Hematology, 2009. Vol. 114, N 26. P. 5402 - 5403.
37. Crocchiolo R. et al. Tandem autologous-allogeneic stem cell transplantation as a feasible and effective procedure in high-risk lymphoma patients//Haematologica. Ferrata Storti Foundation, 2015. Vol. 100, N 10. P. e423 - e427.
38. Dreyling M. et al. Treatment for patients with relapsed/refractory mantle cell lymphoma: European-based recommendations//Leuk. Lymphoma. Taylor and Francis Ltd, 2018. Vol. 59, N 8. P. 1814 - 1828.
39. Weigert O. et al. High Dose Cytarabine Salvage Regimen Combined with Bortezomib Is Feasible and Highly Effective in Relapsed Mantle Cell Lymphoma.//Blood. 2006. Vol. 108, N 11. P. 2449 - 2449.
40. Gironella M. et al. Rituximab Plus Gemcitabine and Oxaliplatin As Salvage Therapy in Patients with Relapsed/Refractory Mantle-Cell Lymphoma//Blood. 2012. Vol. 120, N 21.
41. Corazzelli G. et al. Gemcitabine, ifosfamide, oxaliplatin and rituximab (R-GIFOX), a new effective cytoreductive/mobilizing salvage regimen for relapsed and refractory aggressive non-Hodgkin's lymphoma: Results of a pilot study//Annals of Oncology. 2006. Vol. 17, N SUPPL. 4.
42. Corazzelli G. et al. Long-term results of gemcitabine plus oxaliplatin with and without rituximab as salvage treatment for transplant-ineligible patients with refractory/relapsing B-cell lymphoma.//Cancer Chemother. Pharmacol. 2009. Vol. 64, N 5. P. 907 - 916.
43. Friedberg J.W. et al. The combination of bendamustine, bortezomib, and rituximab for patients with relapsed/refractory indolent and mantle cell non-Hodgkin lymphoma//Blood. 2011. Vol. 117, N 10. P. 2807 - 2812.
44. Wang M.L. et al. Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma//N. Engl. J. Med. Massachussetts Medical Society, 2013. Vol. 369, N 6. P. 507 - 516.
45. Wang M.L. et al. Long-term follow-up of MCL patients treated with single-agent ibrutinib: Updated safety and efficacy results // Blood. American Society of Hematology, 2015. Vol. 126, N 6. P. 739 - 745.
46. Dreyling M. et al. Ibrutinib versus temsirolimus in patients with relapsed or refractory mantle-cell lymphoma: An international, randomised, open-label, phase 3 study//Lancet. Lancet Publishing Group, 2016. Vol. 387, N 10020. P. 770 - 778.
47. Wang M.L. et al. Ibrutinib in combination with rituximab in relapsed or refractory mantle cell lymphoma: a single-centre, open-label, phase 2 trial.//Lancet. Oncol. 2016. Vol. 17, N 1. P. 48 - 56.
48.  M. et al. Lenalidomide versus investigator's choice in relapsed or refractory mantle cell lymphoma (MCL-002; SPRINT): a phase 2, randomised, multicentre trial.//Lancet. Oncol. 2016. Vol. 17, N 3. P. 319 - 331.
M. et al. Lenalidomide versus investigator's choice in relapsed or refractory mantle cell lymphoma (MCL-002; SPRINT): a phase 2, randomised, multicentre trial.//Lancet. Oncol. 2016. Vol. 17, N 3. P. 319 - 331.
49. Chong E.A. et al. Combination of Lenalidomide and Rituximab Overcomes Rituximab Resistance in Patients with Indolent B-cell and Mantle Cell Lymphomas.//Clin. Cancer Res. 2015. Vol. 21, N 8. P. 1835 - 1842.
50. Le Gouill S. et al. Reduced-intensity conditioning allogeneic stem cell transplantation for relapsed/refractory mantle cell lymphoma: A multicenter experience//Ann. Oncol. 2012. Vol. 23, N 10. P. 2695 - 2703.
51. Soubeyran P., Gressin R. Treatment of the elderly patient with mantle cell lymphoma//Hematology. Bulgarian Medical Society of Hematology, 2016. Vol. 2016, N 1. P. 425 - 431.
52. Flinn I.W. et al. Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in first-line treatment of indolent NHL or MCL: the BRIGHT study//Blood. American Society of Hematology, 2014. Vol. 123, N 19. P. 2944 - 2952.
53. Gressin R. et al. Frontline Therapy with the Ribvd Regimen Elicits High Clinical and Molecular Response Rates and Long PFS in Elderly Patients Mantle Cell Lymphoma (MCL); Final Results of a Prospective Phase II Trial By the Lysa Group//Blood. 2014. Vol. 124, N 21. P. 148 - 148.
54. Robak T. et al. Frontline bortezomib, rituximab, cyclophosphamide, doxorubicin, and prednisone (VR-CAP) versus rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) in transplantation-ineligible patients with newly diagnosed mantle cell lymphoma: final overall survival results of a randomised, open-label, phase 3 study//Lancet Oncol. Lancet Publishing Group, 2018. Vol. 19, N 11. P. 1449 - 1458.
55. Spurgeon S.E. et al. Cladribine plus rituximab is an effective therapy for newly diagnosed mantle cell lymphoma.//Leuk. Lymphoma. 2011. Vol. 52, N 8. P. 1488 - 1494.
56. Kluin-Nelemans H.C. et al. Treatment of Older Patients With Mantle Cell Lymphoma (MCL): Long-Term Follow-Up of the Randomized European MCL Elderly Trial//J. Clin. Oncol. NLM (Medline), 2020. Vol. 38, N 3. P. 248 - 256.
57. Robak T. et al. Rituximab combined with cladribine or with cladribine and cyclophosphamide in heavily pretreated patients with indolent lymphoproliferative disorders and mantle cell lymphoma//Cancer. 2006. Vol. 107, N 7. P. 1542 - 1550.
58. Coleman M. et al. Prednisone, etoposide, procarbazine, and cyclophosphamide (PEP-C) oral combination chemotherapy regimen for recurring/refractory lymphoma: low-dose metronomic, multidrug therapy.//Cancer. 2008. Vol. 112, N 10. P. 2228 - 2232.
59. Владимирова Л.Ю. et al. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных//Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 502 - 511.
60. Барях Е.А., Мякова Н.В., Поддубная И.В. Профилактика и лечение синдрома лизиса опухоли//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 251 - 253.
61. Aapro M. et al. Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. М.: Ассоциация онкологов России, 2014.
62. Орлова Р.В. et al. Практические рекомендации по лечению анемии при злокачественных новообразованиях//Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 494 - 501.
63. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
64. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278 - 288.
65. Cheson B.D. et al. Revised response criteria for malignant lymphoma//Journal of Clinical Oncology. 2007. Vol. 25, N 5. P. 579 - 586.
66. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
67. Hoster E. et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma.//Blood. 2008. Vol. 111, N 2. P. 558 - 565.
68. Schaffel R. et al. Prognostic impact of proliferative index determined by quantitative image analysis and the international prognostic index in patients with mantle cell lymphoma//Ann. Oncol. 2010. Vol. 21, N 1. P. 133 - 139.
69. Yelvington B.J. Subcutaneous Rituximab in Follicular Lymphoma, Chronic Lymphocytic Leukemia, and Diffuse Large B-Cell Lymphoma.//J. Adv. Pract. Oncol. Harborside Press, 2018. Vol. 9, N 5. P. 530 - 534.
70. Davies A. et al. Subcutaneous Rituximab for the Treatment of B-Cell Hematologic Malignancies: A Review of the Scientific Rationale and Clinical Development//Advances in Therapy. Springer Healthcare, 2017. Vol. 34, N 10. P. 2210 - 2231.
71.  R. et al. Safety of switching from intravenous to subcutaneous rituximab during first-line treatment of patients with non-Hodgkin lymphoma: the Spanish population of the MabRella study//Br. J. Haematol. Blackwell Publishing Ltd, 2020. Vol. 188, N 5. P. 661 - 673.
R. et al. Safety of switching from intravenous to subcutaneous rituximab during first-line treatment of patients with non-Hodgkin lymphoma: the Spanish population of the MabRella study//Br. J. Haematol. Blackwell Publishing Ltd, 2020. Vol. 188, N 5. P. 661 - 673.
72. Macdonald D. et al. A canadian perspective on the subcutaneous administration of rituximab in non-Hodgkin lymphoma//Current Oncology. Multimed Inc., 2017. Vol. 24, N 1. P. 33 - 39.
73. Delarue R. et al. CHOP and DHAP plus rituximab followed by autologous stem cell transplantation in mantle cell lymphoma: A phase 2 study from the Groupe d'Etude des Lymphomes de l'Adulte//Blood. American Society of Hematology, 2013. Vol. 121, N 1. P. 48 - 53.
74. Geisler C.H. et al. Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem cell rescue: A nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group//Blood. 2008. Vol. 112, N 7. P. 2687 - 2693.
75. Dreyling M., Ferrero S., Hermine O. How to manage mantle cell lymphoma//Leukemia. Nature Publishing Group, 2014. Vol. 28, N 11. P. 2117 - 2130.
76. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Воробьев Владимир Иванович - к.м.н., врач-гематолог гематологического отделения ГБУЗ "Городская клиническая больница им. С.П. Боткина" Департамента здравоохранения города Москвы, член Российского общества онкогематологов.
2. Тумян Гаяне Сергеевна - д.м.н., профессор, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии непрерывного профессионального образования Минздрава России, ведущий научный сотрудник отделения химиотерапии гемобластозов "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член правления Российского общества онкогематологов.
3. Фалалеева Наталья Александровна - д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
4. Птушкин Вадим Вадимович - д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ "ГКБ им. С.П. Боткина", главный внештатный специалист-гематолог Департамента здравоохранения города Москвы, член Национального гематологического общества и Российского общества онкогематологов.
5. Османов Евгений Александрович - д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Российского общества онкогематологов.
6. Поддубная Ирина Владимировна - академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
7. Байков Вадим Валентинович - д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
8. Ковригина Алла Михайловна - д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением "НМИЦ гематологии" Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
9. Невольских Алексей Алексеевич - д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
10. Иванов Сергей Анатольевич - профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
11. Хайлова Жанна Владимировна - кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
12. Геворкян Тигран Гагикович - заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина".
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи.
2. Врачи-онкологи.
3. Студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
- поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
- поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных мета анализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 4, 5).
В настоящих клинических рекомендациях в скобках приведены уровни доказательности рекомендаций в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа.
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования.
4
Несравнительные исследования, описание клинического случая.
5
Имеется лишь обоснование механизма действия или мнение экспертов.
Таблица 2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор РКИ с применением метаанализа.
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа.
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования.
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль".
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов.
Таблица 3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными).
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными).
C
Слабая рекомендация (отсутствие доказательств надлежащего качества, все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными).
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций. Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017 - 2018 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний "Лимфорум", ежегодной Российской конференции с международным участием "Злокачественные лимфомы", а также в рамках IV Конгресса гематологов России.
Окончательная редакция. Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Режимы лекарственного лечения
R-CHOP [54]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Доксорубицин** 50 мг/м2 в/в кап., день 1.
- Циклофосфамид** 750 мг/м2 в/в кап., день 1.
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1.
- Преднизолон** 100 мг внутрь, дни 1 - 5.
Лечение возобновляется на 22 день.
R-CVP [52]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Циклофосфамид** 750 мг/м2 в/в кап., день 1.
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1.
- Преднизолон** 100 мг внутрь, дни 1 - 5.
Лечение возобновляется на 22 день.
RB [18]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Бендамустин** 90 мг/м2 в/в кап., дни 1, 2.
Лечение возобновляется на 29 день.
R-BAC [17]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 1 [69 - 72].
- Бендамустин** 70 мг/м2 в/в кап., дни 2, 3.
- Цитарабин** 800 мг/м2 в/в кап., дни 2 - 4.
Лечение возобновляется на 29 день.
Бендамустин** + бортезомиб** + ритуксимаб** [43]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Бендамустин** 90 мг/м2 в/в кап., дни 1, 4.
- Бортезомиб** 1,3 мг/м2 в/в кап., дни 1, 4, 8, 11.
Лечение возобновляется на 29 день.
VR-CAP [54]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Бортезомиб** 1,3 мг/м2 п/к, дни 1, 4, 8, 11.
- Доксорубицин** 50 мг/м2 в/в кап. (короткая инфузия 20 мин), день 1.
- Циклофосфамид** 750 мг/м2 в/в кап., день 1.
- Преднизолон** 100 мг внутрь или в/в, дни 1 - 5.
Лечение возобновляется на 22 день.
R-HyperCVAD/R-HMA [28]
Циклы 1, 3, 5, 7 (HyperCVAD):
-
- Циклофосфамид** 300 мг/м2 в/в каждые 12 ч, дни 1 - 3 (всего 6 введений).
- Дексаметазон** 40 мг в/в или внутрь, дни 1 - 4, 11 - 14.
- Доксорубицин** 50 мг/м2 в/в непрерывной 48-часовой инфузией в центральный катетер, дни 4 - 5 (по 25 мг/м2/сут).
- #Винкристин** 2 мг в/в, дни 4, 11.
Циклы 2, 4, 6, 8 (HMA):
-
- Метотрексат** 1000 мг/м2 в/в непрерывной 24-часовой инфузией (200 мг/м2 болюсно, затем 800 мг/м2 за 24 часа) день 1.
- Цитарабин** 3 г/м2 (у пациентов старше 60 лет - 1 г/м2) в/в каждые 12 ч, дни 2 - 3 (всего 4 введения).
- Ритуксимаб** 375 мг/м2 в/в или #ритуксимаб** 1400 мг п/к (кроме первого введения - [69 - 72]), день 0 или 1 каждого цикла.
R-CHOP/R-DHAP [73]
Циклы 1, 3, 5 (R-CHOP)
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Доксорубицин** 50 мг/м2 в/в кап., день 1.
- Циклофосфамид** 750 мг/м2 в/в кап., день 1.
- Этопозид** 75 мг/м2 в/в, день 1.
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1.
- Преднизолон** 40 мг/м2 внутрь, дни 1 - 5.
Циклы 2, 4, 6 (R-DHAP)
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1
или
-
- #ритуксимаб** 1400 мг п/к, день 1 [69 - 72].
- #Цисплатин** 100 мг/м2 в/в постоянная инфузия за 24 часа (при почечной недостаточности цисплатин заменяется на #оксалиплатин 120 мг/м2 за 6 ч).
- Цитарабин** 2000 мг/м2 2 раза в день, день 2 (всего 2 введения).
- Дексаметазон** 40 мг в/в, дни 1 - 4.
Лечение возобновляется на 22 день или после восстановления показателей периферической крови.
R-MaxiCHOP/R-HAD [74]
Циклы 1, 3, 5, (R-MaxiCHOP)
-
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Циклофосфамид** 1200 мг/м2 в/в, день 1.
-
- Доксорубицин** 75 мг/м2 в/в, день 1.
- #Винкристин** 2 мг в/в, день 1.
- Преднизолон** 100 мг в/в или внутрь, дни 1 - 5.
Циклы 2, 4, 6 (R-HAD)
-
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1
или
-
-
- #Ритуксимаб** 1400 мг п/к, день 1 [69 - 72].
- Цитарабин** 3000 мг/м2 (у пациентов старше 60 лет - 2 г/м2) в/в каждые 12 ч, дни 2 - 3 (всего 4 введения).
-
- Дексаметазон** 40 мг в/в, дни 1 - 4.
Лечение возобновляется на 22 день или после восстановления показателей периферической крови, проводится 6 - 8 курсов терапии.
R-CHOP/R-HAD [75]
Циклы 1, 3, 5, 7 (R-CHOP)
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Доксорубицин** 50 мг/м2 в/в кап., день 1.
- Циклофосфамид** 750 мг/м2 в/в кап., день 1.
- Этопозид** 75 мг/м2 в/в, день 1.
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1.
- Преднизолон** 40 мг/м2 внутрь, дни 1 - 5.
Циклы 2, 4, 6, 8 (R-HAD)
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1
или
-
- #ритуксимаб** 1400 мг п/к, день 1 [69 - 72].
- Цитарабин** 3000 мг/м2 (при концентрации креатинина в сыворотке более 150 мкмоль/л и у пациентов старше 60 лет - 2000 мг/м2) в/в каждые 12 ч, дни 2 - 3 (всего 4 введения).
- Дексаметазон** 40 мг в/в, дни 1 - 4.
Лечение возобновляется на 22 день или после восстановления показателей периферической крови, проводится 6 - 8 курсов терапии.
R-HAD + B [39]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- Цитарабин** 2000 мг/м2 (у пациентов старше 60 лет - 1000 мг/м2) в/в, дни 2 - 3.
- #Бортезомиб** 1,5 мг/м2 в/в, дни 1, 4.
- Дексаметазон** 40 мг в/в, дни 1 - 4.
Лечение возобновляется на 22 день
R-GemOx [40, 42]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 0 или 1 [69 - 72].
- #Гемцитабин** 1200 мг/м2 в/в кап., день 1.
- #Оксалиплатин** 120 мг/м2 в/в кап., день 2.
R-GIFOX [41]
- Ритуксимаб**:
- 375 мг/м2 в/в кап., день 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 1 [69 - 72]
- #Гемцитабин** 1000 мг/м2 в/в кап., день 2.
- #Оксалиплатин** 130 мг/м2 в/в кап., день 3.
- Ифосфамид** 5000 мг/м2 в/в кап. (с месной**), день 3 в виде 24-часовой однократной инфузии у пациентов в возрасте младше 66 лет, или фракционированной в течение 3 дней (дни 3 - 5) у пациентов в возрасте > 65 лет.
PEPC [58].
- Преднизолон** 20 мг внутрь.
- Циклофосфамид** 50 мг внутрь.
- Этопозид** 50 мг внутрь.
- Прокарбазин** 50 мг внутрь.
При режиме PEPC препараты принимаются ежедневно до снижения уровня лейкоцитов ниже 3 x 109/л. Прием возобновляется после восстановления показателей крови в ежедневном режиме, через день или в фракционированном режиме (5 дней в неделю, 2 дня перерыв) в зависимости от индивидуальной переносимости. Ежедневная доза препаратов всегда остается постоянной, возможно только изменение количества дней в неделю, в которые принимаются препараты.
Монотерапия ибрутинибом** [23]
- Ибрутиниб** 560 мг в сутки внутрь (4 капсулы). Принимается через 2 часа после и за 1 час до приема пищи. Запивается стаканом воды. 4 капсулы принимаются вместе. При возникновении осложнений лучше временно снижать дозу препарата, а не отменять его целиком. При необходимости отмены препарата следует возобновить его прием в течение 7 дней. Применяется ежедневно до прогрессирования заболевания или недопустимого токсического действия
Ибрутиниб** + ритуксимаб** [47]
- Ритуксимаб** - один раз в неделю в течение 4 недель, затем 1 раз в 28 дней в течение 2 лет:
- 375 мг/м2 в/в кап., день 1 все циклы курса
или
-
- 375 мг/м2 в/в кап. 1 цикл, далее #ритуксимаб** 1400 мг п/к, день 1 [69 - 72]
- Ибрутиниб** 560 мг в сутки внутрь (4 капсулы). Принимается через 2 часа после и за 1 час до приема пищи. Запивается стаканом воды. 4 капсулы принимаются вместе. При возникновении осложнений лучше временно снижать дозу препарата, а не отменять его целиком. При необходимости отмены препарата следует возобновить его прием в течение 7 дней. Применяется ежедневно до прогрессирования заболевания или недопустимого токсического действия
Монотерапия леналидомидом** [48]
- Леналидомид** 25 мг внутрь, дни 1 - 21
Лечение возобновляется на 29 день, проводится до прогрессирования заболевания или недопустимого токсического действия
Леналидомид** + ритуксимаб** [49]
- Леналидомид** 10 мг ежедневно, до, во время и после применения ритуксимаба**, до прогрессирования заболевания или недопустимого токсического действия
- Ритуксимаб** 375 мг/м2 в/в кап. 4 еженедельных введения, после двух 28-дневных циклов леналидомида** (после 8 недель приема леналидомида**)
#Кладрибин** + ритуксимаб** [57]
- Ритуксимаб** 375 мг/м2 в/в кап., день 1
- #Кладрибин 0,12 мг/кг/сут, дни 2 - 6
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Рис. 1. Алгоритмы ведения пациента с лимфомой из клеток мантии.
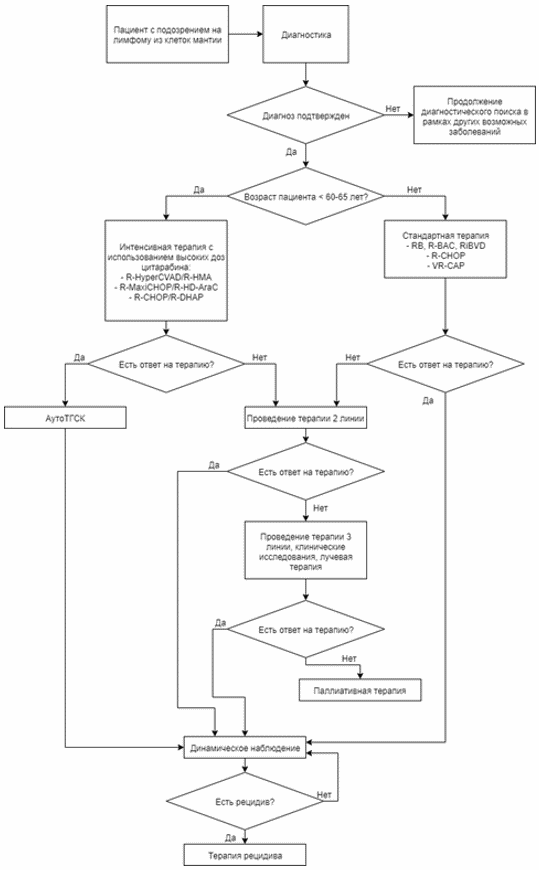
Рис. 2. Терапия пациентов с ЛКМ в рецидиве\резистентности в зависимости от возраста и соматического статуса.

Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Что такое лимфома из клеток мантийной зоны?
Это опухолевое заболевание лимфатической ткани. Клетки опухоли происходят из B-клеток, которые располагаются в мантийной зоне лимфатических узлов. Как правило, первым симптомом лимфомы является значительное увеличение размеров лимфатических узлов на шее, в подмышечных впадинах или в паху. При этом, в отличие от инфекционных заболеваний, увеличенные лимфатические узлы безболезненны, их размеры не уменьшаются со временем и при лечении антибиотиками. Иногда вследствие давления со стороны увеличенных печени, селезенки и лимфатических узлов возникает чувство переполнения в животе, затруднения дыхания, распирающие боли в нижней части спины, ощущение давления в лице или на шее
Как подтвердить, что у вас ЛКМ?
Основным анализом, позволяющим подтвердить диагноз лимфомы, является микроскопическое исследование образца лимфоидной ткани, полученной при биопсии (хирургическом удалении лимфатического узла или кусочка ткани пораженного органа). Эта ткань направляется на морфологическое исследование к врачу-патоморфологу, главная задача которого - определить, есть ли в изучаемой ткани опухолевые (лимфомные) клетки. Если врач находит опухолевые клетки в изучаемом гистологическом препарате, то следующий вопрос, на который он должен ответить - с каким видом лимфомы мы имеем дело. Для этого проводится иммуногистохимическое и цитогенетическое исследование.
Какое медицинское обследование необходимо перед началом лечения?
1. Подробный рассказ о том, какие симптомы заболевания появились и когда.
2. Развернутый клинический, биохимический и иммунохимический анализы крови.
3. Если у Вас повышено содержание лейкоцитов - ИФТ лимфоцитов периферической крови.
4. КТ или ПЭТ/КТ, УЗИ для определения всех очагов опухолевого поражения.
5. Исследование костного мозга и люмбальной жидкости.
6. Электрокардиография, ЭХО-кардиография для выявления заболеваний сердца.
7. Тест на беременность.
8. Консультация репродуктолога, если Вы хотите иметь детей после окончания терапии.
Нуждаетесь ли вы сейчас в лечении?
Очень редко ЛКМ не требует немедленного начала терапии, когда объем поражения очень мал, нет признаков быстрого роста опухоли, отсутствуют симптомы интоксикации.
Приложение Г
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5 (6): 649 - 65 [76]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания.
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу).
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования.
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели.
5
Смерть пациента
