"Клинические рекомендации "Агрессивные нефолликулярные лимфомы - диффузная крупноклеточная B-клеточная лимфома, первичная медиастинальная B-клеточная лимфома, лимфома Беркитта"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
АГРЕССИВНЫЕ НЕФОЛЛИКУЛЯРНЫЕ ЛИМФОМЫ - ДИФФУЗНАЯ
КРУПНОКЛЕТОЧНАЯ B-КЛЕТОЧНАЯ ЛИМФОМА, ПЕРВИЧНАЯ
МЕДИАСТИНАЛЬНАЯ B-КЛЕТОЧНАЯ ЛИМФОМА, ЛИМФОМА БЕРКИТТА
МКБ 10: C83.3, C83.7, C85.2, C91.8
Год утверждения (частота пересмотра): 2020
ID: КР129/1
URL
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России" - Региональная общественная организация "Общество онкогематологов" - Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество" - Региональная общественная организация Национальное общество детских гематологов и онкологов
Одобрено Научно-практическим Советом Минздрава РФ
Ключевые слова
Список сокращений
АЧТВ - активированное частичное тромбопластиновое время
МНО - международное нормализованное отношение
МПИ - международный прогностический индекс
ВБП - выживаемость без прогрессирования
ОВ - общая выживаемость
УЗИ - ультразвуковое исследование
КТ - компьютерная томография
ПЭТ - позитронно-эмиссионная томография
МРТ - магнитно-резонансная томография
ЛБ - лимфома Беркитта
ЛТ - лучевая терапия
РОД - разовая доза облучения
СОД - суммарная доза облучения
ЭКГ - электрокардиография
Эхо-КГ - эхокардиография
ВДХТ с аутоТГСК - высокодозная химиотерапия с последующей трансплантацией аутологичных гемопоэтических стволовых клеток
ГЭБ - гематоэнцефалический барьер
MALT - мукозассоциированная лимфома
НХЛ - неходжкинские лимфомы
ИФТ - иммунофенотипирование методом проточной цитометрии
ИГХ - иммуногистохимия
КМ - костный мозг
ЛДГ - лактатдегидрогеназа
ДВКЛ - диффузная крупноклеточная B-клеточная лимфома
ВКЛ - B-клеточная крупноклеточная лимфома
ПМВКЛ - первичная медиастинальная крупноклеточная B-клеточная лимфома
ПЛЦНС - первичная лимфома центральной нервной системы
ЦНС - центральная нервная система
Mtx/AraC/Pred - интратекальное введение метотрексата**, цитарабина** и преднизолона**
FISH - флуоресцентная гибридизация in situ
** - жизненно необходимые и важнейшие лекарственные препараты
# - препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
ECOG - оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) - см. приложение Г1.
B-симптомы - неспецифические симптомы опухолевой интоксикации, включающие лихорадку выше 38 °C не менее трех дней подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Диффузная крупноклеточная B-клеточная лимфома (ДВКЛ) является гетерогенной группой лимфатических опухолей с различными клиническими, морфологическими, иммунофенотипическими, цитогенетическими проявлениями и с разным ответом на терапию. Субстратом опухоли являются крупные лимфоидные B-клетки, которые характеризуются выраженным атипизмом и полиморфизмом, наличием крупного ядра, в два и более раз превышающим размер ядра малого лимфоцита или равным и превышающим размер ядра макрофага. Опухолевые клетки в большинстве случаев располагаются диффузно, но могут быть и разбросанными среди зрелых B-лимфоцитов, иногда на фоне T-клеточного окружения, или формировать очаговые скопления [1]. В зависимости от клинических проявления, морфологических и молекулярных признаков выделяют различные типы крупноклеточных B-клеточных лимфом (см. раздел классификация).
Лимфома Беркитта (ЛБ) - высоко агрессивная лимфома из иммунологически зрелых B-клеток с преимущественно экстранодальной локализацией [2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология ДВКЛ остается неясной. Опухоль чаще возникает de novo, но может также трансформироваться из менее агрессивной лимфомы (ХЛЛ/лимфома из малых лимфоцитов, фолликулярная лимфома, лимфома из клеток маргинальной зоны или вариант нодулярного лимфоидного преобладания лимфомы Ходжкина). Значимым фактором риска является также сопутствующий иммунодефицит, у таких пациентов значительно чаще, чем в спорадических случаях встречается EBV-позитивная ДВКЛ.
В патогенезе ДВКЛ основными звеньями являются нарушение клеточных процессов пролиферации, созревания и дифференцировки B-лимфоцитов. Первый этап дифференцировки B-лимфоцитов (первичная перестройка генов, кодирующих синтез иммуноглобулинов) проходит в костном мозге. Клетки с "успешной перестройкой" генов иммуноглобулинов (наивные B-клетки), покидают костный мозг и попадают во вторичные лимфоидные органы - лимфатические узлы, миндалины, селезенку, пейеровы бляшки, где, трансформировавшись под влиянием антигенной стимуляции, при участии фолликулярных дендритных клеток и T-лимфоцитов образуют фолликулы. В зародышевом центре вторичных фолликулов наивные B-клетки, не имеющие комплементарного антигена и не способные произвести функциональное антитело, подвергаются апоптозу. С B-лимфоцитами, получившими возможность синтезировать антитела после контакта с соответствующими антигенами, в зародышевом центре происходит ряд изменений (переключение класса иммуноглобулина (IgM, IgD на IgG, IgA или IgE), а также соматическая гипермутация (замена одного нуклеотида в гипервариабельных регионах иммуноглобулинов), после чего B-клетки покидают фолликул, становясь окончательно дифференцированными плазматическими клетками или долгоживущими B-клетками памяти. Случайные неудачи в управлении этими процессами и играют решающую роль в развитии B-клеточных опухолей, в том числе ДВКЛ [3 - 9].
Как показали молекулярно-генетические исследования, в патогенезе ДВККЛ имеют значение многие гены, регулирующие события в зародышевых центрах, но самым изученным механизмом является перестройка гена Bcl-6, расположенного в локусе 3q27 и экспрессируемого исключительно B-клетками зародышевого центра. В физиологических условиях ген Bcl-6 связывается с определенными регулирующими последовательностями ДНК, влияет на транскрипцию других генов, участвующих в активации и терминальной дифференцировке B-лимфоцитов. При перестройке локуса 3q27 происходит блок дальнейшей дифференцировки B-клеток в плазматические клетки, что приводит к бесконтрольной пролиферации B-клеток зародышевого центра [10].
ЛБ делят на 3 варианта: эндемический, спорадический и иммунодефицит-ассоциированный [2].
Эндемический вариант ЛБ чаще всего встречается в странах экваториальной Африки и Папуа - Новой Гвинеи, в которых это заболевание составляет до 75% всех детских онкологических заболеваний. Заболевание ассоциировано с такими инфекционными агентами, как вирус Эпштейна-Барр (EBV) или малярийный плазмодий. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант ЛБ - типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант ЛБ - ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения CD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Диффузная B-клеточная крупноклеточная лимфома (ДВКЛ) является наиболее распространенным вариантом лимфопролиферативных заболеваний взрослых (30 - 40% от всех неходжкинских лимфом). В возрасте до 18 лет частота этого варианта B-клеточной опухоли не превышает 8 - 10%. Заболеваемость составляет в среднем 4 - 5 на 100 000 населения, ежегодно в мире диагностируется 123 000 новых случаев ДВКЛ. Риск развития болезни выше у людей с серопозитивностью вируса гепатита C, при наличии вируса иммунодефицита человека (ВИЧ), аутоиммунных заболеваний. Медиана возраста составляет примерно 60 лет, мужчины и женщины болеют ДВКЛ почти с равной частотой [1, 11].
ЛБ болеют преимущественно мужчины. У детей ЛБ составляет около 30 - 50% всех лимфом. Соотношение мальчики:девочки - 3 - 4:1, средний возраст - 8 лет. У взрослых ЛБ встречается значительно реже - в 2% случаев всех лимфом. Болеют преимущественно молодые мужчины, соотношение мужчины:женщины - 3:1, средний возраст - 25 - 30 лет [12 - 14].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
- C83.3 - Диффузная крупноклеточная B-клеточная лимфома
- C83.7 - Лимфома Беркитта
- C85.2 - Медиастинальная (тимусная) большая B-клеточная лимфома
- C91.8 - Зрелый B-клеточный лейкоз типа Беркитта
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Разнообразие клинических, морфологических и иммунологических характеристик, а также молекулярно-цитогенетические исследования последних лет доказали, что ДВКЛ является не единой нозологической формой, а группой лимфатических опухолей, имеющих близкий, но неодинаковый патогенез. В настоящее время выделено несколько вариантов ДВКЛ в зависимости от уровня дифференцировки опухолевых клеток, типов нарушения клеточных процессов, хромосомных аномалий [1]. В соответствии с классификацией ВОЗ пересмотра 2017 г. самостоятельными вариантами ДВКЛ признаны:
- ДВККЛ, неспецифицированная (NOS). В данную биологически гетерогенную группу включены заболевания, не относящиеся ни к одной из нижеперечисленных вариантов крупноклеточных лимфом:
- B-крупноклеточная лимфома, богатая T-клетками/гистиоцитами
- первичная ДВККЛ ЦНС (ПЛЦНС)
- первичная кожная ДВККЛ, тип "нижних конечностей" (leg-type)
- EBV-позитивная ДВККЛ, NOS
- ДВККЛ, ассоциированная с хроническим воспалением
- лимфоматоидный гранулематоз
- крупноклеточная лимфома с реарранжировкой IRF4
- первичная медиастинальная (тимическая) крупноклеточная лимфома (ПМВКЛ)
- внутрисосудистая крупноклеточная лимфома
- ALK-позитивная B-крупноклеточная лимфома
- плазмобластная лимфома
- HHV8 позитивная крупноклеточная лимфома
- первичная лимфома серозных полостей
Отдельно рассматриваются следующие группы B-крупноклеточных лимфом:
- агрессивная лимфома с MYC и BCL-2 и/или BCL 6 реарранжировкой
- агрессивная лимфома, неклассифицируемая, с чертами, промежуточными между ДВККЛ и лимфомой Ходжкина (лимфома серой зоны)
Вариантом ДВКЛ в настоящее время также признаны случаи с очаговым поражением фолликулярных структур, с иммуногистохимически подтвержденным происхождением из фолликулярных дендритных клеток (ранее 3B цитологический тип фолликулярной лимфомы). В последнее время охарактеризована новая группа лимфом - ДВКЛ, ассоциированные с фолликулярной лимфомой, с MALT-лимфомой желудка и MALT-лимфомой других локализаций, имеющая клинические, морфо-иммунологические и молекулярно-генетические особенности и возможно, в скором времени потребующая разработки новых подходов к их лечению.
Выделены следующие морфологические варианты ДВКЛ неспецифицированной, имеющие различную клиническую картину и течение заболевания:
- центробластный
- иммунобластный
- анапластический
- другие редкие варианты
В практике гематопатолога в настоящее время используется определение молекулярного подтипа ДВКЛ:
- Из B-клеток герминальных центров фолликулов (GCB-подтип)
- Из активированных B-клеток (non-GCB, ABC-like подтип)
Известно, что опухолевые клетки при ДВКЛ обычно экспрессируют пан-B-клеточные антигены, такие как CD19, CD20, CD22, CD79a, PAX5, но в процессе прогрессии заболевания некоторые из них могут утрачиваться. В 50 - 75% случаев экспрессируются поверхностные и цитоплазматические иммуноглобулины (в порядке убывания IgM, IgG, IgA). CD30 может выявляться на опухолевых клетках в 10 - 20% случаев, особенно в анапластическом варианте лимфомы. Присутствие EBV в большинстве клеток является основанием для установления диагноза EBV-позитивной ДВКЛ, неспецифицированной, большинство опухолевых лимфоидных клеток при этом CD30 позитивны. CD5+ на клетках определяется в 5 - 10% случаев, при этом это могут быть как de novo ДВКЛ, так и вторичные крупноклеточные лимфомы, возникшие вследствие трансформации из ХЛЛ/лимфомы из малых лимфоцитов. Частота экспрессии CD10, BCL6, IRF4/MUM1, FOXP1, GCET1 и LM02 варьируется. В алгоритме Hans используются 3 основных маркера для отличия GCB от ABC типов ДВКЛ: CD10, BCL-6 и IRF4/MUM1. Тест считается позитивным при выявлении этих антигенов на 30% и более опухолевых клеток. Показатель пролиферативной активности опухоли Ki-67 высокий, от 40 до 90% в некоторых случаях более 90%. Экспрессия p53 определяется у 20 - 60% лиц, больных ДВКЛ, что во многом определяет ответ на лечение и прогноз у данной группы пациентов [1].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические признаки ДВКЛ разнообразны, не всегда специфичны и определяются первичной локализацией, скоростью роста и распространенностью опухоли, а также наличием/отсутствием симптомов интоксикации (B-симптомами - температурой тела > 38 °C более 3 дней без признаков воспаления, ночными профузными потами, похуданием на 10% массы тела за последние 6 мес.). Может наблюдаться увеличение лимфатических узлов, в случае вовлечения в процесс лимфатических узлов средостения и/или тимуса возможно развитие синдрома верхней полой вены (цианоз; одутловатость головы, шеи, верхних конечностей, верхней половины грудной клетки; расширение подкожных вен; одышка, охриплость голоса, кашель и др.). Процесс, локализованный в лимфатических узлах брюшной полости/забрюшинного пространства, может манифестироваться возникновением болевого синдрома и/или признаками нарушения функции внутренних органов, компримированных опухолевыми образованиями. При экстранодальном поражении обычно превалируют симптомы нарушения функции соответствующих органов и систем. ПЛЦНС в большинстве случаев проявляется очаговой и/или общемозговой неврологической симптоматикой. Часто встречаются изменения психики, симптомы повышения внутричерепного давления, судорожные припадки.
Клинические проявления ЛБ обусловлены локализацией и объемом опухоли. Практически всегда есть B-симптомы, чаще всего - быстро развивающаяся потеря массы тела (до 10 кг и более за месяц).
Для ЛБ характерна экстранодальная локализация опухоли. Наиболее часто поражаются органы брюшной полости: тонкая кишка (чаще ее терминальный отдел), брыжейка, а также желудок, толстая кишка, брюшина, печень, селезенка. Специфическое поражение костного мозга наблюдается в 25 - 35% случаев, центральной нервной системы - в 20 - 25% случаев. Типично вовлечение почек, яичников, яичек, абдоминальных и забрюшинных лимфатических узлов (особенно в илеоцекальной области), реже - периферических лимфатических узлов.
В 10 - 15% случаев ЛБ отмечено вовлечение кольца Вальдейера, слюнных желез, верхней и нижней челюсти, орбиты. Средостение поражается редко.
Характерным симптомокомплексом при ЛБ является клиника "острого живота" в результате обструктивной кишечной непроходимости, острого аппендицита, желудочно-кишечного кровотечения или перфорации вследствие специфической инфильтрации желудка и/или кишечника. При физикальном осмотре у больного можно обнаружить увеличение живота за счет опухоли и асцита. Рост опухоли происходит стремительно, и в большинстве случаев к моменту госпитализации поражение органов брюшной полости представлено массивным опухолевым конгломератом с вовлечением нескольких внутренних органов. Как правило, больные ЛБ поступают в стационар в тяжелом или крайне тяжелом состоянии, обусловленном большой опухолевой массой, интоксикацией, истощением вплоть до кахексии, электролитными нарушениями. Нередко основной терапевтической проблемой у больных ЛБ на начальном этапе заболевания является прогрессирующая острая почечная недостаточность (ОПН). Наиболее частыми причинами ее развития являются специфическое поражение почек, синдром лизиса опухоли (СЛО) и нарушение уродинамики за счет сдавления мочеточников опухолевым конгломератом с развитием постренальной анурии.
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УРР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния: диагнозы ДВКЛ, ПМВКЛ и ЛБ устанавливаются на основании патолого-анатомического исследования биоптата опухоли с применением иммуногистохимических методов. Рекомендуется обязательное выполнение эксцизионной биопсии (при отсутствии технической возможности - cor-биопсии) лимфатического узла или очага поражения с последующим патолого-анатомическим исследованием (цитологическим и гистологическим) с применением иммуногистохимических методов. Для уточнения диагноза в некоторых случаях требуется дополнительно выполнение молекулярно-биологических и цитогенетических методов исследования биологического материала [15].
Яркие клинические особенности ЛБ позволяют предположить этот диагноз уже на основании внимательной оценки анамнеза, клинических проявлений, первоочередных стандартных лабораторных показателей и результатов простейших первоначальных диагностических мероприятий (УЗИ брюшной полости). Дальнейший диагностический процесс, получение и исследование материала должны проводиться в режиме оказания неотложной помощи, целью которой является верификация диагноза и срочное начало соответствующей адекватной терапии [2].
Диагноз ПЛЦНС устанавливается на основании биопсии (открытой или с использованием стереотаксической техники) и исследования спинномозговой жидкости (общий (клинический) анализ спинномозговой жидкости, цитологическое исследование клеток спинномозговой жидкости, исследование биологического материала (спинномозговой жидкости) методом проточной цитофлуориметрии). При отсутствии возможности выполнения биопсии опухоли диагноз может быть установлен только на основании результатов исследования биологического материала (спинномозговой жидкости) методом проточной цитофлуориметрии [16].
2.1 Жалобы и анамнез
- Всем пациентам с подозрением на ДВКЛ, ПМВКЛ или ЛБ, а также всем пациентам с верифицированной ДВКЛ, ПМВКЛ или ЛБ при каждом приеме (осмотре, консультации) врача-онколога или врача-гематолога рекомендуется сбор жалоб и анамнеза при заболеваниях органов кроветворения и крови для оценки состояния пациента, а также для установления факторов, которые могут оказать влияние на определение лечебной тактики пациента [2, 11, 17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: жалобы неспецифичны и определяются первичной локализацией, скоростью и распространенностью опухоли, могут присутствовать любые жалобы, связанные с вовлечением/нарушением функции органов и тканей. При сборе жалоб особое внимание необходимо уделить выявлению неспецифических симптомов интоксикации (температуры тела > 38 °C 3 дня и более без признаков воспаления, ночных профузных потов; похудания на 10% массы тела за последние 6 мес.). При ПЛЦНС в большинстве случаев наблюдаются жалобы, связанные с общемозговой (головная боль, тошнота, рвота) или очаговой неврологической симптоматикой. Учитывая агрессивный характер опухоли, анамнез заболевания, как правило, короткий.
2.2 Физикальное обследование
- Всем пациентам с подозрением на ДВКЛ, ПМВКЛ или ЛБ, или с выявленной ДВКЛ, ПМВКЛ или ЛБ, при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности заболевания и оценки состояния пациента по органам и системам [2, 11, 17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарий: при осмотре необходимо оценить общее состояние пациента по шкале ECOG (см. приложение Г1), а также осмотреть кожные покровы, миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
2.3 Лабораторные диагностические исследования
- Всем пациентам с подозрением на ДВКЛ, ПМВКЛ или ЛБ или выявленной ДВКЛ, ПМВКЛ или ЛБ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется для уточнения состояния пациента, планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии выполнить следующие диагностические исследования [17, 18]:
- общий (клинический) анализ крови развернутый с исследованием уровней общего гемоглобина, эритроцитов, тромбоцитов, лейкоцитов в крови, с дифференцированным подсчетом лейкоцитов (лейкоцитарная формула), с исследованием уровня ретикулоцитов в крови, а также с исследованием скорости оседания эритроцитов;
- общий (клинический) анализ мочи;
- анализ крови биохимический общетерапевтический с определениями активностей лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы в крови, исследованиями уровней мочевины, креатинина, альбумина, общего белка, общего билирубина, калия, натрия, общего кальция, хлоридов в крови, исследованием уровня бета-2-микроглобулина в крови (другие параметры биохимического анализа крови могут быть включены в исследование на усмотрение врача);
- у пациентов в тяжелом состоянии, а также при наличии признаков острой почечной недостаточности (особенно при ЛБ) - исследование кислотно-основного состояния и газов крови
- исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер [19, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: объем исследования включает в себя дифференциальный подсчет клеток крови с использованием автоматического анализатора; исследование морфологии эритроцитов, тромбоцитов, лейкоцитов по мазку, при необходимости - оптический подсчет количества тромбоцитов (по Фонио).
- Всем пациентам с подозрением на ДВКЛ, ПМВКЛ или ЛБ или с верифицированной ДВКЛ, ПМВКЛ или ЛБ при выявлении лимфоцитоза в общем (клиническом) анализе крови (независимо от числа лейкоцитов), а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией на любом этапе диагностики и лечения рекомендуется выполнение иммунофенотипирования периферической крови для выявления субпопуляционного состава лимфоцитов [17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: выполнение ИФТ желательно при наличии лимфоцитоза в общем анализе крови (независимо от числа лейкоцитов), а также при преобладании лимфоидных клеток, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях. Выполнение ИФТ позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для ИФТ могут служить клетки крови, костного мозга, выпотных жидкостей, спинномозговой жидкости, гомогенизированные образцы тканей (селезенка, лимфатические узлы и т.д.), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов. Минимальная ИФТ - панель должна включать оценку экспрессии CD19, CD20, CD10, CD5, СД23, CD3, CD45, легкие цепи иммуноглобулинов (Ig-kappa, Ig-lambda). Объем исследования включает в себя дифференциальный подсчет.
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ при наличии клинических или лабораторных признаков гемолиза перед проведением первой линии противоопухолевой терапии рекомендуется прямой антиглобулиновый тест (прямая проба Кумбса) для уточнения причины гемолиза [17, 21 - 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Всем ранее не получавшим лечение пациентам с ДВКЛ, ПМВКЛ или ЛБ перед проведением первой линии противоопухолевой терапии рекомендуется определение основных групп крови по системе AB0, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем ранее не получавшим лечение пациентам с ДВКЛ, ПМВКЛ или ЛБ перед проведением первой линии противоопухолевой терапии рекомендуется для уточнения наличия сопутствующих инфекционных заболеваний и планирования необходимой сопутствующей терапии выполнение следующих исследований [17, 18]:
- молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus);
- молекулярно-биологического исследования крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1);
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ младше 18 лет до начала противоопухолевой терапии, а также всем пациентам с ДВКЛ, ПМВКЛ или ЛБ независимо от возраста, получающим или получавшим противоопухолевую терапию, после первого эпизода тяжелой инфекции рекомендуется определение иммунного статуса (исследования уровня иммуноглобулинов G, A и M в крови) для уточнения риска развития инфекционных осложнений и необходимости назначения соответствующей профилактики [17, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: если IgG < 4 г/л, клиническая ситуация расценивается как симптоматическая гипогаммаглобулинемия. В этих случаях показана заместительная терапия иммуноглобулинами (см. раздел "Сопутствующая и сопроводительная терапия)
2.4 Инструментальные диагностические исследования
- Всем пациентам при установлении диагноза ДВКЛ, ПМВКЛ или ЛБ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется при наличии возможности выполнить позитронную эмиссионную томографию, совмещенную с компьютерной томографией (ПЭТ/КТ) с туморотропными радиофармпрепаратами (РФП) или (хуже, при отсутствии технической возможности выполнит ПЭТ/КТ) позитронную эмиссионную томографию (ПЭТ) всего тела с туморотропными РФП для стадирования заболевания и оценки эффекта на терапию [17, 18, 26 - 28].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: ПЭТ/КТ, выполненная до начала лечения, позволяет не только уточнить стадию, но и более точно определить локализацию очагов поражения, особенно экстранодальные вовлечения, которые могут плохо диагностироваться при КТ, что имеет существенное значение для последующей оценки эффекта терапии индукции и качественного планирования последующей лучевой терапии и минимизации облучения здоровых тканей. При наличии возможности выполнения ПЭТ/КТ, она может быть применена в соответствии с пересмотренными критериями оценки ответа, в первую очередь у пациентов с минимальным объемом опухоли, а также с учетом возможной коррекции лечения.
При наличии технической возможности ПЭТ/КТ должна оцениваться по шкале Deauville (см. приложение Г2).
- Всем пациентам при установлении диагноза ДВКЛ, ПМВКЛ или ЛБ, которым не может быть выполнена ПЭТ/КТ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с противопоказаниями к ПЭТ/КТ и КТ, либо при невозможности выполнения ПЭТ/КТ и КТ, при установлении диагноза ДВКЛ, ПМВКЛ или ЛБ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания рекомендуется для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов выполнить следующие диагностические исследования [17]:
- рентгенографию органов грудной клетки в двух проекциях;
- ультразвуковое исследование лимфатических узлов и внутренних органов, у мужчин - также яичек.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: при ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза. Лимфоузлы диаметром менее 1 см считаются непораженными, лимфоузлы диаметром 1 - 2 см требуют динамического наблюдения в процессе терапии, лимфоузлы диаметром более 2 см считаются пораженными.
- Пациентам с подозрением на ПЛЦНС, либо с установленным диагнозом ПЛЦНС, а также всем пациентам с ДВКЛ, ПМВКЛ или ЛБ с нейролейкемией и/или неврологической симптоматикой, имеющейся в дебюте болезни или на этапах ее развития, перед лечением, после завершения лечения или в процессе лечения для исключения прогрессирования, рекомендуется выполнить МРТ головного мозга с внутривенным контрастированием для уточнения распространенности опухолевого процесса или оценки противоопухолевого эффекта, если исследование выполнено в динамике [16, 29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с установленным диагнозом ДВКЛ, которым планируется лечение по поводу впервые установленного заболевания, либо по поводу рецидива, и всем пациентам с ЛБ рекомендуется для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [2, 17]:
- электрокардиографию;
- эхокардиографию;
- эзофагогастродоуденоскопию;
- колоноскопию, биопсию кишки эндоскопическую при подозрении на поражение кишки при ЛБ;
- ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей [30]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: эзофагогастродоуденоскопия выполняется как с целью установления распространенности опухолевого процесса, так и с целью исключения неопухолевой патологии, требующей дополнительного лечения, профилактики развития осложнений в процессе терапии.
2.5 Иные диагностические исследования
- Всем пациентам с подозрением на ДВКЛ, ПМВКЛ или ЛБ, с подозрением на рецидив ДВКЛ, ПМВКЛ или ЛБ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения рекомендуется выполнить биопсию (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза [11, 17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: выбор ткани и объем биопсии должны быть адекватны поставленной диагностической задаче.
- Тонкоигольные биопсии лимфоидной ткани могут быть диагностически значимыми, но не всегда
- Краевые биопсии лимфоидной ткани мало информативны.
- Фрагментация материала крайне затрудняет его оценку.
- Материал для гистологического исследования должен быть помещен в фиксирующую среду как можно быстрее. Нельзя допускать высыхания материала.
- Соотношение объема фиксирующей среды к объему фиксируемого объекта не менее чем 10:1
- Время фиксации не должно быть менее 12 и более 48 часов.
Неадекватная (слабая или чрезмерная) фиксация приводит к изменению морфологических свойств ткани и артефициальным результатам ИГХ.
Гистологический материал должен сопровождаться направлением, содержащим информацию о пациенте, длительности и характере заболевания, локализации очага поражения, описании биопсии [31].
Диагностические полостные операции - торакоскопия/томия, лапароскопия/томия с биопсией внутригрудных, внутрибрюшных л/у или печени проводятся только при отсутствии увеличенных периферических лимфоузлов и невозможности верификации диагноза.
Гистологические и иммуногистохимические характеристики различных ДВКЛ, а также обязательные требования к патолого-анатомическому заключению представлены в разделе 7.1 данных рекомендаций. Описание морфологической и иммуногистохимической картины различных ДВКЛ представлено в разделе 7.2 данных рекомендаций.
- Всем пациентам при подозрении или наличии подтвержденного диагноза ДВКЛ, ПМВКЛ или ЛБ первично (для стадирования заболевания), после завершения терапии (для оценки противоопухолевого ответа), при подозрении на рецидив заболевания рекомендуется [11, 17, 27, 28]:
- получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а при повышении количества лимфоидных клеток, наличия атипичных лимфоцитов или клеток с бластной морфологией в костном мозге - исследование биологического материала (аспирата костного мозга) методом проточной цитофлуориметрии
- получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: исследование костного мозга (аспират и трепанат) также рекомендуется при появлении клинически немотивированных цитопении и лихорадки (вне зависимости от наличия исходного поражения).
У детей трепанобиопсия подвздошной кости должна обязательно проводиться под общей анестезией.
- Всем пациентам с ЛБ, также всем пациентам с ДВКЛ с неврологической симптоматикой, имеющейся в дебюте болезни или на этапах ее развития, а также пациентам с ДВКЛ из группы высокого риска по вовлечению ЦНС (4 - 6 прогностических факторов по шкале CNS-IPI - см. раздел 7.4 данных рекомендаций, а также пациентам с ВИЧ ассоциированной лимфомой, лимфомой яичка, лимфомой высокой степени злокачественности с транслокацией MYC, BCL-2 и/или BCL-6, лимфомой высокой степени злокачественности, неклассифицируемой, или ДВКЛ с вовлечением почек или надпочечников, пациентам с IE ДВКЛ с поражением молочных желез) перед началом терапии рекомендуется [2, 11, 17, 29]:
- выполнение спинномозговой пункции;
- исследование спинномозговой жидкости, включающее визуальную оценку, определение концентрации белка и глюкозы, микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза), с оценкой морфологии лейкоцитов в мазке, а также, при обнаружении повышенного количества лимфоидных элементов, выполнение ИФТ ликвора.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Всем пациентам с подозрением на ЛБ или с верифицированной ЛБ с асцитом рекомендуется выполнить парацентез с регулируемым удалением перитонеального транссудата, цитологическое исследование перитонеальной жидкости и исследование биологического материала (перитонеальной жидкости) методом проточной цитофлуориметрии для уточнения распространенности опухолевого процесса верификации диагноза [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с подозрением на ЛБ или с верифицированной ЛБ с плевритом рекомендуется выполнить дренирование плевральной полости, цитологическое исследование плевральной жидкости и исследование биологического материала (плевральной жидкости) методом проточной цитофлуориметрии для уточнения распространенности опухолевого процесса верификации диагноза [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам младше 18 лет с верифицированной ЛБ, особенно если опухоль обнаружена в младшем возрасте или если есть признаки врожденного иммунодефицита или синдрома нестабильности хромосом, рекомендуется выполнить молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein - Barr virus) для уточнения этиологии и патогенеза заболевания [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с верифицированной ДВКЛ, ПМВКЛ или ЛБ при первичном обследовании и планировании терапии рекомендуется в зависимости от сопутствующей патологии осмотр (консультация) врача-кардиолога, врача-эндокринолога, врача-невролога, врача-инфекциониста, для детей раннего возраста с ЛБ - врача-генетика и врача-иммунолога, а также других врачей-специалистов для определения необходимости терапии сопутствующих заболеваний [2, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с верифицированной ДВКЛ, ПМВКЛ или ЛБ при первичном обследовании и планировании терапии рекомендуется оценить риск развития венозных тромбоэмболических осложнений (шкала оценки риска ВТЭО по Khorana - см. приложение Г3 данных рекомендаций) для выявления пациентов, требующих назначения и определения способов профилактики тромботических осложнений при проведении цитостатической терапии [19, 20, 32 - 34].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
- Всем женщинам детородного возраста с впервые выявленной ДВКЛ, ПМВКЛ или ЛБ, а также с рецидивом ДВКЛ, ПМВКЛ или ЛБ, перед началом терапии рекомендуется выполнение комплекса исследований по определению беременности для коррекции терапевтической тактики и консультации акушера-гинеколога в случае наличия беременности и желания женщины ее сохранить [17, 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3. Лечение
При выборе тактики и проведении терапии следует учитывать, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Учитывая наличие неудовлетворенных медицинских потребностей (большое количество рецидивов, недостаточная эффективность и высокая токсичность существующих методов лечения), а также интенсивное изучение новых методов диагностики и лечения, рекомендуется участие пациентов в исследовательских проектах.
Каждый цикл терапии начинается, если состояние пациента удовлетворяет следующим критериям:
- гранулоциты > 1 x 109/л,
- тромбоциты > 100 x 109/л.
Для пациентов с цитопенией, обусловленной поражением костного мозга, специфическая терапия возможна и при более низких показателях лейкоцитов и тромбоцитов, однако в этих случаях должна быть обеспечена соответствующая сопроводительная терапия.
Все режимы терапии, начиная с первого курса, должны проводиться с ритуксимабом** во внутривенной или подкожной форме. В нескольких крупных рандомизированных исследованиях доказано, что подкожная форма ритуксимаба** является столь же эффективной и безопасной, как и внутривенная. Первое введение препарата всем пациентам проводится в дозе 375 мг/м2 внутривенно, во втором и/или последующих циклах терапии ритуксимаб** может вводиться подкожно в фиксированной дозе 1400 мг независимо от площади поверхности тела.
Пациент прекращает лечение по протоколу в случаях прогрессии заболевания или токсических эффектов, не позволяющих продолжать химиотерапию в необходимом объеме.
3.1 Первая линия терапии ДВКЛ у взрослых пациентов
- Пациентам с верифицированной ДВКЛ с высокой опухолевой нагрузкой рекомендуется начинать лечение с предфазы (#преднизолон** 100 мг внутрь 5 - 7 дней) на фоне инфузионной терапии (2 - 3 литра в сутки) и приема аллопуринола для предотвращения синдрома лизиса опухоли (см. раздел 3.7.) [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с впервые установленной ДВКЛ I - II стадии рекомендуется провести 4 - 6 курсов иммунохимиотерапии по схеме R-CHOP-21 (схемы режимов лечения см. в приложении А3.1) с последующим выполнением процедуры рестадирования (см. раздел 7.6) [36 - 43].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарий: В случае отсутствия противоопухолевого ответа и/или при наличии признаков прогрессирования ДВКЛ пациент переводится на терапию в рамках 2 линии.
- В случае достижения противоопухолевого ответа по схеме R-CHOP у пациентов старше 18 лет с впервые установленной ДВКЛ I - II стадии, рекомендовано выполнение консолидирующей лучевой терапии на зоны исходно пораженных лимфатических узлов и/или экстранодального поражения СОД 30 Гр, РОД 1,8 - 2,0 Гр [44]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам старше 18 лет с впервые установленной ДВКЛ III - IV стадии рекомендуется провести 2 - 4 курсов иммунохимиотерапии R-CHOP-21 (схемы режимов лечения см. в приложении А3.1) с последующим выполнением процедуры рестадирования (см. раздел 7.6) и, в случае достижения противоопухолевого ответа, проведением еще 2 - 4 курсов иммунохимиотерапии R-CHOP-21 (суммарно 6) и планированием консолидирующей лучевой терапии на зоны с исходно массивными опухолевыми образованиями СОД 30 Гр и/или изолированными очагами поражения костей в СОД 30 - 40 Гр, РОД 1,8 - 2,0 Гр [36 - 38, 45 - 49].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: в случае отсутствия противоопухолевого ответа и/или при наличии признаков прогрессирования ДВККЛ пациент переводится на терапию в рамках 2 линии.
- Пациентам старше 18 лет с впервые установленной ДВКЛ при наличии серьезной сердечно-сосудистой патологии (снижение фракции выброса левого желудочка ниже 50%) рекомендуется терапия режимами иммунохимиотерапии, не содержащими доксорубицин** или с использованием пегилированного липосомального доксорубицина**: CHOP с пегилированным липосомальным доксорубицином, CEOP, CCOP, GCVP, CNOP в комбинации с ритуксимабом** (см. приложение А3.1) [50 - 56]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4)
- Пациентам с верифицированной ДВКЛ с высоким риском вовлечения ЦНС (4 - 6 прогностических факторов по по шкале CNS-IPI - см. раздел 7.4 данных рекомендаций, а также пациентам с ВИЧ-ассоциированной лимфомой, лимфомой яичка, лимфомой высокой степени злокачественности с транслокацией MYC, BCL-2 и/или BCL-6, лимфомой высокой степени злокачественности, неклассифицируемой, или ДВККЛ с вовлечением почек или надпочечников, пациентам с IE ДВККЛ с поражением молочных желез) рекомендуется проведение профилактики рецидива в ЦНС, которая включает 4 интратекальных введения #метотрексата** (12 - 15 мг), #цитарабина** (24 - 30 мг), #дексаметазона** (5 мг) и 2 системных введения высоких доз метотрексата** (1,5 - 3 г/м2) [11, 57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с впервые установленной ДВКЛ яичка рекомендуется выполнение орхофуникулэктомии с последующей химиотерапией в соответствии с рекомендациями для ДВКЛ соответствующей стадии с высоким риском вовлечения ЦНС и последующей лучевой терапии на область мошонки СОД 30 Гр, РОД 1,8 - 2,0 Гр [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам старше 18 лет с впервые установленной ДВКЛ при одновременном выявлении паренхиматозного поражения ЦНС рекомендовано проведение программы лечения R-CHOP (см. приложение А3.1) с добавлением 2 системных введений высоких доз метотрексата** (3,5 г/м2) [58].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам старше 18 лет с впервые установленной ДВКЛ при одновременном выявлении поражения оболочек головного/спинного мозга (нейролейкемии) рекомендовано проведение программного лечения по схеме R-CHOP с выполнением интратекальных введений цитостатиков (#метотрексат** 15 мг, #цитарабин** 30 мг, #дексаметазон** 4 мг) дважды в неделю до полной санации ликвора с последующими интратекальными введениями препаратов 1 раз в месяц до завершения программы иммунотерапии с последующим введением метотрексата** в высоких дозах [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: выбор дозы метотрексата** для внутривенной инфузии определяется возрастом, наличием сопутствующих заболеваний и состояний, выделительной функцией почек. Для снижения токсичности рекомендуется ограничиться 4-часовой длительностью инфузии метотрексата**. Профилактика поражения ЦНС выполняется на ранних этапах программного лечения, при необходимости - с поддержкой колониестимулирующими факторами (по одному интратекальному введению в 1-й день циклов 1 - 4, метотрексат** в высоких дозах назначается на 15-й день 1 или 2-ого циклов и после завершения последнего цикла лечения). В ряде случаев, при тяжелом соматическом состоянии пациента, наличии значимого плеврита/асцита возможно использование системного метотрексата** в конце лекарственного лечения (2 введения препарата с перерывом в 15 дней).
- Пациентам с впервые установленной ДВКЛ старше 80 лет, с выраженной сопутствующей патологией и/или с ослабленным соматическим статусом рекомендуется применение менее токсичных режимов иммунохимиотерапии (R-CVP, BR, R-mini-CHOP - см. приложение А3.1) [59 - 64]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
3.2 Первая линия терапии первичной медиастинальной (тимической) B-клеточной крупноклеточной лимфомы
- Пациентам старше 18 лет с установленным диагнозом ПМВКЛ рекомендовано проведение одного из следующих режимов иммунохимиотерапии на выбор лечащего врача (см. приложение А3.1) [65 - 71]:
- DA-EPOCH-R
- R-MACOP-B
- R-CHOP
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарий: эффективность и преимущества в достижении противоопухолевого ответа, показателей ВБП и ОВ режимов R-MACOP-B и R-DA-EPOCH над режимом R-CHOP продемонстрированы в нескольких международных и отечественных проспективных и ретроспективных исследованиях. Программа R-MACOP-B рассчитана для использования в условиях дневного стационара.
- Пациентам с установленным диагнозом ПМВКЛ с исходным массивным поражением средостения в случае достижения ремиссии после индукционной химиотерапии рекомендовано проведение консолидирующей дистанционной лучевой терапии на средостение СОД 30 Гр, РОД 1,8 - 2,0 Гр, при сохранении остаточной опухоли в средостении - с добавлением "буста" СОД 6 - 10 Гр на остаточную опухоль [65 - 70].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
3.3 Лечение первичной лимфомы ЦНС (ПЛЦНС)
- Пациентам с впервые верифицированной ПЛЦНС рекомендовано лечение с включением высоких доз метотрексата** (>= 3000 мг/м2) (см. приложение А3.1) [72 - 76].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
Комментарии: Применение химиотерапии значительно улучшило результаты лечения ПЛЦНС. Выбор лекарственных препаратов для лечения ПЛЦНС обусловлен их активностью при НХЛ и способностью проникать через гематоэнцефалический барьер (ГЭБ). Стандартные протоколы (CHOP, MACOP-B), применяемые при лечении других форм НХЛ, не эффективны для ПЛЦНС, поскольку входящие в них лекарственные средства не могут проникать через ГЭБ. К препаратам, проникающим через ГЭБ, относят метотрексат, цитарабин, прокарбазин, винкристин, кармустин, ломустин, тиотепа, топотекан, циклофосфамид, этопозид, цисплатин и глюкокортикоиды [72 - 79].
MTX** в высоких дозах является одним из наиболее часто используемых препаратов для лечения ПЛЦНС. Доза MTX** >= 1 г/м2 уже обеспечивает необходимую лечебную концентрацию в головном мозге, а доза >= 3,5 г/м2 - в ликворе. На основании полученных данных наиболее эффективными режимами лечения признаны монотерапия высокими дозами MTX** (от 3 до 8 г/м2) и комбинация его с другими химиотерапевтическими агентами.
- Пациентам с впервые верифицированной ПЛЦНС, которым по тем или иным причинам невозможно проведение терапии с включением высоких доз метотрексата** (>= 3000 мг/м2), рекомендована терапия комбинацией #темозоломида** и ритуксимаба** (см. приложение А3.1) [80].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с ПЛЦНС при достижении полной ремиссии после первой линии индукционной терапии рекомендовано проведение этапа консолидации ремиссии по одной из следующих терапевтических стратегий:
- ВДХТ с аутоТГСК у пациентов моложе 65 лет [81, 82],
- химиотерапия с включением высоких доз цитарабина** +/- высокие дозы метотрексата (см. приложение А3.1) [73, 83]
- проведение лучевой терапии на весь головной мозг СОД 23,4 Гр, РОД 1,8 Гр [78].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: в настоящее время отсутствуют сведения о преимуществе того или иного варианта терапии на этапе консолидации ремиссии при ПЛЦНС.
- Пациентам с ПЛЦНС при сохранении резидуальной опухоли после первой линии индукционной терапии рекомендовано проведение курсов химиотерапии с включением высоких доз цитарабина** +/- этопозида** (см. приложение А3.1) или проведение лучевой терапии на весь головной мозг СОД 30 - 36 Гр с последующим дополнительным облучением резидуальных опухолевых образований до 44 Гр, или проведение лучевой терапии только на резидуальные опухолевые образования до 45 Гр [29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: проведение лучевой терапии на головной мозг сопряжено с риском развития нейротоксичности, более высоким у пациентов старше 60 лет.
3.4 Первая линия терапии ДВКЛ у детей и подростков до 18 лет
- Пациентам до 18 лет с установленным диагнозом агрессивной нефолликулярной B-клеточной лимфомы (ДВКЛ, ЛБ или ПМВКЛ) рекомендовано проведение многокомпонентной полихимиотерапии на основе протоколов группы БФМ (см. приложение А3.1) в зависимости от групп риска (см. раздел 7.5) с включением ритуксимаба** [84].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3).
Комментарий: при сохраняющемся остаточном образовании после 4 блока пациенту рекомендовано провести контрольное обследование (ПЭТ/КТ или биопсию остаточного образования), в сомнительных случаях - обе процедуры. Если нет данных об активном опухолевом процессе, продолжают курсы AA-BB-CC.
При инициальном поражении ЦНС (особенно при наличии инфильтративных очагов) больным после блока AA проводится эндолюмбальная терапия (по 2 - 3 введения в течение одного блока в полной возрастной дозе трех препаратов, кроме введений на блоке CC).
3.5 Лечение лимфомы Беркитта
Лечение ЛБ проводится в кратчайшие сроки и в режиме оказания неотложной медицинской помощи [2, 85].
- Пациентам с ЛБ рекомендуется экстренное купирование имеющихся хирургических осложнений (кишечная непроходимость, кровотечения, перфорация), коррекция электролитных нарушений, купирование инфекционных осложнений, болевого синдрома [2, 85].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 5).
- Пациентам с ЛБ при наличии острой почечной недостаточности рекомендуется проводить ХТ на фоне ежедневных сеансов гемодиализа [86].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам с ЛБ рекомендуется в качестве основного метода лечения короткая импульсная высокоинтенсивная ХТ +/- ритуксимаб** (см. приложение A3.1) [87].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: при редко встречающихся локальных стадиях заболевания количество курсов ХТ редуцировано в соответствии с протоколами. К факторам плохого прогноза, требующим интенсификации терапии, относят: поражение КМ и ЦНС, повышение ЛДГ > 2 верхних границ нормальных значений, поражение почек, костей (мультифокальные очаги), размер опухоли более 10 см.
- Пациентам с ЛБ в 1-й линии лечения рекомендуется применение интенсивных протоколов ХТ: R-Hyper-CVAD, ЛБ-М-04+/-R, LMB 95, CODOXM/IVAC+/-R, (схемы см. в приложении А3.1) [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: основным правилом в терапии ЛБ является соблюдение принципа "доза - интервал", т.е. проведение курса в полных дозах с соблюдением межкурсового интервала. За исключением ситуаций развития жизнеугрожающих осложнений, не рекомендуется прерывать начатый курс ХТ. В исключительных случаях при наличии тяжелых инфекционных осложнений, с которыми не удалось справиться к окончанию межкурсового перерыва, возможно увеличение интервала между курсами.
- Пациентам с ЛБ не рекомендуется проведение терапии по схеме R-CHOP вследствие ее неэффективности [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Пациентам старше 55 лет без поражения ЦНС (не кандидатам для интенсивной ХТ) рекомендуется проведение лечения по протоколу R-DA-EPOCH (см. приложение А3.1) [88].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с ЛБ рекомендуется устанавливать центральный венозный катетер для проведения ХТ и сопроводительной терапии [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам при проведении первого курса терапии обязательную профилактику и лечение синдрома массивного лизиса опухоли: аллопуринол** 10 мг/кг/сут и инфузионная терапия 3 л/м2/сут с защелачиванием раствора натрия гидрокарбоната** 40 - 80 ммоль/л под контролем диуреза и плановым назначением фуросемида**, лабораторным контролем кислотно-основного состояния [89, 90].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При применении высоких доз метотрексата** рекомендованы контроль его элиминации (определение концентрации в сыворотке!) и коррекция дозы кальция фолината** ежедневно до нормализации показателей [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Всем пациентам с массивным экстрамедуллярным опухолевым поражением (органов средостения, брюшной полости и др.) рекомендовано проведение профилактики тромботических осложнений под контролем коагулограммы согласно существующим протоколам профилактики венозных тромбоэмболических осложнений (см. соответствующие клинические рекомендации) [32].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется терапию ЛБ у пациентов, инфицированных ВИЧ, проводить по аналогичным протоколам на фоне постоянного приема антиретровирусной терапии [91].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Не рекомендуется вводить ритуксимаб** ВИЧ-инфицированным пациентам при количестве CD4-клеток менее 100/мкл в связи с увеличением количества инфекционных осложнений и высоким риском смерти от них [91].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется всем пациентам с ЛБ обязательная профилактика нейролейкемии путем интратекального введения 3 препаратов (цитарабин** 30 мг, метотрексат** 15 мг, дексаметазон** 4 мг) 1 раз за курс в течение всего периода терапии [2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: лечение нейролейкемии должно выполняться в соответствии со стандартными правилами: спинномозговые пункции с введением цитостатиков выполняют 3 раза в неделю до получения 3 нормальных анализов ликвора связи с увеличением количества инфекционных осложнений и высоким риском смерти от них. На последующих блоках ХТ (после санации ликвора) люмбальные пункции с интратекальным введением цитостатиков проводят дважды за курс.
- Рекомендуется всем пациентам с ЛБ ауто-ТГСК, которая может являться вариантом терапии при рецидиве, отвечающем на лечение, или во второй ремиссии [92].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: большинство рецидивов ЛБ инкурабельны.
- Не рекомендуется всем пациентам с ЛБ алло-ТГСК в связи с рисками, обусловленными выполнением трансплантации [93].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.6 Лечение рецидивов агрессивных нефолликулярных B-клеточных лимфом
- Пациентам с рецидивами/рефрактерными формами ДВКЛ моложе 65 лет без значимой коморбидности рекомендовано проведение интенсивных рецидивов противорецидивной терапии по одной из следующих схем:
- DHAP [94]
- ESHAP [95]
- ICE [96]
- GDP [97]
- GemOx [98]
- DHAX [99]
- MINE [100]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарии: цитостатики, используемые в данных схемах лечения, не оказывают повреждающего влияния на стволовые гемопоэтические клетки и не ухудшают качество сбора стволовых клеток для ауто-трансплантата.
- Пациентам с рецидивами/рефрактерными формами ДВКЛ моложе 65 лет без значимой коморбидности в случае достижения противоопухолевого ответа на противорецидивную терапию при наличии возможности рекомендовано проведение высокодозной химиотерапии с трансплантацией аутологичных гемопоэтических стволовых клеток [101].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: тактика лечения рецидивов у пациентов после ВДХТ с аутоТГСК определяется физическим состоянием пациента, а также объемом проведенного ранее лечения. У молодых пациентов с хорошим соматическим статусом можно рассматривать возможность выполнения алло-ТГСК (алло-ТКМ). Предлагается рассмотреть вопрос об участии пациентов данной группы в клинических исследованиях.
- Пациентам с рецидивами/рефрактерными формами ДВКЛ старше 65 лет и/или со значимой коморбидностью и не являющимся кандидатами на проведение ВДХТ с ауто-ТГСК рекомендовано проведение менее интенсивных режимов химиотерапии/иммунохимиотерапии второй и последующих линий терапии, таких как:
- GemOx [102]
- BR [103, 104],
- CEPP [105],
- GDP [106],
- #Гемцитабин** + #Винорелбин** [107]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
- Пациентам с рецидивами/рефрактерными формами ДВКЛ, у которых рецидив был диагностирован более чем через 6 месяцев после предшествующего введения препарата, рекомендовано добавление к противорецидивной терапии ритуксимаба** [55].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с рецидивами/рефрактерными формами ПЛЦНС, развившимися после тотального облучения головного мозга рекомендовано в зависимости от физического и неврологического статуса, возраста, сопутствующих заболеваний проведение системной химиотерапии (повторное введение высокодозного метотрексата** с /или без риткусимаба**, #темозоломид** с/или без ритуксимаба**, топотекан, DHAP, высокие дозы цитарабина**) и/или интратекального введения цитостатиков с или без высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток, или повторного облучения или паллиативной помощи [72, 73, 108 - 110].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 4).
Комментарии: пациентам, получившим в первой линии режимы с высокодозным метотрексатом, без лучевой терапии, выбор между назначением системной химиотерапии или облучения зависит от длительности ответа на ХТ первой линии: если эффект сохраняется относительно долго (1 год и больше), рекомендуется возобновление ХТ, того же или иного режима. Если ответ был коротким или не получен вообще, рекомендуется выполнение ЛТ: на весь головной мозг или вовлеченные области с/или без системной терапии. В иных случаях, как опция рассматривается паллиативная терапия, для отдельных групп пациентов - ВДХТ с аутоТГСК.
3.7 Оценка ответа на лечение
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ после завершения всей программы лечения, рекомендуется оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом (см. раздел 7.6 данных рекомендаций) [17, 111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
3.8 Сопутствующая и сопроводительная терапия
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ с исходно массивным поражением, получающим противоопухолевую терапию, рекомендовано проведение профилактики синдрома лизиса опухолей согласно существующим профильным рекомендациям [89]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ со сниженной концентрацией гемоглобина крови рекомендовано лечение анемии согласно существующим профильным рекомендациям [112, 113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Всем пациентам с ДВКЛ, ПМВКЛ или ЛБ, получающим противоопухолевую химио- или лучевую терапию, рекомендована профилактика и лечение тошноты и рвоты в зависимости от эметогенного потенциала проводимого лечения согласно существующим профильным рекомендациям [114].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
- Пациентам с ДВКЛ, ПМВКЛ или ЛБ с выявленной симптоматической гипогаммаглобулинемией (перенесенная тяжелая инфекция, IgG < 4 г/л) рекомендовано проведение заместительной терапии #иммуноглобулином человека нормальным 0,2 - 0,4 г/кг в/в каждые 3 - 4 недели в течение 12 месяцев для лечения вторичного иммунодефицита [25, 115].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: терапия проводится под контролем уровня IgG каждые 6 месяцев, пересмотр дозы #иммуноглобулина человека нормального каждые 6 месяцев. После завершения терапии проводится пожизненное мониторирование уровня IgG 1 раз в год, в случае повторного снижения IgG < 4 г/л проводятся повторные курсы заместительной терапии аналогичным препаратом в аналогичном режиме в течение 12 месяцев.
- Для пациенток с ДВКЛ, ПМВКЛ или ЛБ - девочек и молодых женщин, у которых планируется лучевая терапия на подвздошную область, рекомендуется рассмотрение вопроса о необходимости гомолатеральной овариопексии для защиты яичников [116].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарий: овариопексия особенно показана, если ожидаемая доза облучения на яичники составит более 5 Гр, так как при этом может возникнуть длительная дисфункция яичника. Этого можно избежать, если лучевая терапия проводится с противоположных полей в СОД 20 Гр и яичник находится, как минимум, на расстоянии 2 см от границы лучевой области.
При проведении овариопексии нить должна быть обязательно помечена клипсой. Процедура выполняется хирургом немедленно после консультации врача-радиолога до начала лучевой терапии на поддиафрагмальную область.
Обезболивание
- Пациентам с ДВКЛ при возникновении острого или хронического болевого синдрома рекомендуется провести диагностику причины болевого синдрома и последующую терапию болевого синдрома в соответствии с существующими профильными рекомендациями [117, 118].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Диетотерапия
Не применяется.
4. Реабилитация
- Всем пациентам с ДВКЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также, при необходимости, поддерживающая терапия [119, 120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: Специальных методов реабилитации при ДВКЛ не существует. Реабилитация пациентов с ДВКЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
5. Профилактика
Методов профилактики ДВКЛ в настоящее время не существует, поскольку неизвестны этиологические факторы, ведущие к развитию заболевания.
- Взрослым пациентам, завершившим лечение по поводу ДВКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога с соблюдением следующей частоты обследований пациента - в течение первого года после завершения терапии каждые 3 месяца, 2-го года - каждые 6 месяцев, в дальнейшем - ежегодно, после 5 лет - каждые 2 года [11, 17, 18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий: диспансерное наблюдение должно включать тщательный сбор жалоб, клинический осмотр пациента, рентгенологический контроль органов грудной клетки (КТ или рентгенография), УЗИ брюшной полости и периферических лимфатических коллекторов. Для пациентов, получавших антрациклины и блеомицин в сочетании с облучением средостения - исследование функции сердца (ЭКТ и ЭхоКГ) и легких (спирография).
- Детям и подросткам, завершившим лечение по поводу ДВКЛ с достижением ПР, рекомендуется диспансерное наблюдение у врача-онколога или врача-гематолога по графику, представленному в табл. 5.1 [121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий:
Таблица 5.1. График диспансерного наблюдения детей после завершения терапии по поводу ДВКЛ
Обследование
1-ый год
2-ой год
3-ий год
4-ый год
5-ый год
6-ой год
Клинический осмотр
4 - 8x
4 - 8x
4x
2x
2x
Индивидуально
ОАК
4x
4x
2x
2x
2x
ФВД
1x
Индивидуально
УЗИ
4x
4x
2x
2x
2x
КТ, МРТ
2x
2 - 1x
1x
1x
1x
Гормоны щитовидной железы
1x
1x
1x
1x
1x
ЭКГ, ЭХО-КГ
1x
1x
- Детям и подросткам, завершившим лечение по поводу ДВКЛ с достижением ПР, рекомендуется скрининг поздних эффектов терапии (см. табл. 5.2), скрининг органных осложнений проведенного лечения (см. табл. 5.3) и скрининг по кардиотоксическим эффектам (в зависимости от проведенного лечения и возраста пациента - см. табл. 5.4) [121].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5).
Комментарий:
Таблица 5.2. Скрининг поздних эффектов противолимфомной терапии
1 год от окончания терапии
(каждые 3 мес.)
-
осмотр (рост/вес, объем яичек, признаки полового созревания)
-
ежемесячное самообследование молочных желез
-
общий анализ крови + СОЭ
-
Рентгенография органов грудной клетки/КТ шеи/грудной клетки для I - II + КТ живота/таза для III - IV стадий
-
ЭКГ/эхоКГ/Холтер, LH, FSH, эстрогены/тестостерон, гормоны щит. Железы
2 год от окончания терапии
-
осмотр, анализы и КТ каждые 6 мес.
-
ежегодно - маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса
3 год от окончания терапии
-
осмотр, анализы и КТ каждые 12 мес.
-
маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса
4 год от окончания терапии
-
осмотр, анализы и КТ каждые 12 мес.
-
маммолог, оценка функции сердца, легких, щитовидной железы и гормонального статуса
5 год от окончания терапии
Переход под наблюдение в катамнестическую службу
Таблица 5.3. Скрининг по кардиотоксическим эффектам
Функция сердца
Возраст
Облучение средостения
Доза антрациклинов
ЭхоКГ
< 1 года
+
любая
раз в год
-
< 200 мг/м2
каждые 2 года
> 200 мг/м2
раз в год
1 - 4 лет
+
любая
раз в год
-
< 100 мг/м2
каждые 5 лет
100 - 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
> 5 лет
+
< 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
-
< 200 мг/м2
каждые 5 лет
200 - 300 мг/м2
каждые 2 года
> 300 мг/м2
раз в год
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ДВКЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении ДВКЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза ДВКЛ (в случае отсутствия медицинских показаний к проведению патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-гематологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с ДВКЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ДВКЛ, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "онкология" определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по причине тяжести состояния, обусловленного опухолью, или по причине риска осложнений, связанных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, включающее биопсию и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно
Показания для экстренной госпитализации:
1. Развитие тяжелой инфекции (необязательна госпитализация в гематологический стационар).
2. Развитие угрожающих жизни цитопений (глубокой анемии, геморрагического синдрома, нейтропении).
3. Развитие осложнений ДВККЛ: симптоматическую лимфаденопатию и органомегалию с риском развития тяжелых осложнений, нейролейкемию, специфический плеврит, хилоторакс, синдром компрессии верхней полой с признаками дыхательной недостаточности и другие осложнения, угрожающие жизни.
4. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к выписке пациента из стационара:
1. Завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
2. Отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
3. Необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
4. Решение врачебной комиссии об отсутствии показаний к пребыванию пациента в стационаре в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Общие требования к морфологической диагностике лимфом
До биопсии лимфатического узла необходимо выполнить общий анализ крови с подсчетом лейкоцитарной формулы, чтобы исключить выполнение биопсии у пациентов с хроническим лимфолейкозом, моноклональным B-клеточным лимфоцитозом, острыми лейкозами, при лимфоцитозе инфекционной (HIV, EBV, CMV-инфекции, коклюш, вирусные гепатиты, токсоплазмоз и др.) или другой этиологии (поствакцинальный, лекарственная реакция, курение, тимома, "стрессорный" лимфоцитоз).
Диагноз ДВКЛ устанавливают на основании патолого-анатомического исследования с применением иммуногистохимических методов биопсийного или операционного материала. В части случаев необходимо проведение молекулярно-биологических и генетических тестов. Цитологическое исследование пунктатов или мазков-отпечатков лимфатических узлов или других опухолевых очагов является дополнительным методом исследования и не может служить достаточным основанием для диагноза лимфомы и ее нозологической верификации.
При первичном обследовании пациента во всех случаях проводится гистологическое и иммуногистохимическое исследование материала инцизионной или эксцизионной биопсии патологического очага или операционного материала при обязательном предоставлении врачу-патологоанатому выписки из амбулаторной карты/истории болезни пациента. Пунктировать лимфатические узлы для аспирации клеточной взвеси не следует. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах, тяжесть состояния пациента) при обосновании невозможности выполнения эксцизионной биопсии (отраженном в медицинской документации), объектом исследования может быть тканевой материал, полученный с помощью пистолетной ("кор"-) биопсии. Пригодным для исследования является биоптат диаметром не менее 16 G, при длине опухолевого инфильтрата в ткани не менее 1,5 см. Объем иммуногистохимического исследования определяет врач-патологоанатом при гистологическом изучении материала. Разделение материала между различными лабораториями категорически недопустимо. Протокол патолого-анатомического исследования биопсийного (операционного) материала должен содержать:
1. Макроскопическое описание материала, присланного для исследования; при исследовании готовых блоков и микропрепаратов в протоколе должны быть указаны количество и идентификационные номера всех присланных объектов.
2. Гистологическое описание лимфомы с указанием типа роста (диффузный, нодулярный и т.п.), характеристики клеточного состава (мелкие, крупные клетки, полиморфный состав, анапластическая, бластная/бластоидная морфология, наличие многоядерных форм, характеристика ядер), наличия реактивных и резидуальных компонентов.
3. Результаты иммуногистохимического исследования с указанием использованных антител и подробностей окрашивания, указывающих на специфический характер реакции (например, окрашивание ядер в реакциях с антителами к TdT, BCL-6, Cyclin D1; цитоплазмы - в реакциях на CD79a; гранулярная цитоплазматическая реакция - цитотоксические молекулы; окрашивание цитоплазмы или мембраны - в реакциях с антителами к CD3, тяжелым или легким цепям иммуноглобулинов; мембраны - в реакциях на CD20, CD10), интенсивность, особенности иммуногистоархитектоники. Представление результатов иммуногистохимических тестов только в виде "крестов" ("плюсов") и перечня антител недопустимо.
4. Заключение, сформулированное в соответствии с действующей редакцией классификации опухолей гемопоэтической и лимфоидной тканей (ВОЗ, 2017 г.).
Обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально.
Цитологическое исследование пунктата костного мозга (стернального или др.) не заменяет патолого-анатомическое исследование трепанобиоптата.
При наличии в общем анализе крови или миелограмме лимфоцитоза, независимо от числа лейкоцитов, а также при преобладании лимфоидных клеточных элементов, атипичных лимфоцитов или клеток с бластной морфологией в плевральной, асцитической или других биологических жидкостях необходимо выполнить иммунофенотипирование методом проточной цитометрии. Проточная цитометрия позволяет быстро провести дифференциальную диагностику опухолевого и реактивного лимфоцитоза, что важно для определения дальнейшей тактики обследования пациента. Материалом для анализа методом проточной цитометрии могут служить клетки крови, костного мозга, выпотных жидкостей, бронхоальвеолярного смыва, ликвора, гомогенизированные образцы тканей (селезенка, лимфатические узлы и т.д.), клеточная суспензия, полученная при аспирационной тонкоигольной пункции лимфатических узлов.
При определении стадии опухолевого процесса может потребоваться биопсия других очагов поражения, если нельзя исключить их опухолевую природу другими способами.
При рецидиве или прогрессировании заболевания обязательно выполнение повторной биопсии и патолого-анатомического исследования пораженных лимфатических узлов или экстранодальных очагов. Повторная биопсия также показана при наличии резидуальных очагов для подтверждения ремиссии. Проведение повторной биопсии патологического очага является обязательным при первично-резистентном течении или рецидиве заболевания в целях подтверждения диагноза или верификации опухолевой трансформации, а также исключения второй опухоли, инфекционного процесса.
Повторная аспирация и трепанобиопсия костного мозга выполняются для плановой оценки результатов лечения и при появлении клинически немотивированных цитопении и лихорадки. Аспират костного мозга может быть информативен для оценки регенерации и диспластических изменений миелопоэза. У пациентов с поражением костного мозга цитологическое исследование пунктата для оценки изменений объема опухолевой инфильтрации не всегда информативно.
6.2 Морфологическая и иммуногистохимическая диагностика агрессивных нефолликулярных B-клеточных лимфом
Морфологический субстрат диффузной B-клеточной крупноклеточной лимфомы (ДВКЛ) представлен центробластами, иммунобластами, клетками с многодольчатыми ядрами, клетками с полиморфными/анаплазированными ядрами в различных количественных соотношениях, что определяет морфологический вариант опухоли: центробластный, иммунобластный (> 90% опухолевых клеток с морфологией иммунобластов), анапластический.
Иммунофенотип опухоли характеризуется экспрессией пан-B-клеточных антигенов CD20, CD19, CD79a, PAX-5 (мономорфная интенсивная ядерная экспрессия), CD45 и отсутствием экспрессии CD3. CD30 (мембранная +/- dot-like реакция) может быть экспрессирован частью опухолевых клеток. CD5-позитивная ДВКЛ встречается примерно в 10% наблюдений. В этих случаях необходимо иммуногистохимическое исследование с антителами к Cyclin D1 для исключения полиморфноклеточного/бластоидного варианта лимфомы из клеток мантии. Вместе с тем, до 20% ДВКЛ могут экспрессировать Cyclin D1 (часть опухолевых клеток, слабая по интенсивности ядерная реакция).
ДВКЛ, как правило, характеризуется высокой митотической и пролиферативной активностью. Индекс пролиферации (по Ki-67) колеблется в широком диапазоне от 40% до 90%, в отдельных наблюдениях превышает 90%.
Изучение профиля экспрессии генов позволяет идентифицировать молекулярные подтипы ДВКЛ, что может иметь прогностическое значение: благоприятным признается GCB (герминоклеточный) подтип, неблагоприятным - ABC подтип (из активированных B-клеток). С помощью иммуногистохимического алгоритма с использованием суррогатных маркеров CD10, BCL-6, MUM.1 (алгоритм Hans, 2004; рис. 6.2.1) или CD10, BCL-6, FOXP1 (алгоритм Visco-Young, 2012; рис. 6.2.2) могут быть выделены иммуногистохимические подгруппы ДВКЛ (GCB и non-GCB типы), коррелирующие с профилем экспрессии генов.
Рисунок 6.2.1
Диагностический алгоритм Hans, 2004
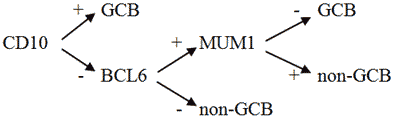
Рисунок 6.2.2
Диагностический алгоритм Visco-Young, 2012
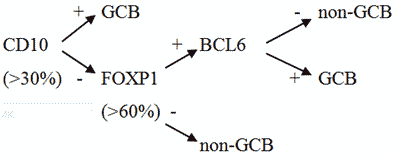
Для выявления случаев ДВКЛ с неблагоприятным прогнозом, требующих интенсификации терапии, классификация ВОЗ рекомендует исследовать наличие/отсутствие коэкспрессии c-Myc (учитывается при окрашивании более 40% клеток) и BCL-2 (более 50% клеток).
В диагностический алгоритм целесообразно включить определение перестройки гена MYC - ДВКЛ с реаранжировкой MYC встречается в около 10% случаев.
Если ткань опухоли, имеющая структуру ДВКЛ, содержит очаги некроза, участки ангиоцентрического роста, крупные одно-, двуядерные клетки с крупными ядрышками, напоминающие клетки Ходжкина и Рид-Штернберга, признаки плазмоцитоидной дифференцировки, необходимо включить в спектр дифференциальной диагностики EBV-позитивную ДВКЛ. Рекомендуется использовать панель маркеров: CD20, CD30, EBV-LMP, однако диагностика этой лимфомы часто невозможна без выявления малых PHK вируса Эпштейна-Барр - EBER (методом гибридизации in situ). При EBV+ ДВКЛ практически все крупные опухолевые клетки (> 90%) мономорфно экспрессируют EBER (ISH).
В целом, в спектре ДВКЛ (по классификации ВОЗ 2017 г.) опухолевый пролиферат с морфологией центробластов и/или иммунобластов может соответствовать по крайней мере 13 нозологическим формам лимфом:
- ДВКЛ, неуточненная
- ДВКЛ, богатая T-клетками и/или гистиоцитами
- Первичная кожная ДВКЛ, leg type
- Первичная ДВКЛ ЦНС
- Фибрин-ассоциированная ДВКЛ
- ДВКЛ, ассоциированная с хроническим воспалением
- ДВКЛ, EBV+, неуточненная
- Плазмобластная лимфома
- B-клеточная крупноклеточная лимфома, ALK+
- Внутрисосудистая B-клеточная крупноклеточная лимфома
- Первичная медиастинальная (тимическая) B-клеточная крупноклеточная лимфома
- ДВКЛ, HHV+, неуточненная
- B-клеточная лимфома высокой степени злокачественности с реаранжировками MYC и BCL-2 и/или BCL-6.
Нозологическая форма устанавливается с учетом клинико-анамнестических данных, локализации опухолевого поражения, на основе детального морфологического, расширенного ИГХ-исследования, с использованием в ряде случаев молекулярных тестов.
Лимфома Беркитта (ЛБ) представляет собой B-клеточную лимфому с диффузным ростом мономорфных клеток среднего размера с округлыми ядрами, высоким ядерно-цитоплазматическим соотношением, выраженными морфологическими признаками апоптоза. Типична картина "звездного неба" (макрофаги с фрагментами апоптозных телец в цитоплазме).
Опухоль имеет иммунофенотип CD20+, CD10+, CD38+, BCL-6+, BCL-2-, CD44-, TdT-, CD3-, EBER (ISH)-/+. Индекс пролиферативной активности опухолевых клеток (по Ki-67) приближается к 100%. В редких случаях часть опухолевых клеток слабо экспрессирует BCL-2 (цитоплазматическая реакция). Экспрессия MUM.1 (ядерная реакция) часто ассоциирована с наличием инфекции HIV и EBV.
Диагноз ЛБ требует обязательного проведения цитогенетического/FISH исследования для выявления транслокации c-myc/IgH, и исключения реаранжировок генов BCL-2, BCL-6.
Признаком, свидетельствующим о высокой вероятности реаранжировки гена c-MYC, является экспрессия белка c-MYC (клон Y69/EP121) в 100% опухолевых клеток с интенсивным ядерным окрашиванием.
B-клеточная лимфома высокой степени злокачественности встречается в виде
1. B-клеточной лимфомы высокой степени злокачественности с реаранжировками MYC, BCL-2 и/или BCL-6
2. B-клеточной лимфомы высокой степени злокачественности, неуточненной
B-клеточная лимфома высокой степени злокачественности в классификации ВОЗ 2017 г. заменила "B-клеточную лимфому, неклассифицируемую, занимающую промежуточное положение между диффузной крупноклеточной B-клеточной лимфомой и лимфомой Беркитта".
В отличие от классификации ВОЗ 2008 г., из этой группы исключены фолликулярная лимфома с трансформацией в B-клеточную лимфому высокой степени злокачественности с реаранжировками MYC, BCL-2, а также лимфобластная лимфома, TdT+ с реаранжировками MYC, BCL-2.
Диагностика B-клеточной лимфомы высокой степени злокачественности с реаранжировками MYC, BCL-2 и/или BCL-6 невозможна без выявления указанных реаранжировок. Необходимо учитывать, что изолированная реаранжировка MYC является одним из диагностических признаков лимфомы Беркитта, а также может встречаться при других лимфомах: диффузной B-клеточной крупноклеточной лимфоме (5 - 10% наблюдений), плазмобластной лимфоме (примерно в 50%), B-лимфобластной лимфоме TdT+.
Субстрат этой опухоли может напоминать ЛБ, иметь черты ЛБ и ДВКЛ, может иметь бластоидный вид, напоминая бластоидный вариант лимфомы из клеток мантии или лимфобластную лимфому, а также соответствовать диффузной B-клеточной крупноклеточной лимфоме. Диагностические иммунофенотипические признаки отсутствуют.
Опухоли с морфологическими/иммунофенотипическими чертами лимфомы Беркитта и диффузной B-клеточной крупноклеточной лимфомы ("промежуточного типа") или с бластоидной морфологией, но без указанных реаранжировок классифицируются как B-клеточные лимфомы высокой степени злокачественности, неуточненные (NOS).
Если опухоль имеет "промежуточную" морфологию, но полностью соответствует иммунофенотипу и генотипу лимфомы Беркитта, она диагностируется как лимфома Беркитта.
6.3 Стадирование агрессивных нефолликулярных B-клеточных лимфом
Стадирование ДВКЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (табл. 6.3.1). Данная классификация не применима для ПЛЦНС. Диагноз ПЛЦНС формулируется с указанием локализации очага поражения без указания стадии.
Таблица 6.3.1. Стадирование лимфом по Ann Arbor (модификация Лугано, 2014) [122]:
Стадия
Поражение лимфоузлов
Экстранодальное поражение
Стадия I
Вовлечение одного ЛУ или одной группы ЛУ
Локализованное поражение одного экстралимфатического органа или ткани без поражения ЛУ
Стадия II
Вовлечение >= 2 групп ЛУ по одну сторону диафрагмы
Стадия II bulky - стадия II с массивным поражением ЛУ
Локализованное поражение экстралимфатического органа или ткани + поражение регионарных ЛУ по одну сторону диафрагмы
Стадия III
Вовлечение ЛУ по обе стороны диафрагмы или вовлечение ЛУ выше диафрагмы с поражением селезенки
Стадия IV
Диффузное или диссеминированное поражение экстралимфатического органа или ткани с/без вовлечения ЛУ либо поражение экстранодального органа или ткани + поражение нерегионарных ЛУ
Для определения распространенности опухолевого процесса используется стадирование по S.B. Murphy (аналогично - St. Jude)
I стадия:
- одна локальная экстранодальная или нодальная, за исключением медиастинальной, абдоминальной или эпидуральной локализации
II стадия:
- одна экстранодальная опухоль с поражением региональных лимфоузлов
- две и более групп лимфоузлов по одну сторону диафрагмы
- две одиночные экстранодальные опухоли с/без поражения региональных лимфоузлов по одну сторону диафрагмы
- первичная опухоль желудочно-кишечного тракта, локализованная в илеоцекальной области с/без поражения мезентериальных лимфоузлов
- исключаются медиастинальные, абдоминальные и эпидуральные опухоли
IIR - резецированная опухоль (макроскопически полностью удалена)
IINR - не резецированная опухоль (макроскопически не полностью удалена)
III стадия:
- две одиночные экстранодальные опухоли по обе стороны диафрагмы
- две и более областей лимфоузлов по обе стороны диафрагмы
- все первичные внутригрудные опухоли (медиастинальные, плевральные)
- все обширные внутрибрюшные опухоли (нерезектабельные)
- все параспинальные и эпидуральные опухоли вне зависимости от других мест поражения
IV стадия:
- любая из перечисленных выше локализаций опухоли с инициальным поражением центральной нервной системы и/или костного мозга (бласты < 25%) и/или мультифокальным поражением скелета
Лимфома/лейкоз Беркитта (Стадия IV-ОЛЛ по типу L3):
- в костном мозге > 25% опухолевых клеток
6.4 Определение групп риска ДВКЛ у взрослых пациентов
Для анализа индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (для всей популяции пациентов - табл. 6.4.1 [123], и скорректированный по возрасту aaIPI (для пациентов моложе 60 лет - табл. 6.4.2 [124], которые не потеряли своего значения в условиях современных программ лечения.
Таблица 6.4.1. Международный прогностический индекс (IPI)
Категория риска
Кол-во факторов риска <*>
Ожидаемая 3-летняя общая выживаемость, %
Низкий
0 - 1
91 (89 - 94) <1>
Низкий промежуточный
2
81 (73 - 86)
Высокий промежуточный
3
65 (58 - 73)
Высокий
4 - 5
59 (49 - 69)
<*> Факторы риска:
- Возраст старше 60 лет
- ECOG >= 2
- Повышение ЛДГ
- Стадия III - IV
- > 1 экстранодальной зоны поражения.
--------------------------------
<1> По данным различных клинических исследований.
Таблица 6.4.2 Международный прогностический индекс, скорректированный по возрасту для пациентов моложе 60 лет (aaIPI)
Категория риска
Кол-во факторов риска <*>
Ожидаемая 3-летняя общая выживаемость, %
Низкий
0
98 (96 - 100)
Низкий промежуточный
1
92 (87 - 95)
Высокий промежуточный
2
75 (66 - 82)
Высокий
3
<*> Факторы риска:
- ECOG >= 2
- Повышение ЛДГ
- Стадия III - IV.
Прогностические модели типа R-IPI (пересмотренный в эру ритуксимаба) или E-IPI (шкала для пожилых) тестированы на меньшем числе пациентов и могут рассматриваться в качестве дополнительных прогностических конструкций.
Также существует шкала CNS-IPI для пациентов с ДВКЛ, отражающая риск развития рецидива/прогрессирования с поражением ЦНС
Категория риска
Кол-во факторов риска <*>
Риск вовлечения ЦНС в рецидиве/прогрессировании в течение 2 лет
Низкий
0 - 1
Менее 5%
промежуточный
2 - 3
Менее 5%
Высокий
4 - 6
Более 10%
<*> Факторы риска:
- Возраст более 60 лет
- Повышенный уровень лактатдегидрогеназы в крови
- ECOG статус выше 1
- Распространенные стадии (III или IV)
- Более чем один очаг экстранодального поражения
- Вовлечение почек и/или надпочечников.
В соответствии с приведенной прогностической моделью высокий риск поражения ЦНС в рецидиве ДВКЛ имеют пациенты с 4 - 6 прогностическими факторами, а также пациенты с ВИЧ-ассоциированной лимфомой, лимфомой яичка, лимфомой высокой степени злокачественности с транслокацией MYC, BCL-2 и/или BCL-6, лимфомой высокой степени злокачественности, неклассифицируемой, или ДВКЛ с вовлечением почек или надпочечников. Недавно получены данные о том, что стадия IE ДВКЛ с поражением молочных желез является потенциальным фактором риска для вовлечения ЦНС.
6.5 Определение групп риска ДВКЛ у пациентов моложе 18 лет
При лечении пациентов моложе 18 лет с ДВКЛ выбор рукава протокола группы BFM основывается на определении группы риска пациента:
RG1 - стадия I - II R; первичная опухоль макроскопически полностью удалена.
RG2 - стадия II NR-III; первичная опухоль не удалена или удалена не полностью:
1) только экстраабдоминальное поражение;
2) интраабдоминальная локализация, если показатель ЛДГ до начала ПХТ после инициальной операции не превышает удвоенных нормальных значений.
RG3, 4 - стадия II NR, III, IV; первичная опухоль не удалена или удалена не полностью, и имеет место хотя бы один из нижеперечисленных признаков:
1) при абдоминальном поражении увеличение ЛДГ более, чем в 2 раза от возрастной нормы перед началом ПХТ после оперативного вмешательства (биопсия или удаление опухоли);
2) поражение ЦНС;
3) поражение костного мозга;
4) мультифокальное поражение костей;
5) B-ОЛ (> 25% бластов в костном мозге).
6.6 Оценка ответа на лечение при лимфомах
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по лимфомам в 2007 году [111].
Полная ремиссия (ПР):
1. Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения.
2. Размеры лимфатических узлов:
a. <= 1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см
b. <= 1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 - 1,1 см
3. Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются.
4. Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически.
Для ДВКЛ ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 3 месяцев или констатируется дальнейшее улучшение.
Неуверенная полная ремиссия (ПРн) констатируется только у пациентов, которым не выполнялась ПЭТ-КТ для оценки эффекта:
1. Остаточные изменения, выявляемые только при помощи лучевых методов исследования (особенно это касается остаточных объемных образований в месте массивного опухолевого поражения, чаще всего в средостении), в случае сокращения опухоли более чем на 75% от исходных размеров по сумме двух наибольших ее диаметров. Эти остаточные изменения не должны увеличиваться в течение более чем 3 месяцев.
2. По другим показателям - соответствие критериям полной ремиссии.
Частичная ремиссия (ЧР):
1. Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3 см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более чем 6 очагов поражения более 3 см, достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении.
2. Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения.
3. В случае исходного поражения костного мозга, статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Пациенты с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация
Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации)
1. Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения.
2. Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении - увеличение до 1,5 см и более.
Ответ на лечение при ПЛЦНС должен оцениваться в соответствии с Международными рекомендациями 2005 г. [125]
Таблица 6.6.1 Международные критерии ответа на терапию ПЛЦНС.
Ответ на терапию
Визуализация структур мозга
Прием глюкокортикоидов
Результаты проверки зрения
Результат цитологии ликвора
Полный ответ
Нет накопления контраста
Нет
Норма
Негативный
Неподтвержденный полный ответ
Нет накопления контраста
Любая
Норма
Негативный
Минимальное отклонение от нормы
Любая
Небольшие нарушения в пигментном эпителии сетчатки
Негативный
Частичный ответ
Уменьшение размеров опухоли на 50%
Не имеет значения
Небольшие нарушения в пигментном эпителии сетчатки или норма
Негативный
Нет накопления контраста
Не имеет значения
Уменьшение клеток в стекловидном теле или инфильтрации сетчатки
Сохраняется патология или подозрение на патологию
Прогрессирование заболевания
Увеличение размеров опухоли на 25%
Новые очаги заболевания (ЦНС или другие лок.)
Не имеет значения
Рецидив или новое поражение глаз
Рецидив или появление признаков поражения
Следует отметить, что на момент установления полного ответа пациент не должен принимать какие-либо кортикостероиды для системного применения в течение двух недель. Редкие исключения возможны в случае, если пациент получает кортикостероиды для системного применения в связи с другим заболеванием (например, пангипопитуитаризм). Повторное офтальмологическое обследование не требуется у пациентов без признаков окулярной лимфомы исходно или без развития окулярных симптомов в последующий период. Пациентам без значительных патологических изменений состава цереброспинальной жидкости в исходном периоде не требуется проведение анализа цереброспинальной жидкости повторно при условии отсутствия отсроченных симптомов лептоменингеальной диссеминации.
6.7 Лучевая терапия при ДВКЛ
Лучевая терапия у первичных пациентов с ДВККЛ является, как правило, компонентом комбинированного иммуно-химиолучевого лечения, используется с целью консолидации ремиссии, достигнутой в результате проведения лекарственной терапии. Параметры лучевой терапии определяются в зависимости от первичной распространенности процесса - поражения лимфатических узлов, вовлечения и локализации экстранодальных очагов, объема остаточной опухоли. Объем облучения ограничен чаще всего исходно визуализируемыми лимфатическими узлами и экстранодальными очагами (involved sites). Определение исходных очагов поражения должно осуществляться с использованием контрастируемой компьютерной томографии, позитронно-эмиссионной томографии. Данные исследования должны проводиться и после завершения медикаментозного лечения для определения объема и СОД предстоящего облучения. Используемая в настоящее время технология планирования (3Д, 4Д) позволяет более точно определять границы опухоли и, соответственно, уменьшать размеры полей облучения.
При ДВКЛ I, II, III стадий, когда поражение ограничено лимфатическими узлами, а лучевая терапия используется для консолидации ремиссии, целесообразно применение объема облучения вовлеченных мест (ISRT). При отсутствии полной регрессии опухоли может быть использовано дополнительно локальное облучение ("буст"). При планировании облучения медицинским физиком должны быть рассчитаны гистограмма "доза-объем" и вероятность осложнений со стороны нормальных тканей, которые должны быть учтены радиотерапевтом при принятии окончательного плана облучения.
Дистанционную лучевую терапию целесообразно осуществлять на линейном ускорителе электронов. Режим облучения - традиционный, один раз в день, 5 раз в неделю. Разовая очаговая доза - 1,8 - 2,0 Гр. Суммарная очаговая доза, как правило, 30 Гр.
Лучевую терапию следует начинать через 2 - 4 недели после завершения иммунохимио- или химиотерапии.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень убедительности рекомендаций
Уровень достоверности доказательств
1.
Пациенту с подозрением на ДВКЛ, ПМВКЛ или ЛБ или с выявленной ДВКЛ, ПМВКЛ или ЛБ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы с оценкой абсолютного содержания лейкоцитов и количества ретикулоцитов, оценкой скорости оседания эритроцитов
C
5
2.
Пациенту с подозрением на ДВКЛ, ПМВКЛ или ЛБ или с выявленной ДВКЛ, ПМВКЛ или ЛБ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнен анализ крови биохимический общетерапевтический с включением следующих параметров: ЛДГ, мочевина, креатинин, общий белок, альбумин, билирубин, АСТ, АЛТ, щелочная фосфатаза, калий, натрий, хлор, кальций
C
5
3.
Пациенту с подозрением на ДВКЛ, ПМВКЛ или ЛБ или с выявленной ДВКЛ, ПМВКЛ или ЛБ при первичном или повторном приеме, после завершения каждого цикла терапии и перед началом каждого нового цикла терапии, при оценке ремиссии после завершения терапии, при контрольных обследованиях, или при подозрении на рецидив заболевания выполнено исследование свертывающей системы крови (коагулограмма) с включением следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер
C
5
4.
Пациенту при установлении диагноза ДВКЛ, ПМВКЛ или ЛБ, при оценке ответа на лечение, а также при подозрении на рецидив заболевания выполнено ПЭТ/КТ или ПЭТ всего тела, либо, при невозможности выполнить эти исследования, КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием), либо (при противопоказаниях против КТ или невозможности его выполнения) выполнены рентгенография органов грудной клетки в двух проекциях и ультразвуковое исследование лимфатических узлов и внутренних органов.
C
5
5.
Пациенту с подозрением на ДВКЛ, ПМВКЛ или ЛБ, с подозрением на рецидив ДВКЛ, ПМВКЛ или ЛБ, а также при неоднозначности трактовки противоопухолевого ответа после завершения лечения выполнена биопсия (взятие биопсийного материала) лимфатического узла либо другого очага поражения, патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов для верификации диагноза
C
5
6.
Пациенту при подозрении или наличии подтвержденного диагноза ДВКЛ, ПМВКЛ или ЛБ первично, после завершения терапии, при подозрении на рецидив заболевания выполнены получение цитологического препарата костного мозга путем пункции, цитологическое исследование мазка костного мозга (миелограмма), а также получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов.
B
3
Список литературы
1. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in Cancer (IARC)/ed. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p.
2. Барях Е.А. Лимфома Беркитта//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 80 - 87.
3. ![]() A.M. et al. Development of hematopoietic stem cell activity in the mouse embryo//Immunity. 1994. Vol. 1, N 4. P. 291 - 301.
A.M. et al. Development of hematopoietic stem cell activity in the mouse embryo//Immunity. 1994. Vol. 1, N 4. P. 291 - 301.
4. Melchers F. The pre-B-cell receptor: Selector of fitting immunoglobulin heavy chains for the B-cell repertoire//Nature Reviews Immunology. 2005. Vol. 5, N 7. P. 578 - 584.
5. Van Zelm M.C. et al. Replication history of B lymphocytes reveals homeostatic proliferation and extensive antigen-induced B cell expansion//J. Exp. Med. 2007. Vol. 204, N 3. P. 645 - 655.
6. Chen J. et al. Immunoglobulin gene rearrangement in B cell deficient mice generated by targeted deletion of the JH locus//Int. Immunol. 1993. Vol. 5, N 6. P. 647 - 656.
7. Teng G., Papavasiliou F.N. Immunoglobulin Somatic Hypermutation//Annu. Rev. Genet. Annual Reviews, 2007. Vol. 41, N 1. P. 107 - 120.
8. Yuan D. Regulation of IgM and IgD synthesis in B lymphocytes. II. Translational and post-translational events.//J. Immunol. 1984. Vol. 132, N 3. P. 1566 - 1570.
9. Natkunam Y. The biology of the germinal center.//Hematology/the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2007. P. 210 - 215.
10. Raghavan S.C., Hsieh C.-L., Lieber M.R. Both V(D)J Coding Ends but Neither Signal End Can Recombine at the bcl-2 Major Breakpoint Region, and the Rejoining Is Ligase IV Dependent//Mol. Cell. Biol. American Society for Microbiology, 2005. Vol. 25, N 15. P. 6475 - 6484.
11. Тумян Г.С. et al. Диффузная B-клеточная крупноклеточная лимфома//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 58 - 68.
12. Программное лечение заболеваний системы крови: Сборник алгоритмов диагностики и протоколов лечения заболеваний системы крови. Под ред. В.Г. Савченко. 2012. 1056 p.
13. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы//Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 409 - 502.
14. Burkitt D.P. The discovery of Burkitt's lymphoma.//Cancer. 1983. Vol. 51, N 10. P. 1777 - 1786.
15. Zelenetz A.D. et al. B-cell lymphomas. NCCN Clinical Practice Guidelines in Oncology. Version 5.2019.
16. Grommes C., DeAngelis L.M. Primary CNS lymphoma//Journal of Clinical Oncology. American Society of Clinical Oncology, 2017. Vol. 35, N 21. P. 2410 - 2418.
17. Демина Е.А. et al. Общие принципы диагностики лимфом//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 9 - 27.
18. Tilly H. et al. Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2015. Vol. 26 Suppl 5. P. v116 - 25.
19. Kuderer N.M. et al. A Validated Risk Score for Venous Thromboembolism Is Predictive of Cancer Progression and Mortality//Oncologist. Alphamed Press, 2016. Vol. 21, N 7. P. 861 - 867.
20. Santi R.M. et al. PO-03 - Khorana score and histotype predict the incidence of early venous thromboembolism (VTE) in Non Hodgkin Lymphoma (NHL). A pooled data analysis of twelve clinical trials of Fondazione Italiana Linfomi (FIL)//Thromb. Res. Elsevier BV, 2016. Vol. 140. P. S177.
21. Zhuang Y. et al. [Autoimmune hemolytic anemia associated with B-cell chronic lymphoproliferative disorders].//Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2013. Vol. 21, N 3. P. 633 - 636.
22. Sumi M. et al. [Primary diffuse large B-cell lymphoma of the bone marrow complicated with autoimmune hemolytic anemia and erythroid hypoplasia].//Rinsho. Ketsueki. 2007. Vol. 48, N 7. P. 571 - 575.
23. Wan S.-G. et al. Incipient Coombs' test negative autoimmune hemolytic anemia precedes non-Hodgkin's lymphoma.//Zhongguo shi yan xue ye xue za zhi. 2012. Vol. 20, N 1. P. 97 - 99.
24.  Y. et al. Autoimmune hemolytic anemia as presenting manifestation of primary splenic anaplastic large cell lymphoma.//Turk. J. Pediatr. Vol. 48, N 4. P. 354 - 356.
Y. et al. Autoimmune hemolytic anemia as presenting manifestation of primary splenic anaplastic large cell lymphoma.//Turk. J. Pediatr. Vol. 48, N 4. P. 354 - 356.
25. Srivastava S., Wood P. Secondary antibody deficiency-causes and approach to diagnosis//Clin. Med. J. R. Coll. Physicians London. 2016.
26. Мухортова О.В. Использование ПЭТ/КТ при лимфопролиферативных заболеваниях//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 168 - 179.
27. Pelosi E. et al. Bone marrow disease detection with FDG-PET/CT and bone marrow biopsy during the staging of malignant lymphoma: results from a large multicentre study.//Q. J. Nucl. Med. Mol. Imaging. 2011. Vol. 55, N 4. P. 469 - 475.
28. Khan A.B. et al. PET-CT staging of DLBCL accurately identifies and provides new insight into the clinical significance of bone marrow involvement//Blood. 2013. Vol. 122, N 1. P. 61 - 67.
29. Кузьмин А.А. et al. Первичная лимфома центральной нервной системы//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 87 - 93.
30. Fekri M.S., Zade M.K., Fatehi S. The association of deep vein thrombosis with cancer treatment modality: Chemotherapy or surgery?//Iran. Red Crescent Med. J. Kowsar Medical Publishing Company, 2014. Vol. 16, N 9.
31. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. КОСТА, Санкт-Петербург, 2006.
32. Бокерия Л.А., Затевахин И.И., Кириенко А.И. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО).//Флебология. 2015. Vol. 4, N 2. P. 3 - 52.
33. Кириенко А.И., Галстян Г.М., Савченко В.Г. Профилактика венозных тромбоэмболических осложнений при лимфопролиферативных заболеваниях//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 268 - 278.
34. Santi R.M. et al. Khorana score and histotype predicts incidence of early venous thromboembolism in Non-Hodgkin lymphomas: A Pooled-Data analysis of 12 clinical trials of fondazione italiana linfomi (FIL)//Thromb. Haemost. Schattauer GmbH, 2017. Vol. 117, N 8. P. 1615 - 1621.
35. Шмаков Р.Г., Демина Е.А. Лимфомы и беременность//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 143 - 150.
36. Coiffier B. et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: A study by the Groupe d'Etudes des Lymphomes de l'Adulte//Blood. American Society of Hematology, 2010. Vol. 116, N 12. P. 2040 - 2045.
37. Feugier P. et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: A study by the groupe d'etude des lymphomes de l'adulte//J. Clin. Oncol. 2005. Vol. 23, N 18. P. 4117 - 4126.
38. Pfreundschuh M. et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group//Lancet Oncol. 2006. Vol. 7, N 5. P. 379 - 391.
39. Miller T.P. et al. Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate-and high-grade non-Hodgkin's lymphoma//N. Engl. J. Med. 1998. Vol. 339, N 1. P. 21 - 26.
40. Horning S.J. et al. Chemotherapy with or without radiotherapy in limited-stage diffuse aggressive non-Hodgkin's lymphoma: Eastern Cooperative Oncology Group Study 1484//J. Clin. Oncol. 2004. Vol. 22, N 15. P. 3032 - 3038.
41. Persky D.O. et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group Study 0014//J. Clin. Oncol. 2008. Vol. 26, N 14. P. 2258 - 2263.
42.  T. et al. Six cycles of R-CHOP-21 are not inferior to eight cycles for treatment of diffuse large B-cell lymphoma: a Nordic Lymphoma Group Population-based Study.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2018. Vol. 29, N 8. P. 1882 - 1883.
T. et al. Six cycles of R-CHOP-21 are not inferior to eight cycles for treatment of diffuse large B-cell lymphoma: a Nordic Lymphoma Group Population-based Study.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2018. Vol. 29, N 8. P. 1882 - 1883.
43. Cunningham D. et al. Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: A phase 3 comparison of dose intensification with 14-day versus 21-day cycles//Lancet. Lancet Publishing Group, 2013. Vol. 381, N 9880. P. 1817 - 1826.
44. Kwon J. et al. Additional survival benefit of involved-lesion radiation therapy after r-chop chemotherapy in limited stage diffuse large b-cell lymphoma//Int. J. Radiat. Oncol. Biol. Phys. Elsevier Inc., 2015. Vol. 92, N 1. P. 91 - 98.
45. Illidge T. et al. Modern radiation therapy for nodal non-hodgkin lymphoma - Target definition and dose guidelines from the international lymphoma radiation oncology group//International Journal of Radiation Oncology Biology Physics. Elsevier Inc., 2014. Vol. 89, N 1. P. 49 - 58.
46. Held G. et al. Role of radiotherapy to bulky disease in elderly patients with aggressive b-cell lymphoma//J. Clin. Oncol. American Society of Clinical Oncology, 2014. Vol. 32, N 11. P. 1112 - 1118.
47. Shi Z. et al. Renewed interest in the role of consolidative radiotherapy in advanced stage diffuse large B-cell lymphoma//Leukemia and Lymphoma. 2013. Vol. 54, N 10. P. 2122 - 2130.
48. Boyle J. et al. Improving outcomes in advanced DLBCL: systemic approaches and radiotherapy.//Oncology (Williston Park). 2014. Vol. 28, N 12. P. 1074 - 1081, 1084.
49. Dabaja B.S. et al. Radiation for diffuse large B-cell lymphoma in the rituximab era: Analysis of the National Comprehensive Cancer Network lymphoma outcomes project//Cancer. John Wiley and Sons Inc., 2015. Vol. 121, N 7. P. 1032 - 1039.
50. Martino R. et al. Cyclophosphamide, pegylated liposomal doxorubicin (Caelyx), vincristine and prednisone (CCOP) in elderly patients with diffuse large B-cell lymphoma: results from a prospective phase II study.//Haematologica. Haematologica, 2002. Vol. 87, N 8. P. 822 - 827.
51. Zaja F. et al. CHOP-rituximab with pegylated liposomal doxorubicin for the treatment of elderly patients with diffuse large B-cell lymphoma//Leuk. Lymphoma. 2006. Vol. 47, N 10. P. 2174 - 2180.
52. Moccia A.A. et al. R-CHOP with Etoposide Substituted for Doxorubicin (R-CEOP): Excellent Outcome in Diffuse Large B Cell Lymphoma for Patients with a Contraindication to Anthracyclines.//Blood. American Society of Hematology, 2009. Vol. 114, N 22. P. 408 - 408.
53. Fields P.A. et al. De novo treatment of diffuse large B-cell lymphoma with rituximab, cyclophosphamide, vincristine, gemcitabine, and prednisolone in patients with cardiac comorbidity: A United Kingdom National Cancer Research Institute trial//J. Clin. Oncol. American Society of Clinical Oncology, 2014. Vol. 32, N 4. P. 282 - 287.
54. Han S.M. et al. Primary splenic lymphoma associated with hemophagocytic lymphohistiocytosis complicated with splenic rupture//J. Chinese Med. Assoc. Elsevier (Singapore) Pte Ltd, 2008. Vol. 71, N 4. P. 210 - 213.
55. Salles G. et al. Rituximab in B-Cell Hematologic Malignancies: A Review of 20 Years of Clinical Experience//Advances in Therapy. 2017. Vol. 34, N 10. P. 2232 - 2273.
56. Raefsky E.L. et al. Brief duration rituximab(R)/chemotherapy (CNOP or CVP) followed by maintenance rituximab in elderly/poor performance status patients (pts) with diffuse large B-cell lymphoma (DLBCL): A phase II trial of the Minnie Pearl Cancer Research Network//J. Clin. Oncol. American Society of Clinical Oncology, 2006. Vol. 24, N 18_suppl. P. 7577 - 7577.
57.  R. et al. Practical aspects of the use of intrathecal chemotherapy Aspectos
R. et al. Practical aspects of the use of intrathecal chemotherapy Aspectos  de la
de la  de quimioterapia intratecal//Farm Hosp. 2017. Vol. 41, N 1. P. 105 - 129.
de quimioterapia intratecal//Farm Hosp. 2017. Vol. 41, N 1. P. 105 - 129.
58. Perry C. et al. Characteristics, management and outcome of DLBCL patients, presenting with simultaneous systemic and CNS disease at diagnosis: A retrospective multicenter study//Am. J. Hematol. Wiley-Liss Inc., 2019. Vol. 94, N 9. P. 992 - 1001.
59. Peyrade F. et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: A multicentre, single-arm, phase 2 trial//Lancet Oncol. 2011. Vol. 12, N 5. P. 460 - 468.
60. Peyrade F. et al. Long-term follow-up of the GELA LNH 03-7B study: A prospective phase II study of 150 patients over 80 years with diffuse large B-cell lymphoma (DLBCL) treated with RminiCHOP.//J. Clin. Oncol. American Society of Clinical Oncology, 2013. Vol. 31, N 15_suppl. P. 8536.
61. Laribi K. et al. R-CVP regimen is active in frail elderly patients aged 80 or over with diffuse large B cell lymphoma//Ann. Hematol. Springer Verlag, 2016. Vol. 95, N 10. P. 1705 - 1714.
62. Arakaki H. et al. Comparison of R-CVP with R-CHOP for very elderly patients aged 80 or over with diffuse large B cell lymphoma//Annals of Hematology. Springer Verlag, 2017. Vol. 96, N 7. P. 1225 - 1226.
63. Zeremski V. et al. Is bendamustine-rituximab a reasonable treatment in selected older patients with diffuse large B cell lymphoma? Results from a multicentre, retrospective study//Ann. Hematol. Springer, 2019. Vol. 98, N 12. P. 2729 - 2737.
64. Storti S. et al. Rituximab plus bendamustine as front-line treatment in frail elderly (> 70 years) patients with diffuse large b-cell non-hodgkin lymphoma: A phase ii multicenter study of the fondazione italiana linfomi//Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, N 8. P. 1345 - 1350.
65. Zinzani P.L. et al. Rituximab combined with MACOP-B or VACOP-B and radiation therapy in primary mediastinal large B-cell lymphoma: A retrospective study//Clin. Lymphoma Myeloma. Cancer Information Group, LP, 2009. Vol. 9, N 5. P. 381 - 385.
66. Вернюк М.А. et al. Опыт лечения первичной медиастинальной B-крупноклеточной лимфомы//Онкогематология. 2013. Vol. 4. P. 18 - 23.
67. Тумян Г.С. Первичная медиастинальная B-крупноклеточная лимфома: диагностика, клиническая картина и лечение//Современная онкология. 2008. Vol. 10, N 3. P. 66 - 68.
68. Dunleavy K. et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma//N. Engl. J. Med. Massachussetts Medical Society, 2013. Vol. 368, N 15. P. 1408 - 1416.
69. Chan E.H.L. et al. Real world experience of R-CHOP with or without consolidative radiotherapy vs DA-EPOCH-R in the first-line treatment of primary mediastinal B-cell lymphoma//Cancer Med. Blackwell Publishing Ltd, 2019. Vol. 8, N 10. P. 4626 - 4632.
70. Мангасарова Я.К. et al. Первичная медиастинальная (тимическая) B-крупноклеточная лимфома: диагностика отдаленных экстрамедиастинальных поражений и возможности лечения//Клиническая онкогематология. 2018. Vol. 11, N 3. P. 220 - 226.
71. Derenzini E. et al. Cyclophosphamide, doxorubicin, vincristine, methotrexate, bleomicin and prednisone plus rituximab in untreated young patients with low-risk (age-adjusted international prognostic index 01) diffuse large B-cell lymphoma//Leuk. Lymphoma. Taylor & Francis, 2009. Vol. 50, N 11. P. 1824 - 1829.
72. Thiel E. et al. High-dose methotrexate with or without whole brain radiotherapy for primary CNS lymphoma (G-PCNSL-SG-1): a phase 3, randomised, non-inferiority trial//Lancet Oncol. 2010. Vol. 11, N 11. P. 1036 - 1047.
73. Ferreri A.J. et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial//Lancet. 2009. Vol. 374, N 9700. P. 1512 - 1520.
74. Rubenstein J.L. et al. Intensive chemotherapy and immunotherapy in patients with newly diagnosed primary CNS lymphoma: CALGB 50202 (Alliance 50202)//J. Clin. Oncol. 2013. Vol. 31, N 25. P. 3061 - 3068.
75. Chamberlain M.C., Johnston S.K. High-dose methotrexate and rituximab with deferred radiotherapy for newly diagnosed primary B-cell CNS lymphoma.//Neuro. Oncol. 2010. Vol. 12, N 7. P. 736 - 744.
76. Holdhoff M. et al. High-dose methotrexate with or without rituximab in newly diagnosed primary CNS lymphoma//Neurology. Lippincott Williams and Wilkins, 2014. Vol. 83, N 3. P. 235 - 239.
77. Omuro A. et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: An intergroup ANOCEF-GOELAMS randomised phase 2 trial//Lancet Haematol. Elsevier Ltd, 2015. Vol. 2, N 6. P. e251 - e259.
78. Morris P.G. et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: Final results and long-term outcome//J. Clin. Oncol. American Society of Clinical Oncology, 2013. Vol. 31, N 31. P. 3971 - 3979.
79. Fritsch K. et al. Immunochemotherapy with rituximab, methotrexate, procarbazine, and lomustine for primary CNS lymphoma (PCNSL) in the elderly.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2011. Vol. 22, N 9. P. 2080 - 2085.
80. Wong E.T. et al. Immunochemotherapy with rituximab and temozolomide for central nervous system lymphomas//Cancer. 2004. Vol. 101, N 1. P. 139 - 145.
81. Illerhaus G. et al. High-dose chemotherapy with autologous stem-cell transplantation and hyperfractionated radiotherapy as first-line treatment of primary CNS lymphoma//J. Clin. Oncol. 2006. Vol. 24, N 24. P. 3865 - 3870.
82. Houillier C. et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study.//J. Clin. Oncol. American Society of Clinical Oncology, 2019. Vol. 37, N 10. P. 823 - 833.
83. Ferreri A.J.M. et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: Results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial//Lancet Haematol. Elsevier Ltd, 2016. Vol. 3, N 5. P. e217 - e227.
84. Maschan A. et al. Rituximab and reduced-intensity chemotherapy in children and adolescents with mature B-cell lymphoma: interim results for 231 patients enrolled in the second Russian-Belorussian multicentre study B-NHL-2010M//Br. J. Haematol. Blackwell Publishing Ltd, 2019. Vol. 186, N 3. P. 477 - 483.
85. Kane E. et al. Emergency admission and survival from aggressive non-Hodgkin lymphoma: A report from the UK's population-based Haematological Malignancy Research Network//Eur. J. Cancer. Elsevier Ltd, 2017. Vol. 78. P. 53 - 60.
86. Senbanjo I.O. Tumor lysis and acute renal failure in Burkitt's lymphoma: A review on pathophysiology and management//Indian Journal of Nephrology. 2009. Vol. 19, N 3. P. 83 - 86.
87. Oosten L.E.M. et al. Treatment of sporadic Burkitt lymphoma in adults, a retrospective comparison of four treatment regimens.//Ann. Hematol. 2018. Vol. 97, N 2. P. 255 - 266.
88. Dunleavy K. Approach to the Diagnosis and Treatment of Adult Burkitt's Lymphoma//J. Oncol. Pract. American Society of Clinical Oncology (ASCO), 2018. Vol. 14, N 11. P. 665 - 671.
89. Барях Е.А., Мякова Н.В., Поддубная И.В. Профилактика и лечение синдрома лизиса опухоли//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 251 - 253.
90. Барях Е.А. et al. Лейкоз/лимфома Беркитта: клинические особенности, диагностические критерии, терапевтическая тактика//Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2010. Vol. 3, N 2. P. 138 - 143.
91. Дудина Г.А., Пивник А.В. Неходжкинские лимфомы у больных ВИЧ-инфекцией//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 126 - 137.
92. Sweetenham J.W. et al. Adult Burkitt's and Burkitt-like non-Hodgkin's lymphoma - Outcome for patients treated with high-dose therapy and autologous stem-cell transplantation in first remission or at relapse: Results from the European group for blood and marrow transplantation//J. Clin. Oncol. American Society of Clinical Oncology, 1996. Vol. 14, N 9. P. 2465 - 2472.
93. Doocey R.T. et al. Allogeneic haematopoietic stem-cell transplantation for relapsed and refractory aggressive histology non-Hodgkin lymphoma.//Br. J. Haematol. 2005. Vol. 131, N 2. P. 223 - 230.
94. Guidelines for the management of non--Hodgkin's and Hodgkin's lymphoma in adults. 2015.
95. Velasquez W.S. et al. ESHAP - An effective chemotherapy regimen in refractory and relapsing lymphoma: A 4-year follow-up study//J. Clin. Oncol. American Society of Clinical Oncology, 1994. Vol. 12, N 6. P. 1169 - 1176.
96. Zelenetz A.D. et al. Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin's lymphoma//Ann. Oncol. 2003. Vol. 14, N SUPPL. 1.
97. Crump M. et al. Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: A phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG)//Cancer. 2004. Vol. 101, N 8. P. 1835 - 1842.
98. Corazzelli G. et al. Long-term results of gemcitabine plus oxaliplatin with and without rituximab as salvage treatment for transplant-ineligible patients with refractory/relapsing B-cell lymphoma.//Cancer Chemother. Pharmacol. 2009. Vol. 64, N 5. P. 907 - 916.
99. Chau I. et al. An oxaliplatin-based chemotherapy in patients with relapsed or refractory intermediate and high-grade non-Hodgkin's lymphoma//Br. J. Haematol. 2001. Vol. 115, N 4. P. 786 - 792.
100. Amorim S. et al. Consolidation therapy with mitoxantrone, ifosfamide and etoposide with or without rituximab before stem cell transplantation in relapsed diffuse large B-cell lymphoma patients failing second-line treatment//Leukemia and Lymphoma. Taylor and Francis Ltd, 2016. Vol. 57, N 10. P. 2425 - 2428.
101. Philip T. et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-hodgkin's lymphoma//N. Engl. J. Med. 1995. Vol. 333, N 23. P. 1540 - 1545.
102. Mounier N. et al. Rituximab plus gemcitabine and oxaliplatin in patients with refractory/relapsed diffuse large B-cell lymphoma who are not candidates for high-dose therapy. A phase II lymphoma study Association trial//Haematologica. 2013. Vol. 98, N 11. P. 1726 - 1731.
103. Vacirca J.L. et al. Bendamustine combined with rituximab for patients with relapsed or refractory diffuse large B cell lymphoma//Ann. Hematol. 2014. Vol. 93, N 3. P. 403 - 409.
104. Ohmachi K. et al. Multicenter phase II study of bendamustine plus rituximab in patients with relapsed or refractory diffuse large B-cell lymphoma//Journal of Clinical Oncology. American Society of Clinical Oncology, 2013. Vol. 31, N 17. P. 2103 - 2109.
105. Chao N.J., Rosenberg S.A., Horning S.J. CEPP(B): An effective and well-tolerated regimen in poor-risk, aggressive non-Hodgkin's lymphoma//Blood. 1990. Vol. 76, N 7. P. 1293 - 1298.
106. Gopal A.K. et al. Efficacy and safety of gemcitabine, carboplatin, dexamethasone, and rituximab in patients with relapsed/refractory lymphoma: A prospective multi-center phase II study by the Puget Sound Oncology Consortium//Leuk. Lymphoma. 2010. Vol. 51, N 8. P. 1523 - 1529.
107. Papageorgiou E.S. et al. Combination chemotherapy with gemcitabine and vinorelbine in the treatment of relapsed or refractory diffuse large B-cell lymphoma: A phase-II trial by the Hellenic Cooperative Oncology Group//Eur. J. Haematol. 2005. Vol. 75, N 2. P. 124 - 129.
108. McLaughlin P. et al. Chemotherapy with dexamethasone, high-dose cytarabine, and cisplatin for parenchymal brain lymphoma.//J. Natl. Cancer Inst. 1988. Vol. 80, N 17. P. 1408 - 1412.
109. Welch M.R. et al. Autologous stem cell transplant in recurrent or refractory primary or secondary central nervous system lymphoma using thiotepa, busulfan and cyclophosphamide//Leuk. Lymphoma. Informa Healthcare, 2015. Vol. 56, N 2. P. 361 - 367.
110. Nguyen P.L. et al. Results of whole-brain radiation as salvage of methotrexate failure for immunocompetent patients with primary CNS lymphoma//J. Clin. Oncol. 2005. Vol. 23, N 7. P. 1507 - 1513.
111. Cheson B.D. et al. Revised response criteria for malignant lymphoma//Journal of Clinical Oncology. 2007. Vol. 25, N 5. P. 579 - 586.
112. Aapro M. et al. Клинические рекомендации по лечению анемии у больных злокачественными новообразованиями. М.: Ассоциация онкологов России, 2014.
113. Орлова Р.В. et al. Практические рекомендации по лечению анемии при злокачественных новообразованиях//Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 494 - 501.
114. Владимирова Л.Ю. et al. Практические рекомендации по профилактике и лечению тошноты и рвоты у онкологических больных//Практические рекомендации Российского общества клинической онкологии. Лекарственное лечение злокачественных опухолей. Поддерживающая терапия в онкологии. 2018. P. 502 - 511.
115. Константинова Т.С., Клясова Г.А., Капланов К.Д. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями.//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 289 - 311.
116. Meirow D., Nugent D. The effects of radiotherapy and chemotherapy on female reproduction//Hum. Reprod. Update. 2001. Vol. 7, N 6. P. 535 - 543.
117. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
118. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278 - 288.
119. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 - 94.
120. Rozental A. et al. The role of maintenance therapy in patients with diffuse large B cell lymphoma: A systematic review and meta-analysis//Hematol. Oncol. John Wiley and Sons Ltd, 2019. Vol. 37, N 1. P. 27 - 34.
121. Румянцев А.Г., Самочатова Е.В. Практическое руководство по детским болезням. Гематология/онкология детского возраста. Медпрактика-М, Москва, 2004.
122. Cheson B.D. et al. Recommendations for initial evaluation, staging, and response assessment of hodgkin and non-hodgkin lymphoma: The lugano classification//Journal of Clinical Oncology. American Society of Clinical Oncology, 2014. Vol. 32, N 27. P. 3059 - 3067.
123. A Predictive Model for Aggressive Non-Hodgkin's Lymphoma//N. Engl. J. Med. 1993. Vol. 329, N 14. P. 987 - 994.
124. Abdelhamid T. et al. Clinical prognostic factors of diffuse large B cell non-Hodgkin lymphoma: A retrospective study//J. Egypt. Natl. Canc. Inst. 2011. Vol. 23, N 1. P. 17 - 24.
125. Abrey L.E. et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma//Journal of Clinical Oncology. 2005. Vol. 23, N 22. P. 5034 - 5043.
126. Yelvington B.J. Subcutaneous Rituximab in Follicular Lymphoma, Chronic Lymphocytic Leukemia, and Diffuse Large B-Cell Lymphoma.//J. Adv. Pract. Oncol. Harborside Press, 2018. Vol. 9, N 5. P. 530 - 534.
127. Davies A. et al. Subcutaneous Rituximab for the Treatment of B-Cell Hematologic Malignancies: A Review of the Scientific Rationale and Clinical Development//Advances in Therapy. Springer Healthcare, 2017. Vol. 34, N 10. P. 2210 - 2231.
128.  R. et al. Safety of switching from intravenous to subcutaneous rituximab during first-line treatment of patients with non-Hodgkin lymphoma: the Spanish population of the MabRella study//Br. J. Haematol. Blackwell Publishing Ltd, 2020. Vol. 188, N 5. P. 661 - 673.
R. et al. Safety of switching from intravenous to subcutaneous rituximab during first-line treatment of patients with non-Hodgkin lymphoma: the Spanish population of the MabRella study//Br. J. Haematol. Blackwell Publishing Ltd, 2020. Vol. 188, N 5. P. 661 - 673.
129. Macdonald D. et al. A canadian perspective on the subcutaneous administration of rituximab in non-Hodgkin lymphoma//Current Oncology. Multimed Inc., 2017. Vol. 24, N 1. P. 33 - 39.
130. Gang A.O. et al. R-CHOEP-14 improves overall survival in young high-risk patients with diffuse large B-cell lymphoma compared with R-CHOP-14. A population-based investigation from the Danish Lymphoma Group.//Ann. Oncol. Off. J. Eur. Soc. Med. Oncol. 2012. Vol. 23, N 1. P. 147 - 153.
131. Thomas D.A. et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia//Cancer. 2006. Vol. 106, N 7. P. 1569 - 1580.
132. Batchelor T. et al. Treatment of Primary CNS Lymphoma With Methotrexate and Deferred Radiotherapy: A Report of NABTT 96-07//J. Clin. Oncol. American Society of Clinical Oncology, 2003. Vol. 21, N 6. P. 1044 - 1049.
133. Zhu J.-J. et al. High-dose methotrexate for elderly patients with primary CNS lymphoma//Neuro. Oncol. Oxford University Press (OUP), 2009. Vol. 11, N 2. P. 211 - 215.
134. Samochatova E.V. et al. Therapy of advanced-stage mature b-cell lymphoma and leukemia in children and adolescents with rituximab and reduced intensity induction chemotherapy (B-NHL 2004M protocol): The results of a multicenter study//J. Pediatr. Hematol. Oncol. Lippincott Williams and Wilkins, 2014. Vol. 36, N 5. P. 395 - 401.
135. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group//Am. J. Clin. Oncol. 1982. Vol. 5, N 6. P. 649 - 655.
136. Meignan M., Gallamini A., Haioun C. Report on the First International Workshop on interim-PET scan in lymphoma//Leukemia and Lymphoma. 2009. Vol. 50, N 8. P. 1257 - 1260.
137. Khorana A. et al. Development and validation of a predictive model for chemotherapy-associated thrombosis//Blood. 2008. Vol. 111, N 10. P. 4902 - 4907.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Тумян Гаяне Сергеевна - д.м.н., профессор, профессор кафедры онкологии и паллиативной медицины Российской медицинской академии непрерывного профессионального образования Минздрава России, ведущий научный сотрудник отделения химиотерапии гемобластозов "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член правления Российского общества онкогематологов.
2. Османов Евгений Александрович - д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава России, член правления Российского общества онкогематологов.
3. Кравченко Сергей Кириллович - к.м.н., доцент, зав. отделением интенсивной высокодозной химиотерапии с круглосуточным и дневным стационаром ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
4. Фалалеева Наталья Александровна - д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
5. Барях Елена Александровна - к.м.н., зав. отделением гематологии и химиотерапии ГБК N 52 г. Москвы, доцент кафедры общей терапии ФДПО РНИМУ им Н.И. Пирогова, член Российского общества онкогематологов, Европейской гематологической ассоциации
6. Стефанов Дмитрий Николаевич - научный сотрудник, зав. научно-организационным отделом, ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Российского общества онкогематологов, Европейской гематологической ассоциации
7. Поддубная Ирина Владимировна - академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
8. Михайлова Наталья Борисовна - д.м.н., руководитель отдела клинической онкологии (химиотерапии) НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, член Российского общества онкогематологов.
9. Мякова Наталья Валерьевна - д.м.н., профессор, Заместитель главного врача по лечебной работе, зав. отделением онкогематологии ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член Национального общества детских гематологов и онкологов
10. Румянцев Александр Григорьевич - академии РАН, д.м.н., профессор, генеральный директор ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, президент Национального общества детских гематологов и онкологов
11. Масчан Алексей Александрович - член-корр. РАН, д.м.н., профессор, зам. генерального директора ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член правления Национального общества детских гематологов и онкологов
12. Птушкин Вадим Вадимович - д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ "ГКБ им. С.П. Боткина", главный внештатный специалист-гематолог Департамента здравоохранения города Москвы, член Национального гематологического общества и Российского общества онкогематологов.
13. Савченко В.Г., академик, д.м.н., профессор, генеральный директор ФГБУ "НМИЦ гематологии" Минздрава России, председатель Национального гематологического общества
14. Паровичникова Е.Н., д.м.н., заведующая научно-клиническим отделом химиотерапии гемобластозов, депрессий кроветворения и трансплантации костного мозга ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
15. Троицкая В.В., к.м.н., заведующая научно-клиническим отделением химиотерапии гемобластозов и депрессий кроветворения ФГБУ "НМИЦ гематологии" Минздрава России, директор Национального гематологического общества
16. Соколов А.Н., к.м.н., старший научный сотрудник научно-клинического отделения химиотерапии гемобластозов и депрессий кроветворения ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
17. Кузьмина Л.А., к.м.н., заведующая научно-клиническим отделением трансплантации костного мозга ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
18. Клясова Г.А., д.м.н., профессор, заведующая научно-клинической лабораторией микробиологии ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
19. Гаврилина О.А., к.м.н., старший научный сотрудник отделения химиотерапии гемобластозов и депрессий кроветворения ФГБУ "НМИЦ гематологии" Минздрава России, член Национального гематологического общества
20. Бондаренко С.Н., к.м.н., НИИ детской гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербургский государственный медицинский университет
21. Баранова О.Ю., к.м.н., старший научный сотрудник отделения гематологии ФГБУ "НМИЦ им. Н.Н. Блохина", член Национального гематологического общества
22. Константинова Т.С., ГБУЗ СО "Областной гематологический центр Свердловской областной клинической больницы N 1", член Национального гематологического общества и Российского общества онкогематологов
23. Самойлова О.С., к.м.н., заведующая отделением гематологии ГБУЗ НО "Нижегородская областная клиническая больница им. Н.А. Семашко", член Национального гематологического общества и Российского общества онкогематологов
24. Капорская Т.С., к.м.н., заведующая отделением гематологии, ГБУЗ "Иркутская ордена "Знак Почета" областная клиническая больница", член Национального гематологического общества
25. Лапин В.А., к.м.н., заведующий отделением гематологии ГБУЗ ЯО "Областная клиническая больница"
26. Капланов К.Д., к.м.н., заведующий отделением гематологии ГБУЗ "Волгоградский областной онкологический диспансер", член Национального гематологического общества и Российского общества онкогематологов
27. Байков Вадим Валентинович - д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
28. Ковригина Алла Михайловна - д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением "НМИЦ гематологии" Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
29. Криволапов Юрий Александрович - д.м.н., профессор, зав. патологоанатомическим отделением клинической молекулярной морфологии клиники им. Э.Э. Эйхвальда ФГБОУ СЗГМУ им. И.И. Мечникова Минздрава России, член панели патологов Европейской сети исследования лимфом, член Европейской рабочей группы исследования костного мозга, член президиума Российского общества патологоанатомов
30. Коновалов Дмитрий Михайлович - к.м.н., зав. патологанатомическим отделением ФГБУ "НМИЦ ДГОИ им. Дмитрия Рогачева" Минздрава России, член президиума Российского общества патологоанатомов
31. Трофимова Оксана Петровна - д.м.н., ведущий научный сотрудник радиологического отделения ФГБУ "НМИЦ им. Н.Н. Блохина" Минздрава России, доцент кафедры онкологии ГБОУ ДПО РМАНПО Минздрава России, член Российской Ассоциации терапевтических радиационных онкологов.
32. Сотников Владимир Михайлович - д.м.н., руководитель лаборатории лучевой терапии ФГБУ "РНЦРР" Минздрава России.
33. Ильин Николай Васильевич - д.м.н., профессор, профессор кафедры радиологии, хирургии и онкологии, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ "Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова" Минздрава России.
34. Виноградова Юлия Николаевна - д.м.н., руководитель отдела лучевых и комбинированных методов лечения, главный научный сотрудник отдела лучевых и комбинированных методов лечения ФГБУ "Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова" Минздрава России.
35. Невольских Алексей Алексеевич - д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
36. Иванов Сергей Анатольевич - профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
37. Хайлова Жанна Владимировна - кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
38. Геворкян Тигран Гагикович - заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина".
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи.
2. Врачи-онкологи.
3. Врачи - детские онкологи.
4. Врачи-радиологи.
5. Студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
- поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 4, 5).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа.
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования.
4
Несравнительные исследования, описание клинического случая.
5
Имеется лишь обоснование механизма действия или мнение экспертов.
Таблица А2.2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор РКИ с применением метаанализа.
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа.
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования.
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль".
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов.
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными).
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными).
C
Слабая рекомендация (отсутствие доказательств надлежащего качества, все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными).
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание методики валидизации рекомендаций. Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами.
Окончательная редакция. Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Приложение А3.1
РЕЖИМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ДВКЛ
При проведении химиотерапии рекомендуется контролировать вес пациента и производить пересчет доз химиопрепаратов при изменении веса.
A3.1.1 Схемы терапии ДВКЛ и ПМВКЛ
R-CHOP
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Доксорубицин** 50 мг/м2 в/в кап., день 1
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Преднизолон** 100 мг внутрь, дни 1 - 5
Лечение возобновляется на 22 день
У пациентов пожилого возраста с сердечно-сосудистой патологией возможно применение пегилированного липосомального доксорубицина** 30 мг/м2 в/в кап., день 1 [51]
R-CVP [61, 62]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Преднизолон** 40 мг/м2 внутрь, дни 1 - 5
Лечение возобновляется на 22 день
BR [63, 64]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Бендамустин** 90 мг/м2 в/в кап., дни 1, 2
Лечение возобновляется на 28 день
R-miniCHOP [59]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Доксорубицин** 25 мг/м2 в/в кап., день 1
- Циклофосфамид** 400 мг/м2 в/в кап., день 1
- #Винкристин** 1 мг в/в, день 1
- Преднизолон** 40 мг/м2 внутрь, дни 1 - 5
Лечение возобновляется на 22 день
R-CEOP [11, 52]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- Этопозид** 50 мг/м2 в/в, день 1
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Преднизолон** 40 мг/м2 внутрь, дни 1 - 5
Лечение возобновляется на 22 день
R-GCVP [53]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- #Гемцитабин** 750 мг/м2 (цикл 1), 875 мг/м2 (цикл 2), 1000 мг/м2 (цикл 3 и далее) в/в кап., дни 1, 8
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Преднизолон** 100 мг внутрь, дни 1 - 5
Эскалация дозы #гемцитабина** проводится в случае отсутствия гематологической токсичности. Лечение возобновляется на 22 день
R-CCOP [50]
- Ритуксимаб** [55]
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- Пегилированный липосомальный доксорубицин** 30 мг/м2 в/в кап., день 1
- #Винкристин** 2 мг в/в, день 1
- Преднизолон** 60 мг/м2 внутрь, дни 1 - 5
R-CHOEP [130]
- Ритуксимаб** [55]
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Доксорубицин** 50 мг/м2 в/в кап., день 1
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Этопозид** 100 мг/м2 в/в кап., дни 1 - 3
- Преднизолон** 100 мг внутрь, дни 1 - 5
Лечение возобновляется на 22 день
R-CNOP [56]
- Ритуксимаб** [55]
- 375 мг/м2 в/в кап., день 0 или 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 или 1 [126 - 129]
- Циклофосфамид** 500 мг/м2 в/в кап., день 1
- Митоксантрон** 10 мг/м2 в/в, день 1
- #Винкристин** 1,0 мг/м2 (суммарно не более 2 мг) в/в, день 1
- Преднизолон** 80 мг внутрь, дни 1 - 5
Лечение возобновляется на 22 день
R-MACOP-B [71]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 1, нед. 1, 3, 5, 7, 9, 11
или
- 375 мг/м2 в/в кап. 1 день 1 нед., далее ритуксимаб 1400 мг п/к, день 1, нед. 3, 5, 7, 9, 11 [126 - 129]
- Доксорубицин** 50 мг/м2 в/в кап., день 1, нед. 1, 3, 5, 7, 9, 11
- Циклофосфамид** 350 мг/м2 в/в кап., день 1, нед. 1, 3, 5, 7, 9, 11
- #Винкристин** 1,4 мг/м2 (суммарно не более 2 мг) в/в, день 1, нед. 2, 4, 6, 8, 10, 12
- Метотрексат** 400 мг/м2 в/в кап., день 1, нед. 2, 6, 10
- Кальция фолинат** 15 мг внутрь каждые 6 часов x 6 приемов, начиная через 24 часа после метотрексата
- Блеомицин** 10 мг/м2 в/в, день 1, нед. 4, 8, 12
- Преднизолон** 75 мг/сут. внутрь непрерывно 10 недель с постепенным снижением дозы в течение 11 - 12 недель или только недели 1, 3, 5, 7, 9, 11
DA-R-EPOCH [68]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 0, все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 0 [126 - 129]
- Этопозид** 50 мг/м2/сут в/в, дни 1 - 4 (непрерывная 96-часовая инфузия)
- Доксорубицин** 10 мг/м2/сут в/в, дни 1 - 4 (непрерывная 96-часовая инфузия)
- #Винкристин** 0,4 мг/м2/сут в/в, дни 1 - 4 (непрерывная 96-часовая инфузия)
- Циклофосфамид** 750 мг/м2 в/в, день 5
- Преднизолон** 60 мг/м2 2 раза в день внутрь, дни 1 - 5
- Г-КСФ 5 мкг/кг подкожно, начиная с 6-го дня и продолжая до достижения абсолютного уровня нейтрофилов более, чем 0,5 x 109/л после надира
Лечение возобновляется на 22 день
В данной дозировке проводится 1 курс. Далее дозы этопозида, доксорубицина и циклофосфана корректируются относительно предыдущего в зависимости от низшего уровня показателей крови, определенных во время и после проведения курса, по следующей схеме:
- нейтрофилы выше 0,5 x 109/л, тромбоциты выше 25 x 109/л - увеличение доз на 25%
- нейтрофилы менее 0,5 x 109/л при 1 - 2 измерениях, тромбоциты выше 25 x 109/л - сохранение доз предыдущего курса
- нейтрофилы менее 0,5 x 109 при 3 и более измерениях, тромбоциты ниже 25 x 109/л - редукция доз на 25%
А3.1.2 Программы лечения лимфомы Беркитта
ЛБ-М-04 [90]
Схема лечения: предфаза - A - C - A - C.
Предфаза:
- Циклофосфамид** 200 мг/м2 в/в, 1 - 5-й дни
- Дексаметазон** 20 мг в/в, 1 - 5-й дни
Блок A:
- Ифосфамид** 800 мг/м2 в/в, 1 - 5-й дни
- Метотрексат** 1,5 г/м2 в/в (в течение 12 ч), 1-й день
- #Винкристин** 2 мг в/в струйно в 1 день
- Доксорубицин** 50 мг/м2 в/в, 3-й день
- Цитарабин** 150 мг/м2 в/в каждые 12 ч, 4 - 5-й дни (всего 4 введения)
- Этопозид** 100 мг/м2 в/в, 4 - 5-й дни
- Дексаметазон** 10 мг/м2 в/в, 1 - 5-й дни
Блок C:
- Метотрексат** 1,5 г/м2 в/в (в течение 12 ч), 1-й день
- Винбластин** 10 мг в/в, 1-й день
- Цитарабин** 2 г/м2 в/в каждые 12 ч, 2 - 3-й дни (всего 4 введения)
- Этопозид** 150 мг/м2 в/в, 3 - 5-й дни
- Дексаметазон** 20 мг в/в, 1 - 5-й дни
Профилактику нейролейкемии проводят в 1-й день предфазы и в 1-й день каждого блока в виде интратекального введения ХТ: цитарабин** 30 мг, метотрексат** 15 мг, преднизолон** 30 мг.
Ритуксимаб** 375 мг/м2 вводят в 0-й день каждого блока (всего 4 введения)
R-Hyper-CVAD/R-HMA [131]
Циклы 1, 3, 5, 7 (Hyper-CVAD):
- Ритуксимаб** 375 мг/м2 в/в, 1-й, 11-й дни (циклы 1, 3)
- Циклофосфамид** 300 мг/м2 в/в каждые 12 ч, 1 - 3-й дни (всего 6 введений)
- Дексаметазон** 40 мг в/в или внутрь, 1 - 4-й, 11 - 14-й дни
- Доксорубицин** 50 мг/м2 в/в непрерывной 24-часовой инфузией в центральный катетер, 4-й день
- Винкристин** 2 мг в/в, 4-й, 11-й дни
Циклы 2, 4, 6, 8 (HMA):
- Ритуксимаб** 375 мг/м2 в/в, 2-й, 8-й (циклы 2, 4)
- Метотрексат** 1000 мг в/в непрерывной 24-часовой инфузией, 1-й день
- Цитарабин** 3 г/м2 (у больных старше 60 лет - 1 г/м2) в/в каждые 12 ч, 2 - 3-й дни (всего 4 введения)
Профилактика поражения ЦНС проводится на каждом курсе, суммарно 16 интратекальных введений: метотрексат** 12 мг интратекально, 2-й день, цитарабин** 100 мг интратекально, 7-й день
A3.1.3 Схемы лечения рецидивов у пациентов с агрессивными нефолликулярными B-клеточными лимфомами
DHAP [11, 94]
- Дексаметазон** 40 мг в/в, дни 1 - 4
- #Цисплатин** 100 мг/м2 в/в кап. 12-часовая инфузия, день 1
- Цитарабин** 2 г/м2 в/в кап. 2 раза в день, день 3
ESHAP [95]
- Этопозид** 40 мг/м2 в/в кап., дни 1 - 4
- Метилпреднизолон** 500 мг в/в кап., дни 1 - 5
- #Цисплатин** 25 мг/м2/сут. в/в непрерывная инфузия, дни 1 - 4
ICE [96]
- Этопозид** 100 мг/м2 в/в кап., дни 1 - 3
- Ифосфамид** 5000 мг/м2 в/в 24-часовая инфузия, день 2
- #Карбоплатин** AUC 5 с использованием формулы Calvert; максимально 800 мг в/в кап., день 2
GDP [97, 106]
- #Цисплатин** 75 мг/м2 в/в кап., день 1
- #Гемцитабин** 1000 мг/м2 в/в кап., дни 1, 8
- Дексаметазон** 40 мг внутрь, дни 1 - 4
GemOx [98, 102]
- #Гемцитабин** 1000 мг/м2 в/в кап., день 1
- #Оксалиплатин** 100 мг/м2 в/в кап., день 1
DHAX [99]
- Дексаметазон** 40 мг в/в, дни 1 - 4
- #Оксалиплатин** 130 мг/м2 в/в кап., день 1
- Цитарабин** 2 г/м2 в/в кап., дни 2, 3
MINE [100]
- Ифосфамид** 1500 мг/м2 в/в кап., день 1
- Месна** 1000 мг/м2 в/в кап., дни 1 - 3
- Этопозид** 150 мг/м2 в/в кап., дни 1 - 3
- Митоксантрон** 12 мг/м2 в/в кап., день 1
BR [103, 104]
- Ритуксимаб**
- 375 мг/м2 в/в кап., день 1 все циклы курса
или
- 375 мг/м2 в/в кап. 1 цикл, далее ритуксимаб 1400 мг п/к, день 1 [126 - 129]
- Бендамустин** 120 мг/м2 в/в кап., дни 2, 3
Лечение возобновляется на 21 день
CEPP [105]
- Циклофосфамид** 600 мг/м2 в/в кап., дни 1, 8
- Этопозид** 70 мг/м2 в/в кап., дни 1 - 3
- Прокарбазин** 60 мг/м2 внутрь, дни 1 - 10
- Преднизолон** 60 мг/м2 внутрь, дни 1 - 10
Начало курса на 28 день
#Гемцитабин** + #винорелбин** [107]
- #Гемцитабин** 1000 мг/м2 в/в кап., дни 1 и 8
- #Винорелбин** 30 мг/м2 в/в, дни 1 и 8
- Лечение возобновляется на 22 день. Всего не более 6 циклов
A3.1.5 Схемы лечения пациентов с ПЛЦНС
Монотерапия высокими дозами метотрексата [132, 133]:
- Метотрексат** 8000 мг/м2 в/в кап. в течение 4 часов.
Возобновление лечения на 15 день, всего 8 циклов
или
- Метотрексат** 3500 мг/м2 в/в кап. Возобновление лечения на 22 день, всего 4 цикла, с последующей лучевой терапией
MT-R [74]
- Метотрексат** 8000 мг/м2 в/в кап. в течение 4 часов, день 1
- Ритуксимаб** 375 мг/м2 в/в кап., день 3
- #Темозоломид** 150 мг/м2 внутрь, дни 7 - 11
Возобновление лечения на 15 день Всего 6 циклов
Метотрексат** + цитарабин** [73]
- Метотрексат** 3500 мг/м2 в/в кап., день 1
- Цитарабин** 2000 мг/м2 в/в кап. 2 раза в день, дни 2 - 3
Возобновление на 22 день Всего 4 циклов
MATRix [83]
- Ритуксимаб** 375 мг/м2 в/в кап., день - 5 и 0
- Метотрексат** 3500 мг/м2 в/в кап., день 1
- Цитарабин** 2000 мг/м2 в/в кап. 2 раза в день, дни 2 - 3
- Тиотепа** 30 мг/м2 в/в, день 4
Возобновление на 22 день Всего 4 циклов
#Темозоломид** + ритуксимаб** [80]
- Ритуксимаб** 375 мг/м2 в/в кап., день 1 (1 - 4 циклы)
- #Темозоломид** 150 мг/м2 внутрь, дни 1 - 5
- Возобновление лечения на 29 день. Всего до 12 циклов
3.1.6 Схема терапии агрессивных нефолликулярных B-клеточных лимфом у пациентов до 18 лет
Протокол B-NHL-2010M [84, 134]
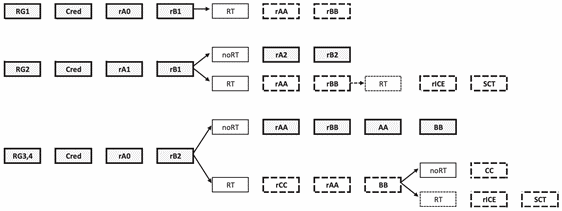
RG - группа риска (см. раздел 7.5), Cred - циторедукция, r - ритуксимаб, RT - остаточная опухолевая масса (подтвержденная ПЭТ/КТ и/или биопсией), noRT - отсутствие остаточной опухолевой массы, SCT - трансплантация аутологичных гемопоэтических стволовых клеток
Циторедукция
Дексаметозон** внутрь 10 мг/м2 1 - 5 дни
Циклофосфамид** в/в 1 ч 200 мг/м2 1, 2 дни
Mtx/AraC/Pred <1> э/л в возрастных дозах
Ритуксимаб**
Ритуксимаб 375 мг/м2 в/в в течение 4 часов: 1 введение за 24 часа до блока A0 или A1, далее - каждые 2 недели, независимо от проводимой цитостатической терапии - 2 введения для групп RG1 и RG2, четыре введения для групп RG3 и RG4
A0
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Ифосфамид** 1 ч в/в 800 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Цитарабин** 1 ч в/в 150 мг/м2 2 р/д 4, 5 дни
Этопозид** 1 ч в/в 100 мг/м2 4, 5
Mtx/AraC/Pred <1> э/л в возрастных дозах
A1
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Ифосфамид** 1 ч в/в 800 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Метотрексат** 24 ч. в/в 1 г/м2 1 день
Кальция фолинат** <2> в/в 15 мг/м2 через 42, 48, 54 час от начала инфузии метотрексата**
Цитарабин** 1 ч в/в 150 мг/м2 2 р/д 4, 5 дни
Этопозид** 1 ч в/в 100 мг/м2 4, 5
Mtx/AraC/Pred <1> э/л в возрастных дозах
AA
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Ифосфамид** 1 ч в/в 800 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Метотрексат** 24 ч. в/в 5 г/м2 1 день
Кальция фолинат** <2> в/в 15 мг/м2 через 42, 48, 54 час от начала инфузии метотрексата**
Цитарабин** 1 ч в/в 150 мг/м2 2 р/д 4, 5 дни
Этопозид** 1 ч в/в 100 мг/м2 4, 5
Mtx/AraC/Pred <1> э/л в возрастных дозах
B1
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Циклофосфамид** в/в 200 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Метотрексат** 24 ч в/в 1 г/м2 1 день
Кальция фолинат** <2> в/в 15 мг/м2 через 42, 48, 54 час от начала инфузии метотрексата**
Доксорубицин** в/в 25 мг/м2 4, 5 дни
Mtx/AraC/Pred <1> э/л в возрастных дозах
B2
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Циклофосфамид** в/в 200 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Метотрексат** 24 ч в/в 2 г/м2 1 день
Кальция фолинат** <2> в/в 15 мг/м2 через 42, 48, 54 час от начала инфузии метотрексата**
Доксорубицин** в/в 25 мг/м2 4, 5 дни
Mtx/AraC/Pred <1> э/л в возрастных дозах
BB
Дексаметазон** внутрь 10 мг/м2 1 - 5 дни
Циклофосфамид** в/в 200 мг/м2 1 - 5 дни
Винкристин** в/в 1,5 мг/м2 1 день
Метотрексат** 24 ч в/в 5 г/м2 1 день
Кальция фолинат** <2> в/в 15 мг/м2 через 42, 48, 54 час от начала инфузии метотрексата**
Доксорубицин** в/в 25 мг/м2 4, 5 дни
Mtx/AraC/Pred <1> э/л в возрастных дозах
CC
Дексаметазон** внутрь 20 мг/м2 1 день
Винкристин** в/в 1,5 мг/м2 1 день
Цитарабин** в/в 3 ч 2000 мг/м2 2 р/д 1, 2 дни
Этопозид** в/в 1 ч 100 мг/м2 3, 4, 5 дни
Mtx/AraC/Pred <1> э/л в возрастных дозах
ICE
Ифосфамид** 1800 мг/м2/сут, дни 1 - 5
#Карбоплатин** 500 мг/м2, день 1
Этопозид** 150 мг/м2, дни 1 - 3
Mtx/AraC/Pred <1> э/л в возрастных дозах
--------------------------------
<1> Метотрексат**/цитарабин**/преднизолон**, обычно 1 раз на блоке или 2 раза при инициальном поражении ЦНС.
<2> Доза кальция фолината** определяется по концентрации метотрексата** в сыворотке.
Интервалы между началом курсов (блоков) не должны быть больше 18 - 21 дня. Для выполнения интервалов можно использовать Г-КСФ
Приложение А3.2
РЕКОМЕНДАЦИИ
ПО РЕДУКЦИИ ДОЗ ИЛИ УВЕЛИЧЕНИЮ ПРОМЕЖУТКОВ ПРИ ПРОВЕДЕНИИ
МИЕЛОСУПРЕССИВНОЙ ЦИТОСТАТИЧЕСКОЙ ТЕРАПИИ
Миелосупрессивную цитостатическую терапию следует проводить в полных дозах в соответствии со схемой, если в день введения цитостатических препаратов уровень нейтрофилов > 1 x 109/л и тромбоцитов > 100 x 109, но только в том случае, если пик падения уже пройден.
Если необходимый уровень нейтрофилов не достигается к плановому дню введения лекарственных препаратов, введение колониестимулирующих факторов продолжается в прежних дозах до достижения уровня нейтрофилов > 1 x 109 при ежедневном контроле анализов крови, далее исследование крови повторяется через день. Лечение возобновляется при достижении вышеуказанных параметров.
В том случае, если показатели крови восстанавливаются в течение последующих 14 дней, следующий цикл проводится в полных дозах.
В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, а также в случае повторной отсрочки курса вследствие миелотоксичности более 10 дней, проводится снижение доз препаратов до 75% от исходной дозы (кроме доз винкристина, блеомицина и преднизолона).
Если к плановому дню введения цитостатических препаратов необходимый уровень тромбоцитов не достигается, в дальнейшем исследование крови повторяется на 3, 7, 10 и 14 дни; лечение возобновляется при достижении вышеуказанных параметров. Если показатели крови восстанавливаются в течение дополнительных 14 дней, цикл проводится в полных дозах. В случае, если показатели крови не восстанавливаются дольше дополнительных 14 дней, в следующем цикле производится редукция доз по той же схеме, как и при длительной нейтропении.
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Приложение Б1.1
АЛГОРИТМ ПЕРВОЙ ЛИНИИ ТЕРАПИИ ПАЦИЕНТА С ДВКЛ
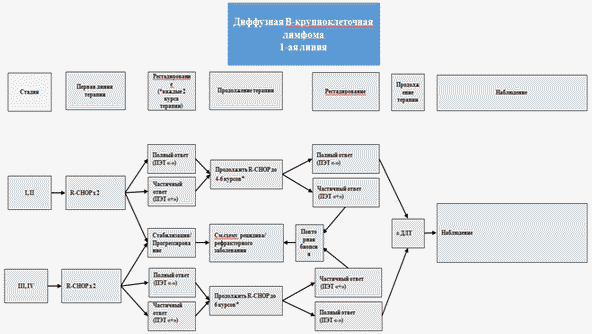
Приложение Б1.2
АЛГОРИТМ ВТОРОЙ ЛИНИИ ТЕРАПИИ ПАЦИЕНТА С ДВКЛ
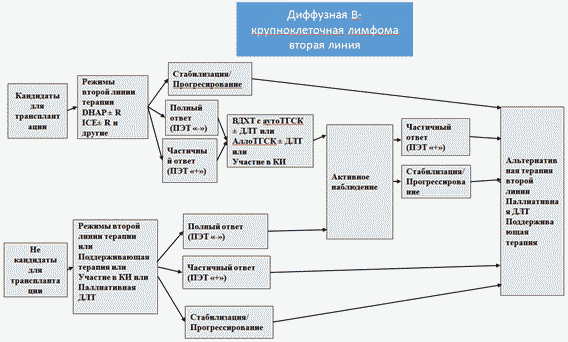
Приложение Б2
АЛГОРИТМ ПЕРВОЙ ЛИНИИ ТЕРАПИИ ПАЦИЕНТА С ПЛЦНС

Приложение Б3
АЛГОРИТМ ПЕРВОЙ ЛИНИИ ТЕРАПИИ ПАЦИЕНТА ПМВККЛ
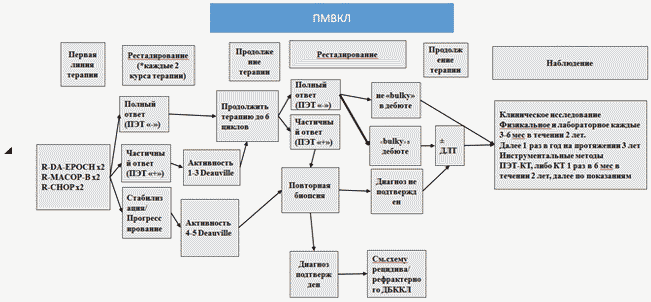
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Лимфомы - это опухоли из лимфоидных клеток. Лимфома - не одна болезнь, это большая группа, включающая более 30 разных заболеваний, которые отличаются друг от друга по своим проявлениям, по течению, по ответу на лечение. Лимфомы ведут себя и лечатся совершенно по-разному. Поэтому просто слово "лимфома" ни о чем не говорит - чтобы понимать, как лечить, надо знать конкретный вариант лимфомы.
Диффузная B-крупноклеточная лимфома - агрессивное лимфопролиферативное заболевание. Прогноз зависит от многих факторов, в том числе от объема поражения, в связи с чем необходимо полное и всестороннее обследование. Своевременное и адекватное лечение является залогом успеха. Пациент должен четко выполнять все рекомендации врача относительно времени и сроков диагностических процедур, а также все назначения, касающиеся противоопухолевого лечения и сопроводительной терапии.
Во время прохождения лечения при появлении нежелательных явлений пациент обязан вовремя сообщить о них врачу для принятия своевременных решений об их коррекции.
Приложение Г
Приложение Г1
ШКАЛА
ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ВОСТОЧНОЙ
ОБЪЕДИНЕННОЙ ОНКОЛОГИЧЕСКОЙ ГРУППЫ (ECOG)
Оригинальное название: The ECOG Scale of Performance Status
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5(6): 649 - 65 [135]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы)
Описание общего состояния пациента
0
Пациент полностью активен, способен выполнять все, как и до заболевания.
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу).
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования.
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели.
5
Смерть пациента
Приложение Г2
ШКАЛА ВИЗУАЛЬНОЙ ОЦЕНКИ ПЭТ-ДАННЫХ
Оригинальное название: The Deauville five point scale
Источник: Meignan M. et al. Report on the First International Workshop on Interim-PET-Scan in Lymphoma. Leuk Lymphoma. 2009; 50(8): 1257 - 1260 [136]
Тип: шкала оценки
Назначение: оценка результатов ПЭТ или ПЭТ/КТ исследования
Содержание и интерпретация: для стандартизации, воспроизводимости и возможности сравнения результатов ПЭТ или ПЭТ/КТ, полученных в различных медицинских учреждениях, при оценке эффективности лечения у пациентов с лимфомами используется визуальный анализ ПЭТ-данных по 5-балльной шкале [136]. При этом интенсивность накопления 18F-ФДГ в патологическом очаге сравнивается с интенсивностью накопления препарата в неизмененных отделах средостения или в правой доле печени:
1 балл - характеризуется отсутствием накопления препарата в определяемом ранее патологическом очаге;
2 балла - накопление препарата в патологическом очаге не превышает по интенсивности накопление препарата в неизмененных отделах средостения;
3 балла - накопление препарата в патологическом очаге выше, чем в средостении, но не превышает накопление препарата в правой доле печени;
4 балла - накопление препарата в патологическом очаге несколько выше, чем в печени;
5 баллов - накопление препарата в патологическом очаге значительно выше, чем в печени, или определяется появление новых патологических очагов, связанных с заболеванием.
Также введено понятие X-баллов, характеризующих наличие очагов накопления 18F-ФДГ неясного, скорее воспалительного генеза, связь которых с основным заболеванием маловероятна.
Интерпретация результатов ПЭТ или ПЭТ/КТ по шкале Deauville проводится комплексно с учетом клинических и исходных ПЭТ-данных, этапа лечения, а также других показателей ответа на лечение.
Приложение Г3
ШКАЛА
KHORANA ДЛЯ ОЦЕНКИ РИСКА ВТЭО У ПАЦИЕНТОВ,
ПОЛУЧАЮЩИХ ХИМИОТЕРАПИЮ
Оригинальное название:
Источник: Development and Validation of a predictive model for chemotherapyassociated thrombosis. Blood. 2008; 111(10): 4902 - 4907 [137]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
ФАКТОРЫ РИСКА БАЛЛЫ
ФАКТОРЫ РИСКА БАЛЛЫ
Локализация опухоли
2
Очень высокий риск (желудок, поджелудочная железа)
1
Высокий риск (легкие, лимфома, кровь, яички, яичники, матка)
Количество тромбоцитов в крови перед началом химиотерапии >= 350 000/мл3
1
Уровень гемоглобина менее 10 г/дл или использование эритропоэтинов
1
Количество лейкоцитов в крови перед началом химиотерапии > 11 000/мл3
1
Ожирение (индекс массы тела выше 35 кг/м2) и выше
1
Риск развития ВТЭО за 2 - 5 мес. (%)
Высокий риск, сумма баллов >= 3
6,7 - 7,1
Средний риск, сумма баллов 1 - 2
1,8 - 2
Низкий риск, сумма баллов 0
0,3 - 0,8
