"Клинические рекомендации "Злокачественное новообразование бронхов и легкого"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЗЛОКАЧЕСТВЕННОЕ НОВООБРАЗОВАНИЕ БРОНХОВ И ЛЕГКОГО
МКБ 10: C34
Год утверждения (частота пересмотра): 2020
ID: КР30/1
URL
Профессиональные ассоциации
- - Общероссийский национальный союз "Ассоциация онкологов России" - Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава РФ
Ключевые слова
Список сокращений
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БОС-терапия - терапия с биологически обратной связью
КТ - компьютерная томография
ЛТ - лучевая терапия
МНО - международное нормализованное отношение
МРЛ - мелкоклеточный рак легкого
МРТ - магнитно-резонансная томография
НМРЛ - немелкоклеточный рак легкого
ПЭТ - позитронно-эмиссионная томография
РОД - разовая очаговая доза
СОД - суммарная очаговая доза
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
ХТ - химиотерапия
ALK - anaplastic lymphoma kinase (киназа анапластической лимфомы)
AUC - area under curve - площадь под фармакологической кривой, расчет дозы карбоплатина по площади под фармакологической кривой производится по формуле Calvert (1989): доза карбоплатина = AUC x (клиренс креатинина + 25).
EGFR - epidermal growth factor receptor (рецептор эпидермального фактора роста)
PD1/PD-L1 - programmed cell death 1/programmed cell death 1 ligand (мембранный белок запрограммированной смерти клеток/его лиганд)
MEK - mitogen-activated protein kinase (внутриклеточная сигнальная молекула протеинкиназа, также известная как MAPK/ERK-киназа)
SCC - squamous cell carcinoma antigen (антиген плоскоклеточного рака)
ECOG PS - Eastern Cooperative Oncology Group Performance Status (шкала оценки общего состояния пациента Восточной объединенной онкологической группы)
EUS/EBUS - esophageal/endobronchial ultrasound (трансэзофагеальная/трансбронхиальная сонография)
Термины и определения
Рак легкого - злокачественное новообразование, берущее начало из эпителиальных клеток легкого.
Компьютерная томография - метод послойной внутренней диагностики.
Магнитно-резонансная томография - метод послойной внутренней диагностики, осуществляемой с помощью эффекта ядерного магнитного резонанса.
Позитронная эмиссионная томография - метод радионуклидной диагностики.
Ультразвуковая допплерография - неинвазивное исследование сосудов с помощью ультразвуковых волн.
Ультразвуковое исследование - неинвазивное исследование организма с помощью ультразвуковых волн.
Anaplastic lymphoma kinase - рецепторная тирозинкиназа из семейства инсулинзависимых рецепторов.
Ген BRAF - онкоген, который кодирует серин-треониновую протеинкиназу B-Raf.
CTLA4 - антиген цитотоксических T-лимфоцитов 4-го типа, также известен как CD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
CYFRA 21-1 - цитокератиновый фрагмент.
Ген EGFR - протоонкоген, который кодирует внутриклеточный домен рецептора эпидермального фактора роста (EGFR).
Ген ROS1 - онкоген, который кодирует рецепторную тирозинкиназу, родственную киназе анапластической лимфомы, а также ряду членов семейства инсулиновых рецепторов.
Блокатор CTLA4 - моноклональное антитело, блокирующее антиген цитотоксических T-лимфоцитов 4-го типа.
Блокатор PD1 - моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
I этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
II этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений заболевания.
III этап реабилитации - реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Рак легкого - собирательное понятие, объединяющее различные по происхождению, гистологической структуре, клиническому течению и результатам лечения злокачественные эпителиальные опухоли. Развиваются они из покровного эпителия слизистой оболочки бронхов, бронхиальных слизистых желез бронхиол и легочных альвеол [1, 2].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
У подавляющего большинства пациентов, страдающих от рака легкого (85 - 90%) развитие заболевания связано с курением, как активным, так и пассивным. Кроме того, к факторам риска можно отнести облучение (проведенную ранее лучевую терапию (ЛТ) по поводу других опухолей внутригрудной локализации), воздействие радона, асбеста, мышьяка [3].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По заболеваемости рак легкого занимает 1-е место среди других злокачественных опухолей у мужчин в России, а по смертности - 1-е место среди мужчин и женщин как в России, так и в мире.
В России в 2015 г. раком легкого заболели 55 157 человек [4]. От рака легкого ежегодно умирает больше пациентов, чем от рака простаты, молочной железы и толстой кишки вместе взятых [5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Злокачественное новообразование бронхов и легкого (C34)
C34.0 Злокачественное новообразование главных бронхов, киля трахеи, корня легкого
C34.1 Злокачественное новообразование верхней доли, бронхов или легкого
C34.2 Злокачественное новообразование средней доли, бронхов или легкого
C34.3 Злокачественное новообразование нижней доли, бронхов или легкого
C34.8 Поражение бронхов или легкого, выходящее за пределы одной и более вышеуказанных локализаций
C34.9 Злокачественное новообразование бронхов или легкого неуточненной локализации
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация (2015) [5]
8140/3 Аденокарцинома
8250/3 со стелющимся типом роста (lepidic) G-I
G18551/3 ацинарная G-II
8260/3 папиллярная G-III
8265/3 микропапиллярная
8230/3 солидная
8253/3 инвазивная муцинозная
8254/3 смешанная инвазивная муцинозная и немуцинозная
8480/3 коллоидная
8333/3 фетальная
8144/3 кишечного типа
Минимально-инвазивная аденокарцинома
8250/2 немуцинозная
8250/3 муцинозная
Преинвазивные опухоли
8250/0 Атипичная аденоматозная гиперплазия
Аденокарцинома in situ
8410/2 немуцинозная
8253/2 муцинозная
8070/3 Плоскоклеточный рак
8071/3 ороговевающий
8072/3 неороговевающий
8083/3 базалоидный
Преинвазивные опухоли
8070/2 Плоскоклеточная карцинома in situ
Нейроэндокринные опухоли
8041/3 Мелкоклеточный рак
8045/3 Комбинированный мелкоклеточный рак
8013/3 Крупноклеточная нейроэндокринная карцинома
8013/3 Комбинированная крупноклеточная нейроэндокринная карцинома
Карциноидные опухоли
8240/3 Типичный карциноид
8249/3 Атипичный карциноид
8040/0 Диффузная идиопатическая легочная нейроэндокринная гиперплазия
8012/3 Крупноклеточная карцинома
8022/3 Плеоморфная карцинома
8032/3 Веретеноклеточная карцинома
8031/3 Гигантоклеточная карцинома
8980/3 Карциносаркома
8972/3 Легочная бластома
Другие неклассифицируемые опухоли
8082/3 лимфоэпителиомоподобная карцинома
8023/3 NUT-карцинома
Опухоли по типу опухолей слюнных желез
8430/3 Мукоэпидермоидная карцинома
8200/3 Аденокистозный рак
8562/3 Эпителиально-миоэпителиальная карцинома
8940/0 Плеоморфная аденома
Клинико-анатомическая классификация
Центральный рак легкого локализуется в бронхах (главном, промежуточном, долевом, сегментарном, субсегментарном). По направлению роста различают экзофитный (эндобронхиальный) рак, при котором опухоль растет в просвет бронха; эндофитный (экзобронхиальный) рак, при котором опухоль растет преимущественно в толщу легочной паренхимы; разветвленный рак с муфтообразным перибронхиальным ростом опухоли вокруг бронхов, а также опухоли со смешанным характером роста с преобладанием того или иного компонента [1, 2].
Периферический рак легкого локализуется в периферических отделах легкого.
Различают узловую форму опухоли, пневмониеподобный рак и рак верхушки легкого с синдромом Панкоста [1, 2].
Стадирование
Для определения стадии рака легкого используется классификация TNM (8-е издание, 2017) [6, 7] (табл. 1).
T - первичная опухоль.
Tx - первичная опухоль не может быть оценена или опухоль верифицирована путем обнаружения злокачественных клеток в мокроте или лаваже, при этом опухоль не визуализируется при бронхоскопии.
T0 - первичная опухоль не определяется.
Tis - карцинома in situ.
T1 - опухоль достигает 30 мм в диаметре или менее в наибольшем измерении, окружена легочной паренхимой или висцеральной плеврой, нет признаков инвазии проксимальнее долевого бронха при бронхоскопии (это значит, что опухоль не расположена в главном бронхе).
T1(mi) - минимально инвазивная аденокарцинома
T1a - опухоль 10 мм в диаметре или менее в наибольшем измерении
T1b - опухоль от 10 до 20 мм в диаметре в наибольшем измерении
T1c - опухоль от 20 до 30 мм в диаметре в наибольшем измерении
T2 - опухоль от 31 до 50 мм в диаметре в наибольшем измерении или опухоль в сочетании с вовлечением главного бронха, независимо от расстояния до карины, но без ее поражения; с поражением висцеральной плевры; с ателектазом или обструктивным пневмонитом, который располагается в прикорневых отделах, вовлекает часть легкого или все легкое
T2a - опухоль от 31 до 40 мм в диаметре в наибольшем измерении или опухоль, размер которой не может быть определен (например, если опухоль неотделима от ателектаза).
T2b - опухоль от 41 до 50 мм в диаметре в наибольшем измерении.
T3 - опухоль от 51 до 70 мм в диаметре в наибольшем измерении или прямая инвазия в грудную стенку (включая париетальную плевру и опухоли верхней борозды), диафрагмальный нерв, париетальный перикард, а также метастатические узлы (узел) в той же доле.
T4 - опухоль более 70 мм в диаметре в наибольшем измерении или поражение диафрагмы, средостения, сердца, крупных сосудов, трахеи, возвратного гортанного нерва, пищевода, тела позвонка, бифуркации трахеи, висцерального перикарда, а также метастатические узлы (узел) в других ипсилатеральных долях.
N - вовлечение регионарных лимфатических узлов
Nx - невозможно дать оценку регионарных лимфатических узлов.
N0 - нет метастазов в регионарных лимфатических узлах.
N1 - метастазы в ипсилатеральных перибронхиальных и/или ипсилатеральных корневых лимфатических узлах или метастазы во внутрилегочных лимфатических узлах, включая прямое поражение лимфатических узлов.
N2 - метастазы в ипсилатеральных медиастинальных и/или субкаринальных лимфатических узлах.
N3 - метастазы в контралатеральных медиастинальных, контралатеральных корневых, ипсилатеральных или контралатеральных любых лестничных или надключичных лимфатических узлах.
M - отдаленные метастазы.
M0 - нет отдаленных метастазов.
M1 - отдаленные метастазы есть.
M1a - опухолевые узлы в контралатеральном легком, опухолевое узелковое поражение плевры, метастатический плевральный или перикардиальный выпот
M1b - одиночный отдаленный опухолевый узел
M1c - множественные внелегочные метастазы в одном или нескольких органах.
Для уточнения локализации отдаленного метастатического очага (M) применяют дополнительную градацию:
PUL - легкое
PER - брюшная полость
MAR - костный мозг
BRA - головной мозг
OSS - кости
SKI - кожа
PLE - плевра
LYM - лимфатические узлы
ADP - почки
SADP - надпочечники
HEP - печень
OTH - другие
При клинической оценке распространенности опухолевого процесса перед символами TNM ставится "c", а при патогистологической классификации - "p". Требования к определению категории pT, pN, pM аналогичны таковым для категории cT, cN, cM. Символ pN может быть оценен при исследовании не менее 6 лимфатических узлов, 3 из которых средостенные, из них 1 - бифуркационный.
Таблица 1. Стадирование рака легкого
Стадия
T
N
M
Оккультная
Tx
N0
M0
0
Tis
N0
M0
IA
T1
N0
M0
IA1
T1mi
T1a
N0
M0
IA2
T1b
N0
M0
IA3
T1c
N0
M0
IB
T2a
N0
M0
IIA
T2b
N0
M0
IIB
T1a-c, 2a, b
N1
M0
T3
N0
M0
IIIA
T1a-c, 2a, b
N2
M0
T3
N1
M0
T4
N0-1
M0
IIIB
T1a-c, 2a, b
N3
M0
T3, T4
N2
M0
IIIC
T3, T4
N3
M0
IV
Любое T
Любое N
M1
IVA
Любое T
Любое N
M1a, M1b
IVB
Любое T
Любое N
M1c
Для мелкоклеточного рака легкого (МРЛ) также применяется упрощенная классификация по степени распространенности: локализованная форма и распространенная форма. Локализованная форма характеризуется распространенностью опухолевого процесса в одном легком и средостении, в пределах гемиторакса и возможностью облучения одним полем.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические симптомы опухолевого поражения могут сочетаться с симптомами сопутствующих осложнений. Первичные симптомы - кашель, одышка, боль в груди, кровохарканье, общие симптомы - слабость, утомляемость, снижение аппетита. К клиническим проявлениям относятся также паранеопластические синдромы. Возможно и бессимптомное течение рака легкого.
2. Диагностика
Критерии установления диагноза: при наличии результатов комплексного обследования по оценки распространенности опухолевого процесса и морфологической верификации диагноз "рак легкого" считается доказанным. В случае если в силу каких-либо обстоятельств провести верификацию диагноза не представляется возможным, то, на основании клинико-рентгенологической картины, по решению консилиума может быть определена тактика лечения.
2.1. Жалобы и анамнез
Выраженность клинической симптоматики при раке легкого зависит от клинико-анатомической формы новообразования, его гистологической структуры, локализации, размеров и типа роста опухоли, характера метастазирования, сопутствующих воспалительных изменений в бронхах и легочной ткани [1].
Кашель при центральном раке легкого у большинства пациентов сухой, временами надсадный. С нарастанием обтурации бронха кашель может сопровождаться мокротой слизистого или слизисто-гнойного характера.
Кровохарканье может проявляться в виде прожилок алой крови в мокроте или в виде диффузно окрашенной мокроты.
Одышка выражена тем ярче, чем крупнее просвет пораженного бронха при центральном раке, или ее выраженность зависит от размера периферической опухоли, т.е. степени сдавления анатомических структур средостения, особенно крупных венозных стволов, бронхов и трахеи.
Боль в грудной клетке различной интенсивности на стороне поражения может быть обусловлена локализацией новообразования в плащевой зоне легкого, особенно при прорастании опухолью плевры и грудной стенки, а также наличием плеврального выпота или ателектаза легкого с признаками обтурационного пневмонита.
При наличии периферического рака верхушки легкого может наблюдаться симптомокомплекс, описанный Панкостом (H. Pancoast) в 1924 г. (боль в участке плечевого сустава и плеча, атрофия мышц предплечья, синдром Горнера). Рентгенологическими особенностями этой формы считают локализацию опухолевого узла в области верхушки, сравнительно быстрое прорастание в плевру, деструкцию I - II ребер, а иногда и поперечных отростков позвонков.
Синдром сдавления верхней полой вены (цианоз, отек лица, шеи, верхних конечностей, развитые подкожные венозные коллатерали на туловище) наиболее характерен для МРЛ, при котором часто наблюдается массивное поражение лимфатических узлов средостения и, как следствие, сдавление верхней полой вены.
Перечисленные симптомы и синдромы не патогномоничны для рака легкого и могут иметь место при неопухолевой легочной и общесоматической внелегочной патологии. Так, кровохарканье может наблюдаться при туберкулезе легкого и декомпенсированной кардиальной патологии, одышка - при хронических обструктивных заболеваниях легких, боли в грудной клетке - при воспалительных плевритах, радикулитах, межреберной невралгии, кашель - при простудных, вирусных инфекциях, туберкулезе и гнойных процессах в легких, а симптомы общей интоксикации присущи большой группе заболеваний.
У некоторых пациентов выявляются паранеопластические синдромы, связанные с гиперпродукцией гормонов (синдромы секреции адренокортикотропного, антидиуретического, паратиреоидного гормонов, эстрогенов, серотонина).
Рак легкого может сопровождаться тромбофлебитом, различными вариантами нейро- и миопатии, своеобразными дерматозами, нарушениями жирового и липидного обмена, артралгическими и ревматоидноподобными состояниями. Нередко проявляется остеоартропатией (синдромом Мари-Бамбергера), заключающейся в утолщении и склерозе длинных трубчатых костей голеней и предплечий, мелких трубчатых костей кистей и стоп, припухлости суставов (локтевых, голеностопных), колбовидном утолщении концевых фаланг пальцев кистей (синдроме "барабанных палочек") [1]. При периферическом раке верхушки легкого возможно появление синдрома Бернара-Горнера (птоза, миоза, энофтальма) в сочетании с болями в плечевом суставе и плече, прогрессирующей атрофией мышц дистальных отделов предплечья, обусловленными непосредственным распространением опухоли через купол плевры на плечевое сплетение, поперечные отростки и дужки нижних шейных позвонков, а также симпатические нервы [2].
Возможно бессимптомное развитие заболевания, при котором оно становится случайной рентгенологической находкой.
- При сборе анамнеза у всех пациентов рекомендуется обращать внимание на стаж курения и количество потребляемых сигарет, профессиональные вредности для верификации диагноза и определения адекватной лечебной тактики [1 - 3].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.2. Физикальное обследование
- Рекомендуется тщательный физикальный осмотр у всех пациентов, включающий пальпацию шейно-надключичных зон, оценка нутритивного статуса для верификации диагноза [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
2.3 Лабораторные диагностические исследования
- Рекомендуется в целях дифференциальной диагностики на этапе установки диагноза и в целях оценки эффективности лечения определять уровень следующих онкомаркеров (в зависимости от гистологической структуры рака легкого):
- нейронспецифической енолазы при МРЛ [1];
- исследование уровня растворимого фрагмента цитокератина 19 (CYFRA 21.1) в крови, исследование уровня антигена плоскоклеточной карциномы (SCC) в крови;
- ракового эмбрионального антигена, исследование уровня растворимого фрагмента цитокератина 19 (CYFRA 21.1) в крови, уровня антигена аденогенных раков CA 125 в крови при аденокарциноме [10];
- исследование уровня растворимого фрагмента цитокератина 19 (CYFRA 21.1) в крови, исследование уровня антигена плоскоклеточной карциномы (SCC) в крови, ракового эмбрионального антигена при крупноклеточном раке [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациенту с подозрением на рак легкого развернутый клинический и биохимический анализы крови (включая следующие показатели: глюкоза, креатинин, общий билирубин, альбумин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза), исследование свертывающей системы крови (включая оценку активированного частичного тромбопластинового времени (АЧТВ), фибриноген, международное нормализованное отношение (МНО), протромбиновое время), общий анализ мочи на наличие системной воспалительной реакции и определение уровня ее выраженности, установление функционального статуса кроветворной, гемостатической, детоксикационной и выделительной систем [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При выявлении неплоскоклеточного (в том числе, диморфного) рака рекомендуется проведение молекулярно-генетическое исследование мутаций в гене EGFR, BRAF V600E в биопсийном (операционном) материале (в том числе цитологическое); молекулярно-генетическое исследование транслокации генов ALK и ROS1. При отрицательных или неизвестных данных о наличии мутаций EGFR или транслокаций ALK следует проводить тестирование определение экспрессии белка PDL1 иммуногистохимическим методом (проводится для неплоскоклеточного и плоскоклеточного немелкоклеточного рака, только гистологический материал). Исследования проводятся для прогноза и определения тактики лечения болезни [9, 10]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: В настоящее время выделено несколько биомаркеров, которые помогают выделить подгруппу пациентов со значимым ответом на определенную терапию. Данные биомаркеры включают: ALK, ROS1 транслокацию генов, EGFR, BRAF V600E активирующие мутации и PD-L1 экспрессию. Молекулярно-генетическое тестирование может быть оправдано и в случаях плоскоклеточного рака или при затруднении (мало материала) в определении гистологического подтипа у некурящих молодых пациентов [9, 10].
2.4 Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на рак легкого проведение компьютерной томографии (КТ) органов грудной клетки с внутривенным контрастированием от уровня выше верхней апертуры до уровня окончания реберных синусов (включая надпочечники) в целях оценки местной распространенности опухолевого процесса в грудной клетке, а также при динамическом наблюдении пациента после хирургического, лучевого и химиотерапевтического лечения [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: КТ - перспективный метод скрининга рака легкого, основной метод его дифференциальной диагностики и оценки местной распространенности опухолевого процесса в грудной полости. КТ также применяется для оценки динамики опухолевого процесса после хирургического, лучевого и химиотерапевтического лечения [8]. Внутривенное контрастирование повышает результативность КТ, особенно на этапе оценки местной распространенности опухоли и дифференциальной диагностики (исключения неопухолевых процессов).
При центральном расположении опухоли КТ позволяет выявить изменения в бронхах до развития воспаления легких и формирования обтурационного ателектаза. В сравнении с фибробронхоскопией точность КТ выше при перибронхиально расположенных образованиях и ниже - при поверхностных эндобронхиальных опухолях.
Периферическая опухоль может иметь вид одиночного очага различной плотности, полости распада или участка инфильтрации некруглой формы (пневмониеподобная форма рака). Реже уже на этапе первичной диагностики выявляется, что опухоль врастает в грудную стенку (кортикоплевральная форма), в средостение (медиастинальная форма), в верхнюю апертуру (опухоль Панкоста), представляет собой очаговую диссеминацию в легком.
В зависимости от плотности очаг периферического рака может быть солидного типа, частично солидного типа или очагом по типу "матового стекла". Солидный очаг чаще имеет бугристые и/или лучистые контуры, стенки дренирующего бронха утолщены, висцеральная плевра втянута в опухоль и локально утолщена.
Для дифференциальной диагностики может иметь значение накопление контраста в опухоли (при динамической КТ и КТ-перфузии).
Позитронно-эмиссионная томография (ПЭТ) как метод выявления солидных очагов оценивается неоднозначно, особенно в странах с высоким бременем туберкулеза. Очаг по типу "матового стекла" характерен для аденокарциномы с поверхностным ростом, в том числе in situ. Очаги по типу "матового стекла" увеличиваются медленнее солидных очагов; обычно ПЭТ с 18F-фтордезоксиглюкозой при таких очагах дает отрицательный результат. Субсолидный очаг имеет центральный солидный компонент и периферическую зону "матового стекла". Солидная часть очага ассоциируется с инвазивным ростом и имеет значение для определения прогноза и оценки T-стадии опухолевого роста.
Для определения поражения лимфатических узлов при раке легкого в ходе КТ используется единственный критерий - линейный размер по короткой оси. Лимфатический узел считается неувеличенным при размере < 10 мм. Увеличение лимфатического узла может быть обусловлено воспалительной гиперплазией, особенно при центральных формах. В неувеличенных лимфатических узлах могут быть обнаружены микроскопические метастазы, особенно при периферических опухолях. В целом КТ не является методом выявления метастазов в лимфатических узлах, но локализация увеличенных внутригрудных узлов или отсутствие их увеличения при наличии опухоли важны для определения показаний к инвазивным дигностическим процедурам.
КТ грудной полости позволяет выявить имеющиеся в зоне сканирования отдаленные метастазы (в легких, печени, надпочечниках, почках, костях и др.). КТ головного мозга позволяет выявить метастазы, но информативность исследования уступает магнитно-резонансной томографии (МРТ) с внутривенным контрастированием.
ПЭТ и ПЭТ-КТ с 18F-фтордезоксиглюкозой имеет большое значение для выявления поражений регионарных лимфатических узлов и отдаленных метастазов.
- Рекомендуется пациентам с подозрением на рак легкого проведение бронхологического исследования (фибробронхоскопии) при центральном расположении опухолевого узла в легком или периферическом расположении новообразования, но с наличием "дренирующего" бронха с целью оценки локализации, распространенности опухолевого процесса и получения материала для патолого-анатомического исследования биопсийного (операционного) материала (в т.ч. цитологического исследования) [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: бронхологическое исследование относят к основным и обязательным методам диагностики рака легкого. Оно позволяет не только визуально исследовать гортань, трахею и все бронхи, непосредственно увидеть локализацию опухоли, определить границы ее распространения, косвенно судить об увеличении лимфатических узлов корня легкого и средостения, но и провести биопсию для гистологического исследования, получить материал (браш-биоптаты, мазки-отпечатки, соскоб или смыв из бронхиального дерева) для цитологического изучения, т.е. морфологически подтвердить диагноз и уточнить гистологическую структуру опухоли.
В последние годы все шире используются диагностические аппараты, объединяющие в себе возможности рентгеноэндоскопии, эндосонографии и флюоресцентной эндоскопии. Наиболее перспективным методом выявления скрытых микроочагов рака слизистой оболочки считается бронхоскопия аутофлюоресцентная, которая основана на эффекте аутофлюоресценции и при которой регистрируется концентрация в опухоли эндогенных фотосенсибилизаторов [1, 2].
- Рекомендуется пациентам с подозрением на рак легкого проведение биопсии трансторакальной под рентгенологическим или ультразвуковым контролем периферического образования в легком, если совокупность результатов перечисленных выше методов диагностики не позволяет верифицировать процесс, а вероятность злокачественной опухоли остается высокой. В случае неэффективности трансторакальной биопсии может быть использована торакоскопия для верификации диагноза [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам при подозрении на метастатическое поражение лимфатических узлов средостения (N 2 - 3) для оценки распространенности процесса трансбронхиальная или трансэзофагеальная пункция (EBUS/EUS), медиастиноскопия, торакоскопия [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: после интраоперационной торакоскопической ревизии и срочного патолого-анатомического исследования биопсийного (операционного) материала в зависимости от клинической ситуации операцию завершают удалением адекватного объема легочной ткани, а при злокачественном процессе дополняют ее медиастинальной лимфаденэктомией.
Диагностическую видеоторакоскопию проводят:
- при отсутствии результатов бронхологического и/или других исследований для получения морфологического материала из лимфатических узлов средостения или первичной опухоли у неоперабельных пациентов;
- с целью дифференциальной диагностики медиастинальной формы рака легкого и опухоли переднего средостения (в случае неинформативности трансторакальной биопсии);
- при экссудативном плеврите неясной этиологии;
- с целью стадирования рака легкого;
- при метастазах опухоли в легком и по плевре (при невозможности применения малоинвазивных методов диагностики).
- Рекомендуется пациентам с подозрением на рак легкого проведение ПЭТ-КТ для оценки распространенности процесса и уточнения статуса медиастинальных лимфатических узлов при невозможности получения биопсийного материала из лимфатических узлов средостения [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с подозрением на рак легкого ультразвуковое исследование или КТ органов брюшной полости с внутривенным контрастированием для уточнения распространенности заболевания [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с подозрением на рак легкого ультразвуковое исследование шейно-надключичных зон для уточнения распространенности заболевания [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с установленным диагнозом рака легкого выполнение остеосцинтиграфии для уточнения распространенности заболевания и для контроля эффективности лечения [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с установленным диагнозом рака легкого МРТ или КТ головного мозга с внутривенным контрастированием с целью оценки распространенности опухолевого процесса, а также с целью динамического наблюдения пациента после хирургического, лучевого и химиотерапевтического лечения для контроля заболевания [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациенту с установленным диагнозом рака легкого ПЭТ-КТ для уточнения распространенности заболевания, если имеются подозрения на метастазы по данным КТ или МРТ, и если подтверждение их наличия принципиально меняет тактику лечения [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется всем пациентам с подозрением на рак легкого выполнение электрокардиографии для выявления сопутствующей патологии [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется при подготовке пациента к хирургическому, лучевому и химиотерапевтическому лечению с целью оценки функционального статуса по показаниям проводить дополнительное обследование: эхокардиографию, холтеровское мониторирование электрокардиограммы, исследование функции внешнего дыхания, сцинтиграфию легких, ультразвуковую допплерографию сосудов шеи и нижних конечностей, эзофагогастродуоденоскопию, консультации врача-кардиолога, врача-эндокринолога, врача-невролога и т.п. [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.5 Иные диагностические исследования
- Рекомендуется для уточнения морфологической формы рака легкого (аденокарцинома или плоскоклеточный рак) проведение патолого-анатомического исследования биопсийного (операционного) материала с применением иммуногистохимических методов или иммуноцитохимического исследования с моноклональными антителами [8, 10, 11].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам при проведении патолого-анатомического исследования биопсийного (операционного) материала тканей удаленного опухолевого препарата отражать в заключении следующие параметры для верификации диагноза:
1. состояние краев резекции;
2. гистологическое строение опухоли;
3. pT;
4. pN (с указанием локализации, общего числа исследованных и пораженных лимфатических узлов) [12, 13].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3. Лечение
3.1. Лечение пациентов с немелкоклеточным раком легкого
Один из основных методов лечения рака легкого - хирургический. Объем операции определяется распространенностью опухолевого процесса, гистологической формой опухоли и функциональным состоянием пациента.
При карциноидных опухолях хирургический метод является основным. Карциноидные опухоли, особенно типичные формы, характеризуются менее агрессивным местным инфильтративным ростом и отдаленным метастазированием, чем другие (чаще встречающиеся) формы немелкоклеточного рака легкого (НМРЛ) - плоскоклеточный и железистый рак. Карциноиды развиваются чаще в крупных бронхах 1, 2 и 3-го порядка и характеризуются преимущественно экзофитным, внутрипросветным ростом, без распространения опухоли по стенке бронха, что чаще позволяет выполнить органосохраняющую радикальную операцию в объеме лоб-, билобэктомии с использованием резекции и реконструкции бронхов и трахеи или изолированную радикальную резекцию бронхов, трахеи и ее бифуркации с сохранением функции всего легкого.
Эндоскопическое, эндобронхиальное удаление карциноидных опухолей может быть проведено у пациентов без прорастания опухолью всей стенки бронха, у которых по тем или иным причинам нельзя провести радикальную резекцию легкого и бронха открытым способом или через торакоскопический доступ. При обследовании до операции всегда сложно установить истинную глубину поражения опухолью стенки бронха [14].
3.1.1. Принципы лечения пациентов с 0 - IIIA стадиями заболевания
Пациенты 0 - IIIA стадиями НМРЛ считаются операбельными с учетом функциональных показателей [1, 2].
- Пациентам с 0 - IIIA стадиями НМРЛ рекомендуется хирургическое лечение, с целью улучшения выживаемости у данных пациентов, при условии соблюдения требований к радикальной операции [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: стандартный объем операции включает анатомическую резекцию легкого (лобэктомию, билобэктомию) с ипсилатеральной медиастинальной лимфодиссекцией.
Торакоскопические операции при клинической I стадии рака легкого могут быть рекомендованы как стандартный вариант хирургического лечения наряду с обычными открытыми вмешательствами [15, 16].
- Не рекомендуется адъювантная ХТ и ЛТ пациентам с I стадией [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам с I стадией НМРЛ при функциональной неоперабельности, высоком риске хирургических осложнений или отказе пациента от хирургического лечения рекомендуется радикальная ЛТ с целью улучшения выживаемости у данных пациентов [8, 10, 17].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Пациентам группы высокого риска с Ib стадией при размере опухоли > 4 см рекомендуется адъювантная химиотерапия (ХТ), с целью улучшения выживаемости у данных пациентов [18].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Пациентам со II стадией НМРЛ в случае невозможности проведения хирургического лечения рекомендуется химиолучевая терапия, или ЛТ, или ХТ с целью улучшения выживаемости у данных пациентов [8, 10, 17].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам с НМРЛ II стадии рекомендуется адъювантная лекарственная противоопухолевая терапия с целью улучшения выживаемости у данных пациентов (табл. 2). Предоперационное противоопухолевое лечение данной группе пациентов не рекомендуется, в связи с отсутствием доказательств влияния данного лечения на выживаемость данных пациентов [18 - 21].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Пациентам с распространенностью заболевания T1-2N0 в случае невозможности проведения хирургического лечения рекомендуется дистанционная лучевая стереотаксическая гипофракционная терапия (высокодозированное облучение) с использованием крупных доз за фракцию (РОД 10 - 18 Гр, СОД 50 - 54 Гр) с целью улучшения выживаемости у данных пациентов [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: лечение проводится с использованием методов контроля дыхания.
- ЛТ рекомендуется пациентам с НМРЛ при нерадикальной операции (R+), так как уменьшает риск рецидива у данных пациентов [10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- При исходно нерезектабельной опухоли у пациентов в удовлетворительном общем состоянии (0 - 1 балл по шкале ECOG, Приложение Г3) при IIIA стадии заболевания на 1-м этапе рекомендуется одновременная химиолучевая терапия; у пациентов с оценкой 2 балла по шкале ECOG предпочтительнее последовательное использование двух методов с целью улучшения выживаемости у данных пациентов [22].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Пациенты с IIIA стадией считаются потенциально операбельными, им рекомендуется комбинированное лечение с применением ХТ (хирургическое вмешательство + адъювантная ХТ) с целью улучшения выживаемости у данных пациентов [23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Неоадъювантная ХТ (2 - 4 курса) рекомендуется операбельным пациентам с IIIA стадией с N2 (доказанной по данным патолого-анатомического исследования биопсийного (операционного) материала или ПЭТ-КТ) в качестве этапа комбинированного лечения [24].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: Операцию рекомендуется выполнять через 3 - 8 нед. с момента последнего введения химиопрепаратов.
- Рекомендуются в рамках проведения неоадъювантной ХТ в зависимости от конкретной клинической ситуации следующие схемы комбинированной лекарственной терапии:
Гемцитабин** 1250 мг/м2 в/в в 1-й и 8-й дни + цисплатин** 80 мг/м2 в/в в 1-й день 21-дневного цикла; до 4 циклов [26, 28, 178]
A1
Винорелбин** 30 мг/м2 в/в (максимум 60 мг/м2 внутрь) в 1-й и 8-й дни + цисплатин** 80 мг/м2 в/в в 1-й день 21-дневного цикла; до 4 циклов [20, 178]
A1
Паклитаксел** 175 мг/м2 в/в в 1-й день + карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в в 1-й день 21-дневного цикла; до 4 циклов [25, 178]
A1
Доцетаксел** 75 мг/м2 в/в в 1-й день + карбоплатин AUC 6 в/в в 1-й день 21-дневного цикла; до 4 циклов [27, 178]
A1
Доцетаксел** 75 мг/м2 в/в в 1-й день + цисплатин** 75 мг/м2 в/в в 1-й день 21-дневного цикла; до 4 циклов [27]
A1
- Адъювантная ХТ рекомендуется пациентам во всех случаях N+ при отсутствии противопоказаний с целью улучшения выживаемости у данных пациентов [23].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Проведение ЛТ совместно с химиотерапией в послеоперационном периоде возможно у пациентов с pN2. Рекомендуется облучение лимфатических узлов средостения с СОД 50 - 54 Гр после R0-резекции и с СОД 54 - 60 Гр при R1-резекции или при прорастании в капсулу лимфатического узла с целью улучшения выживаемости у данных пациентов [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Послеоперационная ЛТ не является стандартным подходом к лечению пациентов, она рекомендуется при резекции R+ и в индивидуальных случаях при высоком риске локального рецидива (IVC). Следует учитывать ослабленное состояние пациентов после операции [21, 177].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- Рекомендованы в рамках проведения адъювантной ХТ в зависимости от конкретной клинической ситуации следующие схемы комбинированной лекарственной терапии:
Винорелбин** 25 - 30 мг/м2 в 1 и 8 дни + цисплатин** 75 - 80 мг/м2 в/в в 1-й день 21-дневного цикла; до 4 циклов [8]
5C
#Этопозид** 100 мг/м2 в/в в 1, 2 и 3-й дни + цисплатин** 100 мг/м2 в/в в 1-й день 28-дневного цикла; до 4 циклов [20, 185]
2A
#Паклитаксел** 200 мг/м2 в/в в 1-й день + карбоплатин** AUC 6 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в в 1-й день 21-дневного цикла; до 4 циклов [25, 26]
2A
Гемцитабин** 1000 мг/м2 в/в в 1-й и 8-й дни + Карбоплатин AUC 5 в/в в 1-й день 21-дневного цикла; до 4 циклов [26]
4C
Пеметрексед** 500 мг/м2 в/в в 1-й день 21-дневного цикла + цисплатин** 75 мг/м2 в/в в 1-й день; до 4 циклов с премедикацией фолиевой кислотой** и цианокобаламином** для уменьшения токсичности (фолиевая кислота** внутрь по 350 - 1000 мкг, в среднем 400 мг (как минимум за 5 дней до начала лечения пеметрекседом) и цианокобаламин (витамин B12) в дозе 1000 мкг внутримышечно в период за 7 дней до начала лечебного цикла) (только неплоскоклеточный НМРЛ) [29]
2A
3.1.2. Принципы лечения пациентов с IIIB стадией заболевания
- Пациентам с IIIB стадией НМРЛ на 1-м этапе рекомендуется одновременная химиолучевая терапия для достижения ремиссии [30, 22].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: планируемая СОД должна составлять не менее 60 Гр. Одновременная химиолучевая терапия дает лучшие результаты по сравнению с последовательной у пациентов с НМРЛ IIIB стадии, однако она более токсична и рекомендуется только пациентам в удовлетворительном общем состоянии (0 - 1 балл по шкале ECOG) [31]. При состоянии, оцениваемом в 2 балла по шкале ECOG, рекомендуется последовательное применение ХТ и ЛТ. Порядок применения методов лечения определяется индивидуально на основании клинических показаний и противопоказаний.
Дистанционная ЛТ
Первичная опухоль, пораженные лимфатические узлы
Конформная ЛТ (РОД 2 Гр, СОД 60 - 66 Гр (КТ, ПЭТ))
Регионарные лимфатические узлы
Конформная ЛТ (РОД 2 Гр, СОД 40 - 45 Гр (КТ, ПЭТ))
- Рекомендуются следующие режимы химиотерапии, для лечения IIIA, IIIB стадий НМРЛ в комбинации с лучевой терапией для достижения ремиссии:
#Паклитаксел** 200 мг/м2 в/в в 1-й день + карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в капельно в 1-й день, интервал 3 нед., 3 - 4 курса [179]
УДД 2, УУР B
Пеметрексед** 500 мг/м2 в/в капельно в 1-й день + цисплатин** 75 мг/м2 (или карбоплатин**AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения)) в/в капельно в 1-й день каждые 3 нед., 3 курса одновременно с ЛТ (при неплоскоклеточном НМРЛ) [33, 34]
УДД 2, УУР B
#Этопозид** 50 мг/м2 в/в в 1 - 5-й, 29 - 33-й дни +
цисплатин** 50 мг/м2 в 1, 8, 29, 36-й дни одновременно с ЛТ [30, 35]
УДД 2, УУР B
#Паклитаксел** 50 мг/м2 в/в в 1, 8, 15-й дни + карбоплатин** AUC 2 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в капельно в 1, 8, 15-й дни одновременно с ЛТ + 2 курса консолидирующей ХТ (#паклитаксел 200 мг/м2 в/в в 1-й день + карбоплатин AUC 6 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в капельно в 1-й день, интервал 3 нед.) [36]
УДД 2, УУР B
- После завершения химиолучевой терапии пациентам, не имеющим признаков прогрессирования болезни (обследование может быть проведено непосредственно после окончания химиолучевой терапии) рекомендуется поддерживающая иммунотерапия дурвалумабом [37]. Препарат назначается в дозе 10 мг/кг в виде 60-минутной внутривенной инфузии каждые 2 нед. в течение не менее 12 мес., или до прогрессирования, или до развития непереносимой токсичности [10, 37].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- При противопоказаниях к химиолучевому лечению рекомендуется пациентам проводить системную ХТ (см. 3.1.3.1 Химиотерапия 1-й линии) с целью улучшения выживаемости у данных пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.1.3. Принципы лечения пациентов с IV стадией заболевания
- Рекомендуется проводить противоопухолевое лекарственное лечение пациентам. Лечение пациентов с IV стадией НМРЛ следует расценивать как паллиативное, направленное на увеличение продолжительности жизни, улучшение ее качества и эффективный контроль симптомов болезни. Раннее начало противоопухолевой терапии, поддерживающей и сопроводительной симптоматической терапии увеличивает продолжительность жизни [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам с IV стадией рекомендуется назначать лечение с учетом предиктивных и прогностических факторов. (табл. 4) [38, 39].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При выявлении активирующих мутаций гена EGFR (19 и 21 экзоны) или транслокаций ALK, ROS1, мутации BRAF рекомендуется назначение таргетной терапии [38, 39, 58 - 64]. (см. 3.1.3.4 Молекулярно-направленная терапия: EGFR+, ALK/ROS1+, BRAF+).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При отсутствии драйверных молекулярно-генетических нарушений рекомендуется ХТ, химиоиммунотерапия или иммунотерапия в зависимости от ряда клинических и лабораторных параметров, в некоторых случаях с учетом уровня экспрессии PD-L1 опухолевыми клетками (см. 3.1.3.1 Химиотерапия 1-й линии) [8].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
В таблице 4 указаны активные режимы 1-й линии комбинированной платинсодержащей химиотерапии немелкоклеточного рака легкого IV стадии, для лечения пациентов с НМРЛ. Рекомендации по их применению представлены ниже.
Таблица 4. Активные режимы 1-й линии комбинированной платинсодержащей химиотерапии немелкоклеточного рака легкого IV стадии
#Этопозид** 100 мг/м2 в/в в 1, 2, 3-й дни +
цисплатин** 100 мг/м2 в/в в 1-й день каждые 3 нед. [160]
#Этопозид** 100 мг/м2 в/в в 1 - 3-й дни +
карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в в 1-й день каждые 3 нед. [40, 41]
Винорелбин** 25 - 30 мг/м2 в/в (или 60 мг/м2 внутрь) в 1-й и 8-й дни +
цисплатин** 75 - 80 мг/м2 в/в в 1-й день каждые 3 нед. [27, 42]
Паклитаксел** 175 - 200 мг/м2 в 1-й день
+ карбоплатин** AUC 5 - 6 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в в 1-й день каждые 3 нед. +/-
бевацизумаб** 15 мг/кг 1 раз в 3 нед. до прогрессирования (только при аденокарциноме) [43]
Гемцитабин** 1000 - 1250 мг/м2 в 1-й и 8-й дни +
цисплатин** 80 мг/м2 в 1-й день каждые 3 нед. [42, 44]
Гемцитабин** 1000 мг/м2 в 1-й и 8-й дни +
карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в в 1-й день каждые 3 нед. [45]
Пеметрексед** 500 мг/м2 в 1-й день +
цисплатин** 75 мг/м2 (или карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения)) в 1-й день каждые 3 нед.
с премедикацией фолатом и цианкобаламином для уменьшения токсичности (фолиевая кислота** по 350 - 1000 мкг, в среднем 400 мг как минимум за 5 дней до начала лечения пеметрекседом и цианкобаламин (витамин B12) в дозе 1000 мкг внутримышечно в период за 7 дней до начала лечебного цикла) +/-
бевацизумаб** 7,5 мг/кг 1 раз в 3 нед. до прогрессирования (только при аденокарциноме) [46, 180]
Комментарии: комбинация пеметрекседа** с цисплатином** у пациентов неплоскоклеточным НМРЛ в мета-анализе показала преимущество по сравнению с комбинацией с гемцитабином** [65].
- Всем пациентам с IV стадией НМРЛ без активирующих мутаций в состоянии, оцениваемом в 0 - 2 балла по шкале ECOG (Приложение Г3), при отсутствии противопоказаний рекомендуется проведение комбинированной платиносодержащей ХТ (режимы представлены в таблице 4) [67 - 69].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарии: рекомендуется 4 курса ХТ при контроле роста опухоли (стабилизации, полном или частичном регрессе); число курсов может быть увеличено до 6 при нарастающем объективном эффекте и удовлетворительной переносимости [70]. При неплоскоклеточном РЛ при отсутствии признаков прогрессирования заболевания после 4 - 6 курсов лечения возможна поддерживающая терапия пеметрекседом**, или бевацизумабом**, или их комбинацией, если эти препараты входили в схему 1-й линии лечения. Рекомендуется для контроля эффективности лечения проводить обследование с использованием методов объективной визуализации (КТ, рентгенографии, МРТ, ПЭТ-КТ, сцинтиграфии костей скелета) до начала лечения, после каждых 2 курсов ХТ в сроки около 2 нед. от 1-го дня четного курса и далее 1 раз в 6 - 12 нед. с учетом клинических показаний. Представляется целесообразным применять тот же метод оценки, что и до начала лечения.
- Рекомендуется рассмотреть возможность проведения монохимиотерапии для лечения пациентов старше 65 лет или пациентов, состояние которых оценивается в 2 балла по шкале ECOG (Приложение Г3); в качестве минимального варианта лечения рассматривается терапия:
#этопозидом** [181]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5);
винорелбином** (прием внутрь или внутривенное введение), пеметрекседом** (при неплоскоклеточном НМРЛ), таксанами**, гемцитабином**, или моноиммунотерапия пембролизумабом** при уровне экспрессии PD-L1 > 50% [58], а также при PD-L1 > 1%, если ХТ непереносима, или комбинация этих препаратов с производными платины (предпочтительно с карбоплатином**) [72 - 74].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Таблица 5. Монохимиотерапия при НМРЛ
Винорелбин** 25 - 30 мг/м2 в/в (или 60 мг/м2 внутрь) 1, 8, 15-й дни каждые 4 нед.
Гемцитабин** 1000 - 1250 мг/м2 в 1-й и 8-й дни каждые 3 нед. [47, 49]
Доцетаксел** 75 мг/м2 в/в в 1-й день каждые 3 нед. [50, 51]
Пеметрексед** 500 мг/м2 в 1-й день каждые 3 нед.
с премедикацией фолатом и цианкобаламином для уменьшения токсичности (фолиевая кислота** по 350 - 1000 мкг, в среднем 400 мг как минимум за 5 дней до начала лечения пеметрекседом и цианкобаламин (витамин B12) в дозе 1000 мкг внутримышечно в период за 7 дней до начала лечебного цикла) (при неплоскоклеточном НМРЛ) [52]
- Рекомендуется в случае метастатического поражения костей (литического и смешанного характера) назначать бисфосфонаты или деносумаб** (оптимально) в целях уменьшения болевого синдрома у пациентов [74, 75, 159].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Рекомендуется при угрозе перелома, либо с обезболивающей целью, паллиативная ЛТ на область симптомного метастатического поражения костей [76].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Новым направлением в лекарственном лечении пациентов с диссеминированным НМРЛ стала иммунотерапия, в частности терапия ингибиторами контрольных точек иммунного надзора.
В таблице 6 указаны режимы дозирования лекарственных препаратов, назначаемых в рамках иммунотерапии и иммунохимиотерапии, для лечения пациентов с НМРЛ. Рекомендации по их применению представлены ниже.
Таблица 6. Иммуно- и иммунохимиотерапия в первой линии лечения НМРЛ
#Пембролизумаб** 200 мг в/в в виде 30-минутной инфузии каждые 3 нед. для пациентов с НМРЛ без активирующих мутаций с экспрессией PD-L1 в >= 50% опухолевых клеток длительно (до 2 лет) [53]
#Пембролизумаб** 200 мг в/в в виде 30-минутной инфузии каждые 3 нед. для пациентов с НМРЛ без активирующих мутаций с экспрессией PD-L1 в >= 1% опухолевых клеток длительно (до 2 лет) [55]
#Пембролизумаб** 200 мг + пеметрексед** 500 мг/м2 + цисплатин** 75 мг/м2 (карбоплатин** AUC 5 (фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатитина в анализе крови пациента накануне проведения лечения)) в/в капельно 1 раз в 3 нед.; 4 курса, в дальнейшем поддерживающая терапия пембролизумабом** и пеметрекседом** до прогрессирования или развития непереносимой токсичности (пембролизумабом** до 2 лет) только при неплоскоклеточном НМРЛ без активирующих мутаций [54]
Пембролизумаб** 200 мг + #паклитаксел** 200 мг/м2 в 1-й день + карбоплатин** AUC 6 фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатитина в анализе крови пациента накануне проведения лечения) в 1-й день каждые 3 нед.; 4 курса, в дальнейшем поддерживающая терапия пембролизумабом** до прогрессирования или развития непереносимой токсичности (до 2 лет) при плоскоклеточном НМРЛ [78]
Атезолизумаб** 1200 мг + #паклитаксел** 200 мг/м2 (для пациентов-азиатов - 175 мг/м2) + карбоплатин** AUC 6 +бевацизумаб** 15 мг/кг в/в капельно в 1-й день каждые 3 нед.; 4 курса, в дальнейшем поддерживающая терапия атезолизумабом** и бевацизумабом** до прогрессирования или развития непереносимой токсичности (только при неплоскоклеточном НМРЛ). В случае клинической необходимости перед началом терапии атезолизумабом** пациенты с геномной опухолевой мутацией EGFR или ALK должны получить таргетную терапию [56]
- Рекомендуется пациентам в качестве иммунотерапии 1-й линии при отсутствии мутаций в генах EGFR или транслокации ALK/ROS1 при распространенном НМРЛ с экспрессией PD-L1 в >= 50% опухолевых клеток, пембролизумаб**. #Пембролизумаб** назначается в дозе 200 мг внутривенно, введение 30 мин. каждые 3 нед. [55].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- При непереносимости платиносодержащей химиотерапии в качестве иммунотерапии 1-й линии при распространенном НМРЛ с экспрессией PD-L1 в >= 1% опухолевых клеток при отсутствии мутаций в генах EGFR или транслокации ALK/ROS1 рекомендуется #пембролизумаб** в дозе 200 мг внутривенно, введение 30 мин. каждые 3 нед. [55].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 2)
- Рекомендуется комбинация иммунотерапии с ХТ пациентам с распространенным неплоскоклеточным НМРЛ с любым (или неизвестным) статусом PD-L1 в одном из двух режимов:
- пембролизумаб** 200 мг + пеметрексед** 500 мг/м2 + цисплатин** 75 мг/м2 (при непереносимости цисплатина** - карбоплатин** AUC 5, фактическая доза карбоплатина рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) в/в капельно 1 раз в 3 нед.; 4 курса, в дальнейшем поддерживающая терапия пембролизумабом** и пеметрекседом** до прогрессирования или развития непереносимой токсичности только при неплоскоклеточном НМРЛ без активирующих мутаций [77];
- атезолизумаб** 1200 мг + #паклитаксел** 200 мг/м2 (для пациентов монголоидной расы - 175 мг/м2) + карбоплатин** AUC 6 + бевацизумаб** 15 мг/кг в/в капельно в 1-й день каждые 3 нед; 4 курса, в дальнейшем поддерживающая терапия атезолизумабом** и бевацизумабом** в прежних дозах до прогрессирования или развития непереносимой токсичности только при неплоскоклеточном НМРЛ. Перед началом применения данной комбинации пациенты с геномной мутацией EGFR или ALK должны получить таргетную терапию [56].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
- Пациентам с распространенным плоскоклеточным раком легкого с любым (или неизвестным) статусом PD-L1 может быть рекомендована комбинация иммунотерапии с ХТ в следующем режиме: пембролизумаб** 200 мг + #паклитаксел** 200 мг/м2 в 1-й день + карбоплатин** AUC 6 (расчет точной дозы указан выше) в 1-й день каждые 3 нед., 4 курса, в дальнейшем поддерживающая терапия пембролизумабом** до прогрессирования или развития непереносимой токсичности [78].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: повторное назначение препаратов этого класса возможно во 2-й и 3-й линиях если 1-я линия иммунотерапии была завершена без признаков прогрессирования опухоли и/или без явлений непереносимой токсичности. Лечение проводится непрерывно до прогрессирования или развития непереносимой токсичности.
Химиотерапия 2-й линии может уменьшать выраженность симптомов рака легкого и увеличивать продолжительность жизни отдельных пациентов. Вторая линия ХТ применяется только при прогрессировании опухолевого процесса у пациентов. При выборе варианта лечения следует учитывать возможное влияние на качество жизни пациента с учетом сопутствующих заболеваний [79].
- После 1-й линии ХТ рекомендуется иммунотерапия моноклональными антителами к PD-(L) 1, если они не назначались в 1-й линии: ниволумабом** [80, 81], или атезолизумабом** [82] (независимо от уровня PD-L1), или пембролизумабом** при экспрессии PD-L1 в >= 1% опухолевых клеток [84]. Эффективность данных моноклональных антител возрастает (по сравнению с ХТ) с увеличением уровня экспрессии [83].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Рекомендуется ниволумаб** у пациентов плоскоклеточным и неплоскоклеточным НМРЛ независимо от уровня экспрессии PD-L1 в виде 60-минутной инфузии в одном из трех дозовых режимов [80, 81, 161, 162]:
- 3 мг/кг каждые 2 нед;
- 240 мг каждые 2 нед;
- 480 мг каждые 4 нед.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Рекомендуется пембролизумаб** в дозе 200 мг каждые 3 нед. у пациентов с плоскоклеточным и неплоскоклеточным НМРЛ с экспрессией PD-L1 в >= 1% опухолевых клеток [84, 163, 182].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Атезолизумаб** рекомендуется для лечения пациентов плоскоклеточным и неплоскоклеточным НМРЛ независимо от уровня экспрессии PD-L1 в одном из трех дозовых режимов:
- 1200 мг в/в каждые 3 нед;
- 840 мг в/в каждые 2 нед;
- 1680 мг в/в каждые 4 нед [82, 164].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
Комментарии: при отсутствии прямых сравнительных исследований по данным показаниям режимы лечения считаются клинически равноэффективными.
- У пациентов с аденокарциномой с прогрессированием в течение 6 мес. от начала ХТ 1-й линии предпочтительно рекомендуется назначение доцетаксела** (если он не применялся ранее) в комбинации с нинтеданибом** в следующем режиме: доцетаксел** 75 мг/м2 в 1-й день + нинтеданиб** по 200 мг 2 раза в сутки во 2 - 21-й дни; цикл 21 день [85].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: в отдельных случаях после отмены доцетаксела** из-за побочных эффектов только в случае объективного ответа или стабилизации болезни возможно продолжить нинтеданиб** (до прогрессирования).
- Рекомендуется назначение комбинаций с препаратами платины пациентам в общем удовлетворительном состоянии (0 - 1 балл по шкале ECOG, приложение Г3) при исчерпанных возможностях таргетного лечения при известных активирующих мутациях, без активирующих мутаций при длительном интервале без прогрессирования после 1-й платиносодержащей линии лечения [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется монотерапия пеметрекседом**, или доцетакселом**, или гемцитабином**, или винорелбином**, или иммунотерапия ослабленным пациентам (в состоянии, оцениваемом в 2 балла по шкале ECOG) до клинического прогрессирования, если эти препараты не использовались в 1-й линии для достижения ремиссии и продления жизни [50, 52, 86].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- Назначение 3-й и последующих линий терапии рекомендуется пациентам в удовлетворительном общем состоянии (0 - 1 балл по шкале ECOG) при наличии не использованных ранее вместе опций терапии с принципиально другим механизмом противоопухолевого эффекта для достижения ремиссии и продления жизни [8, 10].
Уровень достоверности доказательств - C (уровень достоверности доказательств - 5)
- Рекомендуется #эрлотиниб** 150 мг/сут или #афатиниб** 40 в сутки пациентам без активирующих мутаций в гене EGFR, если имеются противопоказания к иммунотерапии и ХТ для достижения ремиссии и продления жизни [88 - 91, 165, 166].
Уровень достоверности доказательств - A (уровень достоверности доказательств - 3)
Комментарии: необходимо отметить, что клиническая эффективность данных лекарственных препаратов у данной группы пациентов ниже, чем иммунотерапии и ХТ.
EGFRALKROS1BRAF
В таблице 7 указаны режимы дозирования таргетных лекарственных препаратов для лечения пациентов с НМРЛ. Рекомендации по их применению представлены ниже.
Таблица 7. Таргетные препараты для лечения пациентов с НМРЛ
Гефитиниб** 250 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или развития непереносимой токсичности [57]
Эрлотиниб** 150 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или развития непереносимой токсичности [58]
Афатиниб** 40 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или развития непереносимой токсичности [59]
Осимертиниб 80 мг внутрь ежедневно длительно при наличии активирующих мутаций EGFR до прогрессирования или развития непереносимой токсичности [60]
Кризотиниб** по 250 мг 2 раза в сутки внутрь ежедневно длительно при транслокации ALK и ROS1 до прогрессирования или развития непереносимой токсичности в 1-й линии терапии [61]
Церитиниб** 450 мг/сут внутрь ежедневно до прогрессирования или развития непереносимой токсичности (при транслокации ALK) в 1-й линии терапии, после прогрессирования на фоне терапии кризотинибом** или при ее непереносимости [62, 167]
Алектиниб по 600 мг 2 раза в сутки внутрь ежедневно длительно до прогрессировании или развития непереносимой токсичности (при транслокации ALK) в 1-й линии терапии; при прогрессировании заболевания на фоне терапии кризотинибом или при ее непереносимости [63]
Ингибиторы BRAF/MEK: #дабрафениб** по 150 мг 2 раза в сутки внутрь и #траметиниб 2 мг/сут внутрь; оба препарата принимаются ежедневно до прогрессирования или развития непереносимой токсичности (при наличии активирующей мутации BRAF V600E) [64]
- Рекомендуется молекулярно-направленная терапия всем пациентам, имеющим в опухоли соответствующую молекулярную мишень для ее применения с целью достижения максимальной эффективности [91].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется пациентам непрерывное проведение молекулярно-направленной (таргетной) терапии до появления клинических признаков прогрессирования процесса, однако при локальном прогрессировании (олигометастатический процесс, например, в головном мозге) рекомендуется продолжение лечения ингибиторами протеинкиназ с одновременной ЛТ (стереотаксической или на весь объем головного мозга) или хирургическим удалением солитарного очага с целью достижения максимального эффекта [8, 10].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 5)
- Рекомендуется регулярный контроль эффективности лечения пациентов с применением молекулярно-направленной терапии - 1 раз в 2 - 3 мес. или по клиническим показаниям [92 - 94].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Рекомендуются пациентам с мутациями гена EGFR в 19 или 21 экзонах в качестве терапии 1-й линии ингибиторы тирозинкиназы EGFR: гефитиниб**, эрлотиниб** [94],
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- также данным пациентам рекомендуются афатиниб** [95], осимертиниб** [96].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: при выявлении мутации EGFR в 19(Del) экзоне назначение афатиниба** в 1-й линии лечения позволяет увеличить общую выживаемость в сравнении с ХТ [60].
Афатиниб** и осимертиниб являются препаратами выбора при редких мутациях в гене EGFR.
При выявлении мутации EGFR (19, 21 экзоне) назначение осимертиниба в I линии лечения позволяет увеличить общую выживаемость в сравнении с гефитинибом** и эрлотинибом** [157].
Если мутация EGFR выявлена после начала ХТ 1-й линии, ХТ рекомендуется завершить (при эффективности - после 4 курсов) и перейти на ингибиторы протеинкиназы EGFR.
- При системном прогрессировании опухолевого процесса с мутацией EGFR на фоне 1-й линии таргетной терапии рекомендуется оценить возможность ребиопсии или исследования плазмы с целью уточнения механизма резистентности для определения дальнейшей тактики лечения [168, 169].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств 4)
- При выявлении мутации EGFR T790M всем пациентам рекомендуется назначение осимертиниба с целью достижения максимального эффекта [60, 96].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: в качестве альтернативы (при невозможности своевременного назначения осимертиниба, а также при отсутствии мутации T790M) рекомендуется проведение ХТ с включением платиносодержащих дуплетов (см. 1-ю линию ХТ) или химиоиммунотерапии (атезолизумаб** 1200 мг + #паклитаксел** 200 мг/м2 (для пациентов монголоидной расы - 175 мг/м2) + карбоплатин** AUC 6 фактическая доза карбоплатина** рассчитывается индивидуально, исходя из показателя креатинина в анализе крови пациента накануне проведения лечения) + бевацизумаб** 15 мг/кг в/в капельно в 1-й день каждые 3 нед., 4 курса, в дальнейшем поддерживающая терапия атезолизумабом** и бевацизумабом** в прежних дозах до прогрессирования или развития непереносимой токсичности [38, 39].
У пациентов с активирующими мутациями EGFR назначение во 2-й линии ингибиторов контрольных точек моноклональных антител не увеличивает общую выживаемость по сравнению с доцетакселом**, однако эти данные получены при подгрупповом анализе, включавшем небольшое число пациентов; иммунотерапия анти-PD-1-препаратами не уступает монотерапии доцетакселом** по эффективности и имеет преимущества по переносимости в этой подгруппе. Таким образом, моноклональные антитела могут быть рекомендованы для 3-й и 4-й линий терапии.
- При выявлении транслокации ALK в опухоли в качестве 1-й линии лечения НМРЛ рекомендуется один из трех препаратов: алектиниб, или церитиниб**, или кризотиниб**. Лечение проводится до клинического прогрессирования или развития непереносимой токсичности [8, 62 - 64, 97, 98].
- кризотиниб** по 250 мг 2 раза в внутрь;
- алектиниб по 600 мг 2 раза в внутрь;
- церитиниб** 450 мг/ внутрь.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: при выявлении транслокации ALK после начала 1-й линии ХТ рекомендовано завершить запланированный объем лечения (если нет прогрессирования) и перейти на таргетную терапию.
- Рекомендуется пациентам с транслокацией ALK при прогрессировании на фоне терапии кризотинибом** 2-я линия таргетной терапии церитинибом** или алектинибом [8, 62, 63].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: в качестве альтернативы при невозможности своевременного назначения ингибиторов протеинкиназ ALK 2-го поколения показана ХТ.
Если в 1-й линии лечения применялся церитиниб**, показана ХТ или алектиниб.
- Рекомендуется пациентам таргетная терапия кризотинибом** при выявлении транслокации в гене ROS1 [8, 170 - 172]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- При прогрессировании на таргетной терапии кризотинибом** рекомендуется платиносодержащая ХТ [8, 10] или таргетная терапия ROS1-ингибиторами последующих поколений.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При мутации BRAF V600E рекомендуется режим 1-й линии терапии - комбинация BRAF/MEK-ингибиторов: #дабрафениба** 150 мг 2 раза в сутки внутрь ежедневно и #траметиниба** 2 мг/сут внутрь ежедневно до клинического прогрессирования или развития непереносимой токсичности [173, 174]
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- При выявлении мутации BRAF V600E после начала 1-й линии ХТ целесообразно ее продолжение до 4 циклов, при прогрессировании рекомендуется соответствующая таргетная терапия [175, 176].
Уровень убедительности рекомендаций - 4 (уровень достоверности доказательств - C)
Комментарии: в отдельных случаях при невозможности определения активирующих мутаций гена EGFR в опухоли или в плазме как при аденокарциноме, так и плоскоклеточном раке легкого может быть рекомендована молекулярно-направленная терапия эрлотинибом** [90]. При эффективности/стабилизации рекомендуется продолжение лечения до клинического прогрессирования.
Это частое проявление прогрессирования рака легкого, в основном аденокарциномы (до 30%) [5, 52, 70, 71, 99].
- Рекомендуется локальное лечение пациентов при выявлении в головном мозге единичных метастазов без выраженных клинических проявлений: оперативное удаление и/или стереотаксическая радиотерапия/радиохирургия [100, 101]. Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: добавление к локальному лечению ЛТ на весь объем головного мозга улучшает интракраниальный контроль [102].
- При множественном церебральном метастатическом поражении рекомендуется пациентам ЛТ на весь объем головного мозга [103].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- При бессимптомном метастатическом поражении вещества головного мозга у пациентов с высоким (более 50%) уровнем экспрессии PD-L1 в 1-й линии терапии рекомендуется применение моноклонального тела пембролизумаба** для достижения ремиссии [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При бессимптомном метастатическом поражении вещества головного мозга у пациентов с активирующими мутациями EGFR, транслокации ALK, ROS1 рекомендуется начинать лечение с ингибиторов протеинкиназ для увеличения выживаемости пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарий: в 1-й линии терапии осимертиниб**, алектиниб**, церитиниб** обладают преимуществом в отношении интракраниального контроля и выживаемости без прогрессирования по сравнению с ингибиторами протеинкиназ 1-го поколения при классических мутациях. Афатиниб** продемонстрировал эффективность в том числе при редких мутациях EGFR с метастазами в головном мозге.
- При симптомных метастазах в головном мозге рекомендуется назначение высоких доз глюкокортикостероидов (#дексаметазона** до 16 мг/сут) для уменьшения отека вещества мозга; при неэффективности глюкокортикостероидов в рекомендованной дозе дальнейшее повышение дозы не рекомендуется; это свидетельствует о неблагоприятном прогнозе [104].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Принципы лечения олигометастатического НМРЛ
Под олигометастатической болезнью понимают выявление 1 отдаленного метастаза НМРЛ легкого (до 3 в головном мозге) в процессе обследования по поводу первичного опухолевого процесса (синхронное выявление) или при динамическом наблюдении после завершения лечения (метахронное выявление).
- При синхронном выявлении рекомендуется оценить возможности локального воздействия на первичную опухоль. При распространенности первичной опухоли T1-3N0-1 применяют локальные методы лечения (назначают операцию или ЛТ) как в отношении первичного очага, так и солитарных метастазов. При невозможности использования локальных методов рекомендуют лекарственную терапию, принципы которой изложены выше. При выявлении метастазов в лимфатических узлах средостения (N2+) и их морфологическом подтверждении одним из вышеуказанных способов (путем биопсии под контролем EBUS/EUS, медиастиноскопии, торакоскопии), пациентам рекомендуется проведение лекарственной противоопухолевой терапии независимо от индекса T (см. 3.1.3 Принципы лечения пациентов с IV стадией заболевания) [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При метахронном выявлении олигометастазов и отсутствии признаков рецидива первичной опухоли рекомендуется проведение пациентам хирургического лечения или ЛТ (стереотаксической) в соответствии с общими принципами. Удаление солитарного метастаза может быть рекомендовано при его локализации в головном мозге, надпочечнике, оперированном или противоположном легком, грудной стенке. При невозможности локального воздействия рекомендуется проведение лекарственного противоопухолевого лечения с учетом гистологического подтипа и молекулярно-биологических характеристик опухоли (см. 3.1.3 Принципы лечения пациентов с IV стадией заболевания) для увеличения выживаемости пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.1.4. Аспекты хирургического лечения
Хирургическое лечение пациентов с раком легкого в радикальном варианте подразумевает удаление органа (пневмонэктомию) или его анатомическую резекцию (билобэктомию, лобэктомию, сегментэктомию) с очагом болезни, внутрилегочными, корневыми и средостенными лимфатическими узлами (систематическую ипсилатеральную медиастинальную лимфодиссекцию). При типичных центральных карциноидных опухолях возможно проведение изолированной резекции и реконструкции бронха с полным сохранением функции легких [1, 2].
Медиастинальная лимфодиссекция (удаление клетчатки с лимфатическими узлами регионарных зон метастазирования) является обязательным этапом операции независимо от объема удаляемой легочной ткани [1]. Цель медиастинальной лимфодиссекции - превентивное удаление клетчатки и лимфатических узлов средостения. Операция должна выполняться острым способом, возможно применение современных коагуляционных технологий.
Стандартным объемом операции на лимфатических путях средостения следует считать систематическую медиастинальную ипсилатеральную лимфодиссекцию, выполняемую вне зависимости от объема удаления легочной паренхимы и величины лимфатических узлов [1].
В процессе операции справа широко открывается правый отдел средостения, обнажается правая и передняя поверхность трахеи (в том числе в области бифуркации трахеи с визуализацией левого главного бронха), для этого верхняя полая вена отводится кнутри. Верхней границей является обнаженный брахиоцефальный артериальный ствол аорты, левой - правая полуокружность восходящей аорты, нижней - трахеобронхиальный угол. Следует сохранить основной ствол блуждающего нерва. Обязательно удаляется клетчатка переднего средостения и визуализируется проксимальный отдел левой брахиоцефальной вены.
Операция слева подразумевает удаление парааортальных, субаортальных, левых нижних паратрахеальных лимфатических узлов, обнажение верхней полуокружности аорты и удаление клетчатки по ходу начальных отделов общей сонной и подключичной артерий. При наличии показаний перевязка (пересечение) связки боталлова протока позволяет удалить претрахеальные лимфатические узлы, выполнить частичную ревизию правой паратрахеальной области. Возможно широкое рассечение медиастинальной плевры и удаление клетчатки переднего средостения с визуализацией левой брахиоцефальной вены на всем протяжении.
Независимо от стороны операции удаляют бифуркационные, параэзофагеальные и лимфатические узлы легочной связки соответствующих сторон.
Сверхрасширенная медиастинальная лимфодиссекция (систематическая), т.е. операция, объем которой больше описанного (стандартного), подразумевает использование трансстернального доступа с удалением паратрахеальной клетчатки справа и слева, в том числе выше слияния правой и левой брахиоцефальных вен и надключичных областей. Такая операция не может быть рекомендована к широкому применению в практике, ее целесообразность требует специального обсуждения [1].
По характеру выполнения операции подразделяют на радикальные и паллиативные. Под радикальной операцией (R0) подразумевают онкологически обоснованное удаление пораженного органа или его резекцию в пределах здоровых тканей с клетчаткой и лимфатическими узлами зон регионарного метастазирования, включая средостенные [1, 2].
Радикальность вмешательства подтверждают интраоперационно результатами срочного и планового морфологического исследований тканей по краю резекции.
Операцию считают паллиативной при микроскопическом (R1) выявлении опухолевых клеток по линии резекции бронха, сосудов, легочной ткани, дополнительно резецированных структур и органов, а также визуально (R2) определяемой опухоли в оставшейся части легкого, органах и структурах средостения, плевре, при опухолевом плеврите или перикардите, неполном удалении метастатических внутригрудных лимфатических узлов [1, 2, 12, 15, 16, 106 - 108].
В последние годы широкое применение при клинической I стадии болезни получили анатомические резекции легкого с медиастинальной лимфодиссекцией с использованием малоинвазивных хирургических доступов. Непосредственные результаты таких вмешательств превосходят результаты торакотомических операций, а онкологические результаты не уступают результатам вмешательств с использованием открытых доступов [15, 16, 107, 108].
Рекомендации по определению объема хирургического вмешательства представлены ниже.
- Минимальным онкологически обоснованным объемом операции у пациентов рекомендуется считать лобэктомию, билобэктомию или пневмонэктомию с ипсилатеральной медиастинальной лимфодиссекцией для увеличения выживаемости пациентов [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При периферических опухолях размером до 2 см и низких функциональных кардиореспираторных резервах рекомендуется выполнение пациентам анатомической сегментэктомии легкого для увеличения выживаемости пациентов [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Сублобарные резекции (атипичная резекция, сегментэктомия) пациентам не рекомендуются [109].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: Исключение составляют пациенты с типичными карциноидными опухолями легких и бронхов. Биологические особенности этих редких опухолей, их преимущественно эндобронхиальный рост позволяют проводить органосохраняющие операции в объеме лобэктомии или сегментэктомии с резекцией и реконструкцией бронхов, изолированные резекции бронхов или бифуркации трахеи с сохранением всей функционирующей ткани легких и удовлетворительными отдаленными результатами [14].
3.1.5. Лекарственное противоопухолевое лечение
Адъювантная терапия
Адъювантная ХТ проводится в дополнение к локальным (хирургическому и лучевому) методам лечения и позволяет снизить риск рецидива болезни. При планировании адъювантной ХТ необходимо оценить стадию заболевания, прогноз, ожидаемую пользу, наличие сопутствующих заболеваний, возможные осложнения и их влияние на качество жизни, а также учесть предпочтения пациента. Возраст сам по себе не является ограничением при отсутствии противопоказаний, связанных с наличием сопутствующих заболеваний.
При опухолях небольших размеров и отсутствии регионарных метастазов, что является прогностически благоприятным, адъювантная ХТ обладает минимальной эффективностью.
При проведении адъювантной ХТ следует использовать стандартные режимы с соблюдением оптимальной дозовой интенсивности, по возможности избегать необоснованных редукций доз препаратов, увеличения интервалов между курсами, уменьшения числа курсов.
- Адъювантную ХТ рекомендуется начинать не позднее 8 нед. после операции при восстановлении пациента (при состоянии, оцениваемом в 0 - 1 балла по шкале ECOG, Приложение Г3) с целью улучшения выживаемости у данных пациентов, с использованием любых платиносодержащих комбинаций с включением химиопрепаратов 3-го поколения или #этопозида**, всего проводится 4 цикла лечения (см. табл. 2) с целью улучшения выживаемости у данных пациентов. Наиболее изученными и часто применяемыми комбинациями являются сочетания винорелбина** и цисплатина**, гемцитабина** и цисплатина**, паклитаксела** и карбоплатина** [20, 26, 29].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- При неплоскоклеточном НМРЛ рекомендуется применение следующего режима: пеметрексед** + цисплатин** с целью улучшения выживаемости у данных пациентов. При противопоказаниях к назначению цисплатина** используется карбоплатин** [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Таргетная терапия в адъювантном режиме не рекомендуется.
- В случае невозможности проведения хирургического лечения и/или ЛТ или отказа пациента от нее, паллиативную ХТ рекомендуется применять как самостоятельный метод (см. 3.1.3 Принципы лечения пациентов с IV стадией заболевания) с целью улучшения качества жизни и выживаемости у данных пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
3.1.6. Паллиативная, в том числе лучевая, терапия и симптоматическая терапия
- Паллиативная ЛТ пациентам рекомендуется на любых этапах заболевания для локального контроля солитарных метастазов, для симптоматического лечения (устранения болевого синдрома, кровохарканья, обструкции) и улучшения качества жизни пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При экссудативном плеврите и/или перикардите с клинически значимым ухудшением состояния пациента рекомендуется проведение пункции плевральной полости или пункции перикарда для симптоматического лечения и улучшения качества жизни пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При легочном кровотечении рекомендуется рассмотреть вопрос о паллиативном хирургическом лечении; при невозможности его выполнения рекомендуется консервативная гемостатическая терапия для коррекции данного осложнения [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- При массивном распаде опухоли, вторичной пневмонии рекомендуется рассмотреть вопрос о паллиативной операции для коррекции данного осложнения [1, 2].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Рекомендуется адекватное медикаментозное обезболивание всех пациентов с болевым синдромом для коррекции данного осложнения и улучшения качества жизни данных пациентов. Степень болевого синдрома оценивается по шкале интенсивности боли (см. Приложение Г1, Г2) [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: целью так называемой "наилучшей поддерживающей терапии" (best supportive care) является профилактика возникновения, облегчение симптомов заболевания и поддержание качества жизни пациентов и их близких независимо от стадии заболевания и потребности в других видах терапии.
3.2. Лечение пациентов с мелкоклеточным раком легкого
- Рекомендуется лечение пациентов с МРЛ: оперативное лишь при I стадии (IA и IB) и в отдельных случаях при II стадии с обязательной адъювантной ХТ по следующей схеме: этопозид** + цисплатин** (или этопозид** + карбоплатин**), 4 курса с интервалом в 3 - 4 нед. [110, 111].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- При локализованном МРЛ (не выходящем за пределы одной половины грудной клетки) в качестве стандарта лечения рекомендуется пациентам химиолучевая терапия [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: существуют 2 варианта химиолучевой терапии: 1-й вариант - одновременное применение ХТ и ЛТ, при котором лечение начинается с ХТ по схеме этопозид** + цисплатин**, а ЛТ на область опухоли и средостения присоединяется не позднее 2-го курса ХТ ("ранняя" ЛТ) или после 3-го ("поздняя" ЛТ). Отмечено недостоверное преимущество "ранней" ЛТ над "поздней" [113]. При 2-м варианте применяют ХТ и ЛТ последовательно: проводят 2 - 4 курса ХТ, а после их окончания начинают ЛТ.
ЛТ проводится в дозе 2 Гр 5 дней в неделю. В объем облучения включают опухоль, пораженные лимфатические узлы средостения, а также весь объем средостения до контралатерального корня. Надключичные области включаются в объем облучения только при наличии метастазов. СОД - 60 Гр на опухоль и 46 Гр на средостение. Возможно гиперфракционирование ЛТ - облучение 2 раза в день с интервалом 4 - 6 ч между фракциями по 1,5 Гр до СОД 45 Гр, которое незначительно увеличило выживаемость ценою значительного увеличения числа эзофагитов III - IV степени [114].
- При распространенной стадии МРЛ рекомендуется системное лекарственное лечение (табл. 5). В качестве стандарта 1-й линии ХТ пациентов в объективном состоянии, оцениваемом в 0 - 2 балла по шкале ECOG, используется режим этопозид** + цисплатин** и альтернативная схема (#иринотекан** + цисплатин**) [115].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: режимы ХТ этопозид** + цисплатин** и #иринотекан** + цисплатин** демонстрируют равную непосредственную эффективность и одинаковые отдаленные результаты. При использовании режима #иринотекан** + цисплатин** чаще отмечается диарея (15,4% против 0,5%) и рвота (10,9% против 4,4%), при использовании режима этопозид** + цисплатин** чаще отмечается нейтропения (59,6% против 38,1%) [115]. При наличии противопоказаний цисплатин** заменяется на карбоплатин** [116].
Таблица 5. Рекомендуемые режимы химиотерапии при мелкоклеточном раке легкого
Режим
Схема
1-я линия
EC + атезолизумаб**
Этопозид** 100 мг/м2 в 1 - 3-й дни,
карбоплатин** AUC 5 в 1-й день, атезолизумаб** 1200 мг в 1-й день.
Цикл 21 день; до 4 циклов. Далее поддерживающая терапия атезолизумабом** в 1200 мг каждые 3 нед. [117]
EP
Этопозид** 120 мг/м2 в 1 - 3-й дни,
цисплатин** 60 - 80 мг/м2 в 1-й день.
Цикл 21 день [115]
EC
Этопозид** 100 мг/м2 в 1 - 3-й дни,
карбоплатин** AUC 5 в 1-й день.
Цикл 21 день [116]
IP
#Иринотекан** 60 - 65 мг/м2 в 1-й, 8-й дни,
цисплатин** 60 - 75 мг/м2 в 1-й день.
Цикл 21 день [115]
2-я линия
CAV
Циклофосфамид** 1000 мг/м2 в 1-й день,
доксорубицин** 50 мг/м2 в 1-й день,
винкристин** 1,5 мг/м2 в 1-й день.
Цикл 21 день [119]
Топотекан**
1,5 мг/м2 в 1 - 5-й дни.
Цикл 21 день [119]
Схемы резерва (для 2-й и 3-й линий)
#Иринотекан**
125 мг/м2 в 1, 8, 15, 22-й дни; цикл 28 дней
или 350 мг/м2 каждые 3 нед. [120]
#Паклитаксел**
80 мг/м2 в 1, 8, 15-й дни; цикл 28 дней
или 175 мг/м2 каждые 3 нед. [183, 184]
#Ниволумаб**
(3-я линия)
3 мг/кг в/в капельно каждые 2 нед., или
240 мг в/в капельно каждые 2 нед. [122]
В случае необходимости оказания "срочной" помощи пациенту с выраженным синдромом сдавления верхней полой вены рекомендуется применение схемы CAV в 1-й линии лечения.
- При отсутствии противопоказаний к иммунотерапии у пациентов в удовлетворительном состоянии (0 - 1 балл по шкале ECOG) рекомендуется химиоиммунотерапия: этопозид** + карбоплатин** в комбинации с атезолизумабом** и последующей поддерживающей терапией атезолизумабом** [117].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: режим химиоиммунотерапии обладает достоверным преимуществом в отношении общей выживаемости по сравнению с ХТ. При этом на основании подгруппового анализа установлено, что назначение данной схемы нежелательно при метастатическом поражении головного мозга и множественных метастазах в печени. Обычно проводится 4 - 6 циклов ХТ 1-й линии с интервалами 3 нед. между циклами. Введение атезолизумаба** начинается с 1-м циклом ХТ по схеме этопозид** + карбоплатин** и продолжается после завершения ХТ каждые 3 нед. до прогрессирования болезни.
- Рекомендуется пациентам проведение консолидирующего курса ЛТ на область первичной опухоли и лимфатические узлы средостения (РОД 3 Гр, СОД 30 Гр) после завершения любой схемы ХТ при достижении полной регрессии при диссеминированном МРЛ [118].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Профилактическое облучение мозга, ввиду высокого риска появления метастазов в мозге (до 70%), рекомендуется пациентам, после достижения полной или частичной ремиссии при локализованном процессе и полной ремиссии при распространенном МРЛ после завершения основного лечения. Суммарная доза профилактического облучения мозга - 25 Гр (10 сеансов по 2,5 Гр в день) [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: Профилактическое облучение мозга увеличивает продолжительность жизни пациентов с МРЛ.
- При дальнейшем прогрессировании заболевания или плохой переносимости 1-й линии терапии рекомендуются к использованию схемы 2-й и 3-й линий (CAV или топотекан [119, 120]), а также паллиативная ЛТ. Альтернативные схемы 2-й и 3-й линий:
- #иринотекан** [120] или #паклитаксел** в монорежиме [183, 184],
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
- или ниволумаб** [122] в монорежиме.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- При наличии метастазов в головном мозге рекомендуется проведение ЛТ пациентам на весь мозг в СД - 30 - 40 Гр [125].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
4. Реабилитация
4.1. Предреабилитация
- Пациентам перед проведением оперативного вмешательства рекомендуется проведение физической предреабилитации, которая значительно улучшает функциональное состояние дыхательной мускулатуры и биомеханику дыхания, что увеличивает вентиляционную способность легких, повышает бронхиальную проходимость, ускоряет функциональное восстановление дыхательной системы, значительно сокращает сроки пребывания в стационаре после операции, а также снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания [126].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: аэробная направленность физической предреабилитации улучшает крово- и лимфообращение, вентиляционную активность легких, повышает толерантность к физическим нагрузкам, а также качество жизни [127].
- Пациентам перед проведением оперативного вмешательства рекомендуется выполнение комплекса физических упражнений на этапе предреабилитации 5 - 7 дней в неделю в течение 1 - 10 нед., что достоверно увеличивает жизненную емкость легких на 630 мл и объем форсированного выдоха на 420 мл, а также сокращает продолжительность госпитального лечения на 4,83 дня и риск развития послеоперационных осложнений на 45% [128].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарии: эффективное применение дыхательной гимнастики в ходе предреабилитации снижает частоту послеоперационных легочных осложнений и сокращает срок пребывания в стационаре [129].
4.2. Первый этап реабилитации после хирургического лечения
- Пациентам в раннем послеоперационном периоде рекомендуется использовать тактику fast track rehabilitation ("быстрый путь") и ERAS (early rehabilitation after surgery - медицинская реабилитации пациента, перенесшего операцию по поводу онкологического заболевания), включающую комплексное обезболивание, раннее энтеральное питание, отказ от рутинного применения зондов и дренажей, раннюю мобилизацию пациентов в 1-е сутки после операции [129, 130].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарий: данная тактика снижает риск ранних послеоперационных осложнений, уменьшает длительность пребывания в стационаре и частоту повторных госпитализаций [131]. Кроме того, ранняя мобилизация в комплексе с применением антикоагулянтов и эластической компрессии нижних конечностей способствует профилактике тромбоэмболических осложнений в послеоперационном периоде [131].
- Пациентам после проведения лобэктомии рекомендуется рассматривать возможность кинезиологического тейпирования, которое достоверно снижает интенсивность болевого синдрома в послеоперационном периоде [132].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Пациентам после проведения лобэктомии рекомендуется глубокая высокочастотная осцилляция и вибрационный массаж грудной клетки, проводимые в раннем послеоперационном периоде, которые увеличивают объем форсированного выдоха в раннем послеоперационном периоде, способствуя возрастанию парциального давления кислорода в артериальной крови [133].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
4.3. Второй этап реабилитации после хирургического лечения
- Пациентам, перенесшим оперативные вмешательства по поводу рака легких, рекомендуется адекватная физическая активность, чередование аэробных и анаэробных нагрузок, сочетание дыхательных статических и динамических упражнений с целью улучшения показателей внешнего дыхания, повышения общей физической работоспособности, расширения адаптивных возможностей организма, улучшения качества жизни пациентов [134, 136]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Пациентам, перенесшим оперативные вмешательства по поводу рака легких, рекомендуются регулярные занятия лечебной физкультурой, которая улучшает функцию внешнего дыхания, увеличивает выносливость, положительно влияет на психологический статус пациента, уменьшает выраженность тревожности и депрессии, слабости, болевого синдрома, улучшает настроение [136, 140].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: после комбинированного лечения злокачественных новообразований легких работа с медицинским психологом, методики релаксации, методы когнитивно-поведенческой терапии снижают симптомы депрессии и тревоги [135, 137, 138, 139].
4.4. Третий этап реабилитации после хирургического лечения
- Пациентам после комплексного лечения рака легких рекомендуется вести активный образ жизни с целью достижения компенсированного функционального состояния, ускорения социальной адаптации и предотвращения формирования хронического стрессорного состояния [140].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарий: Лечебная физкультура и повышение физической активности сопровождаются уменьшением слабости, повышением мобильности пациента, снижают уровень депрессии, улучшают качество жизни и являются мерой профилактики сердечно-сосудистых и легочных осложнений [141, 142]. Применение методик аудиовизуальной релаксации достоверно уменьшает выраженность болевого синдрома, усталости, тревожности, улучшает качество жизни и социальную адаптацию пациента [143].
4.5. Реабилитация при химиотерапии
- Пациентам, получающим ХТ, рекомендуется проведение сеансов акупунктуры, которая увеличивает уровни ИЛ-2, CD3+ и CD4+, уменьшает супрессию костного мозга, а также снижает слабость и тошноту, улучшает показатели качества жизни [144].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- При возникновении индуцированной ХТ полинейропатии пациентам рекомендуется выполнять физические упражнения, практиковать терренное лечение (лечение ходьбой) с целью контроля клинических проявлений полинейропатии [145].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: упражнения на тренировку баланса более эффективны для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений [147]; регулярное выполнение комплексов лечебной физкультуры на фоне ХТ снижает частоту развития кардиальных осложнений [147].
- В комплексном лечении периферической полинейропатии на фоне ХТ пациентам рекомендуется применение по показаниям физиотерапевтических методов лечения: низкоинтенсивной лазеротерапии, низкочастотной магнитотерапии, чрескожной электростимуляции [148 - 149].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2)
- Для профилактики мукозита полости рта на фоне ХТ пациентам рекомендуется проведение низкоинтенсивной лазеротерапии [150].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
- Для профилактики алопеции на фоне ХТ пациентам рекомендуется использование систем охлаждения кожи головы [151].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
- Для восстановления когнитивных функций (объем рабочей памяти, устойчивость внимания), снижения уровня тревоги, улучшения функции дыхания и вариабельности сердечного ритма пациентам рекомендована БОС-терапия (различные методики с биологической обратной связью) 20 - 30 сеансов [152].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3)
4.6. Реабилитация при лучевой терапии
- Для улучшения функции внешнего дыхания, уменьшения слабости, снижения числа осложнений, улучшения качества жизни пациентам во время проведения лучевой терапии пациентам рекомендуется заниматься лечебной физкультурой (аэробная нагрузка в сочетании с силовой) [153].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Для профилактики лучевого дерматита пациентам рекомендуется проводить низкоинтенсивную лазеротерапию пациентам [155].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
- Для повышения адаптивности пациентов к новому образу жизни, снижения симптомов тревожных, депрессивных расстройств и повышения совладания со стрессовыми ситуациями вне и после терапевтических сессий рекомендуется проводить краткосрочные психотерапевтические сессии в рамках когнитивно-поведенческой психотерапии (КПТ) длительность 45 - 60 минут в течение 2 месяцев [154].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
5. Профилактика
- Рекомендуется пациентам отказ от курения, как от активного, так и от пассивного с целью профилактики возникновения рака легкого. Существует прямо пропорциональная зависимость между количеством сигарет, выкуриваемых за день и риском возникновения рака легко. Пассивное курение повышает риск возникновения рака легкого на 20 - 30% [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
- Рекомендуется пациентам своевременное лечение заболеваний легких, которые могут повышать риск возникновения рака легкого (например, ХОБЛ) [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
- Рекомендуется использовать современные средства защиты у лиц, контактирующих с веществами, обладающими канцерогенным действием: асбестом, хромом, никелем, кадмием, мышьяком, дизельным топливом и пр. с целью первичной профилактики [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
- Рекомендуется соблюдать следующую периодичность наблюдения пациентов у врача-онколога в удовлетворительном состоянии после радикального лечения рака легкого: каждые 3 мес. в течение первых 3 лет и каждые 6 мес. в течение 4-го и 5-го года. Применяются следующие методы наблюдения: физикальный осмотр, ультразвуковое исследование и рентгенография грудной клетки или КТ. МРТ головного мозга, остеосцинтиграфия проводится 1 раз в год. Через 5 лет после операции обследование проводится 1 раз в год [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
- Не рекомендуется проведение ПЭТ/КТ в качестве метода наблюдения пациентов [8, 10].
Уровень убедительности рекомендаций - C (уровень достоверности доказательства - 5)
- Рекомендуется МРТ головного мозга пациентам с мелкоклеточным раком легкого, которым не было выполнено профилактическое облучение головного мозга - каждые 3 - 4 месяца в течение первых 2 лет [8].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала ХТ или хирургического удаления резектабельных метастатических очагов, рецидивных опухолей.
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации" организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента онкологического заболевания или подозрении на него врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патолого-анатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патолого-анатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или появлении подозрений на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациентам с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения определяется консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную медицинскую помощь по профилю "онкология", определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличии осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургического вмешательства, ЛТ, лекарственной терапии и т.д.) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, ЛТ, в том числе контактной, дистанционной и других видов, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
На течение заболевания и эффективность его лечения помимо распространенности опухолевого процесса, морфологической и молекулярно-генетических характеристик опухоли существенное влияние оказывают сопутствующие патологии, адекватность сопроводительной терапии, социальная адаптация пациента, наличие или отсутствие ежедневной физической активности. Рекомендована ежедневная 30-минутная умеренно-интенсивная физическая активность. Отказ от курения улучшает прогноз заболевания [8, 10].
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1.
Выполнена компьютерная томография органов грудной клетки (при установлении диагноза)
да/нет
2.
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства
да/нет
3.
Выполнена компьютерная томография органов брюшной полости и забрюшинного пространства и/или магнитно-резонансная томография органов брюшной полости и забрюшинного пространства (при установлении диагноза)
да/нет
4.
Выполнено ультразвуковое исследование шейных и надключичных лимфатических узлов (при установлении диагноза)
да/нет
5.
Выполнена сцинтиграфия костей всего тела (при установлении диагноза)
да/нет
6.
Выполнена магнитно-резонансная томография головного мозга с внутривенным контрастированием и/или компьютерная томография головного мозга с внутривенным контрастированием (при установлении диагноза)
да/нет
7.
Выполнена бронхоскопия (при установлении диагноза)
да/нет
8.
При подозрении на метастатическое поражение медиастинальных лимфатических узлов проведена морфологическая верификация и/или позитронно-эмиссионная томография, совмещенная с компьютерной томографией
да/нет
9.
Проведено патолого-анатомическое исследование биопсийного (операционного) материала с применением иммуногистохимических методов или иммуноцитохимического исследования с моноклональными антителами (при установлении диагноза)
да/нет
10.
Выполнено молекулярно-генетическое исследование образца опухоли или плазмы неоперабельного пациента с неплоскоклеточным немелкоклеточным раком легкого для определения активирующих мутаций EGFR, транслокаций ALK и ROS1, мутации BRAF
да/нет
11.
При отрицательных или неизвестных данных о наличии мутаций EGFR или транслокаций ALK проведено тестирование определение экспрессии белка PDL1 иммуногистохимическим методом (проводится для неплоскоклеточного и плоскоклеточного немелкоклеточного рака, только гистологический материал)
да/нет
12.
Проведено хирургическое лечение операбельного рака легкого. Минимальный объем - лобэктомия (при низких функциональных показателях и/или опухолях размером до 2 см допускается выполнение анатомической сегментэктомии). Выполнена ипсилатеральная медиастинальная лимфодиссекция
да/нет
13.
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала, при показаниях иммуногистохимическое исследование препарата удаленных тканей (при хирургическом вмешательстве)
да/нет
14.
Проведена адъювантная полихимиотерапия у пациента с метастазами уровня N 1
да/нет
15.
Проведена неоадъювантная и/или адъювантная полихимиотерапия у пациента с IIIa стадией
да/нет
16.
Проведена химиолучевая терапия у неоперабельного пациента с III стадией
да/нет
17.
Проведена химиотерапия, и/или иммунотерапия, или химиоиммунотерапии при наличии клинических показаний
да/нет
18.
Проведена таргетная терапия при наличии выявленной активирующей мутации (EGFR, ALK, ROS1, BRAF)
да/нет
19.
Выполнен общий (клинический) развернутый анализ крови
да/нет
20
Проведена паллиативная и симптоматическая терапия по показаниям
да/нет
Список литературы
1. Давыдов М.И., Полоцкий Б.Е. Рак легкого. М.: Радикс, 1994. 206 с.
2. Трахтенберг А.Х., Чиссов В.И. Клиническая онкопульмонология. М.: Гэотар-медиа, 2000. 600 с.
3. The health consequences of smoking: a report of the Surgeon General. Available at: https://www.hhs.gov/surgeongeneral/reports-and-publications/tobacco/consequences-smoking-factsheet/index.html.
4. Состояние онкологической помощи населению России в 2017 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2018. Доступно по: http://www.oncology.ru/service/statistics/condition/2017.pdf
5. Stahel R., Peters S., Garassino M. Thoracic tumours essentials for clinicians. ESMO Press, 2014.
6. WHO classification of tumours of the lung, pleura, thymus and heart 2015.
7. The AJCC Cancer staging manual. Eight ed. Springer, 2017.
8. NCCN Guidelines. Non-small cell lung cancer, version 7.2019. Available at: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
9. Grunnet M., Sorensen J.B., Carcinoembrionic antigen (CEA) as a tumor marker in lung cancer. Lung Cancer 2012; 76: 138 - 43.
10. Planchard D., Popat S, Kerr R et al. Metastatic non-small-cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann of Oncology 29 (Supplement 4):192 - 234, 2018
11. Travis D.W., Brambilla E., Burke A.P. et al. Classification of tumours of the lung, pleura, thymus and heart. 4th ed. Lyon: IARC Press, 2015.
12. Lung cancer. Ed. by F.V. Fossella, J.B. Putnam, R. Komaki. M.D. NewYork: Springer, 2003. 316 p.
13. Schrump D.S., Carter D., Kelsey C.R. et al. Non-small cell lung cancer. In: DeVita, Hellman, and Rosenberg cancer; prinsiples and practice of oncology. Ed. by V.T. DeVita Jr, T.S. Lawrence, S.A. Rosenberg et al. Philadelphia: Lippincott Williams and Wilkins, 2011.
14. Трахтенберг А.Х., Чиссов В.И., Франк Г.А. Нейроэндокринные опухоли легких. М.: Практическая медицина, 2012. 200 с.
15. Аллахвердиев А.К., Давыдов М.М. Торакоскопическая лобэктомия с медиастинальной лимфодиссекцией стандарт в хирургическом лечении больных немелкоклеточным раком легкого T1-2N0M0. Вопросы онкологии 2015; 61(3): 413 - 7.
16. Higuchi M., Yaginuma H., Yonechi A. et al. Long-term outcomes after video-assisted thoracic surgery (VATS) lobectomy versus lobectomy via open thoracotomy for clinical stage Ia non-small cell lung cancer. J Cardiothorac Surg 2014; 9: 88 - 92.
17. Lindberg K., Nyman J., Riesenfeld Kallskog V. et al. Long-term of a results of prospective trial phase II of medically inoperable stage I NSCLC treated with SBRT - the Nordic experience. Acta Oncol 2015; 54: 1096 - 104.
18. Zhang T, Guo Q, Zhang Y, Liu Z, Zhou S, Xu S. Meta-analysis of adjuvant chemotherapy versus surgery alone in T2aN0 stage IB non-small cell lung cancer. J Can Res Ther 2018; 14: 139 - 44
19. Winton T., Livingston R., Johnson D. et al. Vinorelbine plus cisplatinvs observation in resected non-small-cell lung cancer. N Engl J Med 2005; 352: 2589 - 97.
20. Arriagada R1, Dunant A, Pignon JPLong-term results of the international adjuvant lung cancer trial evaluating adjuvant Cisplatin-based chemotherapy in resected lung cancer. J Clin Oncol. 2010 Jan 1; 28(1): 35 - 42. doi: 10.1200/JCO.2009.23.2272.
21. NSCLC Meta-analyses Collaborative Group. Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer: two meta-analyses of inpidual patient data. Lancet 2010; 375(9722): 1267 - 77.
22. Aureperin A., Le Pechoux C., Rolland E. et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non-small cell lung cancer. J Clin Oncol 2010; 28: 2181 - 90.
23. Tsitsias T., Boulemden A., Ang K. et al. The N2 paradox: similar outcomes of pre- and postoperatively identified single-zone N2a positive non-small-cell lung cancer. J Eur Cardiothorac Surg 2014; 45: 882 - 7.
24. Scagliotti G.V., Pastorino U., Vansteenkiste J.F. et al. Randomized phase III study of surgery alone or surgery plus preoperative cisplatin and gemcitabine in stages IB to IIIA non-small-cell lung cancer. J Clin Oncol 2012; 30: 172 - 8.
25. Strauss G.M., Herndon III J.E., Maddaus M.A. et al. Adjuvant paclitaxel plus carboplatin compared with observation in stage IB non-small cell lung cancer: CALGB 9633 with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, and North Central Cancer Treatment Group Study Groups. J Clin Oncol 2008; 26: 5043 - 51.
26. Usami N., Yokoi K., Hasegawa Y. et al. Phase II study of carboplatin and gemcitabine as adjuvant chemotherapy in patients with completely resected non-small cell lung cancer: a report from the Central Japan Lung Study Group, CJLSG 0503 trial. Int J Clin Oncol 2010; 15: 583 - 7.
27. Fossella F., Pereira J.R., von Pawel J. et al. Randomized, multinational, phase III study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for advanced non-small-cell lung cancer: the TAX 326 study group. J Clin Oncol 2003; 21: 3016 - 24.
28. ![]() M., Chouaid C.,
M., Chouaid C., ![]() D. et al. Randomized, phase III study of gemcitabine or erlotinib maintenance therapy versus observation, with predefined second-line treatment, after cisplatin-gemcitabine induction chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2012; 30: 3516 - 24.
D. et al. Randomized, phase III study of gemcitabine or erlotinib maintenance therapy versus observation, with predefined second-line treatment, after cisplatin-gemcitabine induction chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2012; 30: 3516 - 24.
29. Kreuter M., Vansteenkiste J., Fishcer J.R. et al. Randomized phase 2 trial on refinement of early-stage NSCLC adjuvant chemotherapy with cisplatin and pemetrexed versus cisplatin and vinorelbine: the TREAT study. Ann Oncol 2013; 24: 986 - 92.
30. Curran W.J., Paulus R., Langer C.J. et al. Sequential vs concurrent chemoradiation for stage III non-small-cell lung cancer randomized phase III trial RTOG 9410. J Natl Cancer Inst 2011; 103: 1452 - 60.
31. Pignon J.P., Tribodet H., Scagliotti G.V. et al. Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552 - 9.
32. Albain KS1, Crowley JJ, Turrisi AT 3rd et al. Concurrent cisplatin, etoposide, and chest radiotherapy in pathologic stage IIIB non-small-cell lung cancer: a Southwest Oncology Group phase II study, SWOG 9019. J Clin Oncol. 2002 Aug 15; 20(16): 3454 - 60.
33. Choy H., Gerber D.E., Bradley J.D. et al. Concurrent pemetrexed and radiation therapy in the treatment of patients with inoperable stage III non-small cell lung cancer: a systematic review of completed and ongoing studies. Lung Cancer 2015; 87: 232 - 40.
34. Senan S., Brade A., Wang L.H. et al. PROCLAIM: randomized phase III trial of pemetrexed-cisplatin or etoposide-cisplatin plus thoracic radiation therapy followed by consolidation chemotherapy in locally advanced nonsquamous non-small-cell lung cancer. J Clin Oncol 2016; 34: 953 - 62.
35. Albain K.S., Crowley J.J., Turrisi A.T. III et al. Concurrent cisplatin, etoposide, and chest radiotherapy in pathologic stage IIIB non-small-cell lung cancer: a Southwest Oncology Group Phase II Study, SWOG 9019. J Clin Oncol 2002; 20: 3454 - 60.
36. Bradley J.D., Paulus R., Komaki R. et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol 2015; 16: 187 - 99.
37. Antonia S.J., Villegas A., Daniel D. et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919 - 29.
38. Masters G.A., Temin S., Azzoli C.G. et al. Systemic therapy for stage IV non-small cell lung cancer. American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2015; 33: 3488 - 515.
39. Kerr K.M., Bubendorf L., Edelman M.J. et al. Second ESMO consensus conference on lung cancer: pathology and molecular biomarkers for non-small-cell lung cancer. Ann Oncol 2014; 25: 1681 - 90.
40. Klastersky J., Sculier J.P., Lacroix H. et al. A randomized study comparing cisplatin or carboplatin with etoposide in patients with advanced non-small cell lung cancer: European Organization for Research and Treatment of Cancer Protocol 07861. J Clin Oncol 1990; 8: 1556 - 62.
41. Frasci G., Comella P., Panza N. et al. Carboplatin-oral etoposide personalized dosing in elderly non-small cell lung cancer patients. Gruppo Oncologico Cooperativo Sud-Italia. Eur J Cancer 1998; 34: 1710 - 4.
42. Ohe Y., Ohashi Y., Kubota K. et al. Randomized phase III study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan. Ann Oncol 2007; 18: 317 - 23.
43. Sandler A., Gray R., Perry M.C. et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small cell lung cancer. N Engl J Med 2006; 355: 2542 - 50.
44. Scagliotti G.V., Parikh P., von Pawel J. et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage NSCLC. J Clin Oncol 2008; 26: 3543 - 51.
45. Danson S., Middleton M.R., O'Byrne K.J. et al. Phase III trial of gemcitabine and carboplatin versus mitomycin, ifosfamide, and cisplatin or mitomycin, vinblastine, and ciplatin in patients with advanced non-small cell lung carcinoma. Cancer 2003; 98: 542 - 53.
46. Barlesi F., Scherpereel A., Rittmeywr A. et al. Randomized phase III trial of maintenance bevacizumab with or without pemetrexed after first-line induction with bevacizumab, cisplatin, and pemetrexed in advanced nonsquamous non-small cell lung cancer: AVAPERL. J Clin Oncol 2013; 31: 3004 - 11.
47. Zatloukal P., Kanitz E., Magyar P. et al Gemcitabine in locally advanced and metastatic non-small cell lung cancer: the Central European phase II study. Lung Cancer 1998; 22: 243 - 50.
48. Sederholm C., Hillerdal G., Lamberg K. et al. Phase III trial of gemcitabine plus carboplatin versus single agent gemcitabine in the treatment of locally advanced or metastatic non-small cell lung cancer: the Swedish Lung Cancer Study group. J Clin Oncol 2005; 23: 8380 - 88.
49. Perol M., Chouaid C., Perol D. et al. Randomized, phase III study of gemcitabine or erlotinib maintenance therapy versus observation, with predefined second-line treatment, after cisplatin-gemcitabine induction chemotherapy in advanced non-small celll lung cancer. J Clin Oncol 2012; 30: 3516 - 24.
50. Fossella F.V., DeVore R., Kerr R.N. et al. Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J Clin Oncol 2000; 18: 2354 - 62.
51. Fidias P.M., Dakhil S.R., Lyss A.P. et al. Phase III study of immmediate compared with delayed docetaxel after front-line therapy with gemcitabine plus carboplatin in advanced non-small cell lung cancer. J Clin Oncol 2009; 27: 591 - 8.
52. Hanna N.H., Sheperd F.A., Fossella F.V. et al. Randomized phase III study of pemetrexed versus docetaxel in patients with non-small cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589 - 97.
53. Reck M., Rodriguez-Abreu D., Robinson A.G. et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375: 1823 - 33.
54. Langer C.J., Gadgeel S.M., Borghaei H. et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016; 17(11): 1497 - 508.
55. Lopes G., Wu Y.-L., Kudaba I. et al. Pembrolizumab versus platinum-based chemotherapy as first-line therapy for advanced/metastatic NSCLC with a PD-L1 tumor proportion score >= 1%: open-label, phase 3 KEYNOTE-042 study. J Clin Oncol 2018; 36(18 Suppl).
56. Socinski M.A., Jotte R.M., Cappuzzo F. et al. Atezolizumab in first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med 2018; 378: 2288 - 301.
57. Inoue A., Kobayashi K., Usui K. et al. First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations without indication for chemotherapy. J Clin Oncol 2009; 27: 1394 - 400.
58. Rosell R., Carcereny E., Gervais R. et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13: 239 - 46.
59. Yang J.C., Wu Y.I., Shuler M. et al. Afatinib versus cisplatin-based chemotherapy for EGFR-mutation-positive lung adenocarcinoma LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomized, phase 3 trials. Lancet Oncol 2015; 16: 141 - 51.
60. Soria J.C., Ohe Y., Vansteenkiste J. et al. Osimertinib in untreated EGFR mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378: 113 - 25.
61. Solomon B.J., Mok T., Kim D.W. et al. First-line crisotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2013; 371: 2167 - 77.
62. Soria J.C., Tan D.S.W., Chiari R. et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND 4): a randomized, open-label, phase 3 study. Lancet 2017; 389: 917 - 29.
63. Camidge D.R. Updated efficacy and safety data from the global phase III ALEX global study of alectinib (ALC) versus crizotinib (CZ) in untreated advanced ALK+ NSCLC. J Clin Oncol 2018; 35(Suppl): 9064.
64. Planchard D., Smit E.F., Groen H.J.M. et al. Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017; 18: 1307 - 16.
65. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on inpidual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. BMJ 1995; 311: 899 - 909.
66. NSCLC Meta-Analyses Collaborative Group. Chemotherapy in addition to supportive care improves survival in advanced non-small-cell lung cancer: a systematic review and meta-analysis of inpidual patient data from 16 randomized controlled trials. J Clin Oncol 2008; 26: 4617 - 25.
67. Non-Small Cell Lung Cancer Collaborative Group. Chemotherapy and supportive care versus supportive care alone for advanced non-small cell lung cancer. Cochrane Database Syst Rev 2010; (5): CD007309.
68. Azzolic G., Temin S., Aliff T. et al. 2011 Focused Update of 2009 American Society of Clinical Oncology clinical practice guideline update of chemotherapy for stage IV non-small-cell lung cancer. J Clin Oncol 2011; 29: 3825 - 31.
69. D'Addario G., Pintile M., Leighi N.B. et al. Platinum-based versus non-platinum-based chemotherapy in advanced non-small-cell lung cancer: a meta-analysis of published literature. J Clin Oncol 2005; 23: 2926 - 36.
70. Zukin M., Barrios C.H., Pereira J.R. et al. Randomized phase III trial of single-agent pemetrexed versus carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol 2013; 31: 2849 - 53.
71. Sandler A., Yi J., Dahlberg S. et al. Treatment outcomes by tumor histology in Eastern Cooperative Group Study E4599 of bevacisumab with paclitaxel/carboplatin for advanced non-small-cell lung cancer. J Thorac Oncol 2010; 5: 1416 - 23.
72. Gridelli C., Perrone F., Gallo C. et al. Chemotherapy in elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study (MILES) phase III randomized trial. J Natl Cancer Inst 2003; 95: 362 - 72.
73. Corre R., Greillier L., Le Caer H. et al. Use of a comprehensive geriatric assessment for the management of elderly patients with advanced nonsmall-cell lung cancer: the phase III randomized ESOGIA-GFPC-GECP 08-02 study. J Clin Oncol 2016; 34: 1476 - 83.
74. Henry H.D., Costa I., Goldwasser F. et al. Randomised, double-blind study of denosumab versus zoledronic acid in the treatment skeletal metastases in patients with advanced cancer (excluded breast and prostate cancer) or multiple myeloma. J ClinOncol 2011; 29: 1125 - 32.
75. Rosen L.S., Gordon D., Tchekmedyian N.S. et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with non-small-cell lung carcinoma and other solid tumors: a randomized, phase III, double-blind, placebo-controlled trial. Cancer 2004; 100: 2613 - 21.
76. Chow E., Zeng L., Salvo N. et al. Update on the systematic review of palliative radiotherapy trials for bone metastases. Clin Oncol (R Coll Radiol) 2012; 24: 112 - 24.
77. Gandhi I., Rodriguez-Abreu D., Gadgeel S. et al. Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 378: 2078 - 92.
78. Paz-Ares L., Luft A., Vicente D. et al. Pembrolizumab plus chemotherapy for squamous non-small-cell lung cancer. N Engl J Med 2018; 379(21): 2040 - 51.
79. Sheperd F.A., Dancey J., Ramlau R. et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18: 2095 - 103.
80. Brahmer J., Reckamp K.L., Baas P. et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015; 373: 123 - 35.
81. Borghaei H., Paz-Ares L., Horn L. et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373: 1627 - 39.
82. Rittmeyer A., Barlesi F., Waterkamp D. et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017; 389: 255 - 65.
83. Herbst R., Garon E., Kim D.-W. et al. OA03.07 KEYNOTE-010: durable clinical benefit in patients with previously treated, PD-L1-expressing NSCLC who completed pembrolizumab. J Thoracic Oncol 2017; 12: S254 - 5.
84. Herbst R.S., Baas P., Kim D.W. et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387: 1540 - 50.
85. Novello S., Kaiser R., Mellengaard A. et al. Analysis of patient-reported outcomes from the LUME-Lung I trial: a randomized, double-blind, placebo-controlled. Phase III study of second line nintedanib in patients non-small-cell lung cancer. Eur J Cancer 2015; 51: 317 - 26.
86. Sculier J.P., Lafitte J.J., Berghmans T. et. al. A phase II trial testing gemcitabine as second-line chemotherapy for non-small-cell lung cancer. The European Lung Cancer Working Party. Lung Cancer 2000; 29: 67 - 73.
87. Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353: 123 - 32.
88. Ciuleanu T., Stelmakh L., Cicenas S. et al. Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced, non-small-cell lung cancer with poor prognosis (TITAN): a randomised multicentre, open-label, phase 3 study. Lancet Oncol 2012; 13: 300 - 8.
89. Karampeazis A., Voutsina A., Souglakos J. et al. Pemetrexed versus erlotinib in pretreated patients with advanced non-small cell lung cancer: a Hellenic Oncology Research Group (HORG) randomized phase 3 study. Cancer 2013; 119: 2754 - 64.
90. Soria J.C., Felip E., Cobo M. et al. Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16: 897 - 907.
91. Planchard D., Popat S., Kerr K. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29(Suppl 4): iv192 - 237.
92. Eisenhauer E.A., Therasse P., Bogaerts J. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228 - 47.
93. Miller A.B., Hoogstraten B., Staquet M., Winkler A. Reporting results of cancer treatment. Cancer 1981; 47(1): 207 - 14.
94. Burroto M., Manasanch E.E., Wilkerson J., Fojo T. Gefitinib and erlotinib in metastatic non-small-cell lung cancer: a meta-analysis of toxicity and efficacy of randomized clinical trials. Oncologist 2015; 20: 400 - 10.
95. Sequst L.V., Yang J.C., Yamamoto N. et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327 - 34.
96. Cross D.A., Ashton S.E., Ghiorghiu S. et al. AZD9291 irreversible EGFR TKI, overcomes T790M-mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014; 4: 1046 - 61.
97. Cho B.C., Kim D.W., Bearz A. et al. ASCEND-8 - a randomized phase I study ceritinib 450 mg or 600 mg taken with a low-fat meal versus 750 mg in fasted state in patients with anaplastic lymphoma kinase (ALK) rearranged metastatic non-small-cell lung cancer (NSCLC). J Thorac Oncol 2017; 12: 1357 - 67.
98. Shaw A.T., Yeap B.Y., Solomon B.J. et al. Impact of crisotinib on survival in patients with advanced, ALK-positive NSCLC compared with historical controls [abstract]. J Clin. Oncol 2011; 29(Suppl 15): 7507.
99. Yang B., Lee H., Um S.W. et al. Incidence of brain metastasis in lung adenocarcinoma at initial diagnosis on the basis of stage and genetic alterations. Lung Cancer 2019; 129: 28 - 34.
100. Patchell R.A., Tibbs P.A., Walsh J.W. et al. A randomized trial of surgery in the treatment of single metastases to the brain. New Engl J Med 1990; 322: 494 - 500.
101. Noordijk E.M., Vecht C.J., Haaxma-Reiche H. et al. The choice of treatment of single brain metastasis should be based on extracranial tumor activity and age. Int J Radiat Oncol Biol Phys 1994; 29: 711 - 7.
102. Sahgal A., Aoyama H., Kocher M. et al. Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for 1 to 4 brain metastases: inpidual patient data of meta-analysis. Int J Radiat Oncol Biol Phys 2015; 91: 710 - 7.
103. Priestman T.J., Dunn J., Brada M. et al. Final results of the Royal College of Radiologists' Trial comparing two different radiotherapy schedules in the treatment of cerebral metastases. Clin Oncol 1996; 8: 308 - 15.
104. Batchelor T., DeAngelis L.M. Medical management of cerebral metastases. Neurosurg Clin North Am 1996; 7: 435 - 46.
105. Vecht C.J., Hovestadt A., Verbiest H.B. et al. Dose-effect relationship of dexamethasone on Karnofsky performance in metastatic brain tumors: a randomized study of doses of 4, 8, and 16 mg per day. Neurology 1994; 44: 675 - 80.
106. Naruke T. Lymph node metastasis of lung cancer and associated surgery. Asian Med J 1990; 33(12): 668 - 77.
107. Paul S., Altorki N.K., Sheng S. et al. Thoracoscopic lobectomy is associated with lower morbidity than open lobectomy: a propensity-matched analysis from the STS Database. J Thorac Cardiovasc Surg 2010; 139: 366 - 78.
108. Scott W.J., Allen M.S., Darling G. et al. Video-assisted thoracic surgery versus open lobectomy for lung cancer: a secondary analysis of data from the American College of Sugeons Oncology Group Z0030 randomised clinical trial. J Thorac Cardiovasc Surg 2010; 139: 976 - 81.
109. Ginsberg R.J., Rubinstein L.V. Randomised trial of lobectomy versus limited resection for T1N0 non-small cell lung cancer. Ann Thorac Surg 1995; 60: 615 - 22.
110. Schreiber D., Rineer J., Weedon J. et al. Survival outcomes with the use of surgery in limited-stage small cell lung cancer: should its role be re-evaluated? Cancer 2010; 116(5): 1350 - 7.
111. Мелкоклеточный рак легкого. Под ред. М.Б. Бычкова. М., 2013.
112. Bloom B.C., Augustyn A., Sepesi B. et al. Prophylactic cranial irradiation following surgical resection of early-stage small-cell lung cancer: a review of the literature. Front Oncol 2017; 7: 228.
113. De Ruysscher D., Pijls-Johannesma M., Vansteenkiste J. et al. Systematic review and meta-analysis of randomised, controlled trials of the timing of chest radiotherapy in patients with limited-stage, small-cell lung cancer. Ann Oncol 2006; 17: 543 - 52.
114. Turrisi A.T., Kim K., Blum R. et al. Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med 1999; 340: 265 - 71.
115. Zatloukal P., Cardenal F., Szczesna A. et al A multicenter international randomized phase III study comparing cisplatin in combination with irinotecan or etoposide in previously untreated small-cell lung cancer patients with extensive disease Ann Oncol 2010; 21(9): 1810 - 6.
116. Rossi A., Di Maio M Chiodini Pet al. Carboplatin- or cisplatin-based chemotherapy in first-line treatment of small-cell lung cancer: the COCIS meta-analysis of inpidual patient data. J Clin Oncol 2012; 30(14): 1692 - 8.
117. Horn L., Mansfeld A.S., Szcz sna A. et al. First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379: 2220 - 9.
118. Slotman B.J., van Tinteren H., Praag J.O. et al. Use of thoracic radiotherapy for extensive stage small cell lung cancer: a phase 3 randomised controlled trial. Lancet 2015; 385: 36 - 42.
119. Von Pawel J., Schiller J.H., Shepherd F.A., Fields S.Z. Topotecan versus cyclophosphamide, doxorubicin, and vincristine for the treatment of recurrent small-cell lung cancer. J Clin Oncol 1999; 17(2): 658 - 67.
120. Morise M., Niho S., Umemura S., Matsumoto S., Yoh K. et al. Low-dose irinotecan as a second-line chemotherapy for recurrent small cell lung cancer. Jpn J Clin Oncol. 2014 Sep; 44(9): 846 - 51. doi: 10.1093/jjco/hyu094. Epub 2014 Jul 23.
121. Antonia S.J., Lopez-Martin J.A., Bendell J. et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol 2016; 17(7): 883 - 95.
122. Slotman B., Faivre-Finn C., Kramer G. et al. EORTC Radiation Oncology Group and Lung Cancer Group. Prophylactic cranial irradiation in extensive small-cell lung cancer. N Engl J Med 2007; 357(7): 664 - 72.
123. Van Der Linden Y.M., Van Kempen M.L., Van Der Tweel I. et al. Prophylactic cranial irradiation in limited disease small-cell lung cancer in complete remission: a retrospective analysis. Respir Med 2001; 95(3): 235 - 6.
124. Kepka L., Cieslak E., Bujko K., Wierzchowski M. Results of the whole-brain radiotherapy for patients with brain metastases from lung cancer: the RTOG RPA intra-classes analysis. Acta Oncol 2005; 44: 389 - 98.
125. Sommer M.S., Trier K., Vibe-Petersen J. et al. Perioperative rehabilitation in operation for lung cancer (PROLUCA) - rationale and design. BMC Cancer 2014; 14: 404.
126. Sebio R.,  M.I.,
M.I.,  E. et al. Impact of a pre-operative pulmonary rehabilitation program on functional performance in patients undergoing video-assisted thoracic surgery for lung cancer. Arch Bronconeumol 2016; 52(5): 231 - 2.
E. et al. Impact of a pre-operative pulmonary rehabilitation program on functional performance in patients undergoing video-assisted thoracic surgery for lung cancer. Arch Bronconeumol 2016; 52(5): 231 - 2.
127. Sebio Garcia R., ![]() Brage M.I.,
Brage M.I.,  Moolhuyzen E. et al. Functional and postoperative outcomes after preoperative exercise training in patients with lung cancer: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg 2016; 23(3): 486 - 97.
Moolhuyzen E. et al. Functional and postoperative outcomes after preoperative exercise training in patients with lung cancer: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg 2016; 23(3): 486 - 97.
128. Barassi G., Bellomo R.G., Di Iulio A. et al. Preoperative rehabilitation in lung cancer patients: yoga approach. Adv Exp Med Biol 2018; 1096: 19 - 29.
129. Rogers LJ, Bleetman D, Messenger DE, Joshi NA, et al. The impact of enhanced recovery after surgery (ERAS) protocol compliance on morbidity from resection for primary lung cancer. J Thorac Cardiovasc Surg. 2018; 155(4): 1843 - 1852.
130. Li S, Zhou K, Che G, Yang M, Su J, Shen C1, Yu P. Enhanced recovery programs in lung cancer surgery: systematic review and meta-analysis of randomized controlled trials. Cancer Manag Res. 2017 Nov 16; 9: 657 - 670. doi: 10.2147/CMAR.S150500.
131. Deng G.E., Rausch S.M., Jones L.W. et. al. complementary therapies and integrative medicine in lung cancer. diagnosis and management of lung cancer, 3rd ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2013; 143(5 Suppl): e420S-36S.
132. Imperatori A., Grande A., Castiglioni M. et al. Chest pain control with kinesiology taping after lobectomy for lung cancer: initial results of a randomized placebo-controlled study. Interact Cardiovasc Thorac Surg 2016; 23: 223 - 30.
133. Park H., Park J., Woo S.Y. et al. Effect of high-frequency chest wall oscillation on pulmonary function after pulmonary lobectomy for non-small cell lung cancer. Crit Care Med 2012; 40(9): 2583 - 9.
134. Dhillon H.M., van der Ploeg H.P., Bell M.L. et al. The impact of physical activity on fatigue and quality of life in lung cancer patients: a randomised controlled trial protocol. BMC Cancer 2012; 12: 572.
135. Sun V., Raz D.J., Ruel N. et al. A multimedia self-management intervention to prepare cancer patients and family caregivers for lung surgery and postoperative recovery. Clin Lung Cancer 2017; 18(3): e151-9.
136. Schmitz K.H., Courneya K.S., Matthews C. et al. American College of Sports Medicine roundtable on exercise guidelines for cancer survivors. Med Sci Sports Exerc 2010; 42: 1409 - 26.
137. Batty G.D., Russ T.C., Stamatakis E., Kivim ki M. Psychological distress in relation to site specific cancer mortality: pooling of unpublished data from 16 prospective cohort studies. BMJ 2017; 356: j108.
138. Luszczynska A.,  I., Cieslak R. et al. Social support and quality of life among lung cancer patients: a systematic review. Psychooncology 2013; 22(10): 2160 - 8.
I., Cieslak R. et al. Social support and quality of life among lung cancer patients: a systematic review. Psychooncology 2013; 22(10): 2160 - 8.
139. Li M., Kennedy E., Byrne N. et al. Systematic review and meta-analysis of collaborative care interventions for depression in patients with cancer. Psycho-Oncology. 2017; 26: 573 - 87.
140. Janssen S.M., Abbink J.J., Lindeboom R., Vliet Vlieland T.P. Outcomes of pulmonary rehabilitation after treatment for non-small cell lung cancer stages I to IIIa: an observational study. J Cardiopulm Rehabil Prev 2017; 37(1): 65 - 71.
141. Rivas-Perez H., Nana-Sinkam P. et al. Integrating pulmonary rehabilitation into the multidisciplinary management of lung cancer: a review. Respir Med 2015; 109(4): 437 - 42.
142. Andrea L., Kollasch J., Vandenberg J. et al. A home-based exercise program to improve function, fatigue, and sleep quality in patients with stage IV lung and colorectal cancer: a randomized controlled trial. J Pain Symptom Manage 2013; 45: 811 - 21.
143. Hilliard R.E. Music therapy in hospice and palliative care: a review of the empirical data. Evid Based Complement Alternat Med 2005; 2(2): 173 - 8.
144. Chen H.Y., Li S.G., Cho W.C.S., Zhang Z.J. The role of acupoint stimulation as an adjunct therapy for lung cancer: a systematic review and meta-analysis. BMC Complement Altern Med 2013; 13: 362.
145. Streckmann F., Zopf E.M., Lehmann H.C. et al: Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014; 44: 1289 - 304.
146. Kleckner I.R., Kamen C., Gewandter J.S. et al. Effects of exercise during chemotherapy on chemotherapy-induced peripheral neuropathy: a multicenter, randomized controlled trial. Support Care Cancer 2018; 26: 1019 - 28.
147. Muzi J.L., Look R.M., Turner C. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J Clin Oncol 2012; 30(15 Suppl): 9019.
148. Rick O., von Hehn U., Mikus E. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics 2016; 38(2): 85 - 94.
149. ![]() M.,
M., 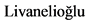 A.,
A., 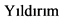 S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med 2014; 46(5): 454 - 60.
S.A., Tan E. Effects of transcutaneous electrical nerve stimulation in patients with peripheral and central neuropathic pain. J Rehabil Med 2014; 46(5): 454 - 60.
150. Oberoi S., Zamperlini-Netto G., Beyene J. et al. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. PLoS One 2014; 9(9): e107418.
151. Ross M., Fischer-Cartlidge E. Scalp cooling: a literature review of efficacy, safety, and tolerability for chemotherapy-induced alopecia. Clin J Oncol Nurs 2017; 21(2): 226 - 33.
152. Hetkamp M., Bender J., Rheindorf N. et al. A Systematic Review of the Effect of Neurofeedback in Cancer Patients. Integr Cancer Ther. 2019; 18:1534735419832361. doi:10.1177/1534735419832361
153. Bade B.C., Thomas D.D., Scott J.B., Silvestri G.A. Increasing physical activity and exercise in lung cancer. reviewing safety, benefits, and application. J Thorac Oncol 2015; 10(6): 861 - 71.
154. Williams S., Dale J. The effectiveness of treatment for depression/depressive symptoms in adults with cancer: a systematic review. Br J Cancer. 2006; 94: 372 - 390
155. Bensadoun R.J., Nair R.G. Low-level laser therapy in the management of mucositis and dermatitis induced by cancer therapy. Photomed Laser Surg 2015; 33(10): 487 - 91.
156. LBA5_PR' Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): Final overall survival analysis' will be presented by Suresh S. Ramalingam during the Presidential Symposium I on Saturday, 28 September, 16:30 to 18:20 (CEST) in Barcelona Auditorium (Hall 2). Annals of Oncology, Volume 30, Supplement 5, October 2019
157. Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6): 649 - 655
158. Hendriks L. E. L. et al. Effect of bisphosphonates, denosumab, and radioisotopes on bone pain and quality of life in patients with non-small cell lung cancer and bone metastases: A systematic review//Journal of Thoracic Oncology. - 2016. - Т. 11. - N. 2. - С. 155 - 173.
159. J Clin Oncol. 1999 Jan; 17(1): 12 - 8. Randomized phase III study of gemcitabine-cisplatin versus etoposide-cisplatin in the treatment of locally advanced or metastatic non-small-cell lung cancer. Cardenal F1,  MP,
MP, ![]() A, Zhao X. et al.
A, Zhao X. et al.
160. Assessment of nivolumab benefit-risk profile of a 240-mg flat dose relative to a 3-mg/kg dosing regimen in patients with advanced tumors//Annals of Oncology. - 2017. - Т. 28. - N. 8. - С. 2002 - 2008.
161. Long G. V. et al. Assessment of nivolumab exposure and clinical safety of 480 mg every 4 weeks flat-dosing schedule in patients with cancer//Annals of Oncology. - 2018. - Т. 29. - N. 11. - С. 2208 - 2213.
162. Garon E et al. P3.02c-030 Use of a 200-Mg Fixed Dose of Pembrolizumab for the Treatment of Advanced Non-Small Cell Lung Cancer (NSCLC): Topic: IT/JTO January 2017 Volume 12, Issue 1, Supplement, Pages S1290 - S1291 DOI: https://doi.org/10.1016/j.jtho.2016.11.1825
163. Morrissey K.M. et al Alternative dosing regimens for atezolizumab: an example of model-informed drug development in the postmarketing
164. Garassino M. C. et al. Erlotinib versus docetaxel as second-line treatment of patients with advanced non-small-cell lung cancer and wild-type EGFR tumours (TAILOR): a randomised controlled trial//The lancet oncology. - 2013. - Т. 14. - N. 10. - С. 981 - 988.
165. Ahn M. J. et al. Phase II study of Afatinib as third-line treatment for patients in Korea with stage IIIB/IV non-small cell lung cancer harboring wild-type EGFR//The oncologist. - 2014. - Т. 19. - N. 7. - С. 702 - 703.
166. Cho BC, Kim DW, Bearz A ASCEND-8: A Randomized Phase 1 Study of Ceritinib, 450 mg or 600 mg, Taken with a Low-Fat Meal versus 750 mg in Fasted State in Patients with Anaplastic Lymphoma Kinase (ALK)-Rearranged Metastatic Non-Small Cell Lung Cancer (NSCLC). J Thorac Oncol. 2017 Sep; 12(9): 1357 - 1367. doi: 10.1016/j.jtho.2017.07.005. Epub 2017 Jul 17
167. Riely GJ1, Yu EGFR: The Paradigm of an Oncogene-Driven Lung Cancer. HA2Clin Cancer Res. 2015 May 15; 21(10): 2221 - 6. doi: 10.1158/1078-0432.CCR-14-3154.
168. Oxnard GR1, Thress KS2, Alden RS. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer J Clin Oncol. 2016 Oct 1; 34(28): 3375 - 82. doi: 10.1200/JCO.2016.66.7162. Epub 2016 Jun 27.
169. Shaw AT, Ou SH, Bang YJ et al. Crizotinib in ROS1-rearranged nonsmall-cell lung cancer. N Engl J Med 2014; 371: 1963 - 1971.
170. Moro-Sibilot D, Faivre L, Zalcman G et al. Crizotinib in patients with advanced ROS1-rearranged non-small cell lung cancer (NSCLC). Preliminary results of the ACSE phase II trial. J Clin Oncol 2015; 33: 8065.
171. Mazieres J, Zalcman G, Crino L et al. Crizotinib therapy for advanced lung adenocarcinoma and a ROS1 rearrangement: results from the EUROS1 cohort. J Clin Oncol 2015; 33: 992 - 999. 170
172. Pan J. Dabrafenib Plus Trametinib for BRAF V600E-Mutant Non-small Cell Lung Cancer: A Patient Case Report//Clinical Drug Investigation. - 2019. - С. 1 - 5.
173. Planchard D, Smit EF, Groen HJM et al. Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017; 18: 1307 - 1316
174. Planchard D, Besse B, Groen HJM et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic nonsmall cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol 2016; 17: 984 - 993.
175. Planchard D, Smit EF, Groen HJM et al. Updated survival of patients (pts) with previously treated BRAF V600E-mutant advanced non-small cell lung cancer (NSCLC) who received dabrafenib (D) or D trametinib (T) in the phase II BRF113928 study. J Clin Oncol 2017; 28(Suppl 5): 9075.
176. Butts CA Ding K, Seymour L et al. Randomized phase III trial of vinorelbine plus cisplatin compared with observation in completely resected stage IB and II non-small-cell lung cancer: updated survival analysis of JBR-10. J Clin Oncol 2010; 28: 29 - 34].
177. Burdett S. et al. Postoperative radiotherapy for non small cell lung cancer//Cochrane database of systematic reviews. - 2016. - N. 10.
178. Gilligan D. et al. Preoperative chemotherapy in patients with resectable non-small cell lung cancer: results of the MRC LU22/NVALT 2/EORTC 08012 multicentre randomised trial and update of systematic review//The Lancet. - 2007. - Т. 369. - N. 9577. - С. 1929 - 1937.
179. Gridelli C., Chen T., Ko A. et al. Nab-Paclitaxel/carboplatin in elderly patients with advanced squamous non-small cell lung cancer: a retrospective analysis of a Phase III trial//Drug Des Devel Ther. 2018; 12: 1445 - 1451. Published online 2018 May 24. doi: 10.2147/DDDT.S155750
180. Takagi Y., Hosomi Y., Sunami K. et al. A Prospective Study of Shortened Vitamin Supplementation Prior to Cisplatin-Pemetrexed Therapy for Non-Small Cell Lung Cancer//Oncologist. 2014 Nov; 19(11): 1194 - 1199. Published online 2014 Sep 26. doi: 10.1634/theoncologist.2014-0221
181. Переводчикова Н.И., В.А. Горбунова Руководство по химиотерапии опухолевых заболеваний//Практическая медицина. 2015. - 688 с.
182. Reck M. et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer//New England Journal of Medicine. - 2016. - Т. 375. - N. 19. - С. 1823 - 1833.
183. Yamamoto N., Tsurutani J., Yoshimura N. et al. Phase II study of weekly paclitaxel for relapsed and refractory small cell lung cancer.//Anticancer Res. 2006 Jan-Feb; 26(1B): 777 - 81.
184. Smit E., Fokkema E., Biesma B., Groen H., Snoek W., Postmus P. A phase II study of paclitaxel in heavily pretreated patients with small-cell lung cancer.//Br J Cancer. 1998; 77(2): 347 - 51.
185. Arriagada R., Bergman B., Dunant A. et al. International Adjuvant Lung Cancer Trial Collaborative Group. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer//New England Journal of Medicine. - 2004. - Т. 350. - N. 4. - С. 351 - 360.
186. Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191 - 205
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Лактионов Константин Константинович - д.м.н., заведующий отделением лекарственных методов лечения (химиотерапии) N 17 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
2. Артамонова Елена Владимировна - д.м.н., заведующая отделением лекарственных методов лечения (химиотерапии) N 1 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
3. Борисова Татьяна Николаевна - к.м.н., старший научный сотрудник отделения клинической радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
4. Бредер Валерий Владимирович - д.м.н., ведущий научный сотрудник отделения лекарственных методов лечения (химиотерапии) N 17 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Бычков Юрий Маркович - к.м.н., врач-онколог, заведующий дневным стационаром клиники радиотерапии (Центра лучевой терапии и комбинированных методов лечения).
6. Владимирова Любовь Юрьевна - д.м.н., профессор, руководитель отдела противоопухолевой лекарственной терапии.
7. Волков Никита Михайлович - к.м.н., врач-онколог, начальник отделений химиотерапевтического и радиотерапевтического профиля.
8. Ергнян Степан Мкртычевич - к.м.н., старший научный сотрудник научного отделения торакальной онкологии, врач-онколог хирургического торакального отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, член Европейского сообщества хирургической онкологии (ESSO), Ассоциации торакальных хирургов России, Ассоциации онкологов Северо-Запада.
9. Жабина Альбина Сергеевна - к.м.н., врач-онколог онкологического химиотерапевтического (противоопухолевой лекарственной терапии) отделения биотерапии.
10. Кононец Павел Вячеславович - директор НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им Н.Н. Блохина" Минздрава России, член Европейской ассоциации кардиоторакальных хирургов (EACTS) и Международного общества по миниинвазивной кардиоторакальной хирургии (ISMICS).
11. Кузьминов Александр Евгеньевич - к.м.н., научный сотрудник отделения лекарственных методов лечения (химиотерапии) N 17 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
12. Левченко Евгений Владимирович - д.м.н., заведующий научным отделением, ведущий научный сотрудник научного отделения торакальной онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, член правления Мультидисциплинарного общества торакоабдоминальных онкологов, член правления Ассоциации торакальных хирургов России, член Международной ассоциации по изучению рака легкого (IASLC), Европейской ассоциации кардиоторакальных хирургов (EACTS), Европейского сообщества хирургической онкологии (ESSO), Ассоциации торакальных хирургов России, Ассоциации онкологов России, Ассоциации онкологов Северо-Запада.
13. Малихова Ольга Александровна - д.м.н., профессор, заведующая отделением эндоскопии НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
14. Маринов Димитр Тодорович - ведущий научный сотрудник научно-консультативного отделения НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
15. Миллер Сергей Викторович - д.м.н., ведущий научный сотрудник отделения торакальной онкологии НИИ онкологии ФГБНУ "Томский НИМЦ РАН", специализация - рак легкого.
16. Моисеенко Федор Владимирович - д.м.н., заведующий отделением биотерапии ГБУЗ "Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)"
17. Мочальникова Валерия Васильевна - врач-патологоанатом отдела патологоанатомической анатомии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
18. Новиков Сергей Николаевич - д.м.н., заведующий отделением радиотерапии, заведующий научным отделением радиационной онкологии и ядерной медицины ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, член Российской ассоциации терапевтических радиоонкологов (РАТО), Европейской ассоциации терапевтических онкологов (ESTRO), Европейского общества специалистов по ядерной медицине (EANM).
19. Пикин Олег Валентинович - д.м.н., руководитель отделения торакальной хирургии МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, член Ассоциации онкологов России, IASLC, специальность - торакальная хирургия, онкология.
20. Реутова Елена Валерьевна - к.м.н., старший научный сотрудник отделения лекарственных методов лечения (химиотерапии) N 17 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
21. Родионов Евгений Олегович - к.м.н., старший научный сотрудник отделения торакальной онкологии НИИ онкологии ФГБНУ "Томский НИМЦ РАН", член RUSSCO, специализация - рак легкого.
22. Сакаева Дина Дамировна - д.м.н., заместитель главного врача ГБУЗ РКОД МЗ РБ по химиотерапии.
23. Семенова Анна Игоревна - к.м.н., старший научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации, врач-онколог отделения химиотерапии и инновационных технологий ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, член RUSSCO, ESMO.
24. Смолин Алексей Владимирович - к.м.н., начальник центра радиологии ФГБУ "ГВКГ им. Н.Н. Бурденко".
25. Сотников Владимир Михайлович - д.м.н., профессор, врач-радиотерапевт, заведующий отделом Методического аккредитационно-симуляционного центра по специальности "радиотерапия".
26. Тузиков Сергей Александрович - д.м.н., профессор, заведующий отделением торакальной онкологии НИИ онкологии ФГБНУ "Томский НИМЦ РАН", член RUSSCO, специализация - рак легкого.
27. Туркин Игорь Николаевич - д.м.н., профессор, заведующий отделением торакальной хирургии ФГБУ РНИОИ Минздрава России.
28. Тюрин Игорь Евгеньевич - д.м.н., профессор, заведующий кафедрой рентгенологии и радиологии Российской медицинской академии непрерывного профессионального образования, вице-президент Российского общества рентгенологов и радиологов.
29. Чхиквадзе Владимир Давидович - д.м.н., профессор, хирург-онколог, заведующий научно-исследовательским отделом хирургии и хирургических технологий в онкологии, заведующий хирургической клиникой (Центра хирургических методов лечения).
30. Колбанов Константин Иванович, ведущий научный сотрудник Торакального хирургического отделения Отдела торакоабдоминальной онкохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
31. Черниченко Андрей Вадимович, заведующий Отделения высоких технологий лучевой терапии Отдела лучевой терапии МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
32. Феденко Александр Александрович, заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ "НМИЦ радиологии" Минздрава России
33. Филоненко Елена Вячеславовна, заведующий Центра лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
Блок по организации медицинской помощи:
1. Невольских Алексей Алексеевич - д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Иванов Сергей Анатольевич - профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Хайлова Жанна Владимировна - к.м.н, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Тигран Гагикович - заместитель директора НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Блок по медицинской реабилитации:
1. Бутенко Алексей Владимирович - д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, председатель Ассоциации специалистов по онкологической реабилитации.
2. Гильмутдинова Ильмира Ринатовна - к.м.н., заведующая отделом биомедицинских технологий и лабораторией клеточных технологий ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России, врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий.
3. Гриднева Ирина Валерьяновна - к.м.н., доцент кафедры физической культуры и медицинской реабилитации Воронежского государственного медицинского университета им. Н.Н. Бурденко, врач лечебной физкультуры и спортивной медицины.
4. Еремушкин Михаил Анатольевич - д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
5. Зернова Маргарита Александровна - инструктор-методист по лечебной физкультуре ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
6. Каспаров Борис Сергеевич - к.м.н, заместитель главного врача по амбулаторной помощи заведующий клинико-диагностическим отделением ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
7. Ковлен Денис Викторович - д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
8. Кондратьева Кристина Орхановна - медицинский психолог ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
9. Кончугова Татьяна Венедиктовна - д.м.н., профессор, заведующая отделом преформированных физических факторов ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России, врач-физиотерапевт.
10. Короткова Светлана Борисовна - д.м.н., заведующая кафедрой физической культуры и медицинской реабилитации Воронежского государственного медицинского университета им. Н.Н. Бурденко, врач лечебной физкультуры и спортивной медицины.
11. Крутов Антон Андреевич - врач-онколог клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
12. Обухова Ольга Аркадьевна - к.м.н., заведующий отделением реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, врач-физиотерапевт, член Европейской ассоциации парентерального и энтерального питания (ESPEN), Российской ассоциации парентерального и энтерального питания (RESPEN).
13. Пономаренко Геннадий Николаевич - заслуженный деятель науки РФ, д.м.н., профессор, генеральный директор ФГБУ "ФНЦРИ им. Г.А. Альбрехта" Минтруда России, заведующий кафедрой курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
14. Семиглазова Татьяна Юрьевна - д.м.н., доцент, заведующая отделом, ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России, доцент кафедры онкологии ФГБОУ ВО "СЗГМУ им. И.И. Мечникова" Минздрава России.
15. Степанова Александра Михайловна - к.м.н., заместитель директора по науке, заведующая отделением реабилитации частного многопрофильного диагностического и реабилитационного центра "Восстановление", член Союза реабилитологов России, Российского общества онкологов, Международной академии K-Taping.
16. Ткаченко Галина Андреевна - психолог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
17. Филоненко Елена Вячеславовна - д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог.
18. Хуламханова Марина Муратовна - врач-физиотерапевт, врач-онколог отделения реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врачи-онкологи;
2. врачи-хирурги;
3. врачи-радиологи;
4. врачи-радиотерапевты;
5. врачи-генетики.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Метод, использованный для формулирования рекомендаций - консенсус экспертов.
Экономический анализ. Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Методы валидизации рекомендаций:
- внешняя экспертная оценка;
- внутренняя экспертная оценка.
Описание метода валидизации рекомендаций. Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей-онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценка важности рекомендаций как рабочего инструмента для повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка. Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, насколько доходчива и точна интерпретация доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
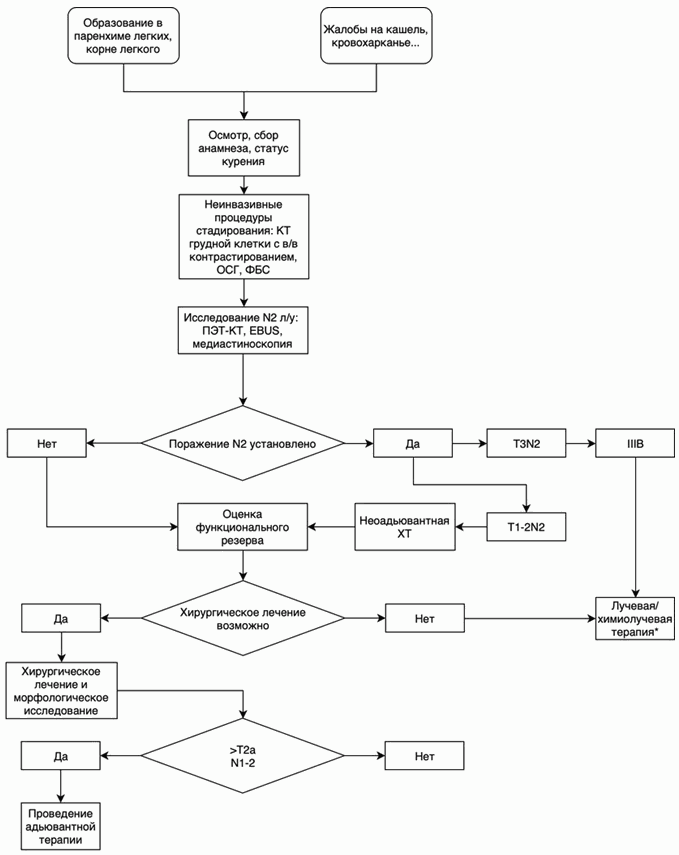
--------------------------------
<*> Пациентам с I стадиями НМРЛ при функциональной неоперабельности, высоком риске хирургических осложнений или отказе пациента от хирургического лечения рекомендуется радикальная лучевая терапия.
При II стадии заболевания в случае невозможности проведения хирургического лечения рекомендуется химиолучевая терапия, или лучевая терапия, или химиотерапия.
T1-2N0 в случае невозможности проведения хирургического лечения возможно проведение стереотаксической гипофракционной радиотерапии с использованием крупных доз за фракцию (РОД 7 - 12 Гр, СОД (48 - 56)).
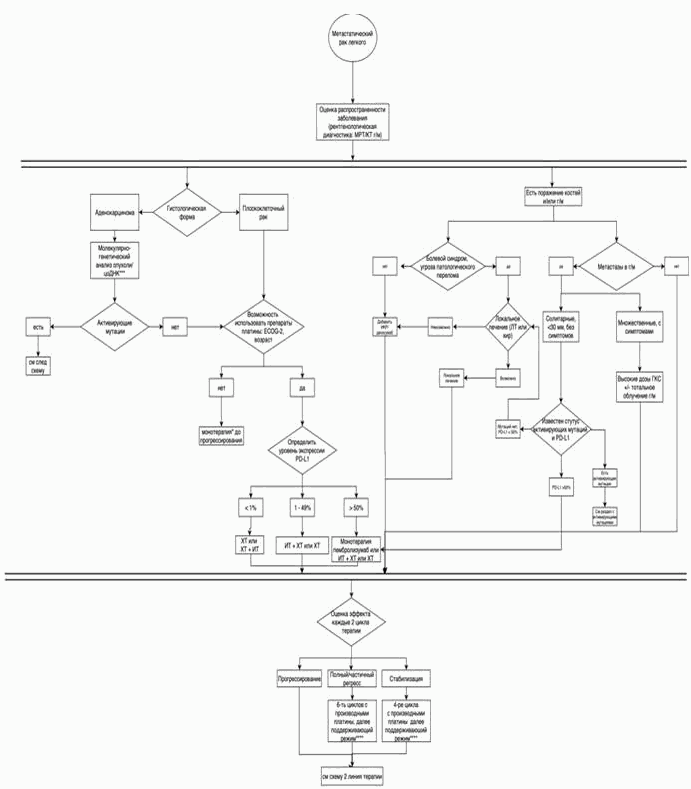
--------------------------------
<*> Пеметрексед, гемцитабин, венорельбин, пембролизумаб целесообразно использовать у больных с наличием данных об экспрессии PD-L1 (CheckMate-049).
<**> На настоящий момент для аденокарциномы легкого зарегистрированы режимы:
Атезолизумаб** 1200 мг. + паклитаксел** 200 мг/м2 (для пациентов азиатов - 175 мг/м2) + карболлатин** AVCG + бевацизумаб** 15 мг/кг в/в как в 1й день каждые 3 недели X 4 курса
Пембролизумаб** 200 мг + пеметрексед** 500 мг/м2 + цисплатин** 75 мг/м2 (карбоплатин** AVCG) в/в как 1 раз в 3 недели X 4 курса
для плоскоклеточного рака легкого без учета PD-L1 статуса: пембролизумаб** 200 мг + Паклитаксел** - 200 мг/м2 в 1-й день + карбоплатин** AVCG6 в 1-й день каждые 3 недели X 4 курса
<***> В рутинной практике рекомендовано тестирование на наличие мутаций EGFR, BRAF и траслокаций ALK/ROS1. Крайне желательно исследование прочих активирующих мутаций.
<****> Терапия пембролизумаб +/- пеметрексед или атезолизумаб +/- бевацизумаб проводится до прогрессирования заболевания.
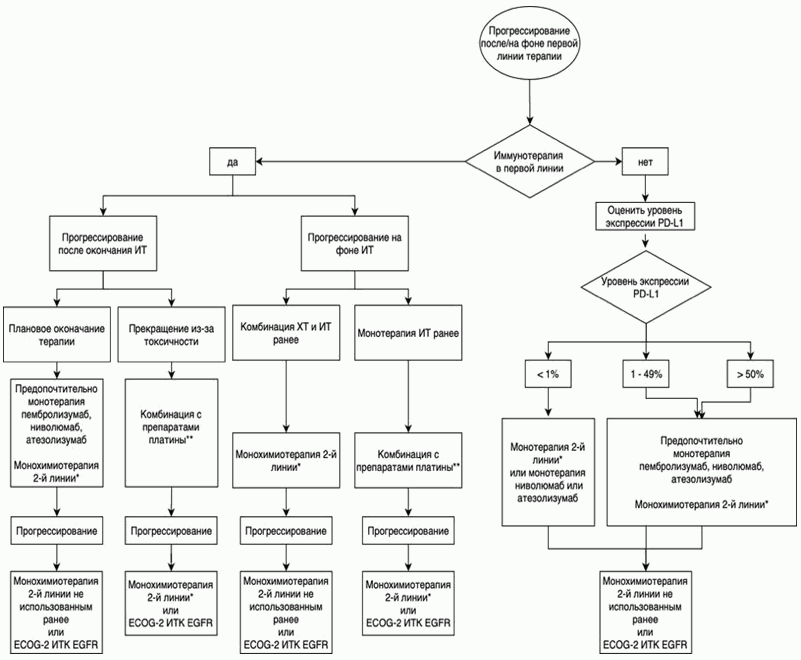
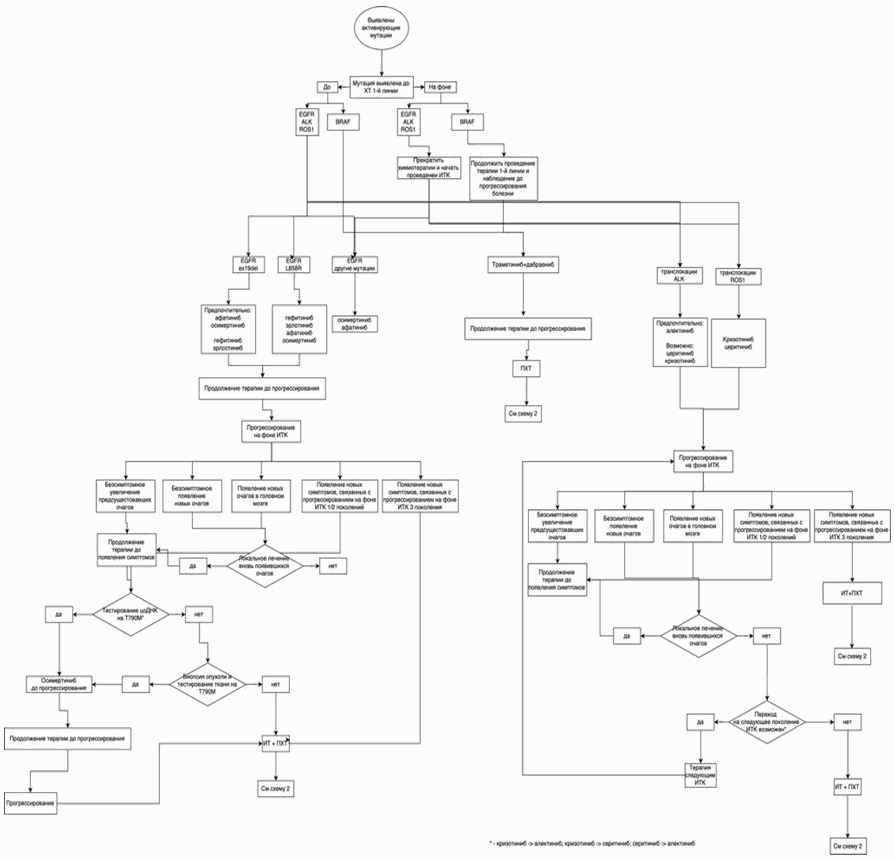
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендации при осложнениях химиотерапии - врачом-онкологом (специалистом по химиотерапии).
1. При повышении температуры тела до 38 °C и выше:
- начать прием антибиотиков по назначению врача;
- клинический анализ крови.
2. При стоматите:
- механически, термически щадящая диета;
- частое (каждый час) полоскание рта отварами ромашки, шалфея, коры дуба, смазывание рта облепиховым (персиковым) маслом;
- обработка полости рта по рекомендации врача.
3. При диарее:
- исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать препараты по назначению врача.
4. При тошноте:
- принимать препараты по назначению врача.
Приложение Г
Приложение Г1
ШКАЛА КАРНОВСКОГО [186]
Название на русском языке: Шкала Карновского
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191 - 205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
40 - Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый больной. Необходимы госпитализация и активное лечение
10 - Умирающий
0 - Смерть
Ключ (интерпретация): приведен в самой шкале
Приложение Г2
ВИЗУАЛЬНО-АНАЛОГОВАЯ ШКАЛА ОЦЕНКИ БОЛЕВОГО СИНДРОМА
Название на русском языке: Визуально-аналоговая шкала оценки болевого синдрома
Оригинальное название: The Numeric Pain Rating Scale Instructions
Источник (официальный сайт разработчиков, публикация с валидацией): https://www.sralab.org/rehabilitation-measures/numeric-pain-rating-scale; McCaffery, M., Beebe, A., et al. (1989). Pain: Clinical manual for nursing practice, Mosby St. Louis, MO
Тип: шкала оценки
Назначение: описать уровень болевого синдрома у пациента.
Инструкция: пациенту на линии 10 см предлагается отметить степень выраженности боли по шкале от 0 до 10.
Ключ: 1 - 3 балла - слабая боль; 4 - 7 баллов - умеренная боль; >= 8 баллов - сильная боль.
Приложение Г3
ШКАЛА
ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG [158]
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все, как и до заболевания
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
5
Пациент мертв
Ключ (интерпретация): приведен в самой шкале
