"Клинические рекомендации "Рак печени (гепатоцеллюлярный)"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
РАК ПЕЧЕНИ (ГЕПАТОЦЕЛЛЮЛЯРНЫЙ)
МКБ 10: C22.0
Год утверждения (частота пересмотра): 2020
ID: КР1/2
URL
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России" - Общероссийская общественная организация "Российское общество клинической онкологии" - Общероссийская общественная организация содействия развитию лучевой диагностики и терапии "Российское общество рентгенологов и радиологов"
Одобрено Научно-практическим Советом Минздрава РФ
Ключевые слова
Список сокращений
АЛТ - аланинаминотрансфераза
АСТ - аспартатаминотрансфераза
АФП - альфа-фетопротеин
ГЦР - гепатоцеллюлярный рак
КТ - компьютерная томография
ЛФК - лечебная физкультура
МРТ - магнитно-резонансная томография
ТАХЭ - трансартериальная химиоэмболизация
УЗИ - ультразвуковое исследование
AASLD - American Association for the Study of Liver Disease, Американская ассоциация по изучению заболеваний печени
EASL - The European Association for the Study of the Liver, Европейская ассоциация по изучению печени
BCLC - Barcelona Clinic Liver Cancer (classification), Барселонская система стадирования рака печени
ECOG PS - Eastern Cooperative Oncology Group Performance Status, шкала оценки общего состояния пациента, разработанная Восточной объединенной онкологической группой
LI-RADS - Liver Imaging Reporting and Data System
RECIST - Response Evaluation Criteria in Solid Tumours, критерии оценки ответа солидных опухолей на лечение
mRECIST - modified Response Evaluation Criteria in Solid Tumors, модифицированные критерии оценки ответа солидных опухолей на лечение
PD1/PD-L1 - programmed cell death 1/programmed cell death 1 ligand, мембранный белок запрограммированной смерти клеток/его лиганд
TNM - (аббревиатура от tumor, nodus и metastasis) - международная классификация стадий злокачественных новообразований
** - жизненно необходимые и важнейшие лекарственные препараты
Термины и определения
Блокатор CTLA4 - моноклональное антитело, блокирующее антиген цитотоксических T-лимфоцитов 4-го типа.
Блокатор PD1 - моноклональное антитело, блокирующее рецептор программируемой смерти 1.
Класс цирроза по Child-Pugh - степень выраженности нарушения функции печени (A, B, C), рассчитываемая по сумме баллов.
Компьютерная томография - метод послойной внутренней диагностики.
Магнитно-резонансная томография - метод послойной внутренней диагностики с помощью эффекта ядерного магнитного резонанса.
Позитронно-эмиссионная томография - метод радионуклидной диагностики.
Терапия "понижения стадии" - down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений.
Трансартериальная химиоэмболизация - метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с цитостатиком.
Трансартериальная эмболизация - метод локального лечения внутрипеченочных опухолей с использованием эмболизирующего агента в сочетании с изотопом.
Ультразвуковое исследование - неинвазивное исследование организма с помощью ультразвуковых волн.
Bridge-терапия - терапия "ожидания", которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации.
CTLA4 - антиген цитотоксических T-лимфоцитов 4-го типа, также известен как CD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
Response Evaluation Criteria in Solid Tumours - набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию.
Modified Response Evaluation Criteria in Solid Tumors - набор стандартизированных критериев, используемых для оценки изменения размеров опухоли в ответ на проводимую терапию методом измерения васкуляризованного компонента опухолевого узла.
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Первый этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Второй этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период, поздний реабилитационный период, период остаточных явлений заболевания.
Третий этап реабилитации - реабилитация в ранний и поздний реабилитационные периоды, период остаточных явлений заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций), кабинетах логопеда (учителя-дефектолога).
1. Краткая информация
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Гепатоцеллюлярный рак (ГЦР) (гепатоцеллюлярная карцинома, печеночно-клеточный рак) - наиболее частая (около 85% случаев) злокачественная опухоль печени, исходящая из гепатоцитов. Реже встречается холангиоцеллюлярный рак (холангиокарцинома) - злокачественная опухоль, исходящая из эпителия внутрипеченочных желчных протоков, а также смешанные гепатохолангиокарциномы, фиброламеллярная карцинома, которая формально классифицируется как вариант печеночно-клеточного рака.
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Гепатоцеллюлярный рак развивается чаще всего на фоне цирроза печени (около 80% случаев) или хронического воспаления любой этиологии: вирусных гепатитов B и C, алкогольного и неалкогольного стеатогепатита, первичного склерозирующего и аутоиммунного гепатита, вследствие экзогенных токсических повреждений печени (под действием афлотоксинов, винилхлорида, на фоне применения стероидных гормонов), а также при наследственных заболеваниях (дефиците альфа-1-антитрипсина, тирозинемии и гемохроматозе) и нарушениях состояния иммунной системы, при которых происходит повреждение печени с исходом в хронический гепатит и цирроз. Менее 10% случаев ГЦР развивается в здоровой ткани печени.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В Российской Федерации ГЦР встречается достаточно редко. В 2014 г. в России зарегистрировано 7 252 новых случая ГЦР и рака внутрипеченочных желчных протоков, умерло по этой причине 9 268 пациентов [1].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезни и проблем, связанных со здоровьем
Первичный рак печени (C22)
C22 Злокачественное новообразование печени и внутрипеченочных желчных протоков
C22.0 Печеночно-клеточный рак. Гепатоцеллюлярный рак.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
1.5.1 Международная гистологическая классификация (2010)
Эпителиальные гепатоцеллюлярные доброкачественные опухоли:
Гепатоцеллюлярная аденома 8170/0
Фокальная нодулярная гиперплазия 8170/0
Предраковые или ассоциированные со злокачественными новообразования:
Крупноклеточные изменения
Мелкоклеточные изменения
Диспластические узлы
низкой степени злокачественности
высокой степени злокачественности
Злокачественные гепатоцеллюлярные опухоли:
Гепатоцеллюлярный рак 8170/3
Гепатоцеллюлярный рак (фиброламеллярный вариант) 8171/3
Гепатобластома, эпителиальные варианты 8171/3
Недифференцированный рак 8020/3
Мезенхимальные опухоли:
Доброкачественные
Ангиомиолипома (PECома) 8860/0
Гемангиома
Кавернозная гемангиома 9131/0
Инфантильная гемангиома 9131/0
Воспалительная псевдоопухоль
Лимфангиома 9170/0
Мезенхимальная гамартома
Солитарная фиброзная опухоль 8815/0
Злокачественные опухоли
Ангиосаркома 9120/3
Эмбриональная саркома 8991/3
Эпителиоидная гемангиоэндотелиома 9133/3
Саркома Капоши 9140/3
Лейомиосаркома 8890/3
Рабдомиосаркома 8900/3
Синовиальная саркома 9040/3
Смешанные злокачественные опухоли неясного происхождения:
Смешанный гепатохолангиоцеллюлярный рак 8180/3
Карциносаркома 8980/3
Герминогенные опухоли
Лимфомы
Метастатические опухоли
1.5.2. Стадирование
Стадирование по системе TNM (8-й редакции, 2017 г.) [2]
T - первичная опухоль.
TX - оценить первичную опухоль невозможно.
T0 - признаков первичной опухоли нет
T1 - одиночная опухоль.
T1a - одиночная опухоль <= 2 см в наибольшем измерении с сосудистой инвазией или без нее.
T1b - одиночная опухоль > 2 см в наибольшем измерении без сосудистой инвазии.
T2 - одиночная опухоль размером > 2 см с сосудистой инвазией или множественные опухоли <= 5 см в наибольшем измерении.
T3 - множественные опухоли, в том числе хотя бы одна опухоль > 5 см в наибольшем измерении.
T4 - одиночная опухоль или множественные опухоли любого размера с прорастанием в крупную ветвь воротной вены либо в печеночную вену, или с прорастанием в соседние органы, включая диафрагму (кроме желчного пузыря), или с прорастанием в висцеральную брюшину.
N - вовлечение регионарных лимфатических узлов. Регионарными лимфатическими узлами являются лимфатические узлы ворот печени (расположенные в печеночно-двенадцатиперстной связке).
NX - недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 - нет признаков метастатического поражения регионарных лимфатических узлов.
N1 - имеется поражение регионарных лимфатических узлов метастазами.
M - отдаленные метастазы.
MX - недостаточно данных для определения отдаленных метастазов.
M0 - отдаленных метастазов нет.
M1 - имеются отдаленные метастазы.
pTNM - патогистологическая классификация.
Требования к определению категорий pT, pN, pT соответствуют требованиям к определению категорий T, N, M (таблица 1).
G - гистопатологическая дифференцировка.
Gx - степень дифференцировки не может быть установлена.
G1 - высокая степень дифференцировки.
G2 - средняя степень дифференцировки.
G3 - низкая степень дифференцировки.
G4 - недифференцированные опухоли.
Таблица 1. Группировка гепатоцеллюлярных карцином по стадиям (UICC)
Стадия
T
N
M
IA
T1a
N0
M0
IB
T1b
N0
M0
II
T2
N0
M0
IIIA
T3
N0
M0
IIIB
T4
N0
M0
IVA
Любая T
N 1
M0
IVB
Любая T
Любая N
M1
Стадирование по Барселонской системе
Барселонская система стадирования рака печени (Barcelona Clinic Liver Cancer (BCLC) classification) - наиболее часто используемая классификация ГЦР, которая учитывает распространенность опухолевого процесса, функциональное состояние печени, объективное состояние пациента и предполагаемую эффективность лечения (см. рисунок А1 в приложении А3) [3].
Выделяют 5 стадий: от 0 - очень ранней и A - ранней до D - терминальной. Стадии по BCLC, равно как прогноз заболевания и тактика лечения, могут меняться при прогрессировании заболевания либо эффективном лечении. Следует отметить прогностическую значимость классификации для пациентов с ГЦР безотносительно наличия цирроза печени. Важная особенность этой классификации в том, что в ней предложен алгоритм лечения в зависимости от стадии заболевания. В последней редакции этой классификации (2018 г.) вместо классов цирроза A-B по Child-Pugh используется формулировка "сохранная функция печени", что соответствует оценке < 8 баллов по классификации Child-Pugh [4].
Очень ранняя стадия (BCLC 0) - солитарная опухоль печени < 2 см в диаметре.
Ранняя стадия (BCLC A) - солитарная опухоль печени любого размера или не более 3 узлов размером до 3 см, не распространяющиеся на магистральные сосуды печени, соседние анатомические структуры, у пациента без опухолеспецифических жалоб в удовлетворительном объективном состоянии (ECOG 0) при сохранной функции печени.
Промежуточная стадия (BCLC B) - случаи изолированного бессимптомного множественного опухолевого поражения печени без макрососудистой инвазии у пациентов в удовлетворительном состоянии (ECOG 0) при сохранной функции печени.
Распространенная стадия (BCLC C) - симптомная опухоль, ухудшающая объективное состояние пациента (ECOG 0-2), любого размера с инвазией или без инвазии в магистральные печеночные сосуды и/или с внепеченочным распространением при сохранной функции печени.
Терминальная стадия (BCLC D) - случаи заболевания со значимым ухудшением объективного состояния (опухоль/цирроз), декомпенсацией цирроза (класс C по Child-Pugh). Но при выявлении малой опухоли (солитарной размером < 5 см или не более 3 узлов размером < 3 см) при соответствии так называемым миланским критериям возможна ортотопическая трансплантация печени.
1.6 Клиническая картина заболевания или состоянию (группы заболеваний или состояний)
Клиническая картина, как правило, имеет скрытый характер, не имеет специфических симптомов. Чаще всего ГЦР обнаруживается на более поздних стадиях. Спектр проявлений может определяться фоновым заболеванием печени, циррозом и осложнением опухолевого процесса.
Основными жалобами являются выраженная общая слабость, вялость, быстрая утомляемость, увеличение размеров живота, дискомофорт и боли в правом подреберье, а также повышение температуры тела, появление отеков нижних конечностей.
Паранеопластические синдромы встречаются у небольшой части пациентов и проявляются гипогликемией, эритроцитозом, гиперкальциемией. В начале развития заболевания симптомы мало выражены. Поэтому пациенты не придают им особого значения, не обращаясь за медицинской помощью. Со временем симптомы нарастают и становятся более ощутимыми: появление болей чаще всего связано с прорастанием анатомических структур, включая магистральные сосуды, с образованием опухолевых тромбов, а также с метастатическим поражением органов.
2. Диагностика
Критерии установления диагноза/состояния - на основании патогномоничных клинико-рентгенологических данных, результатов патолого-анатомического исследования биопсийного или операционного материала, лабораторных исследований, направленных на оценку функции печени и инструментального обследования распространенности опухолевого процесса и выраженности сопутствующих заболеваний
Чаще всего ГЦР развивается на фоне хронического заболевания печени - цирроза печени, вирусного гепатита, стеатогепатита - которое, как и опухолевый процесс, может проявляться специфическими симптомами, нуждаться в специфической терапии, конкурентно влиять на качество жизни и ухудшать выживаемость. В рамках мультидисциплинарной оценки состояния пациента необходимо оценить функциональные резервы печени, выраженность фоновой патологии печени и распространенность опухолевого процесса.
2.1 Жалобы и анамнез
- Рекомендуется при сборе жалоб и анамнеза активное выявление факторов риска развития хронических заболеваний печени (злоупотребление алкоголем, прием наркотиков, перенесенный вирусный гепатит(ы) и признаки метаболического синдрома, включающего ожирение, диабет, артериальную гипертензию) с целью выявления факторов, которые могут повлиять на выбор тактики лечения [3, 5, 6].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
2.2 Физикальное обследование
- Рекомендуется пациентам при подозрении на ГЦР или с установленным диагнозом ГЦР выполнить стандартный врачебный осмотр, включая оценку нутритивного статуса, наличие симптомов хронического заболевания печени (асцита, желтухи, энцефалопатии, кровотечений, спленомегалии) [6, 7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Следует разграничить вызванные опухолью симптомы и длительно существующие симптомы цирроза печени.
2.3 Лабораторные диагностические исследования
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР с целью определения этиологии и выраженности сопутствующего заболевания печени, а также выявления показаний к назначению сопутствующей противовирусной терапии провести исследование на наличие антител к HBsAg и HCV; при положительном результате теста на HBsAg необходимо исследование на наличие HBeAg, HBeAb и количественное определение ДНК HBV; при подозрении на острый вирусный гепатит необходим анализ на HBcAb IgG [6 - 9].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, для объективной оценки степени выраженности изменений в гемограмме и выявления возможного нарушения функции печени и почек выполнить развернутый клинический (с подсчетом количества тромбоцитов) и биохимический (с измерением уровня альбумина, общего и прямого билирубина) анализ крови, определение протромбинового времени и международного нормализованного отношения, общий анализ мочи [5, 7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить определение концентрации в плазме опухолеспецифического маркера альфа-фетопротеина (АФП) для оценки агрессивности заболевания и прогноза его течения, контроля эффективности лечения.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Результат анализа на АФП считается положительным, если уровень АФП > 100 нг/мл [10]и если он увеличивался на 7 нг/мл в месяц по результатам 3 последовательных измерений [11]. Уровень АФП может повышаться при хронических заболеваниях печени, например при острых и хронических вирусных гепатитах, при других онкологических заболеваниях (гепатоидном раке желудка, герминогенных опухолях и т.д.), при беременности.
Оценка функционального статуса печени
- Рекомендуется пациентам с установленным диагнозом ГЦР, получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, оценить функциональный статус печени по критериям Child-Pugh (Приложение Г1) с целью оценки степени нарушения функций печени для определения переносимости планируемого лечения или токсичности проводимого противоопухолевого лечения и прогноза течения цирроза печени [6, 7, 12, 13].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1).
Комментарий: цирроз печени, частое сопутствующее заболевание печени, определяет переносимость основных методов лечения, вплоть до невозможности проведения лечения, негативно и конкурентно с ГЦР влияет на общую выживаемость; необходима профилактика осложнений цирроза печени.
2.4 Инструментальные диагностические исследования
- При положительном результате анализа на АФП пациентам с подозрением на ГЦР рекомендуется мультифазная компьютерная томография (КТ) печени и брюшной полости с контрастированием и магнитно-резонансная томография (МРТ) печени и брюшной полости с контрастированием независимо от результатов ультразвукового исследования (УЗИ) печени для уточнения диагноза и степени распространенности опухолевого процесса [12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, в том числе, печени, включая бассейн воротной вены, для оценки степени распространенности ГЦР, выявления осложнений ГЦР и/или цирроза и их контроля, контроля эффективности противоопухолевого лечения [12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: УЗИ применяется на этапе скрининга, при осуществлении чрескожной биопсии, интервенционных вмешательств и иногда мониторинга эффективности лечения. УЗИ позволяет выявить осложнения ГЦР и/или цирроза, включая инвазию опухоли в магистральные сосуды печени. Обязательна оценка проходимости бассейна воротной вены. Чувствительность УЗИ невысока для обнаружения узлов малого размера. УЗИ с контрастным усилением обладает преимуществом в выявлении гиперваскуляризованных узлов, что может использоваться при дифференциальной диагностике очаговых образований печени.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить эзофагогастродуоденоскопию для выявления варикозного расширения вен пищевода и желудка и оценки степени его выраженности [7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить четырехфазную компьютерную томографию (КТ) (нативная, артериальная, венозная и отсроченная венозная фазы) и/или динамическую магнитно-резонансную томографию (МРТ) печени с внутривенным контрастированием для оценки распространенности опухолевого процесса и выявления ее изменений: определяют количество и размеры опухолевых узлов внутри печени, наличие сосудистой инвазии и тромбоза, внепеченочного распространения, контроля эффективности лечения [6, 7, 12, 14 - 16].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - I.
Комментарий: диагноз печеночно-клеточного рака может считаться обоснованным без морфологической верификации, если в цирротически измененной печени по данным одного из методов (мультифазной КТ или МРТ) выявляют типичные для ГЦР признаки, а именно диффузное (не кольцевидное) контрастное усиление опухоли размером > 1 см в поздней артериальной фазе и "вымывание" контрастного вещества в венозной фазе; в опухолевых узлах размером > 2 см выявление псевдокапсулы в отсроченной (равновесной) фазе; рост опухоли менее чем за 6 мес. на 50% или увеличение размеров опухоли не менее чем на 5 мм за 6 мес. (Американская ассоциация по изучению заболеваний печени (American Association for the Study of Liver Disease, AASLD)/Liver Imaging Reporting and Data System (LI-RADS), Европейская ассоциация по изучению печени (The European Association for the Study of the Liver, EASL) 2018). В дифференциальной диагностике новообразований печени может использоваться рентгенологическая классификация LI-RADS [7, 17]. В рандомизированных исследованиях доказано, что категория LI-RADS 4 - 5 имеет высокую специфичность (95 - 100%) для пациентов группы высокого риска ГЦР с узлом размером > 10 мм [18, 19].
Классификация LI-RADS регулярно дополняется ведущими диагностами всего мира и позволяет рентгенологам тесном взаимодействовать с клиницистами и осуществлять с использованием методов КТ/МРТ качественное наблюдение пациентов в процессе лечения. Категориями LI-RADS руководствуются клинические рекомендации AASLD [7, 20].
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после или в процессе лечения, выполнить МРТ брюшной полости с применением гепатоспецифического контрастного препарата (гадоксетовой кислоты**) для дифференциальной диагностики проявлений ГЦР и неопухолевой патологии печени, контроля эффективности лечения [7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: метод применяется в следующих случаях: первично выявленные новообразования печени неустановленной природы (для уточнения их характера и количества); при циррозе печени - для уточненной оценки состояния паренхимы и дифференциальной диагностики регенераторных узлов и ГЦР; при первичном или метастатическом ГЦР на фоне цирроза - для оценки эффективности лекарственного лечения - и локо-регионарной терапии; а также для установления их морфологического подтипа - например, гепатоцеллюлярная аденома воспалительного типа накапливает гепатоспецифический контрастный препарат. Накопление гепатоспецифического контрастного препарата в гепатоспецифических фазах контрастного усиления (на 10-й и 20-й минутах и позже) свидетельствует о наличии большого количества соединительной ткани в структуре ГЦР, холангиоцеллюлярного рака или метастаза.
- Рекомендуется пациентам с подозрением на ГЦР или установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить КТ органов грудной клетки, брюшной полости и малого таза для исключения внепеченочных проявлений опухоли, контроля эффективности лечения [12, 21].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР, а также получающим специализированное противоопухолевое лечение или находящимся в процессе динамического наблюдения после лечения, выполнить остеосцинтиграфию при наличии болевого синдрома для выявления метастатического поражения костей скелета, контроля эффективности лечения [12].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Для морфологического подтверждения диагноза рекомендуется пациентам с подозрением на ГЦР выполнить биопсию под контролем УЗИ/КТ для уточнения диагноза [6, 7] в следующих случаях:
- если по данным КТ или МРТ заподозрено патологическое образование в нецирротической печени;
- если необходимо исключить злокачественную опухоль печени при отсутствии рентгенографических специфических признаков ГЦР в цирротической печени
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: пункционная биопсия опухоли печени с получением столбика ткани (cor-биопсия) предпочтительнее аспирационной тонкоигольной биопсии. Биопсия рекомендуется при малом размере опухоли (< 2 см) и типичном для ГЦР кровотоке, нетипичной васкуляризации узла размером > 2 см, расхождениях в описании и трактовке контрастных динамических исследований в сочетании с нормальным или незначительно повышенным уровнем АФП, выявлении любого опухолевого образования в нецирротической печени [22]. Отрицательный результат биопсии не исключает диагноза злокачественной опухоли печени и предполагает дальнейшее наблюдение с возможностью повторных биопсий. Биопсия локального образования в цирротической печени не нужна, если: 1) не планируется какого-либо лечения в связи с декомпенсированным циррозом и/или другой тяжелой патологией; 2) планируется резекция печени; 3) при циррозе мультифазная КТ и МРТ с контрастированием описывают признаки, специфичные для ГЦР (неравномерное контрастирование узла в артериальной фазе, затем "вымывание" в венозной) [23, 24].
Для уточняющей диагностики раннего и высокодифференцированного ГЦР Международная консенсусная группа по опухолям печени рекомендует панель из 3 иммуно-гистохимических маркеров - HSP70 (HSPA7), глипикана 3 (GPC3) и глутаминсинтетазы (GS), а для выявления прогностически неблагоприятных случаев - цитокератин 19 (CK 19). В сложных для диагностики случаях целесообразно отправить гистопрепараты для исследования в специализированные центры.
- Рекомендуется выполнить позитронно-эмиссионную томографию с 18-фтордезоксиглюкозой, совмещенную с КТ, у пациентов с установленным диагнозом ГЦР, являющихся кандидатами на оперативное лечение, если имеется подозрение на отдаленные метастазы по данным КТ или МРТ, и их подтверждение приведет к отказу от операции [12, 25].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
- Рекомендуется пациентам с установленным диагнозом ГЦР при подозрении на метастазирование в головной мозг выполнить МРТ или КТ головного мозга с внутривенным контрастированием [16].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется установить стадию ГЦР по классификации TNM (8-й редакции), AJCC и BCLC для повышения точности диагностики [6, 7, 26 - 28].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
2.5 Иные диагностические исследования
Диагностические ангиографические методики являются неотъемлемой частью эндоваскулярного лечебного вмешательства у пациентов с ГЦР, позволяющие оценить состояние чревного ствола и его ветвей, уточнить анатомический вариант кровоснабжения печени, определить уровень васкуляризации опухолевых узлов, уточнить наличие артерио-портальных или артериовенозных шунтов. Полученные диагностические данные имеют важное значение в определении, как возможности выполнения, так и планирования последующей трансартериальной химиоэмболизации печени.
При выявлении у пациентов с ГЦР выраженного артериовенозного фистулирования или наличии артериопортального шунта с контрастированием ствола воротной вены или ее долевых ветвей ТАХЭ не показана. Пациентам с наличием артериовенозного фистулирования на I этапе эндоваскулярного лечения (перед ТАХЭ) показана эмболизация печеночных артерий с целью окклюзии АВФ. [78, 79]
3. Лечение
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
Разработка плана лечения по результатам диагностики должна быть отнесена к компетенции специализированной мультидисциплинарной группы по ГЦР, функционирующей на базе специализированных центров. При выборе стратегии лечения пациентов с ГЦР приоритет должен отдаваться противоопухолевому специализированному лечению с использованием методов, позволяющих увеличить выживаемость.
Радикальное лечение раннего локализованного ГЦР включает резекцию печени, ортотопическую трансплантацию печени и применение местно-деструктивных аблативных методов (радиочастотную, микроволновую аблацию и др.) [6, 7, 12].
Паллиативное лечение ГЦР направлено на достижение контроля над проявлениями болезни, призвано увеличивать продолжительность и улучшать качество жизни пациентов. Паллиативное специализированное лечение включает интервенционно-радиологическое лечение (различные виды эмболизации) и системную химиотерапию [6, 7, 12].
План лечения вырабатывается на основании результатов объективного обследования мультидисциплинарной командой специалистов (включающей врача-радиолога, врача-хирурга (гепатолога), врача по рентгеноэндоваскулярным диагностике и лечению, врача-онколога, врача-гастроэнтеролога (гепатолога), имеющих опыт работы с пациентами с ГЦР на базе специализированных центров. Поскольку ГЦР в большинстве случаев выявляется в цирротически измененной печени, прогноз жизни для этих пациентов определяется не только степенью распространения опухоли, но и степенью дисфункции печени и объективным состоянием пациентов.
3.1 Хирургическое лечение
- Рекомендуется резекция печени как метод выбора лечения при локализованном ГЦР у пациентов без цирроза, а также при наличии цирроза с нарушением печеночно-клеточной функции печени, соответствующему классу A по шкале Child-Pugh (Приложение Г1) для улучшения результатов лечения и снижения риска рецидива. Выполнение оперативного вмешательства возможно при наличии стадии BCLC 0/A, BCLC B с ограниченным поражением органа и у отобранной группы BCLC C [6, 7, 12, 27 - 34].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: Следует учитывать, что большой размер опухоли и/или множественное внутриорганное поражение, наличие инвазии магистральных сосудов, метастатическое поражение регионарных лимфатических узлов не являются абсолютным противопоказанием к резекции печени, однако результаты хирургического лечения в этих случаях предсказуемо хуже.
- Рекомендуется ортотопическая трансплантация печени при раннем ГЦР (BCLC 0-A) в случаях, не подходящих для резекции, при соответствии принятым критериям (показаниям) к трансплантации при ГЦР [6, 7, 12, 86].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: чаще используются так называемые "миланские" критерии: размер единственной опухоли <= 5 см или наличие в печени не более 3 очагов с диаметром наибольшего узла <= 3 см и отсутствием инвазии в сосуды [6, 7, 29]. Показания и противопоказания к выполнению трансплантации печени определяются врачом-трансплантологом
- Bridge-терапия (терапия "ожидания", которая направлена на замедление прогрессирования опухоли и уменьшение вероятности выбытия из листа ожидания трансплантации) или терапия "понижения стадии" (down-staging, направлена на уменьшение внутрипеченочной распространенности опухолевого процесса при отсутствии внепеченочных изменений) рекомендуется пациентам, ожидающим трансплантации печени, для увеличения вероятности выполнения трансплантации печени, улучшения селекции и исключения агрессивных случаев ГЦР [7, 29, 35, 36].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: Bridge-терапия включает аблацию, трансартериальную эмболизацию, резекцию печени, лекарственную терапию.
- Рекомендуется пациентам с ГЦР и сопутствующем хроническим вирусным гепатитом В (HBs+, вирусная нагрузка > 10 000 копий в мл) противовирусная терапия аналогами нуклеозидов; после радикального лечения ранних стадий ГЦР она увеличивает безрецидивную и общую выживаемость [37, 38].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
3.2 Методы локальной деструкции опухоли
- Рекомендуются методы локальной деструкции опухоли для радикального лечения раннего ГЦР стадий BCLC 0-A при невозможности выполнения резекции печени; для сдерживания прогрессирования ГЦР в период ожидания трансплантации печени; для лечения рецидивов после резекции печени; возможно сочетанное применение в ходе выполнения резекции печени [39 - 41].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: Основным критерием при определении показаний является техническая возможность выполнения вмешательства с минимальным риском развития осложнений. Деструкции подлежат не более 5 узлов диаметром <= 3 см. Возможна деструкция узлов большего диаметра, но частота локальных рецидивов существенно увеличивается при опухолях > 3 см в наибольшем измерении. В ряде случаев целесообразно выполнять аблацию после проведения предварительной трансартериальной (химио-) эмболизации опухоли печени. Локальная деструкция противопоказана при множественном поражении печени, декомпенсированном циррозе (класса C по Child-Pugh), внепеченочных проявлениях заболевания, при наличии портального шунта, несмещаемом прилежании опухолевого узла к рядом расположенным органам, а также вне (внутри-) печеночно расположенным трубчатым структурам
- Не рекомендуется пациентам с ГЦР после радикального (R0) хирургического лечения адъювантная терапия мультикиназными ингибиторами в связи с отсутствием преимуществ перед другими вмешательствами в улучшении выживаемости пациентов [42].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- Рекомендуется дистанционная лучевая терапия стереотаксическим методом единичных (1 - 3) опухолевых узлов в печени размером > 2 см при раннем ГЦР стадии BCLC 0-A, при наличии противопоказаний к использованию других методов локальной деструкции. для улучшения локального контроля опухоли (по сравнению с радиочастотной аблацией) [43].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
3.3 Трансартериальная химиоэмболизация
- Рекомендуется трансартериальная химиоэмболизация (ТАХЭ) опухолевых сосудов в 1-й линии паллиативного лечения пациентам с ГЦР при нерезектабельном/неоперабельном процессе без признаков инвазии/тромбоза магистральных печеночных сосудов и без внепеченочных проявлений заболевания в комбинации с другими методами локального и системного воздействия, а также в период ожидания трансплантации печени для улучшения контроля роста опухоли [6, 7, 44 - 47].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: согласно классификации BCLC, ТАХЭ выполняется при лечении пациентов с промежуточной (BCLC B) и ранней (BCLC A) стадиями при противопоказаниях к хирургическому лечению. Проведение ТАХЭ опухоли в печени при наличии внепеченочных проявлений опухолевого процесса не улучшает отдаленных результатов лечения. Показания и противопоказания к проведению ТАХЭ определяются врачом по рентгеноэндоваскулярным диагностике и лечению
- Не рекомендуется ТАХЭ пациентам с ГЦР при поражении более 75% объема печени, декомпенсированном циррозе (класса C по Child-Pugh), тромбозе магистральных ветвей или ствола воротной вены, внепеченочном распространении заболевания, некупируемом асците, почечной недостаточности (уровне креатинина >= 2 мг/дл или клиренсе креатинина < 30 мл/мин), тяжелых нарушениях свертывающей системы крови, желудочно-кишечном кровотечении за последние 3 мес., наличии портального шунта. [48, 49]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: относительными противопоказаниями к ТАХЭ являются цирроз печени класса B по Child-Pugh (9 баллов), размер опухоли > 10 см, наличие некомпенсированных сопутствующих заболеваний: нарушений функций органов сердечно-сосудистой, легочной систем, острых инфекционных заболеваний, желудочно-кишечного кровотечения, произошедшего за последние 3 мес., варикозного расширения вен пищевода/желудка III степени с высоким риском кровотечения, желчной гипертензии. [48, 49]. Выбор метода (селективная, суперселективная, подолевая) и вида артериальной химиоэмболизации (масляная - раствор противоопухолевого препарата + #Липиодол Ультра-Флюид; комбинированная - раствор противоопухолевого препарата + #Липиодол Ультра-Флюид + микросферы для эмболизации из поливинилацетата и др.; эмболизация микросферами, элиминирующими противоопухолевого препарата (DEB - drug-eluting beads)) зависит от клинической ситуации, технических условий и плана лечения. Наиболее часто используемые противоопухолевые препараты - доксорубицин** или эпирубицин** в разовой дозе, аналогичной курсовой дозе препарата, используемой при системном лечении.
- Рекомендуется пациентам с ГЦР оценивать эффективности ТАХЭ по данным КТ/МРТ с внутривенным контрастным усилением по критериям mRECIST (Приложение Г4) через 4 - 8 нед. после процедуры [29, 50]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется системная терапия пациентам с ГЦР при отсутствии эффекта от 2 последовательно выполненных сеансов ТАХЭ (при отсутствии зоны некроза в эмболизированных опухолевых узлах, появлении новых узлов в зоне воздействия) для улучшения выживаемости пациентов [6, 12, 29, 48].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
- Рекомендуется повторная ТАХЭ пациентам с ГЦР при изолированном внутрипеченочном поражении в случае сохранения эффекта ранее выполненной ТАХЭ более 6 месяцев для улучшения выживаемости пациентов [7].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
3.4 Трансартериальная радиоэмболизация
- Эндоваскулярная эмболизация сосудов при новообразованиях печени и желчевыводящих путей c применением иттрия-90 (Y90) - трансартериальная радиоэмболизация - рекомендуется пациентам с ГЦР при стадии BCLC A в качестве bridge-терапии, при стадиях BCLC B и C с тромбозом магистральных вен для улучшения результатов лечения и выживаемости пациентов [6, 7, 29, 35, 51].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: основные противопоказания к трансартериальной радиоэмболизации - поражение > 70% объема печени, наличие артериовенозного шунта.
3.5 Лучевая терапия
- Рекомендуется пациентам с ГЦР лучевая терапия в случаях, когда другие варианты локорегионарного лечения и/или резекции не могут быть проведены для улучшения контроля роста опухоли и выживаемости пациентов [52].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарий: Иногда проводится конформная 3D-лучевая терапия (30 - 60 Гр) на опухоль у пациентов без цирроза и признаков опухолевой инвазии в нижнюю полую вену, портальную вену и ее ветви.
3.6 Лекарственное лечение
- Рекомендуется врачом-онкологом пациентам с ГЦР лекарственная противоопухолевая терапия для улучшения выживаемости и контроля роста опухоли при [53 - 58]:
- наличии объективных признаков опухолевого процесса и удовлетворительном общем состоянии (0 - 1 балл по шкале ECOG (Приложение Г2));
- сохранной функции печени (классе A или B по Child-Pugh, 5 - 7 баллов);
- невозможности применения локальных методов лечения (резекции, трансплантации печени, (химио-) эмболизации опухолевых узлов);
- внутрипеченочном локализованном ГЦР (как терапия ожидания трансплантации).
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: для проведения лекарственной терапии необходима морфологическая (цитологическая/гистологическая) верификация опухолевого процесса, но она не требуется, если на фоне известного цирроза печени выявляется типичная для ГЦР рентгенологическая картина гиперваскулярной опухоли печени (с "вымыванием" контраста в венозной фазе) по данным 2 независимых контрастных исследований (КТ и МРТ).
ГЦР - опухоль, устойчивая к цитотоксической терапии, поэтому рекомендуется в первую очередь рассмотреть возможность лечения в рамках клинических исследований.
Декомпенсация цирроза печени конкурентно влияет на выживаемость. Необходим мониторинг функции печени, проведение активной профилактики осложнений цирроза печени и их лечение.
При суб- и декомпенсированном циррозе (класса B/C по Child-Pugh) цитотоксическое лечение не проводится.
- Рекомендуется в 1-й линии системной терапии ГЦР сорафениб** или ленватиниб** [53 - 56].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: лечение проводится под наблюдением врача-онколога непрерывно до появления объективных (подтвержденных КТ/МРТ) признаков прогрессирования заболевания, явлений непереносимой токсичности или декомпенсации сопутствующих заболеваний. Опухолевый тромбоз магистральных сосудов (чаще воротной вены и/или ее внутрипеченочных ветвей) не является противопоказанием к лечению сорафенибом**. Терапия ГЦР, прогрессирующего после трансплантации печени (на фоне иммуносупрессивной терапии), сопровождается более выраженной токсичностью. Переносимость ленватиниба** в этой группе пациентов изучена недостаточно; рекомендуется начинать с 8 мг/сут, при хорошей переносимости в течение 10 - 14 дней доза может быть увеличена до 12 мг/сут.
Режим применения ленватиниба** зависит от исходного веса пациента: для пациентов с массой тела >= 60 кг лечение начинается с дозы 12 мг/сут однократно, для пациентов с массой < 60 кг - с разовой суточной дозы 8 мг.
Токсические эффекты, ассоциированные с применением сорафениба** и ленватиниба** (диарея, артериальная гипертония, ладонно-подошвенный синдром), являются биологическим предиктором лучшей выживаемости при условии продолжения терапии, целесообразно предпринять все меры по коррекции токсических эффектов, в первую очередь своевременно снизить суточную дозу препарата.
- Рекомендуется регорафениб** в качестве 2 линии терапии ГЦР при его прогрессировании на фоне терапии 1-й линии препаратами из группы ингибиторов протеинкиназы (мультикиназными ингибиторами) (таблица 1) для улучшения контроля роста опухоли и выживаемости пациентов [63].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
Комментарии: регорафениб** назначается, если в 1-й линии терапии сорафенибом** в дозе >= 400 мг/сут была отмечена его переносимость, при условии удовлетворительного состояния пациента (ECOG 0/1) и компенсированной функции печени (классе A по Child-Pugh) в стандартном режиме - 160 мг/сут однократно в 1 - 21-й дни, курс 4 нед., а пациентам, имеющим факторы риска развития токсичности (на фоне приема сорафениба** в дозе 400 мг/сут эпизоды декомпенсации цирроза печени, плохо контролируемая сопутствующая патология), - в начальной дозе 120 мг/сут в 1 - 21-й дни 4-недельного цикла. При начале лечения в сниженной дозе при отсутствии токсичности II и последующих степеней через 10 - 12 дней от начала курса оправданно увеличение суточной дозы до стандартной рекомендуемой (160 мг/сут). При непереносимости сорафениба** к моменту окончания 1-й линии терапии (< 400 мг/сут) рекомендуется терапия моноклональными антителами к PD-1.
- Рекомендуется кабозантиниб 60 мг в день в качестве 2 - 3 линии терапии ГЦР после прогрессирования на фоне терапии сорафенибом**. (таблица 1) [58].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
- Рекомендуется терапия препаратами моноклональных антител - ингибиторами контрольных точек иммунного надзора #ниволумабом** или #пембролизумабом** в качестве 2-й и 3-й линий терапии прогрессирующего ГЦР, а также у пациентов, не переносящих препараты из группы ингибиторов протеинкиназ (мультикиназные ингибиторы) сорафениб**/ленватиниб**/регорафениб**/кабозантиниб или имеющих противопоказания к терапии этими препаратами (таблица 1) для улучшения контроля роста опухоли и выживаемости пациентов [12, 59 - 60].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: пациентам назначается #ниволумаб** в одном из дозовых режимов (выбор режима не влияет на клиническую эффективность) или #пембролизумаб** до клинически значимого прогрессирования опухоли. Оправданно применение #ниволумаба** у пациентов с классом В цирроза печени по Child-Pugh (7 - 9 баллов). Нет данных о негативном влиянии иммунотерапии на течение цирроза печени. Вероятность реактивации вирусных гепатитов низкая, хотя в случаях HBs-положительного хронического вирусного гепатита В необходима одновременная противовирусная терапия аналогами нуклеозидов в течение всего противоопухолевого лечения.
Фиброламеллярная карцинома, как правило, нечувствительна к терапии препаратами из группы моноклональных антител к PD-1 (ингибиторам контрольных точек иммунного надзора).
- Рекомендуется терапия противоопухолевыми препаратами (таблица 1) в качестве лечебной опции у пациентов с ГЦР без цирроза, например, при фиброламеллярной карциноме в качестве 2-й линии терапии для улучшения контроля роста опухоли, улучшения качества жизни пациентов [12, 61, 62, 85].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: применяются платиносодержащие режимы в сочетании с #гемцитабином** (таблица 1). При смешанном гистологическом варианте - гепатохолангиоцеллюлярном раке в 1-й линии лечения предпочтение отдается цитостатической химиотерапии, поскольку считается, что прогноз жизни определяется холангиоцеллюлярным компонентом опухоли, как наиболее злокачественным. Она не увеличивает продолжительность жизни и эффективна в менее чем в 20% случаев
- Рекомендуется для оценки эффективности противоопухолевого лечения у пациентов с ГЦР проводить мультифазную КТ и/или МРТ (с контрастным усилением) каждые 2 - 3 мес. по критериям RECIST 1.1 (Приложение Г4) и/или mRECIST (для опухолевого поражения печени при циррозе) [63].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: определение уровня АФП в динамике показано пациентам с исходно высоким его значением; самостоятельного клинического значения этот показатель не имеет.
3.7 Сопроводительная терапия и лечение фоновой патологии печени
- Пациентам с ГЦР рекомендуется терапия сопутствующего хронического вирусного гепатита B (титр HBV-DNA > 2 x 102) противовирусными средствами (аналоги нуклеотидов) одновременно с лекарственным или интервенционно-радиологическим лечением независимо от выраженности цитолитического синдрома для улучшения выживаемости пациентов. Противовирусная терапия после хирургического лечения (резекции, трансплантации печени) может улучшить отдаленные результаты [12, 37, 38].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
Комментарии: хронический вирусный гепатит C чаще всего не влияет на возможности проведения системной противоопухолевой терапии. Специфическая противовирусная терапия интерфероновыми режимами не проводится. Влияние безинтерфероновых режимов лечения вирусного гепатита C на течение ГЦР активно изучается в клинических исследованиях. При активизации HCV (цитолитическом синдроме - кратном увеличении уровня аспартатаминотрансферазы (АСТ)/аланинаминотрансферазы (АЛТ)) после радикального лечения, ТАХЭ или на фоне системной терапии возможно одновременное проведение курса лечения прямыми противовирусными агентами у пациентов с компенсированной функцией печени.
- Рекомендуется при варикозном расширении вен пищевода/желудка II - III степени у пациентов с ГЦР на фоне цирроза печени проводить первичную профилактику желудочно-пищеводного кровотечения неселективными ![]() -адреноблокаторами [64, 80].
-адреноблокаторами [64, 80].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Комментарии: при неэффективности медикаментозного лечения варикозного расширения вен пищевода и/или желудка III степени, при угрозе кровотечения, а также для вторичной профилактики рецидивного кровотечения выполняют лигирование варикозно-расширенных вен [7, 29, 64, 80].
3.8. Обезболивающая терапия
Выбор противоболевой терапии у пациентов с ГЦР с хроническим болевым синдромом осуществляется в соответствии с "Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи".
При выборе медикаментозной терапии болевого синдрома следует учитывать особенности метаболизма препаратов в условиях цирроза печени и/или печеночной недостаточности.
4. Реабилитация
- Пациентам с ГЦР после оперативных вмешательств рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств, ТАХЭ и/или химиотерапии для улучшения клинических и функциональных исходов [65].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
4.1 Предреабилитация
- С целью повышения кардиореспираторной выносливости на этапе подготовки к проведению противоопухолевого лечения пациентам с ГЦР рекомендуются занятия лечебной физкультурой (ЛФК) в домашних условиях (аэробная и анаэробная физическая нагрузка средней интенсивности) не менее 15 мин в день 6 - 7 раз в неделю для снижения частоты послеоперационных осложнений [65].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
- Пациентам с ГЦР рекомендуется нутритивная поддержка при наличии хотя бы одного из перечисленных факторов: непреднамеренное снижение массы тела на 10% и более от исходной за последние 6 мес., индекс массы тела < 18,5 кг/м2, недостаточный объем принимаемой пищи (калорийность < 1500 ккал/сут) для улучшения результатов лечения и выживаемости пациентов [66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: целью нутритивной поддержки в совокупности с проведением ЛФК является поддержание функционального состояния пациента и предотвращение развития саркопении. При этом предпочтительный способ нутритивной поддержки - пероральное питание (сиппинг). При невозможности или неадекватности перорального питания необходима установка назогастрального зонда или наложение временной гастростомы.
Калорийность рациона должна составлять 25 - 30 ккал на кг массы тела в сутки, доза белка - 1,0 - 1,5 г на кг массы тела в сутки. Необходимо удовлетворение суточной потребности в витаминах и микроэлементах. Предпочтительнее использовать готовые смеси, обогащенные белком и омега-3-полиненасыщенными жирными кислотами, в суточной дозе не менее 400 мл (готового напитка). При использовании нутритивной поддержки в течение как минимум 7 дней частота инфекционных осложнений и длительность госпитализации в послеоперационном периоде достоверно уменьшаются. [67]
4.2 Реабилитация при хирургическом лечении
4.2.1 Первый этап реабилитации
- Рекомендуется ранняя мобилизация и активизация пациента с ГЦР (вертикализация, дыхательная гимнастика, занятия ЛФК) под контролем инструктора начиная с 1 - 2-го дня после операции для снижения частоты осложнений и сокращения сроков госпитализации [67, 68].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2).
- Пациентам с ГЦР рекомендуется раннее начало энтерального питания (на 2-е послеоперационные сутки) с ориентацией на общие принципы нутритивной поддержки после хирургических вмешательств на органах брюшной полости для уменьшения частоты осложнений и длительности госпитализации [66].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: цель проведения ранней мобилизации пациента в совокупности с адекватной нутритивной поддержкой состоит в улучшении кардиореспираторной выносливости пациента, следствием чего является уменьшение частоты нехирургических осложнений и длительности госпитализации.
4.2.2 Второй этап реабилитации
- Пациентам рекомендуются аэробные нагрузки с постепенным увеличением их интенсивности длительностью до 150 мин в неделю, а также упражнения с сопротивлением (по 8 - 10 повторений на основные группы мышц) 2 раза в неделю под контролем инструктора ЛФК для улучшения качества жизни пациента и ускорения социальной реабилитации [69, 70].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: целью физической нагрузки является восстановление кардиореспираторной выносливости, что препятствует развитию мышечной слабости, возникновению и прогрессированию саркопении, улучшает качество жизни пациента и ускоряет его социальную реабилитацию.
- Пациентам с ГЦР рекомендуется проведение сеансов электросна по общепринятой методике для улучшения качества жизни [71].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: целью проведения сеансов электросна является получение выраженного седативного эффекта, который уменьшает проявления астенического и депрессивного синдромов, снижает интенсивность головных болей, проявления дискинезии желчевыводящих путей, что значительно улучшает качество жизни пациента.
4.2.3 Третий этап реабилитации
- Пациентам с ГЦР, находящимся в ремиссии, в домашних условиях рекомендуются регулярные занятия ЛФК, начинающиеся с аэробной нагрузки низкой интенсивности с постепенным увеличением ее до аэробной нагрузки умеренной интенсивности в совокупности с упражнениями с сопротивлением на основные группы мышц (по 15 - 20 мин, по 8 - 10 повторений) дважды в неделю для улучшения кардиореспираторной выносливости и повышения качества жизни [72].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: целью занятий ЛФК является обеспечение сохранения мышечной массы, улучшение кардиореспираторной выносливости, повышение качества жизни и увеличение общей выживаемость. Желательное время тренировки - не менее 30 мин в день с умеренной интенсивностью несколько (большинство) дней в неделю, принимая во внимание наличие и тяжесть осложнений противоопухолевого лечения.
4.3 Реабилитация при химиотерапии
- Пациентам с ГЦР, получающим химиотерапевтическое лечение, рекомендуются занятия ЛФК с включением аэробной нагрузки средней интенсивности в домашних условиях с целью повышения кардиореспираторной выносливости [73].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- При развитии полинейропатии пациентам с ГЦР рекомендуется проведение поликомпонентной программы реабилитации, включающей в себя упражнения на тренировку баланса, низкоинтенсивную лазеротерапию, низкочастотную магнитотерапию, чрескожную электростимуляцию для уменьшения явления полинейропатии [74 - 77].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 2).
- В течение всего курса химиотерапии пациентам с ГЦР рекомендуется нутритивная поддержка по показаниям в режиме, совпадающем с режимом нутритивной поддержки на предоперационном этапе для сохранения мышечной массы [66].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - 3).
Комментарии: нутритивная поддержка необходима с целью сохранения мышечной массы, что в совокупности с посильной физической нагрузкой, препятствует усилению токсичности химиотерапии.
5. Профилактика
- Рекомендуется соблюдать следующую периодичность наблюдения после завершения радикального лечения по поводу ГЦР и применять следующие методы наблюдения для раннего выявления прогрессирования заболевания [7, 12, 29]:
- сбор анамнеза и физикальное обследование - каждые 3 - 6 мес., далее 1 раз в 6 - 12 мес;
- определение уровня АФП (если исходно он был повышен) - каждые 3 - 4 мес. в первые 2 года, далее 1 раз в 6 - 12 мес.;
- УЗИ органов брюшной полости - каждые 3 - 4 мес.;
- КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3 - 6 мес.;
- рентгенография органов грудной клетки - каждые 12 мес.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания после завершения лечения с целью раннего проведения хирургического лечения резектабельных метастатических очагов, аблации и/или химиоэмболизации рецидивных опухолей, своевременного начала лекарственного противоопухолевого лечения.
- Рекомендуется соблюдать следующую периодичность и применять следующие методы наблюдения за пациентами, проходящими противоопухолевое лечение по поводу ГЦР для раннего выявления прогрессирования заболевания [7, 12, 29]:
1. сбор анамнеза заболевания и лечения, включая данные о сопутствующей патологии, и физикальное обследование;
2. развернутый клинический анализ крови (лейкоцитарная формула, число тромбоцитов);
3. биохимический анализ крови (определение уровня мочевины, креатинина, альбумина, глюкозы, АСТ, АЛТ, щелочной фосфатазы);
4. коагулограмма (международное нормализованное отношение);
5. определение уровня АФП - каждые 3 - 4 мес.;
6. УЗИ органов брюшной полости - каждые 2 - 3 мес.;
7. эзофагогастродуоденоскопия - каждые 6 мес.;
8. мультифазная КТ или МРТ органов брюшной полости с внутривенным контрастированием - каждые 3 - 4 мес.;
9. рентгенография органов грудной клетки - каждые 6 мес.;
10. сцинтиграфия костей всего тела - по показаниям.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 5).
6. Организация медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 N 323-ФЗ (ред. от 25.05.2019) "Об основах охраны здоровья граждан в Российской Федерации", организуется и оказывается:
1. в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
2. в соответствии с порядком оказания помощи по профилю "онкология", обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3. на основе настоящих клинических рекомендаций;
4. с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении, поликлиническом отделении онкологического диспансера.
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, участковые врачи-терапевты, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, первичное онкологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, первичном онкологическом отделении медицинской организации должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или первичного онкологического отделения) организует взятие биопсийного (операционного) материала, а также выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, первичное онкологическое отделение), биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественного новообразования, не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
При выявлении у пациента онкологического заболевания или возникновении подозрения на него в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета, первичного онкологического отделения) направляет пациента в онкологический диспансер или в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания, врачом-онкологом центра амбулаторной онкологической помощи, первичного онкологического кабинета или первичного онкологического отделения) и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Срок начала оказания специализированной, за исключением высокотехнологичной, медицинской помощи пациентам с онкологическими заболеваниями в медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, не должен превышать 14 календарных дней с даты гистологической верификации злокачественного новообразования или 14 календарных дней с даты установления предварительного диагноза злокачественного новообразования (в случае отсутствия медицинских показаний для проведения патолого-анатомических исследований в амбулаторных условиях).
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-онкологами, врачами-радиотерапевтами в онкологическом диспансере или в медицинских организациях, оказывающих медицинскую помощь пациенту с онкологическими заболеваниями, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение онкологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, тактика медицинского обследования и лечения устанавливается консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю "онкология", определяются консилиумом врачей-онкологов и врачей-радиотерапевтов с привлечением при необходимости других врачей-специалистов.
Показаниями к госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1. наличие осложнений онкологического заболевания, требующих оказания пациенту специализированной медицинской помощи в экстренной и неотложной форме;
2. наличие осложнений лечения (хирургического вмешательства, лучевой терапии, лекарственной терапии и т.д.) онкологического заболевания.
Показаниями к госпитализации в медицинскую организацию в плановой форме являются:
1. необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2. наличие показаний к специализированному противоопухолевому лечению (хирургическому вмешательству, лучевой терапии, в том числе контактной, дистанционной и других видов, лекарственной терапии и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1. завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при отсутствии осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2. отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при отсутствии осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3. необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию выносится после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
6. Дополнительная информация, влияющая на течение и исход заболевания
Нет.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения
1
Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев сопутствующего декомпенсированного цирроза или планируемого радикального хирургического лечения
Да/Нет
2
Выполнена контрастная 4-фазная компьютерная томография или магнитно-резонансная томография органов брюшной полости
Да/Нет
3
Выполнено исследование уровня альфа-фетопротеина в крови (при установлении диагноза)
Да/Нет
4
Определена стадия опухолевого процесса до начала противоопухолевого лечения (по классификации TNM, AJCC и BCLC)
Да/Нет
5
Определен класс цирроза печени по классификации Child-Pugh
Да/Нет
6
Проведена консультация врача-хирурга (гепатолога) и врача-трансплантолога (при отсутствии внепеченочных проявлений опухоли)
Да/Нет
7
Проведена консультация врача-гастроэнтеролога-(гепатолога) перед началом противоопухолевого лечения (пациентам с хроническими вирусными гепатитами, компенсированным циррозом печени)
Да/Нет
8
Проведена консультация врача по рентгеноэндоваскулярным диагностике и лечению перед началом противоопухолевого лечения (при отсутствии внепеченочных проявлений опухоли и при компенсированной функции печени)
Да/Нет
9
Проведена консультация врача-онколога - при противопоказаниях к локальному лечению (при компенсированной функции печени)
Да/Нет
10
Выполнено гистологическое исследование удаленной ткани с указанием параметров в соответствии с рекомендациями (у пациентов, перенесших хирургическое вмешательство)
Да/Нет
11
Назначена и проведена системная терапия 1-й линии рака печени стадии BCLC A/B/C по показаниям
Да/Нет
12
Оценена эффективность системной терапии с использованием объективных методов диагностики и критериев оценки (RECIST 1.1)
Да/Нет
14
Проведена трансартериальная (химио-) эмболизация при локализованном внутрипеченочном процессе стадии BCLC A/B
Да/Нет
Список литературы
1. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ НМИРЦ Минздрава России, 2016. 250 с.
2. AJCC cancer staging manual, eight edition. Springer International Publishing, 2017.
3. European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69(1): 182 - 236.
4. Forner A., Reig M., Bruix J. Hepatocellular carcinoma. Lancet 2018; 391(10127): 1301 - 14.
5. Fattovich G., Stroffolini T., Zagni I., Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology 2004; 127(5 Suppl 1): S35 - 50.
6. Vogel A., Cervantes A., Chau I. et al. Hepatocellular carcinoma: ESMO Clinical Practice. Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29(Suppl 4): iv238 - 55.
7. Marrero J.A., Kulik L.M., Sirlin C.B. et al. Diagnosis, staging, and management of hepatocellular carcinoma: 2018 practice guidance by the American Association for the Study of Liver Diseases. Hepatology 2018; 68(2): 723 - 50.
8. Terrault N.A., Bzowej N.H., Chang K.M. et al. AASLD guidelines for treatment of chronic hepatitis B. Hepatology 2016; 63: 261 - 83.
9. Hepatitis C Guidance 2018 Update: AASLD-IDSA recommendations for testing, managing, and treating hepatitis C virus infection. Available at: https://www.aasld.org/sites/default/files/2019-06/PracticeGuidelines-HCV-November2018.pdf.
10. Waidely E., Al-Yuobi A.R., Bashammakh A.S. et al. Serum protein biomarkers relevant to hepatocellular carcinoma and their detection. Analyst 2016; 141(1): 36 - 44.
11. Arrieta O., Cacho B., Morales-Espinosa D. et al. The progressive elevation of alpha fetoprotein for the diagnosis of hepatocellular carcinoma in patients with liver cirrhosis. BMC Cancer 2007; 7: 28.
12. NCCN Clinical Practice Guidelines in Oncology. Hepatobiliary Cancers, version 3.2019. Available at: https://www.nccn.org/professionals/physician_gls/pdf/hepatobiliary.pdf.
13. Peng Y., Qi X., Guo X. Child-Pugh versus MELD Score for the assessment of prognosis in liver cirrhosis a systematic review and meta-analysis of observational studies. Medicine (Baltimore) 2016; 95(8): e2877.
14. Forner A., Vilana R., Ayuso C. et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis: Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology 2008; 47: 97 - 104.
15. Chou R., Cuevas C., Fu R. et al. Imaging techniques for the diagnosis of hepatocellular carcinoma: a systematic review and meta-analysis. Ann Intern Med 2015; 162: 697 - 711.
16. Lee Y.J., Lee J.M., Lee J.S. et al. Hepatocellular carcinoma: diagnostic performance of multidetector CT and MR imaging - a systematic review and meta-analysis. Radiology 2015; 275: 97 - 109.
17. Cerny M., Chernyak V., ![]() D. et al. LI-RADS Ver 2018 Ancillary Features at MRI. Radiographics 2018; 38(7): 1973 - 2001.
D. et al. LI-RADS Ver 2018 Ancillary Features at MRI. Radiographics 2018; 38(7): 1973 - 2001.
18. Chernyak V., Santillan C.S., Papadatos D. et al. 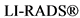 algorithm: CT and MRI. Abdom Radiol 2018; 43(1): 111 - 26.
algorithm: CT and MRI. Abdom Radiol 2018; 43(1): 111 - 26.
19. Ludwig D.R., Fraum T.J., Cannella R. et al. Expanding the Liver Imaging Reporting and Data System (LI-RADS) v2018 diagnostic population: performance and reliability of LI-RADS for distinguishing hepatocellular carcinoma (HCC) from non-HCC primary liver carcinoma in patients who do not meet strict LI-RADS high-risk criteria. HPB (Oxford) 2019; 28(6): pii: S1365-182X(19)30525-8.
20. Elsayes K.M., Kielar A.Z., Chernyak V. et al. LI-RADS: a conceptual and historical review from its beginning to its recent integration into AASLD clinical practice guidance. J Hepatocell Carcinoma 2019; 6: 49 - 69.
21. Katyal S., Oliver J.H., Peterson M.S. et al. Extrahepatic metastases of hepatocellular carcinoma. Radiology 2000; 216: 698 - 703.
22. Natsuizaka M., Omura T., Akaike T. et al. Clinical features of hepatocellular carcinoma with extrahepatic metastases. J Gastroenterol Hepatol 2005; 20: 1781 - 7.
23. Stewart C.J., Coldewey J., Stewart I.S. Comparison of fine needle aspiration cytology and needle core biopsy in the diagnosis of radiologically detected abdominal lesions. J Clin Pathol 2002; 55: 93 - 7.
24. Sangiovanni A., Manini M.A., Iavarone M. et al. The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis. Gut 2010; 59: 638 - 44.
25. Intenzo C., Kim S., Lakhani P. Utility of FDG-PET/CT in Detecting Metastases from Hepatocellular Carcinoma. J Nucl Med 2017; 58 Suppl 1: 427.
26. Marrero J.A., Fontana R.J., Barrat A. et al. Prognosis of hepatocellular carcinoma: comparison of 7 staging systems in an American cohort. Hepatology 2005; 41: 707 - 15.
27. Cillo U., Vitale A., Grigoletto F. et al. Prospective validation of the Barcelona Clinic Liver Cancer staging system. J Hepatol 2006; 44: 723 - 31.
28. Chen C.H., Hu F.C., Huang G.T. et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method - analysis of 2010 Taiwanese patients. Eur J Cancer 2009; 45: 1630 - 9.
29. EASL clinical practice guidelines: management of hepatocellular carcinoma. J Hepatol 2018; 69: 182 - 236.
30. Truty M.J., Vauthey J.-N. Surgical resection of high-risk hepatocellular carcinoma: patient selection, preoperative considerations, and operative technique. Ann Surg Oncol 2010; 17: 1219 - 25.
31. Pawlik T.M., Poon R.T., Abdalla E.K. et al. Critical appraisal of the clinical and pathologic predictors of survival after resection of large hepatocellular carcinoma. Arch Surg 2005; 140: 450 - 7.
32. Chok K.S., Ng K.K., Poon R.T. et al. Impact of postoperative complications on long-term outcome of curative resection for hepatocellular carcinoma. Br J Surg 2009; 96: 81 - 7.
33. Ribero D., Curley S.A., Imamura H. et al. Selection for resection of hepatocellular carcinoma and surgical strategy: indications for resection, evaluation of liver function, portal vein embolization, and resection. Ann Surg Oncol 2008; 15: 986 - 92.
34. Berzigotti A., Reig M., Abraldes J.G. et al. Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: a systematic review and meta-analysis. Hepatology 2015; 61: 526 - 36.
35. Fujiki M., Aucejo F., Kim R. General overview of neo-adjuvant therapy for hepatocellular carcinoma before liver transplantation: necessity or option? Liver Int 2011; 31: 1081 - 9.
36. Majno P., Giostra E., Mentha G. Management of hepatocellular carcinoma on the waiting list before liver transplantation: time for controlled trials? Liver Transpl 2007; 13: S27 - 35.
37. Yin J., Li N., Han Y. et al. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis B virus-related hepatocellular carcinoma: a two-stage longitudinal clinical study. J Clin Oncol 2013; 31(29): 3647 - 55.
38. Huang G., Lau W.Y., Wang Z.G. et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma: a randomized controlled trial. Ann Surg 2015; 261(1): 56 - 66.
39. Lencioni R.A., Allgaier H.P., Cioni D. et al. Small hepatocellular carcinoma in cirrhosis: randomized comparison of radio-frequency thermal ablation versus percutaneous ethanol injection. Radiology 2003; 228: 235 - 40.
40. Lin S.M., Lin C.J., Lin C.C. et al. Randomised controlled trial comparing percutaneous radiofrequency thermal ablation, percutaneous ethanol injection, and percutaneous acetic acid injection to treat hepatocellular carcinoma of 3 cm or less. Gut 2005; 54: 1151 - 6.
41. Cho Y.K., Kim J.K., Kim M.Y. et al. Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies. Hepatology 2009; 49: 453 - 9.
42. Bruix J., Takayama T., Mazzaferro V. et al. Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Oncol 2015; 16: 1344 - 54.
43. Robbins J.R., Schmid R.K., Hammad A.Y. et al. Stereotactic body radiation therapy for hepatocellular carcinoma: Practice patterns, dose selection and factors impacting survival. Cancer Med 2019; 8(3): 928 - 38.
44. Rand T., Loewe C., Schoder M. et al. Arterial embolization of unresectable hepatocellular carcinoma with use of microspheres, lipiodol, and cyanoacrylate. Cardiovasc Intervent Radiol 2005; 28: 313 - 8.
45. Bonomo G., Pedicini V., Monfardini L. et al. Bland embolization in patients with unresectable hepatocellular carcinoma using precise, tightly size-calibrated, anti-inflammatory microparticles: first clinical experience and one-year follow-up. Cardiovasc Intervent Radiol 2010; 33: 552 - 9.
46. Llovet J.M., Real M.I., Montana X. et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet 2002; 359: 1734 - 9.
47. Affonso BB, Galastri FL, da Motta Leal Filho JM et al., Long-term outcomes of hepatocellular carcinoma that underwent chemoembolization for bridging or downstaging World J Gastroenterol. 2019 Oct 7; 25(37): 5687 - 5701.
48. Raoul JL, Sangro B, Forner A, et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011; 37: 212 - 220.
49. Forner A, Gilabert M, Bruix J, Raoul JL. Treatment of intermediate-stage hepatocellular carcinoma. Nat Rev Clin Oncol 2014; 11: 525 - 535
50. Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010 Feb; 30(1): 52 - 60.
51. Cerrito L, Annicchiarico BE, Iezzi R. et al. Treatment of hepatocellular carcinoma in patients with portal vein tumor thrombosis: Beyond the known frontiers, World J Gastroenterol. 2019 Aug 21; 25(31): 4360 - 4382.
52. Chino F, Stephens SJ, Choi SS, et al. The role of external beam radiotherapy in the treatment of hepatocellular cancer. Cancer. 2018 Sep 1; 124(17): 3476 - 3489.
53. Llovet J.M., Ricci S., Mazzaferro V. et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359: 378 - 90.
54. Cheng A.L., Kang Y.K., Chen Z. et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. Lancet Oncol 2009; 10: 25 - 34.
55. Bruix J., Raoul J.-L., Sherman M. et al. Efficacy and safety of sorafenib in patients with advanced hepatocellular carcinoma: subanalyses of a phase III trial. J Hepatol 2012; 57: 821 - 9.
56. Kudo M., Finn R.S., Qin S. et al. Lenvatinib vs sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 trial. Lancet 2018; 391: 1163 - 73.
57. Bruix J., Qin S., Merle P. et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017; 389(10064): 56 - 66.
58. Abou-Alfa GK, Meyer T, Cheng A-L, M.D., et al. Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. NEngl J Med 2018; 379: 54 - 63
59. El-Khoueiry A.B., Sangro B., Yau T. et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. Lancet 2017; 389(10088): 2492 - 502.
60. Finn R.S., Ryoo B.-Y., Merle P. et al. Results of KEYNOTE-240: phase 3 study of pembrolizumab (Pembro) vs best supportive care (BSC) for second line therapy in advanced hepatocellular carcinoma (HCC). J Clin Oncol 2019; 37(15 Suppl): 4004.
61. Qin S., Bai Y., Lim H.Y. et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia. J Clin Oncol 2013; 31: 3501 - 8.
62. Zaanan A; Williet N; Hebbar M; et al. Gemcitabine plus oxaliplatin in advanced hepatocellular carcinoma: a large multicenter AGEO study. J Hepatol. 2013; 58(1): 81 - 8
63. Tovoli F, Renzulli M, Granito A, Golfieri R & Bolondi L. Radiologic criteria of response to systemic treatments for hepatocellular carcinoma. Hepat. Oncol. (2017) 4(4), 129 - 137
64. Paolo A, Bernardi M, Villanueva C, et al. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis J of Hepatology, Vol 69, Issue 2, 406 - 460
65. Luther A., Gabriel J., Watson R.P., Francis N.K. The impact of total body prehabilitation on post-operative outcomes after major abdominal surgery: a systematic review. World J Surg 2018; 42(9): 2781 - 91.
66. Arends J., Bachmann P., Baracos V. et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017; 36: 11 - 48.
67. Souza Possa S., Braga Amador C. Meira Costa A. et al. Implementation of a guideline for physical therapy in the postoperative period of upper abdominal surgery reduces the incidence of atelectasis and length of hospital stay. Rev Port Pneumol 2014; 20(2): 69 - 77.
68. Lewis L.K., Williams M.T., Olds T.S. The active cycle of breathing technique: a systematic review and meta-analysis. Respir Med 2012; 106(2): 155 - 72.
69. Cho I., Son Y., Song S. et al. Feasibility and effects of a postoperative recovery exercise program developed specifically for gastric cancer patients (PREP-GC) undergoing minimally invasive gastrectomy. J Gastric Cancer 2018; 18(2): 118 - 33.
70. Hunter E.G., Baltisberger J. Functional outcomes by age for inpatient cancer rehabilitation: a retrospective chart review. J Appl Gerontol 2013; 32(4): 443 - 56.
71. Грушина Т.И. Реабилитация в онкологии: физиотерапия. М.: ГЭОТАР - Медиа, 2006. 240 с.
72. Ajani J.A., D"Amico T.A., Almhanna K. et al. Gastric Cancer, Version 3.2016, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw 2016; 14(10): 1286 - 312.
73. Bland K.A., Zadravec K., Landry T. et al. Impact of exercise on chemotherapy completion rate: A systematic review of the evidence and recommendations for future exercise oncology research. Crit Rev Oncol Hematol 2019; 136: 79 - 85.
74. Streckmann F., Zopf E.M., Lehmann H.C. et al. Exercise intervention studies in patients with peripheral neuropathy: a systematic review. Sports Med 2014; 44: 1289 - 304.
75. Westphal J.G., Schulze P.C. Exercise training in cancer related cardiomyopathy. J Thorac Dis 2018; 10(Suppl 35): S4391 - 9.
76. Lee J.M., Look R.M., Turner C. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J Clin Oncol 2012; 30(15 Suppl): 9019.
77. Rick O., von Hehn U., Mikus E. et al. Magnetic field therapy in patients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics 2016; 38(2): 85 - 94.
78. Kumar A, Ahuja CK, Vyas S, et al. Hepatic arteriovenous fistulae: role of interventional radiology. Dig Dis Sci 2012; 57: 2703 - 12.
79. Wu H, Zhao W, Zhang J, Han J, Liu S. Clinical characteristics of hepatic arterioportal shunts associated with hepatocellular carcinoma. BMC Gastroenterol. 2018 Nov 12; 18(1): 174. doi: 10.1186/s12876-018-0899-3.
80. Kim, J. H., Sinn, D. H., Kim, K., et al. Primary Prophylaxis for Variceal Bleeding and the Improved Survival of Patients with Newly Diagnosed Hepatocellular Carcinoma. Digestive Diseases and Sciences, (2016). 61(11), 3354 - 3362. doi: 10.1007/s10620-016-4255-6
81. Finkelmeier F, Waidmann O. & Trojan J: Nivolumab for the treatment of hepatocellular carcinoma, Expert Review of Anticancer Therapy 2018, DOI: 10.1080/14737140.2018.1535315
82. Zhao X, Ivaturi V, Gopalakrishnan M, et al. A model-based exposure-response (ER) assessment of a nivolumab (NIVO) 4-weekly (Q4W) dosing schedule across multiple tumor types. Cancer Res. 2017 Jul; 77 Suppl: 13.
83. Yang TS, Lin YC, Chen JS, et al. Phase II study of gemcitabine in patients with advanced hepatocellular carcinoma. Cancer 2000; 89: 750 - 6.
84. Zaanan A, Williet N, Hebbar M, Dabakuyo TS, et al. Gemcitabine plus oxaliplatin in advanced hepatocellular carcinoma: a large multicenter AGEO study. J Hepatol. 2013 Jan; 58(1): 81 - 8. doi: 10.1016/j.jhep.2012.09.006.
85. Chakrabarti, Kommalapati A, Tella S. H, et al. Clinicopathological features and outcomes of fibrolamellar hepatocellular carcinoma. J Clin Oncol 2019 37: 4_suppl, 393 - 393
86. Chieh Kow, A. Transplantation versus liver resection in patients with hepatocellular carcinoma. Translational Gastroenterology and Hepatology, 2019, vol 4, number 0. doi: 10.21037/tgh.2019.05.06
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Алиева С.Б., д.м.н., ведущий научный сотрудник радиологического отделения НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
2. Бредер В.В., д.м.н., ведущий научный сотрудник отделения химиотерапии N 17 ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
3. Базин И.С., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
4. Виршке Э.Р., д.м.н., заведующий лабораторией интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Долгушин Б.И., чл.-корр. РАН, д.м.н., директор НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
6. Косырев В.Ю., д.м.н., ведущий научный сотрудник лаборатории интервенционной радиологии НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
7. Лукъянченко А.Б., д.м.н., профессор, ведущий научный сотрудник рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
8. Медведева Б.М., д.м.н., ведущий научный сотрудник рентгенодиагностического отделения НИИ клинической и экспериментальной радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
9. Мороз Е.А., к.м.н., старший научный сотрудник отдела патологической анатомии опухолей ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
10. Кудашкин Н.Е., к.м.н., научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
11. Новрузбеков М С., д.м.н., заведующий научным отделом трансплантации печени ГБУЗ "НИИ скорой помощи им. Н.В. Склифосовского ДЗМ".
12. Патютко Ю.И., д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
13. Подлужный Д.В., к.м.н., заведующий отделением опухолей печени и поджелудочной железы ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
14. Сагайдак И.В., д.м.н., профессор, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
15. Балахнин П.В., к.м.н., ГБУЗ "Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)".
16. Ледин Е.В., к.м.н., клиническая больница N 2 АО "Группа компаний МЕДСИ".
17. Петкау В.В., к.м.н., ГАУЗ СО "Свердловский областной онкологический диспансер", г. Екатеринбург.
18. Сидоров Д.В., заведующий Абдоминального хирургического отделения Хирургического отдела МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
19. Петров Л.О., Заведующий отделения лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России
20. Феденко А.А., заведующий Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
21. Болотина Л.В. заведующий Отделения химиотерапии Отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России
22. Фалалеева Н.А., Заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России
Блок по реабилитации:
1. Кончугова Т.В., д.м.н., профессор, врач-физиотерапевт, заведующая отделом преформированных физических факторов ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
2. Еремушкин М.А., д.м.н., профессор, заведующий отделением ЛФК и клинической биомеханики ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
3. Гильмутдинова И.Р., к.м.н., врач-трансфузиолог, дерматовенеролог, специалист в области клеточных технологий, заведующая отделом биомедицинских технологий и лабораторией клеточных технологий ФГБУ "НМИЦ реабилитации и курортологии" Минздрава России.
4. Буланов А.А., д.м.н., старший научный сотрудник отделения клинической фармакологии и химиотерапии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
5. Бутенко А.В., д.м.н., профессор, главный врач НИИ клинической онкологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, председатель Ассоциации специалистов по онкологической реабилитации.
6. Назаренко А.В., к.м.н., заведующий отделением радиологии ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Российской ассоциации терапевтических радиационных онкологов, European Society for Radiotherapy & Oncology, Российско-Американского альянса по изучению рака, представитель Российской Федерации в МАГАТЭ, врач высшей квалификационной категории.
7. Обухова О.А., к.м.н., врач-физиотерапевт, заведующий отделением медицинской реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России, член Европейской ассоциации парентерального и энтерального питания (ESPEN), член Российской ассоциации парентерального и энтерального питания.
8. Хуламханова М.М., врач-физиотерапевт, врач-онколог отделения медицинской реабилитации ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
9. Ковлен Д.В., д.м.н., доцент кафедры курортологии и физиотерапии ФГБВОУ ВО "Военно-медицинская академия им. С.М. Кирова" Минобороны России.
10. Крутов А.А., врач-онколог клинико-диагностического отделения ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
11. Зернова М.А., инструктор-методист по лечебной физкультуре ФГБУ "НМИЦ онкологии им. Н.Н. Петрова" Минздрава России.
12. Иванова Г.Е., д.м.н., главный специалист по медицинской реабилитации Минздрава России, заведующая отделом медико-социальной реабилитации инсульта НИИ ЦВПиИ ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
13. Романов А.И., академик РАН, д.м.н., профессор, главный врач ФГБУ "Центр реабилитации" Управления делами Президента Российской Федерации.
14. Филоненко Е.В., д.м.н., профессор, заведующий центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена - филиала ФГБУ "НМИЦ радиологии" Минздрава России, врач-онколог.
Блок по организации медицинской помощи:
1. Невольских А.А., д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
2. Иванов С.А., профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
3. Хайлова Ж.В., к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ "НМИЦ радиологии" Минздрава России.
4. Геворкян Т.Г., заместитель директора НИИ КЭР ФГБУ "НМИЦ онкологии им. Н.Н. Блохина" Минздрава России.
Конфликта интересов нет.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. врачи-онкологи;
2. врачи-хирурги;
3. врачи-радиологи;
4. врачи по рентгенэндоваскулярным диагностике и лечению;
5. студенты медицинских вузов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме ГЦР в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
3
Исследования без последовательного контроля референсным методом, или исследования с контролем референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Уровень достоверности доказательств
Расшифровка
1
Систематический обзор рандомизированных контролируемых исследований с применением метаанализа
2
Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа
3
Нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Уровень убедительности рекомендаций
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
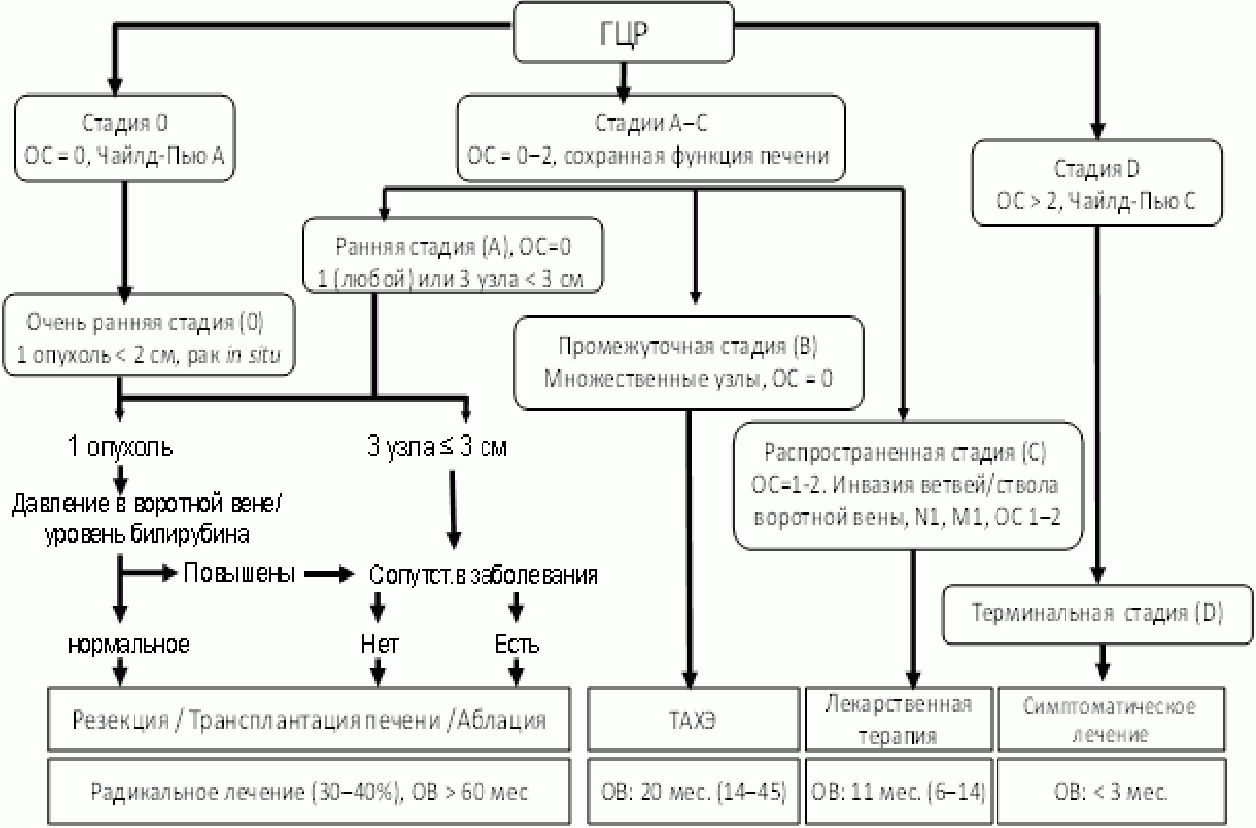
Рисунок А1. Барселонская система стадирования гепатоцеллюлярного рака [4].
ОВ - общая выживаемость; ОС - объективный статус
по шкале ECOG; ТАХЭ - трансартериальная химиоэмболизация
Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
Таблица 1. Режимы лекарственного лечения гепатоцеллюлярного рака
Вид терапии
Препарат
Схема приема
Терапия ингибиторами протеаз
Сорафениб**
по 400 мг 2 раза в день длительно [53]
Ленватиниб**
8 мг (если масса тела < 60 кг) 1 раз в день длительно [56]
12 мг (если масса тела >= 60 кг) 1 раз в день длительно [56]
Регорафениб**
160 мг/сут в 1 - 21-й дни каждые 4 нед. [57]
120 мг/сут в 1 - 21-й дни каждые 4 нед.
Кабозантиниб
60 мг 1 р/день длительно [58]
Антитела моноклональные
#Ниволумаб**
3 мг/кг в/в 1 раз в 2 нед. длительно [59]
240 мг в/в 1 раз в 2 нед. длительно [81]
480 мг в/в 1 раз в 4 нед. длительно [82]
#Пембролизумаб**
200 мг в/в 1 раз в 3 нед. длительно [60]
Полихимиотерапия
#Гемцитабин**
#Цисплатин**
1000 мг/м2 в 1-й и 8-й дни
25 - 30 мг/м2 в 1-й и 8-й дни каждые 3 нед. [83]
#Гемцитабин**
#Оксалиплатин**
1000 мг/м2 1-й и 15-й дни
85 мг/м2 1-й и 15-й дни каждые 4 нед. [84]
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
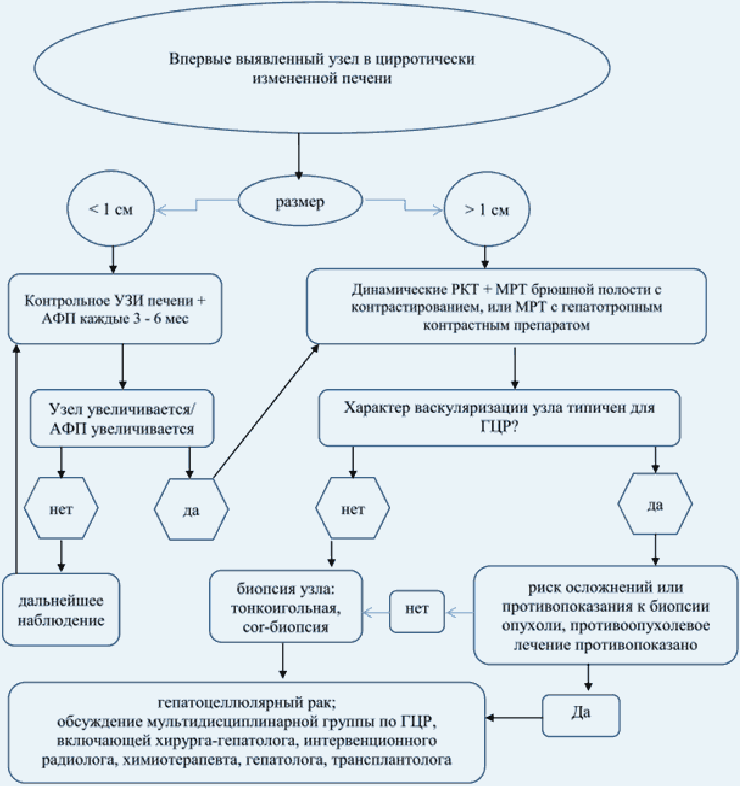
Рис. Б1. Диагностический алгоритм при выявлении узловых образований в цирротической печени у пациентов группы риска развития гепатоцеллюлярного рака
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендации по первичной профилактике гепатоцеллюлярного рака
Главным фактором риска развития рака печени является хроническое воспаление печени вследствие воздействия различных повреждающих факторов: хронических вирусных гепатитов B и C, употребления алкоголя и других токсических веществ, нарушения углеводного и жирового обмена и цирроза различной этиологии. Сочетание нескольких факторов риска увеличивает вероятность развития первичного рака печени. Вакцинация от вирусного гепатита B - важнейшее профилактическое мероприятие. Эффективная противовирусная терапия хронического гепатита C достоверно уменьшает вероятность развития рака печени.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38 °C и выше - начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
- механически, термически щадящая диета;
- частое (каждый час) полоскание рта отварами ромашки, шалфея, коры дуба, смазывание рта облепиховым (персиковым) маслом;
- обработка полости рта по рекомендации врача-онколога.
3. При диарее:
- исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
- принимать лекарственные препараты в соответствии с назначением врача-онколога.
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
5. При развитии специфических для непрерывной таргетной терапии побочных эффектов - артериальной гипертензии, появлении трещин на коже рук и ног, многократной диарее, выраженной слабости - следует прекратить прием препарата и незамедлительно связаться с лечащим врачом.
Информация для пациента, получающего терапию моноклональными антителами - блокаторами CTLA4 и/или PD1/PD-L1
Своевременное взаимодействие с вашим лечащим врачом и медицинской сестрой по поводу состояния вашего здоровья - важная составляющая вашей помощи медицинской команде в осуществлении настолько полной защиты вас в процессе лечения, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами CTLA4 и/или PD1, были выявлены и устранены при первом их появлении, это поможет предотвратить их переход в более тяжелые формы.
Блокаторы CTLA4 и/или МКА-блокаторы PD1/PD-L1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые 12 нед. лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами CTLA4 и/или PD1/PD-L1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые формы.
Если после лечения блокаторами CTLA4 и/или МКА-блокаторами PD1/PD-L1 у вас возникли какие-либо симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные эффекты терапии блокаторами CTLA4 и/или PD1/PD-L1:
- увеличение числа актов дефекации (> 2 в день) или любая диарея в ночное время, любой стул со слизью и кровью;
- боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
- красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
- желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи к солнечным лучам;
- возникновение кашля или одышки;
- усталость или сонливость;
- затрудненная концентрация внимания или спутанность сознания;
- головная боль, боль в теле или в месте опухоли;
- лихорадка (повышение температура тела до +38 °C и выше);
- внезапное снижение или увеличение массы тела;
- возникновение эректильной дисфункции или потеря интереса к интимной жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записывайте количество актов каждый день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
- стул неплотный;
- водянистый;
- болезненный;
- кровянистый;
- слизистый.
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед. до нескольких месяцев от начала лечения блокаторами CTLA4 и/или PD1/PD-L1. Если у вас возник любой из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской сестре.
Приложение Г
Приложение Г1
ШКАЛА ОЦЕНКИ ФУНКЦИИ ПЕЧЕНИ ПО ЧАЛД-ПЬЮ
Название на русском языке: классификация тяжести цирроза печени по Чалд-Пью
Оригинальное название: Child-Pugh classification
Источник (официальный сайт разработчиков, публикация с валидацией): Cholongitas, E; Papatheodoridis, GV; Vangeli, M; Terreni, N; Patch, D; Burroughs, AK (Dec 2005). "Systematic review: The model for end-stage liver disease--should it replace Child-Pugh"s classification for assessing prognosis in cirrhosis?". Alimentary Pharmacology & Therapeutics. 22(11 - 12): 1079 - 89. doi:10.1111/j.1365-2036.2005.02691.x. PMID 16305721 [86]. Child CG, Turcotte JG (1964). "Surgery and portal hypertension". In Child CG (ed.). The liver and portal hypertension. Philadelphia: Saunders. pp. 50 - 64 [87]. Pugh RN, Murray-Lyon IM, Dawson JL, Pietroni MC, Williams R (1973). "Transection of the oesophagus for bleeding oesophageal varices". The British Journal of Surgery. 60(8): 646 - 9. doi:10.1002/bjs.1800600817. PMID 4541913. [88]
Тип: шкала оценки.
Назначение: определить степень выраженности нарушения функции печени.
Содержание:
Характеристика
1 балл
2 балла
3 балла
Энцефалопатия, степень
Нет
I - II степень (или компенсируется медикаментозно)
III - IV степень (или рефрактерная)
Асцит
Нет
Незначительный
Умеренный
Альбумин плазмы, г/дл
> 3,5
2,8 - 3,5
< 2,8
Протромбиновое время, увеличение (норма 12 - 14 с)
на 1 - 4 с
на 4 - 6 с
более чем на 6 с
или
международное нормализованное отношение
< 1,7
1,7 - 2,3
> 2,3
Билирубин, мг/дл (мкмоль/л)
1 - 2 (< 34,2)
2 - 3 (34,2 - 51,3)
> 3 мг/дл (> 51,3)
Пояснения: хроническое поражение (нарушение функции) печени классифицируется как Child-Pugh класса A, B или C, в зависимости от суммы баллов, полученных для каждого параметра. Класс A: 5 - 6 баллов, класс B: 7 - 9 баллов и класс C: 10 - 15 баллов.
Приложение Г2
ШКАЛА ОЦЕНКИ ТЯЖЕСТИ СОСТОЯНИЯ ПАЦИЕНТА ПО ВЕРСИИ ВОЗ/ECOG
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG.
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS).
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status.
Oken M.M., Creech R.H., Tormey D.C. et al. Toxicity and response criteria of the East-ern Cooperative Oncology Group. Am J Clin Oncol 1982; 5(6): 649 - 55 [72].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание:
Балл
Описание
0
Пациент полностью активен, способен выполнять все действия так же, как и до заболевания (90 - 100% по шкале Карновского)
1
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70 - 80% по шкале Карновского)
2
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно - в вертикальном положении (50 - 60% по шкале Карновского)
3
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования (30 - 40% по шкале Карновского)
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10 - 20% по шкале Карновского)
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г3
ШКАЛА КАРНОВСКОГО
Название на русском языке: Шкала Карновского.
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Оригинальное название (если есть): Karnofsky Performance Status.
Оригинальная публикация: Karnofsky D.A., Burchenal J.H. The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. Ed. by C. MacLeod. New York: Columbia University Press, 1949. Pp. 191 - 205. [73].
Тип: шкала оценки.
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т.д.).
Содержание (шаблон):
Шкала Карновского
100 - Состояние нормальное, жалоб нет
90 - Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
80 - Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70 - Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
60 - Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50 - Нуждается в значительной помощи и медицинском обслуживании
40 - Инвалид, нуждается в специальной помощи, в том числе медицинской
30 - Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
20 - Тяжелый пациент. Необходимы госпитализация и активное лечение
10 - Умирающий
0 - Смерть
Примечание. Ключ (интерпретация) приведен в самой шкале.
Приложение Г4
КРИТЕРИИ ОЦЕНКИ ОТВЕТА ОПУХОЛИ НА ЛЕЧЕНИЕ (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1).
Оригинальное название (если есть): Response Evaluation Criteria in Solid Tumors 1.1.
Оригинальная публикация: Eisenhauer E.A., Therasse P., Bogaerts J., Schwartz L.H., Sargent D., Ford R., Dancey J., Arbuck S., Gwyther S., Mooney M. et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45(2): 228 - 47.
Тип: шкала оценки.
Назначение: оценка ответа на химиотерапевтическое лечение.
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях N 46 ГБУЗ "Научно-практический центр медицинской радиологии" Департамента здравоохранения города Москвы и доступны на веб-сайте http://medradiology.moscow/d/1364488/d/no46_2018_recist_11.pdf [74]. Данный документ является собственностью Департамента здравоохранения города Москвы, не подлежит тиражированию и распространению без соответствующего разрешения.
