"Клинические рекомендации "Синдром компрессии чревного ствола брюшной аорты"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
СИНДРОМ КОМПРЕССИИ ЧРЕВНОГО СТВОЛА БРЮШНОЙ АОРТЫ
МКБ 10: I77.4
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР94
URL
Профессиональные ассоциации
- Ассоциация сердечно-сосудистых хирургов России
Ключевые слова
- аортомезентериальное шунтирование;
- артерии кишечника;
- атеросклероз мезентериальных артерий;
- верхняя брыжеечная артерия;
- инфаркт кишечника;
- компьютерная томография;
- магнитно-резонансная томография;
- мезентериальный тромбоз;
- национальные рекомендации;
- нижняя брыжеечная артерия;
- острое нарушение мезентериального кровообращения;
- протезирование мезентериальных артерий;
- реимплантация мезентериальных артерий;
- селезеночная артерия;
- стандартная ангиография;
- стентирование мезентериальных артерий;
- торакофренолюмботомия;
- транслюминальная баллонная ангиопластика;
- хроническая ишемия органов пищеварения;
- хроническая мезентериальная ишемия;
- чревный ствол;
- экстравазальная компрессия.
Список сокращений
ВБА - верхняя брыжеечная артерия
ВСУЗИ - внутрисосудистое ультразвуковое исследование
ЖКТ - желудочно-кишечный тракт
КТ - компьютерная томография
КТА - компьютерная томографическая ангиография
ЛСК - линейная скорость кровотока
МР - магнитно-резонансный
МРА - магнитно-резонансная ангиография
МРТ - магнитно-резонансная томография
ОМИ - острая мезентериальная ишемия
СКЧС - синдром компрессии чревного ствола
УЗДС - ультразвуковое дуплексное сканирование
ФК - функциональный класс
ХИОП - хроническая ишемия органов пищеварения
ХМИ - хроническая мезентериальная ишемия
ЧС - чревный ствол
Термины и определения
Интестинальная ишемия - состояние, возникающее при нарушении кровоснабжения мезентериального кровообращения и характеризующееся специфическим абдоминальным симптомокомплексом.
Кахексия - комбинированный метаболический синдром, сопровождающийся потерей мышечной, нередко жировой массы, который приводит к ухудшению течения заболевания, снижению эффективности специфической терапии и повышению смертности.
Реваскуляризация - восстановление кровоснабжения какого-либо сосудистого бассейна в результате одного из вариантов лечения, сопровождающееся купированием (уменьшения) ишемического синдрома, вызванного тяжелыми морфофункциональными изменениями артериального русла.
Ситофобия - боязнь приема пищи, навязчивый страх с полным или частичным отказом от пищи при наличии сохранного аппетита.
Стентирование - медицинское оперативное вмешательство, проводимое с целью установки стента - специального каркаса, который помещается в просвет полых органов человека и обеспечивает расширение участка, суженного патологическим процессом.
Хроническая мезентериальная ишемия - заболевание, возникающее при хроническом нарушении кровообращения по непарным висцеральным ветвям брюшной аорты, клинически проявляющееся болями в животе, возникающими после приема пищи, нарушениями моторно-секреторной и абсорбционной функции кишечника, прогрессирующим похуданием.
1. Краткая информация
1.1 Определение
Синдром компрессии чревного ствола брюшной аорты - это симптомокомплекс, сопровождающий внесосудистое сдавление чревного ствола окружающими его анатомическими элементами (серповидная связка и/или медиальный ножки диафрагмы, солнечное сплетение, объемные образования и т.д.) и обусловленный нарушением проходимости из-за сужения (стеноза) его просвета с формированием синдрома хронической мезентериальной ишемии.
1.2 Этиология и патогенез
Этиология синдрома компрессии чревного ствола (СКЧС) по-прежнему остается объектом дискуссии. Неопределенность связана с тем, что достаточно часто анатомическая компрессия чревного ствола (ЧС) срединной дугообразной связкой и другими элементами диафрагмы можно наблюдать у абсолютно асимптомных пациентов. Формирование СКЧС потенцировано двумя анатомическими ситуациями: аномально высоким (краниальным) отхождением ЧС от брюшной аорты и аномально низкой фиксацией диафрагмы [1, 2, 3]. Эта гипотеза подтверждается небольшими сериями исследований в семьях и монозиготных близнецах. Кроме того, предпосылкой для манифестации клинических проявлений СКЧС является связь с дыхательными движениями и изменением положения тела [4, 5, 6].
Дугообразная срединная серповидная связка диафрагмы и ее медиальная ножка являются самой частой причиной развития синдрома экстравазальной компрессии (более 70% случаев) [7, 8], поэтому в зарубежной литературе чаще используется термин "Median arcuate ligament syndrome". Реже встречается поражение в результате периартериального фиброза, разрастания и гипертрофии нервных тканей солнечного сплетения, воздействия опухолевидных образований [9, 10, 11].
Близкое анатомическое и пространственное положение мышечно-сухожильных элементов диафрагмы и чревного ствола определяет преимущественный изолированный характер поражения. Ретроспективный анализ показывает, что в 91,1% случаев интраоперационно выявляется изолированная экстравазальная компрессия чревного ствола, в остальных случаях патологический процесс может распространяться на верхнюю брыжеечную артерию [9]. В литературе описаны случаи вовлечения в патологический процесс не только чревного ствола и верхней брыжеечной артерии, но и сразу обеих почечных артерий [12], что говорит о высокой вероятности врожденного генеза патологии.
К настоящему времени исследователи придерживаются двух основных теорий возникновения хронической мезентериальной ишемии у пациентов с экстравазальной компрессией. Первая предполагает возникновение преходящей мезентериальной ишемии, вследствие нарушения проходимости чревного ствола, вызванной воздействием мышечно-связочного аппарата диафрагмы [4, 13, 14, 15]. О клиническом подтверждении этой теории сообщил C. Desmond, который наблюдал развитие синдрома компрессии срединной связкой, индуцированного длительными физическими упражнениями у спортсменов-бегунов и сопровождавшегося болевым абдоминальным синдромом и диареей [16]. Авторы предположили, что возникновение клиники интестинальной ишемии обусловлено редукцией (обкрадыванием) мезентериального кровотока в пользу кровоснабжения нижних конечностей при выполнении упражнений и усилением эффекта уже имеющейся компрессии на кровоснабжение кишечника. Гипотезу с влиянием активного дыхания, особенно глубокого выдоха, на ЧС подтверждают результаты исследования Ли и соавторов, в котором 60% функциональный стеноз ЧС возникал в 16,5% случаев на высоте выдоха и сохранялся на высоте вдоха у 12,4% пациентов абсолютно здоровых пациентов [15]. Сохранение гемодинамически значимого стеноза ЧС наблюдается в среднем в 1% случаев при выявленном факторе ЭК [17, 18].
Вторая теория приписывает развитие симптомов экстравазальной компрессии возникающему раздражению солнечного ганглия и симпатического нервного сплетения [19], в результате как прямого воздействия компрессионного фактора на нервную ткань, так и опосредованно за счет вызванной им вазоконстрикции [20, 21]. Нейрогенный механизм возникновения болей также подтверждается положительным влиянием диагностического и лечебного медикаментозного блока солнечного сплетения [22, 23]. Некоторые авторы сообщают о восстановлении эвакуаторной функции желудка после декомпрессионных денервирующих вмешательств [24]. Другие постулируют о дисфункции или патологии солнечного ганглия и его элементов, как основной причины нейрогенного механизма вазоконстрикции [25].
1.3 Эпидемиология
Сведения о частоте встречаемости синдрома компрессии чревного ствола существенно разнятся. По данным исследований, основанных на аутопсиях признаки компрессии ЧС той или иной степени, выявляются в 34% среди общей популяции [26]. При этом не сообщается о клинической характеристике подтвержденной компрессии. В более ранних работах, при выполнении ангиографической диагностики, анатомические изменения ЧС, характерные для синдрома Данбара, выявляются у 24% здоровых добровольцев без предварительной селекции [27]. При оценке более значимых статистических групп и проведении современной инструментальной диагностики частота СКЧС варьирует от 1,8 до 4,7% [28, 29, 30], и в этой группе пациентов гемодинамически значимый характер стеноза ЧС выявляется в 7,4% [28].
Несмотря на высокую распространенность выявляемых стенозирующих поражений, частота истинного СКЧС, характеризующегося типичной триадой симптомов и проявлениями хронической мезентериальной ишемии составляет всего 2 пациента на 100 000 человек [31, 32]. Однако, в исследовании  H., на долю выявленного асимптомного СКЧС пришлось 2,8% в общей популяции, и клинические симптомы были выявлены у 3 (0,4%) из 744 обследованных с помощью КТ-ангиографии пациентов [29], что говорит в пользу большей распространенности заболевания.
H., на долю выявленного асимптомного СКЧС пришлось 2,8% в общей популяции, и клинические симптомы были выявлены у 3 (0,4%) из 744 обследованных с помощью КТ-ангиографии пациентов [29], что говорит в пользу большей распространенности заболевания.
Согласно анализу современной литературы, в структуре причин хронической мезентериальной ишемии частота различных периартериальных компрессионных факторов составляет до 5% [1, 13, 33].
СКЧС выявляется у пациентов молодой возрастной группы (20 - 40 лет), преимущественно женщин (75 - 91%) с характерными конституционными особенностями [34, 35, 36]. Имеется ряд сообщений о наследственной природе патологии [37]. В 2010 году было опубликовано сообщение о 16-летней девочке с СКЧС, мать которой ранее лечилась от этого же заболевания [38]. Соотношение между женщинами и мужчинами с СКЧС варьирует, в среднем составляя 4:1 [2, 14]. Нередко СКЧС выявляется у детей и подростков, маскируясь за такими заболеваниями, как функциональная диспепсия, синдром раздраженного кишечника, абдоминальная мигрень [35, 39], однако при этом большинство авторов не приводит данные о распространенности СКЧС в этой возрастной группе.
Прогноз и естественное течение. В связи с низкой распространенностью заболевания, неспецифическим характером возникающих симптомов и невысокой осведомленностью врачей о данной патологии, пациенты с СКЧС проходят длительное (несколько месяцев и иногда даже лет) лечение в гастроэнтерологических клиниках по поводу различных, маскирующих СКЧС, заболеваний. Неблагоприятным результатом поздней диагностики синдрома экстравазальной компрессии ЧС становится формирование тяжелых, нередко необратимых, дистрофических изменений органов ЖКТ, а также развитие различной степени астено-невротических состояний, связанных с длительным болевым синдромом. Некоторые авторы, сообщают о достаточно высокой частоте развития астении или неврозов на фоне СКЧС, достигающей 15 - 56% [31, 40 - 44].
Практика показывает, что используемые методы консервативной терапии у пациентов с клиническими проявлениями ХМИ не в силах остановить дальнейшее прогрессирование заболевания и характеризуется неблагоприятными отдаленными результатами.
В анализе группы авторов из Австралии, показано что при динамическом наблюдении без хирургического лечения у 67% пациентов с СКЧС симптомы сохраняются (50%) или прогрессируют (17%), что со временем может привести к декомпенсации хронической мезентериальной ишемии [40].
В последнее время некоторые авторы представляют работы, в которых доказывают ассоциативную связь между формированием истинных аневризм панкреатодуоденальной зоны и стенозом/окклюзией чревного ствола. Известно, что стеноз/окклюзия ЧС стала причиной формирования 50 - 80% истинных аневризм указанной локализации [45]. СКЧС является наиболее частой и даже специфической причиной формирования окклюзии чревного ствола, предрасполагающей к формированию аневризм [46]. В связи с этим фактом, рекомендуется ранее проведение КТ-ангиографии у пациентов с верифицированным стенозом/окклюзией ЧС для выявления экстравазальной компрессии и спланхнических аневризм, а также раннего превентивного лечения для профилактики их разрывов, летальность при которых может достигать 30 - 50%.
1.4 Кодирование по МКБ 10
Другие поражения артерий и артериол (I77)
I77.4 - Синдром компрессии чревного ствола брюшной аорты
1.5 Классификация
Несмотря на достаточно длительный период изучения данной патологии, единой общепринятой классификации СКЧС, а также вызываемой им ХМИ, по настоящее время так и не принято. Предложенные классификации J. Vollmar (1967), V. Cicala (1970), Ю.Л. Шалькова (1970), G. Freidman и W. Sloan (1972) либо учитывали этиологический принцип, либо основывались преимущественно на клинических проявлениях заболевания. При этом не учитывалась степень развившихся циркуляторных расстройств и компенсации нарушения кровообращения в органах пищеварения.
Первая классификация, соответствующая этим требованиям и применительная к СКЧС, была предложена А.В. Покровским и соавт. [47] в 1982 г. Она включала этиологические факторы (интравазальные, экстравазальные) врожденные или приобретенные, клинические формы (чревную и брыжеечную), а также 3 стадии в течении ХМИ (компенсированную доклиническую, субкомпенсированную и декомпенсированную). Данная классификация, несмотря на свое 30-летнее существование, не утратила свою актуальность, а по некоторым позициям и в настоящее время широко применяется практикующими врачами [48].
С практической точки зрения для пациентов с СКЧС, так же, как и для пациентов с ХМИ атеросклеротического генеза, наибольшей информативностью в плане определения показаний к хирургическому лечению, прогнозирования и оценки результатов лечения являются классификации с выделением степеней нарушения спланхнического кровообращения и соответствующей этому нарушению клинической картины. Этому требованию соответствуют несколько отечественных классификаций. Прежде всего это хирургическая классификация А.А. Спиридонова и соавт. (1996), которая предполагает деление на 4 стадии развития хронической ишемии органов пищеварения (ХИОП). Стадия компенсации включает асимптомное течение заболевания (Iа) и стадию микросимптоматики (Iб) - ишемию в результате функциональной перегрузки органов пищеварения. Стадия субкомпенсации (II) - ишемия вследствие функциональной нагрузки на органы пищеварения. Стадия декомпенсации (III) - ишемия функционального покоя органов пищеварения. Стадия язвенно-некротических изменений (IV) в органах пищеварения (язвы желудка и двенадцатиперстной кишки, энтериты, колиты, стриктуры тонкой и толстой кишки) [49].
По тождественному принципу построена классификация, используемая в клиниках гастроэнтерологии. В классификации Л.Б. Лазебника и соавторов помимо этиологических и клинических форм выделяется функциональные классы (ФК) хронической ишемической болезни органов пищеварения: I ФК - без выраженной клинической симптоматики, характерно отсутствие нарушения кровотока в покое и появления абдоминальной боли лишь после нагрузочной пробы; II ФК - наличие признаков расстройства кровообращения в покое и усиление их после функциональной нагрузки, выраженная клиническая симптоматика (болевой, диспепсический синдром, похудание), нарушение функции поджелудочной железы, дисфункция кишечника; к III ФК отнесены пациенты с выраженными циркуляторными расстройствами, выявляемые в покое и сочетающиеся с постоянным болевым синдромом, органическими изменениями органов пищеварения; IV ФК - стадия деструктивных изменений органов пищеварения [50].
1.6 Клиническая картина
Основной жалобой пациентов при синдроме хронической абдоминальной ишемии при СКЧС является боль как результат ишемии органов пищеварения, которая ведет к гипоксии и метаболическим нарушениям, которые передают раздражение в солнечное или верхнебрыжеечное нервное сплетение. При поражении чревного ствола болевой синдром связан и с гипоксией печени и ишемией слизистой желудка. Боль обычно появляется через 20 - 25 мин после приема пищи и продолжается 2 - 2,5 ч, т.е. в течение всего периода пассажа пищи через кишечник. Обычно боль стихает самостоятельно и возникает вновь при приеме пищи. В большинстве случаев боль локализуется в эпигастральной области и иррадиирует в правое подреберье (зона ишемии бассейна чревного ствола). Болевой синдром уменьшается при резком ограничении приема пищи - синдром малой пищи. Некоторые пациенты отмечают чувство постоянной тяжести в животе, особенно в эпигастральной области. Редко наблюдается рвота. Вторым основным симптомом хронической абдоминальной ишемии при СКЧС является дисфункция кишечника, выражающаяся нарушениями моторной, секреторной и абсорбционной функций. Третий основной симптом хронической абдоминальной ишемии - прогрессирующее похудание. Оно обусловлено несколькими факторами: во-первых, болевой симптом заставляет сократить объем, а затем и уменьшить частоту приемов пищи; во-вторых, резкие нарушения секреторной и абсорбционной функций кишечника также ведут к потере массы тела. В связи с этим похудание фактически обусловлено тремя факторами: алиментарным (отказ от еды, фобия перед едой и последствия нарушений секреторно-абсорбционной и моторной функций кишечника); обезвоживанием организма вследствие поноса, искусственно вызываемой рвоты, приема слабительных средств; вследствие болевого фактора [47].
2. Диагностика
1.1 Жалобы и анамнез
- Рекомендуется всем пациентам с подозрением на СКЧС сбор жалоб и анамнеза для верификации диагноза [22, 51, 52, 55].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Несмотря на преимущественное однососудистое поражение, пациенты с СКЧС часто имеют характерную клинику мезентериальной ишемии. Так, например, группа авторов из клиники Мейо после обследования группы из 36 пациентов с синдромом срединной дугообразной связки, выявила, что клиническая картина в 94,4% случаев сопровождалась болевым синдромом, из них в 80% случаях он возникал после приема пищи, а в 8% - провоцировался физической активностью. Среди других симптомов наиболее часто возникали прогрессирующее похудание, вздутие живота и другие диспепсические явления (тошнота и рвота) в 50%, 38,9% и 55,6%, соответственно [22].
Большинство авторов сообщает о наличии у пациентов с СКЧС характерной триады симптомов, состоящей из болевого синдрома, часто связанного с приемом пищи, прогрессирующей потерей веса (кахексией) и тошнотой или рвотой, вызванной болевым синдромом или гастропарезом [51, 52]. Появлений болей в животе некоторые авторы объясняют наличием препятствия кровотоку в виде стеноза и снижением объемного кровотока по ЧС на 60 - 75% [53].
У пациентов с малоспецифичными абдоминальными симптомами и экстравазальным стено-окклюзионным поражением ЧС, СКЧС расценивается как основная причина появления симптомов [53, 55]. В настоящее время нет утвердительных и высокого уровня доказательности рекомендаций относительно взаимосвязи выраженности клинических симптомов СКЧС от увеличения степени стенозирования ЧС [54]. Тем не менее, большинство экспертов сходится во мнении, что стенозирующее поражение чревного ствола является основной причиной формирования абдоминальных симптомов при СКЧС [53]. Несмотря на высокую частоту асимптомного течения или наличие микросимптомов при стенозирующем поражении при СКЧС, диагноз часто выставляется методом исключения другой абдоминальной патологии или причины возникших симптомов [55].
2.2 Физикальное обследование
- Рекомендуется всем пациентам с подозрением на СКЧС физикальный осмотр для верификации диагноза [47, 56, 57].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Принципы физикального обследования пациента с СКЧС направлены на выявление объективных признаков стено-окклюзирующего поражения чревного ствола и косвенных признаков возникшей на этом фоне мезентериальной ишемии. Для этого пациентам необходимо проводить полное сосудистое пальпаторное и аускультативное обследование с обязательным изучением абдоминальной полости.
Ведущим объективным признаком возможной взаимосвязи клинических проявлений при СКЧС и вероятным наличием гемодинамически значимого стеноза ЧС (или аномалии его развития) является внешний вид пациента, чаще женского пола. Как правило, пациенты с СКЧС имеют долихоморфный тип строения тела, с выраженно острыми реберными дугами [56]. Необходимо учитывать возможную генетическую предрасположенность при изучении анамнеза жизни. Также определенное диагностическое значение нередко имеет систолический шум, определяемый в эпигастральной области, в проекции отхождения висцеральных артерий от брюшной аорты и являющийся отображением нарушения проходимости таких крупных магистральных артерий, как ЧС и ВБА. Как показывает ряд исследований, выявление систолического шума в группе пациентов с подозрением СКЧС, и вызванную им ХМИ, варьирует в диапазоне 35 - 78,5% [47, 57, 58]. Внешние признаки астенизации пациента на фоне болей в животе, боязни приема пищи и дисфункции кишечника являются критерием для проведения инструментальной диагностики ХМИ. ХМИ-ассоциированная кахексия по данным некоторых авторов может достигать 53 - 77% [59, 60].
2.3 Инструментальная диагностика
Ультразвуковая диагностика
Ультразвуковое дуплексное сканирование (УЗДС) в отличие от других методов ангиографической визуализации УЗДС обеспечивает визуализацию в режиме реального времени и, таким образом, позволяет оценить изменения скоростей кровотока по чревному стволу в синхронизации с актом дыхания. В отличие от КТ-ангиографии и стандартной ангиографии, обладающих лучшим пространственным разрешением, УЗДС является неинвазивным методом диагностики, не нуждающимся в использовании контраста и радиоактивной энергии [61].
Традиционно УЗДС используется в качестве метода скрининга и первичной диагностики гемодинамически значимых мезентериальных стенозов и окклюзий. Ультразвуковые критерии гемодинамической значимости поражений висцеральных артерий определены целым рядом исследований с некоторыми различиями, вероятно связанными с включением в исследования различных популяций пациентов. В качестве ключевых критериев при СКЧС и ХМИ используются пиковая систолическая и конечная диастолическая скорости кровотока по артериям (см. Приложение Г), взаимосвязь изменений линейных скоростей и характеристик кровотока по ЧС с актом дыхания, угол наклона чревного ствола на высоте выдоха [62 - 65]. При сравнении диагностических возможностей ультразвукового исследования с информативностью дигитальной субтракционной ангиографией подтверждена высокая диагностическая точность ультразвука, достигающая 85 - 90% при выявлении > 70% стенозов мезентериальных артерий [66].
- Ультразвуковое дуплексное сканирование чревного ствола с дыхательными пробами рекомендуется в качестве метода первичной диагностики для верификации диагноза всем пациентам с подозрением на СКЧС [63 - 65, 69].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Дуплексное ультразвуковое сканирование используется в качестве метода первичного скринига для выявления/исключения гемодинамически значимых стенозов или окклюзий мезентериальных артерий. При подозрении на СКЧС выполненное во время глубокого вдоха УЗДС позволяет зарегистрировать увеличение ЛСК в области компрессии и косвенно подтверждает наличие стеноза чревного ствола [63, 70, 71]. Чувствительность и специфичность при выявлении > 70% стеноза чревного ствола и ЛСК более 200 см/сек составляет 75% и 89%, соответственно. Наиболее надежным критерием СКЧС является увеличением пиковой скорости кровотока на выдохе более 350 см\сек и изменение угла отклонения от обычной оси ЧС более чем на 50° [65]. При таком диагностическом приеме чувствительность и специфичность УЗДС увеличивается до 83% и 100% соответственно. Другим инструментальным критерием является соотношение ЛСК в чревном стволе на высоте выдоха к ЛСК в брюшной аорте, расположенной в проекции серповидной связки диафрагмы. Если это соотношение выше 3:1, у обследуемого пациента высока вероятность СКЧС [62]. Исследователи рекомендуют проводить это исследование со сменой положения тела с горизонтального на вертикальное. В последние годы проводится исследование диагностической ценности внутрисосудистого ультразвукового исследования (ВСУЗИ) при СКЧС. Так, результаты ВСУЗИ по характеристике стенозов и измерению градиента артериального давления хорошо коррелировали с данными, полученными с помощью КТ-ангиографии и МР-ангиографии [71]. При этом в спорадических случаях при выявлении стеноза 40 - 50% с помощью томографической диагностики, ВСУЗИ показывал более гемодинамически значимый стеноз (72,2%).
Ангиография
Ангиографическое исследование исторически является золотым стандартом диагностики стено-окклюзионных поражения чревного ствола, благодаря возможности прямой и качественной визуализации спланхнического бассейна, а также выявлению коллатеральной артериальной сети. Основные ангиографические критерии СКЧС представлены выявляемым стенозом чревного ствола с характерной постстенотической дилятацией. Отличительной особенностью ангиографической картины при экстравазальном поражении является возможность изменения степени стеноза при проведении дыхательных проб. Неоспоримым преимуществом ангиографии, как метода исследования, является возможность быстрого перехода к лечебным мероприятиям и выполнения различных вариантов эндоваскулярного вмешательства. С другой стороны, ангиография является инвазивным исследованием с потенциальным риском процедура-ассоциированных осложнений и лучевой нагрузки. Из-за неинвазивного характера и высокой диагностической ценности КТ-ангиография практически полностью заменила стандартную ангиографию в качестве метода диагностики, в том числе при планировании какого-либо из вариантов лечения СКЧС. В некоторых центрах во время ангиографии и эндоваскулярных процедур производят измерение градиента артериального давления с помощью размещения датчика в брюшной аорте и дистальнее места стенозирующего поражения, определяя гемодинамическую значимость стеноза и эффективность выполненного вмешательства [72, 73]. Хорошим дополнением ангиографической диагностики СКЧС является ВСУЗИ, которое позволяет с высокой степенью точности определить вид стенозирующего поражения и оценить взаимоотношение ЧС с мышечно-сухожильными элементами диафрагмы [71].
КТ-ангиография
- КТ-ангиографию рекомендуется выполнить для визуализации стено-окклюзионного поражения, определения экстравазального фактора стенозирования и выявления/исключения абдоминальной патологии всем пациентам с подозрением на СКЧС [74, 75].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарий: КТ-ангиография в настоящее время является методом выбора при необходимости визуализации патологии мезентериальных артерий при СКЧС. При формировании 3D-реконструкции спланхнического бассейна КТ-ангиография обеспечивает полную картину патологии с чувствительностью и специфичностью 96% и 94%, соответственно, в отношении выявления стено-окклюзионных поражений. Важной отличительной особенностью метода от стандартной ангиографии является возможность визуализировать и произвести оценку других органов брюшной полости во время процедуры, что позволяет исключить/подтвердить другую причину хронических болей в животе. Ключевым критерием КТ диагностики СКЧС является визуализация и оценка брюшной аорты и чревного ствола в сагитальной проекции, а также проведение исследования на высоте вдоха и выдоха [74]. Enterline с соавторами. [75] опубликовали исследование, в котором КТ-ангиография брюшной полости выполнялась в двух фазах, на вдохе и на выдохе с помощью метода низких доз при однократном введении контраста. Во время такого диагностического подхода отклонение чревного ствола без стенозирования выявлено у 79 (7%) из 1121 пациентов. Такой критерий как наличие угла чревного ствола без признаков компрессии и стеноза на вдохе, может быть диагностическим признаком компрессии на высоте выдоха. С другой стороны, у симптомных пациентов при стенозе 48 - 70%, процент стеноза может увеличиваться при глубоком выдохе, еще больше провоцируя появление симптомов ХМИ. Такие динамические изменения являются предметом исследования большинства современных научных работ. Пространственное визуализация позволяет воссоздать всю коллатеральную сосудистую сеть, развивающуюся при критическом характере поражения чревного ствола.
МР-ангиография
- МР-ангиография рекомендуется в качестве альтернативы КТ-ангиографии для диагностики предполагаемого СКЧС [77, 78].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарий: МР-ангиография обладает хорошим диагностическим потенциалом в качестве метода визуализации патологии мезентериальных артерий при СКЧС [76]. В исследовании с небольшой когортой пациентов МР-ангиография показала высокие показатели чувствительности и специфичности (100% и 95%, соответственно) при сравнении с данными, полученными с помощью ангиографии и интраоперационной картиной патологии [77, 78]. Основное преимущество МР-ангиографии - это отсутствие радиоактивного облучения и возможность проведения измерений потока крови. Однако, сравнительно недавно было проведено исследование, подтвердившее диагностическое превосходство КТА над МРА. Кроме того, большинство экспертов сходится в мнении, что КТ-ангиографии доступна лучшая визуализация нижней брыжеечной артерии и других периферических брыжеечных артерий малого калибра, в том числе коллатератей.
3. Лечение
3.1 Консервативное лечение
- Пациентам при СКЧС симптоматическое медикаментозное лечение рекомендуется в качестве вспомогательной терапии [22].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIb)
Комментарии: К настоящему времени отсутствуют научные доказательства эффективности консервативной терапии при использовании какого-либо из вариантов неинтервенционного или медикаментозного лечения. Медикаментозная терапия, используемая при СКЧС носит симптоматический характер, и лишь у трети (29%) пациентов удается частично стабилизировать симптомы мезентериальной ишемии. Более того, большая часть используемых препаратов не обладает достаточной доказательной базой для широких рекомендаций.
При выборе варианта консервативного лечения и динамического наблюдения пациенты с СКЧС нуждаются в тщательном контроле и консультировании в отношении появления и развития у них симптомов мезентериальной ишемии. Если у пациента развиваются любые симптомы гастроинтестинальной дисфункции, такие, например, как, вздутие живота, диарея, появление нестандартных болей и других, это говорит о прогрессировании мезентериальной ишемии и необходимо рассмотреть вопрос о проведении реваскуляризации. Только после проведения декомпрессии и реваскуляризации, как основных методов лечения СКЧС, можно возобновить консервативную терапию.
3.2 Хирургическое лечение
- Пациентам с симптомным СКЧС и однососудистым поражением рекомендуется выполнить реваскуляризацию бассейна чревного ствола [16, 79].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Необходимость реваскуляризации у пациентов с клиническими проявлениями СКЧС и ХМИ не вызывает сомнения. При выполнении реваскуляризации преследуется сразу несколько целей: купирование симптомов ХМИ, улучшение качества жизни, нормализацию веса и питания, увеличение выживаемости за счет профилактики развития острой мезентериальной ишемии и инфаркта кишечника, развития осложнений СКЧС-ассоциированных разрывов мезентериальных аневризм.
Ключевые принципы лечения СКЧС предполагают восстановление нормального кровотока по чревному стволу и устранение источника постоянного раздражения солнечного сплетения и вазоконстрикции. Большинство специалистов сходятся в мнении, что оперативное лечение является методом выбора. Среди основных вариантов операций, выполняемых по поводу СКЧС, выделяют хирургическое или лапароскопическое рассечение (декомпрессия) срединной дугообразной связки или медиальных ножек диафрагмы, сосудистые операции с реконструкцией или шунтированием чревного ствола, эндоваскулярные операции и операция деструкции полулунного ганглия [16, 79].
Открытая хирургическая декомпрессия
- Пациентам с симптомным СКЧС рекомендуется выполнить декомпрессию чревного ствола, обязательно дополненную спланхникганглионэктомией [24, 34, 80, 81].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: При выборе хирургического лечения в виде изолированной декомпрессии оптимальным клиническим условием считается рассечение срединной дугообразной связки при отсутствии признаков деформации (странгуляции) чревного ствола [82]. Традиционно лучшими результатами характеризуется комбинация декомпрессии чревного ствола с резекцией ганглия солнечного сплетения (спланхникганглионэктомия), а также операции по замещению деформированного чревного ствола или его шунтирования, по сравнению с изолированной декомпрессией.
Многие эксперты поддерживают мнение о влиянии раздражаемых диафрагмой элементов солнечного сплетения на патогенез и формирование клинической картины СКЧС, в частности таких симптомов как анорексия, тошнота, рвота, кахексия [24, 83, 84]. Большинство из них постулирует о необходимости обязательного дополнения декомпрессии спланхникганглионэктомией и паравазальной десимпатизацией для улучшения отдаленных результатов и клинической эффективности операций, выполняемых при СКЧС [24, 34, 80, 81].
Лапароскопическая декомпрессия
Из-за своих атравматичных характеристик лапароскопические и роботизированные методы декомпрессии становятся все более популярными и активно используются в специализированных медицинских центрах. Как правило, купирования болевого синдрома удается добиться сразу после операции, однако, по данным разных авторов, результаты хирургической декомпрессии сильно варьируют. Опубликовано достаточное количество работ, в которых авторы говорят о возможности сохранения болей в раннем послеоперационном периоде после открытых операций [25, 44]. Поскольку послеоперационные боли могут маскировать симптомы СКЧС, имевшиеся в дооперационном периоде, для полной реабилитации и купирования болей может понадобиться не менее 1 месяца. В связи с этим эксперты в большинстве случаев предлагают лапароскопическую декомпрессию в качестве метода первичного лечения СКЧС. Однако из-за сохраняющегося высокого риска (0 - 26%) конверсии от лапароскопии к открытому варианту коррекции [25, 36, 41, 43, 85 - 87], в научном обществе сохраняются дебаты относительно приоритетности и выбора метода первичного лечения.
- Пациентам с симптомным СКЧС в качестве первичного метода лечения рекомендуется применить лапароскопический или открытый вариант декомпрессии чревного ствола [36, 85, 88 - 90].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Из-за невысокой травматизации лапароскопическую технику вмешательства нередко называют приоритетной. Действительно согласно данным ряда сравнительных исследований лапароскопическое вмешательство характеризуется такими очевидными преимуществами как возможность более раннего купирования симптомов СКЧС, сокращение послеоперационного пребывания в стационаре, снижение частоты ранних операция-ассоциированных осложнений и кровопотери [36, 85, 88 - 90]. Особенно эти характеристики лапароскопии востребованы из-за желания минимизировать травматичность у пациентов с СКЧС, как представителей молодой и активной популяции. Тем не менее, сохраняющаяся, хоть и снижающаяся благодаря накоплению практического опыта, вероятность конверсии (в среднем около 10%) к открытому варианту коррекции, сохраняет за ним позиции незаменимой в настоящее время технологии.
Реконструктивные операции
- Выполнение одного из вариантов реконструктивных операций у пациентов рекомендуется при наличии дегенеративных странгуляционных изменений чревного ствола после декомпрессии [34, 44, 91, 92].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Принципы реконструктивных операций, выполняемых при СКЧС, не отличаются от операций, используемых при ХМИ атеросклеротической природы (см. рекомендации по лечению "Атеросклероза мезентериальных артерий"). В основе лежит замещение или шунтирование измененного участка артерии с восстановлением кровоснабжения бассейна чревного ствола. Показанием к реконструкции чревного ствола многие авторы считают наличие объективных дегенеративных странгуляционных изменений стенки чревного ствола, сохраняющейся после выполненной декомпрессии. Как показывают данные небольшого количества исследований, реконструкция чревного ствола характеризуется умеренным улучшением результатов лечения (снижением частоты рецидивов и реинтервенций) по сравнению с изолированной декомпрессией [34, 44, 91, 92], хотя различия не являются статистически значимыми. Вероятно, для получения однозначного ответа на вопрос предпочтительного варианта реваскуляризации чревного ствола при СКЧС необходимо проведение крупного статического исследования.
Эндоваскулярные и гибридные операции
- При наличии СКЧС не рекомендуется выполнять эндоваскулярное стентирование без предварительной хирургической или лапароскопической декомпрессии чревного ствола [61, 93 - 97].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств III)
Комментарии: Стратегии хирургического лечения СКЧС постоянно меняются в связи с быстрым развитием новых эндоваскулярных устройств и методов лечения. Однако, несмотря на существенные изменения в выборе приоритетного варианта лечения ХМИ атеросклеротического генеза в пользу эндоваскулярной техники вмешательств, изолированное эндоваскулярное лечение СКЧС без устранения фактора экстравазальной компрессии по данным большинства работ сопряжено с высоким риском получения неблагоприятных результатов и осложнений. Прежде всего это связано с риском деформации, перелома, миграции стентов, тромбоза стентированной артерии в раннем или отдаленном периоде наблюдения [61, 93 - 97].
- При развитии рестеноза ЧС или возврате симптомов СКЧС после проведенной ранее изолированной декомпрессии ЧС рекомендуется выполнить эндоваскулярное стентирование [98 - 100].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: В настоящее время из-за неблагоприятных результатов изолированного стентирования при СКЧС в качестве альтернативы многими исследователями рекомендуется использование гибридного подхода, когда стентирование ЧС выполняется сразу после декомпрессии или через непродолжительный период послеоперационного наблюдения в случае сохранения резидуальных симптомов [98 - 100]. Из представленных в доступной медицинской литературе данных наибольшим опытом применения гибридного подхода обладает группа авторов из академического медицинского центра Лебанона (США), по данным которых эффективное стентирование ЧС в различные сроки после декомпрессии было выполнено 7 пациентам с симптомным рестенозом из 21 пролеченных [100]. В качестве имплантируемых устройств большинством экспертов предлагается стентирование голометаллическими стентами, хотя, учитывая положительный опыт использования эндографтов при ХМИ атеросклеротического генеза [101], их применение при СКЧС кажется весьма перспективным.
- Пациентам с СКЧС открытую операцию рекомендуется выполнять при неудаче лапароскопического декомпрессивного и/или эндоваскулярного лечения [98, 99].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIb)
Комментарий: При СКЧС после неэффективного лапароскопического или эндоваскулярного лечения с развившимся рестенозом/окклюзией большинством исследователей рекомендуется проведение открытого хирургического лечения. Варианты наиболее распространенных открытых вмешательств подробно освещены в клинических рекомендациях "Атеросклероз мезентериальных артерий".
3.3 Иное лечение
Обезболивающая терапия у взрослых
- Рекомендуется пациентам для премедикации с целью седации и обеспечения эмоциональной стабильности вечером накануне операции с целью уменьшения эмоционального стресса назначить транквилизаторы и нейролептики. Для премедикации перед подачей пациента в операционную с целью седации и обеспечения эмоциональной стабильности применяются опиаты и/или бензодиазепины [102 - 104].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Вечером накануне операции: бензодиазепины (Бромдигидрохлорфенилбензодиазепин**, лоразепам), атипичные нейролептики (тиоридазин**, сульпирид**) в индивидуальных дозировках. Перед подачей в операционную в/м тримепередин** и/или диазепам**/мидазолам**.
- Рекомендуется пациентам для индукции в наркоз использовать: фентанил**, пропофол**, бензодиазепины, для поддержания анестезии - фентанил**, пропофол**, бензодиазепины, фторсодержащие газовые анестетики. Предпочтение необходимо отдавать проведению комбинированной анестезии с применением галогенсодержащих газовых анестетиков на всех этапах хирургического вмешательства, включая искусственное кровообращение [102 - 104].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: препараты, используемые для индукции и поддержании анестезии:
Индукция: мидазолам**/диазепам**/пропофол** и фентанил** в/в в расчетных дозировках.
Поддержание анестезии: мидазолам**/диазепам**/пропофол** и фентанил** - в/в в расчетных дозировках. Возможно применение галогенсодержащих газовых анестетиков в комбинации с фентанилом**. При превышении дозировок (применении дозировок, превышающих указанные в инструкции к препарату) необходимо решение врачебной комиссии.
- Рекомендуется пациентам для обезболивания в раннем послеоперационном периоде использовать опиаты и НПВП в возрастных дозировках [102 - 104].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: препараты, используемые для обезболивания в послеоперационном периоде:
Первые сутки после операции - тримепередин**, либо морфин** в/м каждые 4 - 8 часов, далее НПВП. При наличии специальных дозаторов эффективно применение пациент-контролируемой анальгезии фентанилом**. При сохранении выраженного болевого синдрома тримепередин**/морфин**/фентанил** по показаниям.
4. Реабилитация
Специфической реабилитации после оперативного лечения при СКЧС нет.
Принципы реабилитации пациентов после лечения СКЧС соответствуют основным принципам, используемым при реабилитации пациентов после стандартных абдоминальных операций.
5. Профилактика
- Пациентам после сосудистой реконструкции, выполненной по поводу СКЧС, рекомендуется пожизненное динамическое наблюдение у сосудистого хирурга/гастроэнтеролога из-за риска развития симптомного рестеноза [105, 106].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Все пациенты в обязательном порядке должны наблюдаться у сосудистого хирурга с целью мониторинга состояния за выполненной реконструкцией не реже 1 раза в год, по причине возможного появления клинических симптомов СКЧС и ХМИ, и для раннего выявления рецидива заболевания и рестенозирования чревного ствола.
- Пациентам после сосудистой реконструкции, выполненной по поводу СКЧС, для раннего выявления асимптомного рестеноза рекомендуется выполнение инструментальной визуализации (ультразвуковое дуплексное исследование) в отдаленном периоде наблюдения [105, 106].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: Европейское общество кардиологов в рекомендациях по лечению заболеваний периферических артерий постулирует о необходимости проведения контрольного дуплексного ультразвукового исследования каждые 6 - 12 месяцев пожизненно [105, 106].
- Всем пациентам после открытой хирургической реваскуляризации, выполненной по поводу СКЧС, рекомендуется проведение однокомпонентной антиагрегантной терапии (ацетилсалициловая кислота 100 мг**, клопидогрел** 75 мг или аналоги) [105].
Уровень убедительности рекомендаций B (Уровень достоверности доказательств IIa)
Комментарии: Так же, как и у пациентов с атеросклерозом мезентериальных артерий, для пациентов с СКЧС после реконструктивных вмешательств или стентирования антитромбоцитарная терапия является эффективной, особенно для сохранения компетентности (проходимости) выполненных реваскуляризирующих операций. Длительность терапии - пожизненно (при отсутствии противопоказаний).
- Всем пациентам после эндоваскулярного стентирования, выполненного в качестве дополнения к декомпрессии по поводу СКЧС, рекомендуется двойная антиагрегантная терапия (ацетилсалициловая кислота 100 мг** + клопидогрел** 75 мг) в течение 3 - 12 месяцев по схеме, рекомендованной для пациентов с поражением коронарных артерий после реваскуляризации [107].
Уровень убедительности рекомендаций C (Уровень достоверности доказательств IIa)
Комментарии: В настоящее время некоторые эксперты для улучшения отдаленных результатов и повышения отдаленной проходимости стентированных мезентериальных артерий рекомендуют проведение двойной антитромбоцитарной терапия, обосновывая ее профилактикой рестенозирования и лучшими результатами по сравнению с однокомпонентной антитромбоцитарной терапией [107].
6. Дополнительная информация, влияющая на течение и исход заболевания
Обследования, используемые для подтверждения ишемии при СКЧС
В настоящий момент наиболее информативным вариантом подтверждения ХМИ при СКЧС является тонометрия, основанная на измерении pCO2 слизистой, показатели которой не зависят от интенсивности метаболизма тканей или характеристик кровотока. Диагностические возможности метода были апробированы на различных моделях животных с модерированием стено-окклюзионного или неокклюзионного характера ишемии [108]. Измерение внутрипросветного pCO2 можно выполнить с использованием назогастрального и назоеюнального катетеров, подключенных к специально разработанному капнографу, который позволяет автоматически измерить pCO2. Появление и увеличение градиента pCO2 возникает при снижении кровотока ниже 50% от исходного потока и его последующего резкого изменения [109, 110]. Повышение уровня CO2 связано с локальным накоплением молочной кислоты (лактата) при включении анаэробного метаболизма тканей.
Как показали исследования, наилучшими диагностическим возможностями для подтверждения хронической мезентериальной ишемии обладает тонометрия, выполняемая на фоне функциональной нагрузки или пищевой пробы [111, 112]. Так, например, чувствительность и специфичность нагрузочной тонометрии составляют 76% и 92%, соответственно, для 24-часовой тонометрии эти показатели достигают 92% и 77%, соответственно [113]. Тем не менее, при очевидных диагностических преимуществах тонометрия обладает целым рядом недостатков, из которых ключевыми являются сложность и дороговизна технологии, дискомфорт, испытываемый пациентами во время исследования, длительность исследования, ошибки, возникающие при нарушении технологии измерения. Кроме того, один из основных производителей капнографов для тонометрии, использованных в большинстве исследований, прекратил их производство и обслуживание, несмотря на наличие и доступность тонометрических катетеров.
В недавнем исследовании с использованием нагрузочной желудочной тонометрии была показаны достаточно высокие диагностические возможности метода при идентификации мезентериальной ишемии у пациентов с СКЧС. Благодаря этому методу удалось отобрать для хирургического лечения пациентов и выполнить вмешательство с 83% частотой свободы от возврата симптомов в течение 39 месяцев, что говорит о высоких прогностических возможностях тонометрии [114]. В настоящее время отсутствуют данные о современных работах, проводимых с использованием техники, позволяющей измерять pCO2 слизистой у пациентов с ХМИ.
Хирургическое лечение
Как показывают данные большинства ретроспективных исследований хирургическое лечение, независимо от варианта используемой коррекции, в целом характеризуется хорошими результатами. После проведенной операции при сроках наблюдения до 30 дней симптомы СКЧС, преимущественно болевой синдром, удается купировать в среднем у 83 - 88% пациентов [25, 44, 115], причем после сосудистой реконструкции чревного ствола этот показатель может достигать 100% [91]. Тем не менее, данные разных авторов существенно различаются, что вероятно связано с отсутствием масштабных клинических исследований на больших статистических группах или проведенных мета-анализов, которые бы могли представить более достоверные цифры.
В исследованиях, где производилась оценка отдаленных результатов лечения, с увеличением сроков разница в эффективности между декомпрессивными и реконструктивными операциями становиться более существенной, но до не достигает статистически различных значений. Так при 5-летнем периоде наблюдения частота асимптомных пациентов в декомпрессионной и реконструктивной группах составила 69% и 83% соответственно [91]. К 10 году наблюдения эта разница становиться значимой, составляя 53 и 76% соответственно для декомпрессии и реконструкции чревного ствола [44].
Среди предикторов, которые могут неблагоприятно отразиться на результатах лечения, выделяют атипичный болевой синдром с периодами ремиссии, наличие в анамнезе астено-невротического состояния, психического заболевания или злоупотребления алкоголем, возраст старше 60 лет, потеря в весе менее 20 фунтов (9 кг) [44], а также рвота и боль, возникающая без провоцирующих факторов [40]. Существенным дискредитирующим фактором, снижающим эффективность лечения, является астено-невротическая или психическая девиация, встречаемая у 28% взрослых и 43% детей с СКЧС [116]. Из-за наличия вероятной нейрогенной связи СКЧС и невротических состояний, некоторые авторы рекомендуют обязательное выполнение спланхникганглионэктомии при выполнении хирургического лечения [117, 118]. В связи с этим некоторые авторы дополнительно рекомендуют проводить расширенный психиатрический/психологический анализ пациентов с СКЧС как перед операцией, так и в послеоперационном периоде, что вероятно позволит в перспективе проводить аргументированную селекцию пациентов на операцию, прогнозировать и улучшить результаты лечения [119].
7. Организация медицинской помощи
Показания для плановой госпитализации:
1) Выявленное по данным УЗДС (или другой инструментальной диагностики) гемодинамически значимое стено-окклюзионное поражение мезентериальных артерий для дообследования и определения тактики лечения;
2) Высокая вероятность поражения мезентериальных артерий у пациентов из категории скрининга (см. алгоритм диагностики и лечения);
3) Необходимость проведения инвазивной инструментальной диагностики (например, ангиографии) для уточнения гемодинамической значимости поражения;
4) Наличие показаний к хирургическому, лапароскопическому или интервенционному (комбинированному) лечению СКЧС.
Показания для экстренной госпитализации:
1) Убедительных показаний к экстренной госпитализации при СКЧС нет;
2) Осложненное течение раннего послеоперационного периода.
Показания к выписке пациента из стационара:
1) Подтверждение при ультразвуковом контроле состоятельности выполненной по поводу СКЧС реваскуляризации;
2) Купирование характерного для СКЧС болевого синдрома.
Пациентам с подозрением на СКЧС необходимо проводить диагностику и лечение в специализированных центрах с мультидисциплинарным подходом, позволяющим выполнять лапароскопическое, эндоваскулярное и хирургическое лечение.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень убедительности рекомендаций
Уровень достоверности доказательств
1
Проведен сбор анамнеза и жалоб всем пациентам с подозрением на синдром компрессии чревного ствола
C
IIa
2
Проведен визуальный осмотр всем пациентам с подозрением на синдром компрессии чревного ствола
C
IIa
3
Проведена ультразвуковая визуализирующая диагностика для верификации анатомии поражения чревного ствола и выбора тактики лечения
B
IIa
4
Проведено ультразвуковое дуплексное сканирование чревного ствола с применением дыхательных функциональных проб
B
IIa
5
Проведена КТ-ангиография/МР-ангиография с визуализацией чревного ствола для подтверждения патологии спланхнического бассейна и подтверждения/исключения другой абдоминальной патологии
C
IIa
6
Проведена реваскуляризация чревного ствола при наличии симптомов синдрома компрессии чревного ствола
C
IIa
7
Лапароскопическая или открытая декомпрессия дополнена спланхникганглионэктомией при синдроме компрессии чревного ствола
C
IIa
8
Проведена реконструкция чревного ствола с восстановлением его проходимости при выявлении органических странгуляционных изменений стенки
B
IIa
9
Проведено эндоваскулярное лечение при возврате симптомов синдрома компрессии чревного ствола или выявлении рестеноза чревного ствола после ранее выполненной декомпрессии
C
IIa
10
Проведено открытое реконструктивное хирургическое лечение при неудаче лапароскопической или эндоваскулярной коррекции синдрома компрессии чревного ствола
C
IIb
11
Проведена антиагрегантная терапия после открытой хирургической реваскуляризации, выполненной по поводу синдрома компрессии чревного ствола
B
IIa
12
Проведена двойная антиагрегантная терапия после эндоваскулярного стентирования, выполненного по поводу синдрома компрессии чревного ствола
C
IIa
Список литературы
1. Lindner, H.H. A clinicoanatomical study of the arcuate ligament of the diaphragm/H.H. Lindner, E. Kemprud//Arch. Surg. - 1971. - vol. 103. - p. 600 - 605
2. Gloviczki, P. and Duncan, A.A. Treatment of celiac artery compression syndrome: does it really exist? Perspect Vasc Surg Endovasc Ther. 2007; 19: 259 - 263,
3. Curl, J.H., Thompson, N.W., and Stanley, J.C. Median arcuate ligament compression of the celiac and superior mesenteric arteries. Ann Surg. 1971; 173: 314 - 320
4. Reuter, S.R. The anatomic basis for respiratory variation in median arcuate ligament compression of the celiac artery/S.R. Reuter, E.F. Bernstein//Surgery. - 1973. - vol. 73. - p. 381 - 385
5. Reuter, S.R. Accentuation of celiac compression by the median arcuate ligament of the diaphragm during deep expiration/S.R. Reuter//Radiology. - 1971. - vol. 98. - p. 561 - 564
6. Poole, J.W. Hemodynamic basis of the pain of chronic mesenteric ischemia/J.W. Poole, B.S. Sam Martano, S.J. Boley//Am. J. Surg. - 1987. - vol. 153. - p. 171
7. Aburahma, A.F. A case study of abdominal angina secondary to celiac compression syndrome/A.F. Aburahma//West V. Med. J. - 1995. - vol. 91. - p. 10 - 12
8. De Cecchis, L. Sindrome di Dunbar: realta clinica o ipotesi fisiopatologica?/L. De Cecchis, A. Risaliti, G. Anania, A. Donini, G. Terrosu, N. Cautero, C. Cedolini//Ann. Ital. Chir. - 1996. - vol. 67. - p. 501 - 505
9. Гавриленко, А.В. Диагностика и лечение хронической абдоминальной ишемии/А.В. Гавриленко, А.Н. Косенков. - М.: Грааль, 2000. - 170 с
10. Jamieson, C.W. Coeliac axis compression syndrome/C.W. Jamieson//Br. Med. J. - 1986. - vol. 293. - p. 159 - 160
11. Van Gossun, M. Syndrome de compression isolee du tronc coeliaque (SCITC). A propos de 8 cases/M. Van Gossun, J. Morobe, A. Van Laethem, A. Burette, J. Somerhausen, J. Schockert//Acta Chir. Belg. - 1984. - vol. 84. - p. 379 - 383
12. Kopecky, K.K. Median arcuate ligament syndrome with multivessel involvement: diagnosis with spiral CT angiography/K.K. Kopecky, S.B. Stine, M.C. Dalsing, K. Gottlieb//Abdom. Imaging. - 1997. - vol. 22. - p. 318 - 320
13. Bech, FR. Celiac artery compression syndromes/F.R. Bech//Surg. Clin. North. Am. - 1997. - vol. 77. - p. 409 - 424
14. Horton, K.M., Talamini, M.A., and Fishman, E.K. Median arcuate ligament syndrome: evaluation with CT angiography. RadioGraphics. 2005; 25: 1177 - 1182
15. Lee, V.S., Morgan, J.N., Tan, A.G. et al. Celiac artery compression by the median arcuate ligament: a pitfall of end-expiratory MR imaging. Radiology. 2003; 228: 437 - 442
16. Desmond, C.P. Exercise-related abdominal pain as a manifestation of the median arcuate ligament syndrome/C.P. Desmond//Scand. J. Gastroenterol. - 2004. - vol. 39. - p. 1310 - 1313
17. Bron, K.M. and Redman, H.C. Splanchnic artery stenosis and occlusion: incidence, arteriographic, and clinical manifestations. Radiology. 1969; 92: 323 - 328
18. Cornell, S.H. Severe stenosis of celiac axis: analysis of patients with and without symptoms. Radiology. 1971; 99: 311 - 316
19. Tribble, C.G. Celiac artery compression syndrome: report of a case and review of the literature/C.G. Tribble//Vasc. Surg. - 1986. - vol. 20. - p. 120 - 129
20. Saleem T, Baril DT. Celiac Artery Compression Syndrome. [Updated 2017 Dec 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing
21. Petrella, s. & Prates J. C, Celiac trunk compression syndrome A review. Int. J. Morphol., 24(3): 429 2006. - 436
22. Cusati, D.A. Median arcuate ligament syndrome: a 20-year experience of surgical treatment / D.A. Cusati // Presented at the Annual Meeting of the Society for Vascular Surgery - Philadelphia, PA.: June 1 - 4, 2006
23. Lee, M.J. CT-guided celiac ganglion block with alcohol./M.J. Lee//Am. J. Roentgenol. - 1993. - vol. 161. - p. 633 - 636
24. Balaban, D.H. Median arcuate ligament syndrome: a possible cause of idiopathic gastroparesis/D.H. Balaban//Am. J. Gastroenterol. - 1997. - vol. 92. - p. 519 - 523
25. Jimenez JC, Harlander-Locke M, Dutson EP. Open and laparoscopic treatment of median arcuate ligament syndrome. J Vasc Surg. 2012; 56: 869 - 873
26. Plate G, ![]() B, Vang J. The celiac compression syndrome: myth or reality? Acta Chir Scand. 1981; 147: 201-3
B, Vang J. The celiac compression syndrome: myth or reality? Acta Chir Scand. 1981; 147: 201-3
27. Levin DC, Baltaxe HA. High incidence of celiac axis narrowing in asymptomatic inpiduals. Am J Roentgenol Radium Ther Nucl Med 1972; 116: 426 - 429
28. Park, C.M., Chung, J.W., Kim, H.B. et al. Celiac axis stenosis: incidence and etiologies in asymptomatic inpiduals. Korean J Radiol. 2001; 2: 8 - 13
29.  H.,
H.,  , M.,
, M.,  , G. et al. Clinical and multidetector computed tomography findings of patients with median arcuate ligament syndrome. Clin Imaging. 2012; 36: 522 - 525
, G. et al. Clinical and multidetector computed tomography findings of patients with median arcuate ligament syndrome. Clin Imaging. 2012; 36: 522 - 525
30. ![]() , A.T., Kocaoglu, M., Bilici, A. et al. Median arcuate ligament syndrome: multidetector computed tomography findings. J Comput Assist Tomogr. 2007; 31: 728 - 731
, A.T., Kocaoglu, M., Bilici, A. et al. Median arcuate ligament syndrome: multidetector computed tomography findings. J Comput Assist Tomogr. 2007; 31: 728 - 731
31. Rongies-Kosmol M, Jakimowicz T. Celiac artery compression syndrome. Mini-review. Acta Angiol 2015; 21: 21 - 4
32. Foertsch T, Koch A, Singer H, Lang W. Celiac trunk compression syndrome requiring surgery in 3 adolescent patients. J Pediatr Surg. 2007; 42(4): 709 - 13
33. Bergqvist, D. Celiac artery compression syndrome/D. Bergqvist//In: Geroulakos G., Cherry K.J., editors. Diseases of the visceral circulation. - London., 2002. - p. 80 - 87
34. Grotemeyer D, Duran M, Iskandar F, Blondin D, Nguyen K, Sandmann W (2009) Median arcuate ligament syndrome: vascular surgical therapy and follow-up of 18 patients. Langenbecks Arch Surg; 394: 1085 - 1092
35. Mak GZ, Speaker Ch, Anderson K et al (2013) Median arcuate ligament syndrome in pediatric population. J Pediatr Surg; 48: 2261 - 2270
36. Tulloch AW, Jimenez JC, Lawrence PF et al (2010) Laparoscopic versus open celiac ganglionectomy in patients with median arcuate ligament syndrome. J Vasc Surg 52: 1283 - 1289
37. Bech, F., Loesberg, A., Rosenblum, J. et al. Median arcuate ligament compression in monozygotic twins. J Vasc Surg. 1994; 19: 934 - 938
38. Dsaid SM, Zarroug AE, Gloviczki P, Shields RC (2010) Pediatric median arcuate ligament syndrome: first report of familial pattern and transperitoneal laparoscopic release. J Pediatr Surg; 45: E17 - E20
39. Joyce DD, Antiel RM, Oderich G, Gloviczki P, Tung J, Grothe R, et al. Pediatric median arcuate ligament syndrome: Surgical outcomes and quality of life. J Laparoendosc Adv Surg Tech A. 2014; 24: 104 - 10
40. Ho, Kelvin Kam Fai et al. Outcome predictors in median arcuate ligament syndrome. Journal of Vascular Surgery 2017, Volume 65, Issue 6, 1745 - 1752
41. Roseborough, G.S. Laparoscopic management of celiac artery compression syndrome. J Vasc Surg. 2009; 50: 124 - 133
42. Williams, S., Gillespie, P., and Little, J.M. Celiac axis compression syndrome: factors predicting a favorable outcome. Surgery. 1985; 98: 879 - 887
43. Berard, X., Cau, J., Deglise, S., Trombert, D., Saint-Lebes, B., Midy, D. et al. Laparoscopic surgery for coeliac artery compression syndrome: current management and technical aspects. Eur J Vasc Endovasc Surg. 2012; 43: 38 - 42
44. Reilly, L.M., Ammar, A.D., Stoney, R.J., and Ehrenfeld, W.K. Late results following operative repair for celiac artery compression syndrome. J Vasc Surg. 1985; 2: 79 - 91
45. Katsura M, Gushimiyagi M, Takara H, Mototake H. True aneurysm of the pancreaticoduodenal arteries: a single institution experience. J Gastrointest Surg 2010; 14: 1409 - 1413
46. Mano Y, Takehara Y, Sakaguchi T, et al. Hemodynamic assessment of celiaco-mesenteric anastomosis in patients with pancreaticoduodenal artery aneurysm concomitant with celiac artery occlusion using flow-sensitive four-dimensional magnetic resonance imaging. Eur J Vasc Endovasc Surg 2013; 46: 321 - 328
47. Покровский А.В., Казанчян П.О., Дюжиков А.А. Диагностика и лечение хронической ишемии органов пищеварения. Ростов н/Д: Изд-во Рост. ун-та 1982
48. Кохан Е.П., Белякин С.А., Мироненко Д.А. О классификации хронической абдоминальной ишемии. Кардиология и сердечно-сосудистая хирургия. 2014. Т. 7. N 2. С. 10 - 14
49. Спиридонов А.А., Клионер Л.И. Хроническая ишемия органов пищеварения. В кн.: Бураковский В.И., Бокерия Л.А. (ред.). Сердечно-сосудистая хирургия: Руководство. М: Медицина 1996: 681 - 688
50. Лазебник Л.Б., Звенигородская Л.А. Хроническая ишемическая болезнь органов пищеварения. М: Анахарсис 2003. 136 с
51. Loukas, M., Pinyard, J., Vaid, S. et al. Clinical anatomy of celiac artery compression syndrome: a review. Clin Anat. 2007; 20: 612 - 617.
52. Al-zoubi, Nabil & Hamouri, Shadi & Hijazi, Emad. (2017). Prevalence of incidental celiac artery compression caused by median arcuate ligament among patients with peripheral arterial disease. Italian Journal of Vascular and Endovascular Surgery. 24. 47 - 9.
53. Boley, S.J., Brandt, L.U., and Veith, F.J. Ischemic disorders of the intestine. Curr Probl Surg. 1978; 15: 1 - 85
54. Baskan, Ozdil et al. Compression of the Celiac Artery by the Median Arcuate Ligament: Multidetector Computed Tomography Findings and Characteristics Canadian Association of Radiologists Journal 2015, Volume 66, Issue 3, 272 - 276
55. Kim EN, Lamb K, Relles D, Moudgill N, DiMuzio PJ, Eisenberg JA. Median arcuate ligament syndrome-review of this rare disease. JAMA Surgery 2016; 151: 471 - 477
56. Chou SQH, Kwok KY, Wong LS, Fung DHS, Wong WK. Imaging features of median arcuate ligament syndrome. Journal of the Hong Kong College of Radiologists. 2010; 13(2): 101 - 103
57. Herbert GS, Steele SR. Acute and chronic mesenteric ischemia. Surg Clin North Am 2007; 87: 1115 - 34
58. Stein JJ, Costanza MJ, Rivero M, et al. External compression of the superior mesenteric artery by the median arcuate ligament. Vasc Endovascular Surg 2011; 45 (6): 565 - 7
59. Barret M., Martineau C., Rahmi G., Pellerin O., Sapoval M., Alsac JM., Fabiani JN., Malamut G., Samaha E., Cellier C. Chronic Mesenteric Ischemia: A Rare Cause of Chronic Abdominal Pain. Am J Med. 2015 Dec; 128 (12): 1363. e1 - 8
60. Lejay, A., Georg, Y., Tartaglia, E., Creton, O., Lucereau, B., Thaveau, F., ![]() , B., & Chakfe, N. (2015). Chronic mesenteric ischemia: 20 year experience of open surgical treatment. European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery, 49 5, 587 - 92.
, B., & Chakfe, N. (2015). Chronic mesenteric ischemia: 20 year experience of open surgical treatment. European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery, 49 5, 587 - 92.
61. Ghulam, Qasam M. et al. Median Arcuate Ligament Syndrome European Journal of Vascular and Endovascular Surgery 2016, Volume 51, Issue 3, e15 - e16.
62. Wolfman D, Bluth EI, Sossaman J. Median arcuate ligament syndrome. J Ultrasound Med 2003; 22: 1377 - 80
63. Tembey RA, Bajaj AS, Wagle PK, Ansari AS. Real-time ultrasound: key factor in identifying celiac artery compression syndrome. Indian J Radiol Imaging. 2015; 25: 202 - 205
64. Toksoy G, Ozdogan O, Mahmutoglu AS, Karpat Z. Ultrasonographic diagnosis of median arcuate ligament syndrome: A report of two cases. Med Ultrason 2012; 14: 154 - 7
65. Gruber H, Loizides A, Peer S, Gruber I. Ultrasound of the median arcuate ligament syndrome: A new approach to diagnosis. Med Ultrason 2012; 14: 5 - 9
66. Zwolak, R.M., Fillinger, M.F., Walsh, D.B., LaBombard, F.E., Musson, A., Darling, C.E. et al. Mesenteric and celiac duplex scanning: a validation study. J Vasc Surg. 1998; 27: 1078 - 1087
67. Moneta, G.L., Lee, R.W., Yeager, R.A., Taylor, L.M. Jr., and Porter, J.M. Mesenteric duplex scanning: a blinded prospective study. J Vasc Surg. 1993; 17: 79 - 84
68. AbuRahma, A.F., Stone, P.A., Srivastava, M., Dean, L.S., Keiffer, T., Hass, S.M. et al. Mesenteric/celiac duplex ultrasound interpretation criteria revisited. J J Vasc Surg. 2012; 55: 428 - 436
69. Van Petersen, A.S., Meerwaldt, R., Kolkman, J.J., Huisman, A.B., van der Palen, J., van Bockel, J.H. et al. The influence of respiration on criteria for transabdominal duplex examination of the splanchnic arteries in patients with suspected chronic splanchnic ischemia. J Vasc Surg. 2013; 57: 1603 - 1611
70. Dalag, L et al. Comparing CT angiography with Doppler ultrasound evaluation in the diagnosis of median arcuate ligament syndrome. Journal of Vascular and Interventional Radiology 2017, Volume 28, Issue 2, S195
71. A-Cienfuegos J, Rotellar F, Valenti V, Arredondo J, Pedano N, Bueno A, Vivas I. The celiac axis compression syndrome (CACS): critical review in the laparoscopic era. Rev Esp Enferm Dig 2010; 102(3): 193 - 201
72. Dias, N.V., Acosta, S., Resch, T., Sonesson, B., Alhadad, A., Malina, M. et al. Mid-term outcome of endovascular revascularization for chronic mesenteric ischaemia. Br J Surg. 2010; 97: 195 - 201
73. Landis, M.S., Rajan, D.K., Simons, M.E., Hayeems, E.B., Kachura, J.R., and Sniderman, K.W. Percutaneous management of chronic mesenteric ischemia: outcomes after intervention. J Vasc Intervent Radiol. 2005; 16: 1319 - 1325
74. FH Ng, OK Wai, AW Wong, SM Yu Median arcuate ligament syndrome. Hong Kong Med J, 22: 2016
75. Enterline, J., Moser, K., Hulse, M. et al. Single injection, inspiratory/expiratory high-pitch dual-source CT angiography for median arcuate ligament syndrome: novel technique for a classic diagnosis. J Cardiovasc Comput Tomogr. 2012; 6: 357 - 359
76. Aschenbach, ![]() et al. Compression of the Celiac Trunk Caused by Median Arcuate Ligament in Children and Adolescent Subjects: Evaluation with Contrast-enhanced MR Angiography and Comparison with Doppler US Evaluation Journal of Vascular and Interventional Radiology, Volume 22, Issue 4, 556 - 561
et al. Compression of the Celiac Trunk Caused by Median Arcuate Ligament in Children and Adolescent Subjects: Evaluation with Contrast-enhanced MR Angiography and Comparison with Doppler US Evaluation Journal of Vascular and Interventional Radiology, Volume 22, Issue 4, 556 - 561
77. Meaney JF, Prince MR, Nostrant TT, Stanley JC. Gadoliniumenhanced MR angiography of visceral arteries in patients with suspected chronic mesenteric ischemia. J Magn Reson Imaging 1997; 7(1): 171 - 176
78. Laissy JP, Trillaud H, Douek P. MR angiography: noninvasive vascular imaging of the abdomen. Abdom Imaging 2002; 27(5): 488 - 506
79. Dordoni L, Tshomba Y, Giacomelli M, Jannello AM, Chiesa R. Celiac artery compression syndrome: Successful laparoscopic treatment: A case report. Vasc Endovascular Surg 2002; 36: 317 - 21
80. Chou JP, Stemmer EA, Connolly JE. Median arcuate ligament syndrome. Experimental and clinical observations. Arch Surg. 99(4): 441 - 446, 1969
81. J. W. Chou, C. M. Lin, C. L. Feng, C. F. Ting, K. S. Cheng, and Y. F. Chen, "Celiac artery compression syndrome: an experience in a single institution in Taiwan," Gastroenterology Research and Practice, vol. 2012, Article ID 935721, 6 pages, 2012
82. Ogino H, Sato Y, Banno T, Arakawa T, Hara M. Embolization in a patient with ruptured anterior inferior pancreaticoduodenal arterial aneurysm with median arcuate ligament syndrome. Cardiovasc Intervent Radiol 2002; 25: 318 - 9
83. Geelkerken RH, van Bockel JH, de Roos WK, Hermans J. Coeliac artery compression syndrome: the effect of decompression. Br J Surg; 77: 807. 1990
84. Harjola, P.T. &Lahtiharju, A.Celiac axis syndrome. Abdominal angina caused by external compression of the celiac artery. Am. J. Surg., 115: 864 - 9, 1968
85. Baccari, P. Civilini, E. Dordoni L., Melissano, G. Nicoletti, R. and Chiesa, R. "Celiac artery compression syndrome managed by laparoscopy," Journal of Vascular Surgery, vol. 50, no. 1, pp. 134 - 139, 2009
86. El-Hayek KM, Titus J, Bui A, Mastracci T, Kroh M. Laparoscopic median arcuate ligament release: are we improving symptoms? J Am Coll Surg 2013; 216: 272 - 9
87. Aschenbach R, Basche S, Vogl TJ. Compression of the celiac trunk caused by median arcuate ligament in children and adolescent subjects: evaluation with contrast-enhanced MR angiography and comparison with Doppler US evaluation. J Vasc Interv Radiol 2011; 22: 556 - 61
88. Jaik NP, Stawicki SP, Weger NS, Lukaszczyk JJ: Celiac artery compression syndrome: successful utilization of robotic-assisted laparoscopic approach. Journal of gastrointestinal and liver diseases: JGLD 2007, 16(1): 93 - 96
89. Aspacher F, Vogel P. Laparoscopic, minimally invasive techniques in vascular surgery: Dunbar's syndrome (coeliac trunk compression syndrome) as an example. Zentralblatt fur Chirurgie 2009, 134(4): 357 - 361
90. Roayaie S, Jossart G, Gitlitz D, Lamparello P, Hollier L, Gagner M: Laparoscopic release of celiac artery compression syndrome facilitated by laparoscopic ultrasound scanning to confirm restoration of flow. Journal of vascular surgery 2000, 32(4): 814 - 817
91. Duran M, Simon F, Ertas N, Schelzig H, Floros N. Open vascular treatment of median arcuate ligament syndrome. BMC Surg. 2017; 17(1): 95
92. Sultan, S., Hynes, N., Elsafty, N., & Tawfick, W. (2013). Eight Years Experience in the Management of Median Arcuate Ligament Syndrome by Decompression, Celiac Ganglion Sympathectomy, and Selective Revascularization. Vascular and Endovascular Surgery, 47(8), 614 - 619
93. Delis KT, Gloviczki P, Altuwaijri M, McKusick MA. Median arcuate ligament syndrome: open celiac artery reconstruction and ligament pision after endovascular failure. J Vasc Surg. 2007; 46: 799 - 802
94. Matsumoto, A.H., Tegtmeyer, C.J., Fitzcharles, E.K., Selby, J.B. Jr, Tribble, C.G., Angle, J.F. et al. Percutaneous transluminal angioplasty of visceral arterial stenoses: results and long-term clinical follow-up. J Vasc Interv Radiol. 1995; 6: 165 - 174
95. Cina, C.S. and Safar, H. Successful treatment of recurrent celiac axis compression syndrome (A case report). Panminerva Med. 2002; 44: 69 - 72
96. Tracci, M. C. Median Arcuate Ligament Compression of the Mesenteric Vasculature. Techniques in Vascular & Interventional Radiology, Volume 18, Issue 1, 43 - 50
97. Rongies-Kosmol, M., Jakimowicz T. (2015). Celiac artery compression syndrome. Mini-review. Acta Angiologica. 21. 21 - 24
98. Palmer, O., Tedesco, M.M., Casey, K.M., Lee, J.T., & Poultsides, G.A. (2011). Hybrid Treatment of Celiac Artery Compression (Median Arcuate Ligament) Syndrome. Digestive Diseases and Sciences, 57, 1782 - 1785
99. Michalik M,  N, Lech P, Majda K, Gutowski P. Hybrid (laparoscopy + stent) treatment of celiac trunk compression syndrome (Dunbar syndrome, median arcuate ligament syndrome (MALS)). Wideochir Inne Tech Maloinwazyjne. 2016; 11(4): 236 - 239
N, Lech P, Majda K, Gutowski P. Hybrid (laparoscopy + stent) treatment of celiac trunk compression syndrome (Dunbar syndrome, median arcuate ligament syndrome (MALS)). Wideochir Inne Tech Maloinwazyjne. 2016; 11(4): 236 - 239
100. Columbo JA, Trus T, Nolan B, et al. Contemporary management of median arcuate ligament syndrome provides early symptom improvement. J Vasc Surg. 2015; 62(1): 151 - 6
101. Oderich, G.S., Erdoes, L.S., Lesar, C., Mendes, B.C., Gloviczki, P., Cha, S. et al. Comparison of covered stents versus bare metal stents for treatment of chronic atherosclerotic mesenteric arterial disease. J Vasc Surg. 2013; 58: 1316 - 1323
102. Рыбка М.М., Хинчагов Д.Я. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения кардиохирургических операций, выполняемых при ишемической болезни сердца, патологии клапанного аппарата, нарушениях ритма, гипертрофической кардиомиопатии, аневризмах восходящего отдела аорты у пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2015.
103. Рыбка М.М., Хинчагов Д.Я., Мумладзе К.В., Никулкина Е.С. Под ред. Л.А. Бокерия. Протоколы анестезиологического обеспечения рентгенэндоваскулярных и диагностических процедур, выполняемых у кардиохирургических пациентов различных возрастных групп. Методические рекомендации. М.: НЦССХ им. А.Н. Бакулева РАМН; 2018.
104. Бунятян А.А., Анестезиология: национальное руководство [Электронный ресурс]/под ред. А.А. Бунятяна, В.М. Мизикова - М.: ГЭОТАР-Медиа, 2017. - 656 с. - ISBN 978-5-9704-3953-1 - Режим доступа: http://www.rosmedlib.ru/book/ISBN9785970439531.html, стр 578 - 625
105. Stroke, O., Tendera, M., Aboyans, V., Bartelink, M.L., Baumgartner, I., Clement, D. et al. ESC guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2011; 32: 2851 - 2906
106. Baker, A.C., Chew, V., Li, C.S., Lin, T.C., Dawson, D.L., Pevec, W.C. et al. Application of duplex ultrasound imaging in determining in-stent stenosis during surveillance after mesenteric artery revascularization. J Vasc Surg. 2012; 56: 1364 - 1371 (discussion 71)
107. Gustavo S. Oderich, MD, Tiziano Tallarita, MD, Peter Gloviczki, MD, Audra A. Duncan, MD, Manju Kalra, MBBS, Sanjay Misra, MD, Stephen Cha, MS, and Thomas C. Bower, MD. Mesenteric artery complications during angioplasty and stent placement for atherosclerotic chronic mesenteric ischemia. J Vasc Surg. 2012 Apr; 55(4): 1063 - 1071
108. Groeneveld, A.B. and Kolkman, J.J. Splanchnic tonometry: a review of physiology, methodology, and clinical applications. J Crit Care. 1994; 9: 198 - 210
109. Knichwitz, G., Rotker, J., Mollhoff, T., Richter, K.D., and Brussel, T. Continuous intramucosal PCO2 measurement allows the early detection of intestinal malperfusion. Crit Care Med. 1998; 26: 1550 - 1557
110. Otte, J.A., Oostveen, E., Geelkerken, R.H., Groeneveld, A.B., and Kolkman, J.J. Exercise induces gastric ischemia in healthy volunteers: a tonometry study. J Appl Physiol (1985). 2001; 91: 866 - 871
111. Mensink, P.B., van Petersen, A.S., Geelkerken, R.H., Otte, J.A., Huisman, A.B., and Kolkman, J.J. Clinical significance of splanchnic artery stenosis. Br J Surg. 2006; 93: 1377 - 1382
112. Otte, J.A., Geelkerken, R.H., Oostveen, E., Mensink, P.B., Huisman, A.B., and Kolkman, J.J. Clinical impact of gastric exercise tonometry on diagnosis and management of chronic gastrointestinal ischemia. Clin Gastroenterol Hepatol. 2005; 3: 660 - 666
113. Sana, A., Vergouwe, Y., van Noord, D., Moons, L.M., Pattynama, P.M., Verhagen, H.J. et al. Radiological imaging and gastrointestinal tonometry add value in diagnosis of chronic gastrointestinal ischemia. Clin Gastroenterol Hepatol. 2011; 9: 234 - 241
114. Mensink, P.B.F., van Petersen, A.S., Kolkman, J., Otte, J.A., Huisman, A.B., and Geelkerken, R.H. Gastric exercise tonometry: the key investigation in patients with suspected celiac artery compression syndrome. J Vasc Surg. 2006; 44: 277 - 281
115. Evans W. E. Long term evaluation of the celiac band syndrome. Surgery 1974, vol. 76, no. 6, pp. 867 - 871
116. Mak, G.Z., Lucchetti, A.R., Drossos, T., Fitzsimmons-Craft, E.E., Accurso, E.C., Stiles-Shields, C. et al. Pediatric chronic abdominal pain and median arcuate ligament syndrome: a review and psychosocial comparison. Pediatr Ann. 2016; 45: e257 - e264
117. Watson, W.C. Coeliac-axis compression. Lancet. 1977; 2: 561 - 562
118. Ghosn, P.B., Rabbat, A.G., Trudel, J., D"Amico, P., Lecours, R., and Trudel, J. Celiac compression syndrome. Can J Surg. 1982; 25: 377 - 379
119. Skelly C.L., Stiles-Shields C., Mak G.Z., Speaker C.R., Lorenz J., Anitescu M., Dickerson D.M., Drossos T. The impact of psychiatric comorbidities on patient-reported surgical outcomes in adults treated for the median arcuate ligament syndrome. Journal of Vascular Surgery 2018, 68 (5), pp. 1414 - 1421
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Академик РАН Л.А. Бокерия - Ассоциация сердечно-сосудистых хирургов России
2. Академик РАН А.В. Покровский - Ассоциация сердечно-сосудистых хирургов России
3. проф. В.С. Аракелян (Москва) - Ассоциация сердечно-сосудистых хирургов России
4. член-корреспондент РАН Л.С. Коков (Москва) - Ассоциация сердечно-сосудистых хирургов России
5. к.м.н. Р.Г. Букацелло (Москва) - Ассоциация сердечно-сосудистых хирургов России
6. проф. С.А. Абугов (Москва) - Ассоциация сердечно-сосудистых хирургов России
7. академик РАН Ю.В. Белов (Москва) - Ассоциация сердечно-сосудистых хирургов России
8. д.м.н. Д.Ф. Белоярцев (Москва) - Ассоциация сердечно-сосудистых хирургов России
9. проф. А.Н. Вачев (Самара) - Ассоциация сердечно-сосудистых хирургов России
10. академик РАН А.В. Гавриленко А.В. (Москва) - Ассоциация сердечно-сосудистых хирургов России
11. проф. А.А. Дюжиков (Ростов-на-Дону) - Ассоциация сердечно-сосудистых хирургов России
12. д.м.н. И.А. Ерошкин (Москва) - Ассоциация сердечно-сосудистых хирургов России
13. академик РАН И.И. Затевахин (Москва) - Ассоциация сердечно-сосудистых хирургов России
14. академик РАН Д.Г. Иоселиани (Москва) - Ассоциация сердечно-сосудистых хирургов России
15. проф. З.А. Кавтеладзе (Москва) - Ассоциация сердечно-сосудистых хирургов России
16. проф. Ю.И. Казаков (Тверь) - Ассоциация сердечно-сосудистых хирургов России
17. проф. А.А. Карпенко (Новосибирск) - Ассоциация сердечно-сосудистых хирургов России
18. проф. И.И. Кательницкий (Ростов-на-Дону) - Ассоциация сердечно-сосудистых хирургов России
19. д.м.н. А.В. Максимов (Казань) - Ассоциация сердечно-сосудистых хирургов России
20. проф. Г.Ю. Сокуренко (Санкт-Петербург) - Ассоциация сердечно-сосудистых хирургов России
21. проф. В.В. Сорока (Санкт-Петербург) - Ассоциация сердечно-сосудистых хирургов России
22. д.м.н. И.Е. Тимина (Москва) - Ассоциация сердечно-сосудистых хирургов России
23. проф. А.В. Троицкий (Москва) - Ассоциация сердечно-сосудистых хирургов России
24. к.м.н. А.Ф. Харазов (Москва) - Ассоциация сердечно-сосудистых хирургов России
25. проф. В.Н. Шиповский (Москва) - Ассоциация сердечно-сосудистых хирургов России
26. проф. А.А. Фокин (Челябинск) - Ассоциация сердечно-сосудистых хирургов России
27. член-корреспондент РАН Э.Р. Чарчян (Москва) - Ассоциация сердечно-сосудистых хирургов России
28. проф. А.М. Чернявкий (Новосибирск) - Ассоциация сердечно-сосудистых хирургов России
29. проф. А.В. Чупин (Москва) - Ассоциация сердечно-сосудистых хирургов России
Все члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов, о которых необходимо сообщить.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория разработанных клинических рекомендаций:
1. Врач - сердечно-сосудистый хирург
2. Врач-хирург
3. Врач ультразвуковой диагностики
4. Врач-радиолог
5. Врач по рентгенэндоваскулярным диагностике и лечению
6. Врач-онколог
7. Врач-гастроэнтеролог
8. Врач-эндоскопист
9. Врач-кардиолог
Таблица П1. Уровни убедительности рекомендаций
Уровень убедительности рекомендаций
Описание
Уровень I
Процедура или лечение являются полезными/эффективными, они должны быть выполнены/назначены.
Уровень II
Уровень IIa
Процедура или лечение с большой долей вероятности являются полезными/эффективными, их разумно было бы выполнить/назначить.
Уровень IIb
Противоречивые доказательства о пользе/эффективности процедуры или лечения, их выполнение/назначение может быть рассмотрено.
Уровень III
Процедура или лечение являются вредными/неэффективными, они не должны выполняться/назначаться.
Таблица П2. Уровни достоверности доказательств
Уровень достоверности доказательств
Описание
Уровень A
Мета-анализы, систематические обзоры, рандомизированные контролируемые исследования
Уровень B
Когортные исследования, исследования "случай-контроль", исследования с историческим контролем, ретроспективные исследования, исследования серии случаев.
Уровень C
Мнение экспертов
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
1. Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Министерства здравоохранения РФ от 15.11.2012 г. N 918н)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Алгоритм ведения пациентов с СКЧС
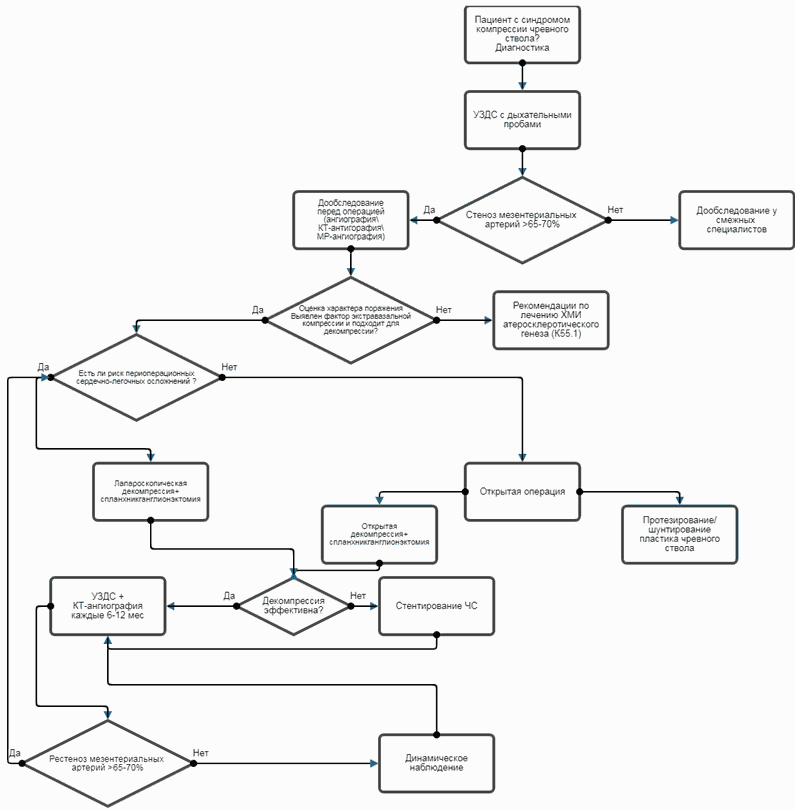
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Уважаемый пациент!
Результаты обследования выявили у Вас заболевание артерий, кровоснабжающих органы пищеварения и ЖКТ, которое нужно лечить оперативно. Перед запланированным вмешательством ваш лечащий врач объяснит вам суть и возможности операции. Вы должны, зная о возможном риске, добровольно решиться на операцию. Данная информация должна помочь вам подготовиться к встрече с врачом.
Что такое синдром компрессии чревного ствола?
Синдром компрессии чревного ствола - это сосудистое заболевание, при котором происходит внесосудистое сдавливающее поражение крупной магистральной артерии - чревного ствола (ЧС), обеспечивающего кровоснабжение верхних отделов ЖКТ. При этой патологии внешнее воздействие различных анатомических факторов (чаще сухожильно-мышечного аппарата диафрагмы и элементов солнечного нервного сплетения) приводит к нарушению просвета чревного ствола и следующего за этим сокращению кровоснабжения органов пищеварения. Кроме того, постоянное раздражение чревного ствола атипично расположенной диафрагмой приводит к постоянному раздражению солнечного сплетения и сосудистому спазму. Такие нарушения приводят к выраженному обеднению кровоснабжения таких важных органов пищеварения как печень, поджелудочная железа, желудок, начальные отделы тонкой кишки, следствием чего становятся их дегенеративные изменения.
Что может произойти без лечения?
Течение заболевания может быть весьма различным, нередко достаточно драматичным. Постоянное нарушение кровоснабжения органов пищеварения, иначе говоря длительное их нахождение в состоянии ишемии, может привести к выраженным дистрофическим процессам как этих органов, так и организма в целом, восстановить которое лекарственным путем не представляется возможным. Не купирующийся медикаментозной терапией болевой абдоминальный синдром может принять характер необратимого, существенно подрывая не только здоровье, но и качество жизни и трудоспособность пациента. Кроме того, длительное сохранение болей в животе может стать причиной астено-невротического, астено-депрессивного состояния и психической дисфункции. При отсутствии лечения сохраняется высокая вероятность формирования аневризм артерий, кровоснабжающих кишечник и склонных к разрывам с массивным внутренним кровотечением, при котором летальность может достигать 30 - 50%.
Операция при СКЧС у подавляющего большинства пациентов устраняет симптомы ишемии, восстанавливает проходимость чревного ствола и функцию органов пищеварения, позволяют вернуться к нормальному образу жизни и избежать перечисленных неблагоприятных осложнений.
Как проводится операция?
Открытое или лапароскопическое оперативное вмешательство проходит под наркозом. Риски анестезии вам детально объяснит врач-анестезиолог. Эндоваскулярное стентирование выполняется под местной анестезией.
Существуют различные виды операций:
- Открытая хирургическая декомпрессия
- Лапароскопическая декомпрессия
- Шунтирование сосудов;
- Протезирование сосудов;
- Пластика артерий;
- Эндоваскулярное стентирование.
Целью всех операций является восстановление проходимости артерий, пуск кровотока по сосудистой системе ЖКТ и устранение болевого синдрома.
Вместе с лечащим врачом накануне операции необходимо обсудить преимущества и особенности каждого из вариантов лечения, возможные осложнения, результаты и перспективы последующей реабилитации.
Врач обсуждает с вами этапы оперативного вмешательства, однако во время операции может возникнуть необходимости в проведении дополнительных незапланированных этапов. На это также должно быть получено ваше согласие, в противном случае, операция не будет выполнена. Повторная операция будет проводиться после дополнительного обсуждения с вами, поскольку она может увеличить сроки лечения и повысит вероятность опасных осложнений и неблагоприятного исхода.
Какие могут быть осложнения?
В отдельных случаях при тяжелых операциях могут возникать осложнения.
Общие осложнения:
- Послеоперационные кровотечения, крупные гематомы;
- Инфекционные осложнения. Возникает нагноение раны, которое требует дальнейших лечебных мероприятий. При этом раны заживают долго, с образованием келоидных рубцов;
- Образование тромбов в венах с возможной эмболией легочных артерий. При повышенном риске вы будете получать медикаментозные препараты с профилактической целью, которые понижают свертываемость крови. При применении этих препаратов может повыситься склонность к кровотечениям. При инъекции этих препаратов, так же, как и при инъекции любых других, в единичных случаях могут возникать абсцессы;
- Сдавление нервов и мягких тканей из-за необходимого при операции длительного неподвижного положения тела. Эти осложнения встречаются очень редко и, как правило, проходят в течение недели. В отдельных случаях могут оставаться жалобы (например, чувство онемения) и рубцы. Также может встречаться поражение кожи дезинфектантами;
- Переливание крови или компонентов крови, которое может потребоваться при определенных обстоятельствах. Крайне редко может возникнуть заражение (например, вирусами гепатита, ВИЧ/СПИД);
- Реакции гиперчувствительности (аллергии) на медикаменты, средства для наркоза и рентгенологического исследования, которые могут проявляться, например, зудом. Крайне редко встречаются сильно выраженные реакции, такие как коллапс, судороги и нарушение дыхания, которые требуют стационарного лечения и могут приводить к необратимым последствиям;
- Избыточное рубцевание. При соответствующей предрасположенности могут, как и при другой операции, возникать толстые бугристые и/или болезненные рубцы (келоиды).
Специфические осложнения
- Повреждения соседних органов таких, как легкие, сердце (легочная артерия); при этом может возникнуть массивное кровотечение, которое потребует соответствующего расширения операции (наложение шва на легкое или удаление его доли, наложение шва на легочную артерию, применение аппарата искусственного кровообращения) - крайне редкое состояние;
- Повреждение нервов, что иногда может привести к чувству онемения или наоборот жжения/болей в области оперативного вмешательства или пункции сосудов;
- Закупорка (окклюзия) протеза, ниже- и вышележащих участков сосуда. У оперированных пациентов симптомы могут появиться вновь в связи с постепенным сужением оперированного сегмента артерии из-за прогрессирования процесса или разрастания внутреннего слоя сосуда в области анастомозов. Следствием является уменьшение кровоснабжения органов брюшной полости. В этом случае будет обсуждаться необходимость повторного оперативного или консервативного лечения.
- Тромбоз протеза или реконструированной артерии более опасное осложнение и связан с острой закупоркой сосуда, и возможным развитием инфаркта кишечника. В этой ситуации при появлении минимальных клинических проявлений неблагополучения в животе необходимо обратиться за медицинской помощью, предпочтительно в многопрофильный стационар, обладающий опытом лечения острой ишемии кишечника.
- Инфицирование протеза, что может привести к кровотечению из швов протеза; при прогрессировании инфекции может потребоваться удаление протеза, следствием чего станет значительное ухудшение кровоснабжения органов.
- Послеоперационное расширение протеза в месте прикрепления протеза к артерии; большое расширение должно быть удалено повторным оперативным вмешательством.
- Все вышеназванные осложнения могут возникнуть после операции. Но серьезные осложнения встречаются редко: при повторных операциях (если возникает рецидив), при прогрессировании болезни, при избыточной массе тела или при наличии сопутствующих заболеваний. Для примера: при избыточном весе чаще возникают инфекционные осложнения, тромбозы, ТЭЛА.
Каковы перспективы лечения?
В большинстве случаев операция приводит к улучшению состояния и исчезновению жалоб. Для сохранения положительного результата операции необходимо ваше активное участие. Требуется лечение и профилактика прогрессирования основного заболевания. Для этого вы должны полностью отказаться от курения, обсудить с вашим лечащим врачом специальную диету и возможность устранения факторов риска, постоянно принимать назначенное в послеоперационном периоде лечение.
На что следует обратить внимание после операции?
Особенно важными являются контрольные обследования после операции для своевременного выявления оценки состояния оперированного сосуда и выявлении возможных осложнений.
Для этого можно самостоятельно контролировать функциональное состояние ЖКТ, оценивать такие характеристики режим питания, характеристики стула, интенсивность газообразования в кишечнике, реакции на различную пищу (иногда при помощи родственников, близких), возможное появление явлений воспаления, объемных образований, избыточной пульсации, раневого отделяемого или отека тканей в области хирургических ран.
Важно регулярно наблюдаться у профильного хирурга, в том числе сосудистого, по месту жительства, сопоставлять данные и состояние до и после проведенной операции, проходить контрольные ультразвуковые исследования, соблюдать рекомендации лечащего врача при выписке. Частота контрольного посещения врача и проведения дополнительных инструментальных исследований после операции строго индивидуальна и определяется совместно с лечащим врачом или врачом поликлиники.
Ниже приведены основные критерии, на основании которых пациенту необходимо обратиться к врачу за помощью, при этом характер экстренности обращения необходимо согласовать с профильными службами оказания медицинской помощи (скорая медицинская помощь, амбулаторно-поликлиническая помощь и т.д.):
- Возврат болей к исходному уровню или появление интенсивных болей в животе
- Появление тошноты, рвоты, резкого вздутия живота и других признаков дисфункции кишечника
- Отсутствие прибавки в весе или прогрессирующее похудание несмотря на проведенное оперативное лечение
- Появление признаков воспаление ран, интенсивного отделяемого из раны и т.д.
- Отсутствие эффекта от консервативного лечения при возврате симптомов заболевания.
Приложение Г
Нет.
