"Клинические рекомендации "Первичный иммунодефицит - X-сцепленный лимфопролиферативный синдром"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПЕРВИЧНЫЙ ИММУНОДЕФИЦИТ - X-СЦЕПЛЕННЫЙ
ЛИМФОПРОЛИФЕРАТИВНЫЙ СИНДРОМ
МКБ 10: D82.3, D82.8, D84.8, D89.8
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: КР544/1
URL
Профессиональные ассоциации
- Национальное общество детских гематологов и онкологов Национальное общество экспертов по первичным иммунодефицитам Российская ассоциация аллергологов и клинических иммунологов
Ключевые слова
- Первичный иммунодефицит
- Гемофагоцитарный лимфогистиоцитоз
- Эпштейн-Барр-ассоциированное заболевание
- Воспалительное заболевание кишечника у детей
- Внутривенный иммуноглобулин
- Пренатальная диагностика
- Трансплантация гематопоэтических стволовых клеток
- X-сцепленный лимфопролиферативный синдром
Список сокращений
ВЗК - воспалительное заболевание кишечника
ГЛГ - гемофагоцитарный лимфогистиоцитоз
ДНК - дезоксирибонуклеиновая кислота
ЖКТ - желудочно-кишечный тракт
ЛДГ - лактатдегидрогеназы
НК - натуральные киллеры
НКТ - натуральные киллерные T-клетки
ПИД - Первичный иммунодефицит
ПЦР - полимеразной цепной реакции
ТГСК - трансплантация гематопоэтических стволовых клеток
УЗИ - Ультразвуковое исследование
рчГ-КСФ - гранулоцитарный колониестимулирующий фактор рекомбинантный
ФМН - фульминантный мононуклеоз
XЛП - X-сцепленный лимфопролиферативный синдром
ЦМВ - цитомегаловирус
ЭБВ - Вирус Эпштейна-Барр
ЭКГ - Электрокардиография
BIRC4 - baculoviral IAP repeat-containing protein 4
HHV VI - герпес-вируса 6 типа
HLA - human leukocyte antigen
IL - интерлейкин
IUIS - Международный союз иммунологических обществ
L18-MDP - L18-Muramyl dipeptide
MAIT - Mucosa-associated invariant T cells
MCP-1 - моноцитарный хемотаксический протеин-1
RICD - Restimulation-induced cell death
SLAM - Signaling lymphocyte activation molecule
TCR - T-клеточный рецепторов
TLR - toll-like receptors
TNF-alpha - фактор некроза опухоли альфа
Treg - регуляторные T-клетки
XIAP - X-linked inhibitor of apoptosis - X-сцепленный ингибитор апоптоза
XMEN - X-сцепленный иммунодефицит с дефектом магниевых каналов, ЭБВ-инфекцией и неоплазией
Термины и определения
Внутривенные иммуноглобулины - препараты, содержащие преимущественно нормальный человеческий IgG. Изготовляются из пулированной плазмы тысяч здоровых доноров, с применением специальных методов очистки и вирусинактивации.
Воспалительное заболевание кишечника - заболевание, характеризующееся хроническим воспалением желудочно-кишечного тракта. Включает в себя болезнь Крона и неспецифический язвенный колит.
Гемофагоцитарный лимфогистиоцитоз - жизнеугрожающее состояние, вызванное неконтролируемой активацией макрофагов и цитотоксических лимфоцитов в совокупности с гиперпродукцией воспалительных цитокинов (цитокиновый шторм).
Нейтропения - снижение уровня нейтрофилов в периферической крови менее 1,5 x 109/л (для детей первого года жизни - менее 1,0 x 109/л).
Полимеразная цепная реакция - метод молекулярной биологии, позволяющий амплифицировать (размножить) определенный участок ДНК
Секвенирование ДНК - определение ее нуклеотидной последовательности. В результате секвенирования получают описание первичной структуры линейной ДНК в виде последовательности нуклеотидов в текстовом виде.
Трансплантация гематопоэтических стволовых клеток - метод лечения некоторых наследственных и приобретенных гематологических, онкологических и иммунных заболеваний, основанный на замене собственного, патологического, кроветворения пациента на нормальное кроветворение донора.
X-сцепленный рецессивный тип наследования - наследование мутации генов, расположенных на X хромосоме. При этом лица женского пола как правило являются бессимптомными носителями, а заболеванием страдают лишь лица мужского пола.
1. Краткая информация
1.1 Определение
X-сцепленный лимфопролиферативный синдром (XЛП) - это комбинированный первичный иммунодефицит (ПИД), характеризующийся атипичной реакцией на инфекцию вирусом Эпштейна-Барр (ЭБВ), вследствие чего развивается гемофагоцитоз, дисгаммаглобулинемия, аутоиммунная патология и, в зависимости от типа, злокачественной лимфопролиферация [1].
1.2 Этиология и патогенез
На сегодняшний день охарактеризованы три гена, мутации которых ведут к проявлениям XЛП - SH2D1A, XIAP (он же BIRC4) и MAGT1. Подтипы XЛП объединены в одну группу в связи с наследованием по X-сцепленному типу и в связи со схожестью клинической картины, представленной в первую очередь предрасположенностью к ЭБВ-ассоциированной лимфопролиферации и к развитию гемофагоцитарного лимфогистиоцитоза (ГЛГ). Тем не менее, имеются некоторые различия в клинической картине и существенные - в патогенезе XЛП различных типов. Наиболее изученными являются XЛП 1 и 2 типа, вызываемые мутациями в генах SH2D1А и XIAP соответственно.
Патогенез X-сцепленного лимфопролиферативного синдрома 1 типа
Ген SH2D1A кодирует SLAM-ассоциированный белок SAP, где SLAM - signaling lymphocyte activation molecule - сигнальная молекула активации лимфоцитов, экспрессирующаяся в T-, НК (натуральные киллеры), НКТ (натуральные киллерные T-клетки) и, по некоторым источникам, в трансформированных B-клетоках [2]. SAP является адаптерной молекулой в пути передачи сигнала от SLAM-подобных рецепторов внутрь клетки [3].
Мутация в гене SH2D1A приводит к следующим иммунологическим дефектам: нарушению эффекторных функций НК-клеток, CD8+ и CD4+ T-клеток, резкому снижению/отсутствию НКТ-клеток, гуморальным нарушениям в виде дисгаммаглобулинемии и уменьшению CD27+ B-клеток памяти.
В норме стимуляция SLAM-рецепторов в НК-клетках приводит к повышению концентрации  и в целом к активации НК-клеток. Соответственно у пациентов с XЛП1 НК-опосредованная цитотоксичность снижена [4]. Страдает у них и CD8+-опосредованная цитотоксичность, однако преимущественно на антигены, презентируемые B-клетками, что может частично объяснять предрасположенность именно к ЭБВ-инфекции и B-клеточным лимфомам [5]. Вклад в предрасположенность к ЭБВ-инфекции и лимфомам также вносит характерное для XЛП1 нарушение созревания НКТ-клеток, выражающееся в их снижении или полном отсутствии [6].
и в целом к активации НК-клеток. Соответственно у пациентов с XЛП1 НК-опосредованная цитотоксичность снижена [4]. Страдает у них и CD8+-опосредованная цитотоксичность, однако преимущественно на антигены, презентируемые B-клетками, что может частично объяснять предрасположенность именно к ЭБВ-инфекции и B-клеточным лимфомам [5]. Вклад в предрасположенность к ЭБВ-инфекции и лимфомам также вносит характерное для XЛП1 нарушение созревания НКТ-клеток, выражающееся в их снижении или полном отсутствии [6].
Имеющиеся при XЛП1 дефекты гуморального иммунитета обусловлены тем, что в отсутствии SAP снижается способность фолликулярных T-клеток формировать стабильные контакты с B-клетками. В результате нарушается дифференцировка наивных B-клеток в долгоживущие, высокоаффинные клетки памяти и плазматические клетки. Это объясняет малочисленность B-клеток памяти у пациентов с XЛП1 и гипогаммаглобулинемию и/или нарушение антиген-специфичного антительного ответа. Кроме того, это соответствует картине, описанной D. Purtilo и соавт. [7] при открытии заболевания - отсутствие герминативных центров в лимфоидной ткани большинства пациентов.
Наконец, исследования A.Snow и соавт. [8] показали вовлеченность SLAM-пути в процесс смерти, индуцируемой избыточной стимуляцией (restimulation-induced cell death - RICD). Запрограммированная клеточная гибель необходима для элиминации активированных T-клеток во время иммунного ответа, что ограничивает иммунный ответ и предотвращает лимфопролиферацию и избыточное T-опосредованное повреждение тканей. Вероятно, дефект пути RICD отвечает за значительное увеличение количества CD8+ T-клеток в ответ на ЭБВ-инфекцию у пациентов с XЛП1 и развитие ГЛГ.
Патогенез X-сцепленного лимфопролиферативного синдрома 2 типа
Ген XIAP, также известный как BIRC4 (baculoviral IAP repeat-containing protein 4), - кодирует цитоплазматический белок XIAP. Данный белок экспрессируется повсеместно, более выражена его экспрессия в гематопоэтических клетках, где она сопоставима в различных субпопуляциях [9].
XIAP является физиологическим ингибитором каспаз 3, 7, 9 и, следовательно, ингибитором клеточной гибели. У пациентов с XЛП2 лимфоциты подвержены избыточному апоптозу, что может объяснить отсутствие лимфом у пациентов с XЛП2. При этом, несмотря на повышенную склонность к апоптозу, снижение количества T- и B-лимфоцитов у пациентов с XЛП2, как правило, не развивается, за исключением снижения количества НКТ-клеток. Предполагается, что они более чувствительны к апоптозу, индуцированному активацией, а, следовательно, более зависимы от белка XIAP [10].
Помимо антиапоптотической функции XIAP опосредует сигнальный путь через NOD1/2 и Dectin-1 рецепторы. Данные рецепторы экспрессируются в эпителиальных клетках, миелоидных клетках и клетках Панета кишечника и представляют собой соответственно внутриклеточные и трансмембранные паттерн-распознающие рецепторы, улавливающие продукты деградации бактерий, грибов и некоторых вирусов. В норме активация этих рецепторов в моноцитах приводит к увеличению выработки цитокинов и хемокинов, важных для клиренса патогенов - IL (интерлейкин)-8, MCP-1 (моноцитарный хемотаксический протеин-1), IL-10. IL-8 и MCP-1 важны для миграции нейтрофилов, в то время как IL-10 - для сохранения гомеостаза кишечника. Не последнюю роль в поддержании баланса провоспалительных и противовоспалительных факторов и обеспечения защиты от чужеродных патогенов в кишечнике играют регуляторные T-клетки (Treg), Mucosa-associated invariant T cells (MAIT) and НКТ клетки, которые в отсутствии XIAP становятся подвержены апоптозу. Таким образом, нарушение цитокиновой продукции и избыточный апоптоз регуляторов гомеостаза кишечника ведут к развитию воспалительного заболевания кишечника (ВЗК) у пациентов с XЛП2 [11].
Среди других цитокинов, выработка которых снижена при дефиците XIAP, важно выделить фактор некроза опухоли альфа (TNF-alpha). Выработка цитокина моноцитами пациента в ответ на их стимуляцию лигандом NOD-рецептора L18-MDP (Muramyl dipeptide) снижена по сравнению с моноцитами здорового контроля - тест, который используется для диагностики XЛП2 [12].
В отличие от других форм семейных ГЛГ, при которых нарушена цитотоксическая функция лимфоцитов, при дефиците XIAP цитотоксичность T- и НК-клеток в норме. Будучи ингибитором апоптоза XIAP обеспечивает выживание и пролиферацию активированных T-клеток в случае инфекции, что способствует элиминации инфицированных клеток. Отсутствие белка ведет к персистенции инфицированных клеток. Более того, XIAP ингибирует TLR (toll-like receptors)- и TNF-опосредованное образование инфламмасомы в дендритных клетках и макрофагах, отсутствие же белка ведет к чрезмерной выработке IL-1, IL-18. В совокупности персистенция инфекции и системное воспаление провоцируют развитие ГЛГ [13].
Патогенез X-сцепленного лимфопролиферативного синдрома 3 типа
XЛП3 был назван XMEN - X-сцепленный иммунодефицит с дефектом магниевых каналов, ЭБВ-инфекцией и неоплазией. К его наиболее постоянным признакам относятся CD4+-лимфопения, спленомегалия, персистенция ЭБВ и высокая предрасположенность к развитию ЭБВ-ассоциированной лимфомы [14].
Ген MAGT1 экспрессируется во всех клетках, однако в некоторых сильнее, например, в гемопоэтических. Потеря функции гена MAGT1 в T-клетках ведет к нарушению быстрого потока свободных ионов магния в клетку и, как следствие, к нарушению антигенной стимуляции T-клеточных рецепторов (TCR). В НК-клетках и цитотоксических (CD8+) T-лимфоцитах магниевые каналы обеспечивают базальное содержание свободного магния, необходимое для поддержания экспрессии некоторых активирующих рецепторов. Соответственно, при отсутствии свободного магния цитотоксическая функция T-клеток страдает. Клинически увеличивается предрасположенность к развитию опухолей и инфекций, в частности ЭБВ-инфекции. Поскольку дефект активации T-клеток при синдроме XMEN не столь значителен и может быть компенсирован более длительной и сильной стимуляцией, у таких пациентов не наблюдается тяжелых угрожающих жизни инфекций, как при других ПИД. В отличие от других типов XЛП для пациентов с синдромом XMEN не характерно развитие фульминантного мононуклеоза (ФМН), редко наблюдается ГЛГ и количество НКТ-клеток у них в норме [15].
1.3 Эпидемиология
Частота встречаемости XЛП составляет 1 - 3 на 1 миллион рожденных мальчиков, заболеванием страдают лица мужского пола (за очень редким исключением) [6, 16 - 18].
1.4 Кодирование по МКБ-10
D82.3 Иммунодефицит вследствие наследственного дефекта, вызванного вирусом Эпштейна-Барр
D84.8 Другие уточненные иммунодефицитные нарушения (код также используется в КР по врожденной нейтропении)
D89.8 Другие уточненные нарушения с вовлечением иммунного механизма, не классифицированные в других рубриках
D82.8 Иммунодефицит, связанный с другими уточненными значительными дефектами
1.5 Классификация
По данным классификации ПИД 2017 г., утвержденной Международным союзом иммунологических обществ (IUIS), XЛП относится к группе иммунодефицитов с иммунной дисрегуляцией, подгруппе иммунодефицитов с предрасположенностью к ЭБВ-инфекции и лимфопролиферации. Исторически заболевание классифицируется как XЛП1, XЛП2, XЛП3, в зависимости от типа генетического дефекта - мутации генов SH2D1A, XIAP и MAGT1, соответственно [19].
1.6 Клиническая картина
Общим для XЛП является предрасположенность к ЭБВ-инфекции с развитием фульминантного мононуклеоза, который фактически представляет собой ГЛГ. Для XЛП2 также описаны случаи ГЛГ, вызванного персистенцией цитомегаловируса (ЦМВ) или герпес-вируса 6 типа (HHV VI). Кроме того, гемофагоцитоз у пациентов с XЛП2, как правило, носит менее агрессивный характер.
Еще одним часто встречающимся проявлением XЛП у детей и взрослых является развитие лимфом, имеющих в большинстве своем B-клеточную природу и локализующихся в илеоцекальной области. При этом развитие злокачественной лимфопролиферации возможно, как у ЭБВ-негативных, так и у ЭБВ-позитивных пациентов. Исключение составляет XЛП2, при котором к настоящему моменту не зафиксировано ни одного случая лимфомы [20].
Другим существенным отличием XЛП2 является развитие воспалительного заболевания кишечника, напоминающего гистологически болезнь Крона [21]. Дефицит XIAP относится к группе моногенных заболеваний с поражением желудочно-кишечного тракта, основной характеристикой которых является развитие ВЗК-подобного колита с ранней манифестацией.
К редким проявлениям XЛП1 относятся апластическая анемия, лимфоидный васкулит, лимфоидный гранулематоз легких [22].
К редким проявлениям XЛП2 относятся аутовоспалительные проявления, такие как артрит, увеит, узловатая эритема [10].
Клиническая картина может быть представлена одним или комбинацией приведенных выше состояний, при этом проявления у представителей одной и той же семьи могут различаться.
2. Диагностика
Детям и взрослым пациентам с подозрением на X-сцепленный лимфопролиферативный синдромом проводится дифференциальный диагноз в первую очередь проводить с:
- Другими формами семейного ГЛГ;
- Лимфомами при других ПИД;
- X-сцепленной агаммаглобулинемией;
- Другими ПИД, осложненными течением ВЗК.
2.1 Жалобы и анамнез
- У всех пациентов (или родителей) с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется проводить сбор анамнеза и жалоб для верификации диагноза [20 - 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: Пациенты и их родители могут предъявлять жалобы на появившийся с раннего возраста жидкий стул, кровь в стуле, наличие увеличенных лимфоузлов, эпизоды лихорадки без явного очага инфекции и ответа на антибактериальную терапию, которые могут сопровождаться увеличением печени/селезенки. Следует уточнить особенности физического развития пациента, прибавку в весе, сроки возникновения, частоту и тяжесть кишечных проявлений, а также болел ли пациент инфекционным мононуклеозом и насколько тяжело протекало заболевание. При сборе семейного анамнеза обращать внимание на случаи ранних смертей мальчиков с признаками гемофагоцитоза, лимфопролиферации, а также случаи тяжелого колита у лиц мужского пола. У пациентов XЛП нередко отмечаются "немотивированные" субфебрилитеты и лихорадка без явного очага инфекции (как проявление гемофагоцитоза). Кроме того, эпизоды лихорадки и\или субфебрилитета с потами и потерей массы тела могут быть признаками злокачественного заболевания (например, так называемые "B" симптомы при лимфоме).
2.2 Физикальное обследование
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется физикальный осмотр для верификации диагноза [9].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: Пациенты с XЛП (особенно XЛП2 с симптомами колита) могут отставать в массо-ростовых показателях.
У детей и взрослых пациентов с XЛП 1 и 2 типа могут отмечаться пятнисто-папулезные сыпи, характерные для ГЛГ. При развитии цитопении, в том числе тромбоцитопении, отмечается геморрагическая сыпь.
При осмотре рекомендовано оценить размеры периферических лимфоузлов. Для пациентов с XЛП нередко характерна генерализованная лимфаденопатия или увеличение одной группы лимфоузлов в случае развития лимфомы.
Увеличение печени и селезенки - как проявление хронической ЭБВ-инфекции, ГЛГ или лимфомы.
2.3 Лабораторная диагностика
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется исследование общего анализа крови для диагностики анемии и нейтропении [3, 7].
Уровень убедительности рекомендаций A (уровень достоверности доказательств - 1)
Комментарии: У пациентов с XЛП может выявляться лимфопения (менее 1000 клеток в мкл). При течении ГЛГ отмечается в первую очередь тромбоцитопения, в дальнейшем - анемия и нейтропения. При ВЗК возможно развитие тромбоцитоза как отражение хронического воспалительного процесса
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется исследование биохимического анализа крови: мочевины, креатинина, фракций билирубина, аспартатаминотрансферазы (АсАт), аланинаминотрансферазы (АлАт), альбумина, лактатдегидрогеназы (ЛДГ), щелочной фосфатазы (ЩВ), глюкозы, триглицеридов, ферритина, фибриногена, C-реактивного белка для диагностики сопутствующих заболеваний и верификации диагноза [2, 3, 5, 7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: Повышение ферритина, триглицеридов, снижение фибриногена, гипоальбуминемия относятся к критериям ГЛГ. Повышение ЛДГ особенно характерно для лимфом.
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется исследование концентрации иммуноглобулинов сыворотки IgG, IgA, IgM для верификации диагноза [9, 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: В большинстве случаев у пациентов с XЛП имеются те или иные нарушения концентрации иммуноглобулинов - снижение всех классов иммуноглобулинов, или повышение одних классов и снижение других. При ВЗК в большинстве случаев отмечается повышение IgA, что отражает вовлеченность слизистых в воспалительный процесс
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется иммунофенотипирование субпопуляций лимфоцитов для оценки степени выраженности иммунологического дефекта [9, 24].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: У многих пациентов с XЛП1 отмечается снижение (вплоть до нулевых значений) числа B-лимфоцитов, либо значительное снижение переключенных B-клеток памяти (CD19+CD27+IgD-IgM-). Показатели иммунофенотипирования лимфоцитов при XЛП2 не специфичны. Для XЛП3 характерна CD4-лимфопения. Снижение НКТ наиболее характерно для XЛП1, может встречаться при XЛП2, не характерно для XЛП3
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется определение внутриклеточной экспрессии белков SAP и XIAP методом проточной цитометрии для подтверждения верификации диагноза [4].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: для пациентов с XЛП1 и XЛП2 характерно значительное снижение и полное отсутствие экспрессии белков SAP и XIAP соответственно.
- Пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется молекулярно-генетическое исследование соответствующих генов (SH2D1A, XIAP (он же BIRC4), MAGT1) для подтверждения диагноза у пациента и у других членов семьи мужского пола, а также диагностики матерей-носителей [25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется проводить ПЦР исследование крови (по показаниям других биологических сред) на определение содержания ДНК вируса Эпштейн-Барр (ЭБВ), цитомегаловируса (ЦМВ), герпеса 6 типа (HHV VI), а также микробиологическое исследование биологических сред при наличии соответствующих очагов инфекции для диагностики сопутствующей инфекции и определения вирусологического статуса пациента [16, 26].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Серологические исследования у пациентов с ПИДС, в частности с XЛП, мало информативны. Вирусологический статус пациента характеризуется количественным (предпочтительно) или качественным определением вирусов методом полимеразной цепной реакции (ПЦР) в крови, кале, ликворе, бронхо-альвеолярном лаваже, биопсийном материале. В случае XЛП в первую очередь рекомендовано определить количество копий вируса ЭБВ в крови и, по показаниям, в других средах. Учитывая ЦМВ- и HHV VI-ассоциированные ГЛГ рекомендовано также определение количества данных вирусов в крови и других средах. Посевы биоматериала (на флору и грибы) с определением антибиотикочувствительности со слизистых, из очагов инфекции (включая посев крови и мочи при соответствующей симптоматике), а также посевы кала, бронхоальвеолярного лаважа, ликвора и биопсионного материала рекомендовано проводить всегда при наличии инфекционных очагов.
- Пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется HLA-типирование для подготовки к пересадке костного мозга, определению совместимости с сиблингами, родителями (при отсутствии сиблингов), или типирование для поиска неродственного донора [6, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
2.4 Инструментальная диагностика
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется компьютерная томография (КТ) грудной и брюшной полости с контрастным усилением для оценки выраженности лимфопролиферации, исключения лимфомы; магнитно-резонансная терапия (МРТ) головного мозга с контрастным усилением для оценки поражения центральной нервной системы (ЦНС) при ГЛГ, а также для исключения васкулита и его осложнений (тромбоз, аневризма и т.д.) у пациентов с XЛП1 [26, 28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Всем пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется костномозговая пункция для подтверждения течения ГЛГ, а также оценки его поражения костного мозга при развитии лимфом [10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Пациентам с подозрением на X-сцепленный лимфопролиферативный синдром, осложненный гемофагоцитозом или васкулитом с поражением ЦНС, рекомендуется люмбальная пункция с цитологическим исследованием ликвора, а также определение содержания белка, глюкозы, для подтверждения или исключения вовлеченности ЦНС [16, 28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
- Пациентам с подозрением на X-сцепленный лимфопролиферативный синдром рекомендуется по показаниям гастроскопия и колоноскопия с гистологическим исследованием биоптатов желудка и кишечника (при наличии кишечного синдрома) для уточнения характера поражения желудочно-кишечного тракта (ЖКТ) и решения вопроса об иммуносупрессивной терапии и/или хирургическом методе лечения [29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
3. Лечение
3.1 Консервативное лечение
Цель лечения: стабилизация состояния, контроль развившихся осложнений и предотвращение новых осложнений на период подготовки к ТГСК.
Лечение лимфомы. Проводится по протоколам лечения лимфом, в зависимости от ее типа (см. соответствующие клинические рекомендации).
Лечение гемофагоцитарного лимфогистиоцитоза. Проводится по протоколам лечения ГЛГ, в настоящее время - по протоколу HLH2004 (дексаметазон**, этопозид**, циклоспорин** - см. соответствующие клинические рекомендации). Допускается в качестве дополнительной опции применение антицитокиновой терапии, например, препарат моноклональных антител к человеческому рецептору интерлейкина 6 - #Тоцилизумаб**, а также применение селективного ингибитора JAK-киназы - #Руксолитиниба** - назначение которых должно рассматриваться индивидуально в каждом конкретном случае [30 - 32].
Лечение воспалительного заболевания кишечника. Проводится по протоколам лечения воспалительного заболевания кишечника, в зависимости от гистологической картины (см. соответствующие клинические рекомендации).
- Всем пациентам с XЛП рекомендуется проведение заместительной терапии внутривенными иммуноглобулинами (ВВИГ**) только высокого качества ввиду их вирусной безопасности, в том числе в отношении парвовируса B19, который смертельно опасен для пациентов с ПИД [2].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: терапия проводится пожизненно\до момента восстановления иммунитета после ТГСК в стандартных режимах в дозе 400 - 600 мг/кг веса 1 раз в 3 - 4 недели, с целью поддержания уровня IgG не ниже 6 г\л [2]. В случае, если данная концентрация не достигнута, показано увеличение разовой дозы ВВИГ** до 0,8 - 1 гр/кг или сокращение интервала между введениями препарата до 3-х недель. Применение иммуноглобулина человека нормальный [IgG + IgM + IgA]** для внутривенного введения, а также иммуноглобулина для внутримышечного введения противопоказано из-за его неэффективности у пациентов с данным диагнозом.
- Пациентам с XЛП, осложненным ЭБВ-инфекцией рекомендуется лечение #ритуксимабом** [27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
Комментарии: Специфические вирусостатики, активные в отношении ЭБВ, на сегодняшний день отсутствуют. Так как ЭБВ инфекция представляет угрозу жизни пациента, при выявлении виремии рекомендовано проведение терапии #ритуксимабом** в дозе 375 мг/м2 1 раз в неделю 4 недели, далее - по необходимости под контролем виремии.
- Пациентам с XЛП с нейтропенией менее < 1,0 x 109/л после исключения гемофагоцитоза и гемобластоза рекомендуется назначение препаратов короткого действия гранулоцитарного колониестимулирующего фактора рекомбинантного (рчГ-КСФ) для достижения и поддержания абсолютного количества нейтрофилов > 1,0 x 109/л [33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии: Дозировка и кратность введения ленограстима и филграстима** подбирается индивидуально.
- Профилактическая противомикробная терапия рекомендуется всем пациентам с XЛП с отягощенным инфекционным анамнезом до момента санации хронических очагов инфекции, не менее 3 месяцев. Выбор препарата рассматривается индивидуально в каждом конкретном случае, в том числе с учетом чувствительности выявленной микрофлоры. Стандартная профилактическая антибактериальная терапия - азитромицин** 10 мг/кг/сут 3 р/нед., также назначается (особенно при наличии нейтропении) профилактическая противогрибковая терапия - (флуконазол** 3 - 8 мг/кг/сут.) [34, 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
3.2 Хирургическое лечение
- Пациентам с XЛП рекомендуется по показаниям хирургическое лечение в зависимости от осложнений. При выраженном язвенном поражении кишечника целесообразно рассмотреть вопрос о выведении стомы на время проведения ТГСК и раннего посттрансплантационного периода [29, 36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 3)
3.3 Трансплантация гематопоэтических стволовых клеток (ТГСК)
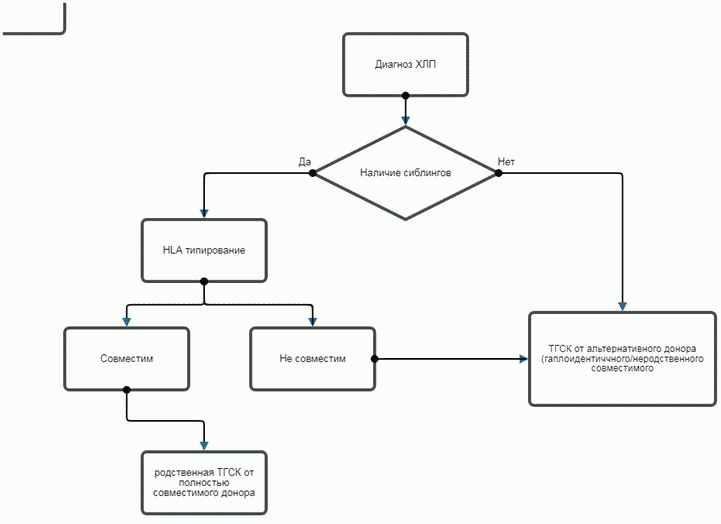
- Пациентам с XЛП рекомендуется проведение ТГСК, являющейся единственным куративным методом лечения пациентов с XЛП. Проводится от родственного совместимого, неродственного совместимого или гаплоидентичного донора по методикам, используемым в конкретных центрах [6, 37].
Уровень убедительности рекомендаций B (уровень достоверности доказательств - 2)
4. Реабилитация
- Пациентам с XЛП рекомендуется реабилитация после проведения ТГСК, включающая вакцинацию в соответствии с национальным календарем, при необходимости - консультации с психологом, специалистами лечебной физической культуры [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
5. Профилактика
- Всем пациентам с XЛП рекомендуется проводить профилактические мероприятия, включающие медико-генетическое консультирование семей и пренатальную диагностику, которая проводится с помощью молекулярно-генетического исследования биоптата хориона с выявлением мутации соответствующего гена, что позволяет предотвратить рождение других пациентов с данным заболеванием в семьях XЛП [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
- Всем пациентам с XЛП рекомендуется диспансерное наблюдение педиатра/терапевта и аллерголога-иммунолога по месту жительства. Профилактическая терапия проводится амбулаторно, длительно - до момента проведения ТГСК. Пациенты и члены их семей должны быть обучены правилам индивидуальной гигиены [38].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4)
Комментарии:
Лабораторные и инструментальные исследования
- Общий клинический анализ крови (обязателен подсчет лейкоцитарной формулы) проводится 1 раз в 1 мес, по показаниям - чаще.
- Биохимический анализ крови с определением активности печеночных ферментов, C-реактивного белка - 1 раз в 1 мес, по показаниям - чаще.
- Общий анализ мочи - 2 раза в год, по показаниям - чаще
- Электрокардиография (ЭКГ) - 1 раз в год.
- Ультразвуковое исследование (УЗИ) брюшной полости - 1 раз в 3 мес.
- Рентгенография грудной клетки - 1 раз в год.
Периодичность осмотра специалистами, проводившими терапию
Аллерголог-иммунолог осматривает пациента 1 раз в 3 мес.
Периодичность контрольных осмотров специалистами смежных специальностей:
- осмотр гематолога - 1 раз в 3 мес;
- осмотр офтальмолога - 1 раз в 6 мес;
- осмотр стоматолога - 1 раз в год;
- осмотр отоларинголога - 1 раз в год
- осмотр невролога - 1 раз в 6 мес;
Вакцинация до проведения ТГСК не показана.
6. Дополнительная информация, влияющая на течение и исход заболевания
Прогноз
При успешной ТГСК прогноз качества и продолжительности жизни в целом благоприятный, он во многом определяется тяжестью сформировавшихся к моменту трансплантации хронических очагов инфекции и поражения органов. Прогностически неблагоприятным фактором к моменту ТГСК для детей и взрослых пациентов является отсутствие выхода в ремиссию ГЛГ и/или злокачественной лимфопролиферации.
Семейное консультирование и пренатальная диагностика.
Семья пациента XЛП
После постановки пациенту диагноза XЛП рекомендовано срочное обследование всех братьев (по показаниям - двоюродных братьев) пациента, независимо от возраста, так как они могут иметь бессимптомное заболевание, еще не инфицировавшись вирусом ЭБВ. Тем не менее, риск смертельного исхода\тяжелейших осложнений при первом контакте с вирусом настолько велик, что бессимптомным пациентам с XЛП также рекомендовано проведение ТГСК [5, 6].
Пренатальная диагностика показана при всех последующих беременностях матери в данном браке и в других браках (X-сцепленный тип наследования). При X-сцепленном типе наследования рекомендовано тестирование на носительство мутации сестер пациента, всех сестер матери детородного возраста, по показаниям - других родственников женского пола [5, 25].
Пациент XЛП после ТГСК
Риск заболевания у детей пациента составляет менее 0,1%. Все дочери пациента являются носителями мутантного гена, им рекомендовано семейное консультирование [25].
Генная терапия
В настоящее время идут активные клинические исследования, которые дадут возможность рутинного применения генной терапии, в том числе и при XЛП, тем не менее на сегодняшний не является терапевтической модальностью [39].
Дополнительные методы диагностики
Для пациентов с XЛП2 характерно снижение продукции TNF-alpha моноцитами в ответ на стимуляцию NOD2 рецепторов. В связи с этим в качестве дополнительного метода верификации диагноза пациентам с подозрением на X-сцепленный лимфопролиферативный синдром 2 типа рекомендуется определение продукции TNF-alpha моноцитами в ответ на их стимуляцию лигандом NOD2-рецепторов - L18-MDP (в России данное исследование пока не проводится) [12].
7. Организация медицинской помощи
Показания для плановой госпитализации:
1. Динамической контроль состояния при хронических очагах инфекции, с целью проведения инструментальных методов исследования, по показаниям (бронхоальвеолярный лаваж, компьютерная томография и т.д.);
2. Оценка эффективности проводимой иммуносупрессивной терапии (терапия ВЗК, поддержание ремиссии ГЛГ, терапия в рамках протоколов лечения лимфом);
3. Проведение эндоскопического обследования для оценки эффективности терапии ВЗК;
4. Проведение предтрансплантационного обследования.
Показания для экстренной госпитализации:
1. Длительная фебрильная лихорадка;
2. Развитие ИМ;
3. Подозрение на течение васкулита (неврологическая симптоматика, судороги и т.д.);
4. Подозрение на развитие ГЛГ;
5. Подозрение на развитие лимфомы;
6. Обострение или подозрение на манифестацию ВЗК.
Показания к выписке пациента из стационара:
1) Стабилизация состояния;
2) Окончание планового обследования.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1.
Выполнен сбор анамнеза и жалоб, физикальное обследование врачом-гематологом и/или аллергологом-иммунологом
C
3
2.
Выполнено базовое лабораторное обследование (клинический анализ крови; биохимический анализ крови (мочевина, креатинин, фракции билирубина, аспартатаминотрансфераза, аланинаминотрансфераза, альбумина, лактатдегидрогеназа, щелочная фосфатаза, глюкоза, триглицериды, ферритин, C-реактивный белок, фибриноген)
C
3
3.
Выполнено инструментальное обследование (компьютерная томография грудной и брюшной полости с контрастным усилением или УЗИ брюшной полости и рентгенография грудной клетки
C
3
4.
Проведено иммунологическое обследование (определение иммуноглобулинов сыворотки крови IgG, IgA, IgM, иммунофенотипирование лимфоцитов)
C
3
5.
Проведено вирусологическое исследование для исключения виремии Эпштейн-Барр вируса, цитомегаловируса, вируса герпеса 6 типа с помощью метода ПЦР
C
4
6.
Проведено молекулярно-генетическое исследование потенциально пораженных генов (SH2D1A, XIAP, MAGT1)
C
3
7.
При подозрении на гемофагоцитоз выполнена костномозговая пункция
C
3
8.
Выполнена люмбальная пункция и магнитно-резонансная томография головного мозга (при подозрении на поражение центральной нервной системы)
C
3
9.
Проведена заместительная терапия препаратами внутривенных иммуноглобулинов
C
4
10.
Проведена антибактериальная, противогрибковая терапии с профилактической целью на этапе наблюдения при наличии рецидивирующих инфекционных заболеваниях
C
4
11.
Проведено семейное генетическое консультирование пациента, его непосредственной семьи, а также других родственников с целью информирования их о рисках заболевания у потомства пациента\членов семьи.
C
4
Список литературы
1. Роппельт А.А., Юхачева Д.В. и др. X-сцепленный лимфопролиферативный синдром 1 и 2 типов//Вопросы гематологии/онкологии и иммунологии в педиатрии. 2016; Т. 15(1). с. 17 - 26.
2. Primary immunodeficiency diseases: A molecular and genetic approach. 3rd edition. Ochs HD, Smith CI, Puck JM, eds. Oxford University press; 2013.
3. Marsh RA, Madden L, Kitchen BJ, Mody R, McClimon B, Jordan MB, et al. XIAP deficiency: a unique primary immunodeficiency best classified as X-linked familial hemophagocytic lymphohistiocytosis and not as X-linked lymphoproliferative disease. Blood. 2010; 116(7): 1079 - 82.
4. Marsh R.A., BleesingJ. J., Filipovich A.H. Using Flow Cytometry to Screen Patients for X-linked Lymphoproliferative Disease Due to SAP Deficiency and XIAP Deficiency. J. Immunol. Methods. 2010; 362(1 - 2): 1 - 9.
5. Иммунология детского возраста. Практическое руководство по детским болезням. Под ред. А.Ю. Щербины и Е.Д. Пашанова. М.: Медпрактика - М; 2006.
6. Booth C., Gilmour K.C., Veys P., Gennery A.R., Slatter M.A., Chapel H., et al. X-linked lymphoproliferative disease due to SAP/SH2D1A deficiency: a multicenter study on the manifestations, management and outcome of the disease. Blood. 2011; 117(1): 53 - 62.
7. Purtilo DT, Grierson HL, Davis JR, Okano M. The X-linked lymphoproliferative disease: from autopsy toward cloning the gene 1975 - 1990. Pediatr Pathol. 1991; 11(5): 685 - 710.
8. Tangye SG. XLP: clinical features and molecular etiology due to mutations in SH2D1A encoding SAP. J Clin Immunol. 2014; 34(7): 772 - 9.
9. Pachlopnik Schmid J, Canioni D, Moshous D, Touzot F, Mahlaoui N, Hauck F, et al. Clinical similarities and differences of patients with X-linked lymphoproliferative syndrome type 1 (XLP-1/SAP deficiency) versus type 2 (XLP-2/XIAP deficiency). Blood. 2011; 117(5): 1522 - 9.
10. Latour S., Aguilar C. XIAP deficiency syndrome in humans. Semin Cell Dev Biol. 2015; 39: 115 - 23.
11. Bertrand M.J., et al. Cellular inhibitors of apoptosis cIAP1 and cIAP2 are required for innate immunity signaling by the pattern recognition receptors NOD1 and NOD2. Immunity. 2009; 30: 789 - 801.
12. Ammann S., et al. A new functional assay for the diagnosis of X-linked inhibitor of apoptosis (XIAP) deficiency. Clinical and Experimental Immunology. 2014; 176: 394 - 400.
13. Yabal M.,  , et al. XIAP restricts TNF- and RIP3-dependent cell death and inflammasome activation. Cell Rep. 2014; 7(6): 1796 - 808.
, et al. XIAP restricts TNF- and RIP3-dependent cell death and inflammasome activation. Cell Rep. 2014; 7(6): 1796 - 808.
14. Ravell J, Chaigne-Delalande B, Lenardo M. X-linked immunodeficiency with magnesium defect, Epstein-Barr virus infection, and neoplasia disease: a combined immune deficiency with magnesium defect. Curr Opin Pediatr. 2014 Dec; 26(6): 713 - 9.
15. Li FY, et al Clinical utility gene card for: X-linked immunodeficiency with magnesium defect, Epstein-Barr virus infection, and neoplasia (XMEN). Eur J Hum Genet. 2015 Jun; 23(6).
16. Aguilar C, Latour S. X-linked inhibitor of apoptosis protein deficiency: more than an X-linked lymphoproliferative syndrome. J Clin Immunol. 2015; 35(4): 331 - 8.
17. Woon S.T. et al. Follicular lymphoma in a X-linked lymphoproliferative syndrome carrier female. Scand J Immunol. 2008; 68(2): 153 - 8.
18. Yang X. et al. A female patient with incomplete hemophagocytic lymphohistiocytosis caused by a heterozygous XIAP mutation associated with non-random X-chromosome inactivation skewed towards the wild-type XIAP allele. J. Clin. Immunol. 2015; 35(3): 244 - 8.
19. Picard C. et al. International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity s. J. Clin. Immunol. 2017; 38(1): 96 - 128.
20. Worthey EA, Mayer AN, Syverson GD, Helbling D, Bonacci BB, Decker B, et al. Making a definitive diagnosis: successful clinical application of whole exome sequencing in a child with intractable inflammatory bowel disease. Genet Med. 2011; 13(3): 255 - 62.
21. Aguilar C, Lenoir C, Lambert N,  , Brousse N, Canioni D, et al. Characterization of Crohn disease in X-linked inhibitor of apoptosis-deficient male patients and female symptomatic carriers. J Allergy Clin Immunol. 2014; 134(5): 1131 - 41. e9.
, Brousse N, Canioni D, et al. Characterization of Crohn disease in X-linked inhibitor of apoptosis-deficient male patients and female symptomatic carriers. J Allergy Clin Immunol. 2014; 134(5): 1131 - 41. e9.
22. Seemayer TA, Gross TG, Egeler RM, Pirruccello SJ, Davis JR, Kelly CM, et al. X-linked lymphoproliferative disease: twenty-five years after the discovery. Pediatr Res. 1995; 38(4): 471 - 8.
23. Щербина А.Ю. Маски первичных иммунодефицитных состояний: проблемы диагностики и терапии. Российский журнал детской гематологии и онкологии (РЖДГиО). 2016; 3(1): 52 - 58.
24. Rigaud S,  , Lambert N, Pasquier B, Mateo V, Soulas P, et al. XIAP deficiency in humans causes an X-linked lymphoproliferative syndrome. Nature. 2006; 444(7115): 110 - 4.
, Lambert N, Pasquier B, Mateo V, Soulas P, et al. XIAP deficiency in humans causes an X-linked lymphoproliferative syndrome. Nature. 2006; 444(7115): 110 - 4.
25. Кузьменко Н.Б., Варламова Т.В., Мерсиянова И.В., Райкина Е.В., Бобрынина В.О., Щербина А.Ю. Молекулярно-генетическая диагностика первичных иммунодефицитных состояний. Вопросы гематологии\онкологии и иммунопатологии в педиатрии. 2016; 15(1): 10 - 16.
26. Mischler M, Fleming GM, Shanley TP, Madden L, Levine J, Castle V, et al. Epstein-Barr virus-induced hemophagocytic lymphohistiocytosis and X-linked lymphoproliferative disease: a mimicker of sepsis in the pediatric intensive care unit. Pediatrics. 2007; 119(5): 1212 - 8.
27. Chellapandian D, Das R, Zelley K, Wiener SJ, Zhao H, Teachey DT, et al. Treatment of Epstein Barr virus-induced haemophagocytic lymphohistiocytosis with rituximab-containing chemo-immunotherapeutic regimens. Br J Haematol. 2013; 162(3): 376 - 82.
28. Talaat K. R. et al. Lymphocytic Vasculitis Involving the Central Nervous System Occurs in Patients with X-linked Lymphoproliferative Disease in the Absence of Epstein-Barr Virus Infection. Pediatr Blood Cancer. 2009; 53(6): 1120 - 1123.
29. Speckmanna C., et al. X-linked inhibitor of apoptosis (XIAP) deficiency: The spectrum of presenting manifestations beyond hemophagocytic lymphohistiocytosis. Clinical Immunology. 2013; 149: 133 - 141.
30. Jordan M.B. Emergence of Targeted Therapy for Hemophagocytic Lymphohistiocytosis//The hematologist. 2018; VOL. 15, Issue 2.
31. Horne A.,  , et al. How to Treat Involvement of the Central Nervous System in Hemophagocytic Lymphohistiocytosis? Curr. Treat. Options Neurol. 2017; 19(1): 3.
, et al. How to Treat Involvement of the Central Nervous System in Hemophagocytic Lymphohistiocytosis? Curr. Treat. Options Neurol. 2017; 19(1): 3.
32. Sin J.H., Zangardi M.L. Ruxolitinib for secondary hemophagocytic lymphohistiocytosis: First case report. Hematol. Oncol. Stem Cell Ther. 2017.
33. Деордиева Е.А. Нейтропения в практике детского гематолога/онколога/Е.А. Деордиева, А.Ю. Щербина//Онкогематология. - 2015. - N 1. - С. 46 - 52.
34. Kuruvilla M., de la Morena M.T. Antibiotic prophylaxis in primary immune deficiency disorders. J. Allergy Clin. Immunol. Pract. 2013; 1(6): 573 - 82.
35. Lortholary O., Dupont B. Antifungal prophylaxis during neutropenia and immunodeficiency. Clin. Microbiol. Rev. 1997; 10(3): 477 - 504.
36. Worthey EA, Mayer AN, Syverson GD, Helbling D, Bonacci BB, Decker B, et al. Making a definitive diagnosis: successful clinical application of whole exome sequencing in a child with intractable inflammatory bowel disease. Genet Med. 2011; 13(3): 255 - 62.
37. Balashov D., Shcherbina A., Maschan M., et al. Single-Center Experience of Unrelated and Haploidentical Stem Cell Transplantation with  and CD19 Depletion in Children with Primary Immunodeficiency Syndromes. Biol. Blood Marrow Transplant. 2015; 21(11): 1955 - 62.
and CD19 Depletion in Children with Primary Immunodeficiency Syndromes. Biol. Blood Marrow Transplant. 2015; 21(11): 1955 - 62.
38. Стратегия медико-психолого-социальной реабилитации детей с гематологическими и онкологическими заболеваниями./Н.Н. Володин, В.Н. Касаткин, Г.Я. Цейтлин и др.//Онкогематология. - 2015 - Т. 1 - С. 7 - 15.
39. Booth C., Gaspar H.B., Thrasher A.J. Treating Immunodeficiency through HSC Gene Therapy. Trends Mol Med. 2016; 22(4): 317 - 327.
40.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
Балашов Дмитрий Николаевич - доктор медицинских наук, член Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов.
Роппельт Анна Артуровна - член Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов
Румянцев Александр Григорьевич - доктор медицинских наук, профессор, академик РАМН, президент Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества гематологов.
Щербина Анна Юрьевна - доктор медицинских наук, профессор РАН, исполнительный директор Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов.
Конфликт интересов: Щербина А.Ю. осуществляет лекторскую деятельность при поддержке компаний CSL Behring, Kedrion, Biotest, РФарм, являющиеся изготовителями\дистрибьюторами препаратов внутривенных иммуноглобулинов. Не участвовала в принятии окончательной редакции раздела лечения.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Гематологи
2. Аллергологи-иммунологи
3. Педиатры
4. Гастроэнтерология
5. Инфекционисты
6. Терапевты
Таблица П1 - Уровни достоверности доказательств
Уровень достоверности
Источник доказательств
I (1)
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Крупные мета-анализы
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
II (2)
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования "случай-контроль"
III (3)
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
IV (4)
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Таблица П2 - Уровни убедительности рекомендаций
Уровень убедительности
Описание
Расшифровка
A
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
B
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии.
Рекомендуется мониторирование побочных явлений
C
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
D
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
Не рекомендовано
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию - не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Нет
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
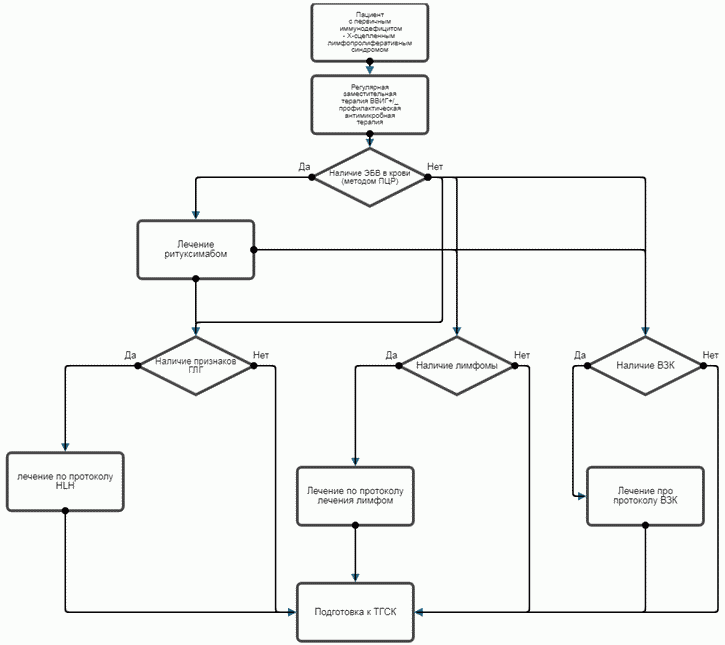
Алгоритм подходов к ТГСК при XЛП
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
X-сцепленный лимфопролиферативный синдром (XЛП) - это комбинированный первичный иммунодефицит (ПИД), характеризующийся атипичной реакцией на инфекцию вирусом Эпштейна-Барр (ЭБВ), вследствие чего развивается гемофагоцитоз, дисгаммаглобулинемией, аутоиммунной патологией, и, в зависимости от типа, злокачественной лимфопролиферацией. На сегодняшний день выделяют 3 типа XЛП с мутациями в генах SH2D1A, XIAP и MAGT1, соответственно.
Высокая предрасположенность к ЭБВ-инфекции, приводящая к развитию фульминантного мононуклеоза, представляющего собой фактически гемофагоцитарный лимфогистиоцитоз, и нарушение количественного состава иммуноглобулинов крови являются общими характеристиками для всех видов XЛП. XЛП 1 типа часто осложняется развитием лимфом, как правило B-клеточных, в то время как для XЛП 2 типа характерно формирование колита, не поддающегося лечению стандартными методами терапии, и нередко требующего хирургического вмешательства для резекции необратимо поврежденного участка кишки.
Клинически стоит обратить внимание на появившийся с раннего возраста жидкий стул, наличие увеличенных лимфоузлов (генерализованная лимфаденопатия или увеличение одной группы лимфоузлов в случае развития лимфомы), эпизоды лихорадки без явного очага инфекции и ответа на антибактериальную терапию. Последнее может сопровождаться увеличением печени/селезенки и являться неполной формой гемофагоцитарного синдрома. Также эпизоды лихорадки и\или субфебрилитета с потами и потерей массы тела могут быть признаками злокачественного заболевания (так называемые "B" симптомы при лимфоме, например). Увеличение печени и селезенки возможно и как проявление хронической ЭБВ инфекции или лимфомы. Появление пятнисто-папулезных высыпаний также должно настораживать в плане ГЛГ.
У пациентов с XЛП 1 и 2 типа могут отмечаться пятнисто-папулезные сыпи, характерные для ГЛГ. При развитии цитопении, в том числе тромбоцитопении, отмечается геморрагическая сыпь.
Лечение пациентов с XЛП представляет собой комплексный подход, включая своевременное и адекватное лечение лимфом, ГЛГ, ЭБВ-инфекции, колита. Однако так как выздоровление от лимфомы или от ГЛГ не гарантирует отсутствие повторных эпизодов, а колит у данных пациент очень плохо поддается иммуносупрессивной терапии, единственным шансом на полное выздоровление в настоящий момент является ТГСК. ТГСК проводится от совместимого брата\сестры, в их отсутствие - от неродственного совместимого донора или от родителей. Исходы ТГСК зависят во многом от имеющегося инфекционного статуса, поражения органов и систем, а также от выхода в ремиссию по ГЛГ и лимфоме к моменту ТГСК.
Риски рождения других мальчиков с XЛП в той же семье составляют 50%. Рекомендовано проведение семейного консультирования и пренатальной\преимплантационной диагностики, для исключения рождения других детей с данным заболеванием.
Приложение Г
Нет
