"Клинические рекомендации "Хронический лимфолейкоз, лимфома из малых лимфоцитов"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ХРОНИЧЕСКИЙ ЛИМФОЛЕЙКОЗ, ЛИМФОМА ИЗ МАЛЫХ ЛИМФОЦИТОВ
МКБ 10: C91.1
Год утверждения (частота пересмотра): 2018 (не реже 1 раза в 3 года)
ID: 134
URL
Профессиональные ассоциации
- Национальное гематологическое общество - Российское общество онкогематологов
Ключевые слова
- Хронический лимфоцитарный лейкоз
- Лимфома из малых лимфоцитов
- Иммунохимиотерапия
- Таргетная терапия
- Терапия 1-й линии
- Терапия 2-й линии
Список сокращений
Chl-G - режим иммунохимиотерапии, включающий обинутузумаб и хлорамбуцил
Chl-R - режим иммунохимиотерапии, включающий ритуксимаб и хлорамбуцил
CTC - общие критерии токсичности
FBR - режим иммунохимиотерапии, включающий флударабин, бендамустин и ритуксимаб
FCR - режим иммунохимиотерапии, включающий ритуксимаб, флударабин и циклофосфамид
FCR-Lite - режим иммунохимиотерапии, включающий ритуксимаб, флударабин и циклофосфамид с редукцией доз цитостатических препаратов
GPP - сложившаяся клиническая практика
IGHV - вариабельные участки тяжелых цепей иммуноглобулинов
RB - режим иммунохимиотерапии, включающий ритуксимаб и бендамустин
R-CD - режим иммунохимиотерапии, включающий ритуксимаб, циклофосфамид и дексаметазон
R-FCM - режим иммунохимиотерапии, включающий ритуксимаб, флударабин, циклофосфамид и митоксантрон
R-HDMP - режим иммунохимиотерапии, включающий ритуксимаб и метилпреднизолон
АИГА - аутоиммунная гемолитическая анемия
АЧТВ - активированное частичное тромбопластиновое время
ВВП - выживаемость без прогрессирования
ДИ - доверительный интервал
ИТП - идиопатическая тромбоцитопеническая пурпура
ИФТ - иммунофенотипирование методом проточной цитометрии
ЛМЛ - лимфома из малых лимфоцитов
МНО - международное нормализованное отношение
МОБ - минимальная остаточная болезнь
МПИ - международный прогностический индекс
ОВ - общая выживаемость
ОР - отношение рисков
РФП - радиофармпрепарат
ХЛЛ - лимфоцитарный лейкоз
КТ - компьютерная томография
УДД - уровень достоверности доказательств
УУР - уровень убедительности рекомендаций
Термины и определения
ECOG - оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) - см. приложение Г1.
B-симптомы - неспецифические симптомы опухолевой интоксикации, включающие лихорадку выше 38 °C более 2 недель подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев.
Лимфома из малых лимфоцитов - это B-клеточная опухоль из мелких лимфоидных клеток без клинически манифестного лимфоцитоза (биологически и патогенетически - аналог хронического лимфоцитарного лейкоза).
Хронический лимфоцитарный лейкоз - это B-клеточная опухоль из мелких лимфоидных клеток, характеризующаяся значительным лимфоцитозом в крови (>= 5000 моноклональных B-лимфоцитов).
Первичный пациент - пациент с верифицированным диагнозом ХЛЛ/ЛМЛ, ранее не получавший лекарственного лечения
Трансформация - развитие диффузной B-клеточной крупноклеточной лимфомы (ДВКЛ) или лимфомы Ходжкина (ЛХ) на фоне ХЛЛ/ЛМЛ.
1. Краткая информация
1.1. Определение
Хронический лимфолейкоз (ХЛЛ) и лимфома из малых лимфоцитов (ЛМЛ) - это B-клеточные опухоли из мелких лимфоидных клеток. Хронический лимфолейкоз и лимфома из малых лимфоцитов биологически представляют собой одну опухоль. Отличие между ними в том, что при ХЛЛ в крови имеется значительный лимфоцитоз (> 5000 моноклональных B-лимфоцитов), тогда как при ЛМЛ клинически манифестного лимфоцитоза нет, несмотря на поражение лимфатических узлов, селезенки, костного мозга.
1.2. Этиология и патогенез
Этиология ХЛЛ неизвестна, обсуждается роль ретровирусов и генетических факторов ХЛЛ обусловлен пролиферацией клона трансформированных лимфоцитов, что приводит к увеличению лимфатических узлов, других лимфоидных органов, прогрессирующей лимфоидной инфильтрации костного мозга с вытеснением нормального кроветворения [1].
1.3. Эпидемиология
ХЛЛ - самый частый вид лейкозов у взрослых. В европейских странах его частота составляет 4:100 000 в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет > 30:100 000 в год. Медиана возраста на момент установления диагноза в европейских странах - 69 лет [2 - 5]. В Российской Федерации ХЛЛ выявляется реже: в 2016 г. заболеваемость составила 2,95:100 000 населения, медиана возраста на момент установления диагноза составила 68 лет [6].
1.4. Кодирование по МКБ 10
C91.1 - хронический лимфоцитарный лейкоз.
1.5. Классификация
ХЛЛ может классифицироваться по стадиям (см. раздел 1.5.1 Стадирование), а также по группам риска (см. раздел 1.5.2 Определение групп риска) [7].
Стадирование
Стадию ХЛЛ устанавливают на основании физикального исследования и анализа крови по критериям J.L. Binet (табл. 1) [7]. Компьютерная томография, рентгеновское исследование и УЗИ для установления стадии не требуется. Стадия констатируется на текущий момент, указывается в диагнозе и ориентирует в показаниях к терапии.
Таблица 1. Стадии ХЛЛ по Binet
Стадия
Характеристика
Медиана выживаемости, мес.
% пациентов в дебюте
A
Гемоглобин > 100 г/л, тромбоциты > 100 x 109/л, поражено < 3 лимфатических областей <*>
> 120
60
B
Гемоглобин > 100 г/л, тромбоциты > 100 x 109/л, поражено > 3 лимфатических областей <*>
61
30
C
Гемоглобин < 100 г/л или уровень тромбоцитов < 100 x 109/л
32
10
--------------------------------
<*> Лимфатические области:
- шейные лимфоузлы;
- подмышечные лимфоузлы (с одной или двух сторон);
- паховые лимфоузлы (с одной или двух сторон);
- печень;
- селезенка.
Определение групп риска
Международный прогностический индекс (МПИ) для ХЛЛ разработан на основании анализа выживаемости 3472 пациентов, включенных в восемь исследований, проводившихся в Европе и США [8]. Индекс основан на пяти параметрах:
1. наличие del(17p) и/или мутаций TP53,
2. мутационный статус генов вариабельного региона иммуноглобулинов,
3. уровень бета-2-микроглобулина,
4. стадия,
5. возраст пациентов.
Каждому из этих показателей присвоен балл, отражающий отношение рисков прогрессии или смерти (табл. 2). МПИ для ХЛЛ позволяет разделить пациентов на четыре группы: с низким риском прогрессии (0 - 1 балл), с промежуточным риском прогрессии (2 - 3 балла), с высоким риском прогрессии (4 - 6 баллов) и с очень высоким риском прогрессии (7 - 10 баллов). Общая выживаемость (ОВ) в этих группах показана в Приложении Г2 (табл. 3). Существуют данные, что МПИ позволяет стратифицировать пациентов в рецидиве ХЛЛ.
Таблица 2. Международный прогностический индекс
Параметр
"-" значение
ОР
Баллы
TP53 (17p)
Делеция/мутация
4,2
4
Статус IGHV
Без мутаций
2,6
2
B2M, мг/л
> 3,5
2,0
2
Стадия
B/C или Rai I - IV
1,6
1
Возраст
> 65 лет
1,7
1
Возможные значения шкалы
0 - 10
1.6. Клиническая картина
Заболевание может протекать бессимптомно или проявляться лимфаденопатией, увеличением миндалин, спленомегалией, гепатомегалией и неспецифическими симптомами, обусловленными анемией (утомляемость, недомогание), иммуносупрессией (например, лихорадка), интоксикацией (B-симптомы - лихорадка выше 38 °C более двух недель подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев).
2. Диагностика
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки УДД и УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
2.1. Жалобы и анамнез
- У всех пациентов с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном приеме рекомендуется сбор анамнеза и жалоб при заболеваниях органов кроветворения и крови для верификации диагноза [7].
Уровень GPP
Комментарии: При сборе анамнеза необходимо уточнить наличие в семейном анамнезе заболеваний органов кроветворения и крови. Жалобы могут отсутствовать, и тогда признаки заболевания выявляются при случайном обследовании. Может определяться бессимптомное увеличение лимфоузлов любой локализации. Могут присутствовать любые жалобы, связанные с вовлечением органов и тканей. При сборе жалоб особый акцент необходимо делать на неспецифические симптомы интоксикации (лихорадка выше 38 °C более двух недель подряд без признаков воспаления; ночные профузные поты; похудание на 10% массы тела за последние 6 месяцев).
2.2. Физикальное обследование
- У всех пациентов с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при оценке ремиссии через 2 месяца после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется выполнение визуального осмотра терапевтического, пальпации терапевтической и аускультации терапевтической для уточнения распространенности и тяжести течения заболевания [7].
Уровень GPP
Комментарий: При осмотре необходимо оценить общее состояние пациента по шкале ECOG (см. приложение Г1), а также осмотреть миндалины и полость рта; пальпация должна включать в себя пальпацию всех доступных групп периферических лимфатических узлов, печени, селезенки.
2.3. Лабораторная диагностика
- У всех пациентов с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при оценке ремиссии через 2 месяца после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания рекомендуется выполнить развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов для верификации диагноза, уточнения активности заболевания, возможности проведения терапии и/или (в случае ранее проведенной терапии) - развития нежелательных явлений лечения [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: В окрашенных препаратах периферической крови клетки ХЛЛ имеют морфологию малых лимфоцитов с узким ободком цитоплазмы, плотным ядром, глыбчатым хроматином, без отчетливого ядрышка. Реже встречается морфология активированных лимфоцитов - с более широким ободком цитоплазмы синего цвета или краевой базофилией. Среди лимфоцитов около 5% могут составлять атипичные клетки (с расщепленными, складчатыми ядрами), а также пролимфоциты - более крупные клетки с неравномерно распределенным хроматином в ядре, 1 - 2 нуклеолами, что не противоречит диагнозу ХЛЛ. Для ХЛЛ характерно выявление в крови разрушенных клеток - теней Гумпрехта. При выявлении более 55% пролимфоцитов в крови диагностируют пролимфоцитарный лейкоз, вариант которого (B- или T-клеточный) устанавливается при иммунофенотипировании [40].
- При подозрении на ХЛЛ у пациентов с лимфоцитозом более 5000 B-лимфоцитов в мкл рекомендуется выполнить иммунофенотипическое исследование лимфоцитов крови (ИФТ) методом проточной цитофлуориметрии с целью верификации диагноза [9].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: Диагноз ХЛЛ устанавливают при выявлении в крови >= 5000 B-лимфоцитов в 1 мкл периферической крови, при условии, что лимфоцитов сохраняется более 3 месяцев. Клональность B-лимфоцитов должна быть подтверждена с помощью иммунофенотипирования. Рекомендуемая для диагностики ХЛЛ минимальная диагностическая панель должна включать следующие маркеры: CD19, CD5, CD23, CD20, каппа, лямбда. В качестве дополнительных диагностических маркеров рекомендуется использовать CD43, CD200, CD79b, CD81. Часто рекомендуемые, но необязательные для диагностики и мониторирования опухолевой популяции ХЛЛ - CD22, FMC7, CD38. Классический фенотип клеток ХЛЛ характеризуется экспрессией B-клеточных антигенов CD 19, CD20, CD22, CD79b в сочетании с "T-клеточным" маркером CD5 и активационным - CD23. Опухолевые клетки экспрессируют один тип легкой цепи иммуноглобулинов (каппа или лямбда). Интенсивность экспрессии B-клеточных антигенов (CD20, CD22, CD79b), а также поверхностных иммуноглобулинов на клетках ХЛЛ ниже, чем на нормальных B-лимфоцитах. Тем не менее, можно встретить немало случаев, когда фенотип опухолевых клеток не вполне соответствует ХЛЛ.
- При подозрении на ЛМЛ у пациентов без клинического лимфоцитоза в крови, а также у пациентов с подозрением на трансформацию рекомендуется выполнить биопсию лимфатического узла (очага поражения) для верификации диагноза [10].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: В гистологических препаратах морфологический субстрат представлен диффузным ростом небольших лимфоидных клеток с округлыми ядрами, комковатым хроматином, без отчетливых ядрышек. В срезах ткани лимфатического узла нередко присутствуют фолликулоподобные структуры - псевдофолликулы, так называемые зоны роста, представленные увеличенным количеством параиммунобластов, клеток с морфологией пролимфоцитов с различимыми ядрышками. Детальное гистологическое описание дается в соответствующих разделах рекомендаций. При прогрессии ХЛЛ размер этих псевдофолликулов увеличивается, они могут сливаться. У 3 - 5% пациентов с ХЛЛ и ЛМЛ развивается диффузная B-крупноклеточная лимфома или лимфома Ходжкина. Появление крупноклеточной лимфомы на фоне ХЛЛ называется синдромом Рихтера. Появление лимфомы Ходжкина на фоне ХЛЛ называется ходжкинской трансформацией. Во всех случаях локального быстрого увеличения лимфоузлов или существенного изменения клинической картины болезни (появления B-симптомов - внезапной потери веса, ночной потливости) необходимо выполнить биопсию лимфатического узла, костного мозга или экстранодального очага. Синдром Рихтера констатируется только на основании гистологического исследования.
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется выполнение анализа крови биохимического общетерапевтического для уточнения состояния пациента и выработки адекватной терапевтической тактики [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Биохимический анализ крови должен обязательно включать определение следующих параметров: ЛДГ, мочевая кислота, мочевина, креатинин, общий белок, альбумин, билирубин, АСТ, АЛТ, щелочная фосфатаза, калий, натрий, хлор, кальций, ![]() -2 микроглобулин.
-2 микроглобулин.
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется выполнение коагулограммы для уточнения состояния пациента и выработки адекватной терапевтической тактики [40 - 42].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Коагулограмма должна включать определение следующих параметров: протромбин, МНО, АЧТВ, фибриноген, тромбиновое время, антитромбин III, плазминоген, D-димер.
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется выполнение прямого антиглобулинового теста (прямой пробы Кумбса) для уточнения наличия гемолитических осложнений ХЛЛ [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется выполнение общего (клинического) анализа мочи для выявления сопутствующей патологии и выработки адекватной терапевтической тактики [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется определение основных групп крови по системе АВО, определение антигена D системы Резус (резус-фактора) для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [40].
Уровень убедительности рекомендаций 5 (уровень достоверности доказательств C)
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением терапии анти-CD20 антителами или ибрутинибом**, рекомендуется выполнение развернутого вирусологического обследования для выявления маркеров вируса гепатита В с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита [11], которое должно включать:
1. Определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови
2. Определение антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis В virus) в крови
3. Определение антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови
4. Определение ДНК вируса гепатита B (Hepatitis B virus) в крови методом ПЦР, качественное исследование.
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: Этому вопросу применительно к ХЛЛ уделяется особое внимание, поскольку клетки ХЛЛ являются дополнительным резервуаром для вируса гепатита B. Значение маркеров вирусного гепатита B представлено в Приложении Г2.
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением первой линии противоопухолевой терапии рекомендуется молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [7]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с подозрением на ХЛЛ/ЛМЛ рекомендуется выполнить получение гистологического препарата костного мозга (трепанобиопсию костного мозга) для оценки объема поражения костного мозга и состояния остальных ростков кроветворения, исключения поражения костного мозга другими опухолями и инфекциями, а также для получения исходного образца костного мозга, необходимого для сравнения с образцом, полученным после проведения терапии [10] в следующих случаях:
1. Первичным пациентам - перед началом терапии (не обязательно, но желательно)
2. При подозрении на трансформацию
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: Гистологический диагноз ХЛЛ устанавливается при наличии в костном мозге диффузного лимфоидного пролиферата из мономорфных клеток небольшого размера с округлыми ядрами, комковатым хроматином, в зависимости от условий фиксации - без/с неотчетливыми ядрышками, с тонкостенными сосудами капиллярного/венулярного типа; обычно разрозненно расположены крупные клетки с морфологией параиммунобластов, иногда присутствуют псевдофолликулы (пролиферативные центры). При иммуногистохимическом исследовании лимфоидный пролиферат характеризуется экспрессией CD20 (гетерогенная по интенсивности, преимущественно слабая мембранная реакция), CD79a, IgM, ядерной экспрессией PAX 5, LEF1 (ядерная реакция), коэкспрессией CD5 (мембранная реакция) и CD23 (мембранная реакция), CD43 при отсутствии экспрессии CD10, BCL-6, Cyclin D1. Экспрессия LEF1 (ядерная экспрессия) более интенсивно выражена в клетках пролиферативных центров, в клетках с морфологией пролимфоцитов. Для клеток пролиферативных центров характерна более интенсивная экспрессия CD20, IgM, LEF1, иногда часть клеток псевдофолликулов (пролиферативных центров) экспрессирует cyclin D1 - слабая ядерная реакция, без Индекс пролиферативной активности Ki-67 - невысокий, обычно составляет 5 - 15% позитивных клеток в зонах диффузного мелкоклеточного инфильтрата. При иммуногистохимическом исследовании на парафиновом материале может отсутствовать экспрессия CD5 (до 20 - 25% случаев). Экспрессией BCL-2 характеризуются все варианты мелкоклеточных B-клеточных лимфом, коэкспрессия IgM и IgD характерна для лимфоцитарной лимфомы и лимфомы из клеток мантии. Экспрессия LEF1 характерна для лимфоцитарной лимфомы с трансформацией в диффузную B-клеточную крупноклеточную лимфому (синдром Рихтера) и позволяет провести дифференциальную диагностику с CD5+ диффузной B-клеточной крупноклеточной лимфомой.
Получение гистологического препарата костного мозга (трепанобиопсия костного мозга) не требуется для подтверждения и формулирования диагноза ХЛЛ/ЛМЛ.
Биопсия костного мозга является не обязательной, но желательной процедурой перед началом терапии. Хронический лимфолейкоз нередко сочетается с другими опухолями, которые могут метастазировать в костный мозг и выявляться только по биопсии и даже быть причиной цитопении. Иммунохимиотерапия флударабин-содержащими режимами нередко осложняется цитопениями. Наличие исходного образца костного мозга позволяет дифференцировать прогрессию, аплазию, развитие миелодиспластического синдрома/ОМЛ, аутоиммунные цитопении.
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза, после каждой иммуносупрессивной терапии и после каждой тяжелой бактериальной инфекции рекомендуется определение иммунного статуса для уточнения риска развития инфекционных осложнений терапии и необходимости назначения соответствующей профилактики [7].
1. Исследование уровня иммуноглобулина A в крови
2. Исследование уровня иммуноглобулина M в крови
3. Исследование уровня иммуноглобулина G в крови
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза и 1 раз в 1 - 2 года рекомендуется определение уровня витамина D как одного из прогностических и предикторных показателей при этом заболевании [52].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Дефицит витамина D у пациентов ХЛЛ ассоциируется с меньшим временем до назначения терапии, меньшей длительностью ремиссии, меньшей общей выживаемостью.
2.4. Инструментальная диагностика
- Всем пациентам перед началом терапии ХЛЛ/ЛМЛ, перед началом терапии, при оценке ремиссии через 2 месяца после завершения терапии (если в грудной клетке исходно имелись очаги болезни), а также при подозрении на рецидив заболевания рекомендуется рассмотреть возможность и необходимость выполнения КТ грудной клетки, органов брюшной полости и малого таза (с контрастированием) для уточнения наличия и распространенности лимфаденопатии [7]
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, перед началом терапии ХЛЛ/ ЛМЛ, перед началом терапии, при оценке ремиссии через 2 месяца после завершения терапии (если в грудной клетке исходно имелись очаги болезни), а также при подозрении на рецидив заболевания рекомендуется выполнить рентгенографию органов грудной клетки в двух проекциях для уточнения наличия и распространенности лимфомы [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
- Пациентам с противопоказаниями к КТ, либо при невозможности выполнения КТ, при установке диагноза ХЛЛ/ЛМЛ, перед началом терапии, при оценке ремиссии через 2 месяца после завершения терапии, а также при подозрении на рецидив заболевания рекомендуется выполнить ультразвуковое исследование лимфатических узлов и внутренних органов для уточнения наличия и распространенности лимфаденопатии [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: При ультразвуковом исследовании необходимо оценить периферические лимфатические узлы, внутрибрюшные, забрюшинные узлы, органы брюшной полости и малого таза.
- Пациентам с подозрением на ХЛЛ/ЛМЛ, либо с установленным диагнозом ХЛЛ/ЛМЛ, у которых имеются клинические признаки синдрома Рихтера (прогрессирующий рост лимфоузлов, потеря веса, персистирующая лихорадка без признаков инфекции, высокий уровень ЛДГ, гиперкальциемия), рекомендуется выполнить позитронную эмиссионную томографию всего тела с туморотропными РФП для исключения трансформации либо для выявления зон с вероятной трансформацией [12].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: При значениях SUV < 5 вероятность синдрома Рихтера составляет около 3% [43]. Типичными для синдрома Рихтера значениями SUV является > 15. Если интенсивность накопления препарата отчетливо различается в разных зонах, необходимо выполнение биопсии наиболее активного узла или очага.
2.5. Иная диагностика
- Всем пациентам с ХЛЛ/ЛМЛ перед началом первой и всех последующих линий терапии рекомендуется при наличии возможности проведение цитогенетического исследования методом FISH на делецию 17(p) и определение мутаций гена TP53 для определения прогностической группы и выработки тактики лечения [8].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: Делеция 17p является главным цитогенетическим маркером, непосредственно влияющим на терапевтическую тактику. Рекомендуется проводить скрининг на делецию 17p у всех пациентов, имеющих показания к началу терапии и/или при неэффективности стандартной терапии, особенно пациентам моложе 55 лет, которым может быть проведена аллогенная трансплантация.
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза рекомендуется определение мутации IGHV для уточнения прогноза заболевания [8].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: Мутации генов вариабельных участков тяжелых цепей иммуноглобулинов (IGHV) имеют прогностическое значение. В настоящее время прогноз у пациентов с ХЛЛ оценивают по международному прогностическому индексу для ХЛЛ (см. раздел 5.1). Индекс требует оценки) ![]() -2-микроглобулина, мутационного статуса IGHV, а также цитогенетического исследования. Где возможно, желательно определение этих показателей. У пациентов с мутациями IGHV без факторов неблагоприятного прогноза, достигших МОБ-негативной ремиссии после 3 циклов, возможно сокращение доз препаратов или числа циклов FCR. При этом ремиссии у данной группы пациентов столь же длительны. С учетом высокой информативной ценности в отношении времени до терапии, эффективности иммунохимиотерапии, времени до рецидива мутационный статус VH-генов рекомендуется определять по возможности, однако данное исследование не является обязательным вне клинических исследований.
-2-микроглобулина, мутационного статуса IGHV, а также цитогенетического исследования. Где возможно, желательно определение этих показателей. У пациентов с мутациями IGHV без факторов неблагоприятного прогноза, достигших МОБ-негативной ремиссии после 3 циклов, возможно сокращение доз препаратов или числа циклов FCR. При этом ремиссии у данной группы пациентов столь же длительны. С учетом высокой информативной ценности в отношении времени до терапии, эффективности иммунохимиотерапии, времени до рецидива мутационный статус VH-генов рекомендуется определять по возможности, однако данное исследование не является обязательным вне клинических исследований.
3. Лечение
3.1. Показания к началу терапии B-клеточного хронического лимфолейкоза
- Всем пациентам с верифицированным ХЛЛ/ЛМЛ рекомендуется начало специфической терапии только при наличии показаний в соответствии с критериями IwCLL 2018 (приложение Г4) [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Около 30% пациентов (две трети пациентов со стадией A в дебюте) имеют медленно прогрессирующее течение ХЛЛ, причем продолжительность их жизни близка к общепопуляционной. Наличие такой группы пациентов делает обоснованной тактику выжидательного наблюдения до появления показаний к терапии. Вследствие этого терапия ХЛЛ должна начинаться при наличии показаний по критериям IwCLL 2018. Пациенты в стадии A с АИГА или ИТП должны получать лечение по поводу этих осложнений (например, преднизолон), а не противолейкозную терапию. Если аутоиммунное осложнение плохо отвечает на терапию стероидами, возможно применение направленной на ХЛЛ иммунохимиотерапии. Бессимптомная гипогаммаглобулинемия и наличие моноклональной секреции сами по себе не являются показаниями к лечению. Выявление маркеров отрицательного прогноза, в том числе делеции 17p НЕ является показанием к началу терапии.
3.2. Первая линия лечения ХЛЛ
Цели лечения в первую очередь определяются возрастом, а также числом и тяжестью сопутствующих заболеваний (табл. 5).
Таблица 5. Подразделение на группы пациентов с ХЛЛ
Коморбидность, возраст
Нет значимой коморбидности
Значимая коморбидность
Старческий возраст
органные патологии
Цель терапии
Долгосрочная ремиссия, эрадикация МОБ
Контроль над болезнью, низкая токсичность
Паллиативная
Существует объективная шкала оценки числа и тяжести сопутствующих заболеваний (коморбидности) - CIRS (Cumulative Illness Rating Score). В реальной клинической практике оценка кумулятивного индекса коморбидности не требуется. В настоящее время понятие "значимая коморбидность" не может быть объективно и воспроизводимо определено. В связи с этим распределение пациентов на терапевтические группы определяется решением врача.
Результаты крупных клинических исследований 2000 годов убедительно свидетельствуют о низкой эффективности иммунохимиотерапии у пациентов с делецией 17p. Однако это цитогенетическое нарушение выявляется до терапии первой линии только у 7% пациентов. Число пациентов с клинической рефрактерностью (прогрессия на фоне лечения или быстрый рецидив) приблизительно вдвое больше. Эти наблюдения легли в основу понятия хронического лимфоцитарного лейкоза высокого риска. В настоящее время благодаря методам глубокого секвенирования установлено, что большинство случаев рефрактерности обусловлено утратой TP53 либо за счет делеции в сочетании с мутациями, либо за счет мутаций гена. Поэтому сегодня выполнения FISH на делецию 17p недостаточно. Для того, чтобы идентифицировать наибольшее число пациентов с устойчивостью к иммунохимиотерапии, необходимо также исследовать мутации TP53. Наличие мутации констатируется, если число клеток с мутацией превышает 10%.
Таким образом, при проведении терапии первой линии пациенты могут быть распределены на три группы.
1. К первой группе относятся пациенты без делеции 17p и/или мутации TP53 с хорошим соматическим статусом без сопутствующих заболеваний. В этой группе необходимо стремиться к достижению полной ремиссии, по возможности с эрадикацией МОЕ, поскольку только такая тактика может привести к реальному увеличению продолжительности жизни. Основой лечения пациентов этой группы являются курсовая иммунохимиотерапия. В подгруппе пациентов без мутаций VH-генов комбинация ибрутиниба и ритуксимаба оказалась значительно более эффективной и менее токсичной по сравнению с режимом FCR. У пациентов без мутаций VH-генов может рассматриваться терапия ибрутинибом.
2. Ко второй группе относятся пациенты преклонного возраста (старше 65 лет) со множеством сопутствующих заболеваний. В этой группе нужно стремиться к достижению эффективного контроля над опухолью, избегая неоправданной токсичности. Аналоги пуринов в этой группе лучше не использовать или применять в редуцированном виде.
3. К третьей группе относятся пациенты с делецией 17p и/или мутацией TP53, независимо от возраста и коморбидности. Выбором терапии у этих пациентов является ибрутиниб** в монорежиме. У молодых пациентов при возможности терапия ибрутинибом** должна служить подготовкой к трансплантации аллогенных стволовых клеток.
У пациентов старческого возраста с органными недостаточностями цель лечения паллиативная.
Первая линия лечения ХЛД/ЛМЛ у пациентов моложе 65 лет с хорошим соматическим статусом без выявленной делеции 17p или мутации TP53
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности (физически активные, нет тяжелых сопутствующих заболеваний, нормальная функция почек) без делеции 17p или мутации TP53 в качестве первой линии лечения рекомендуется проведение иммунохимиотерапии по схеме FCR (схемы режимов лечения - см. приложение Г6) [14, 15].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: Стандартом терапии первой линии у молодых пациентов с хорошим соматическим статусом (кроме пациентов с del(17p) и/или мутацией TP53) является режим FCR (флударабин** циклофосфамид** ритуксимаб**). Обновленные в 2016 году результаты исследования CLL8 показали [15], что в группе FCR число выживших при медиане наблюдения, равной 5,9 лет, составило 78,7% по сравнению с 66,9% в группе FC (отношение рисков [OP] = 0,68, 95% доверительный интервал (ДИ) 0,535 - 0,858, p = 0,001). Медиана выживаемости без прогрессирования (ВВП) у пациентов с мутациями IGHV, получавших лечение по схеме FCR, не достигнута. При этом режим FCR ассоциируется с высокой частотой развития нежелательных явлений (НЯ), особенно цитопении и инфекционных осложнений. Лейкопения и нейтропения 3 - 4-й степени тяжести согласно общим критериям токсичности (CTC) наблюдались у 24% и 34% пациентов, получавших FCR, у 25% зафиксировано развитие инфекций 3 - 4 степени тяжести.
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65 - 70 лет без значимой коморбидности (физически активные, нет тяжелых сопутствующих заболеваний, нормальная функция почек) без делеции 17p или мутации TP53, которым не может быть проведен режим FCR (схемы режимов лечения - см. приложение Г4), в качестве первой линии рекомендуется проведение иммунохимиотерапии по схеме BR (схемы режимов лечения - см. приложение Г4) [16, 17].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: При невозможности проведения режима FCR альтернативным вариантом первой линии терапии может быть комбинация бендамустина** и ритуксимаба** (BR). В исследовании CLL10 [17] показано, что режим BR менее токсичен по сравнению с режимом FCR, хотя и менее эффективен. Частота общего ответа (00) в обеих группах составила 95 - 96%. Медиана ВВП также оказалась больше в группе FCR (55,2 месяца против 41,7, отношение рисков = 1,643, 95% ДИ 1,308 - 2,064, p = 0,0003). Нейтропения и инфекционные осложнения 3 - 4-й степени тяжести по CTC значительно чаще регистрировались в группе FCR (87,7% против 67,8%, p < 0,001, и 39,8% против 25,4%, (p = 0,001), особенно у пациентов старше 65 лет (48,4% против 26,8%, p = 0,001). Частота развития анемии и тромбоцитопении, а также случаев смерти, связанной с лечением, между группами статистически достоверно не отличалась (3,9% против 2,1%). В исследовании CLL10 показано, что эффективность режимов BR и FCR у пациентов старше 65 лет сопоставима. В многоцентровом российском исследовании показано, что режим BR разумно безопасен и высокоэффективен в терапии первой линии у пациентов с ХЛЛ при назначении бендамустина** в дозе 90 мг/м с комбинации ритуксимабом** в 2 2 дозе 375 мг/м в 1 цикле и 500 мг/м в циклах 2 - 6.
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65 - 70 лет без значимой коморбидности без мутаций VH-генов, при наличии возможности в качестве одной из опций первой линии терапии рекомендуется терапия ибрутинибом** в монорежиме или в комбинации с ритуксимабом** (схемы режимов лечения - см. приложение Г4) [44, 45].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: В исследовании E1912 пациенты моложе 70 лет без делеции 17p рандомизировались на 2 ветки: ибрутиниб** в комбинации с ритуксимабом** и режим FCR. В исследование включено 529 пациентов. Комбинация ибрутиниба** и ритуксимаба** значительно превзошла FCR по эффективности и безопасности. Наблюдалось значительное улучшение как беспрогрессивной (ОР: 0,352; 95% интервал (ДИ): 0,223 - 0,558; p < 0,0001), так и общей выживаемости (ОР: 0,168; 95% ДИ: 0,053 - 0,538; p = 0,0003). Режим FCR чаще вызывал нейтропению 3 - 4 степени (44% против 23%; p < 0,0001), а также инфекционные осложнения (17,7% против 7,1%; p < 0,0001) [41]. Наиболее существенное превосходство по БПВ и ОБ получено у пациентов без мутаций VH-генов (ОР: 0,262; 95% ДИ: 0,137 - 0,498; p < 0,0001). На основании полученных данных ибрутиниб** в настоящее время рекомендуется NCCN как терапия первой линии у первичных пациентов ХЛЛ без мутаций VH-генов. У пациентов с мутациями VH-генов FCR вызывает длительные ремиссии. В этой подгруппе пациентов ибрутиниб** не имеет значительного преимущества.
Первая линия лечения ХЛЛ у пожилых пациентов и пациентов с коморбидностью без выявленной делеции 17p или мутации TP53
- Пациентам с верифицированным ХЛЛ/ЛМЛ старше 65 - 70 лет и пациентам с тяжелыми сопутствующими заболеваниями или с угнетением почечной функции без делеции 17p или мутации TP53 рекомендуется проведение первой линии терапии по одной из следующих схем, в зависимости от предпочтений и опыта центра и лечащего врача (схемы режимов лечения - см. приложение Г4):
1. Хлорамбуцил** + обинутузумаб** [18];
2. Бендамустин** +/- ритуксимаб** [16, 17, 19];
3. Ибрутиниб** +/- ритуксимаб** [20, 21, 46];
4. Режим FCR-Lite [22];
5. Хлорамбуцил** + ритуксимаб** [23, 24].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: У пожилых пациентов могут применяться менее интенсивные иммунохимиотерапевтические режимы, терапия таргетными препаратами.
В исследовании MABLE [19] сравнивались режимы BR и Clb-R у пожилых пациентов и показана более высокая частота полных ремиссий в группе BR, а также увеличение ВВП (39,6 месяца против 29,9, соответственно, p = 0,003). По данным российского рандомизированного исследования, применение режима FCR-Lite позволило увеличить медиану ВВП пожилых пациентов ХЛЛ до 37,1 месяца (по сравнению с 26 месяцами при применении режима Clb-R) [22].
В исследовании немецкой группы по изучению ХЛЛ CLL11 сравнивались монотерапия хлорамбуцилом** (Clb), комбинация хлорамбуцила** с ритуксимабом** (R-Clb) и комбинация хлорамбуцила** с обинутузумабом** (G-Clb) [18]. Наибольшая частота ответа и полных ремиссий отмечалась в группе G-Clb (00 - 77,3%, ПО - 22,3%). Режим G-Clb позволяет добиться эрадикации МОЕ в периферической крови и костном мозге у 37,6 и 19,5% пациентов, соответственно. Обинутузумаб в сочетании с хлорамбуцилом** позволяет увеличить ВВП до 26,7 месяца (p < 0,0001 в сравнении с R-Clb и хлорамбуцилом**). Инфузии обинутузумаба** следует проводить при наличии доступа к средствам экстренной медицинской помощи с адекватным мониторингом. У пациентов с большой массой опухоли оправдана предфаза в виде 1 - 2 курсов монотерапии хлорамбуцилом**, направленной на уменьшение массы опухоли. Адекватная профилактика инфузионных реакций (премедикация антигистаминными препаратами и дексаметазоном** в/в, введение первой дозы в два этапа, профилактический отказ от антигипертензивных препаратов) позволяет справляться с инфузионными реакциями. В большинстве случаев они возникают только при первой инфузии обинутузумаба**, так как гиперлимфоцитоз обычно полностью разрешается за неделю.
В 2018 г. были представлены результаты 4-летнего наблюдения данные исследования Resonate-2, в котором сравнивались монотерапия ибрутинибом** и хлорамбуцилом** в первой линии терапии ХЛЛ у пожилых пациентов [20, 21]. В исследовании продемонстрировано значительное превосходство ибрутиниба** по сравнению с хлорамбуцилом**, в том числе по общей выживаемости. Медиана БПВ в группе ибрутиниба** не достигнута при медиане продолжительности наблюдения в 48 месяцев. БПВ была значительно выше при применении ибрутиниба** во всех подгруппах пациентов, в том числе у пациентов с неблагоприятными генетическими факторами. Общая выживаемость была значительно выше в группе ибрутиниба** по сравнению с хлорамбуцилом**. Общий ответ составил 86% в группе пациентов, получавших ибрутиниб, и 35% - в группе пациентов, получавших хлорамбуцил** с достоверной разницей (p < 0,0001). Терапия ибрутинибом** в первой линии не сопровождалась значительным повышением нежелательных явлений и не требовала пребывания пациентов в стационаре.
В исследовании Alliance первичные пациенты старше 65 лет рандомизировались на 3 ветки: режим BR, комбинацию ибрутиниба и ритуксимаба и монотерапию ибрутинибом [46]. Двухлетняя БПВ в группе бендамустин + ритуксимаб составила 74%, в группе ибрутиниба 87%, в группе ибрутиниб + ритуксимабом - 88%. Частота гематологических нежелательных явлений 3, 4 или 5 степени была выше в группе бендамустина с ритуксимабом (61%) в сравнении с ибрутинибом в монотерапии (41%) или ибрутиниба в комбинации с ритуксимабом (39%).
Добавление моноклонального антитела против CD20 к хлорамбуцилу** улучшает результаты лечения при приемлемой токсичности. В двух нерандомизированных исследованиях [23, 24], выборки пациентов в которых различались по коморбидности, показано, что добавление ритуксимаба** к хлорамбуцилу** увеличивает медиану ВБП с 18 до 24 месяцев, кроме пациентов с del11q, у которых ВБП составила 12 месяцев. Комбинация хлорамбуцила** с ритуксимабом** значительно уступает по эффективности всем остальным вариантам лечения пожилых пациентов. По возможности, предпочтительно выбирать другие варианты лечения.
- Пациентам с верифицированным ХЛЛ/ЛМЛ старше 75 - 80 лет с невысокой ожидаемой продолжительностью жизни, обусловленной возрастом, органной недостаточностью, тяжелыми сопутствующими заболеваниями, рекомендуется проводить наименее токсичные варианты терапии:
- монотерапию хлорамбуцилом** [25];
- монотерапию aHTM-CD20 моноклональными антителами [26];
- монотерапию ибрутинибом в малых дозах [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 3)
Первая линия лечения ХЛЛ у пациентов с делецией 17p или мутацией TP53
- Пациентам с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53) при наличии возможности рекомендуется терапия ибрутинибом** до прогрессии или непереносимой токсичности. Ибрутиниб** может применяться как в монорежиме, так и в комбинации с иммунохимиотерапией. [20, 27].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- Молодым пациентам с верифицированным ХЛЛ/ЛМЛ без значимой коморбидности из группы высокого риска (с del(17p) и/или мутацией TP53) после терапии ибрутинибом** и при достижении объективного ответа в первой линии рекомендуется рассмотреть возможность проведения трансплантации аллогенных гемопоэтических стволовых клеток в качестве консолидации [28, 29].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
Комментарии: Оптимальным сроком проведения трансплантации следует считать второй год терапии ибрутинибом**.
- Пациентам с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53), которым лечение ибрутинибом** не может быть назначено, при наличии возможности рекомендуется назначение венетоклакса [30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- Пациентам с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53), у которых нет возможности проведения терапии ибрутинибом** или венетоклаксом, рекомендуется консультация в специализированном онкологическом или гематологическом медицинском центре с рассмотрением возможности проведения современной терапии в федеральном центре или участия пациента в клиническом исследовании, либо, в крайнем случае, терапия одним из режимов иммунохимиотерапии, применяемых для первой линии терапии ХЛЛ - HDMP + моноклональное aHTH-CD20 антитело или другими [31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Стандартные режимы иммунохимиотерапии малоэффективны у пациентов с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53), их применение в этой группе пациентов не обосновано и нежелательно.
3.3. Выбор терапии ХЛЛ второй и последующих линий
Выбор терапии при рецидивах ХЛЛ зависит от следующих факторов:
- терапия первой линии;
- время наступления рецидива;
- клиническая картина в рецидиве.
В терапии рецидива, как и в терапии 1 линии, принципиальное значение имеет определение делеции 17p и мутации TP53. Утрата функции TP53 в рецидиве наблюдается у 20% пациентов. При выявлении утраты TP53, как и в первой линии, наиболее оправданной является терапия ибрутинибом** если он не применялся ранее.
- У пациентов с поздним рецидивом ХЛЛ/ЛМЛ после иммунохимиотерапии (> 24 мес. после последней терапии) при отсутствии делеции 17p/мутации TP53 рекомендуется один из следующих вариантов лечения:
- повтор иммунохимиотерапии 1 линии [32];
- альтернативный режим иммунохимиотерапии [32, 33];
- ибрутиниб** +/- BR (схемы режимов лечения - см. приложение Г4) [34 - 37];
- комбинация венетоклакса и ритуксимаба** [38].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
Комментарии: У пациентов с поздним рецидивом выбор терапии зависит от вида, результатов и переносимости последней терапии, общего состояния и коморбидности пациента, а также предпочтений и возможностей клиники. Повторные флударабин-содержащие курсы возможны при условии, что при проведении этой терапии в первой линии не наблюдалась значительная токсичность - тяжелые затяжные цитопении, повлекшие за собой многомесячные перерывы в лечении, и развитие тяжелых инфекционных осложнений. В качестве терапии второй линии можно вернуться к той же схеме. Если ранее лечение проводилось по программе FC, в качестве второй линии может применяться FCR. У пациентов с цитопениями может быть эффективен режим R-HDMP (ритуксимаб- ** в сочетании с высокими дозами стероидов). В исследованиях II фазы получены убедительные данные об эффективности режима BR (бендамустин** + ритуксимаб**). У пациентов, ранее получавших хлорамбуцил, может быть эффективна терапия бендамустином** режимами BR и FCR-Lite. Результаты трех исследований говорят о высокой эффективности ибрутиниба** в терапии рецидивов ХЛЛ [34 - 37]. Эффективность монотерапии ибрутинибом** у пациентов с рецидивами составляет более 90%. Другой эффективной схемой в лечении рецидивов является комбинация венетоклакса с ритуксимабом**: в исследовании MURANO ВВП на комбинации венетоклакс + ритуксимаб** составила 84,9% в сравнении с 36,3% для комбинации бендамустин** + ритуксимаб** [38]. ВВП была значительно выше во всех клинических и биологических подгруппах пациентов.
- У пациентов с ранним рецидивом (< 24 мес. после последней терапии) ХЛЛ/ЛМЛ, ранее не получавших ибрутиниб**, вне зависимости от делеции 17p/мутации TP53, при наличии возможности рекомендуется монотерапия ибрутинибом** [34 - 35].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2)
- У пациентов с ранним рецидивом (< 24 мес. после последней терапии) ХЛЛ/ЛМЛ, имеющих противопоказания к назначению ибрутиниба**, вне зависимости от делеции 17p/мутации TP53, при наличии возможности рекомендуется комбинация венетоклакса и ритуксимаба** [38].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 2)
- У пациентов с ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности, получивших, в связи с ранним рецидивом или с выявлением в рецидиве делеции 17p и/или мутации TP53, ибрутиниб** или комбинацию венетоклакса с ритуксимабом** и при достижении выраженного объективного ответа на терапию рецидива, рекомендуется рассмотреть возможность проведения аллогенной трансплантации гемопоэтических стволовых клеток в качестве консолидации [28, 29].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- У пациентов с ХЛЛ/ЛМЛ, у которых наблюдался рецидив во время приема ибрутиниба**, при наличии возможности рекомендуется монотерапия венетоклаксом [30].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 3)
- У пациентов с ранним рецидивом либо рефрактерным течением ХЛЛ/ЛМЛ (< 24 мес. после последней терапии либо во время приема ибрутиниба**) вне зависимости от делеции 17p/мутации TP53, у которых нет возможности проведения терапии ибрутинибом** или венетокласом, рекомендуется консультация в федеральном центре с рассмотрением возможности проведения современной терапии в федеральном центре или участия пациента в клиническом исследовании, либо, в крайнем случае, терапия альтернативным режимом иммунохимиотерапии [31].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
3.4. Сопутствующая и сопроводительная терапия
- Пациентам с ХЛЛ/ЛМЛ на любом этапе лечения, у которых выявляется уровень иммуноглобулина G менее 5 г/л и отмечаются рецидивирующие бактериальные инфекции, рекомендуется при наличии возможности проведение постоянной заместительной терапии внутривенным иммуноглобулином для снижения риска инфекционных осложнений [48].
Уровень убедительности рекомендаций A (уровень достоверности доказательств 1)
Комментарии: Инфекции являются ведущей причиной смерти у 10 - 15% пациентов хроническим лимфолейкозом. В нескольких рандомизированных исследованиях показана эффективность постоянной заместительной терапии внутривенным иммуноглобулином в снижении числа бактериальных инфекций. Эффект наиболее значим в подгруппе больных с гипогаммаглобулинемией и рецидивирующими инфекциями. Поэтому заместительная терапия в настоящее время рекомендуется только этой категории пациентов.
Внутривенный иммуноглобулин назначается в виде разовых инъекций в дозе 200 - 400 мг/кг один раз в месяц в течение года. Цель терапии состоит в поддержании уровня IgG на уровне выше 5 г/л. При подборе дозы и кратности введений ориентируются на пиковую и минимальную концентрации IgG. Контроль пиковой концентрации IgG осуществляют после первого введения внутривенного иммуноглобулина, не ранее, чем через сутки. Контроль минимальной концентрации определяют непосредственно перед следующим введением иммуноглобулина. Минимальная концентрация IgG должна быть выше 5 г/л. Повторные определения минимальной концентрации проводят 1 раз в 3 - 6 месяцев. Постоянную заместительную терапию иммуноглобулином завершают при отсутствии тяжелых бактериальных инфекций в течение года.
- Всем пациентам с ХЛЛ/ЛМЛ после установления диагноза при отсутствии противопоказаний рекомендуется проведение вакцинации [49 - 51]:
- сезонная вакцинация антигриппозной вакциной;
- вакцинация пневмококковой вакциной, при отсутствии противопоказаний.
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Пневмококковая иммунизация осуществляется двукратно. Сначала вводится конъюгат пневмококковой вакцины, содержащий 13 пневмокковых антигенов. Через 2 месяца осуществляют введение пневмококковой полисахаридной вакцины, содержащей 23 пневмококковых антигена. Пневмококковая ревакцинация проводится 1 раз в 5 лет.
Применение вакцин против инкапсулированных организмов, таких как Streptococcus pneumonia, Haemophilus influenzae и Neisseria meningitides, рекомендовано во многих странах пациентам с ХЛЛ до химиотерапии (не менее, чем за 2 недели) или после восстановления иммунной системы после терапии (не ранее, чем через 3 месяцев. Это особенно важно для пациентов с функциональной аспленией или которым планируется спленэктомия. Методика последовательной двухкратной вакцинации получена эмпирически на основании того, что ответ на 23-валентную вакцину слабее, чем на 13-валентную вакцину. С другой стороны, 23-валентная вакцина позволяет расширить иммунный ответ и усилить его.
- Всем пациентам с ХЛЛ/ЛМЛ с дефицитом витамина D рекомендуется проведение заместительной терапии [52].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Дефицит витамина D у пациентов ХЛЛ ассоциируется с меньшим временем до назначения терапии, меньшей длительностью ремиссии, меньшей общей выживаемостью.
3.5. Оценка ответа на лечение
- Всем пациентам с ХЛЛ/ЛМЛ рекомендуется оценка терапии по критериям iwCLL 2018 г. (см. Приложение Г4), при получении терапии ограниченной длительности (не менее чем через 2 месяца после окончания терапии); при получении непрерывной терапии или поддерживающей терапии (не менее чем через 2 месяца после достижения максимального ответа) [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Максимальный ответ определяется как ответ, который не становится лучше в течение двух последних месяцев терапии. Ингибиторы сигнального пути B-клеточного рецептора вызывают перераспределительный лимфоцитов. Персистирующий лимфоцитоз при терапии ибрутинибом** не является признаком рефрактерности. Это состояние обозначается как частичный ответ с лимфоцитозом. Срок нормализации уровня лимфоцитов колеблется в разных исследованиях от 4 до 12 месяцев; однако при применении ибрубиниба лимфоцитоз может персистировать в течение 12 месяцев и более, что не влияет на прогноз пациента. У ряда пациентов уровень лимфоцитов никогда не возвращается к норме.
4. Реабилитация
- Всем пациентам с ХЛЛ/ЛМЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также, при необходимости, поддерживающая терапия [39].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Специальных методов реабилитации при ХЛЛ/ЛМЛ не существует. Реабилитация пациентов с ХЛЛ должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия социальных работников и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем.
Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
Поддерживающая терапия при необходимости проводится по месту жительства под наблюдением врача-гематолога или врача-онколога. Врач-гематолог или врач-онколог по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего лечение.
5. Профилактика
Методов профилактики ХЛЛ/ЛМЛ в настоящее время не существует, поскольку неизвестен этиологический фактор(ы), ведущие к развитию заболевания.
- Всем пациентам с ХЛЛ/ЛМЛ на протяжении всей жизни пациента - как в период лечения, так и вне лечения ХЛЛ, рекомендуется диспансерное наблюдение у гематолога [7].
Уровень убедительности рекомендаций C (уровень достоверности доказательств 5)
Комментарии: Частота наблюдения пациентов с ХЛЛ/ЛМЛ после завершения лечения законодательно не регламентирована. В течение первого года после завершения лечения пациент должен наблюдаться у гематолога не реже 1 раза в 3 месяца. Далее частота наблюдения устанавливается гематологом индивидуально в зависимости от общего состояния и самочувствия пациента, осложнений проведенной терапии, достигнутого ответа на терапию, но не должна быть реже 1 раза в год.
При диспансерном наблюдении, кроме осмотра пациента и сбора анамнеза, необходимо выполнять общий анализ крови с исследованием лейкоцитарной формулы, а также, в случае, если заболевание сопровождалось лимфаденопатией, инструментальное исследование периферических лимфоузлов (УЗИ или КТ). Остальные методы обследования могут применяться на усмотрение гематолога.
6. Дополнительная информация, влияющая на течение и исход заболевания
Нет.
7. Организация медицинской помощи
Показания для плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по тяжести состояния, обусловленного опухолью, или по причине рисков осложнений, сопряженных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, в том числе включающее биопсии и инвазивные вмешательства в случаях, когда оно не может быть проведено амбулаторно.
Показания для экстренной госпитализации:
1. Развитие тяжелой инфекции (не обязательна госпитализация в гематологический стационар).
2. Развитие угрожающих жизни цитопений (глубокая анемия, геморрагический синдром, нейтропения).
3. Развитие осложнений ХЛЛ, включая синдром Рихтера, симптоматическую лимфаденопатию и органомегалию с риском развития тяжелых осложнений, нейролейкемию, специфический плеврит и хилоторакс с признаками дыхательной недостаточности, паранеопластические и аутоиммунные синдромы, другие осложнения, угрожающие жизни.
4. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.
Показания к выписке пациента из стационара:
1. Завершение курса терапии.
2. Завершение обследования.
3. Достижение ожидаемого эффекта от лечения.
4. В случаях, когда по решению врачебной комиссии пребывание пациента в стационаре не показано в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
1
Пациенту с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при оценке ремиссии через 2 месяца после завершения терапии, при контрольных обследованиях, и при подозрении на рецидив заболевания выполнен развернутый клинический анализ крови с определением гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов
5
C
2
Пациенту с подозрением на ХЛЛ с лимфоцитозом >= 5000 B-лимфоцитов в мкл выполнено иммунофенотипическое исследование лимфоцитов крови (ИФТ) методом проточной цитофлуориметрии
3
B
3
Пациенту с подозрением на ЛМЛ без клинического лимфоцитоза в крови, либо пациенту с подозрением на трансформацию выполнена биопсия лимфатического узла (очага поражения)
3
B
4
Первичному пациенту ХЛЛ/ЛМЛ с подозрением на трансформацию выполнено получение гистологического препарата костного мозга (трепанобиопсия костного мозга)
3
B
5
Первичному пациенту при установке диагноза ХЛЛ/ЛМЛ, либо пациенту с верифицированным ХЛЛ/ЛМЛ перед началом терапии, при оценке ремиссии через 2 месяца после завершения терапии, а также при подозрении на рецидив заболевания выполнено КТ грудной клетки, органов брюшной полости и малого таза (с контрастированием) или рентгенография органов грудной клетки в двух проекциях и ультразвуковое исследование лимфатических узлов и внутренних органов
5
C
6
У пациента с ХЛЛ/ЛМЛ, получающего терапию ограниченной длительности, выполнена оценка терапии по критериям iwCLL 2018 г. не менее чем через 2 месяца после окончания терапии
5
C
7
У пациента с ХЛЛ/ЛМЛ, получающего непрерывную терапию или поддерживающую терапию, выполнена оценка терапии по критериям iwCLL 2018 г. не менее чем через 2 месяца после достижения максимального ответа
5
C
Список литературы
1. Zhang S, Kipps TJ. The pathogenesis of chronic lymphocytic leukemia. Annu Rev Pathol. 2014; 9: 103 - 118.
2. Morton LM, et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992 - 2001. Blood. 2006; 107(1): 265 - 76.
3. Watson L, Wyld P, Catovsky D. Disease burden of chronic lymphocytic leukaemia within the European Union. European journal of haematology. 2008; 81(4): 253 - 8.
4. Jemal A, et al. Cancer statistics, 2007. CA Cancer J Clin. 2007; 57(1): 43 - 66.
5. Dores GM, et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br J Haematol. 2007; 139(5): 809 - 19.
6. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. Злокачественные новообразования в России в 2016 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИЦ радиологии" Минздрава России. 2018 г.
7. Hallek М, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018; 131(25): 2745 - 60.
8. International CLL-IPI working group. An international prognostic index for patietns with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of inpidual patient data. Lancet Oncol. 2016; 17(6): 779 - 790.
9. Morice WG, Kurtin P, Hodnefield J, et al. Predictive value of blood and bone marrow flow cytometry in B-cell lymphoma classification: comparative analysis of flow cytometry and tissue biopsy in 252 patients. Mayo Clinic Proceedings 2008; 83(7): 776 - 785.
10. Rawstron AC, et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia. N Engl J Med. 2008; 359(6): 575 - 83.
11. Rossi D, et al. Occult hepatitis В virus infection of peripheral blood mononuclear cells among treatment-naive patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2009; 50(4): 604 - 11.
12. Conte MJ, et al. Use of positron emission tomography-computed tomography in the management of patients with chronic lymphocytic leukemia/small lymphocytic lymphoma. Leuk Lymphoma. 2014; 55(9): 2079 - 2084.
13. CLL Trialists' Collaborative Group. Chemotherapeutic options in chronic lymphocytic leukemia: a meta-analysis of the randomized trials. Journal of the National Cancer Institute 1999; 91(10): 861 - 868.
14. Hallek M, et al., Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet. 2010; 376(9747): 1164 - 74.
15. Fischer K, et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood. 2016; 127(2): 208 - 15.
16. Fischer K, et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2012; 30(26): 3209 - 16.
17. Eichhorst B, et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016; 17(7): 928 - 42.
18. Goede V, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014; 370(12): 1101 - 10.
19. Leblond V, Laribi K, Ilhan O, et al. Rituximab in Combination with Bendamustine or Chlorambucil for Treating Patients with Chronic Lymphocytic Leukemia: Interim Results of a Phase Illb Study (MaBLe). Blood. 2012; 120: Abstract 2744.
20. Burger JA, et al. Ibrutinib as Initial Therapy for Patients with Chronic Lymphocytic Leukemia. N Engl J Med. 2015; 373(25): 2425 - 37.
21. Burger JA, et al. Ibrutinib for First-Line Treatment of Older Patients With Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (CLL/SLL): A4-Year Experience From the REASONATE-2 Study. EHA 2018, Abstract PF343.
22. Nikitin E, et al. Randomised Comparison Of FCR-Lite And ClbR (Chlorambucil Plus Rituximab) Regimens In Elderly Patients With Chronic Lymphocytic Leukemia. Hematologica. 2013; 98(s1) Abstract NS 1147.
23. Foa R, et al. Chlorambucil plus rituximab with or without maintenance rituximab as first-line treatment for elderly chronic lymphocytic leukemia patients. Am J Hematol. 2014; 89(5): 480 - 6.
24. Hillmen P, et al. Rituximab plus chlorambucil as first-line treatment for chronic lymphocytic leukemia: Final analysis of an open-label phase II study. J Clin Oncol. 2014; 32(12): 1236 - 41.
25. Catovsky D, Else M, Richards S. Chlorambucil-still not bad: a reappraisal. Clin Lymphoma Myeloma Leuk. 2011; 11 (Suppl 1): S2 - 6.
26. Hainsworth JD, Litchy S, Barton JH, et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphocytic lymphoma: a phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol. 2003; 21: 1746 - 1751.
27. Burger JA, et al. Safety and activity of ibrutinib plus rituximab for patients with high-risk chronic lymphocytic leukaemia: a singlearm, phase 2 study. Lancet Oncol. 2014; 15(10): 1090 - 9.
28. Sorror ML, Storer BE, Sandmaier BM, et al. Five-year follow-up of patients with advanced chronic lymphocytic leukemia treated with allogeneic hematopoietic cell transplantation after non-myeloablative conditioning. J Clin Oncol. 2008; 26(30): 4912 - 4920.
29. Dreger P, Dohner H, Ritgen M, et al; German CLL Study Group. Allogeneic stem cell transplantation provides durable disease control in poor-risk chronic lymphocytic leukemia: long-term clinical and MRD results of the German CLL Study Group CLL3X trial. Blood. 2010; 116(14): 2438 - 2447.
30. Stilgenbauer S, et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study. Lancet Oncol. 2016; 17(6): 768 - 778.
31. National Comprehensive Cancer Network. NCCN Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Version 2.2019. www.nccn.org
32. Tam CS, et al. Long-term results of first salvage treatment in CLL patients treated initially with FCR (fludarabine, cyclophosphamide, rituximab). Blood. 2014; 124(20): 3059 - 64.
33. Fischer K, et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2011; 29(26): 3559 - 66.
34. Byrd, JC, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med. 2014; 371(3): 213 - 23.
35. Moreno C, et al. Ibrutinib in previously treated chronic lymphocytic leukemia: updated efficacy and safety of the RESONATE study with up to four years of follow-up. EHA 2017, Abstract S769.
36. Chanan-Khan A, et al. Ibrutinib combined with bendamustine and rituximab compared with placebo, bendamustine, and rituximab for previously treated chronic lymphocytic leukaemia or small lymphocytic lymphoma (HELIOS): a randomised, double-blind, phase 3 study. Lancet Oncol. 2016; 17(2): 200 - 11.
37. Fraser G, et al. Three-year follow-up of patients with previously treated chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) receiving ibrutinib plus bendamustine and rituximab (BR) versus placebo plus BR: an update of the HELIOS study. iwCLL 2017, Abstract 197.
38. Seymour JF, et al. Venetoclax-rituximab in relapsed or refractory chronic lymphocytic leukemia. New Eng J Med. 2018; 378: 1107 - 1120.
39. Paul KL. Rehabilitation and exercise considerations in hematologic malignancies. Am J Phys Med Rehabil. 2011; 90 (5 Supp 1): S88 - 94.
40. Е.А. Никитин, Е.А. Стадник, С.А. Луговская и соавт. Хронический лимфолейкоз//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. - М., 2018 - с. 179 - 200.
41. Whittle AM, Allsup DJ, Bailey JR. Chronic lymphocytic leukemia is a risk factor for venous thromboembolism. Leukemia Research. 2011; 35: 419 - 421.
42. Lipsky AH, Farooqui MZH, Tian X. et al. Incidence and risk factors of bleeding-related adverse events in patients with chronic lymphocytic leukemia treated with ibrutinib. Haematologica. 2015; 100(12): 1571 - 1578.
43. Parikh SA, Kay NE, Shanafelt TD. How we treat Richter syndrome. Blood. 2014; 123(11): 1647 - 57.
44. Shanafelt TD, Wang V, Kay NE, et al. A randomized phase III study of ibrutinib (PCI-32765)-based therapy vs. standard fludarabine, cyclophosphamide, and rituximab (FCR) chemoimmunotherapy in untreated younger patients with chronic lymphocytic leukemia (CLL): a trial of the ECOG-ACRIN Cancer Research Group (E1912). Abstract # LBA-4. Представлено на конференции ASH Annual Meeting 2018 г.
45. Burger JA, Sivina M, Jain N, et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia. Blood. 2019; 133(10): 1011 - 1019.
46. Woyach JA, Ruppert AS, Heerema NA, et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. N Engl J Med. 2018; 379(26): 2517 - 2528.
47. Michallet AS, Campidelli A, Lequeu H, et al. Ibrutinib in very elderly patients with relapsed/refractory chronic lymphocytic leukemia: A real-world experience of 71 patients treated in France: A study from the French Innovative Leukemia Organization (FILO) group. Am J Hematol. 2017; 92(6): E105 - E107.
48. Raanani P, Gafter-Gvili A, Paul M, et al. Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: Systematic review and meta-analysis. Leukemia & Lymphoma 2009; 50: 764 - 772.
49. Т.С. Константинова, Г.А. Клясова, К.Д. Капланов и соавт. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями.//Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. - М., 2018, - с. 289 - 311.
50. Rubin LG, Levin MJ, Ljungman P, et al. IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2013; 58(3): 309 - 18.
51. Sinisalo M, Aittoniemi J, Oivanen P, et al. Response to vaccination against different types of antigens in patients with chronic lymphocytic leukaemia. Br J Haematol 2001; 114(1): 107 - 10.
52. Shanafelt TD, Drake MT, Maurer MJ, et al. Vitamin D insufficiency and prognosis in chronic lymphocytic leukemia. Blood. 2011; 117(5): 1492 - 8.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Бялик Татьяна Евгеньевна. Кандидат медицинских наук, врач-онкогематолог, ассистент кафедры онкологии Первого МГМУ им. И.М. Сеченова, Москва.
2. Зарицкий Андрей Юрьевич. Доктор медицинских наук, профессор, директор Института гематологии ФГБУ "СЗФМИЦ им. В.А. Алмазова" Минздрава России (г. Санкт-Петербург).
3. Исебер Лоик. Профессор, гематолог, онкологический центр Тулузы, Франция.
4. Капланов Камиль Даниялович. Кандидат медицинских наук. Заведующий гематологическим отделением Волгоградского областного клинического онкологического диспансера (ВОКОД), ассистент кафедры онкологии с курсом онкологии и гематологии ФУВ Волгоградского Государственного медицинского университета (ВолгГМУ), главный внештатный специалист гематолог Комитета по здравоохранению Администрации Волгоградской области. Член Российского общества онкогематологов, член Национального гематологического общества.
5. Лопаткина Татьяна Николаевна. Кандидат медицинских наук, врач - терапевт, гастроэнтеролог, доцент кафедры терапии, профессиональных болезней и пульмонологии Первого МГМУ им. И.М. Сеченова, Москва.
6. Луговская Светлана Алексеевна. Доктор медицинских наук, профессор кафедры клинической лабораторной диагностики ГБОУ ДПО РМАНПО Минздрава России, г. Москва. Член Национального гематологического общества.
7. Мухортова Ольга Валентиновна. Доктор медицинских наук, врач-радилог высшей категории, старший научный сотрудник Отдела ядерной диагностики (ПЭТ-центр) на базе Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, Москва.
8. Никитин Евгений Александрович. Доктор медицинских наук, профессор, заведующий дневным стационаром гематологии, онкологии и химиотерапии городского гематологического центра ГБУЗ ГКБ им. С.П. Боткина ДЗ г. Москвы. Член правления Российского общества онкогематологов, член правления Национального гематологического общества.
9. Поддубная Ирина Владимировна. Академик РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, зав. кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО г. Москва. Председатель Российского общества онкогематологов.
10. Самойлова Ольга Сергеевна. Кандидат медицинских наук, врач-гематолог, заведующая гематологическим отделением Нижегородской областной клинической больницы им. Н.А. Семашко. Главный внештатный специалист гематолог Приволжского федерального округа. Член Российского общества онкогематологов, член Национального гематологического общества.
11. Стадник Елена Александровна. Кандидат медицинских наук, доцент кафедры факультетской терапии СПбГМУ им. И.П. Павлова, старший научный сотрудник Федерального центра сердца, крови и эндокринологии им. В.А. Алмазова, Санкт-Петербург. Член Российского общества онкогематологов.
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи;
2. Врачи-онкологи.
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
Поиск в электронных базах данных
Базы данных, использованных для сбора / селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1 - А4).
В настоящих клинических рекомендациях приведены уровни доказательности рекомендаций, в соответствии с проектом методических рекомендаций по оценке достоверности доказательств и убедительности рекомендаций ФГБУ "Центр экспертизы и контроля качества медицинской помощи" Минздрава России.
Также в соответствии с данным проектом рекомендаций отдельным общепринятым методикам диагностики на основании консенсуса эксперта экспертов придан уровень GPP (сложившаяся клиническая практика).
Таблица А1. Шкала оценки УДД для диагностических вмешательств
УДД
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
1
Систематические обзоры исследований с контролем референсным методом
2
Отдельные исследования с контролем референсным методом
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица А2. Шкала определения УУР для диагностических вмешательств
УУР
Расшифровка
A
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Низкая (слабая) рекомендация - отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Таблица А3. Шкала определения УДД для лечебных, реабилитационных, профилактических вмешательств
УДД
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица А4. Шкала определения УУР для лечебных, реабилитационных, профилактических вмешательств
УУР
Расшифровка
A
Однозначная (сильная) рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Неоднозначная (условная) рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Низкая (слабая) рекомендация - отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017 - 2018 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний "Лимфорум", ежегодной Российской конференции с международным участием "Злокачественные лимфомы", а также в рамках IV Конгресса гематологов России.
Порядок обновления клинических рекомендаций
Актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ХЛЛ/ЛМЛ. Решение об обновлении принимает Минздрав России на основе предложений, представленные медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Нет.
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Алгоритм выбора первой линии терапии пациента с ХЛЛ/ЛМЛ
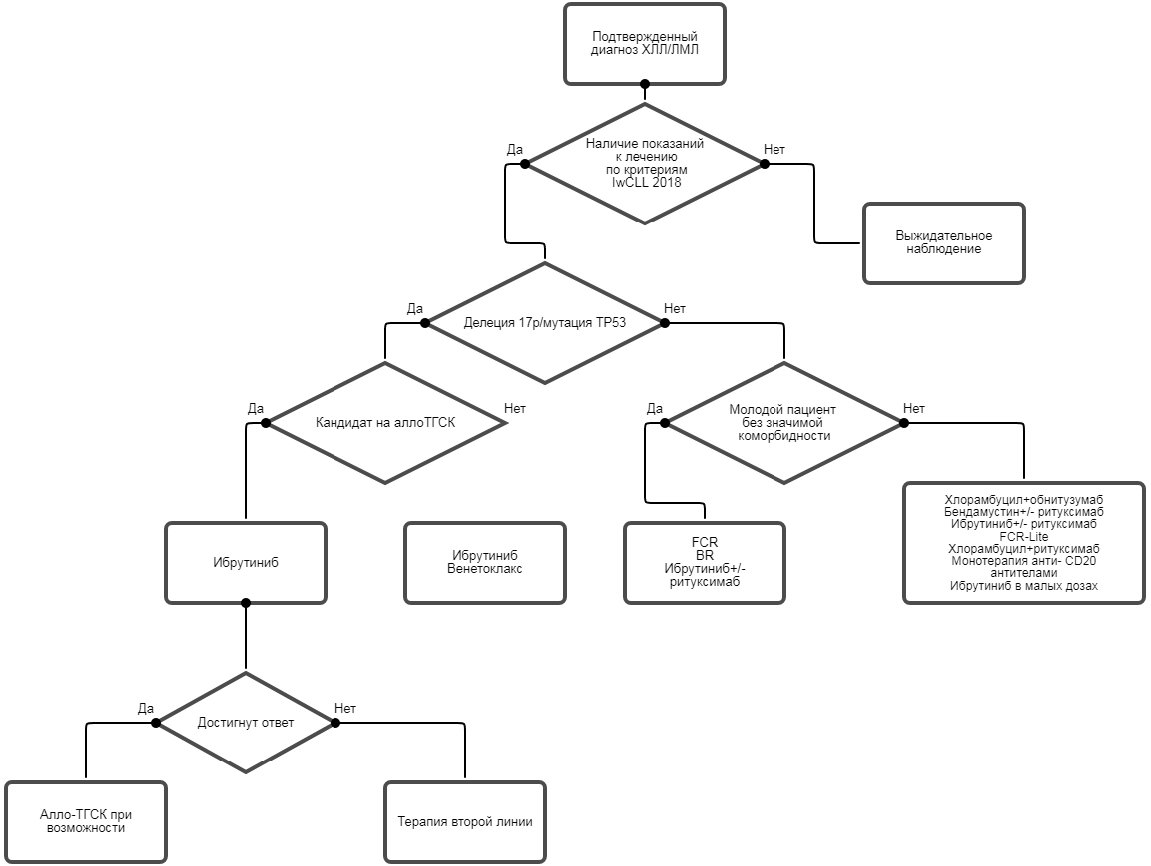
Алгоритм выбора терапии рецидива ХЛЛ/ЛМЛ

Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Хронический лимфоцитарный лейкоз (ХЛЛ) представляет собой онкологическое заболевание, поражающее клетки крови и костного мозга. При хроническом ХЛЛ костный мозг вырабатывает патологически измененные, не способные выполнять свои функции лимфоциты. Они накапливаются в крови и различных органах и вытесняют нормальные клетки крови. Слово "хронический" в названии указывает, что это заболевание протекает доброкачественно.
Лимфомой из малых лимфоцитов (ЛМЛ) называется особое проявление хронического ХЛЛ, при котором патологические лимфоциты накапливаются не в крови или костном мозге, а в лимфоузлах.
Еще десять лет назад считалось, что ХЛЛ/ЛМЛ заболевают, в основном, пожилые люди. Однако по мере улучшения диагностики оказалось, что это заболевание может возникать и у молодых людей (40 - 50 лет), причем в этом возрасте оно протекает менее благоприятно.
Врач может заподозрить ХЛЛ/ЛМЛ, опираясь на Ваши жалобы и обнаружив соответствующие симптомы при осмотре. В этом случае будет необходимо пройти ряд обследований, включая анализ крови и костного мозга. При ХЛЛ самый важный анализ - это анализ крови, без него диагноз не ставится. В анализе крови выявляется увеличение числа лимфоцитов. Диагноз обязательно подтверждается специальным исследованием иммунофенотипированием лимфоцитов. Могут понадобиться и другие уточняющие диагноз исследования. При ЛМЛ диагноз ставится по результатам гистологического и иммуногистохимического исследования пораженного лимфоузла.
К сожалению, на сегодняшний день ХЛЛ/ЛМЛ не излечим. Однако у некоторых пациентов необходимость в лечении не возникает никогда - ХЛЛ/ЛМЛ может оставаться в стабильном состоянии в течение многих лет и даже десятилетий. Было проведено много исследований, в которых сравнивалось выжидательное наблюдение и раннее начало терапии (сразу после установления диагноза). Оказалось, что лечение на ранних этапах никакого преимущества не дает, но вызывает токсические эффекты. Поэтому тактика ведения ХЛЛ/ЛМЛ выстраивается с учетом течения этой болезни - лечение применяют по мере необходимости, поскольку оно, само по себе, небезопасно, и тактика выжидательного наблюдения остается и является стандартом для многих пациентов.
Если имеются четкие признаки прогрессии заболевания - устойчивый рост лимфоцитоза, увеличение лимфоузлов, селезенки, появление анемии и тромбоцитопении, врач предложит определенный курс лечения.
Выбирая лечение, доктор учитывает:
- состояние болезни (клиническую картину и прогностические факторы)
- состояние пациента (возраст, сопутствующие заболевания)
- какое лечение проводилось раньше и когда наступил рецидив
В результате у большинства пациентов заболевание удается эффективно контролировать имеющимися современными лекарствами.
Приложение Г
Приложение Г1
ШКАЛА ОЦЕНКИ ОБЩЕГО СОСТОЯНИЯ ПАЦИЕНТА ECOG
Клиническая оценка общего состояния пациента с ХЛЛ/ЛМЛ проводится по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) [40]:
0
Больной полностью активен, способен выполнять все, как и до заболевания
1
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
2
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно - в вертикальном положении.
3
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования
4
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
Приложение Г2
ОБЩАЯ ВЫЖИВАЕМОСТЬ БОЛЬНЫХ В ГРУППАХ ПО МПИ
Таблица 3. Общая выживаемость больных в группах по МПИ
Группа риска
Балл
N (%) пациентов
5-летняя ОБ
Низкая
0 - 1
340 (29%)
93,2%
Промежуточная
2 - 3
464 (39%)
79,4%
Высокая
4 - 6
326 (27%)
63,6%
Очень высокая
7 - 10
62 (5%)
23,3%
Приложение Г3
ЗНАЧЕНИЕ МАРКЕРОВ ВИРУСА ГЕПАТИТА B ПРИ ХЛЛ
Клетки ХЛЛ могут быть дополнительным резервуаром для вируса гепатита B. Латентная инфекция, вызванная HBV, выявляется у пациентов с ХЛЛ чаще. Значение маркеров HBV-инфекции и предполагаемые действия представлены в таблице 4.
Таблица 4. Значение маркеров вирусного гепатита B
HBs-Ag
Анти-HBc
Анти-HBs
ДНК HBV
Действия
Не контактировал с HBV
-
-
-
-
Провести вакцинацию Противопоказаний к анти-CD20 нет
Вакцинация проведена
-
-
+
-
Противопоказаний к анти-CD20 нет
Реконвалесцент
-
+
+
-
Противопоказаний к анти-CD20 нет
Возможное латентное носительство HBV
+
-
+/-
Контроль ДНК HBV каждые 2 месяца во время терапии анти-CD20, назначение противовирусной терапии при появлении HBsAg или ДНК HBV
Неактивное носительство HBsAg
+
+/-
-
+/-
Назначение противовирусных препаратов во время терапии анти-CD20+ + год после окончания
Хронический гепатит B
+
<*>
<*>
+/-
Отказаться от анти-CD20 или противовирусная терапия до терапии, весь период лечения + год после окончания <*>
--------------------------------
<*> При необходимости назначения aHTH-CD20 показан постоянный прием энтекавира** 0,5 мг/сут. Энтекавир** назначают на весь период лечения/поддерживающей терапии и не менее года после завершения иммуносупрессивной терапии при неоднократных отрицательных результатах тестирования ДНК вируса гепатита B в крови. Оптимальная продолжительность терапии энтекавиром** после завершения терапии ритуксимабом** не определена. Если пациенту с ХЛЛ специфическая терапия не показана, в профилактическом назначении энтекавира** нет необходимости. Ламивудин не должен применяться у пациентов с ХЛЛ, поскольку речь всегда идет о длительном приеме противовирусных препаратов. К концу второго года приема ламивудина к этому препарату устойчиво более 40% штаммов HBV, к концу четвертого года приема - 70% штаммов HBV. При развитии устойчивости к энтекавиру** показан переход на тенофовир**.
Приложение Г4
ПОКАЗАНИЯ К НАЧАЛУ ЛЕЧЕНИЯ ХЛЛ/ЛМЛ
Терапия ХЛЛ/ЛМЛ должна начинаться при наличии как минимум одного из следующих показаний по критериям iwCLL 2018 [7]:
1. Стадия С по J.L.Binet
2. Один или более симптомов интоксикации:
3. потеря веса > 10% массы тела за 6 месяцев (если пациент не принимал меры к похуданию);
4. слабость (общее состояние по ECOG >= 2, нетрудоспособность);
5. субфебрильная лихорадка в течение >= 2 недель без признаков инфекции;
6. ночные поты, сохраняющиеся более месяца, без признаков инфекции.
7. Нарастающая анемия и/или тромбоцитопения, обусловленная инфильтрацией костного мозга.
8. Аутоиммунная анемия и/или тромбоцитопения, резистентные к преднизолону.
9. Большие размеры селезенки (> 6 см ниже реберной дуги), явное увеличение органа.
10. Массивная (>= 10 см в максимальном диаметре) и/или нарастающая лимфаденопатия.
11. Время удвоения лимфоцитов менее 6 месяцев.
12. Экстранодальное поражение, симптомное или влияющее на функцию пораженного органа.
Приложение Г5
ОЦЕНКА ОТВЕТА НА ЛЕЧЕНИЕ ПРИ ХЛЛ
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по ХЛЛ (iwCLL) в 2018 году (таблица Г1) [7].
Таблица Г1. Оценка ответа на лечение при хроническом лимфолейкозе
Полная ремиссия
Частичная ремиссия
Прогрессия
А. Параметры, характеризующие массу опухоли
Лимфаденопатия
отсутствие узлов > 1,5 см
Уменьшение >= 50%
Увеличение >= 50%
Гепатомегалия
Нет
Уменьшение >= 50%
Увеличение >= 50%
Спленомегалия
Кранио-каудальный размер селезенки < 13 см
Уменьшение >= 50% от величины, на которую увеличена исходно
Увеличение >= 50%
Лимфоциты крови
< 4 x 109/л
Уменьшение >= 50% от исходного уровня
Увеличение >= 50% от исходного уровня
Костный мозг
Нормоклеточный, < 30% лимфоцитов, нет нодулярного поражения.
Уменьшение инфильтрации костного мозга на 50%
Конституциональные симптомы
Нет
Любые
Любые
А. Параметры, характеризующие функцию костного мозга
Тромбоциты
> 100 x 109/л
> 100 x 109/л или повышение >= 50% от исходного
Снижение >= 50% от исходного по причине ХЛЛ
Гемоглобин
> 110 г/л (без трансфузий и эритропоэтинов)
> 110 г/л или повышение >= 50% от исходного
Снижение >= 20 г/л от исходного по причине ХЛЛ
Нейтрофилы
> 1,5 x 109/л
> 1,5 x 109/л или повышение > 50% от исходного
Стабилизация заболевания устанавливается в ситуациях, не удовлетворяющих критериям ни частичной ремиссии, ни прогрессии.
Приложение Г6
РЕЖИМЫ ЛЕКАРСТВЕННОГО ЛЕЧЕНИЯ ХЛЛ
Монотерапия
Монотерапия хлорамбуцилом - курсовой формат
- Хлорамбуцил** 10 мг/м2 внутрь, дни 1 - 7
Лечение возобновляется на 29 день
Монотерапия хлорамбуцилом - постоянный формат
- Хлорамбуцил** 0,07 - 0,2 мг/кг внутрь, ежедневно 2 - 4 недели с последующим подбором дозы
Монотерапия бендамустином
- Бендамустин** 90 мг/м2 в/в, дни 1,2
Лечение возобновляется на 29 день
Монотерапия ибрутинибом
- Ибрутиниб** 420 мг/сут (три капсулы) внутрь, 1 раз в день, до прогрессирования или непереносимой токсичности
Монотерапия венетоклаксом
- Венетоклакс 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или непереносимой токсичности
Монотерапия офатумумабом
- В 1 день офатумумаб вводится в дозе 300 мг. Все остальные введения осуществляют в дозе 2000 мг. Сначала препарат вводится 1 раз в неделю на протяжении 8 недель (8 введений в дозе 2000 мг), затем 1 раз в месяц, всего 4 раза. Общее число введений офатумумаба - 15.
Монотерапия алемтузумабом
- Алемтузумаб** 30 мг п/к 3 раза в неделю, 12 - 18 недель
Полихимиотерапия
FCR внутривенный
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Флударабин** 25 мг/м2 в/в кап., дни 1 - 3
- Циклофосфамид** 250 мг/м2 в/в кап., дни 1 - 3
Лечение возобновляется на 29 день
FCR пероральный
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Флударабин** 40 мг/м2 внутрь, дни 1 - 3
- Циклофосфамид** 250 мг/м2 внутрь, дни 1 - 3
Лечение возобновляется на 29 день
FCR-Lite
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., дни 1, 5
- Флударабин** 20 мг/м2 внутрь, дни 1 - 3
- Циклофосфамид** 150 мг/м2 внутрь, дни 1 - 3
Лечение возобновляется на 29 день
R-FCM
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Флударабин** 25 мг/м2 в/в кап., дни 1 - 3
- Циклофосфамид** 200 мг/м2 в/в кап., дни 1 - 3
- Митоксантрон** 6 мг/м2 в/в кап., день 1
Лечение возобновляется на 29 день
RB
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Бендамустин 90 мг/м2 в/в кап., дни 1, 2
Лечение возобновляется на 29 день
Chl-R
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Хлорамбуцил** 10 мг/м2 внутрь, дни 1 - 7
Лечение возобновляется на 29 день
Chl-G
- Обинутузумаб** 1000 мг в/в, дни 1 (100 мг в течение 4 часов) - 2 (900 мг), 8, 15 (цикл 1), день 1 (циклы 2 - 6)
- Хлорамбуцил** 0,5 мг/кг внутрь, дни 1,15
Лечение возобновляется на 29 день
R-HDMP
- Ритуксимаб** 375 мг/м2 в/в кап., дни 1, 8, 15, 22
- Метилпреднизолон** 1 г/м2 в/в кап., дни 1 - 3
Лечение возобновляется на 29 день
Проводят 3 курса
FBR
- Флударабин** 20 мг/м2 в/в кап., дни 2 - 4 (первый цикл), далее - дни 1 - 3
- Бендамустин** 30 мг/м2 в/в кап., дни 1 - 3 (после флударабина)
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
Лечение возобновляется на 29 день
R-CD
- Ритуксимаб** 1 цикл - 375 мг/м2 в/в кап., день 1, последующие циклы - 500 мг/м2 в/в кап., день 1
- Циклофосфамид** 750 мг/м2 в/в кап., день 1
- Дексаметазон** 12 мг в/в или внутрь, дни 1 - 7
Лечение возобновляется на 29 день
Ибрутиниб + ритуксимаб
- Ибрутиниб** 420 мг/сут (три капсулы) внутрь, 1 раз в день, ежедневно 2
- Ритуксимаб** - 50 мг/м2 в/в кап., день 1 цикла 2; 375 мг/м2 в/в кап., день 2 цикла 2; 500 мг/м2 в/в кап., день 1 циклов 3 - 7
Лечение возобновляется на 29 день, всего 7 циклов
Венетоклакс + ритуксимаб
- Венетоклакс 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или непереносимой токсичности
- Ритуксимаб** - 375 мг/м2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее - 500 мг/м2 в/в кап. ежемесячно, всего 6 введений.
