"Клинические рекомендации "Волосатоклеточный лейкоз у взрослых"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ВОЛОСАТОКЛЕТОЧНЫЙ ЛЕЙКОЗ У ВЗРОСЛЫХ
МКБ 10: C91.4
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 2 года)
ID: КР130
URL
Профессиональные ассоциации
- Национальное гематологическое общество Российское профессиональное общество онкогематологов
Ключевые слова
- волосатоклеточный лейкоз
- спленомегалия
- спленэктомия
- лимфоцитоз
- кладрибин
- интерферон-альфа
- глюкокортикостероиды
Список сокращений
ВКЛ - волосатоклеточный лейкоз
Интерферон-![]() - интерферон-альфа
- интерферон-альфа
ИГХ - иммуногистохимическое исследование
TRAP - тартрат-устойчивая кислая фосфатаза
КТ-компьютерная томография
ECOG - шкала определения статуса больного
ПЦР - полимеразная цепная реакция
Термины и определения
Иммунофенотипирование (методом проточной цитометрии) - определение фенотипа клеток путем выявления на них CD-маркеров (кластеров дифференцировки) в жидком образце (кровь) или суспензии клеток (костный мозг, биологические жидкости).
Иммуногистохимическое исследование - исследование фенотипа клеток путем определения CD-маркеров на твердых образцах (парафиновых блоках) биоптата костного мозга или селезенки.
1. Краткая информация
1.1. Определение
Волосатоклеточный лейкоз (ВКЛ) - редкое хроническое B-клеточное лимфопролиферативное заболевание, в большинстве случаев поражающее костный мозг и селезенку. Его субстратом являются лимфоидные клетки с характерной морфологией - крупные размеры, округлое ядро и выросты-"волоски" цитоплазмы, от которых произошло название заболевания.
1.2. Этиология и патогенез
Этиология ВКЛ, как и прочих лейкозов, неизвестна. В патогенезе заболевания важную роль играет активирующая мутация V600E гена BRAF. Естественное течение ВКЛ варьирует от доброкачественного, с медленным нарастанием проявлений заболевания в течение многих лет, до быстрого прогрессирования с появлением симптомной цитопении и/или спленомегалии.
1.3. Эпидемиология
ВКЛ составляет примерно 2% от всех лейкозов взрослых и 8% от других хронических лимфопролиферативных заболеваний. Этот вид лейкоза чаще всего встречается среди мужчин средней возрастной группы (соотношение мужчин и женщин составляет 2 - 4:1, медиана возраста - более 50 лет), однако известны случаи заболевания в молодом (моложе 30 - 40 лет) возрасте.
1.4. Кодирование по МКБ 10
C91.4 - Волосатоклеточный лейкоз
1.5. Классификация
Общепринятой классификации ВКЛ не существует, обычно выделяют начальную и развернутую фазы впервые выявленного заболевания, ремиссию (полную или частичную), рецидив (ранний или поздний), резистентное течение заболевания.
1.6. Клинические признаки
В типичном случае КЛ проявляется спленомегалией, (пан)цитопенией, лимфоцитозом с ворсинчатыми лимфоцитами, нейтропенией, моноцитопенией.
Клинические проявления ВКЛ могут варьировать от минимальных или вообще полностью отсутствовать (и тогда заболевание является случайной находкой при обследовании) до выраженных симптомов спленомегалии и цитопении. Для ВКЛ характерны лейкопения с нейтропенией и моноцитопенией, а также анемия и тромбоцитопения. В 95% случаев в крови пациентов обнаруживают характерные "волосатые" лимфоциты, но количество их может быть различным. Типично для ВКЛ увеличение селезенки - от незначительного до гигантского, однако встречаются варианты ВКЛ без спленомегалии. У 15 - 25% пациентов выявляется увеличение висцеральных лимфоузлов (обычно абдоминальных). При обнаружении увеличения внутригрудных лимфоузлов необходимо исключение туберкулезного поражения; в случае выявления сочетания туберкулеза и ВКЛ необходимо проводить лечение обоих заболеваний одновременно. Клинические симптомы цитопении (одно-, двух- или трехростковой) зависят от степени ее выраженности, но в целом анемия подолгу бывает компенсированной, тромбоцитопения часто бессимптомная или с умеренно выраженным геморрагическим синдромом. Основное жизнеугрожающее осложнение ВКЛ - воспалительно-инфекционные процессы, склонные к септическому течению и абсцедированию. Нейролейкемия нехарактерна для ВКЛ, менингеальные симптомы требуют исключения бактериального, вирусного или туберкулезного менингита. Специфическое поражение нелимфатических органов встречается также крайне редко, клиническая картина при этом может отсутствовать или зависит от локализации поражения (кожа, кости, легкие, почки, центральная нервная система и др.). Исключением служит специфическая диффузная лимфоидная инфильтрация печени, всегда присутствующая при ВКЛ, но обычно не приводящая к увеличению или нарушению функции органа. Крайне редко при ВКЛ встречается изолированное экстрамедулярное поражение - например, поражение осевого скелета (позвонки, крестец, таз) с мягкотканным компонентом. Наличие экстрамедулярного очага поражения должно быть верифицировано морфологическим, иммунофенотипическим (предпочтительно) или иммуногистохимическим исследованием, а в случае изолированного экстрамедулярного поражения (при отсутствии типичной картины ВКЛ) - определением мутации BRAFV600E.
Частота встречаемости клинико-лабораторных проявлений ВКЛ:
- Спленомегалия - у 80% пациентов.
- Лейкопения - у 70% пациентов.
- Нейтропения - у 75% пациентов.
- Моноцитопения - у 90% пациентов.
- "Волосатые" лимфоциты в мазках периферической крови - у 95% пациентов.
- Тромбоцитопения - у 80% пациентов.
- Анемия - у 70% пациентов.
- Абдоминальная лимфаденопатия - у 15 - 25% пациентов.
Моноклональная гаммапатия - у 10% пациентов.
2. Диагностика
Диагноз ВКЛ устанавливается по совокупности лабораторных и инструментальных данных исследования крови, костного мозга, селезенки.
2.1. Жалобы и анамнез
При выраженной анемии - слабость, одышка, сердцебиение, головокружение, усиливающиеся при физической нагрузке.
При выраженной тромбоцитопении - геморрагический синдром (редко).
При нейтропении - гипертермия, частые инфекционно-воспалительные заболевания, иногда с тяжелым жизнеугрожающим течением (абсцедирование, пневмония, сепсис).
При спленомегалии - уплотнение и чувство тяжести в эпигастрии и левой половине живота.
Рекомендуется уточнение семейного анамнеза о наличии заболевания системы крови у родственников.
Поскольку заболевание в большинстве случаев развивается постепенно и длительно, жалобы долго могут отсутствовать, несмотря на выраженную цитопению и спленомегалию.
2.2. Физикальное обследование
- Осмотр по органам и системам с оценкой признаков анемии, геморрагического синдрома, воспалительных очагов;
- Пальпация всех групп периферических лимфатических узлов, печени, селезенки, осмотр миндалин и полости рта;
- Определение наличия B-симптомов;
- Определение статуса по ECOG (0 - 4).
2.3. Лабораторная
- Рекомендуется выполнение биопсии или аспирации из вероятного очага экстрамедулярного поражения.
Уровень убедительности рекомендаций A (уровень достоверности I)
Комментарии: специфическое поражение органов и тканей при ВКЛ доказывается только при морфологическом исследовании с иммунофенотипическим или ИГХ исследованием.
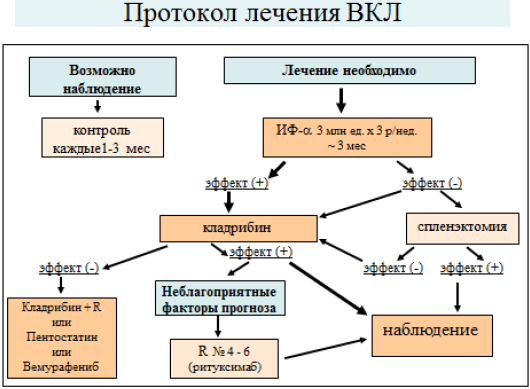
3. Лечение
Целью терапии ВКЛ является максимальная элиминация опухолевого клона с достижением длительной полной ремиссии. В основе терапии ВКЛ в настоящее время лежит использование аналогов нуклеозидов (кладрибина и пентостатина). Применение этих препаратов сравнимо по эффективности и позволяет добиться полной ремиссии и долгосрочной выживаемости у большинства пациентов. Добавление к терапии ритуксимаба может улучшить результаты терапии в группах с неблагоприятными факторами прогноза.
Моно- и полихимиотерапия ВКЛ различными иными цитостатиками неэффективна. Глюкокортикостероиды противопоказаны ввиду неэффективности в лечении ВКЛ и существенного увеличения частоты и тяжести инфекционных осложнений с высокой летальностью при их длительном применении. Терапия гранулоцитарными ростовыми факторами в большинстве случаев не показана, за исключением длительной и глубокой нейтропении (агранулоцитоза) у больного с тяжелыми инфекционными осложнениями. В случае глубокой анемии, при исключении других причин анемии (дефицит железа или витамина B12, и т.д.), кратковременно применяются эритропоэтины.
Показания к началу терапии определяются индивидуально. При неглубокой цитопении и отсутствии симптомов заболевания допускается выжидательная тактика, при условии возможности регулярного контроля за пациентом.
До начала лечения помимо вышеуказанных диагностических исследований необходимо выполнить рутинное обследование пациента (общий биохимический анализ крови, анализ мочи, рентгенологическое или компьютерно-томографическое исследование грудной полости, электрокардиография, при показаниях - дополнительные исследования) для уточнения соматического статуса и наличия сопутствующих заболеваний.
При лечении больных ВКЛ необходима крайняя настороженность в отношении инфекций - на фоне нейтропении часто развиваются пневмонии, синуситы, абсцессы в подкожной клетчатке, межмышечные абсцессы (особенно в мышцах ног).
Гипертермия при ВКЛ, в отличие от лимфом, не является симптомом интоксикации и свидетельствует о наличии инфекционно-воспалительного процесса, часто без четко определяемой локализации. Очаги инфекции при ВКЛ склонны к быстрой генерализации и требуют неотложного назначения антибактериальной терапии. Нередко сочетание ВКЛ с туберкулезом.
Основной нерешенной проблемой в лечении ВКЛ в настоящее время является определение тактики лечения резистентных форм ВКЛ и вариантного ВКЛ.
Оценка ответа на лечение
Эффект лечения проявляется постепенно, по мере уменьшения лимфоидной инфильтрации в костном мозге и селезенке и параллельного восстановления элементов нормального кроветворения, поэтому судить об эффективности терапии необходимо по динамике лабораторных показателей и размеров селезенки в течение длительного периода времени.
Так, оценка эффективности применения интерферона-![]() проводится не ранее чем через 8 недель после начала его применения. При этом на фоне применения интерферона-
проводится не ранее чем через 8 недель после начала его применения. При этом на фоне применения интерферона-![]() еще до уменьшения лимфоцитоза увеличиваются число тромбоцитов и уровень гемоглобина, уменьшается размер селезенки за счет снижения степени инфильтрации костного мозга и селезенки опухолевыми лимфоцитами. Терапия считается эффективной при наличии положительной динамики по всем или нескольким параметрам (уменьшение цитопении, лимфоцитоза и моноцитопении, сокращение размеров селезенки и висцеральной лимфаденопат и и). При снижении лимфоцитоза в крови примерно до 50% применение интерферона-
еще до уменьшения лимфоцитоза увеличиваются число тромбоцитов и уровень гемоглобина, уменьшается размер селезенки за счет снижения степени инфильтрации костного мозга и селезенки опухолевыми лимфоцитами. Терапия считается эффективной при наличии положительной динамики по всем или нескольким параметрам (уменьшение цитопении, лимфоцитоза и моноцитопении, сокращение размеров селезенки и висцеральной лимфаденопат и и). При снижении лимфоцитоза в крови примерно до 50% применение интерферона-![]() завершают и проводят курс химиотерапии аналогом пуринов.
завершают и проводят курс химиотерапии аналогом пуринов.
На фоне курса лечения аналогом пуринов отмечаются закономерная лимфопения, и одновременно прирост тромбоцитов и уровня гемоглобина. В течение первого месяца отмечается увеличение форменных элементов крови, однако полное восстановление гемограммы может потребовать нескольких месяцев, поэтому при наличии положительной динамики показателей крови полнота костномозговой ремиссии оценивается не ранее, чем через 6 - 12 месяцев после окончания химиотерапии.
Критерии ремиссии и резидуальной (остаточной) болезни большинством исследователей приняты следующие:
Полная ремиссия:
Отсутствие цитопении: гемоглобин > 120 г/л; нейтрофилы > 1,5 x 109/л; тромбоциты > 100 x 109/л.
Отсутствие органомегалии: нормализация размеров селезенки, висцеральных лимфоузлов.
Отсутствие "ворсинчатых" лимфоцитов в периферической крови и < 1% в костном мозге.
Некоторые исследователи выделяют полную ремиссию с резидуальной болезнью - при наличии 1 - 5% "ворсинчатых" лимфоцитов в костном мозге.
Частичная ремиссия:
Отсутствие цитопении: гемоглобин > 120 г/л; нейтрофилы > 1,5 x 109/л; тромбоциты > 100 x 109/л.
Уменьшение органомегалии и инфильтрации костного мозга более чем на 50%.
Отсутствие "ворсинчатых" лимфоцитов в периферической крови, но > 5% в костном мозге.
Улучшением считается нормализация одного из параметров без ухудшения других.
Длительной считается ремиссия дольше 5 лет.
Роль минимальной остаточной болезни при ВКЛ
Несмотря на очень хороший клинический ответ на терапию пентостатином и кладрибином, известно, что практически у всех пациентов после окончания лечения определяется минимальная остаточная болезнь (МОЕ). При оценке качества ремиссии после проведенной терапии для выявления МОЕ одного гистологического исследования костного мозга недостаточно, проводится иммуногистохимическое исследование с использованием анти-CD20 антитела для выявления остаточной популяции В-лимфоцитов, которые могут располагаться как кластерами (более трех CD20-позитивных лимфоидных клеток), так и диффузно.
Данные некоторых исследований показали, что при проведении терапии ВКЛ аналогами пуринов в комбинации с ритуксимабом, у 90% пациентов при помощи молекулярных и иммунологических тестов МОБ не выявляется. В то же время продемонстрировано, что МОБ может выявляться у больных на протяжении многих лет без признаков рецидива и прогрессии заболевания. Таким образом, полная эрадикация МОБ не должна являться целью лечения ВКЛ в рутинной клинической практике.
- Рекомендуется при решении вопроса о начале лечения ориентироваться на следующие показания: выраженная или усугубляющаяся цитопения, наличие инфекционных осложнений и симптомная спленомегалия.
Уровень убедительности рекомендаций C (уровень достоверности III)
3.1. Консервативное лечение
- Рекомендуется применение интерферона-![]() ** в течение 12 - 16 недель до назначения аналога пурина в дозе 3 млн ME x 3 р/нед. подкожно.
** в течение 12 - 16 недель до назначения аналога пурина в дозе 3 млн ME x 3 р/нед. подкожно.
Уровень убедительности рекомендаций B (уровень достоверности III)
Комментарии: показан к применению в качестве 1 этапа лечения для коррекции нейтропении и профилактики длительного миелотоксического агранулоцитоза. В зависимости от показателей гемограммы и индивидуальной переносимости доза интерферона-![]() может варьировать от 1 до 5 млн ME и от 2 раз в неделю до ежедневного применения. В связи с частым развитием гриппоподобного синдрома на начальных этапах применения интерферона-
может варьировать от 1 до 5 млн ME и от 2 раз в неделю до ежедневного применения. В связи с частым развитием гриппоподобного синдрома на начальных этапах применения интерферона-![]() терапию следует начинать с дозы 1 млн ME на фоне антипиретиков, постепенно увеличивая дозу до стандартной (3 млн ME). При глубокой лейкопении интерферон-
терапию следует начинать с дозы 1 млн ME на фоне антипиретиков, постепенно увеличивая дозу до стандартной (3 млн ME). При глубокой лейкопении интерферон-![]() необходимо применять с осторожностью, не форсируя дозу (из-за риска временного усугубления лейкопении). Целью применения интерферона-
необходимо применять с осторожностью, не форсируя дозу (из-за риска временного усугубления лейкопении). Целью применения интерферона-![]() является снижение числа лимфоцитов в гемограмме до уровня < 50%, что позволяет избежать агранулоцитоза и инфекционных осложнений после курса аналога пуринов. Параллельно, как правило, происходит сокращение размеров селезенки. Интерферон-
является снижение числа лимфоцитов в гемограмме до уровня < 50%, что позволяет избежать агранулоцитоза и инфекционных осложнений после курса аналога пуринов. Параллельно, как правило, происходит сокращение размеров селезенки. Интерферон-![]() можно не применять при незначительном лимфоцитозе и минимальной инфильтрации костного мозга и отменять в случае непереносимости или развития осложнений.
можно не применять при незначительном лимфоцитозе и минимальной инфильтрации костного мозга и отменять в случае непереносимости или развития осложнений.
Рекомендуется применение кладрибина** - 1 курс в дозе 0,1 мг/кг/сут x 7 дней или 0,14 мг/кг/сут x 5 дней подкожно или длительной внутривенной инфузией.
Уровень убедительности рекомендаций A (уровень достоверности I)
Комментарии: при ВКЛ применяют 1 короткий (7 или 5 дней) курс кладрибина. В рандомизированных исследованиях не было выявлено различий в эффективности и переносимости препарата при разных режимах введения. Одинаковая биодоступность кладрибина при подкожном и болюсном введении была подтверждена данными фармакологических исследований. Учитывая удобство ежедневного подкожного введения препарата, данный режим является предпочтительным в терапии ВКЛ. Если терапия кладрибином назначается по какой-либо причине без предварительного курса интерферона-![]() и в условиях глубокой нейтропении, у ослабленного больного - возможно проведение лечения в дробном режиме: 1 введение в неделю. Лечение кладрибином не требует специальной сопутствующей терапии (т.е. не назначаются антиэметики, водная нагрузка), за исключением применения ко-тримоксазола и ацикловира для профилактики инфекций (по показаниям; обязательно в случае нейтропении - до восстановления нейтрофилов > 1,0 x 109/л).
и в условиях глубокой нейтропении, у ослабленного больного - возможно проведение лечения в дробном режиме: 1 введение в неделю. Лечение кладрибином не требует специальной сопутствующей терапии (т.е. не назначаются антиэметики, водная нагрузка), за исключением применения ко-тримоксазола и ацикловира для профилактики инфекций (по показаниям; обязательно в случае нейтропении - до восстановления нейтрофилов > 1,0 x 109/л).
Рекомендуется применение пентостатина в дозе 4 мг/м2 каждые 2 недели до достижения максимального ответа с последующими одной или двумя дополнительными инъекциями для консолидации достигнутого эффекта (обычно 4 - 10 введений).
Уровень убедительности рекомендаций A (уровень достоверности I)
Комментарии: пентостатин - другой аналог пурина, равнозначный по эффективности с кладрибином. Однако необходимо учитывать, что проведение терапии пентостатином возможно только пациентам с сохранной функцией почек (клиренс креатинина должен быть не менее 60 мл/мин.). При клиренсе от 40 до 60 мл/мин доза редуцируется вдвое. Препарат вводится путем внутривенной инфузии в объеме 1500 мл.
3.2. Хирургическое лечение
- Рекомендуется проведение спленэктомии при глубокой цитопении, препятствующей проведению лекарственной терапии.
Уровень убедительности рекомендаций C (уровень достоверности III)
Комментарии: при ВКЛ удаление селезенки быстро ликвидирует цитопению, но лишь у 20% больных - на длительный срок; у большинства же эффект спленэктомии сохраняется менее 1 года с неизбежной в дальнейшем прогрессией заболевания. В настоящее время спленэктомия применяется ограниченно: при симптомной тромбоцитопении, при неэффективности или непереносимости лекарственной терапии, при осложнениях спленомегалии (инфаркты, разрыв), а также при выраженной спленомегалии (более 10 см ниже реберной дуги), сочетающейся с незначительным поражением костного мозга.
3.3. Лечение экстрамедулярного поражения
До появления эффективной системной терапии ВКЛ интерфероном-![]() и аналогами пурина, для лечения экстрамедулярного поражения применялось хирургическое лечение и лучевая терапия. В настоящее время общепризнано, что лечение ВКЛ с экстрамедулярным поражением должно быть системным - интерферон-
и аналогами пурина, для лечения экстрамедулярного поражения применялось хирургическое лечение и лучевая терапия. В настоящее время общепризнано, что лечение ВКЛ с экстрамедулярным поражением должно быть системным - интерферон-![]() ** и/или аналоги пурина (кладрибин**), возможно с добавлением к терапии ритуксимаба** Локальное лечение (иссечение, облучение) может применяться только дополнительно, при наличии показаний. При адекватной системной терапии специфическое поражение органов и тканей при ВКЛ не является фактором, ухудшающим прогноз заболевания.
** и/или аналоги пурина (кладрибин**), возможно с добавлением к терапии ритуксимаба** Локальное лечение (иссечение, облучение) может применяться только дополнительно, при наличии показаний. При адекватной системной терапии специфическое поражение органов и тканей при ВКЛ не является фактором, ухудшающим прогноз заболевания.
4. Реабилитация
Специальных методов реабилитации при ВКЛ не существует. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий. Рекомендуется вести здоровый образ жизни, исключить избыточную инсоляцию и тепловые физиопроцедуры.
5. Профилактика
Методов профилактики ВКЛ в настоящее время не существует, поскольку неизвестен этиологический фактор(ы), ведущие к развитию заболевания.
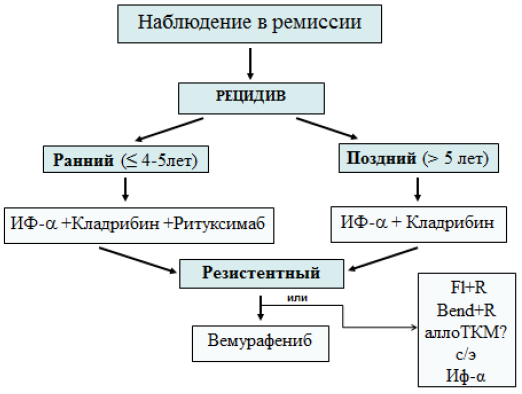
После завершения курса лечения аналогом пурина необходимо наблюдение за пациентом с оценкой динамики показателей клинического анализа крови и размера селезенки. Период восстановления миелопоэза может быть длительным, поэтому если у больного после проведенного курса лечения аналогом пурина отмечается положительная динамика - исчезновение "ворсинчатых" лимфоцитов и тенденция к восстановлению показателей крови, сокращение размера селезенки, то полноту достигнутой ремиссии оценивают не ранее, чем через 6 - 12 мес. после лечения. Поскольку у всех больных в ремиссии заболевания сохраняется минимальная остаточная болезнь, рецидивы ВКЛ с течением времени развиваются в подавляющем большинстве случаев, с частотой выявления до 35% при медиане наблюдения 5 лет и до 50% при медиане 10 лет. Рецидивы могут возникать чаще и в более ранние сроки у молодых больных (дебют заболевания в возрасте моложе 45 лет) и при достижении лишь частичной ремиссии. Для своевременного обнаружения рецидива ВКЛ необходим контроль клинического ан. крови не реже 2 раз в год и размера селезенки не реже 1 раза в год. Рецидив заболевания должен быть подтвержден выявлением "ворсинчатых" лимфоцитов с соответствующим ВКЛ фенотипом в крови или костном мозге. В случае раннего рецидива или резистентного течения заболевания обязательно гистологическое исследование костного мозга и определение мутации BRAFV600E.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1. ВКЛ в период беременности
При установлении диагноза ВКЛ у беременной тактика рецидивов и рефрактерных форм ВКЛ
Большинство пациентов, получавших терапию аналогами пуринов, в случае возникновения рецидива заболевания достигают повторной ремиссии как при терапии пентостатином, так и кладрибином**. Выбор препарата для вариантной формы ВКЛ.
Вариантный ВКЛ в последней классификации ВОЗ 2008 г. рассматривается как отдельная нозологическая форма в разделе "Неклассифицируемая лимфома/лейкоз селезенки", вместе с лимфомой красной пульпы селезенки. Вариантный ВКЛ еще более редкая патология, чем классическая форма заболевания и составляет примерно 10% от всех случаев ВКЛ. Четкое разграничение в-ВКЛ от классического ВКЛ и от лимфомы красной пульпы селезенки часто представляет проблему, ввиду сходства клинической картины и многих диагностических параметров.
Клинические проявления классического ВКЛ, вариантного ВКЛ и лимфомы красной пульпы селезенки в общих чертах схожи, однако при вариантном ВКЛ и лимфоме красной пульпы селезенки чаще наблюдается лейкоцитоз и абсолютный лимфоцитоз, без моноцитопении. Костный мозг обычно гиперклеточный, с минимальными признаками фиброза. Морфологически "ворсинчатые" лимфоциты при вариантном ВКЛ имеют большее сходство с пролимфоцитом, их ядро часто содержит 1 - 2 крупные нуклеолы. Отмечено, что при лимфоме красной пульпы селезенки лимфоидное поражение в гистологическом препарате костного мозга бывает скудным, и иногда выявляется только при иммуногистохимическом исследовании трепанобиоптата.
Для фенотипа вариантного ВКЛ и лимфомы красной пульпы селезенки, в отличие от классической формы ВКЛ, характерно отсутствие экспрессии CD25, CD123, при наличии других типичных для ВКЛ маркеров, но с меньшей степенью экспрессии: CDllc, CD103, FMC7. Кроме этого, при вариантном ВКЛ и лимфоме красной пульпы селезенки обычно отсутствуют TRAP и Annexin A1.
Также для вариантного ВКЛ и лимфомы красной пульпы селезенки, в отличие от классического ВКЛ, характерно отсутствие мутации BRAF V600E в лейкозных клетках.
Лечение вариантной формы ВКЛ до настоящего времени однозначно не определено. Вследствие редкости заболевания рандомизированных клинических исследований по сравнению эффективности различных методов лечения при вариантном ВКЛ не проведено. По данным большинства исследователей, аналоги пурина менее эффективны, и чаще позволяют достичь лишь частичной ремиссии или улучшения. Используются все вышеперечисленные методы лечения, предпочтительным считается сочетание аналога пурина с ритуксимабом. Применяется длительная терапия интерфероном-![]() . При выраженной спленомегалии в первой линии лечения используют спленэктомию. Изучается эффективность лечения антителами анти-СП22 и анти-СП25. У молодых пациентов с резистентным течением заболевания возможно лечение с применением аллогенной трансплантации гемопоэтических стволовых клеток. Не показано применение вемурафениба, в связи с отсутствием мутации BRAFV600E при вариантном ВКЛ.
. При выраженной спленомегалии в первой линии лечения используют спленэктомию. Изучается эффективность лечения антителами анти-СП22 и анти-СП25. У молодых пациентов с резистентным течением заболевания возможно лечение с применением аллогенной трансплантации гемопоэтических стволовых клеток. Не показано применение вемурафениба, в связи с отсутствием мутации BRAFV600E при вариантном ВКЛ.
Критерии оценки качества медицинской помощи
N
Критерии качества
Уровень убедительности рекомендаций
Уровень достоверности доказательств
1
Выполнен клинический анализ крови с цитологическим (морфологическим) исследованием лейкоцитов (лимфоцитов) в мазке периферической крови
A
I
2
Выполнено морфологическое (цитологическое) исследование препарата костного мозга
A
I
3
Выполнено морфологическое (гистологическое) исследование препарата костного мозга
A
I
4
Выполнено иммунофенотипирование лимфоцитов крови или препарата костного мозга методом проточной цитометрии
A
I
5
Выполнено ультразвуковое и/или компьютерно-томографическое исследование органов брюшной полости
A
I
6
Выполнено иммуногистохимическое исследование трепанобиоптата костного мозга (при наличии медицинских показаний)
A
I
7
Выполнено определение тартрат-устойчивой кислой фосфатазы (TRAP) в лимфоцитах крови и/или костного мозга (при наличии медицинских показаний)
B
II
8
Выполнено определение мутации BRAF V600E в лимфоцитах крови или костного мозга (при наличии медицинских показаний)
B
II
9
Выполнено иммунохимическое исследование сыворотки крови и суточной мочи (при наличии медицинских показаний)
B
II
Список литературы
1. Bouroncle B.A.; Wiseman B.K.; Doan C.A. Leukemic reticuloendotheliosis. Blood. 1958; 13: 609 - 630.
2. Went P.T.; Zimpfer A.; Pehrs A. et al. High specificity of combined TRAP and DBA.44 expression for hairy cell leukaemia. American Journal of Surgical Pathology. 2005; 29: 474 - 478.
3. Falini B.; Tiacci E.; Liso A. et al. Simple diagnostic assay for hairy cell leukaemia by immunocytochemical detection of annexin Al (ANXA1). Lancet. 2004; 363: 1869 - 1870.
4. Foucar K.; Falini B.; Catovsky D; Stein H. Hairy cell leukaemia. In: WHO Classification of Tumours of the Haematopoietic and Lymphoid Tissues, (ed. by Swerdlow SH, Campo E, Harris NL, et al.), pp. 188 - 190. IARC Press, Lyon. 2008.
5. Miranda R.N.; Briggs R.C; Kinney M.C. et al. Immunohistochemical detection of cyclin D1 using optimized conditions is highly specific for mantle cell lymphoma and hairy cell leukaemia. Modern Pathology. 2000; 13: 1308 - 1314.
6. Chen Y.H.; Tallman M.S.; Goolsby C.; Peterson L. Immunophenotypic variations in hairy cell leukemia. American Journal of Clinical Pathology. 2006; 125: 251 - 259.
7. Del Giudice I.; Matutes E.; Morilla R. et al. The diagnostic value of CD123 in B-cell disorders with hairy or villous lymphocytes. Haematologica. 2004; 89: 303 - 308.
8. Tiacci E.; Trifonov V.; Schiavoni G. et al. BRAF mutations in hairy cell leukemia. New England Journal of Medicine. 2011; 364: 2305 - 2315.
9. Else M.; Dearden C.E.; Matutes E. et al. (2009) Long-term follow-up of 233 patients with hairy cell leukaemia, treated initially with pentostatin or cladribine, at a median of 16 years from diagnosis. British Journal of Haematology. 2009; 145: 733 - 740.
10. Mercieca J.; Puga M.; Matutes E. et al. Incidence and significance of abdominal lymphadenopathy in hairy cell leukaemia. Leukaemia and Lymphoma. 1994; 14 (Suppl. 1): 79 - 83.
11. Mercieca J.; Matutes E.; Emmett E. et al. 2-chlordeoxyadenosine in the treatment of hairy cell leukaemia: differences in response in patients with and without abdominal lymphadenopathy. British Journal of Haematology. 1996; 93: 409 - 411.
12. Аль-Ради Л.С.; Пивник А.В. Особенности течения и современная тактика терапии волосатоклеточного лейкоза. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2009; 2(2): 111 - 120.
13. Maloisel F.; Benboubker L.; Gardembas M. et al. Long-term outcome with pentostatin treatment in hairy cell leukemia in patients. A French retrospective study of 238 patients. Leukemia. 2003; 17: 45 - 51.
14. Dearden C.E.; Else M.; Catovsky D. Long-term results for pentostatin and cladribine treatment of hairy cell leukemia. Leukaemia and Lymphoma. 2011; 52 (Suppl. 2): 21 - 24.
15. Zinzani P.L.; Tani M.; Marchi E. et al. Long-term follow-up of the front-line treatment of hairy cell leukemia with 2-cholordeoxyadenosine. Haematologica. 2004; 89: 309 - 313.
16. Zinzani P.L.; Pellegrini C.; Stefoni V. et al. (2010) Hairy cell leukaemia: evaluation of the longterm outcome in 121 patients. Cancer. 2010; 116: 4788 - 4792.
17. Cervetti G.; Galimberti S.; Andreazzoli F. et al. Rituximab as treatment for minimal residual disease in hairy cell leukaemia. European Journal of Haematology. 2004; 73: 412 - 417.
18. Juliusson G.; Heldal D.; Hippe E. et al. Subcutaneous injections of 2-chlorodeoxyadenosine for symptomatic hairy cell leukaemia. Journal of Clinical Oncology. 1995; 13: 989 - 995.
19. Robak T.; Jamroziak K.; Gora-Tybor J. et al. Cladribine in a weekly versusdaily schedule for untreated hairy cell leukemia: final report from the Polish Adult Leukaemia Group (PALG) of a prospective, randomised, multicenter trial. Blood. 2007; 109: 3672 - 3675.
20. Zenhausern R.; Leupin N.; Hsu Schmitz S.F. et al. A randomized study of daily versus weekly administration of 2 chlorodeoxyadenosine in patients with hairy cell leukemia. Blood. 2007; 110: 1352a.
21. Chadha P.; Rademaker A.W.; Mendiratta R et al. (2005) Treatment of hairy cell leukaemia with 2-chlorodeoxyadenosine (2-CdA): long-term follow-up of the Northwestern University experience. Blood. 2005; 106: 241 - 246.
22. Liliemark J.; Albertioni F.; Hassan M.; Juliusson G. (1998) On the bioavailablity of oral and subcutaneous 2-chloro-2'-deoxyadenosine in humans: alternative routes of administration. Journal of Clinical Oncology. 1998; 10: 1514 - 1518.
23. ![]() I.; Debski R.; Samsel M. Hairy cell leukemia in pregnancy. Ginekol Pol. 2005; 76(11): 898 - 901.
I.; Debski R.; Samsel M. Hairy cell leukemia in pregnancy. Ginekol Pol. 2005; 76(11): 898 - 901.
24. Pileri S.; Sabattini E.; Poggi S. et al. Bone marrow biopsy in hairy cell leukaemia (HCL) patients, histological and immunohistological analysis of 46 cases treated with different therapies. Leukemia and Lymphoma. 1994; 14 (Suppl. 1): 67 - 71.
25. Konwalinka G.; Schirmer M.; Hilbe W. et al. Minimal residual disease in hairy cell leukaemia after treatment with 2 chlorodeoxyadenosine. Blood Cells Molecules and Diseases. 1995; 21: 142 - 151.
26. Cervetti G.; Galimberti S.; Andreazzoli F. et al. Rituximab as treatment for minimal residual disease in hairy cell leukaemia extended follow-up. British Journal of Haematology. 2008; 143: 296 - 298.
27. Else M.; Osuji N.; Forconi F. et al. The role of rituximab in combination with pentostatin or cladribine for the treatment of recurrent, refractory hairy cell leukaemia. Cancer. 2007; 110: 2240 - 2247.
28. Ravandi F.; Jorgensen J.L.; O'Brien S.M. et al. Eradication of minimal residual disease in hairy cell leukaemia. Blood. 2006; 107: 4658 - 4662.
29. Sigal D.S; Sharpe R.; Burian C.; Saven A. Very long-term eradication of minimal residual disease in patients with hairy cell leukaemia after a single course of cladribine. Blood. 2010; 115, 1893 - 1896.
30. Аль-Ради Л.С.; Пивник А.В.; Зингерман Б.В.; Кравченко С.К. Лечение рецидивов волосатоклеточного лейкоза. Терапевтический архив. 2012; 84(7): 4 - 9.
31. Else M.; Dearden C.E.; Matutes E. et al. Rituximab with pentostatin or cladribine; an effective combination treatment for hairy cell leukaemia after disease recurrence. Leukemia and Lymphoma. 2011; 52 (Suppl. 2), 75 - 78.
32. Grever M.R. How I treat hairy cell leukaemia. Blood. 2010; 115: 21 - 28.
33. Thomas D.A.; O'Brien S.; Bueso-Ramos C. et al. (2003) Rituximab in relapsed or refractory hairy cell leukemia. Blood. 2003; 102: 3906 - 3911.
34. Nieva J.; Bethel K.; Saven L. Phase 2 study of rituximab in the treatment of cladribine-failed patients with hairy cell leukaemia. Blood. 2003; 102: 810 - 813.
35. Dearden C.; Catovsky D. (1990) Treatment of hairy cell leukaemia with 2-deoxycoformycin. Leukemia and Lymphoma. 1990; 1: 179 - 185.
36. Catovsky D. Clinical experience with 2-deoxycoformycin. Hematology and Cell Therapy. 1996; 38: S103 - S107.
37. Summers T.; Jaffe E. Hairy cell leukemia diagnostic criteria and differential diagnosis. Leukemia and Lymphoma. 2011; 52 (Suppl. 2), 6 - 10.
38. Robak T. Management of hairy cell leukemia variant. Leukemia and Lymphoma. 2011; 52 (Suppl. 2), 53 - 56.
39. Noel P. Definition of remission, minimal residual disease, and relapse in hairy cell leukemia bone marrow biopsy histology and immunophenotyping. Leukemia and Lymphoma. 2011; 52 (Suppl. 2), 65 - 68.
40. Daver N.; Nazha A.; Kantarjian H.M. et al. Treatment of hairy cell leukemia during pregnancy: are purine analogues and rituximab viable therapeutic options. (http://www.ncbi.nlm.nih.gov/pubmed/22981963) Clin Lymphoma Myeloma Leuk. 2013; 13(1): 86 - 9.
41. Dietrich S.; Glimm H.; Andrulis M. et al. BRAF Inhibition in Refractory Hairy-Cell Leukemia N Engl J Med 2012, 366; 21.
42. Урнова Е.С.; Аль-Ради Л.С.; Кузьмина Л.А.; Карякина А.А.; Ковригина А.М.; Двирнык В.Н.; Якутик И.А.; Судариков А.Б.; Паровичникова Е.Н.; Савченко В.Г. Успешное применение вемурафениба у больного с резистентной формой волосатоклеточного лейкоза. Терапевтический архив, 2013, N 7, с. 76 - 78.
43. Sari Е.; Nagy Z.G.; Baghy К. et al. Treatment of refractory hairy cell leukemia with a BRAF-inhibitor: lessons to be learnt. Pathol Oncol Res. 2014 May.
44. Cornet E.; Delmer A.; Feugier P. et al. Recommendations of the SFH (French Society of Haematology) for the diagnosis, treatment and follow-up of hairy cell leukaemia. (http://www.ncbi.nlm.nih.gov/pubmed/24994538) Ann Hematol. 2014; 93(12): 1977 - 83.
45. Robak T (http://www.ncbi.nlm.nih.gov/pubmed/?term=Robak%20T%5BAuthor%5D&cauthor=true&cauthor_uid=26269205).; Matutes E (http://www.ncbi.nlm.nih.gov/pubmed/?term=Matutes%20E%5BAuthor%5D&cauthor=true&cauthor_uid=26269205).; Catovsky D (http://www.ncbi.nlm.nih.gov/pubmed/?term=Catovsky%20D%5BAuthor%5D&cauthor=true&cauthor_uid=26269205). et al. Hairy cell leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. (http://www.ncbi.nlm.nih.gov/pubmed/?term=ESMO+hairy+cell) 2015; 26 Suppl 5: v100-7.
46. Jones G (http://www.ncbi.nlm.nih.gov/pubmed/?term=Jones%20G%5BAuthor%5D&cauthor=true&cauthor_uid=22111844).; Parry-Jones N (http://www.ncbi.nlm.nih.gov/pubmed/?term=Parry-Jones%20N%5BAuthor%5D&cauthor=true&cauthor_uid=22111844).; Wilkins B (http://www.ncbi.nlm.nih.gov/pubmed/?term=Wilkins%20B%5BAuthor%5D&cauthor=true &cauthor_uid=22111844). et al. Revised guidelines for the diagnosis and management of hairy cell leukaemia and hairy cell leukaemia variant. Br J Haematol. (http://www.ncbi.nlm.nih.gov/pubmed/22111844) 2012; 156(2): 186 - 95.
47. Osman H (http://www.ncbi.nlm.nih.gov/pubmed/?term=Osman%20H%5BAuthor%5D&cauthor=true&cauthor_uid=23750990).; Roth T (http://www.ncbi.nlm.nih.gov/pubmed/?term=Roth%20T%5BAuthor%5D&cauthor=true&cauthor_uid=23750990).; Zhou J (http://www.ncbi.nlm.nih.gov/pubmed/?term=Zhou%20J%5BAuthor%5D&cauthor=true&cauthor_uid=23750990). Hairy cell lymphoma: a unique presentation of hairy cell leukaemia. Br J Haematol, (http://www.ncbi.nlm.nih.gov/pubmed/23750990) 2013; 162(3): 294.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
Коллектив авторов
1. Аль-Ради Любовь Саттаровна. Кандидат медицинских наук, врач-гематолог, старший научный сотрудник ФГБУ Гематологический научный центр МЗ РФ, г. Москва.
2. Асланиди Ираклий Павлович. Доктор медицинских наук, профессор, руководитель отдела ядерной диагностики ФГБУ "Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева".
3. Байков Вадим Валентинович. Доктор медицинских наук, профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого СПбГМУ им. акад. И.П. Павлова, Санкт-Петербург.
4. Демина Елена Андреевна. Доктор медицинских наук, профессор, врач-онкогематолог, ведущий научный сотрудник отделения химиотерапии гемобластозов ФГБУ "Российский онкологический научный центр им. Н.Н. Блохина" Минздрава России, г. Москва.
5. Екаева Ирина Викторовна, к.хим.н., отдел ядерной диагностики ФГБУ "Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева".
6. Катунина Татьяна Анатольевна, к.м.н., отдел ядерной диагностики ФГБУ "Научный центр сердечно-сосудистой хирургии им. А.Н. Бакулева".
7. Ковригина Алла Михайловна. Доктор биологических наук, врач-патоморфолог, профессор кафедры патологической анатомии, цитологии и молекулярной патологии ИПК ФМБА РФ, заведующая патологоанатомическим отделением ФГБУ "Гематологический научный центр" МЗ РФ, Москва.
8. Криволапов Юрий Александрович. Доктор медицинских наук, профессор, врач-патологоанатом, заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, Санкт-Петербург.
9. Левшин Николай Юрьевич. Кандидат медицинских наук, доцент кафедры поликлинической терапии и клинической лабораторной диагностики Ярославской государственной медицинской академии, Ярославль.
10. Мационис Александр Эдуардович. Доктор медицинских наук, академик РАЕН, врач-патоморфолог высшей категории, заведующий лабораторией иммуноморфологии ГБУ Ростовской области "Патолого-анатомическое бюро", Ростов-на-Дону.
11. Мухортова Ольга Валентиновна. Доктор медицинских наук, врач-радилог высшей категории, старший научный сотрудник Отдела ядерной диагностики (ПЭТ-центр) на базе Научного центра сердечно-сосудистой хирургии им. А.Н. Бакулева, Москва.
12. Поддубная Ирина Владимировна. Член-корреспондент РАН, заслуженный деятель образования РФ, доктор медицинских наук, профессор, заведующая кафедрой онкологии, проректор по учебной работе и международному сотрудничеству ГБОУ ДПО "Российская медицинская академия последипломного образования" (РМАПО) МЗ РФ, г. Москва.
13. Ройтман Евгений Витальевич. Доктор биологических наук, профессор кафедры гематологии, онкологии и лучевой терапии ФГБОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России, г. Москва.
14. Шмаков Роман Георгиевич. Доктор медицинских наук, Главный врач ФГБУ "Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова" МЗ РФ, г. Москва.
Конфликт интересов: авторы не имеют конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гематологи;
2. Врачи-онкологи.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором > 0.3;
Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
- Обзоры опубликованных мета-анализов;
- Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- Консенсус экспертов;
- Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. 4, 5).
В настоящих клинических рекомендациях в квадратных скобках приведены уровни доказательности рекомендаций, в соответствии со шкалами, разработанными Американским обществом клинической онкологии (ASCO) и Европейским обществом медицинской онкологии (ESMO).
Таблица П1. Уровни и степени доказательности
Уровень доказательности
Тип доказательности
I
Как минимум одно крупное рандомизированное контролируемое исследование высокого качества (с низкой вероятностью ошибок) или мета-анализ гомогенных рандомизированных исследований высокого качества
II
Небольшие рандомизированные исследования или крупные рандомизированные исследования с высокой вероятностью ошибок. Мета-анализ подобных исследований или мета-анализ гетерогенных исследований
III
Проспективные когортные исследования
IV
Ретроспективные когортные исследования или исследования "случай-контроль"
V
Исследования без контрольной группы, отдельные случаи, мнение экспертов
Таблица П2
Степень
Градация
A
Достоверные данные о высокой клинической эффективности, настоятельно рекомендуется
B
Достоверные или убедительные данные об умеренной клинической эффективности, рекомендуется
C
Недостоверные данные об эффективности, которая не перевешивает риск или недостатки лечения (нежелательные явления, стоимость и т.д.), может применяться как один из вариантов
Индикаторы доброкачественной клинической практики (Good Practice Points - GPPs):
Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
Методология валидизации рекомендаций
Методы валидизации рекомендаций:
- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Описание методики валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2015 - 2016 гг., на Форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний "Лимфорум", ежегодной Российской конференции с международным участием "Злокачественные лимфомы", а также III Конгресса гематологов России.
Окончательная редакция:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами авторского коллектива, которые пришли к заключению, что все существенные замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке сведен к минимуму.
Клинические рекомендации утверждены на XIII Российской конференции с международным участием "Злокачественные лимфомы" в 2016.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
КР400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Волосатоклеточный лейкоз относится к хроническим заболеваниям. Это означает, что на сегодняшний день излечивающих методик для этой болезни не найдено. Однако в лечении ВКЛ достигнут огромный прогресс - подобрана такая комбинация лекарственных препаратов, которая позволяет более чем у 95% пациентов достичь ремиссии заболевания, чаще длительной, во время которой лечение не требуется и болезнь никак не мешает нормальной жизни.
Опасность для жизни может представлять только инфекция в период сильного понижения лейкоцитов. Вот почему важно в период лечения соблюдать все рекомендации врача и немедленно сообщать об отклонениях в состоянии, особенно повышении температуры тела. Когда лечение успешно завершено, важно оставаться под наблюдение гематолога и регулярно проверять анализ крови и размер селезенки. Это необходимо для того, чтобы вовремя увидеть начало рецидива болезни, еще до всех симптомов, и провести короткий курс лечения, чтобы снова ввести болезнь в состояние ремиссии. При необходимости врач предложит дополнительные средства лечения (например, удаление селезенки).
Пациент в ремиссии ВКЛ может вести обычный здоровый образ жизни - заниматься спортом, работать, рожать детей.
Приложение Г
