"Клинические рекомендации "Злокачественные опухоли слюнных желез"
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ СЛЮННЫХ ЖЕЛЕЗ
МКБ 10: C07, C08
Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
ID: KP116
URL
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество специалистов по опухолям головы и шеи Российское общество клинической онкологии
Ключевые слова
- Рак слюнных желез
- Лучевая терапия
- Системная химиотерапия
Список сокращений
ЛУ - лимфатические узлы
УЗИ - ультразвуковое исследование
ЭКГ - электрокардиография
КТ - компьютерная томография
ТАБ - тонкоигольная аспирационная биопсия
УЗДГ - ультразвуковая доплерография
ЛТ - лучевая терапия
ХЛТ - химиолучевая терапия
МРТ - магнитно-резонансная томография
РОД - разовая очаговая доза
СОД - суммарная очаговая доза
ПХТ - полихимиотерапия
TNM - (аббревиатура от tumor, nodus и metastasis) международная классификация стадий развития раковых опухолей
Термины и определения
Большие слюнные железы: околоушная слюнная железа, подчелюстная слюнная железа, подъязычная слюнная железа
Малые слюнные железы: слюнные железы полости рта, ротоглотки
1. Краткая информация
1.1 Определение
Рак слюнной железы - злокачественная эпителиальная опухоль слюнной железы. [2, 3]
1.2 Этиология
Основными этиологическими факторами развития злокачественных опухолей слюнных желез являются:
- Воспалительные заболевания
- Алиментарные факторы
- Гормональные и генетические нарушения
- Курение [1, 2, 3, 5]
1.3 Эпидемиология
Новообразования слюнных желез составляют 1 - 5% среди всех злокачественных опухолей и 3% среди опухолей головы и шеи. Пик заболеваемости приходится на возраст 15 - 39 лет. [1, 2]
1.4 Кодирование по МКБ 10
Злокачественное новообразование околоушной слюнной железы (C07):
Злокачественное новообразование других и неуточненных больших слюнных желез (C08)
C08.0 - Злокачественное новообразование поднижнечелюстной железы
C08.1 - Злокачественное новообразование подъязычной железы
C08.8 - Поражение больших слюнных желез, выходящее за пределы одной или более вышеуказанных локализаций
C08.9 - Злокачественное новообразование большой слюнной железы неуточненной
Международная гистологическая классификация опухолей слюнных желез. (классификация ВОЗ, 4-е издание, 2010 г.)
Злокачественные эпителиальные опухоли
- 8550/3 Ацинозно-клеточный рак
- 8430/3 Мукоэпидермоидный рак
- 8200/3 Аденокистозный рак
- 8525/3 Полиморфная аденокарцинома низкой степени злокачественности
- 8562/3 Эпителиально-миоэпителиальный рак
- 8310/3 Светлоклеточная аденокарцинома, БДУ
- 8147/3 Базальноклеточная аденокарцинома
- 8410/3 Аденокарцинома сальных желез
- 8440/3 Цистаденокарцинома
- 8480/3 Муцинозная аденокарцинома
- 8290/3 Оксифильная аденокарцинома
- 8500/3 Инфильтрирующий протоковый рак, БДУ
- 8140/3 Аденокарцинома, БДУ
- 8982/3 Злокачественная миоэпителиома
- 8941/3 Рак в плеоморфной аденоме
- 8980/3 Карциносаркома
- 8940/3 Смешанная опухоль, злокачественная, БДУ
- 8070/3 Плоскоклеточный рак, БДУ
- 8041/3 Мелкоклеточный рак
- 8012/3 Крупноклеточный рак, БДУ
- 8082/3 Лимфоэпителиальный рак
- 8974/1 Сиалобластома
Доброкачественные эпителиальные опухоли
- 8940/0 Плеоморфная аденома
- 8982/0 Миоэпителиома
- 8147/0 Базальноклеточная аденома
- 8561/0 Аденолимфома
- 8290/0 Оксифильная аденома
- 8149/0 Канальцевая аденома
- 8410/0 Аденома сальных желез
- 8503/0 Внутрипротоковая папиллома
- 8406/0 Папиллярная сирингоаденома
- 8440/0 Цистаденома, БДУ
1.5 Классификация
Степень распространенности злокачественных опухолей слюнных желез представлена в классификации TNM 2009 г.
Основную группу новообразований слюнных желез составляют опухоли эпителиального происхождения (95%), причем в 80 - 90% случаев они развиваются в больших, в 10% в малых слюнных железах. Значительную роль в прогнозе имеет степень злокачественности опухоли.
Символ T содержит следующие градации:
TX - недостаточно данных для оценки первичной опухоли.
T0 - первичная опухоль не определяется.
T1 - опухоль 2 см или менее в наибольшем измерении без распространения за пределы паренхимы железы
T2 - опухоль более 2 см., но не более 4 см. в наибольшем измерении без распространения за пределы паренхимы железы
T3 - опухоль более 4 см. в наибольшем измерении и/или распространение за пределы паренхимы железы.
T4a - опухоль распространяется на кожу, нижнюю челюсть, слуховой проход и/или лицевой нерв.
T4b - опухоль распространяется на крыловидные отростки, основание черепа или на внутреннюю сонную артерию.
Символ N указывает на наличие или отсутствие метастазов в регионарных ЛУ
Nx - недостаточно данных для оценки регионарных ЛУ.
N0 - поражения регионарных ЛУ нет.
N1 - метастазы в одном ЛУ на стороне поражения не более 3-х см. в наибольшем измерении
N2 - метастазы в одном ЛУ на стороне поражения более 3-х см., но не более 6 см. в наибольшем измерении; или в нескольких ЛУ на стороне поражения не более 6 см. в наибольшем измерении; двухстороннее или контралатеральное поражение ЛУ не более 6 см в наибольшем измерении
N2a - метастазы в одном ЛУ на стороне поражения более 3-х см, но не более 6 см в наибольшем измерении.
N2b - метастазы в нескольких ЛУ на стороне поражения не более 6 см. в наибольшем измерении.
N2c - двухстороннее или контралатеральное метастазы в ЛУ не более 6 см в наибольшем измерении
N3 - метастазы в ЛУ более 6 см в наибольшем измерении
Символ M характеризует наличие или отсутствие отдаленных метастазов
M0 - отдаленных метастазов нет.
M1 - наличие отдаленных метастазов.
Таблица 1 - Группировка по стадиям
Стадия
T
N
M
I
1
0
0
II
2
0
0
III
3
0
0
1
1
0
2
1
0
3
1
0
IVA
4a
0
0
4a
1
0
1
2
0
2
2
0
3
2
0
4a
2
0
IVB
любое T
3
0
4b
любое N
0
IVC
любое T
любое N
1
2. Диагностика
2.1 Жалобы и анамнез 11 - 14, 27, 28
- Рекомендуется тщательный сбор жалоб и анамнеза у пациента с целью выявления факторов, которые могут повлиять на выбор тактики лечения
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
2.2 Физикальное обследование 11 - 14, 27, 28
- Рекомендуется тщательный физикальный осмотр, включающий осмотр и пальпацию (бимануальную) очага поражения и регионарных ЛУ, оценку нутритивного статуса.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
2.3 Лабораторная диагностика 11 - 14, 27, 28
- Рекомендуется выполнять: развернутые клинический и биохимический анализы крови, исследование свертывающей системы крови, анализ мочи [13, 17, 22].
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
2.4 Инструментальная диагностика 8 - 14
- Рекомендуется выполнить УЗИ первичного очага, ЛУ шеи с ТАБ
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется выполнить УЗИ органов брюшной полости и забрюшинного пространства.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется выполнить рентгенографию грудной клетки
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется выполнить ЭКГ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется выполнить КТ/МРТ костей лицевого скелета с внутривенным контрастированием в случае подозрения распространения опухоли на нижнюю/верхнюю челюсти, основание черепа.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется выполнить остеосцинтиграфию при подозрении на метастатическое поражение костей скелета.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
- Рекомендуется при подготовке к хирургическому лечению с целью оценки функционального статуса по показаниям проводить дополнительное обследование:
эхокардиографию, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, УЗДГ сосудов шеи и нижних конечностей, консультации кардиолога, эндокринолога, невропатолога и т.п.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - III)
2.5 Иная диагностика 10 - 13, 16, 18, 27, 28
- Рекомендуется проводить гистологическое исследование хирургически удаленного опухолевого препарата, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
1. Размеры опухоли;
2. Глубина инвазии опухоли
3. Гистологическое строение опухоли;
4. Степень дифференцировки опухоли;
5. Наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован)
6. pT;
7. pN (с указанием общего числа исследованных и пораженных лимфоузлов, признаков экстранодального распространения опухоли);
8. Наличие поражения краев резекции (отрицательный результат также должен быть констатирован) [11 - 16]
Уровень убедительности рекомендаций C (уровень достоверности доказательств - IV)
3. Лечение
3.1 Хирургическое вмешательство 22 - 29
- Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения больных раком слюнных желез.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При T1 - T2, N0: рекомендовано полное хирургическое удаление первичной опухоли. В случае выявления при плановом гистологическом исследовании аденокистозного рака средней/низкой степени дифференцировки или неблагоприятных гистологических признаков (положительные края, периневральная инвазия) рекомендована послеоперационная ДЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При T1-2, N + M0: рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфодиссекцией. В послеоперационном периоде рекомендовано проведение ДЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При T3-4a, N0 M0: рекомендовано полное хирургическое удаление первичной опухоли. Шейная лимфодиссекция проводится при аденокистозном раке средней или низкой степени дифференцировки. В послеоперационном периоде рекомендовано проведение ДЛТ. В случае выявления при плановом гистологическом исследовании неблагоприятных гистологических признаков (средненизкодифференцированная опухоль, положительные края, периневральная инвазия, сосудистая эмболия) рекомендовано рассмотреть вопрос о проведении конкурентной ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При невозможности выполнения радикального оперативного вмешательства на первом этапе рекомендовано проведение конкурентной ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При T3-4a N + M0: рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфодиссекцией. В послеоперационном периоде рекомендовано проведение послеоперационной ДЛТ. В случае выявления при плановом гистологическом исследовании неблагоприятных гистологических признаков (средненизкодифференцированная опухоль, положительные края, периневральная инвазия, опухолевые эмболы в сосудах) рекомендовано рассмотреть вопрос о проведении конкурентной ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При невозможности выполнения радикального оперативного вмешательства на первом этапе рекомендовано проведение конкурентной ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- При стадии T4b: рекомендована конкурентная ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- Локорегионарный рецидив без предшествующей ЛТ:
рекомендовано полное хирургическое удаление с последующим проведением послеоперационной ДЛТ. В случае выявления при плановом гистологическом исследовании неблагоприятных гистологических признаков (средненизкодифференцированная опухоль, положительные края, периневральная инвазия, сосудистая эмболия) рекомендовано рассмотреть вопрос о проведении конкурентной ХЛТ. При невозможности выполнения радикального оперативного вмешательства на первом этапе рекомендована конкурентная ХЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- Локорегионарный рецидив или второй первичный очаг после ЛТ:
рекомендовано полное хирургическое удаление с решением вопроса о повторной лучевой терапией с/без ПХТ. При невозможности выполнения радикального оперативного вмешательства рекомендовано рассмотреть вопрос о повторной ЛТ.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- Отдаленные метастазы и состоянии больного 0 - 3 по шкале Карновского: рекомендована ХТ или выжидательная тактика (при медленной прогрессии опухоли) или селективная метастазэктомия или антиандрогенная терапия при наличии рецепторов к андрогенам (леупролид, бикалутамид) или трастузумаб при HER2+.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
3.2 Принципы лучевой терапии 30 - 31
- ЛТ в самостоятельном варианте: Рекомендована фотонная или фотон/электронная или протонная ЛТ: первичный очаг и клинически определяемые регионарные метастазы от 66 - 70 (2 Гр/фракция), 5 раз в неделю в течение 6 - 7 недель; клинически не измененные ЛУ 50 Гр (2,0 Гр/фракция).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- Послеоперационная ЛТ: Рекомендованный интервал между оперативным вмешательством и сроком начала послеоперационной ЛТ не должен превышать 6 недель. Рекомендована фотонная или фотон/электронная или протонная терапия. первичный очаг и клинически определяемые регионарные метастазы - 60 - 66 Гр (2 Гр/фракция), 5 раз в неделю течении 6 - 6,5 недель; клинически не измененные ЛУ от 50 Гр (2.0 Гр/фракция)
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
3.3 Принципы системной химиотерапии 31, 32
Выбор ХТ должен быть индивидуализирован в зависимости от характеристик пациента (общее состояние, цели лечения).
- Одновременная ХЛТ Рекомендовано Цисплатин + ЛТ. ЛТ на первичный очаг (минимально 70 Гр) и ЛУ (минимально 50 Гр) - фракция 2 Гр/сут ежедневно (понедельник - пятница) в течение 7 недель; Цисплатин в дозе 100 мг/м2 на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (суммарная доза во время ЛТ - 300 мг/м2).
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIa)
- Рецидивные неоперабельные опухоли или наличие отдаленных метастазов (инкурабельные). Рекомендовано: доксорубицин 60 мг/м2 1-й день + цисплатин 40 мг/м2 1-й день или доксорубицин 50 мг/м2 + блеомицин 15 мг + цисплатин 20 мг/м2 или доксорубицин 60 мг/м2 + блеомицин 10 мг + винкристин 1,4 мг/м2. 1 раз в 3 недели, количество курсов ХТ зависит от эффекта от проводимого лечения.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
3.4 Принципы хирургического лечения 28 - 30
1. Рекомендована оценка всех пациентов до лечения хирургом онкологом, специализирующимся на опухолях головы и шеи, которому рекомендовано предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ, МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Хирургическое вмешательство не следует модифицировать на основании клинического ответа, полученного до лечения, при настоящем осмотре (регрессии опухоли), за исключением случаев прогрессии опухоли, которая вынуждает проводить более обширную операцию для охвата всей опухоли во время окончательной резекции.
2. Оценка операбельности. Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия T4b (например, неоперабельность, связанная с технической невозможностью выполнить микроскопически радикальное оперативное вмешательство): значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия и др.); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает >= 270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения, предпозвоночную фасцию или шейные позвонки
3. Удаление первичного очага. По возможности рекомендовано выполнять удаление первичной опухоли единым блоком. Рекомендовано планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию до получения чистого края. Доказано, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное гистологическое исследование). Предпочтительно выполнять одномоментную реконструкцию резецированного участка нерва
4. Края резекции. Адекватное удаление определяется как расстояние от края резекции до макроскопически видимой опухоли >= 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов рекомендовано проводить интраоперационно в следующих случаях: если зона, макроскопически свободная от опухоли, по краю резекции составляет < 2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли, имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли до края резекции >= 5 мм. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции < 5 мм. Первичную опухоль следует помечать таким образом, чтобы патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции. По усмотрению хирурга выполняется пластика с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции нижней челюсти.
Уровень убедительности рекомендаций - B (уровень достоверности доказательств - IIb)
4. Реабилитация
- Рекомендуется проводить реабилитацию, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - IV)
5. Профилактика
- Рекомендуется соблюдать следующую периодичность и методы наблюдения после завершения лечения:
В первые 1 - 2 года физикальный осмотр и сбор жалоб рекомендуется проводить каждые 36 месяца, на сроке 3 - 5 лет - 1 раз в 6 - 12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Объем обследования:
1. Анамнез и физикальное обследование
2. УЗИ ЛУ шеи с 2-х сторон, органов брюшной полости и малого таза каждые 3 - 6 мес. в зависимости от риска прогрессирования;
3. Рентгенография органов грудной клетки каждые 12 мес.
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - Ia)
Комментарии: задачей наблюдения является раннее выявление прогрессирования заболевания с целью раннего начала химиотерапии или хирургического лечения резектабельных метастатических очагов, рецидивных опухолей, а также выявление метахронных опухолей головы и шеи.
6. Дополнительная информация, влияющая на течение и исход заболевания
Критерии оценки качества медицинской помощи
N п/п
Критерии качества
Оценка выполнения
1.
Выполнена тонкоигольная аспирационная биопсия опухоли и/или измененных регионарных лимфоузлов с последующим цитологическим исследованием (при установлении диагноза)
Да/Нет
2.
Выполнено ультразвуковое исследование слюнных желез и/или компьютерная томография лицевого скелета и/или магнитно-резонансная томография основания черепа (при установлении диагноза)
Да/Нет
3.
Выполнено ультразвуковое исследование шеи и/или компьютерная томография верхних дыхательных путей и шеи (при установлении диагноза)
Да/Нет
4.
Выполнена рентгенография органов грудной клетки и/или компьютерная томография органов грудной клетки (при установлении диагноза)
Да/Нет
5.
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) и забрюшинного пространства и/или компьютерная томография органов брюшной полости и/или магнитно-резонансная томография органов брюшной полости (при установлении диагноза)
Да/Нет
6.
Выполнено ультразвуковое исследование органов малого таза и/ или компьютерная томография органов малого таза и/или магнитно-резонансная томография органов малого таза (при установлении диагноза)
Да/Нет
7.
Проведена профилактика инфекционных осложнений антибактериальными лекарственными препаратами при хирургическом вмешательстве (при отсутствии медицинских противопоказаний)
Да/Нет
8.
Выполнено морфологическое и/или иммуногистохимическое исследование препарата удаленных тканей (при хирургическом вмешательстве)
Да/Нет
9.
Выполнена химиотерапия и/или таргетная терапия и/или лучевая терапия при наличии морфологической верификации диагноза (при химиотерапии и/или таргетной терапии и/или лучевой терапии)
Да/Нет
10.
Выполнена дозиметрическая верификация рассчитанного плана (при лучевой терапии)
Да/Нет
11.
Выполнен общий (клинический) анализ крови развернутый не более чем за 5 дней до начала курса химиотерапии и/или таргетной терапии и/или лучевой терапии
Да/Нет
12.
Начат первый курс химиотерапии и/или таргетной терапии не позднее 30 дней от момента выявления метастатической болезни (при наличии медицинских показаний и отсутствии медицинских противопоказаний)
Да/Нет
13.
Выполнен первый курс адъювантной химиотерапии и/или таргетной терапии не позднее 30 дней от момента хирургического вмешательства (при проведении адъювантной химиотерапии и при отсутствии медицинских противопоказаний)
Да/Нет
Список литературы
1. Каприн А.Д., Старинский В.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) - М.: МНИОИ им. П.А. Герцена филиал ФГБУ "НМИРЦ" Минздрава России, 2017., с. 11, 15, 16.
2. Давыдов М.И. Энциклопедия клинической онкологии Москва, ООО "РЛС-2004", 2004.
3. Л.Х. Собин, М. Господарович, К. Виттекинд. TNM. Классификация злокачественных опухолей. - 7-е издание - М.: Логосфера, 2011, стр. 45 - 49.
4. Teymoortash, A. Current advanced in diagnosis and surgical treatment of lymph node metastasis in head and neck cancer/A. Teymoortash, J.A. Werner//GMS Curr. Top Otorhinolaryngol. Head Neck Surg. - 2012. - Vol. 11. - P. 04.
5. Soo KC, Tan EH, Wee J, Lim D, Tai BC, Khoo ML, et al.: Surgery and adjuvant radiotherapy vs concurrent chemoradiotherapy in stage III/IV nonmetastatic squamous cell head and neck cancer: a randomised comparison. Br J Cancer 2005; 93: 279-86.
6. Bernier J, Domenge C, Ozsahin M, Matuszewska K, Lefebvre JL, Greiner RH, et al.: Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer. N Engl J Med 2004; 350: 1945-52.
7. Ang KK, Trotti A, Brown BW, Garden AS, Foote RL, Morrison WH, et al.: Randomized trial addressing risk features and time factors of surgery plus radiotherapy in advanced head-and-neck cancer. Int J Radiat Oncol Biol Phys 2001; 51: 571-8.
8. Eneroth CM, Franzen S, Zajicek J. Aspiration biopsy of salivary gland tumors. A critical review of 910 biopsies. Acta Cytol. 1967 Nov-Dec. 11(6): 470-2. [Medline].
9. Rice DH, Becker T. Magnetic resonance imaging of the salivary glands. A comparison with computed tomographic scanning. Arch Otolaryngol Head Neck Surg. 1987 Jan. 113(1): 78 - 80. [Medline].
10. Mamlouk MD, Rosbe KW, Glastonbury CM. Paediatric parotid neoplasms: a 10 year retrospective imaging and pathology review of these rare tumours. Clin Radiol. 2015 Mar. 70(3): 270-7. [Medline].
11. Illes RW, Brian MB. A review of the tumors of the salivary gland. Surg Gynecol Obstet. 1986 Oct. 163(4): 399 - 404. [Medline].
12. Skolnik EM, Friedman M, Becker S, et al. Tumors of the major salivary glands. Laryngoscope. 1977 Jun. 87(6): 843-61. [Medline].
13. Snyderman NL, Johnson JT. Salivary gland tumors. Diagnostic characteristics of the common types. Postgrad Med. 1987 Oct. 82(5): 105-8, 110-2. [Medline].
14. Spiro RH. Salivary neoplasms: overview of a 35-year experience with 2,807 patients. Head Neck Surg. 1986 Jan - Feb. 8(3): 177-84. [Medline].
15. Stafford ND, Wilde A. Parotid cancer. Surg Oncol. 1997 Dec. 6(4): 209-13. [Medline].
16. Laforga JB. Mucoepidermoid carcinoma of the parotid gland [letter]. Acta Cytol. 1999 May - Jun. 43(3): 515-7. [Medline].
17. Pinkston JA, Cole P. Incidence rates of salivary gland tumors: results from a populationbased study. Otolaryngol Head Neck Surg. 1999 Jun. 120(6): 834-40. [Medline].
18. Suzuki M, Ichimiya I, Matsushita F, et al. Histological features and prognosis of patients with mucoepidermoid carcinoma of the parotid gland. J Laryngol Otol. 1998 Oct. 112(10): 944-7. [Medline].
19. Ozcan C, Talas D, Gorur K. Parotid gland mucoepidermoid carcinoma associated with myasthenia gravis. J Craniofac Surg. 2007 Sep. 18(5): 1055-8. [Medline].
20. Shikhani A, Samara M, Allam C, et al. Primary lymphoma in the salivary glands: report of five cases and review of the literature. Laryngoscope. 1987 Dec. 97(12): 1438-42. [Medline].
21. Alba Garcia JR, Armengot Carceller M, Zapater Latorre E, et al. Malignant fibrohistiocytoma of the parotid region. Report of a case. Med Oral Patol Oral Cir Bucal.
2008 Feb 1. 13(2): E148-50. [Medline].
22. Johns ME. Parotid cancer: a rational basis for treatment. Head Neck Surg. 1980 NovDec. 3(2): 132-41. [Medline].
23. Domenick NA, Johnson JT. Parotid tumor size predicts proximity to the facial nerve. Laryngoscope. 2011 Nov. 121(11): 2366-70. [Medline].
24. Luna Ortiz K, Rascon Ortiz M, Sanson Riofrio JA, et al. Control of Frey"s syndrome in patients treated with botulinum toxin type A. Med Oral Patol Oral Cir Bucal. 2007 Jan. 12(1): E79-84. [Medline].
25. Takushima A, Harii K, Asato H, et al. Neurovascular free-muscle transfer for the treatment of established facial paralysis following ablative surgery in the parotid region. Plast Reconstr Surg. 2004 May. 113(6): 1563-72. [Medline].
26. Shang J, Shui Y, Sheng L, et al. Epidermal growth factor receptor and human epidermal growth receptor 2 expression in parotid mucoepidermoid carcinoma: possible implications for targeted therapy. Oncol Rep. 2008 Feb. 19(2): 435-40. [Medline].
27. Frankenthaler RA, Luna MA, Lee SS, et al. Prognostic variables in parotid gland cancer. Arch Otolaryngol Head Neck Surg. 1991 Nov. 117(11): 1251-6. [Medline].
28. O"Brien CJ, Soong SJ, Herrera GA, et al. Malignant salivary tumors--analysis of prognostic factors and survival. Head Neck Surg. 1986 Nov - Dec. 9(2): 82 - 92. [Medline].
29. Schwentner I, Obrist P, Thumfart W, et al. Distant metastasis of parotid gland tumors. Acta Otolaryngol. 2006 Apr. 126(4): 340-5. [Medline].
30. Ghosh-Laskar S, Murthy V, Wadasadawala T, Agarwal J, Budrukkar A, Patil N, et al.
Mucoepidermoid carcinoma of the parotid gland: Factors affecting outcome. Head Neck. 2011 Apr. 33(4): 497 - 503. [Medline].
31. Schwentner I, Obrist P, Thumfart W, et al. Distant metastasis of parotid gland tumors. Acta Otolaryngol. 2006 Apr. 126(4): 340-5. [Medline].
Kim WS, Lee HS, Park YM, et al. Surgical Outcomes of Parotid Cancer: A 10-Year Experience. Otolaryngol Head Neck Surg. 2012 Aug. 147(2 suppl): P180 - P181.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
1. Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник, отделение радиационной онкологии ФГБУ "РОНЦ им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
2. Алымов Юрий Владимирович врач-онколог, аспирант кафедры онкологии ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России, исполнительный директор Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
3. Болотин Михаил Викторович, к.м.н., научный сотрудник, отделение хирургическое N 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ "РОНЦ им. Н.Н. Блохина" Минздрава России, член Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
4. Мудунов Али Мурадович, д.м.н., заведующий отделением хирургическим N 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ "РОНЦ им. Н.Н. Блохина" Минздрава России, президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
5. Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России, вице-президент Общероссийской общественной организации "Российское общество специалистов по опухолям головы и шеи"
Конфликт интересов отсутствует.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-онкологи;
2. Врачи-хирурги;
3. Врачи-радиологи;
4. Врачи-химиотерапевты;
5. Врачи-генетики;
6. Студенты медицинских ВУЗов, ординаторы и аспиранты.
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица П1 - Уровни достоверности доказательств в соответствии с классификацией Агентства по политике медицинского обслуживания и исследований (AHCPR, 1992)
Уровни достоверности доказательств
Описание
Ia
Доказательность, основанная на мета-анализе рандомизированных контролируемых исследований
Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
IIa
Доказательность, основанная как минимум на одном крупном нерандомизированном контролируемом исследовании
IIb
Доказательность, основанная как минимум на одном квазиэксперементальном исследовании с хорошим дизайном
III
Доказательность, основанная на неэкспериментальных описательных исследованиях с хорошим дизайном, типа сравнительных исследований, корреляционных исследований и исследований случай-контроль
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов
Таблица П2 - Уровни убедительности рекомендаций в соответствии с классификацией Агентства исследований и оценки качества медицинского обслуживания (AHRQ, 1994)
Уровень убедительности рекомендации
Уровни достоверности доказательств
Описание
A
Ia, Ib
Доказательность, основанная как минимум на одном рандомизированном контролируемом исследовании с хорошим дизайном
B
IIa, IIb, III
Доказательность, основанная на хорошо выполненных нерандомизированных клинических исследованиях
C
IV
Доказательность, основанная на мнении экспертов, на опыте или мнении авторов. Указывает на отсутствие исследований высокого качества
Методы, использованные для формулирования рекомендаций - консенсус экспертов.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка
- Внутренняя экспертная оценка
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами, которые попросили прокомментировать, прежде всего, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей - детских онкологов первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультации и экспертная оценка: Проект рекомендаций рецензирован также независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Обновления клинических рекомендаций: актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов с опухолями головы и шеи. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее достоверности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь влияет на силу, вытекающих из нее рекомендаций.
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
KP400. Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи (http://cr.rosminzdrav.ru/#!/schema/708)
Приложение Б
АЛГОРИТМЫ ВЕДЕНИЯ ПАЦИЕНТА
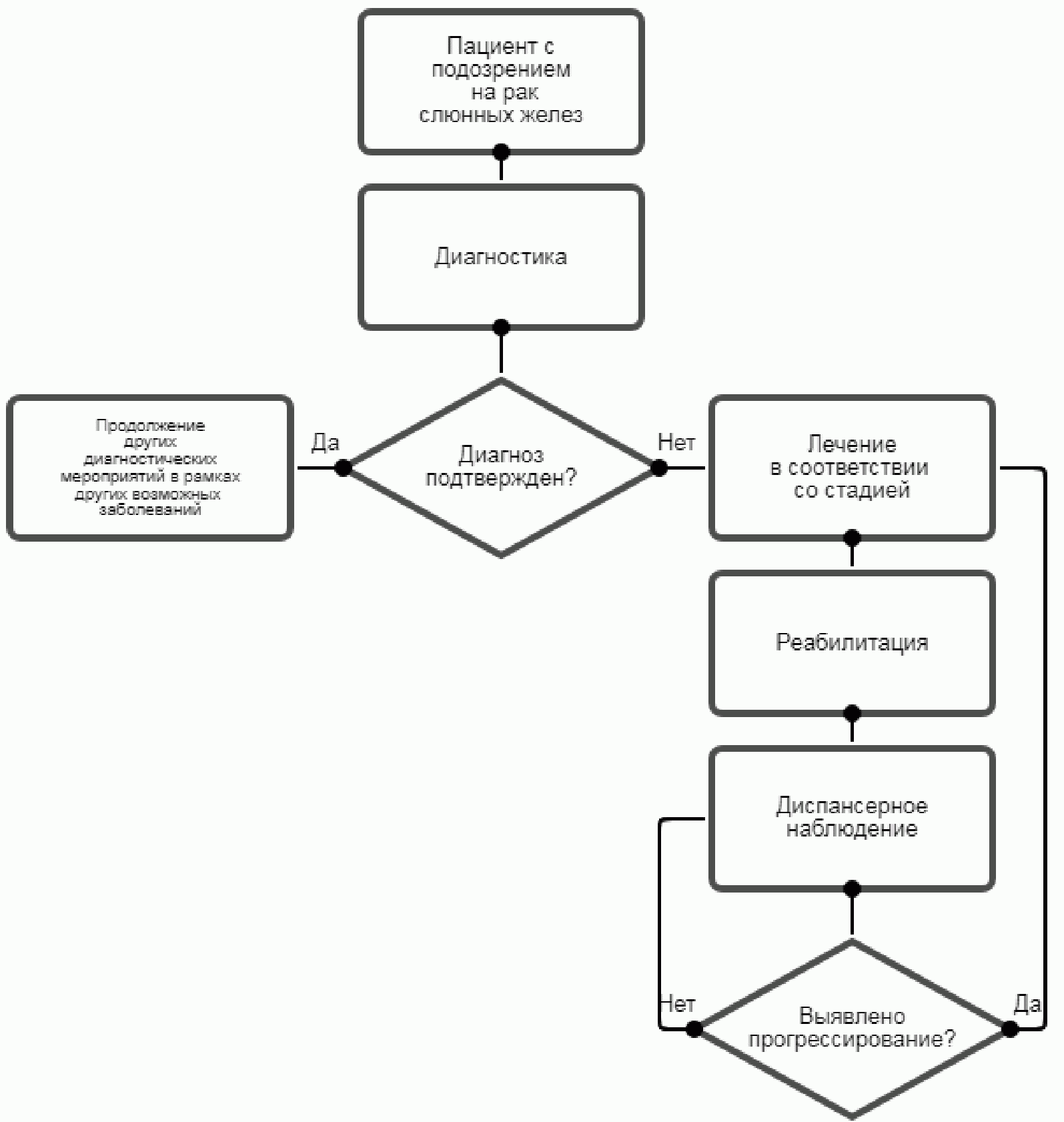
Схема 1. Блок-схема диагностики и лечения больного раком слюнной железы
Злокачественнные опухоли слюнных желез
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Рекомендации при осложнениях химиотерапии - связаться с химиотерапевтом.
1). При повышении температуры тела 38 °C и выше:
- Начать прием антибиотиков: по рекомендации химиотерапевта
2). При стоматите.
- Диета - механическое, термическое щажение;
- Частое полоскание рта (каждый час) - ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом;
- Обрабатывать полость рта по рекомендации химиотерапевта
3). При диарее.
- Диета - исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Принимать препараты по рекомендации химиотерапевта
4). При тошноте.
- Принимать препараты по рекомендации химиотерапевта
Приложение Г
